 Готовимся к олимпиаде по химии
Готовимся к олимпиаде по химии
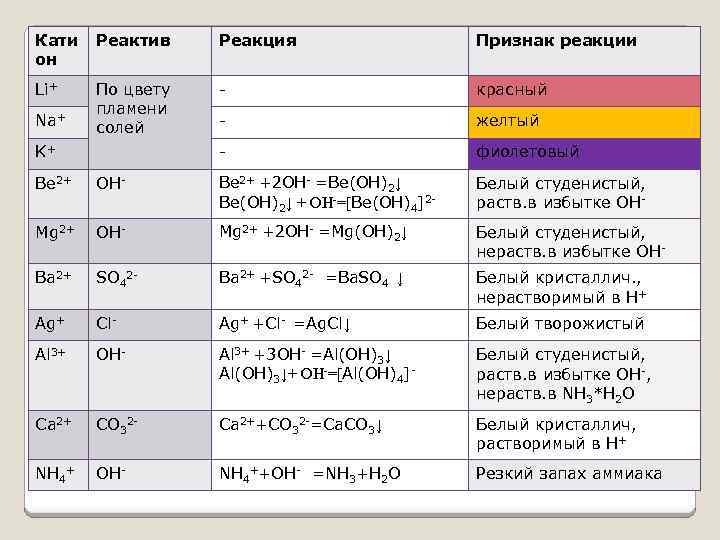 Кати он Реактив Реакция Признак реакции Li+ По цвету пламени солей - красный - желтый - фиолетовый Na+ K+ Be 2+ OH- Ве 2+ +2 OH- =Be(OH)2↓ Ве(OH)2↓ + ОН-=[Ве(OH)4]2 - Белый студенистый, раств. в избытке OH- Mg 2+ +2 OH- =Mg(OH)2↓ Белый студенистый, нераств. в избытке OH- Ba 2+ SO 42 - Ba 2+ +SO 42 - =Ba. SO 4 ↓ Белый кристаллич. , нерастворимый в Н+ Ag+ Cl- Ag+ +Cl- =Ag. Cl↓ Белый творожистый Al 3+ OH- Al 3+ +3 OH- =Al(OH)3↓+ ОН-=[Al(OH)4]- Белый студенистый, раств. в избытке OH-, нераств. в NH 3*Н 2 О Ca 2+ СО 32 - Ca 2++СО 32 -=Са. СО 3↓ Белый кристаллич, растворимый в Н+ NH 4+ OH- NH 4++OH- =NH 3+Н 2 О Резкий запах аммиака
Кати он Реактив Реакция Признак реакции Li+ По цвету пламени солей - красный - желтый - фиолетовый Na+ K+ Be 2+ OH- Ве 2+ +2 OH- =Be(OH)2↓ Ве(OH)2↓ + ОН-=[Ве(OH)4]2 - Белый студенистый, раств. в избытке OH- Mg 2+ +2 OH- =Mg(OH)2↓ Белый студенистый, нераств. в избытке OH- Ba 2+ SO 42 - Ba 2+ +SO 42 - =Ba. SO 4 ↓ Белый кристаллич. , нерастворимый в Н+ Ag+ Cl- Ag+ +Cl- =Ag. Cl↓ Белый творожистый Al 3+ OH- Al 3+ +3 OH- =Al(OH)3↓+ ОН-=[Al(OH)4]- Белый студенистый, раств. в избытке OH-, нераств. в NH 3*Н 2 О Ca 2+ СО 32 - Ca 2++СО 32 -=Са. СО 3↓ Белый кристаллич, растворимый в Н+ NH 4+ OH- NH 4++OH- =NH 3+Н 2 О Резкий запах аммиака
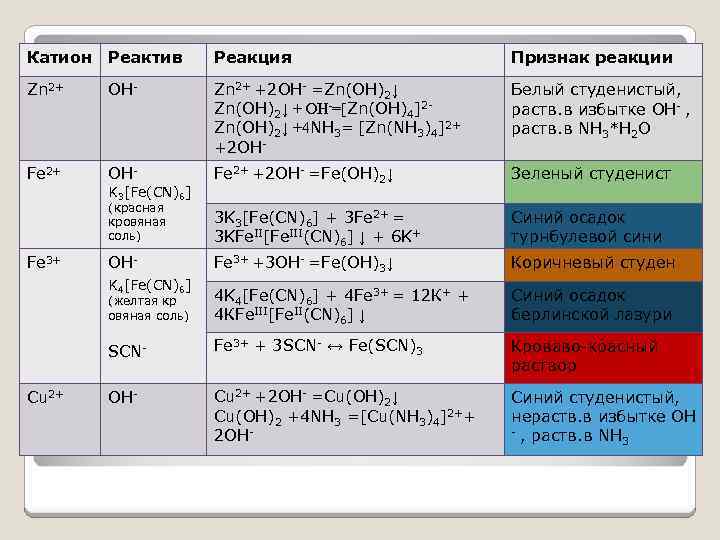 Катион Реактив Реакция Признак реакции Zn 2+ OH- Zn 2+ +2 OH- =Zn(OH)2↓ + ОН-=[Zn(OH)4]2 Zn(OH)2↓ +4 NH 3= [Zn(NH 3)4]2+ +2 OH- Белый студенистый, раств. в избытке OH- , раств. в NH 3*Н 2 О Fe 2+ OH- Fe 2+ +2 OH- =Fe(OH)2↓ Зеленый студенист (красная кровяная соль) 3 K 3[Fe(CN)6] + 3 Fe 2+ = 3 KFe. II[Fe. III(CN)6] ↓ + 6 K+ Синий осадок турнбулевой сини OH- Fe 3+ +3 OH- =Fe(OH)3↓ Коричневый студен (желтая кр овяная соль) 4 K 4[Fe(CN)6] + 4 Fe 3+ = 12 К+ + 4 КFe. III[Fe. II(CN)6] ↓ Синий осадок берлинской лазури SCN- Fe 3+ + 3 SCN- ↔ Fe(SCN)3 Кроваво-красный раствор OH- Cu 2+ +2 OH- =Cu(OH)2↓ Cu(OH)2 +4 NH 3 =[Cu(NH 3)4]2++ 2 OH- Синий студенистый, нераств. в избытке OH - , раств. в NH 3 Fe 3+ Cu 2+ K 3[Fe(CN)6] K 4[Fe(CN)6]
Катион Реактив Реакция Признак реакции Zn 2+ OH- Zn 2+ +2 OH- =Zn(OH)2↓ + ОН-=[Zn(OH)4]2 Zn(OH)2↓ +4 NH 3= [Zn(NH 3)4]2+ +2 OH- Белый студенистый, раств. в избытке OH- , раств. в NH 3*Н 2 О Fe 2+ OH- Fe 2+ +2 OH- =Fe(OH)2↓ Зеленый студенист (красная кровяная соль) 3 K 3[Fe(CN)6] + 3 Fe 2+ = 3 KFe. II[Fe. III(CN)6] ↓ + 6 K+ Синий осадок турнбулевой сини OH- Fe 3+ +3 OH- =Fe(OH)3↓ Коричневый студен (желтая кр овяная соль) 4 K 4[Fe(CN)6] + 4 Fe 3+ = 12 К+ + 4 КFe. III[Fe. II(CN)6] ↓ Синий осадок берлинской лазури SCN- Fe 3+ + 3 SCN- ↔ Fe(SCN)3 Кроваво-красный раствор OH- Cu 2+ +2 OH- =Cu(OH)2↓ Cu(OH)2 +4 NH 3 =[Cu(NH 3)4]2++ 2 OH- Синий студенистый, нераств. в избытке OH - , раств. в NH 3 Fe 3+ Cu 2+ K 3[Fe(CN)6] K 4[Fe(CN)6]
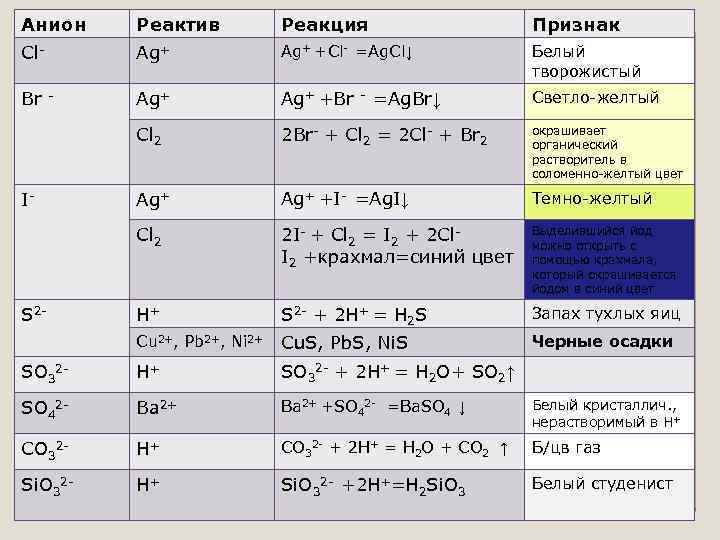 Анион Реактив Реакция Признак Cl- Ag+ +Cl- =Ag. Cl↓ Белый творожистый Br - Ag+ +Br - =Ag. Br↓ Светло-желтый Cl 2 2 Br- + Cl 2 = 2 Cl- + Br 2 окрашивает органический растворитель в соломенно-желтый цвет Ag+ +I- =Ag. I↓ Темно-желтый Cl 2 2 I- + Cl 2 = I 2 + 2 Cl. I 2 +крахмал=синий цвет Выделившийся йод можно открыть с помощью крахмала, который окрашивается йодом в синий цвет H+ S 2 - + 2 H+ = H 2 S Запах тухлых яиц Cu 2+, Pb 2+, Ni 2+ Cu. S, Pb. S, Ni. S Черные осадки SO 32 - H+ SO 32 - + 2 H+ = H 2 O+ SO 2↑ SO 42 - Ba 2+ Белый кристаллич. , Ba 2+ +SO 42 - =Ba. SO 4 ↓ CO 32 - H+ CO 32 - + 2 H+ = H 2 O + CO 2 ↑ Б/цв газ Si. O 32 - H+ Si. O 32 - +2 H+=H 2 Si. O 3 Белый студенист I- S 2 - нерастворимый в Н+
Анион Реактив Реакция Признак Cl- Ag+ +Cl- =Ag. Cl↓ Белый творожистый Br - Ag+ +Br - =Ag. Br↓ Светло-желтый Cl 2 2 Br- + Cl 2 = 2 Cl- + Br 2 окрашивает органический растворитель в соломенно-желтый цвет Ag+ +I- =Ag. I↓ Темно-желтый Cl 2 2 I- + Cl 2 = I 2 + 2 Cl. I 2 +крахмал=синий цвет Выделившийся йод можно открыть с помощью крахмала, который окрашивается йодом в синий цвет H+ S 2 - + 2 H+ = H 2 S Запах тухлых яиц Cu 2+, Pb 2+, Ni 2+ Cu. S, Pb. S, Ni. S Черные осадки SO 32 - H+ SO 32 - + 2 H+ = H 2 O+ SO 2↑ SO 42 - Ba 2+ Белый кристаллич. , Ba 2+ +SO 42 - =Ba. SO 4 ↓ CO 32 - H+ CO 32 - + 2 H+ = H 2 O + CO 2 ↑ Б/цв газ Si. O 32 - H+ Si. O 32 - +2 H+=H 2 Si. O 3 Белый студенист I- S 2 - нерастворимый в Н+
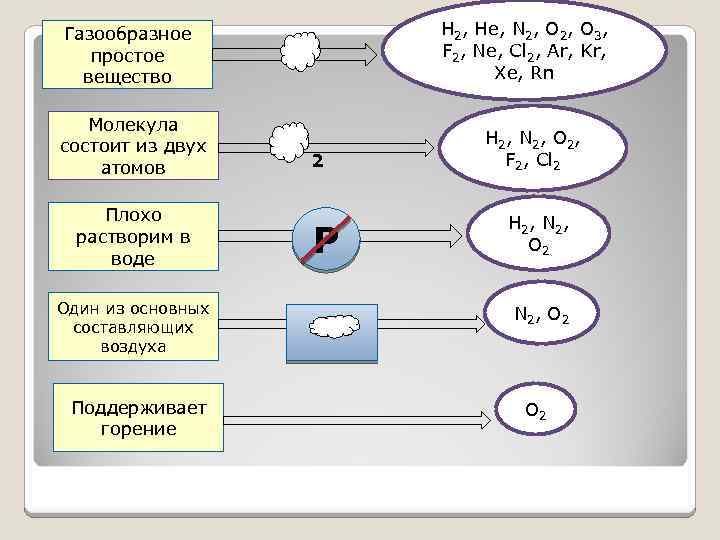 Н 2, Не, N 2, O 3, F 2, Ne, Cl 2, Ar, Kr, Xe, Rn Газообразное простое вещество Молекула состоит из двух атомов Плохо растворим в воде Один из основных составляющих воздуха Поддерживает горение 2 Р Н 2, N 2, O 2, F 2, Cl 2 Н 2, N 2, O 2 N 2, O 2
Н 2, Не, N 2, O 3, F 2, Ne, Cl 2, Ar, Kr, Xe, Rn Газообразное простое вещество Молекула состоит из двух атомов Плохо растворим в воде Один из основных составляющих воздуха Поддерживает горение 2 Р Н 2, N 2, O 2, F 2, Cl 2 Н 2, N 2, O 2 N 2, O 2
 простые H 2, O 2, He, Ne, Ar, Kr, Xe, Rn – б/цв; F 2 – св. -зел. ; Cl 2 – ж. -зел. ; О 3 – син. остальные СО, СО 2, N 2 O, NO, SO 2, CH 4, Si. H 4, NH 3, PH 3, As. H 3, Sb. H 3, H 2 S, HHal, – б/цв; NO 2 -бурый Газы
простые H 2, O 2, He, Ne, Ar, Kr, Xe, Rn – б/цв; F 2 – св. -зел. ; Cl 2 – ж. -зел. ; О 3 – син. остальные СО, СО 2, N 2 O, NO, SO 2, CH 4, Si. H 4, NH 3, PH 3, As. H 3, Sb. H 3, H 2 S, HHal, – б/цв; NO 2 -бурый Газы
 простые бел. оксиды Br 2 - бурая, Hg – серебр. Н 2 О, SO 3, Cl 2 O 7 – б/цв. ; остальные H 2 SO 4, H 2 O 2, HCl. O 4 - б/цв. ; HNO 3 б/цв. летуч. на свету желтеет (разлаг. до NO 2) Жидкости
простые бел. оксиды Br 2 - бурая, Hg – серебр. Н 2 О, SO 3, Cl 2 O 7 – б/цв. ; остальные H 2 SO 4, H 2 O 2, HCl. O 4 - б/цв. ; HNO 3 б/цв. летуч. на свету желтеет (разлаг. до NO 2) Жидкости
 простые Ме – Au – желт. ; Cu – красн. ; остальные сер. /бел. (мет. блеск); Нем – I 2 –фиолет. , мет. блеск; S – желт. ; Р – белый, (красный), С (алмаз) – прозр. ; Si – сер. мет. блеск; Твердые вещества
простые Ме – Au – желт. ; Cu – красн. ; остальные сер. /бел. (мет. блеск); Нем – I 2 –фиолет. , мет. блеск; S – желт. ; Р – белый, (красный), С (алмаз) – прозр. ; Si – сер. мет. блеск; Твердые вещества
 оксиды Ме 2 О (Ме-Li, Na, K), Me. O (Me-Be, Mg, Ca, Sr, Ba, Zn), Al 2 O 3, Sn. O 2, Si. O 2, N 2 O 5, P 2 O 5–бел. ; Cu 2 O – красн. ; Fe 2 O 3, Fe 3 O 4 – корич. ; Hg 2 O, Cu. O, Fe. O – черн. ; Твердые вещества
оксиды Ме 2 О (Ме-Li, Na, K), Me. O (Me-Be, Mg, Ca, Sr, Ba, Zn), Al 2 O 3, Sn. O 2, Si. O 2, N 2 O 5, P 2 O 5–бел. ; Cu 2 O – красн. ; Fe 2 O 3, Fe 3 O 4 – корич. ; Hg 2 O, Cu. O, Fe. O – черн. ; Твердые вещества
 гидроксиды Fe(OH)2 – болотного цв. Ni(OH)2 – зелен. ; Cu(OH)2 – голуб. ; Fe(OH)3 – бурый цв. Твердые вещества
гидроксиды Fe(OH)2 – болотного цв. Ni(OH)2 – зелен. ; Cu(OH)2 – голуб. ; Fe(OH)3 – бурый цв. Твердые вещества
 соли (растворы солей) Cu 2+ - голуб. /св. зелен. ; Fe 3+ - коричн. ; Ni 2+-зелен. Ag. I, Ag 3 PO 4, Pb. I 2, K 4[Fe(CN)6]-желт. ; Ag. Br – св. -желт. Твердые вещества
соли (растворы солей) Cu 2+ - голуб. /св. зелен. ; Fe 3+ - коричн. ; Ni 2+-зелен. Ag. I, Ag 3 PO 4, Pb. I 2, K 4[Fe(CN)6]-желт. ; Ag. Br – св. -желт. Твердые вещества
 Учащимся для проведения опытов были выданы кристаллические соли белого цвета, которые при стоянии на воздухе изменяют окраску на голубую. Известно, что при разложении выданной соли образуется оксид металла черного цвета, газ, поддерживающий горение и ядовитый бурый газ. Добавлении к раствору выданной соли гидроксида калия привело к образованию студенистого осадка голубого цвета. Запишите химическую формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 1. Cu(NO 3)2 – нитрат меди (II) Cu(NO 3)2 =Cu. O +2 NO 2 +O 2 Cu(NO 3)2 +2 KOH=Cu(OH)2+2 KNO 3
Учащимся для проведения опытов были выданы кристаллические соли белого цвета, которые при стоянии на воздухе изменяют окраску на голубую. Известно, что при разложении выданной соли образуется оксид металла черного цвета, газ, поддерживающий горение и ядовитый бурый газ. Добавлении к раствору выданной соли гидроксида калия привело к образованию студенистого осадка голубого цвета. Запишите химическую формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 1. Cu(NO 3)2 – нитрат меди (II) Cu(NO 3)2 =Cu. O +2 NO 2 +O 2 Cu(NO 3)2 +2 KOH=Cu(OH)2+2 KNO 3
 Для определения качественного состава выданной соли двухвалентного металла, применяющегося в качестве антикоррозионного покрытия стальных изделий, учащийся провел две реакции. В ходе первого опыта учащийся приливал к раствору соли раствор гидроксида натрия и наблюдал выпадение студенистого осадка, растворившегося при дальнейшем добавлении щелочи. А при добавлении к раствору выданной соли хлорида бария выпал белый кристаллический осадок. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакции, соответствующих опытам. Задача 2. Zn. SO 4 – сульфат цинка Zn. SO 4 +2 Na. OH=Zn(OH)2+Na 2 SO 4 Zn(OH)2+Na. OH=Na 2[Zn(OH)4] Zn. SO 4+Ba. Cl 2=Ba. SO 4↓+Zn. Cl 2
Для определения качественного состава выданной соли двухвалентного металла, применяющегося в качестве антикоррозионного покрытия стальных изделий, учащийся провел две реакции. В ходе первого опыта учащийся приливал к раствору соли раствор гидроксида натрия и наблюдал выпадение студенистого осадка, растворившегося при дальнейшем добавлении щелочи. А при добавлении к раствору выданной соли хлорида бария выпал белый кристаллический осадок. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакции, соответствующих опытам. Задача 2. Zn. SO 4 – сульфат цинка Zn. SO 4 +2 Na. OH=Zn(OH)2+Na 2 SO 4 Zn(OH)2+Na. OH=Na 2[Zn(OH)4] Zn. SO 4+Ba. Cl 2=Ba. SO 4↓+Zn. Cl 2
 Для проведения опытов учащимся выдана соль, анион которой образован атомами единственного неметалла – жидкости (при н. у. ). Учащимися было проведено две реакции. В ходе первой, при пропускании через выданный раствор соли хлора, образовалась новая соль и указанный неметалл – жидкость. А при добавлении к выданной соли раствора карбоната натрия выпал белый осадок, являющийся основой горной породы – мрамор. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакции, соответствующих опытам. Задача 3. Ca. Br 2 – бромид кальция Ca. Br 2 + Cl 2 =Ca. Cl 2 + Br 2 Ca. Br 2 + Na 2 CO 3=Ca. CO 3↓ +2 Na. Br
Для проведения опытов учащимся выдана соль, анион которой образован атомами единственного неметалла – жидкости (при н. у. ). Учащимися было проведено две реакции. В ходе первой, при пропускании через выданный раствор соли хлора, образовалась новая соль и указанный неметалл – жидкость. А при добавлении к выданной соли раствора карбоната натрия выпал белый осадок, являющийся основой горной породы – мрамор. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакции, соответствующих опытам. Задача 3. Ca. Br 2 – бромид кальция Ca. Br 2 + Cl 2 =Ca. Cl 2 + Br 2 Ca. Br 2 + Na 2 CO 3=Ca. CO 3↓ +2 Na. Br
 При изучении свойств металла, ионы которого обуславливают существование карбонатной жесткости воды, исследователь провел два опыта. Вначале он пожег стружку выданного металла в ложечке для сжигания и быстро поместил ее в стакан с водой. При этом горение металла продолжалось и под водой. В ходе второй реакции выданный порошок добавили к концентрированной серной кислоте , при этом выделился газ с неприятным запахом. Запишите формулу и название соли, полученной в ходе второго опыта. Составьте два молекулярных уравнения реакции, соответствующих опытам. Задача 4. Mg. SO 4 – сульфат магния Mg + 2 H 2 O = Mg(OH)2 + H 2 4 Mg +5 H 2 SO 4 = 4 Mg. SO 4 + H 2 S↑ + 4 H 2 O
При изучении свойств металла, ионы которого обуславливают существование карбонатной жесткости воды, исследователь провел два опыта. Вначале он пожег стружку выданного металла в ложечке для сжигания и быстро поместил ее в стакан с водой. При этом горение металла продолжалось и под водой. В ходе второй реакции выданный порошок добавили к концентрированной серной кислоте , при этом выделился газ с неприятным запахом. Запишите формулу и название соли, полученной в ходе второго опыта. Составьте два молекулярных уравнения реакции, соответствующих опытам. Задача 4. Mg. SO 4 – сульфат магния Mg + 2 H 2 O = Mg(OH)2 + H 2 4 Mg +5 H 2 SO 4 = 4 Mg. SO 4 + H 2 S↑ + 4 H 2 O
 Для проведения опытов учащимся выдан порошок оксида металла. Известно, что из металла, входящего в состав, получают легкие сплавы, используемые, например, в самолетостроении. При взаимодействии выданного оксида с серной кислотой образуется соль и вода, а при его сплавлении с карбонатом натрия образуется соль и кислотный оксид. Запишите формулу и название выданного вещества. Составьте два молекулярных уравнения реакции, соответствующих опытам. Задача 5. Al 2 O 3 – оксид алюминия Al 2 O 3 + 3 H 2 SO 4 =Al 2(SO 4)3+3 H 2 O Al 2 O 3+ Na 2 CO 3 =2 Na. Al. O 2 + CO 2
Для проведения опытов учащимся выдан порошок оксида металла. Известно, что из металла, входящего в состав, получают легкие сплавы, используемые, например, в самолетостроении. При взаимодействии выданного оксида с серной кислотой образуется соль и вода, а при его сплавлении с карбонатом натрия образуется соль и кислотный оксид. Запишите формулу и название выданного вещества. Составьте два молекулярных уравнения реакции, соответствующих опытам. Задача 5. Al 2 O 3 – оксид алюминия Al 2 O 3 + 3 H 2 SO 4 =Al 2(SO 4)3+3 H 2 O Al 2 O 3+ Na 2 CO 3 =2 Na. Al. O 2 + CO 2
 Для проведения опытов исследователям выдано вещество, представляющее собой нерастворимые в воде кристаллы желтого цвета. Известно, что это вещество используется при изготовлении спичек и вулканизации каучука. В результате взаимодействия выданного вещества с концентрированной серной кислотой при нагревании образуется газообразный оксид и вода. А при пропускании образовавшегося оксида через раствор гидроксида бария выпадает осадок белого цвета, растворяющийся при дальнейшем пропускании газа. Запишите формулу и название соли, полученной в результате второго опыта. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 6. Ba. SO 3 – сульфит бария или Ba(HSO 3)2 – гидросульфит бария S +2 H 2 SO 4 = 3 SO 2 +2 H 2 O SO 2 + Ba(OH)2=Ba. SO 3 +H 2 O или SO 2 + Ba(OH)2 = Ba(HSO 3)2
Для проведения опытов исследователям выдано вещество, представляющее собой нерастворимые в воде кристаллы желтого цвета. Известно, что это вещество используется при изготовлении спичек и вулканизации каучука. В результате взаимодействия выданного вещества с концентрированной серной кислотой при нагревании образуется газообразный оксид и вода. А при пропускании образовавшегося оксида через раствор гидроксида бария выпадает осадок белого цвета, растворяющийся при дальнейшем пропускании газа. Запишите формулу и название соли, полученной в результате второго опыта. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 6. Ba. SO 3 – сульфит бария или Ba(HSO 3)2 – гидросульфит бария S +2 H 2 SO 4 = 3 SO 2 +2 H 2 O SO 2 + Ba(OH)2=Ba. SO 3 +H 2 O или SO 2 + Ba(OH)2 = Ba(HSO 3)2
 Учащимся в процессе исследования свойств раствора выданной соли было проведено два опыта. При проведении первого опыта к раствору соли добавили гидроксид калия и нагрели на спиртовке, в результате чего выделился газ с раздражающим запахом. А ко второй части раствора прилили раствор нитрата свинца, в результате чего образовался черный осадок. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 7. (NH 4)2 S – сульфид аммония (NH 4)2 S + 2 KOH = K 2 S +2 NH 3↑ +2 H 2 O (NH 4)2 S + Pb(NO 3)2=Pb. S↓ + 2 NH 4 NO 3
Учащимся в процессе исследования свойств раствора выданной соли было проведено два опыта. При проведении первого опыта к раствору соли добавили гидроксид калия и нагрели на спиртовке, в результате чего выделился газ с раздражающим запахом. А ко второй части раствора прилили раствор нитрата свинца, в результате чего образовался черный осадок. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 7. (NH 4)2 S – сульфид аммония (NH 4)2 S + 2 KOH = K 2 S +2 NH 3↑ +2 H 2 O (NH 4)2 S + Pb(NO 3)2=Pb. S↓ + 2 NH 4 NO 3
 В процессе изучения свойств соединений элементов VIA группы были проведены два опыта. При взаимодействии натрия с концентрированной серной кислотой образовался газ с неприятным запахом. Известно также, что раствор этого газа в воде является кислотой, а при добавлении к нему раствора нитрата меди (II) образуется черный осадок. Запишите формулу и название вещества, выпавшего в осадок. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 8. Cu. S – сульфид меди (II) 8 Na + 5 H 2 SO 4 = 4 Na 2 SO 4 + H 2 S↑ + 4 H 2 O H 2 S + Cu(NO 3)2=Cu. S↓ +2 HNO 3
В процессе изучения свойств соединений элементов VIA группы были проведены два опыта. При взаимодействии натрия с концентрированной серной кислотой образовался газ с неприятным запахом. Известно также, что раствор этого газа в воде является кислотой, а при добавлении к нему раствора нитрата меди (II) образуется черный осадок. Запишите формулу и название вещества, выпавшего в осадок. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 8. Cu. S – сульфид меди (II) 8 Na + 5 H 2 SO 4 = 4 Na 2 SO 4 + H 2 S↑ + 4 H 2 O H 2 S + Cu(NO 3)2=Cu. S↓ +2 HNO 3
 Учащимся для получения металла, из которого изготавливают ювелирные изделия, была выдана соль этого металла. Известно, что одним из способов получения металла является разложение выданной соли, при этом образуется металл и два газа, один из которых имеет бурый цвет, а другой поддерживает горение. А при внесении железного гвоздя в раствор соли на поверхности гвоздя также образуется получаемый металл. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 9. Ag. NO 3 – нитрат серебра 2 Ag. NO 3 = 2 Ag + 2 NO 2 + O 2 2 Ag. NO 3 + Fe = Fe(NO 3)2 +2 Ag
Учащимся для получения металла, из которого изготавливают ювелирные изделия, была выдана соль этого металла. Известно, что одним из способов получения металла является разложение выданной соли, при этом образуется металл и два газа, один из которых имеет бурый цвет, а другой поддерживает горение. А при внесении железного гвоздя в раствор соли на поверхности гвоздя также образуется получаемый металл. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 9. Ag. NO 3 – нитрат серебра 2 Ag. NO 3 = 2 Ag + 2 NO 2 + O 2 2 Ag. NO 3 + Fe = Fe(NO 3)2 +2 Ag
 Учащимся для изучения химических свойств была выдана нерастворимая в воде соль белого цвета. Известно, что катион, входящий в состав этой соли, необходим растущим организмам для минерализации костей. При взаимодействии выданной соли с раствором азотной кислоты наблюдалось выделение бесцветного газа. А при добавлении к полученному раствору избытка раствора фосфата натрия выпал осадок, который на 70% соответствует составу костей человека. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 10. Са. СО 3 – карбонат кальция Са. СО 3 + 2 HNO 3 =Ca(NO 3)2 +CO 2 +H 2 O 3 Ca(NO 3)2+2 Na 3 PO 4=Ca 3(PO 4)2+6 Na. NO 3
Учащимся для изучения химических свойств была выдана нерастворимая в воде соль белого цвета. Известно, что катион, входящий в состав этой соли, необходим растущим организмам для минерализации костей. При взаимодействии выданной соли с раствором азотной кислоты наблюдалось выделение бесцветного газа. А при добавлении к полученному раствору избытка раствора фосфата натрия выпал осадок, который на 70% соответствует составу костей человека. Запишите формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам. Задача 10. Са. СО 3 – карбонат кальция Са. СО 3 + 2 HNO 3 =Ca(NO 3)2 +CO 2 +H 2 O 3 Ca(NO 3)2+2 Na 3 PO 4=Ca 3(PO 4)2+6 Na. NO 3


