Лекция 12 Простые вещества.pptx
- Количество слайдов: 38

Государственный университет питания и торговли Кафедра общей и пищевой химии Факультет экономики и менеджмента Общая и неорганическая химия Губский Сергей Михайлович доцент, кандидат химических наук «Я могу лишь показать тебе дверь, но войти в нее ты можешь сам» «МАТРИЦА» кинофильм

Общая и неорганическая химия Лекция Факультет экономики и менеджмента 12 Простые вещества

Общая и неорганическая химия Ключевые вопросы Факультет экономики и менеджмента q 12. 1. Классификация неорганических соединений. Простые и сложные вещества. Металлы и неметаллы q 12. 2. Металлы. Структуры, получение, физико-химические свойства. Классификация. Ряд активностей металлов q 12. 3. Неметаллы. Структуры, получение, физико-химические свойства. q 12. 4. Оксиды

Общая и неорганическая химия Ключевые вопросы Факультет экономики и менеджмента ü 12. 1. Классификация неорганических соединений. Простые и сложные вещества. Металлы и неметаллы q 12. 2. Металлы. Структуры, получение, физико-химические свойства. Классификация. Ряд активностей металлов q 12. 3. Неметаллы. Структуры, получение, физико-химические свойства. q 12. 4. Оксиды
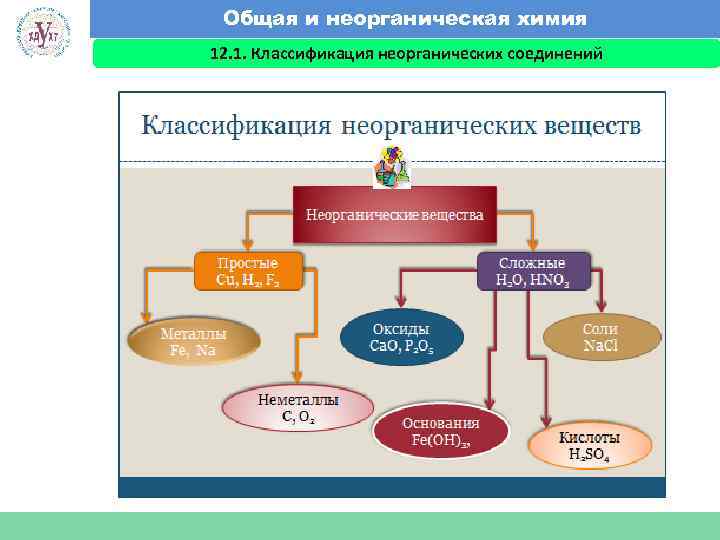
Общая и неорганическая химия 12. 1. Классификация неорганических соединений Факультет экономики и менеджмента
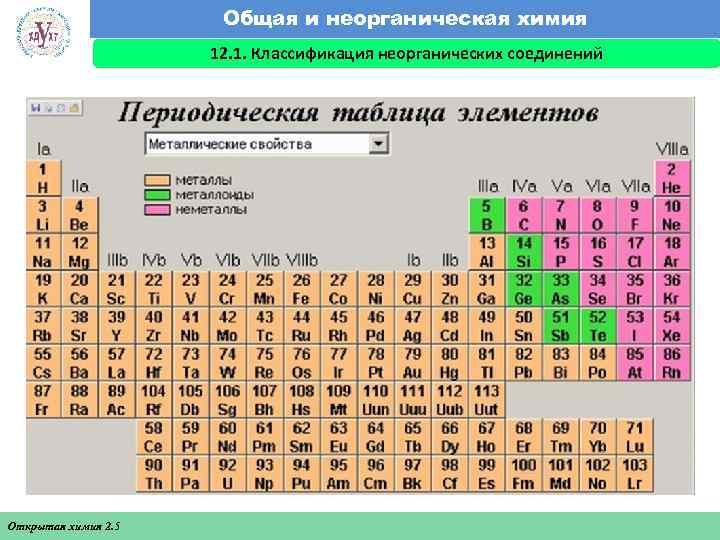
Общая и неорганическая химия 12. 1. Классификация неорганических соединений Факультет экономики и менеджмента Открытая химия 2. 5
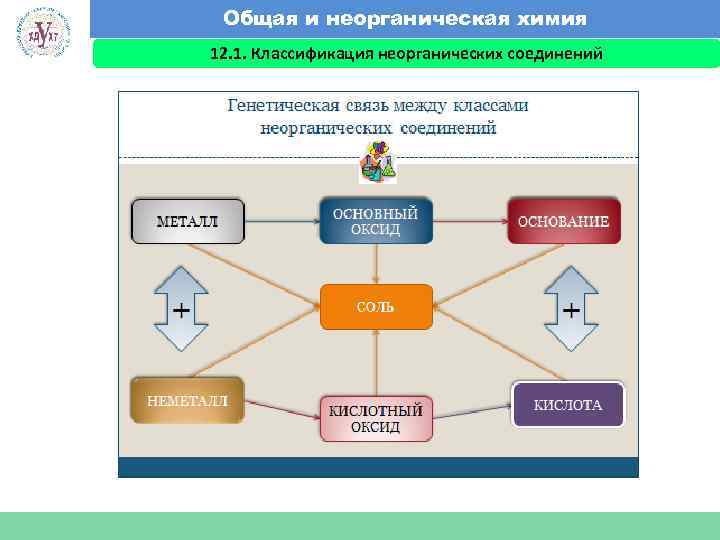
Общая и неорганическая химия 12. 1. Классификация неорганических соединений Факультет экономики и менеджмента

Общая и неорганическая химия Ключевые вопросы Факультет экономики и менеджмента q 12. 1. Классификация неорганических соединений. Простые и сложные вещества. Металлы и неметаллы ü 12. 2. Металлы. Структуры, получение, физико-химические свойства. Классификация. Ряд активностей металлов q 12. 3. Неметаллы. Структуры, получение, физико-химические свойства. q 12. 4. Оксиды
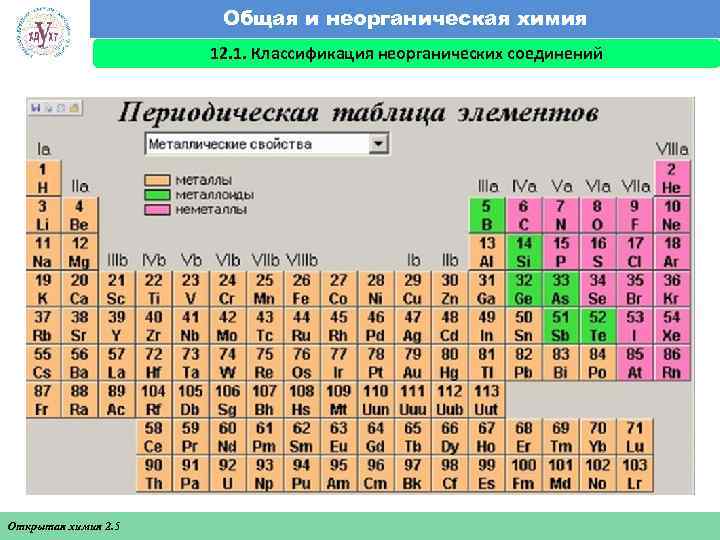
Общая и неорганическая химия 12. 1. Классификация неорганических соединений Факультет экономики и менеджмента Открытая химия 2. 5
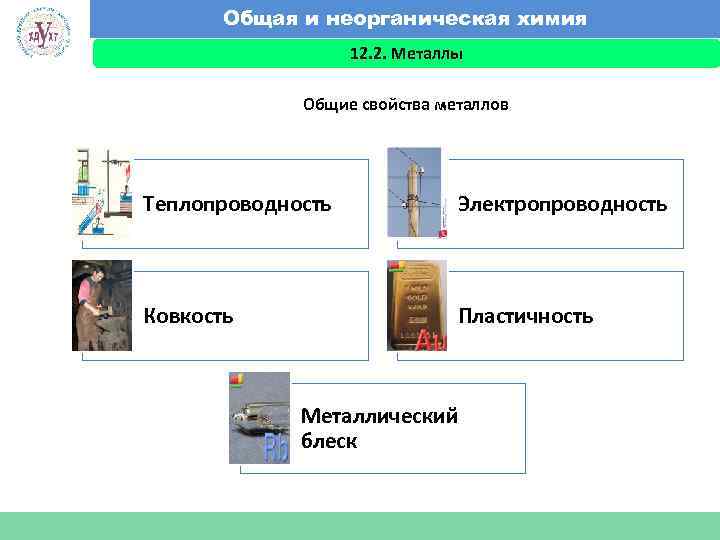
Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента Общие свойства металлов Теплопроводность Электропроводность Ковкость Пластичность Металлический блеск
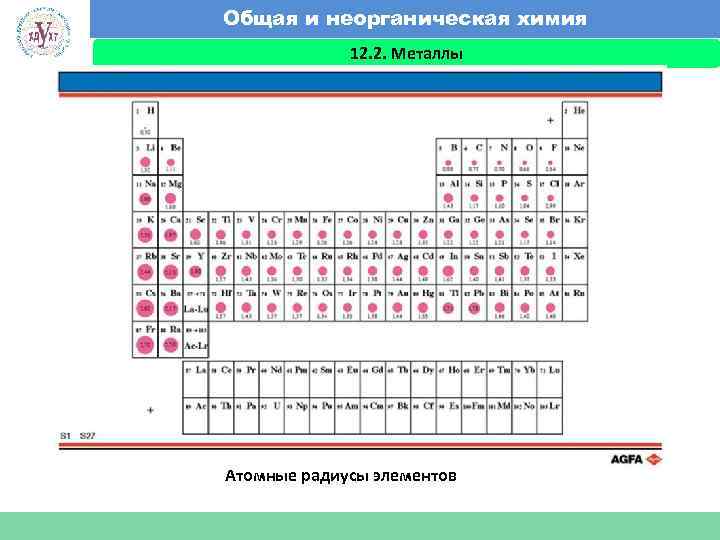
Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента Атомные радиусы элементов
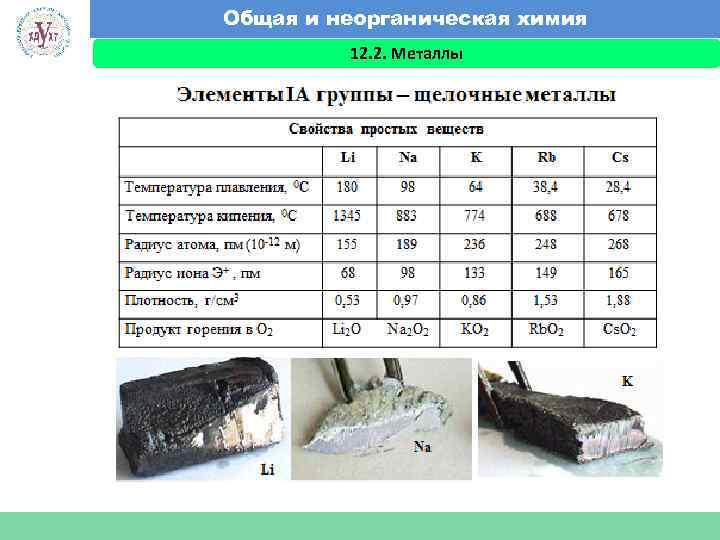
Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента

Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента

Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента

Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента Уменьшение восстановительных свойств Усиление окислительных свойств
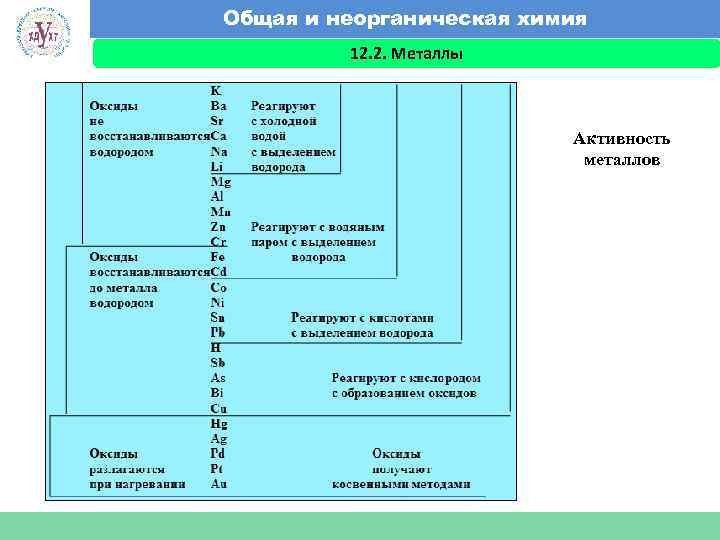
Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента Активность металлов

Общая и неорганическая химия 8. 1. Электродные потенциалы Факультет экономики и менеджмента
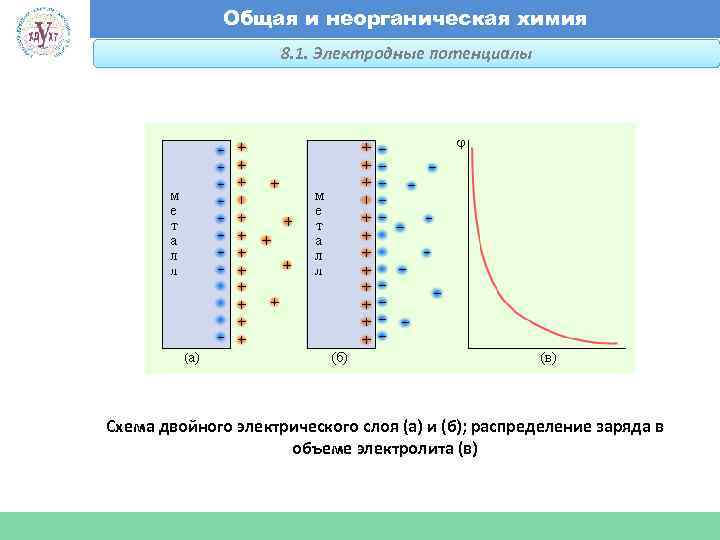
Общая и неорганическая химия 8. 1. Электродные потенциалы Факультет экономики и менеджмента Схема двойного электрического слоя (а) и (б); распределение заряда в объеме электролита (в)

Общая и неорганическая химия 8. 1. Электродные потенциалы Факультет экономики и менеджмента

Общая и неорганическая химия 8. 1. Электродные потенциалы Факультет экономики и менеджмента
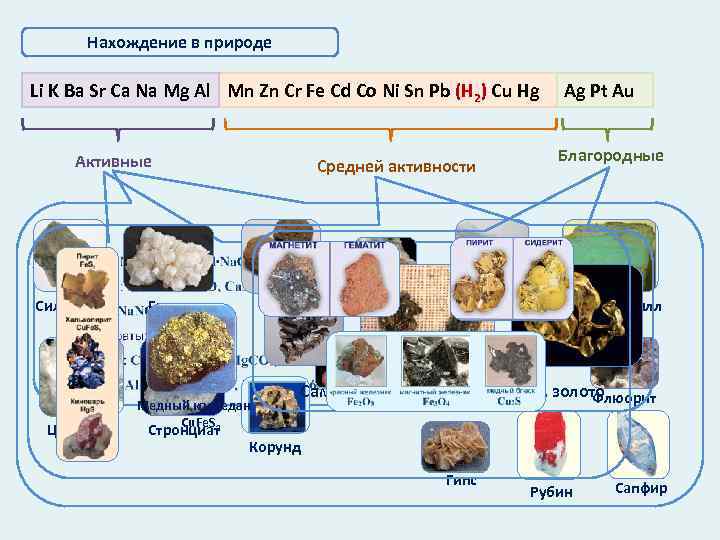
Нахождение в природе Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (Н 2) Cu Hg Активные Сильвинит Целестит Средней активности Галит Барит Медный колчедан Cu. Fe. S 2 Стронциат Магнезит Кальцит Ag Pt Au Благородные Хризоберилл Самородные серебро, платина, золото Флюорит Боксит Фосфорит Корунд Гипс Рубин Сапфир
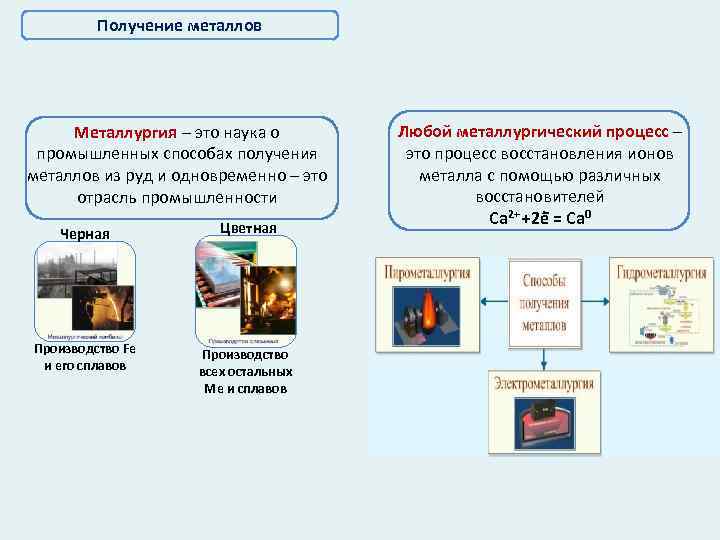
Получение металлов Металлургия – это наука о промышленных способах получения металлов из руд и одновременно – это отрасль промышленности Черная Цветная Производство Fe и его сплавов Производство всех остальных Ме и сплавов Любой металлургический процесс – это процесс восстановления ионов металла с помощью различных восстановителей Ca 2+ +2 e = Ca 0
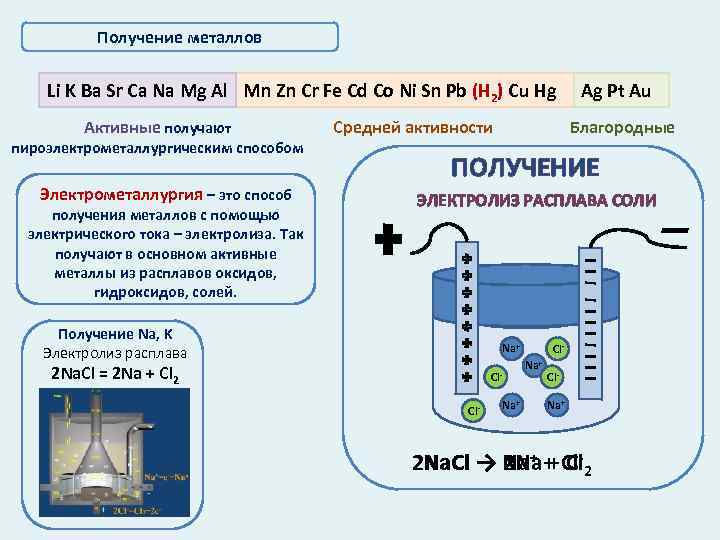
Получение металлов Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (Н 2) Cu Hg Активные получают пироэлектрометаллургическим способом Электрометаллургия – это способ получения металлов с помощью электрического тока – электролиза. Так получают в основном активные металлы из расплавов оксидов, гидроксидов, солей. Средней активности Ag Pt Au Благородные ПОЛУЧЕНИЕ ЭЛЕКТРОЛИЗ РАСПЛАВА СОЛИ Получение Na, K Электролиз расплава Na+ 2 Na. Cl = 2 Na + Cl 2 Cl. Cl- Na+ Cl. Na+ 2 Na. Cl → Na+ + Cl-2 Na. Cl 2 Na + Cl

Получение металлов Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (Н 2) Cu Hg Активные получают пироэлектрометаллургическим способом Средней активности Ag Pt Au Благородные Электрометаллургия – это способ получения металлов с помощью электрического тока – электролиза. Так получают в основном активные металлы из расплавов оксидов, гидроксидов, солей. Получение Аl электролизом Аl 2 O 3 Электролизер для получения Аl T 950°C, Al 2 O 3 в расплаве криолита (Na 3 Al. F 6); на катоде: Al 3+ + 3 e = Al 0 На угольном аноде (расходуется в процессе электролиза): O 2 -- 2 e = O 0; C + O = CO↑; 2 CO + O 2 = 2 CO 2↑;
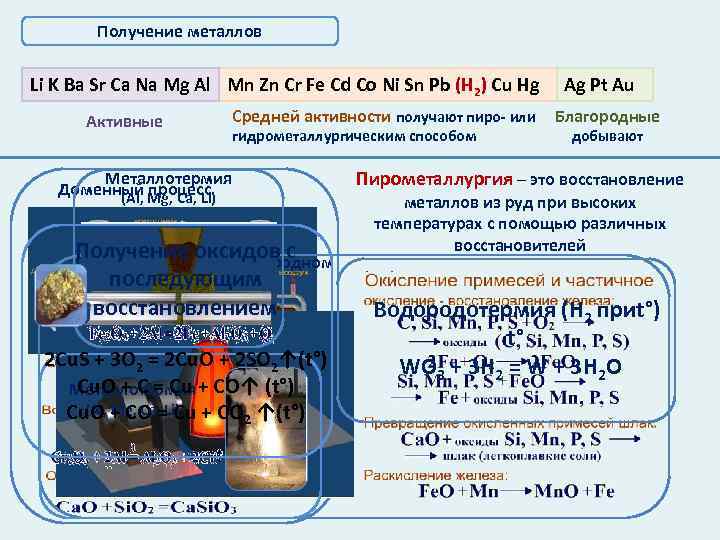
Получение металлов Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (Н 2) Cu Hg Активные Средней активности получают пиро- или гидрометаллургическим способом Металлотермия Доменный Mg, Ca, Li) (Al, процесс Получение оксидов с Получение стали в кислородном последующим конвертере восстановлением 2 Cu. S + 3 O 2 = 2 Cu. O + 2 SO 2↑(t°) Cu. O + C = Cu Металлотермия + CO↑ (t°) (Al, Mg, Ca, Cu Cu. O + CO =Li) + CO 2 ↑(t°) Ag Pt Au Благородные добывают Пирометаллургия – это восстановление металлов из руд при высоких температурах с помощью различных восстановителей Водородотермия (Н 2 приt°) t° WO 3 + 3 H 2 = W + 3 H 2 O
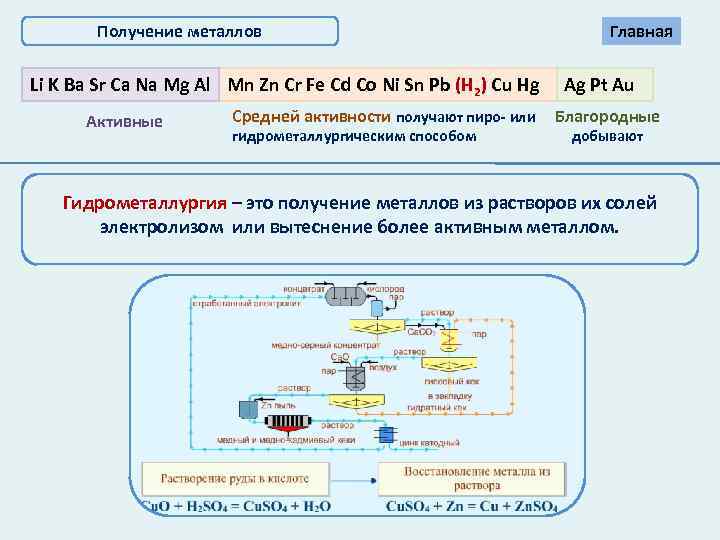
Получение металлов Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (Н 2) Cu Hg Активные Средней активности получают пиро- или гидрометаллургическим способом Главная Ag Pt Au Благородные добывают Гидрометаллургия – это получение металлов из растворов их солей электролизом или вытеснение более активным металлом.

Химические свойства металлов Окисляются при комнатной температуре При обычных условиях взаимодействуют с водой с образованием щелочи и Н 2 ↑ При комн. t°окисл. только с поверх. Окисляются только при нагревании С водой взаимодействуют только при нагревании с образованием оксида и Н 2↑ Помни! 2 Al + 6 HOH → 2 Al(OH)3 + 3 H 2↑ (если снять оксидную пленку) При t° не окисляются С водой не взаимодействуют Коррозионная устойчивость чистых металлов усиливается Из растворов кислот вытесняют водород (исключение HNO 3) Помни! Щелочные и щелочноземельные металлы в водных растворах взаимодействуют прежде всего с Н 2 О Из растворов кислот не вытесняют водород Взаимодействуют с серной кислотой (конц. ). В зависимости от условий и восстановительных свойств Ме образуются SO 2, S, H 2 S (Fe, Ni и некоторые металлы в H 2 SO 4 (конц. ) на холоду пассивируются). Не взаимод ействуют

Химические свойства металлов Взаимодействуют с разбавленной и концентрированной азотной кислотой и в зависимости от условий, восстановительных свойств металлов, концентрации кислоты образуются N 2, N 2 O, N 2 O 3, NO 2 u NH 3 (NH 4 NO 3). Al, Fe, Cr в концентрированной азотной кислоте пассивируются. С HNO 3 не реагируют С разбавленной H 2 SO 4 взаимодействуют с образованием Н 2 С раствором H 2 SO 4 не реагируют С HCl взаимодействуют с образованием Н 2 C HCl не реагируют Каждый впереди стоящий металл вытесняет все последующие металлы из растворов и расплавов их солей При электролизе сначала изменяется тот катион, металл которого находится правее в электрохимическом ряду напряжений металлов Примечание: среди закономерностей, связывающих ряд напряжений металлов и химические свойства Ме и их соединений, есть исключения из правил. Будьте внимательны, обратитесь к теории!
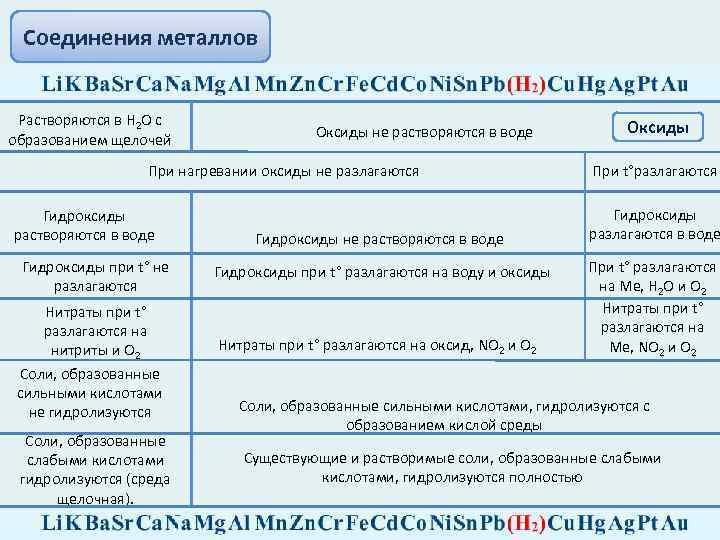
Соединения металлов Растворяются в Н 2 О с образованием щелочей Оксиды не растворяются в воде При нагревании оксиды не разлагаются Гидроксиды растворяются в воде Гидроксиды при t° не разлагаются Нитраты при t° разлагаются на нитриты и О 2 Cоли, образованные сильными кислотами не гидролизуются Cоли, образованные слабыми кислотами гидролизуются (среда щелочная). Гидроксиды не растворяются в воде Гидроксиды при t° разлагаются на воду и оксиды Нитраты при t° разлагаются на оксид, NO 2 и О 2 Оксиды При t°разлагаются Гидроксиды разлагаются в воде При t° разлагаются на Ме, Н 2 О и О 2 Нитраты при t° разлагаются на Ме, NO 2 и О 2 Cоли, образованные сильными кислотами, гидролизуются с образованием кислой среды Существующие и растворимые соли, образованные слабыми кислотами, гидролизуются полностью

Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента Бинарные соединения Оксиды – Na 2 O, Ba. O. Пероксиды – Na 2 O 2, Ba. O 2. Галиды – KCl, Ca. F 2. Сульфиды – Mn. S, Al 2 S 3. Гидриды – Li. H, Ca. H 2. Нитриды – Na 3 N, Al. N. Карбиды – Be 2 C, Ca. C 2. Фосфиды – Ca 3 P 2, Na 3 P. Бориды – Al. B, Mg 3 B 2. Силициды – Mg 2 Si, Al 4 Si 3.

Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента • Бинарные соединения: гидриды MH, MH 2; пероксиды M 2 O 2, MO 2; нитриды M 3 N, M 3 N 2 • KH + H 2 O = KOH + H 2 • Na 2 O 2(т) + H 2 O 2 Na+ + OH + HO 2 • 2 Na. O 2 + H 2 O = Na. OH + Na. HO 2 + O 2 • 4 Na. O 2 + 2 H 2 O = 4 Na. OH + 3 O 2 • 2 Cs. O 3 + 2 H 2 O = 2 Cs. OH + H 2 O 2 + 2 O 2 • Li 3 N + 3 H 2 O = 3 Li. OH + NH 3 • Ca. C 2 + 2 H 2 O = Ca(OH)2 + C 2 H 2 • Be 2 C + 4 H 2 O = 2 Be(OH)2 + CH 4
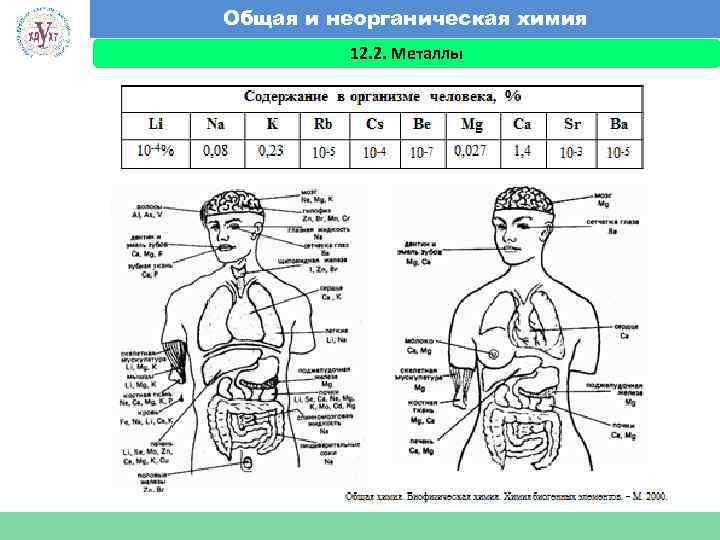
Общая и неорганическая химия 12. 2. Металлы Факультет экономики и менеджмента

Общая и неорганическая химия Ключевые вопросы Факультет экономики и менеджмента q 12. 1. Классификация неорганических соединений. Простые и сложные вещества. Металлы и неметаллы q 12. 2. Металлы. Структуры, получение, физико-химические свойства. Классификация. Ряд активностей металлов ü 12. 3. Неметаллы. Структуры, получение, физико-химические свойства. q 12. 4. Оксиды
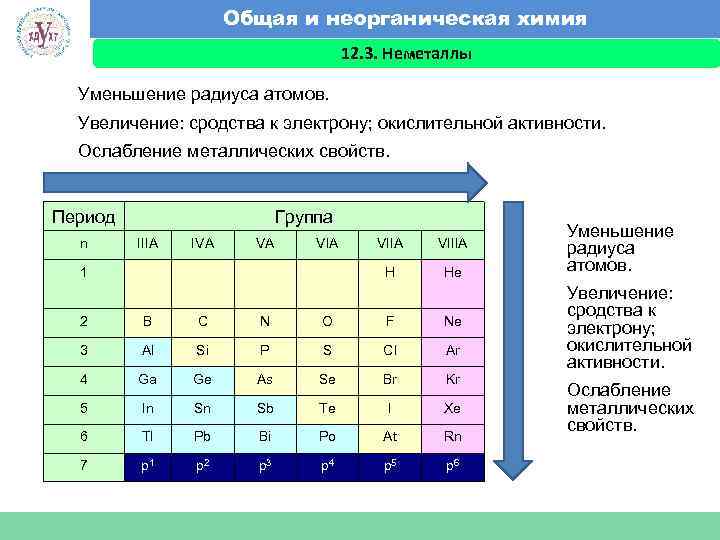
Общая и неорганическая химия 12. 3. Неметаллы Факультет экономики и менеджмента Уменьшение радиуса атомов. Увеличение: сродства к электрону; окислительной активности. Ослабление металлических свойств. Период n Группа IIIA IVA VA VIIIA H 1 VIIA He 2 B C N O F Ne 3 Al Si P S Cl Ar 4 Ga Ge As Se Br Kr 5 In Sn Sb Te I Xe 6 Tl Pb Bi Po At Rn 7 p 1 p 2 p 3 p 4 p 5 p 6 Уменьшение радиуса атомов. Увеличение: сродства к электрону; окислительной активности. Ослабление металлических свойств.

Общая и неорганическая химия 12. 3. Неметаллы Факультет экономики и менеджмента

Общая и неорганическая химия 12. 3. Неметаллы Факультет экономики и менеджмента

Общая и неорганическая химия Размещение информации в интернете Факультет экономики и менеджмента https: //app. box. com/s/6 pqeo 5 cvgkprr 6 e 4 cjvn https: //www. dropbox. com/sh/ra 6 h 14 nnvk 3 v 6 j 9/g. Wzk. MEX_MH http: //vk. com/public 58012086 Облачное хранилище данных (англ. cloud storage) — модель онлайн-хранилища

Общая и неорганическая химия Лекция № 1. Атомно-молекулярное учение Факультет экономики и менеджмента Благодарю за внимание
Лекция 12 Простые вещества.pptx