
Гормоны

Гормо ны (греч. Ορμόνη) (от греческого hormao - возбуждаю, побуждаю) — биологически активные сигнальные химические вещества, выделяемые эндокринными железами и оказывающие дистанционное сложное и многогранное воздействие на организм в целом либо на определённые органы и ткани-мишени. Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в определённых органах и системах.

Расположение основных желёз внутренней секреции

Классификация гормонов по химическому строению 1) белково-пептидные гормоны а. гормоны поджелудочной железы (инсулин, глюкагон). б. гормоны гипофиза и гипоталамуса (АКТГ, пролактин, гонадотропные гормоны, ТТГ, соматотропный гормон, вазопрессин, окситоцин) в. гормоны щитовидной и паращитовидной желёз (кальцитонин, паратгормон, витамин D и его производные) 2) стероидные гормоны (глюко и минералкортикоиды, половые гормоны) 3) гормоны - производные аминокислот (тиреоидные гормоны, мелатонин, адреналин)


Инсулин и пероральные гипогликемические средства Молекула инсулина образована двумя полипептидными цепями, содержащими 51 аминокислотный остаток: A-цепь состоит из 21 аминокислотного остатка, B-цепь образована 30 аминокислотными остатками. Полипептидные цепи соединяются двумя дисульфидными мостиками через остатки цистеина, третья дисульфидная связь расположена в A-цепи. Первичная структура инсулина у разных биологических видов несколько различается, как различается и его важность в регуляции обмена углеводов. Наиболее близким к человеческому является инсулин свиньи, который различается с ним всего одним аминокислотным остатком: в 30 положении B-цепи свиного инсулина расположен аланин, а в инсулине человека — треонин; бычий инсулин отличается тремя аминокислотными остатками.

Первичная структура человеческого инсулина

Секреция инсулина Как известно, в физиологическихусловиях базальная (фоновая) секреция инсулина происходит непрерывно (в том числе в отсутствии приема пищи, а также ночью) и составляет около 1 единицы инсулина в час (см. рис. 1). При физической нагрузке инсулиновая секреция в норме заметно уменьшается. Чтобы поддержать уровень гликемии в пределах нормы во время приема пищи и после него, требуется значительная добавочная (стимулированная) секреция инсулина (приблизительно 1 -2 единицы инсулина на каждые 10 г углеводов).

Единицы действия инсулина МЕ и ЕД: есть ли разница Активность инсулина измеряется в единицах действия (ЕД) или, что то же самое в данном случае, в международных единицах действия (МЕ - русск. или IU - англ. или UI - франц. ). 1 единица соответствует активности 1/24 мг (41, 66 мкг) кристаллического инсулина. Различия нет потому, что в СССР когда-то приняли международные единицы без изменений. Интересна история становления единицы действия инсулина. Фредерик Бантинг в 1922 году предложил считать единицей действия инсулина такое количество кубических сантиметров экстракта поджелудочной железы, которое в течение 2 -4 часов доводило здорового кролика до гипогликемии с уровнем СК 2, 5 ммоль/л. В повседневной жизни учёные стали называть эту единицу "кроличьей". Чуть позже в том же году (видимо, кончились кролики) тем же коллективом была предложена "мышиная" единица - количество инсулина, необходимое для доведения до конвульсий половины экспериментальной группы мышей (думаю, что исследователи здесь сначала действовали по аналогии с LD 50). На следующий год Международный комитет по стандартизации принял такое определение единицы действия инсулина: "количество инсулина, потребное для снижения уровня глюкозы крови до уровня, при котором начинаются судороги у кроликов весом 2 кг, не получавших пищу в течение 24 часов". Эта единица в честь Торонтской группы Бантинга и Беста получила название торонтской единицы действия инсулина. Чуть позже было обнаружено, что кролики бывают разные, и совсем не все падают в обморок от такой ерунды, как одна торонтская единица инсулина. Поэтому в 1925 году был введён в действие первый международный стандарт, который установил, что одна единица действия инсулина - это количество, эквивалентное 1/8 мг кристаллического инсулина. В связи с большим прогрессом на пути очистки инсулина и неудобством применения столь большой единицы в 1936 году комитетом Лиги Наций был одобрен новый международный стандарт действия инсулина, который приравнивал единицу к 1/22 мг кристаллического инсулина. В 1952 году стандарт был вновь изменён и 1 единица была приравнена к 1/24, 5 мг кристаллического инсулина, а в 1958 году наконец-то появился четвёртый, действующий сегодня стандарт (1 ЕД равна 1/24 мг кристаллического инсулина). ВОЗ в 1982 году внесла последние корректировки в стандарт, которые не затронули определение единицы, а касались лишь изменений, связанных с появлением человеческих генноинженерных инсулинов. Так появились сегодняшние хорошо знакомые нам единицы действия инсулина.

Активность инсулина выражается в единицах действия (ЕД). Это активность 0, 04082 мг кристаллического инсулина. В сутки нормальная поджелудочная железа здорового человека выделяет около 40 ЕД инсулина. Поджелудочная железа человека содержит до 8 мг инсулина (примерно 200 ЕД).

Секреция инсулина

Механизм секреции инсулина

Механизм действия инсулина
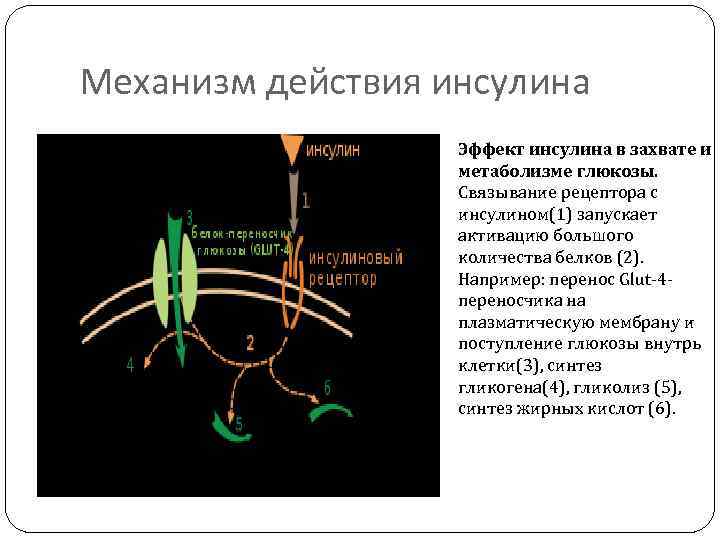
Механизм действия инсулина Эффект инсулина в захвате и метаболизме глюкозы. Связывание рецептора с инсулином(1) запускает активацию большого количества белков (2). Например: перенос Glut-4 переносчика на плазматическую мембрану и поступление глюкозы внутрь клетки(3), синтез гликогена(4), гликолиз (5), синтез жирных кислот (6).

Глюкозные транспортёры (ГЛЮТGLUT) Глют 1 обнаруживается в мозге, эритроцитах, плаценте, в мышцах и жировой ткани, Глют 2 - в печени, почках, кишечнике и поджелудочной железе, Глют 3 - в мозге, небольшое количество - в тканях других органов, Глют 4 - в мышечной и жировой ткани, Глют 5 - в кишечнике и почках.

Глюкозные транспортёры (ГЛЮТGLUT)

Метаболические эффекты инсулина. Примечание: + Стимуляция; - Ингибиция.

Анаболическое действие инсулина усиливает поглощение клетками аминокислот (особенно лейцина и валина); усиливает транспорт в клетку ионов калия, а также магния и фосфата; усиливает репликацию ДНК и биосинтез белка; усиливает синтез жирных кислот и последующую их этерификацию — в жировой ткани и в печени инсулин способствует превращению глюкозы в триглицериды; при недостатке инсулина происходит обратное — мобилизация жиров. Антикатаболическое действие инсулина подавляет гидролиз белков — уменьшает деградацию белков; уменьшает липолиз — снижает поступление жирных кислот в кровь.

Диабет Сахарный диабет — это состояние хронической гипергликемии, обусловленной недостаточностью инсулина или избыточностью факторов, противодействующих его активности. Проявления диабета включают нарушения обмена веществ, особенно углеводного, кетоацидоз, прогрессирующее поражение капилляров почек, сетчатки, поражения периферических нервов и выраженный атеросклероз (ВОЗ, 1980). Заболевание характеризуется хроническим течением и нарушением всех видов обмена веществ: углеводного, жирового, белкового, минерального и водно-солевого. Сахарный диабет встречается у 1 — 4% населения. Среди пожилых — в 2 — 30%. В разных регионах распространенность заболевания неодинакова — от нуля у жителей высокогорных районов Новой Гвинеи до 25% среди индейцев пима (США).

Участие глюкагона и инсулина в гомеостазе глюкозы

Типы сахарного диабета Сахарный диабет 1 -го типа В основе патогенетического механизма развития диабета 1 -го типа лежит недостаточность производства инсулина эндокринными клетками поджелудочной железы (β-клетки поджелудочной железы), вызванное их разрушением под влиянием тех или иных патогенных факторов (вирусная инфекция, стресс, аутоиммунные заболевания и др. ). Диабет 1 -го типа составляет 10— 15% от всех случаев диабета и в большинстве случаев развивается в детском или подростковом возрасте. Для этого типа диабета характерно появление основных симптомов, которые быстро прогрессируют с течением времени. Основным методом лечения являются инъекции инсулина, нормализующие обмен веществ организма. В отсутствие лечения диабет 1 го типа быстро прогрессирует и приводит к возникновению тяжёлых осложнений, таких как кетоацидоз и диабетическая кома, заканчивающихся смертью больного. Сахарный диабет 2 -го типа Этот тип заболевания обусловлен снижением чувствительности тканей к действию инсулина (инсулинорезистентность), который на начальных стадиях заболевания синтезируется в нормальных или даже повышенных количествах. Диета и снижение веса пациента в некоторых случаях помогают нормализовать углеводный обмен организма и снизить синтез глюкозы на уровне печени. Однако с течением заболевания выделение инсулина β-клетками поджелудочной железы снижается, что делает необходимыми инъекции. Диабет 2 -го типа составляет 85— 90% от всех случаев заболевания и наиболее часто развивается у людей старше 40 лет, и, как правило, связан с ожирением. Заболевание развивается медленно. Для него характерны второстепенные симптомы; кетоацидоз развивается редко. С течением времени развиваются такие осложнение как микро- и макроангиопатия, нефро- и нейропатия, ретинопатия и др.

Диагностические критерии сахарного диабета (ВОЗ, 1997)

Основные симптомы диабета (наиболее яркие при диабете первого типа) Полиурия — усиленное выделение мочи, вызванное повышением осмотического давления мочи за счёт растворённой в ней глюкозы (в норме глюкоза в моче отсутствует). Проявляется учащённым обильным мочеиспусканием, в том числе и в ночное время. Полидипсия (постоянная неутолимая жажда) — обусловлена значительными потерями воды с мочой и повышением осмотического давления крови. Полифагия — постоянный неутолимый голод. Этот симптом вызван нарушением обмена веществ при диабете, а именно неспособностью клеток поглощать и перерабатывать глюкозу в отсутствие инсулина (голод среди изобилия). Похудание (характерно для диабета первого типа) — частый симптом диабета, который развивается несмотря на повышенный аппетит больных. Похудание (и даже истощение) обусловлено повышенным катаболизмом белков и жиров из-за выключения глюкозы из энергетического обмена клеток.

Немедикаментозная терапия сахарного диабета Диета с ограничением легкоусвояемых углеводов и жиров Частый приём пищи (5 -6 раз в день) Физические упражнения и активный образ жизни Примечание: приём алкоголя может существенно снизить уровень сахара, а при сочетании с сахароснижающей терапией привести к тяжёлой гипогликемии; нет доказательств эффективности БАДов при сахарном диабете

Медикаментозная терапия Инсулины и аналоги инсулинов Пероральные гипогликемические средства Миметик инкретинов (эксенатид ( «Баета®» ))

Инсулины (классификация) По происхождению (свиной, человеческий, аналоги инсулина) По длительности действия (короткие, ультракороткие, промежуточные (средней продолжительности действия), инсулины длительного действия, комбинированные инсулины (смеси))
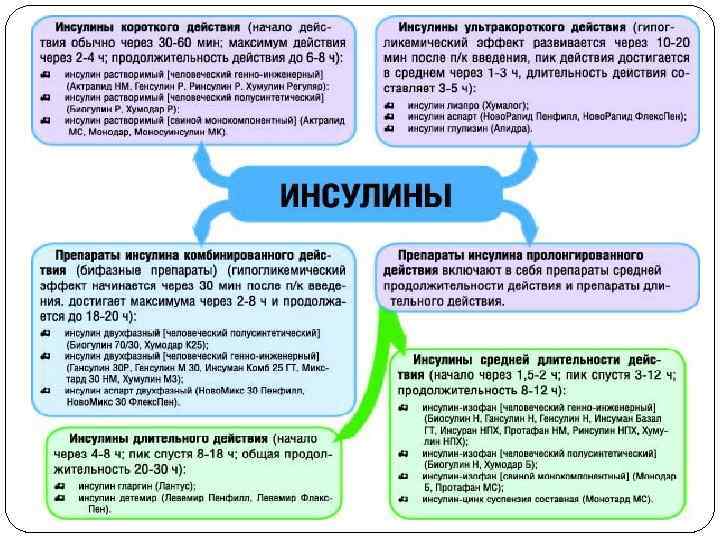


Короткий инсулин начинает действовать при подкожном введении через 30 минут (поэтому вводят за 30 -40 минут до еды), пик действия наступает через 2 часа, исчезает из организма через 6 часов. Представители: Инсулин растворимый (человеческий генноинженерный) — Актрапид HМ, Биоинсулин Р, Гансулин Р, Генсулин Р, Инсуран Р, Ринсулин Р, Хумулин Регуляр. Инсулин растворимый (человеческий полусинтетический) — Биогулин Р, Хумодар Р. Инсулин растворимый (свиной монокомпонентный) — Актрапид МС, Монодар, Моносуинсулин МК.

Ультракороткие инсулины Ультракороткий инсулин начинает действовать через 15 минут, пик через 2 часа, исчезают из организма через 4 часа. Он более физиологичный и его можно вводить непосредственно перед приёмом пищи (за 5 -10 минут) или сразу после еды. Представители: Инсулин лизпро (Хумалог) — полусинтетический аналог человеческого инсулина. Инсулин аспарт (Ново. Рапид Пенфилл, Ново. Рапид Флекс. Пен). Инсулин глулизин (Апидра).

Профиль действия аналогов инсулина и стандартных препаратов инсулина

Строение аналогов инсулина

Короткий и ультракороткий инсулин

Аспарт ( «Ново. Рапид®» )

Преймущества аналогов инсулина ультракороткого действия Начинают действовать фактически сразу после введения (5 -15 мин), что дает больному возможность не соблюдать обычный интервал между инъекцией и приемом пищи, а вводить его непосредственно перед едой. Пик действия наступает через 1 -2 часа, причем концентрация инсулина в этот момент выше по сравнению с обычным инсулином. Это увеличивает возможности поддержания близкого к нормальному уровня гликемии после еды. Действие продолжается в пределах 4 -5 часов, что позволяет при желании отказаться от промежуточных приемов пищи, не рискуя при этом получить гипогликемию. Таким образом, режим дня человека становится более гибким. Еще одно важное свойство ультракоротких инсулиновых аналогов - снижение частоты ночных гипогликемий, поскольку одной из частых причин гипогликемий в ночное время является шлейф действия обычного короткого инсулина, введенного перед ужином. Результаты клинических исследований показали, что перевод на быстродействующие аналоги человеческого инсулина снижает риск развития ночных гипогликемий.

Инсулин средней продолжительности Начинает действовать при подкожном введении через 1 -2 часа, пик действия наступает через 6 -8 часов, длительность действия составляет 10 -12 часов. Обычная доза — 24 ЕД/сут в 2 приёма. Представители: Инсулин-изофан (человеческий генноинженерный) — Биосулин Н, Гансулин Н, Генсулин Н, Инсуман Базал ГТ, Инсуран НПХ, Протафан НМ, Ринсулин НПХ, Хумулин НПХ. Инсулин-изофан (человеческий полусинтетический) — Биогулин Н, Хумодар Б. Инсулин-изофан (свиной монокомпонентный) — Монодар Б, Протафан МС. Инсулин-цинк суспензия составная — Монотард МС.
![Пролонгаторы инсулина НПХ [Нейтральный Протамин Хагедорна] (НПХ-инсулины, н-р, «Хумулин N®» , «Протофан ХМ®» ) Пролонгаторы инсулина НПХ [Нейтральный Протамин Хагедорна] (НПХ-инсулины, н-р, «Хумулин N®» , «Протофан ХМ®» )](https://present5.com/presentation/3/24057639_177155417.pdf-img/24057639_177155417.pdf-37.jpg)
Пролонгаторы инсулина НПХ [Нейтральный Протамин Хагедорна] (НПХ-инсулины, н-р, «Хумулин N®» , «Протофан ХМ®» ) Цинк (цинк-инсулины, н-р, «Ультратард HM®» , «Хумулин Ульталенте®» ) Сурфен (сурфен-инсулины, н-р, «Депо- Инсулин®» )

Инсулины промежуточного и длительного действия

Длительный инсулин Начинает действовать через 4 -8 часов, пик действия наступает спустя 8 -18 часов, продолжительность действия составляет 20 -30 часов. Представители: Инсулин гларгин (Лантус) — обычная доза 12 ЕД/сут. Инсулин гларгин не обладает выраженным пиком действия, поскольку высвобождается в кровоток с относительно постоянной скоростью, поэтому вводится однократно. Действовать начинает уже через 1 -1, 5 часа. Никогда не даёт гипогликемий. Инсулин детемир (Левемир Пенфилл, Левемир Флекс. Пен) — обычная доза 20 ЕД/сут. Поскольку обладает небольшим пиком, суточную дозу лучше разбивать на 2 приёма.

Структура детемира ( «Левемира®» )

Инсулины длительного действия Характеризуются значительно большей внутрииндивидуальной предсказуемостью действия по сравнению с обычными человеческими инсулинами. Они медленно всасываются из инъекционного депо и обладают пролонгированным действием. , не имеютт выраженного пика действия (что уменьшает вероятность гипогликемии ночью и в промежутках между приемами пищи) и действует до 24 часов, могут вводиться 1 или 2 раза в сутки. Обычная инсулинотерапия сопровождается увеличением массы тела, а пациенты с сахарным диабетом 2 типа обычно имеют избыточный вес, увеличение массы тела на фоне инсулинотерапии считается нежелательным. Исследования с инсулинами длительного действия демонстрируют меньшую динамику массы тела по сравнению с другими базальными инсулинами.

Инсулинотерапия

Комбинированные инсулины Смешанный инсулин, содержащий 30% инсулина короткого действия и 70% инсулина средней продолжительности действия

Преимуществами смешанных препаратов инсулина являются точность дозирования и удобство в применении для пациентов. Имеются данные о большей эффективности применения готовых смесей в отношении гликемического контроля при сравнении с самостоятельным смешиванием препаратов пациентами. В последнем случае худшие результаты связывают с ошибками в приготовлении таких смесей, что особенно существенно при использовании малых доз инсулина. Применение готовых смесей препаратов инсулина имеет некоторые ограничения, касающиеся преимущественно стабильности образа жизни, хотя в исследованиях на больных сахарным диабетом 2 типа они, как правило, не были сопряжены с большими затруднениями. В основном эти ограничения связаны с тем, что фиксированное соотношение входящих в состав смеси инсулинов и отсутствие инсулина короткого действия перед обедом уменьшает свободу в изменении количества углеводов в течение дня. Можно выделить категории больных сахарным диабетом 2 типа, применение смешанных препаратов инсулина у которых представляется наиболее рациональным. Это, прежде всего, пожилые пациенты, испытывающие трудности в самостоятельном приготовлении смесей. Можно также говорить о преимуществах инсулиновых смесей для применения у больных с низкой комплаентностью в отношении сложных режимов инсулинотерапии.

Побочные эффекты инсулинотерапии Увеличение массы тела (примерно на 2 -4 кг). Увеличение массы тела на фоне инсулинотерапии обусловлено увеличением реальной калорийности пищи, повышением аппетита за счёт ощущения чувства голода и стимуляцией липогенеза под действием инсулина. При соблюдении принципов рационального питания этого побочного эффекта можно избежать. Задержка воды и натрия (повышение АД, отёки). Введение инсулина в первые недели терапии может сопровождаться преходящими отёками ног в связи с задержкой жидкости в организме, т. н. инсулиновые отёки. Нарушение зрения. Преходящие нарушения зрения возникают в самом начале инсулинотерапии и проходят самостоятельно через 2– 3 недели. Гипогликемия — одно из самых грозных осложнений инсулинотерапии. Гипогликемические состояния при сахарном диабете 2 типа развиваются гораздо реже, чем при сахарном диабете 1 типа. Аллергические реакции на введение инсулина постепенно уходят в прошлое. Современные высокоочищенные инсулины (особенно генно-инженерные препараты человеческого инсулина) относительно редко приводит развитию аллергии. Возникновению аллергии способствуют перерывы в лечении. Чаще встречаются местные аллергические реакции (покраснение, отёк, зуд) в зоне введения инсулина, но возможны генерализованная крапивница и даже анафилактический шок. Аллергические реакции на инсулин возникают чаще в течение нескольких недель от начала введения инсулина и обычно проходят через несколько недель или месяцев. Чтобы предупредить аллергию, следует избегать перерывов в лечении и использовать только человеческий инсулин. Липодистрофия в месте повторных инъекций (редкое осложнение). Выделяют липоатрофию (исчезновение отложений подкожного жира) и липогипертрофию (увеличение отложения подкожного жира). Эти два состояния имеют разную природу. a. Липоатрофия представляет собой ямки в месте инъекции (вследствие исчезновения подкожной клетчатки), которые появились в результате иммунологической реакции в ответ на введение плохо очищенных препаратов инсулина животного происхождения. В настоящее время липоатрофия практически не встречается. Для лечения липоатрофии использовали инъекции малых доз высокоочищенного инсулина по периферии поражённых участков. b. Липогипертрофия представляет собой инфильтраты, которые могут возникать при нарушении техники введения инсулина, а также вследствие анаболического местного действия самого лекарства (в том числе и при использовании высокоочищенных препаратов человеческого инсулина). Помимо косметического дефекта из-за липогипертрофии нарушается всасывание препарата. Для предупреждения развития липогипертрофии рекомендуется постоянно менять места инъекций в пределах одной области, оставляя расстояние между двумя проколами не менее 1 см.

Новые подходы к инсулинотерапии Инсулиновая помпа Ингаляционные инсулины Пересадка β-клеток

Пероральные гипогликемические средства Бигуаниды Производные сульфонилмочевины (ПСМ) Ингибиторы α-глюкозидаз Прандиальные регуляторы (меглитиниды) Инсулиновые сенситайзеры (тиазолидиндионы, глитазоны) Ингибиторы дипептидилпептидазы IV

Бигуаниды (метформин) Метформин является единственным производным гуанидина, который применяется в настоящее время в терапии больных СД II типа. Современные бигуаниды (фенформин, буформин и метформин) начали использовать в конце 50 -х годов. Самое широкое применение в 60 -70 -х годах получил фенформин. Однако в конце 70 -х годов в большинстве стран мира применение фенформина и менее популярного буформина было прекращено. Произошло это после обнаружения четкой корреляции между частотой случаев развития летального спонтанного, не связанного с нарушением функции почек или гипоксией, лактацидоза и применением перечисленных бигуанидов. Данное обстоятельство в немалой степени отразилось и на метформине, популярность которого из-за факта его принадлежности к бигуанидам незаслуженно снизилась. Стремление оптимизировать лечение больных СД II типа явилось поводом для пересмотра отношения к метформину, а в начале 90 -х годов позволило его полностью реабилитировать. Отличие метформина по химической структуре от фенформина и буформина определяет наличие у него особенных фармакокинетических и фармакодинамических качеств, которые могут отражаться на метаболизме молочной кислоты. Анализ риска развития лактацидоза показал, что при назначении метформина он не превышает 2, 4 случая на 1 000 больных, принимающих данный препарат, в год. При этом столь низкий риск развития данного осложнения может быть вообще исключен при четком соблюдении противопоказаний к применению метформина и предосторожностей, направленных на исключение его аккумуляции в организме.

Самым опасным побочным эффектом бигуанидов является лактацидоз. Однако риск развития лактацидоза на фоне терапии метформином в 20 раз ниже, чем на фоне приема других бигуанидов, что обусловлено различиями в фармакокинетике бигуанидов. Фенформин и буформин накапливаются преимущественно в мышечной ткани, связываются с мембранами митохондрий и подавляют процессы окислительного фосфорилирования, в результате чего происходит переключение аэробного пути метаболизма глюкозы в миоцитах на анаэробный и увеличивается продукция лактата. Кроме того, подавляя процессы глюконеогенеза, бигуаниды замедляют утилизацию лактата в печени. В результате значительно возрастает риск развития спонтанного, т. е. не связанного с гипоксией, лактацидоза. Метформин накапливается преимущественно в тонком кишечнике и в слюнных железах, но не в мышцах, слабо связывается с мембранами митохондрий и в меньшей степени подавляет их электронно–транспортные системы. Метформин выводится почками, тогда как фенформин – преимущественно печенью, поэтому при сохраненной функции почек метформин не аккумулируется в организме. Фенформин и буформин в настоящее время не применяются, и единственным бигуанидом, нашедшим широкое применение, является метформин. В крупномасштабном исследовании диабета UKPDS cреди 342 больных, принимавших метформин (Глюкофаж) в суточной дозе 1700– 2550 мг/сут. , в течение в среднем 10, 7 года ни одного случая развития лактацидоза зарегистрировано не было.

Механизм действия метформина Влияние метформина, как и бигуанидов вообще, на уровень сахара в крови можно оценить скорее как антигипергликемическое, нежели как сахароснижающее, так как процесс снижения гликемии при использовании данного препарата непосредственно не связан с повышением содержания эндогенного инсулина в крови. В настоящее время доказано, что влияние метформина на метаболизм глюкозы обусловлено следующими механизмами. 1. Снижение периферической инсулинорезистентности и, соответственно, улучшение утилизации глюкозы в печени, мышцах и в жировой ткани. 2. Подавление глюконеогенеза в печени. 3. Замедление кишечной абсорбции глюкозы. В последние годы стало известно, что под действием метформина стимулируются рецепторные и пострецепторные пути передачи инсулинового сигнала, что приводит к увеличению поглощения глюкозы печеночными, мышечными и жировыми клетками. При СД II типа количество транспортеров глюкозы уменьшено, а их функциональная активность снижена. В исследованиях in vitro было доказано, что метформин усиливает мобилизацию GLUT-4 из интрацеллюлярного депо к плазматической мембране. Усиление транслокации GLUT-1 и GLUT-4 прямо коррелирует с поступлением глюкозы в клетку.

Преимущества метформина Не вызывает гипогликемию. Не вызывает привыкания Хорошо переносится Хорошо сочетается с другими гипогликемическими препаратами Вызывает снижение массы тела Улучшает липидный спектр крови у пациентов с сахарным диабетом Снижает общую онкологическую заболеваемость

Побочные эффекты метформина диспептические явления: диарея, тошнота, металлический вкус во рту, боли в животе, метеоризм (клинически значимые диарея и тошнота у больных СД 2–го типа на фоне лечения метформином в дозе 2550 мг/сут. наблюдались в 8 и 4% случаев соответственно). Чтобы предотвратить появление жалоб со стороны желудочно–кишечного тракта, увеличение дозы метформина следует осуществлять постепенно. Переносимость препарата улучшается, если принимать его во время еды. Противопоказан при тяжёлой почечной и сердечной недостаточности

Производные сульфонилмочевины II поколения • Глибенкламид: (МАНИНИЛ® ) – наиболее сильный препарат • Гликвидон: (ГЛЮРЕНОРМ ®) можно назначать пациентам с почечной недостаточностью • Гликлазид: (ДИАБЕТОН MR ®) обладает способностью улучшать микроциркуляцию и реологию крови у пациентов с СД • Глипизид: (МИНИДИАБ ®) реже вызывает гипогликемию • Глимепирид: (АМАРИЛ ®) редко вызывает гипогликемию, устраняет инсулинорезистентность, т. е. обладает и периферическим действием. Иногда глимепирид относят к III поколению ПСМ

Механизм действия производных сульфонилмочевины

Побочные эффекты Гипогликемия Привыкание при длительном приёме Рост массы тела Диспептические растройства (тошнота, рвота, понос) Гепатотоксичность Анемия, лейкопения, тромбоцитопения (редко) Антабусоподобные реакции (непереносимость алкоголя)

Ингибитор a- глюкозидаз акарбоза (Глюкобай®) Активный компонент глюкобая - акарбоза - азотсодержащий псевдотетрасахарид бактериальной природы, в котором остаток мальтозы замещен на остаток псевдомальтозы. Акарбоза конкурентно ингибирует ферменты сахаразу, гликоамилазу, мальтазу, декстразу, а также панкреатическую амилазу, локализованные на щеточной кайме эпителия тонкой кишки и участвующие в конечной стадии переваривания углеводов.

Побочные эффекты акарбозы Метеоризм и понос При сочетании с другими гипогликемическими препаратами – гипогликемия Противопоказан при грыжах и заболеваниях ЖКТ

Прандиальные регуляторы (меглитиниды) Репаглинид (Ново. Норм ®) — производное бензойной кислоты. Натеглинид (Старликс ®) — производное D- фенилаланина. Как и ПСМ блокируют АТФ-зависимые калиевые каналы β-клеток, стимулируя синтез инсулина. В отличие от ПСМ действуют только при высоких уровнях глюкозы – не вызывают гипогликемии!!! Всасываются очень быстро, действуют около 30 минут. Принимают три раза в сутки до еды.

Инсулиновые сенситайзеры (тиазолидиндионы) Троглитазон (из-за высокой гепатотоксичности снят с производства) Пиоглитазон (Актос®) Росиглитазон (Авандия®) Циглитазон, дарглитазон, энглитазон (незарегистрированы в России)

Механизм действия тиазолидиндионов Тиазолидиндион

Действие тиазолидиндионов Устранение инсулинорезистентности Снижение глюкотоксичности/липотоксичности Нормализация соотношения проинсулин/инсулин Снижают уровни свободных жирных кислот, триглицеридов Уменьшают массу тела Повышают уровни адипонектина и ЛПВП Понижают уровни С-реактивного белка

Побочные эффекты тиазолидиндионов Увеличение веса Задержка воды, периферические отёки и увеличение риска развития сердечной недостаточности Увеличение риска остеопороза (особенно у женщин) Гепатотоксичность (редко) Отёк жёлтого пятна (зрение)

Ингибиторы дипептидилпептидазы VI


Ситаглиптин (Янувия ®) У пациентов с сахарным диабетом типа 2 прием одной дозы препарата Янувия приводит к ингибированию активности фермента ДПП-4 в течение 24 ч, что приводит к увеличению уровня циркулирующих инкретинов ГПП-1 и ГИП в 2 -3 раза, нарастанию плазменной концентрации инсулина и С-пептида, снижению концентрации глюкагона в плазме крови, уменьшению гликемии натощак, а также уменьшению гликемии после нагрузки глюкозой или пищевой нагрузки.

Побочные действия ситоглиптина Инфекции верхних и нижних дыхательных путей Диспепсия Артралгия и гиперурикемия Гипогликемия (редко)

ГПП-1 Глюкаго ноподо бный пепти д-1 (Glucagon-like peptide-1; синоним энтероглюкагон; общепринятые аббревиатуры ГПП-1 или, GLP-1) — пептидный гормон из семейства секретина. Период полураспада активной формы ГПП-1 менее двух минут. Содержание ГПП– 1 в плазме крови у человека в межпищеварительный период находятся в пределах от 5 до 10 пмоль и повышаются после приёма пищи до 50 пмоль.

Эксенатид ((эксендин-4) Баета ®) В начале 90 -х годов прошлого столетия, исследователи обнаружили, что действие экзендина-4 очень похоже на действие гормона, вырабатывающегося эндокринными клетками пищеварительного тракта человеческого организма и названного глюкогоноподобным пептидом-1 (ГПП-1). Причем, по сравнению ГПП-1, экзендин-4 обладал существенно большей продолжительностью действия. ГПП-1 играет важную роль в поддержании метаболизма глюкозы (обеспечивая постоянное, но при этом не чрезмерное поступление глюкозы в кровеносное русло). ®) ГПП-1 стимулирует секрецию глюкозозависимую секрецию инсулина, ингибирует высвобождение глюкозы из печени после приема пищи, замедляет всасывание пищи в кишечнике, способствует появлению чувства насыщения и уменьшает аппетит.

Побочное действие эксенатида Некротический и геморрагический панкреатит (вплоть до летального исхода) 3: 10000 Острая почечная недостаточность (отдельные случаи) Аллергические реакции Гипогликемия (не более 5%)

Глюкокортикостероиды


Ось гипоталамус-гипофиз-надпочечники

Регуляция функции гипоталамо-гипофизарнонадпочечниковой системы.

Глюкокортико иды, или глюкокортикостеро иды — общее собирательное название гормонов коры надпочечников, обладающих более сильным действием на углеводный, чем на водносолевой обмен, и их синтетических аналогов.



Кортизон Гидрокортизон

Выход глюкокортикоидов из надпочечников в кровь в течение суток происходит не равномерно, а в виде 8 -12 импульсов, которые подчиняются циркадному ритму. Особенностью циркадного ритма глюкокортикоидов является то, что максимальная секреция гидрокортизона происходит в ранние утренние часы (68 часов) с резким ее снижением в вечерние и ночные часы. У взрослого человека в обычных условиях в сутки вырабатывается 10 -30 мг гидрокортизона, но при стрессе продукция его может возрастать до 250 мг. У детей суточная выработка гидрокортизона составляет около 12 мг/м 2 поверхности тела.

Геномный и внегеномный механизмы действия глюкокортикоидов

Влияние на обмен веществ Углеводный обмен Стимуляция глюконеогенеза в печени, уменьшение проницаемости мембран для глюкозы, гипергликемия, глюкозурия вплоть до развития стероидного диабета. Таким образом, глюкокортикоиды являются контринсулярными гормонами. Белковый обмен Угнетение синтеза белка, усиление процессов катаболизма, особенно в коже, в мышечной и костной тканях. Это проявляется похуданием, мышечной слабостью, атрофией кожи и мышц, стриями, кровоизлияниями, замедлением заживления ран. Как следствие распада белкового матрикса костей и гипокальциемии развивается остеопороз. Жировой обмен Перераспределение подкожной жировой клетчатки по кушингоидному типу вследствие того, что в тканях конечностей преобладает липолиз, а в тканях груди, шеи, лица, плечевого пояса – липогенез.

Влияние на водно-солевой обмен Водно-электролитный обмен Замедление выделения из организма натрия и воды за счет увеличения реабсорбции в дистальном отделе почечных канальцев. Усиление выведения калия. Эти минералокортикоидные эффекты в большей степени присущи природным глюкокортикоидам (кортизону и гидрокортизону), в меньшей – полусинтетическим (преднизону, преднизолону и метилпреднизолону). У фторированных препаратов – триамцинолона, бетаметазона и дексаметазона – минералокортикоидная активность отсутствует. Обмен кальция Глюкокортикоиды угнетают всасывание кальция в кишечнике, способствуют выходу кальция из костной ткани и усиливают его почечную экскрецию. В результате могут развиваться гипокальциемия и гиперкальциурия.

Влияние глюкокортикостероидов на сердечно-сосудистую систему Глюкокортикоиды повышают чувствительность адренорецепторов к катехоламинам, усиливают прессорное действие ангиотензина-II. Они уменьшают проницаемость капилляров, поддерживают нормальный тонус артериол, сократимость миокарда. Недостаточность коры надпочечников характеризуется низким сердечным выбросом, расширением артериол, слабой реакцией на адреналин. В сочетании с гиповолемией, вызванной дефицитом минералокортикоидов, эти изменения могут вести к сосудистому коллапсу.

Противосполительное действие

Противовосполительное действие Глюкокортикоиды угнетают все фазы воспаления, независимо от вызвавшей его причины. В их противовоспалительном действии играют роль многие факторы. Одним из ведущих является ингибирование фосфолипазы-А 2 и связанное с этим нарушение образования простагландинов и лейкотриенов. Глюкокортикоиды стабилизируют клеточные мембраны, мембраны лизосом, уменьшают проницаемость капилляров, тормозят миграцию нейтрофилов и макрофагов в очаг воспаления и их фагоцитарную активность, угнетают пролиферацию фибробластов и синтез коллагена.

Иммуномодулирующее и противоаллергическое действие Глюкокортикоиды угнетают пролиферацию лимфоидной ткани и клеточный иммунитет, что лежит в основе их применения при пересадке органов и тканей. Глюкокортикоиды тормозят образование и нарушают кинетику Т-лимфоцитов (в большей степени Т-хелперов, чем Т-супрессоров), снижают их цитотоксическую активность. В-лимфоциты более устойчивы к действию глюкокортикоидов, В то же время, у больных с иммунодефицитом глюкокортикоиды снижают супрессорную активность лимфоцитов, восстанавливая тем самым уровень иммуноглобулинов. Глюкокортикоиды препятствуют взаимодействию иммуноглобулинов с тучными клетками, макрофагами, ингибируя высвобождение из них биологически активных веществ. . Глюкокортикоиды подавляют выработку так называемых "провоспалительных" цитокинов (интерлейкины 1, 6 и 8, фактор некроза опухолей), которые участвуют в механизмах иммунного ответа, влияя, в частности, на Т-клеточное распознавание антигенов. Этим цитокинам отводят большую роль в патогенезе ревматических заболеваний, бактериального менингита.

Влияние глюкокортикоидов на кровь Глюкокортикоиды вызывают лимфоцитопению, моноцитопению и эозинопению. В то же время, они стимулируют образование эритроцитов и тромбоцитов. При интерпретации анализа крови следует учитывать, что после приема даже одной дозы глюкокортикоидов отмечается снижение уровня лимфоцитов, моноцитов, эозинофилов, базофилов с одновременным развитием нейтрофильного лейкоцитоза и, возможно, небольшим сдвигом формулы влево. Число нейтрофилов в среднем повышается на 4000/мм 3 (1700 -7500/мм 3). Максимум изменений в крови отмечается через 4 -6 часов, восстановление исходного состояния - через 24 часа. После завершения длительного курса глюкокортикоидной терапии изменения картины крови сохраняются на протяжении 1 -4 недель.


Побочные реакции терапии глюкокортикоидами

Время и условия возникновения нежелательных реакций при использовании глюкокортикоидов

Факторы риска угнетения гипоталамо-гипофизарнонадпочечниковой системы Доза. При приеме глюкокортикоидов в физиологических дозах (у взрослого 2, 5 -5 мг/сутки преднизолона или 10 -30 мг/сутки гидрокортизона) угнетения гипоталамо-гипофизарно-надпочечниковой системы не происходит. Если используются более высокие дозы, то уже через 1 -2 недели отмечается функциональное угнетение коры надпочечников, а в дальнейшем развивается ее атрофия. Причем, полное восстановление функции коры надпочечников при курсе глюкокортикоидов 2 -3 недели происходит только через 6 -12 месяцев. Длительность курса. При курсе глюкокортикоидов до 10 дней (в дозе не более 40 мг преднизолона в сутки) нет опасности значительного угнетения гипоталамо-гипофизарно-надпочечниковой системы, приеме глюкокортикоидов в течение нескольких недель может возникнуть атрофия коры надпочечников. Время приема. Необходимо учитывать циркадный ритм выработки глюкокортикоидов, поэтому опаснее давать 5 мг преднизолона вечером, чем 20 мг утром. Вид препарата. В наибольшей степени угнетение гипоталамогипофизарно-надпочечниковой системы отмечается приеме фторированных глюкокортикоидов – триамцинолон, дексаметазон, бетаметазон, обладающих наиболее продолжительным действием.

Клиника синдрома "отмены" глюкокортикоидов Тяжесть синдрома "отмены" зависит от степени сохранности функции коры надпочечников. В легких случаях у больных после отмены глюкокортикоидов появляются слабость, недомогание, быстрая утомляемость, потеря аппетита, мышечные боли, обострение основного заболевания, повышение температуры. В тяжелых случаях, особенно при больших стрессах, может развиться классический аддисонический криз, сопровождающийся рвотой, коллапсом, судорогами. Без введения глюкокортикоидов больные быстро погибают от острой сердечно-сосудистой недостаточности.

Меры профилактики вторичной надпочечниковой недостаточности За исключением неотложных состояний и специальных показаний применять глюкокортикоиды в соответствии с циркадным ритмом. Максимально широко использовать альтернирующую терапию. При курсе лечения более 10 дней отмену глюкокортикоидов производить с постепенным снижением их дозы. Режим отмены зависит от длительности приема глюкокортикоидов. При курсе от нескольких недель до нескольких месяцев допустимо снижение дозы на 2, 5 -5 мг преднизолона (или эквивалентное количество другого препарата) каждые 3 -5 дней. При более продолжительном применении необходимо понижать дозу более медленно – на 2, 5 мг каждые 1 -3 недели. Особую осторожность следует соблюдать при снижении суточной дозы менее 10 мг (преднизолона). После отмены глюкокортикоидов, которые применялись на протяжении 2 недель и более, в течение 1, 5 -2 лет контролировать состояние больного при стрессовых ситуациях. При необходимости проводить защитную терапию глюкокортикоидами.

Относительные противопоказания к назначению глкокортикоидов Сахарный диабет (особенно опасны фторированные глюкокортикоиды) Психические заболевания, эпилепсия Язвенная болезнь желудка и 12 -перстной кишки Выраженный остеопороз Тяжёлая артериальная гипертензия Тяжёлая сердечная недостаточность

Заместительная терапия ГК Применение глюкокортикоидов при надпочечниковой недостаточности любой этиологии Физиологические дозы (около 25 мг. гидрокортизона) Учитывается циркадный ритм Преимущество отдаётся природным препаратам

Супрессивная терапия ГК Адреногенитальный синдром Супрафизиологические дозы (преднизолон 10 - 15 мг. ) Введение препаратов вечером или равными дозами 3 раза в день

Фармакодинамическая терапия ГК Представляет собой наиболее частый вариант использования глюкокортикоидов, которые при этом также назначают в фармакологических дозах. Фармакодинамическая терапия подразделяется на системную и местную. При системной терапии следует учитывать два принципиальных положения: глюкокортикоиды назначают в расчете на их противовоспалительное, противоаллергическое, иммуносупрессивное, противошоковое и противорвотное действие; при большинстве заболеваний глюкокортикоиды вызывают симптоматическое улучшение и не влияют на первопричину заболевания, то есть лечение глюкокортикоидными препаратами не является этиотропным.

Режимы дозирования глюкокортикоидов при системной фармакодинамической терапии
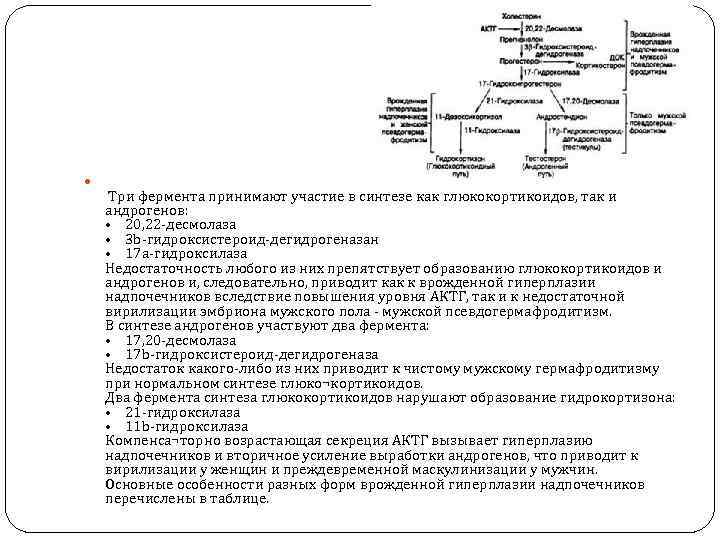
Три фермента принимают участие в синтезе как глюкокортикоидов, так и андрогенов: • 20, 22 -десмолаза • 3 b-гидроксистероид-дегидрогеназан • 17 a-гидроксилаза Недостаточность любого из них препятствует образованию глюкокортикоидов и андрогенов и, следовательно, приводит как к врожденной гиперплазии надпочечников вследствие повышения уровня АКТГ, так и к недостаточной вирилизации эмбриона мужского пола - мужской псевдогермафродитизм. В синтезе андрогенов участвуют два фермента: • 17, 20 -десмолаза • 17 b-гидроксистероид-дегидрогеназа Недостаток какого-либо из них приводит к чистому мужскому гермафродитизму при нормальном синтезе глюко¬кортикоидов. Два фермента синтеза глюкокортикоидов нарушают образование гидрокортизона: • 21 -гидроксилаза • 11 b-гидроксилаза Компенса¬торно возрастающая секреция АКТГ вызывает гиперплазию надпочечников и вторичное усиление выработки андрогенов, что приводит к вирилизации у женщин и преждевременной маскулинизации у мужчин. Основные особенности разных форм врожденной гиперплазии надпочечников перечислены в таблице.


Недостаточность 21 -гидроксилазы. Чаще всего причиной амбисексуальности половых органов у новорожденных служит врожденная гиперплазия надпочечников вследствие недостаточности 21 -гидроксилазы. В Европе она встречается с частотой 1: 5000, а в США — 1: 15 000. Вирилизация у девочек проявляется обычно уже при рождении, а у мальчиков — в первые 2— 3 года жизни. Для девочек характерны гипертрофия клитора в сочетании с его вентральным подтягиванием (патологическая эрекция), частичное сращение лабиоскотальных складок и вирилизация уретры различной степени. Внутренние женские половые органы и яичники остаются интактными, а вольфовы протоки регрессируют нормально, вероятно, потому, что надпо¬чечники начинают функционировать на относительно поздних этапах эмбриогенеза. Наружные половые органы у девочек сходны с таковыми у мальчиков с двусторонним крипторхизмом и гипоспадией. Лабиоскротальные складки увеличены и морщинисты и напо¬минают мошонку. В редких случаях вирилизация достигает такой степени, что у девочки полностью развивается мужская уретра, половой член, а также предстательная железа, что приводит к ошибке при определении пола новорожденных. Без лечения больные девочки в течение первого года жизни быстро растут и вирилизация у них прогрессирует. В период ожидаемого пубертата нормального полового созревания по женскому типу не происходит и менструации не появляются. Быстрое соматическое созревание у лиц обоего пола приводит к преждевременному заращению эпифизарных щелей и низкорослости в зрелые годы. Так как дифференцировка мужского фенотипа остается нормальной, заболевание у мальчиков при рождении обычно не распознается, если только нет явной недостаточности надпочечников. Однако уже в первые годы жизни у больных наблюдают интенсивный рост и созревание наружных половых органов, частые эрекции и чрезмерное развитие мышц. Вирилизация у мальчиков может проявляться двояко. Избыточная секреция андрогенов надпочечниками ингибирует продукцию гонадотропинов, так что яички остаются незрелыми, несмотря на ускорение маскулинизации. В зрелые годы такие больные, если их не лечить, способны к эрекции и эякуляции, но сперматогенез у них отсутствует. В других случаях секреция андрогенов надпочечниками может активировать преждевре¬менное созревание гипоталамо-гипофизарной оси и инициировать истинное преждевременное половое созревание, включая и сперматогенез. Без лечения у мужчин могут появляться АКТГ-зависимые «опухоли» яичек, состоящие из остатков клеток надпочечников. Недостаточность 11 b-гидроксилазы Женский псевдогермафродитизм может быть вызван и недостатком 11 b-гидроксилазы. В этом случае блокада гидроксилирования 11 -го углеродного атома приводит к накоплению 11 -дезоксикортизола и дезоксикортикостерона - сильного сользадерживающего гормона, что сопровождается не потерей соли, а гипертензией. Клинические проявления, обусловливаемые дефицитом глюкокортикоидов и избытком андрогенов, сходны с таковыми при недостаточности 21 -гидроксилазы.