1 ВВед.+углв-род.ppt
- Количество слайдов: 115

Гомология. Гомологические ряды
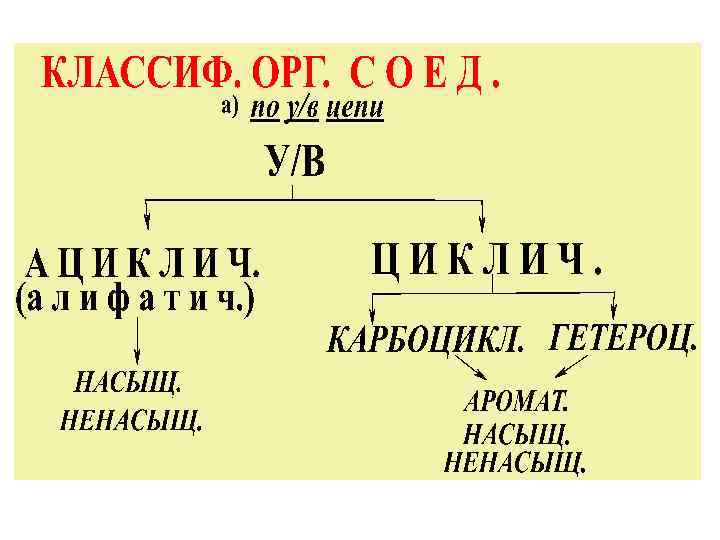
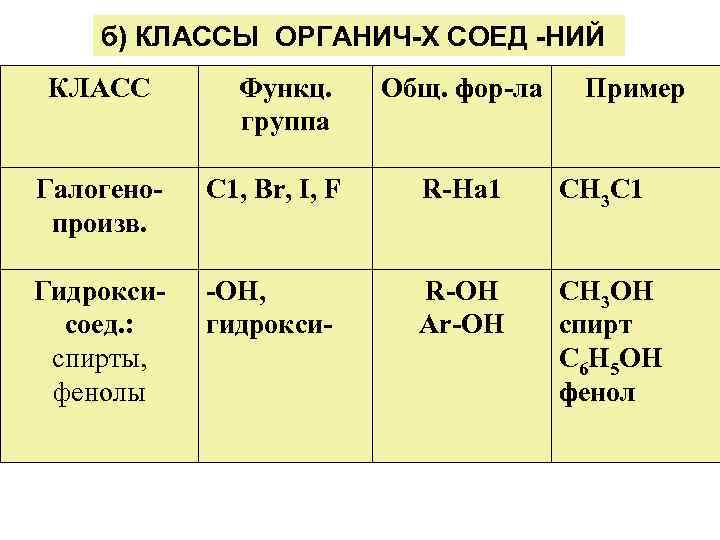
б) КЛАССЫ ОРГАНИЧ-Х СОЕД -НИЙ КЛАСС Функц. группа Общ. фор-ла Пример Галогенопроизв. С 1, Вr, I, F R-На 1 СН 3 С 1 Гидроксисоед. : спирты, фенолы -ОН, гидрокси- R-ОН Аr-ОН СН 3 ОН спирт С 6 Н 5 ОН фенол
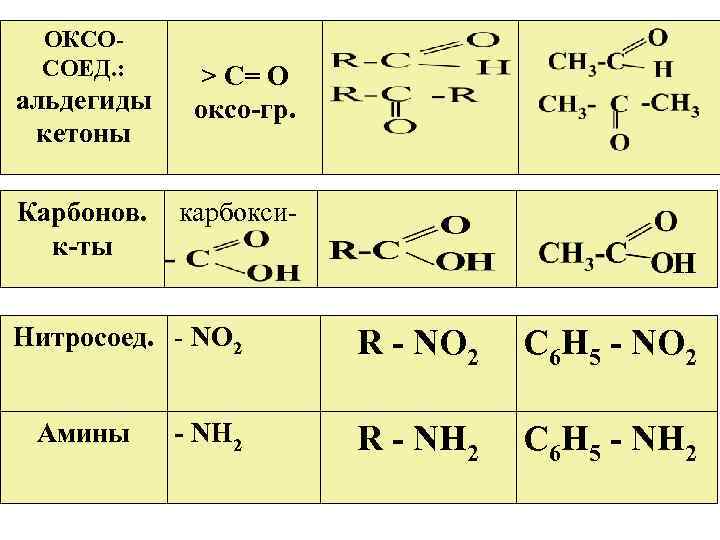
ОКСОСОЕД. : альдегиды кетоны Карбонов. к-ты > С= О оксо-гр. карбокси- Нитросоед. - NО 2 Амины - NН 2 R - NО 2 С 6 Н 5 - NО 2 R - NН 2 С 6 Н 5 - NН 2
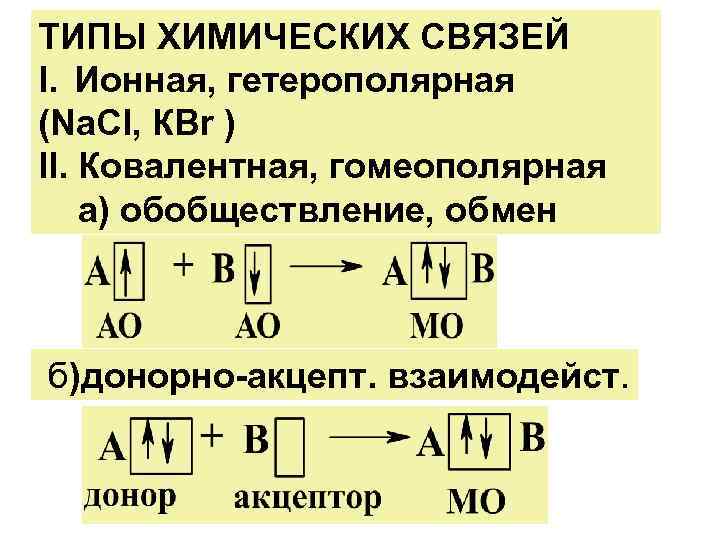
ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ I. Ионная, гетерополярная (Nа. Сl, КВr ) II. Ковалентная, гомеополярная а) обобществление, обмен б)донорно-акцепт. взаимодейст.
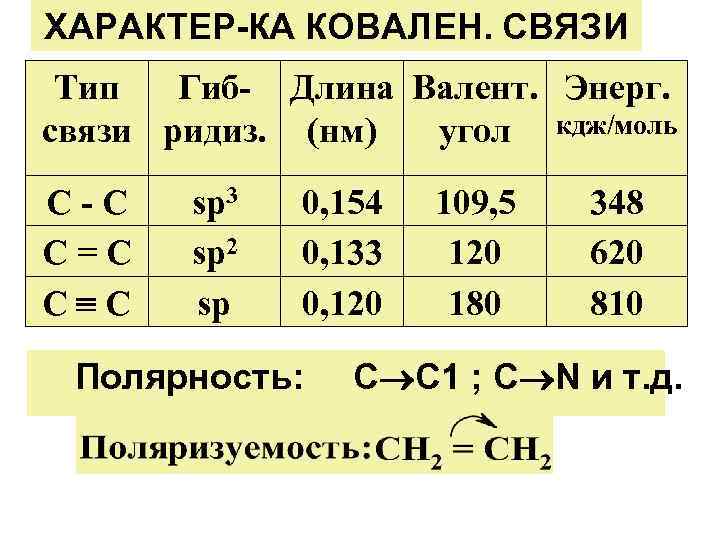
ХАРАКТЕР-КА КОВАЛЕН. СВЯЗИ Тип Гиб- Длина Валент. Энерг. связи ридиз. (нм) угол кдж/моль С-С С=С С С sp 3 sp 2 sp 0, 154 0, 133 0, 120 Полярность: 109, 5 120 180 348 620 810 С С 1 ; С N и т. д.
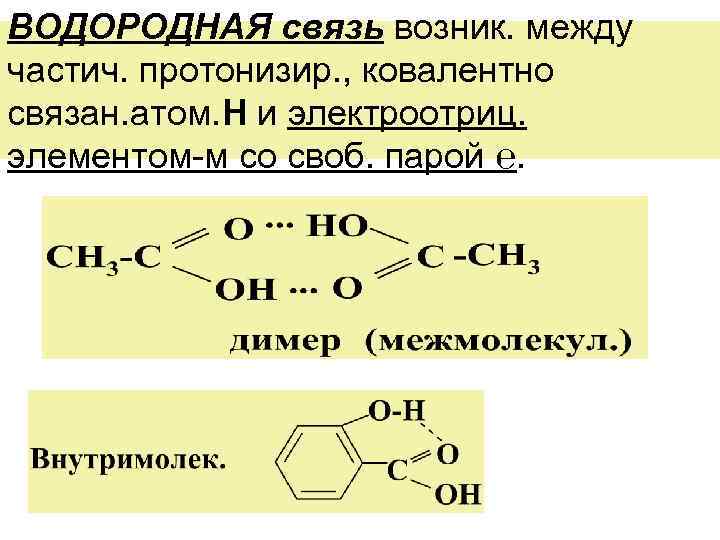
ВОДОРОДНАЯ связь возник. между частич. протонизир. , ковалентно связан. атом. Н и электроотриц. элементом-м со своб. парой ℮.
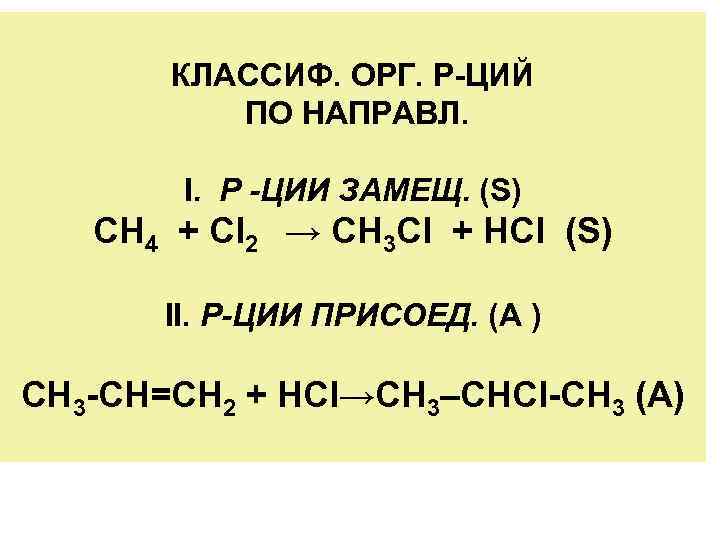
КЛАССИФ. ОРГ. Р-ЦИЙ ПО НАПРАВЛ. I. Р -ЦИИ ЗАМЕЩ. (S) CH 4 + Cl 2 → CH 3 Cl + HCl (S) II. Р-ЦИИ ПРИСОЕД. (A ) СН 3 -СН=СН 2 + НСl→СН 3–СНСl-СН 3 (А)

III. Р-ЦИИ ОТЩЕПЛ. (элиминир. - Е ) КОН (спирт) СН 3 -СН 2 -СНBr-СН 3 -СН=СН-СН 3 IV. Р-ЦИИ ПЕРЕГРУППИРОВОК

Классиф-ция орг. р-ций по механизму Под механизмом р-ции понимают способ нарушения ковалентной связи. По способу разрыва и образ. хим. связи: а) гомолитические (свободнорадикальные) А : В → A∙ + B∙ свобод. радикалы б) гетеролитические (ионные или электрофильно-нуклеофильные) А : В → [A: ]ˉ + [B]+ нуклеофил электрофил

Обознач. орг. р-ций (по типу и механизму) а) радикальный ( SR, АR); б) электрофильный ( SЕ, АЕ ); в) нуклеофильный (SN, АN ) Свободные радикалычаст-цы с одним неспарен. электроном: NO 2 • , Br • , R • и др. Устойчивость у/в радикалов (R • ) : третичн. > вторичн. > первичн. > метил

Электрофильные реаг-ты – катионы или нейтр. мол-лы с дефицитом электр. плотности: NO 2+, SO 3 H+, R+, Al. Cl 3, Fe. Br 3 и др. Устойч. карбкатионов аналог. своб радикал. Нуклеофильные реаг-ты – анионы или нейтр. мол-лы, содерж. элемент со своб. парой электр. : : OH-, : NH 2 -, : NH 3, НOH, С 2 Н 5 ОН и др

ЭЛЕКТРОННЫЕ ЭФФЕКТЫ: Индуктивный (l) и мезомерный (М) Индукт. (l) – смещ. электр. по σ-связи, Мезомерный (М) – с участием π-электр. Различ. +I и - I- эффекты +I-эффект. - в стор. реакц. центра; -I эфф. от реакц. центра Причина l-эфф. – полярность связи

+I-эфф. проявл алкилы: третич>втор>первич; -I-эфф. : галогены; -NO 2, C≡N, и др. Индукт. эфф. затухает по цепи +М-эффект–повыш. электрон. плотн. в системе сопряжения; -М-эфф. – понижает

АЛКАНЫ (Cn. H 2 n+2) СТРОЕНИЕ ГИБРИД-ЦИЯ –sр3; ДЛИНА СВЯЗИ-0, 154 нм ВАЛЕНТН. УГОЛ – 109, 5 град (тетраэдр. ) – причина зигзагообраз. строения С- цепи. В алкан. все атомы С связаны между собой одинарными -связями. -связь допуск. вокруг себя своб. вращ. атомов.
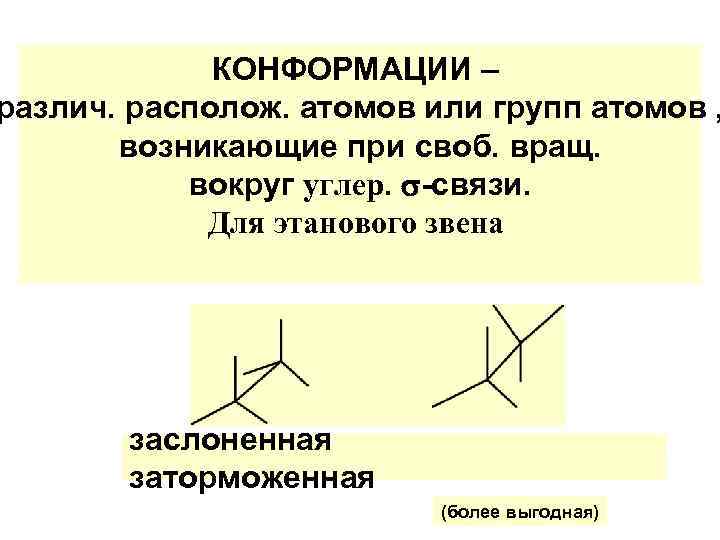
КОНФОРМАЦИИ – различ. располож. атомов или групп атомов , возникающие при своб. вращ. вокруг углер. -связи. Для этанового звена заслоненная заторможенная (более выгодная)

ХИМ. СВ-ВА Алканы или парафины малоактивны, “химич. мертвецы”, вступ. в р-ции только в «жестких» услов. (при повыш. Т-ре, при облуч. , в присут. кt). При н. у. не взаимод. ни с кислот. , ни со щелоч. , ни со щел. метал.

Наиб. характер. р-ции – • замещения (S), • расщепл. (распад), • окисл. (в т. ч. - горение). Р-ции протек. по своб. радикал. мех-му (SR), т. к. оба типа связей в алк-ах С–С и С–Н мало полярны, труднополяризуемы и склонны к гомолитич. разрыву.

Р-ЦИИ АЛКАНОВ (SR)
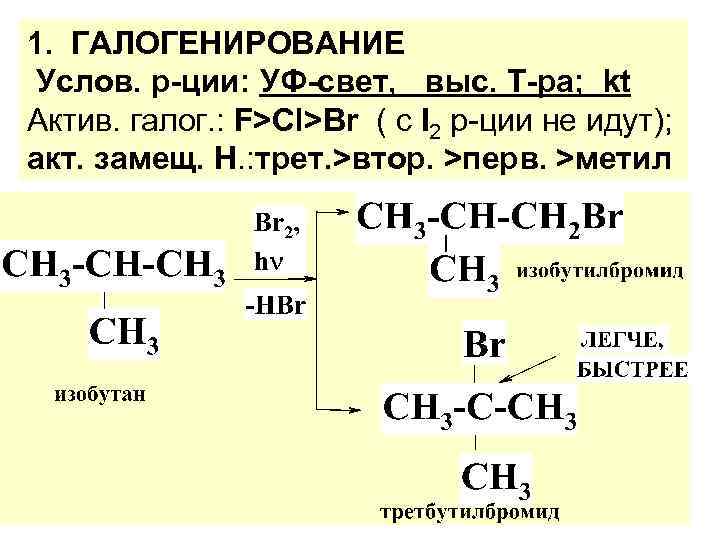
1. ГАЛОГЕНИРОВАНИЕ Услов. р-ции: УФ-свет, выс. Т-ра; kt Актив. галог. : F>Cl>Br ( с I 2 р-ции не идут); акт. замещ. Н. : трет. >втор. >перв. >метил
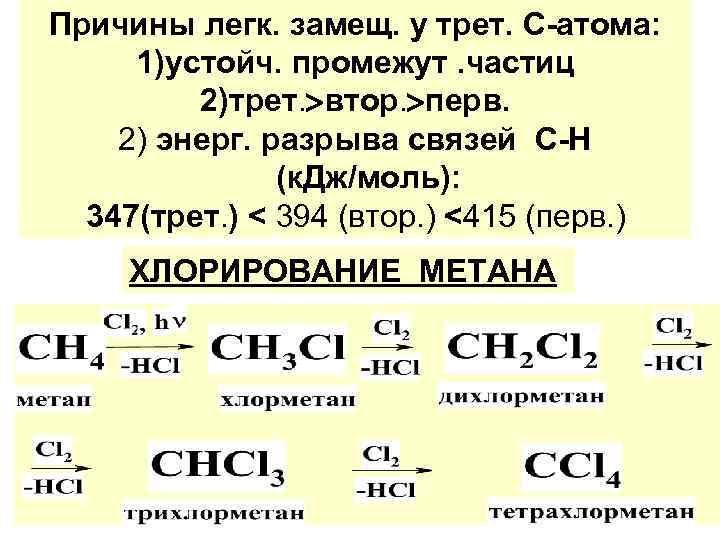
Причины легк. замещ. у трет. С-атома: 1)устойч. промежут. частиц 2)трет. втор. перв. 2) энерг. разрыва связей С-Н (к. Дж/моль): 347(трет. ) < 394 (втор. ) <415 (перв. ) ХЛОРИРОВАНИЕ МЕТАНА

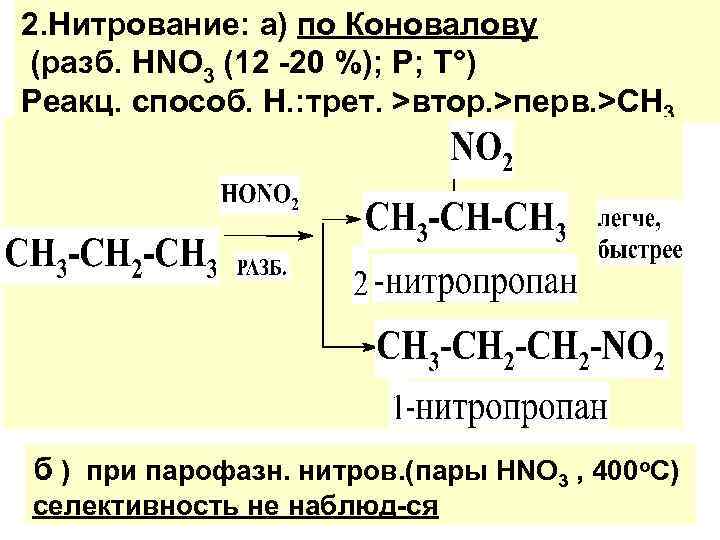
2. Нитрование: а) по Коновалову (разб. HNO 3 (12 -20 %); P; T°) Реакц. способ. Н. : трет. >втор. >перв. >CH 3 б ) при парофазн. нитров. (пары HNO 3 , 400 o. C) селективность не наблюд-ся
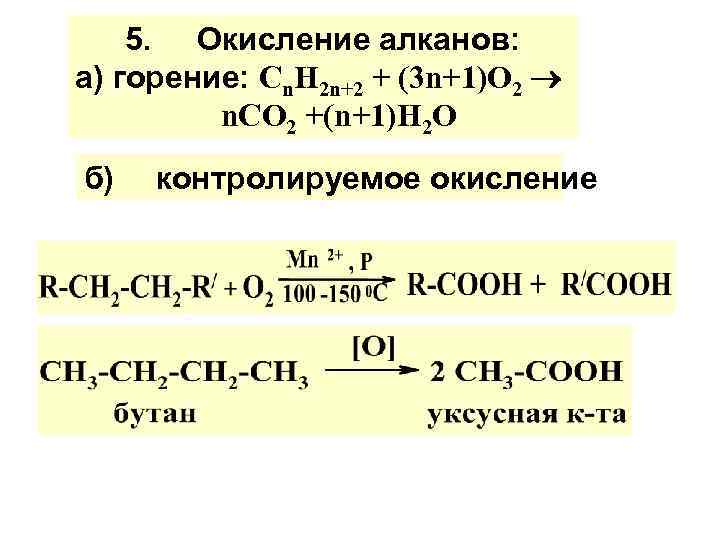
5. Окисление алканов: а) горение: Сn. Н 2 n+2 + (3 n+1)О 2 n. CО 2 +(n+1)H 2 О б) контролируемое окисление

ОСНОВ. СПОСОБ. ПОЛУЧ. АЛКАНОВ ПРОМЫШЛ. 1. ИЗ ПРИРОДНОГО ГАЗА, НЕФТИ. 2. ХИМИЧ. ПЕРЕР-КА КАМЕН. УГЛЯ. 3. ПОЛУЧ. НА ОСНОВЕ СО ( «СИНТЕЗГАЗ» )
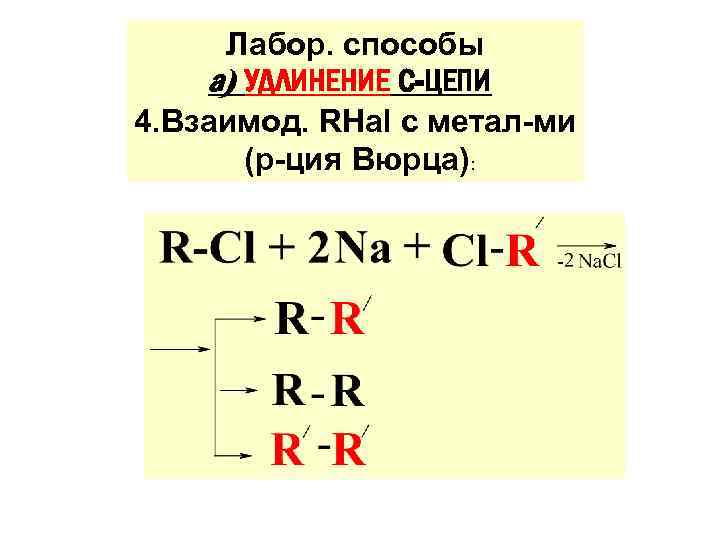
Лабор. способы а) УДЛИНЕНИЕ С-ЦЕПИ 4. Взаимод. RHal с метал-ми (р-ция Вюрца):
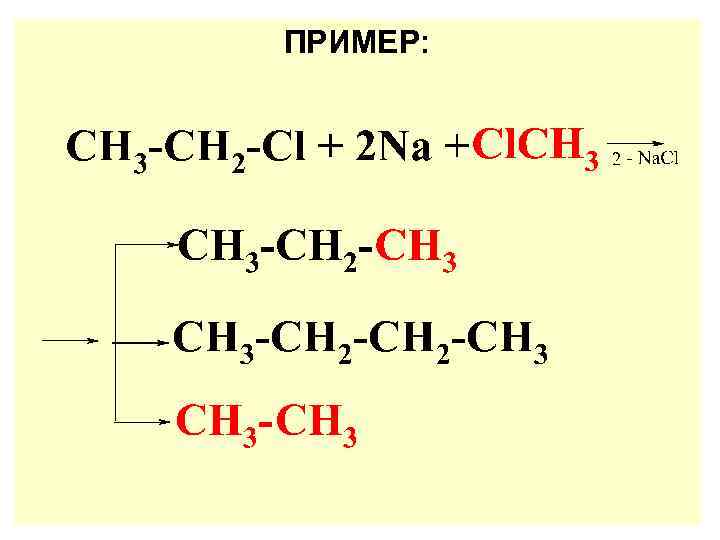
ПРИМЕР:
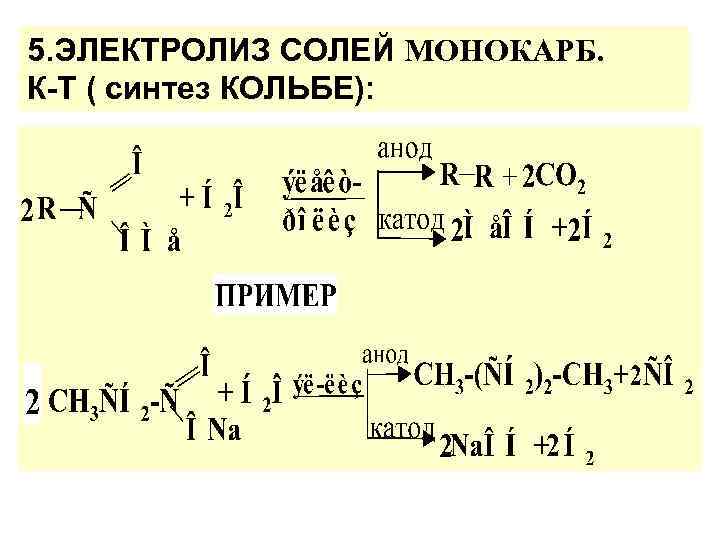
5. ЭЛЕКТРОЛИЗ СОЛЕЙ МОНОКАРБ. К-Т ( синтез КОЛЬБЕ):

6. Получ. на основе реак-в Гриньяра б) БЕЗ ИЗМЕН. ДЛИНЫ С-ЦЕПИ 7. Гидрир. непред. соед. и галогенопроиз. :
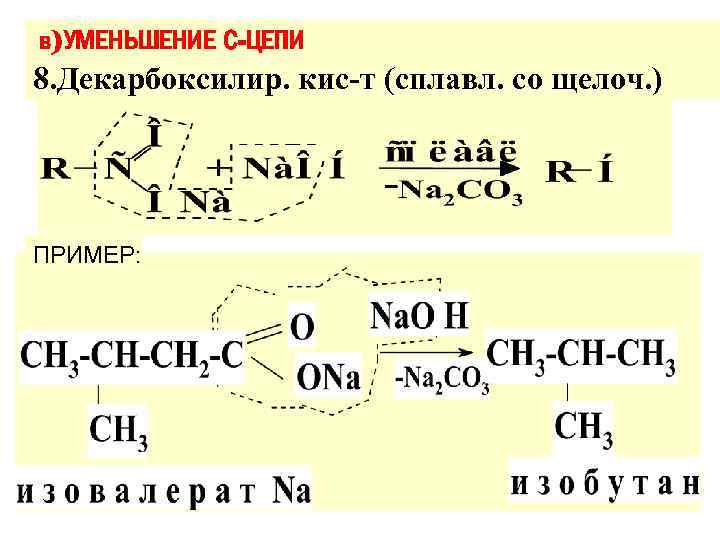
в)УМЕНЬШЕНИЕ С-ЦЕПИ 8. Декарбоксилир. кис-т (сплавл. со щелоч. ) ПРИМЕР:

НЕПРЕДЕЛЬНЫЕ У/В: АЛКЕНЫ, АЛКИНЫ
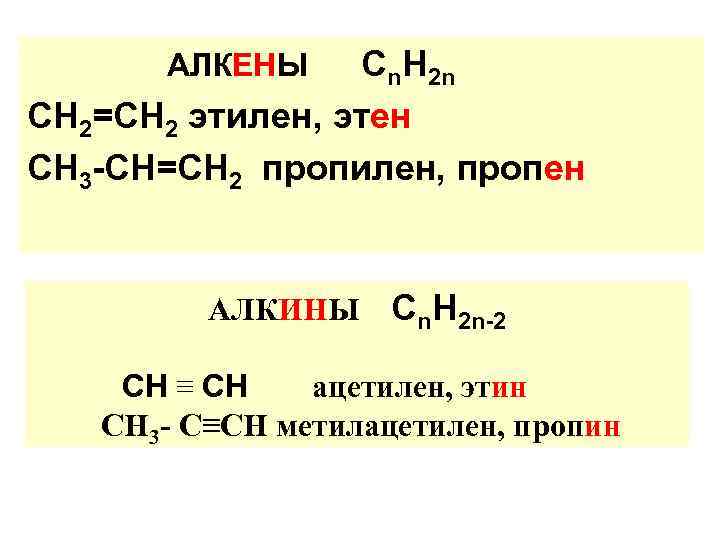
Сn. Н 2 n СН 2=СН 2 этилен, этен СН 3 -СН=СН 2 пропилен, пропен АЛКЕНЫ АЛКИНЫ Сn. Н 2 n-2 СН ≡ СН ацетилен, этин СН 3 - С≡СН метилацетилен, пропин

СТРОЕНИЕ АЛКЕНЫ: атом С при дв. связи в sр2 -гибр. ; вал. угол - 120°; энерг. дв. связи: 620 к. Дж/ моль АЛКИНЫ атом С при тр. связи в sр-гибр. вал. угол - 180°; энерг. дв. связи: 810 к. Дж/ моль π-связь –менее прочная , чем σ
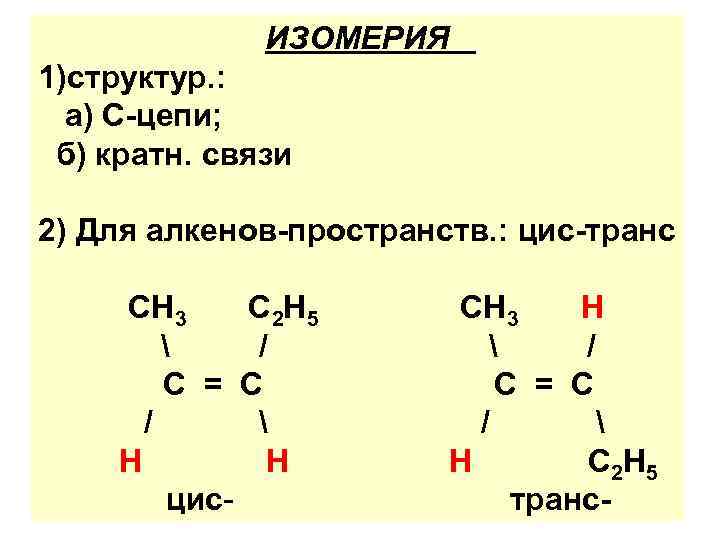
ИЗОМЕРИЯ 1)структур. : а) С-цепи; б) кратн. связи 2) Для алкенов-пространств. : цис-транс СН 3 С 2 Н 5 / С = С / Н Н цис- СН 3 Н / С = С / Н С 2 Н 5 транс-
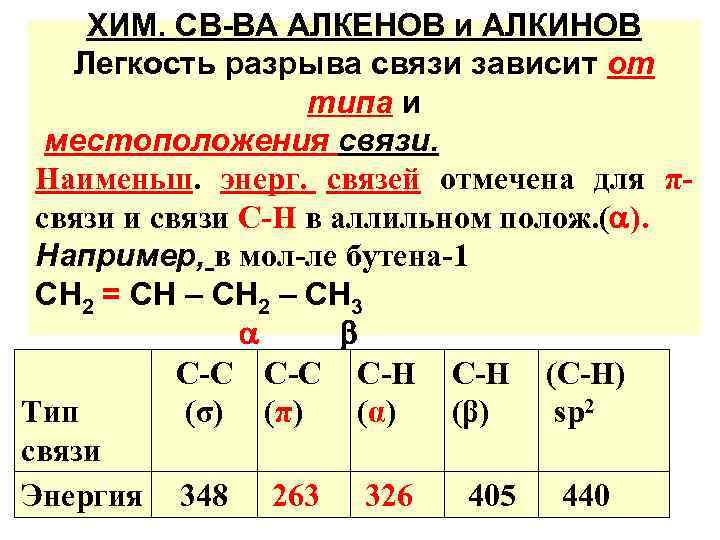
ХИМ. СВ-ВА АЛКЕНОВ и АЛКИНОВ Легкость разрыва связи зависит от типа и местоположения связи. Наименьш. энерг. связей отмечена для πсвязи и связи С-Н в аллильном полож. ( ). Например, в мол-ле бутена-1 СН 2 = СН – СН 2 – СН 3 С-С С-Н (С-Н) Тип (σ) (π) (α) (β) sр2 связи Энергия 348 263 326 405 440
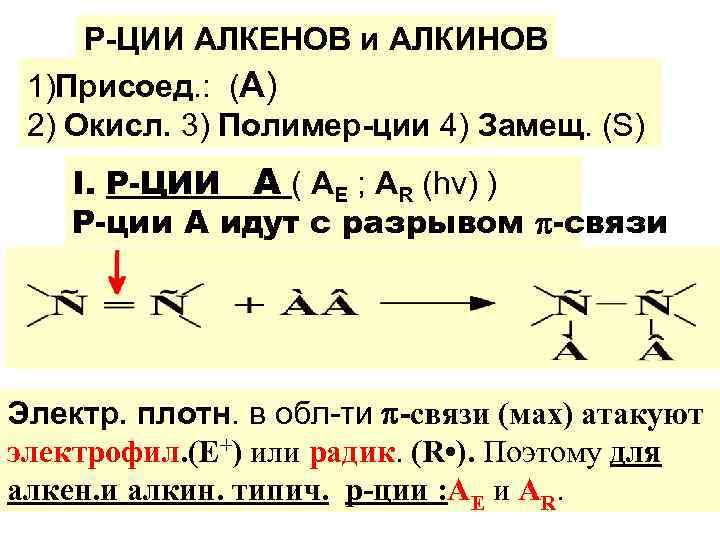
Р-ЦИИ АЛКЕНОВ и АЛКИНОВ 1)Присоед. : (А) 2) Окисл. 3) Полимер-ции 4) Замещ. (S) І. Р-ЦИИ А ( AE ; AR (hν) ) Р-ции А идут с разрывом -связи Электр. плотн. в обл-ти -связи (мах) атакуют электрофил. (Е+) или радик. (R • ). Поэтому для алкен. и алкин. типич. р-ции : АE и АR.
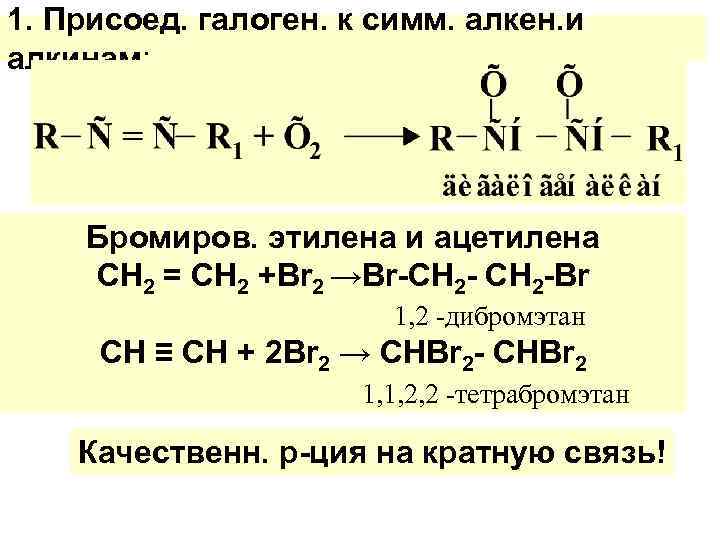
1. Присоед. галоген. к симм. алкен. и алкинам: Бромиров. этилена и ацетилена СH 2 = СH 2 +Br 2 →Br-СH 2 -Br 1, 2 -дибромэтан СH ≡ СH + 2 Br 2 → СHВr 2 - СHBr 2 1, 1, 2, 2 -тетрабромэтан Качественн. р-ция на кратную связь!


2. ПРИСОЕД. РЕАГ-ТОВ К НЕСИММ. АЛКЕНАМ И АЛКИНАМ а) ПРИСОЕД. ПО ПРАВ. МАРКОВНИКОВА Прав. Марковникова: при гетеролитич. присоед. к несимм. алкенам или алкинам водород (или люб. электрофил. част-ца) направл-ся к наиб. гидрогенизир. атому С по месту разрыва кратной связи.
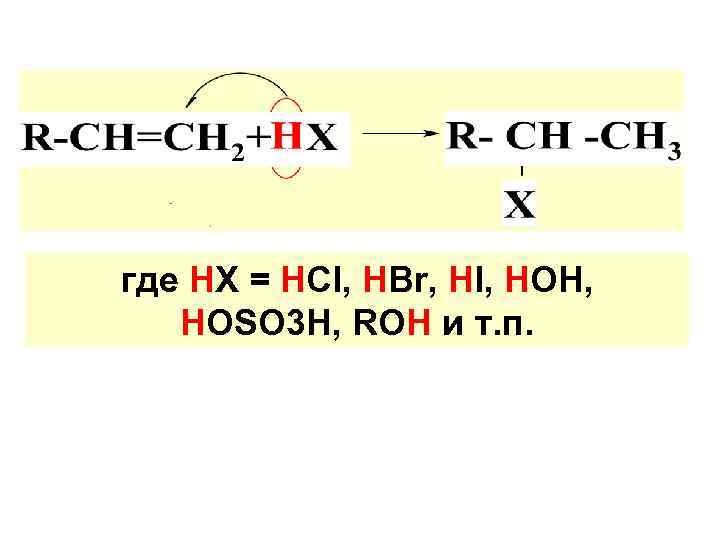
где НХ = НСl, НВr, НI, НОН, НОSO 3 H, ROH и т. п.

б)
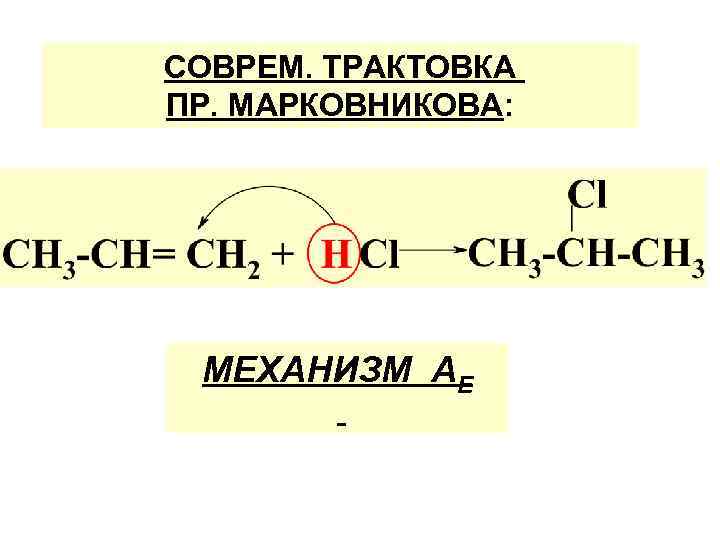
СОВРЕМ. ТРАКТОВКА ПР. МАРКОВНИКОВА: МЕХАНИЗМ АЕ
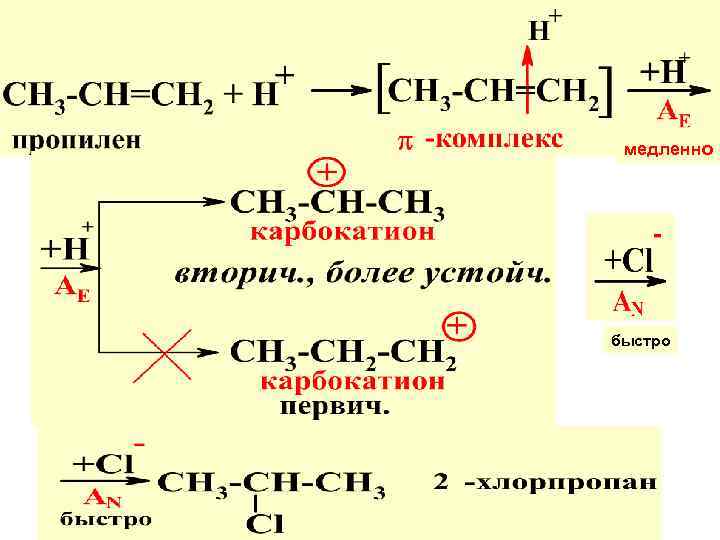
медленно быстро

Т. о. присоед. по пр. Марковникова идет через образ. наиб. устойч. карбокатиона. Самая медлен. стадия р-ции опред. ее общ. мех-зм. В дан. случае – это стадия электофил. присоед. Н+ — АЕ. Поэтому весь мех-м отн-ся к АЕ.
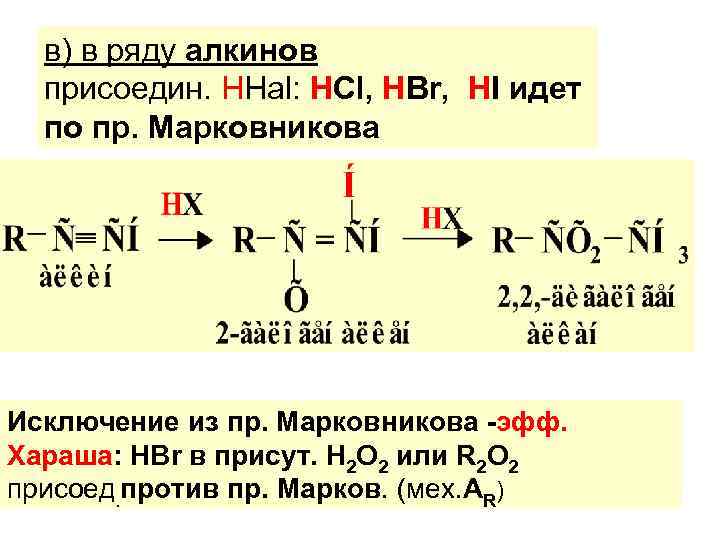
в) в ряду алкинов присоедин. ННаl: НСl, НВr, НI идет по пр. Марковникова Исключение из пр. Марковникова -эфф. Хараша: НВr в присут. Н 2 О 2 или R 2 О 2 присоед. против пр. Марков. (мех. АR)
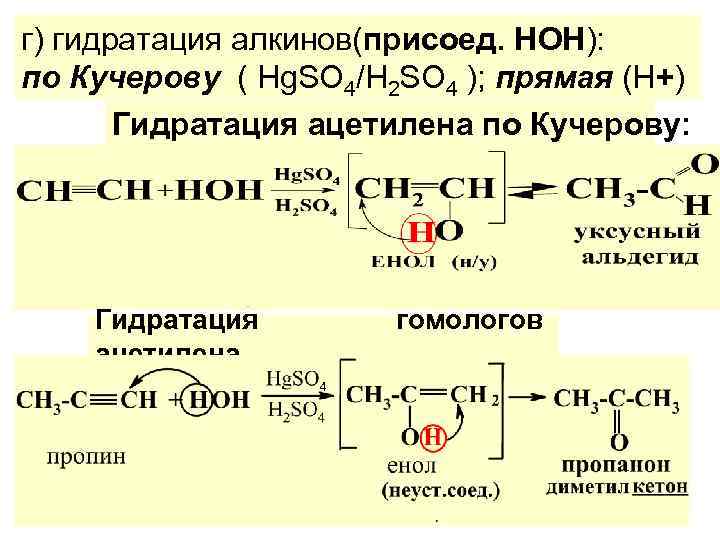
г) гидратация алкинов(присоед. НОН): по Кучерову ( Hg. SO 4/H 2 SO 4 ); прямая (Н+) Гидратация ацетилена по Кучерову: Гидратация ацетилена гомологов
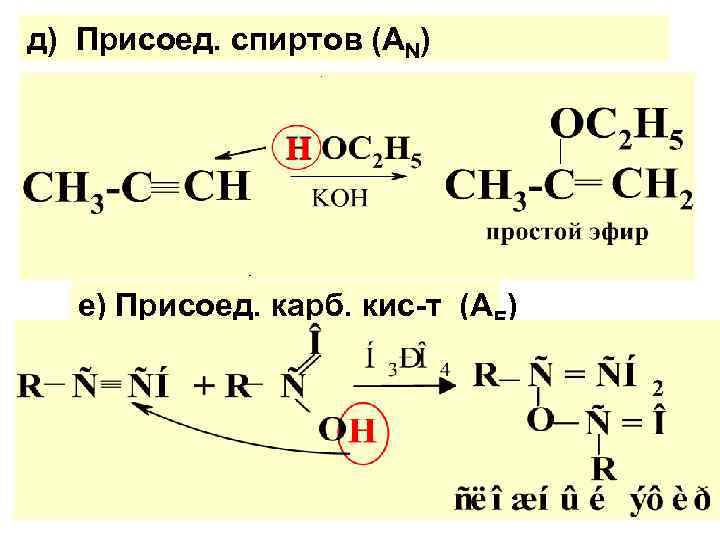
д) Присоед. спиртов (АN) е) Присоед. карб. кис-т (АЕ)
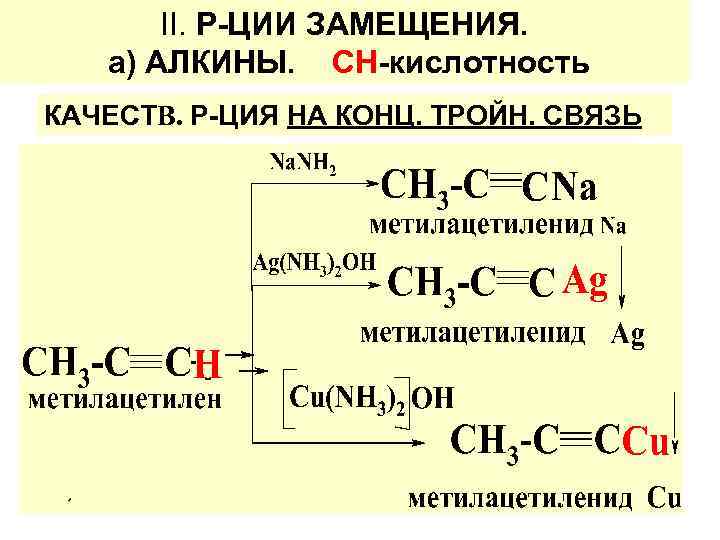
ІІ. Р-ЦИИ ЗАМЕЩЕНИЯ. а) АЛКИНЫ. СН-кислотность КАЧЕСТВ. Р-ЦИЯ НА КОНЦ. ТРОЙН. СВЯЗЬ

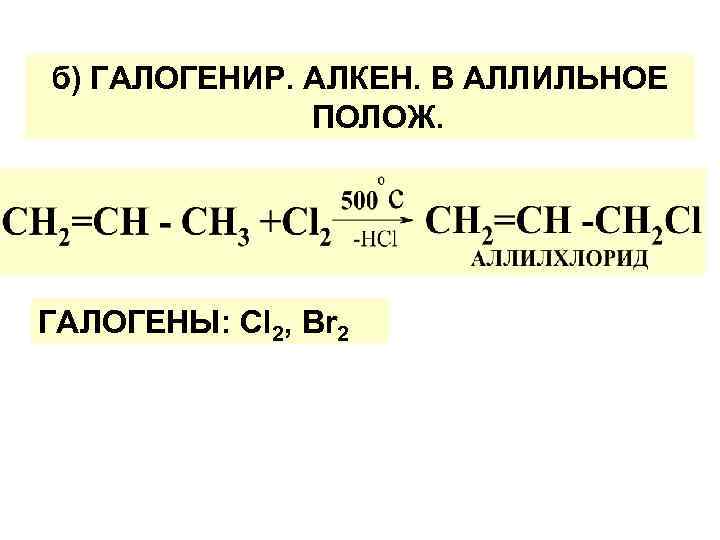
б) ГАЛОГЕНИР. АЛКЕН. В АЛЛИЛЬНОЕ ПОЛОЖ. ГАЛОГЕНЫ: Cl 2, Вr 2

ІІl. Р-ции окисл. алкенов: 1. Гидроксилир. по Вагнеру (качеств. р-ция на дв. связь): Этиленгликоль, этандиол
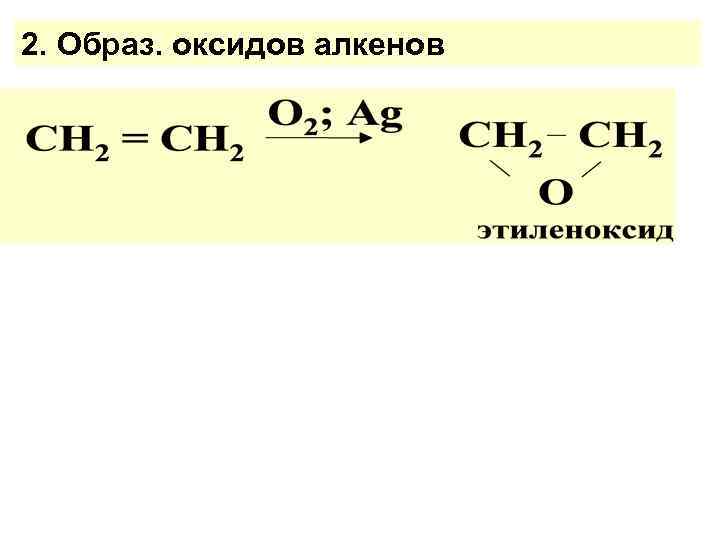
2. Образ. оксидов алкенов
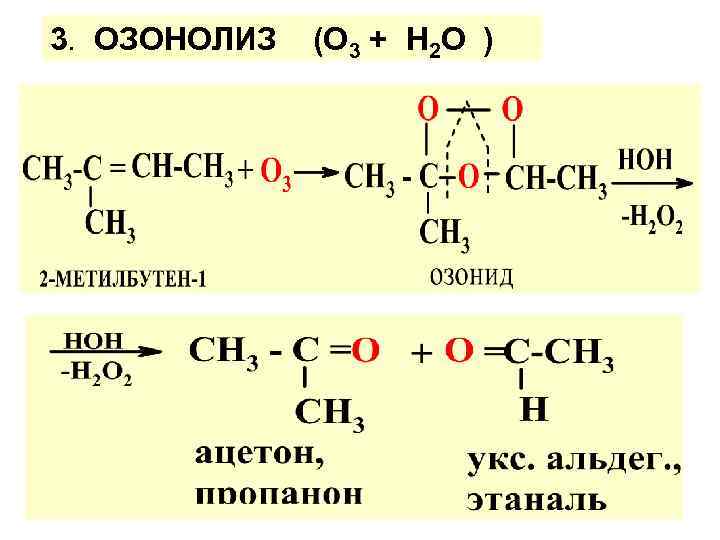
3. ОЗОНОЛИЗ (О 3 + Н 2 О )
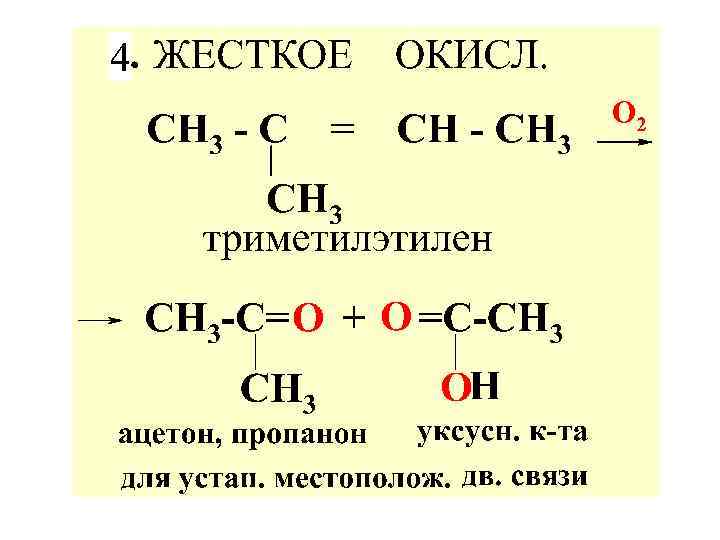
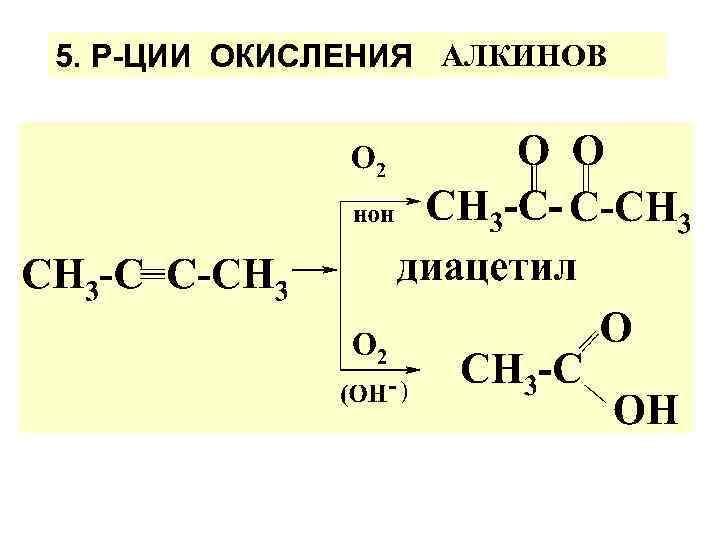
5. Р-ЦИИ ОКИСЛЕНИЯ АЛКИНОВ
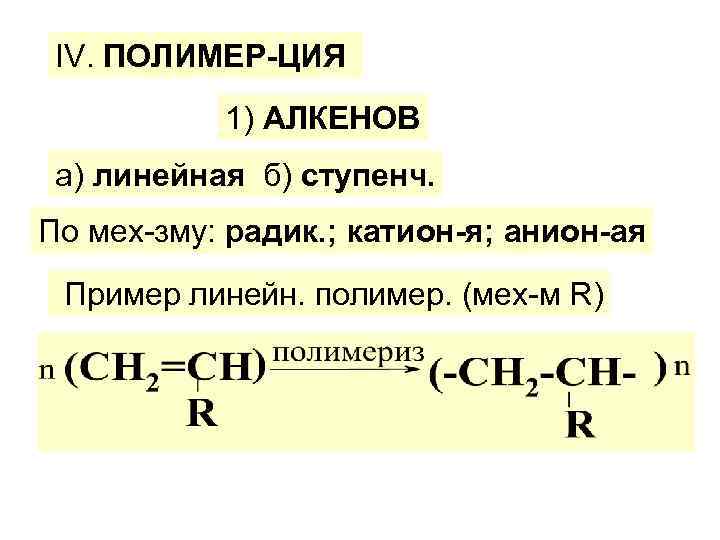
ІV. ПОЛИМЕР-ЦИЯ 1) АЛКЕНОВ а) линейная б) ступенч. По мех-зму: радик. ; катион-я; анион-ая Пример линейн. полимер. (мех-м R)
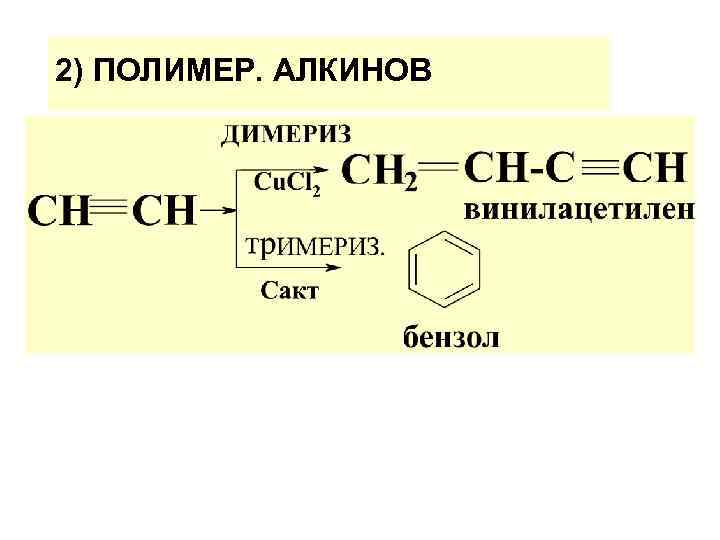
2) ПОЛИМЕР. АЛКИНОВ

ОСНОВ. СПОСОБ. ПОЛУЧ. АЛКЕНОВ и АЛКИНОВ 1. Дегидрирование алканов. 2. Дегидратация спиртов: отщепл. Н по пр. Зайцева! kt(водоотним. сред-ва): алкен Н 2 SО 4, Н 3 РО 4, Аl 2 О 3

3. Дегидрогалогенир. моногалогеналкилов спирт Правило Зайцева! Х: Сl, Вr, I; Дегидрогалог. ср-ва: тверд. Nа. ОН, КОН, спирт. р-ры щелоч.
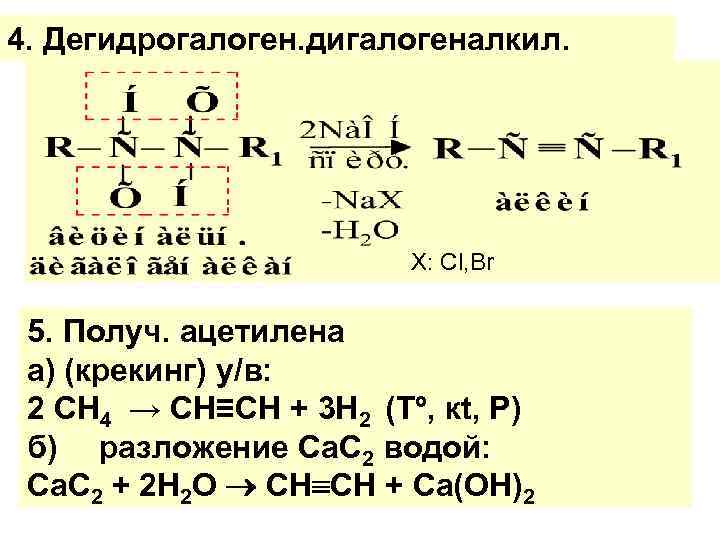
4. Дегидрогалоген. дигалогеналкил. Х: Cl, Br 5. Получ. ацетилена а) (крекинг) у/в: 2 СН 4 → СН≡СН + 3 Н 2 (Тº, кt, Р) б) разложение Са. С 2 водой: Са. C 2 + 2 H 2 О CН СН + Са(ОН)2
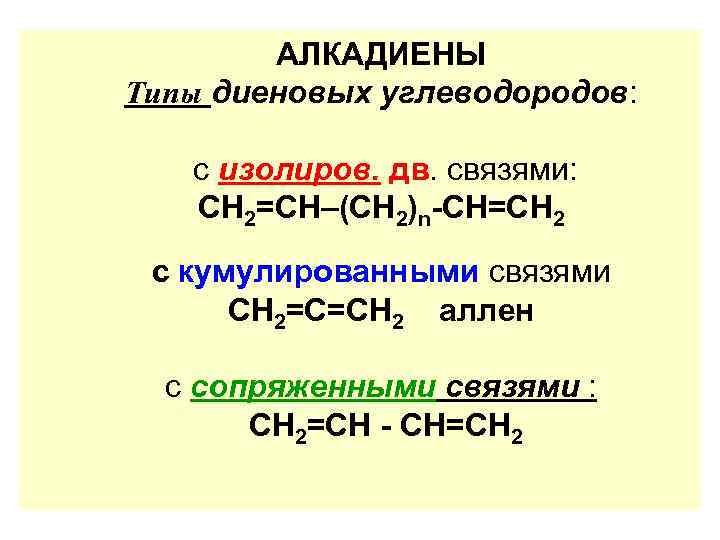
АЛКАДИЕНЫ Типы диеновых углеводородов: с изолиров. дв. связями: СН 2=СН–(СН 2)n-СН=СН 2 с кумулированными связями СН 2=С=СН 2 аллен с сопряженными связями : СН 2=СН - СН=СН 2
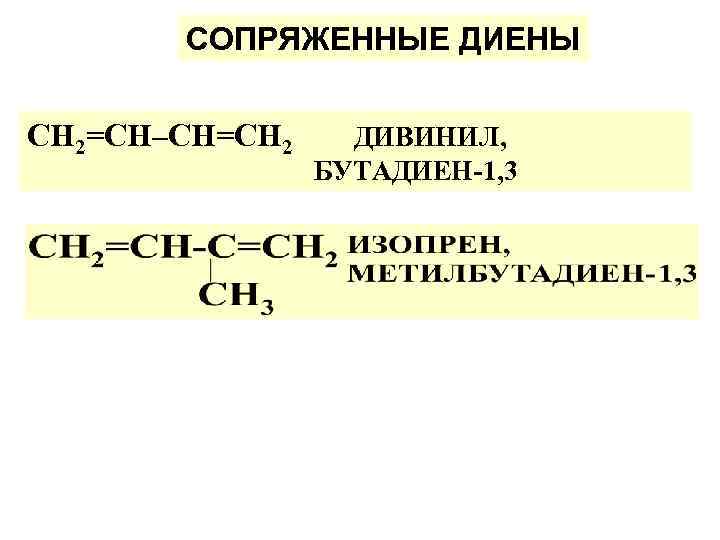
СОПРЯЖЕННЫЕ ДИЕНЫ СН 2=СН–СН=СН 2 ДИВИНИЛ, БУТАДИЕН-1, 3
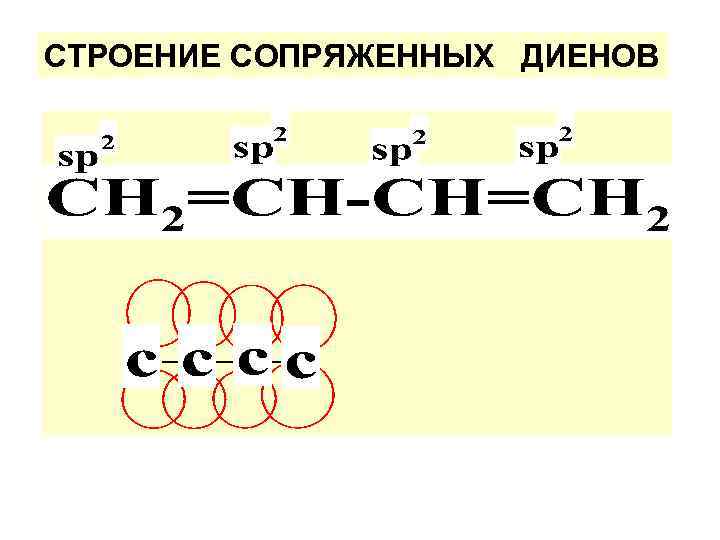
СТРОЕНИЕ СОПРЯЖЕННЫХ ДИЕНОВ

СИСТЕМА СОПРЯЖЕНИЯ – непрерыв. последовательность sp 2 -гибридизованных С-атомов. В бутадиене единое электронное облако охватывает всю систему.

ОСОБЕН-ТИ СТРОЕН. СИСТ-МЫ СОПРЯЖ. 1)Энергетич. более выгодн. , 2)более устойч. система, чем с изолир. кратн. и связями; 2) в сист. сопряж. наблюд. некотор. выравн. связей: С 1 -С 2 0, 136 нм вместо 0, 132 нм (удлин. ) С 2 -С 3 0, 148 нм вместо 0, 154 нм (укороч. ) 3) бóльшая поляризуемость связей и бóльшая активность в р-циях АЕ
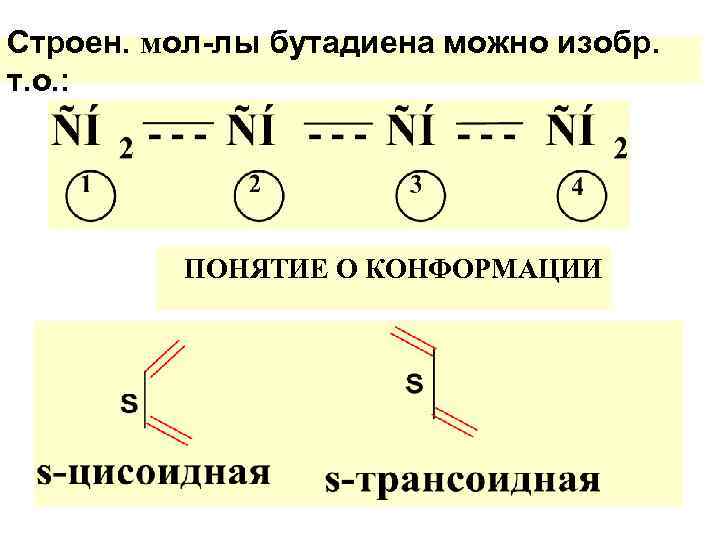
Строен. мол-лы бутадиена можно изобр. т. о. : ПОНЯТИЕ О КОНФОРМАЦИИ

ХИМ. СВ-ВА СХОДСТВО с р-циями алкенов: р-ции А, полимеризации и др. ОТЛИЧИЕ: а) специф. присоед. по типу 1, 2 и 1, 4; б) р-ция диенового синтеза.

І. Р-ции А (присоед. ): 1. Присоед. галогенов: Х: Сl 2, Вr 2 (ССl 4)
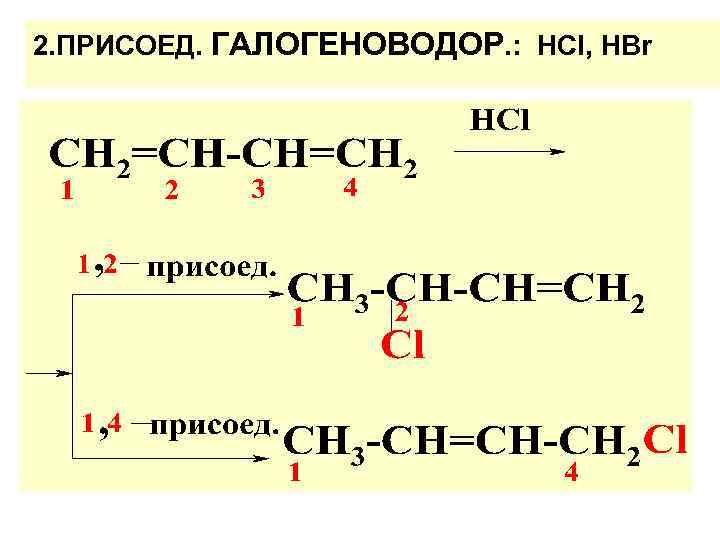
2. ПРИСОЕД. ГАЛОГЕНОВОДОР. : НСI, НВr
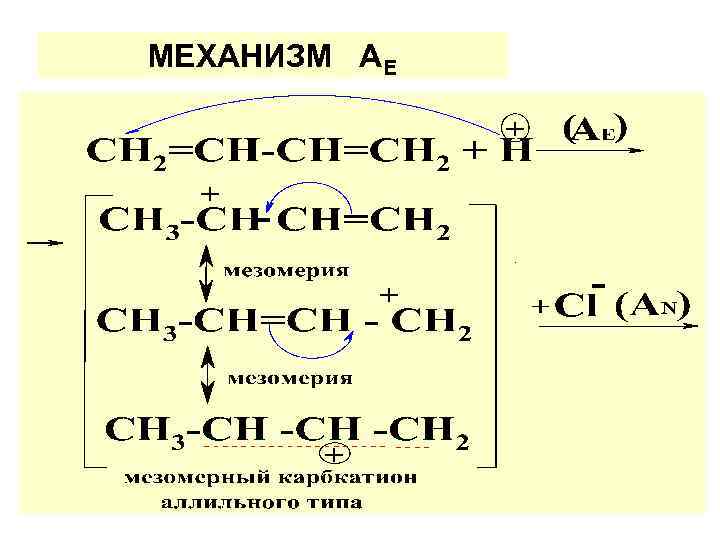
МЕХАНИЗМ АЕ

Устойчивость карбкатионов: аллил>трет. > втор. > перв. > метил

3. Р-ция диенового синтеза (Дильса-Алдера (ЦИКЛОПРИСОЕДИНЕН. )
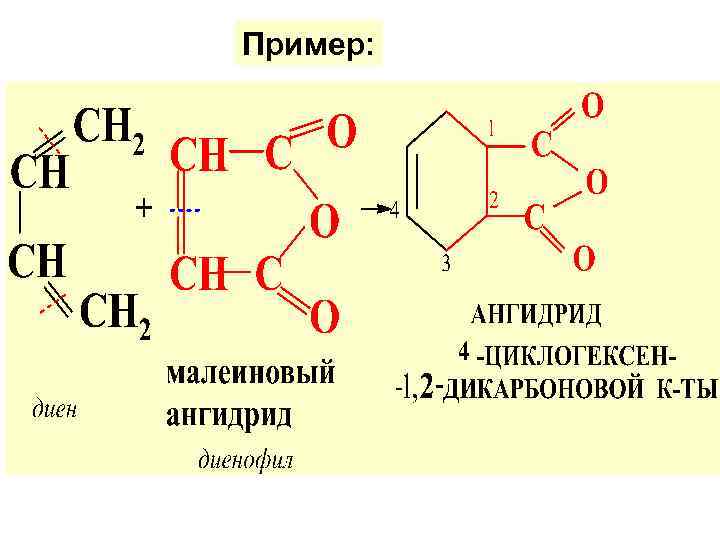
Пример:

4. Полимеризация бутадиена -1, 3
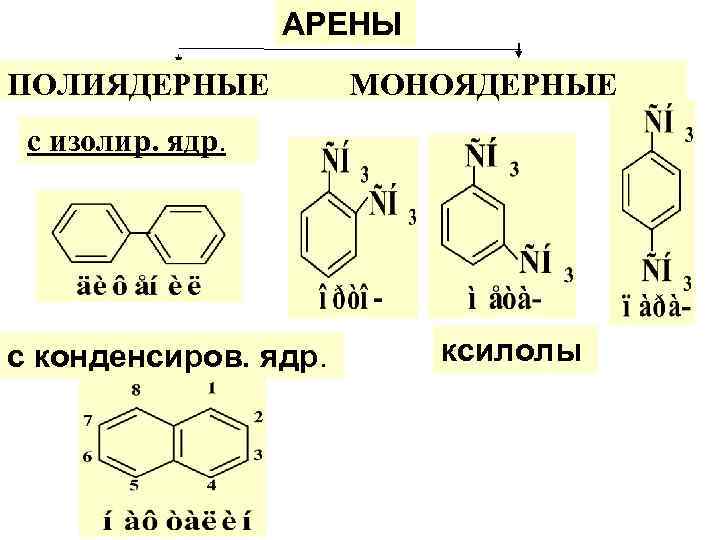
АРЕНЫ ПОЛИЯДЕРНЫЕ МОНОЯДЕРНЫЕ с изолир. ядр. с конденсиров. ядр. ксилолы
МОНОЯДЕРНЫЕ АРЕНЫ АРИЛЫ

НОМЕНКЛАТУРА
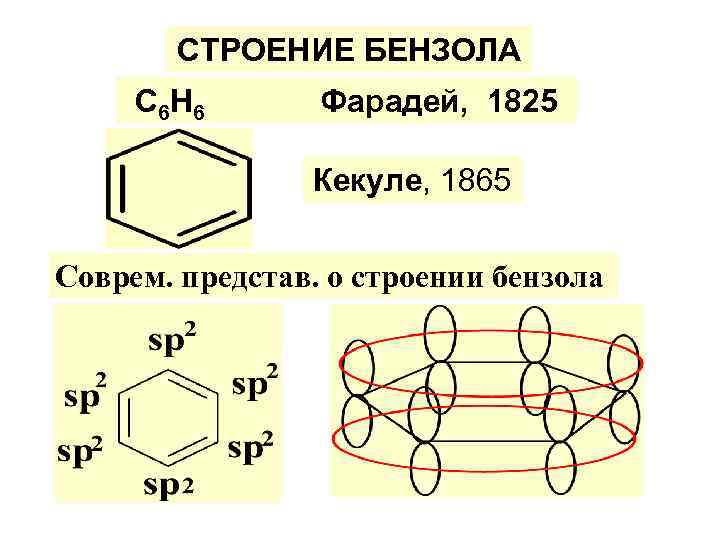
СТРОЕНИЕ БЕНЗОЛА С 6 Н 6 Фарадей, 1825 Кекуле, 1865 Соврем. представ. о строении бензола

-плоск. кольцо; -замкн. цепь сопряж. ; -делокализ. π (р)-электр. по всей с-ме - (един. электр. облако из 6 - π (р) эл-нов ); -все связи С-С равны 0, 140 нм; - система термодинам. устойчива.

ПРАВИЛО ХЮККЕЛЯ ИЛИ ПРАВИЛО 4 n+2 Любая плоск. циклич. система, содерж-я замкн. цепь сопряж. будет ароматич. , если кол-во делокализов. π –электр. отвечает правилу 4 n+2, где n – любое целое число. Для бензола правило вып-ся при n=1

ХИМИЧ. СВ-ВА АРЕНОВ I. Р-ции SЕ –электроф. замещ. : а) замещ. (S) обусл. устойчив. аром. кольца. б) электрофил. мех-зм р-ции обусловл. аромат. секстетом электр. II. Р-ции присоед. III. Р-ции окисления
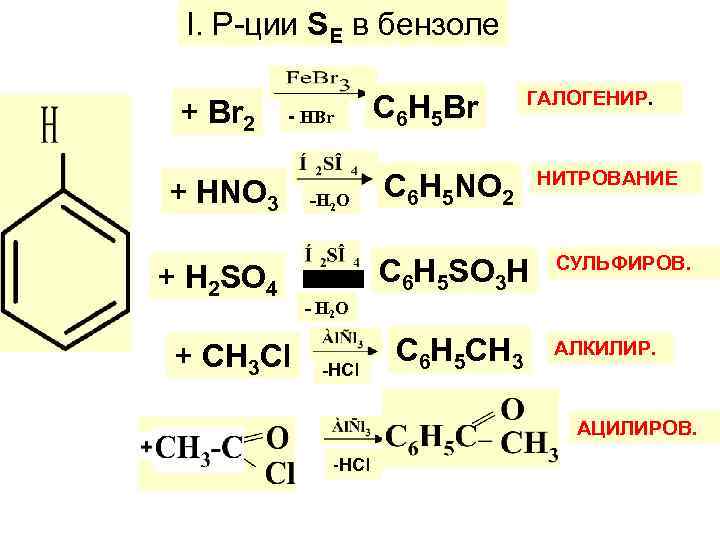
I. Р-ции SЕ в бензоле + Вr 2 - НBr + НNО 3 + Н 2 SО 4 + СН 3 Сl -Н 2 О С 6 Н 5 Вr ГАЛОГЕНИР. С 6 Н 5 NО 2 С 6 Н 5 SО 3 Н НИТРОВАНИЕ СУЛЬФИРОВ. - Н 2 О -HCl C 6 Н 5 СН 3 АЛКИЛИР. АЦИЛИРОВ. -HCl

1. НИТРОВАНИЕ: конц. HNO 3+H 2 SO 4 – нитрующ. смесь Актив. электрофил-катион нитрония NО 2 :
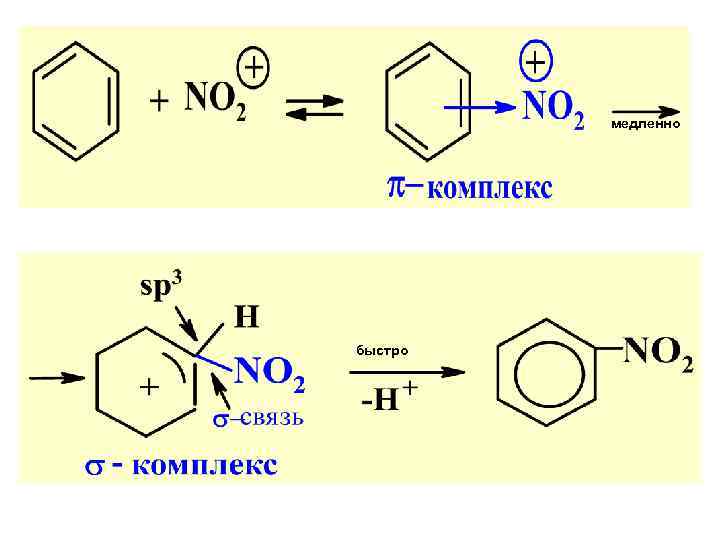
медленно быстро
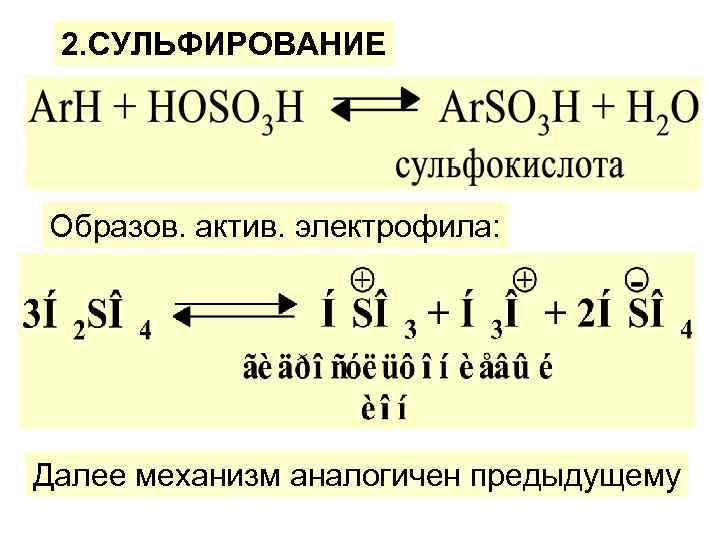
2. СУЛЬФИРОВАНИЕ Образов. актив. электрофила: Далее механизм аналогичен предыдущему

3. ГАЛОГЕНИРОВАНИЕ: Х 2 = Сl 2, Вr 2 kt: Аl. Сl 3, Аl. Вr 3, Fе. Сl 3, Fе. Вr 3, Zn. Cl 2 Образов. актив. электрофила Далее механизм аналогичен р-ции нитрования.

2. АЛКИЛИРОВ. (введен. алкила R) а) галогеналкилами (RHal) по Фриделю- Крафтсу (kt: Аl. Вr 3, Аl. Сl 3, и др. б) алкенами (kt: к-ты) в) спиртами (kt: к-ты)

Пример: синтез изопропилбензола (кумола)

1) образ. актив. электрофила CH 3 -CH 2 Cl + Al. Cl 3 CH 3 -CH 2+ + CH 3 -CH 2+ первич. карбкат Al. Cl 4 CH 3 -CH+-CH 3 втор. карбкатион (устойч. ) Далее мех-м р-ции аналогичен нитров. активн. алкилов: аллил=бензил трет. втор перв. метил
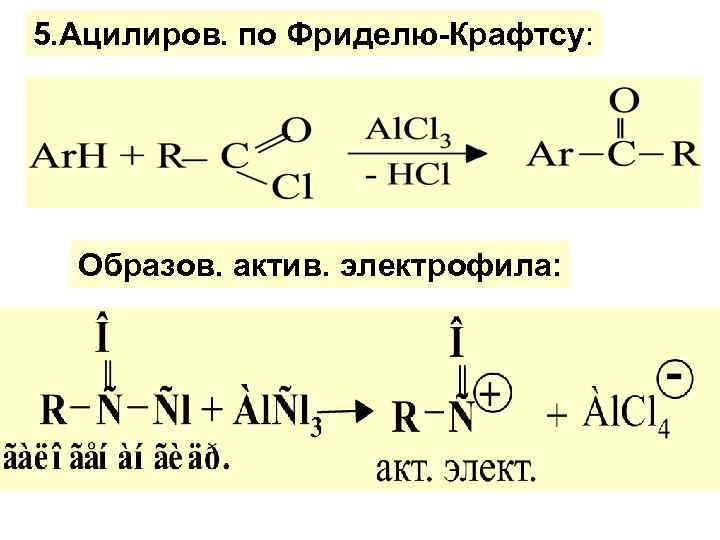
5. Ацилиров. по Фриделю-Крафтcу: Образов. актив. электрофила:
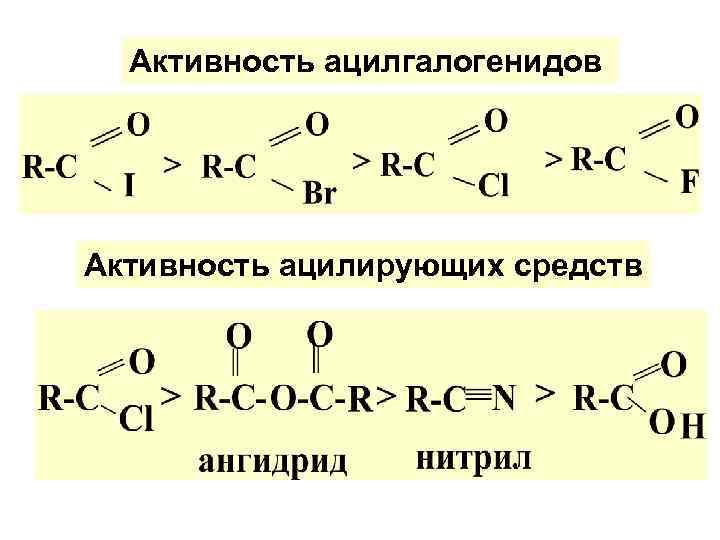
Активность ацилгалогенидов Активность ацилирующих средств
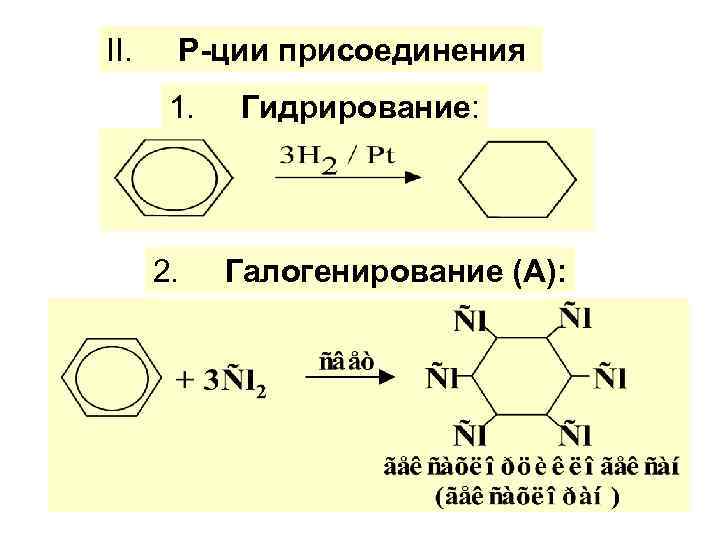
II. Р-ции присоединения 1. 2. Гидрирование: Галогенирование (А):
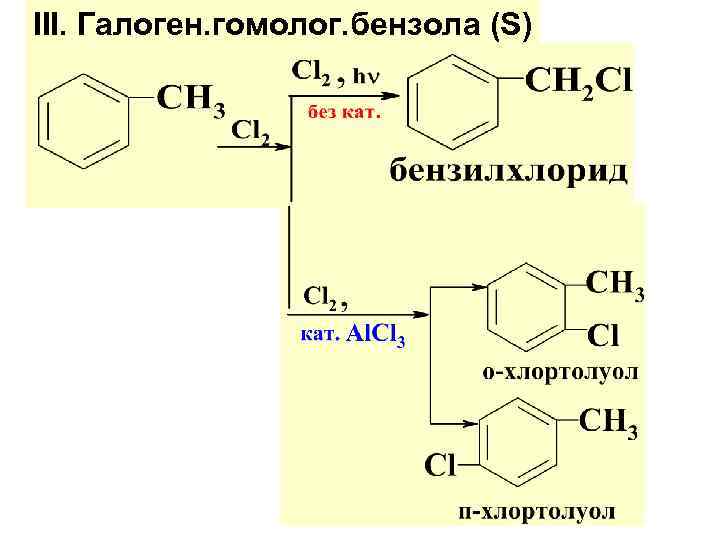
III. Галоген. гомолог. бензола (S)
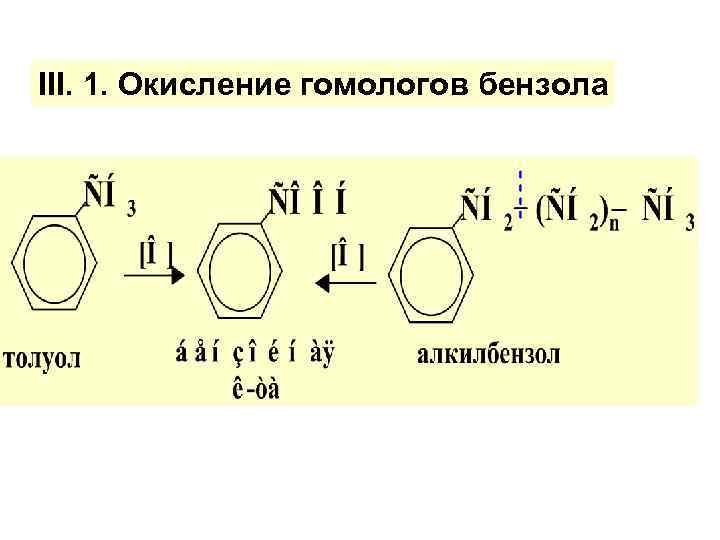
III. 1. Окисление гомологов бензола
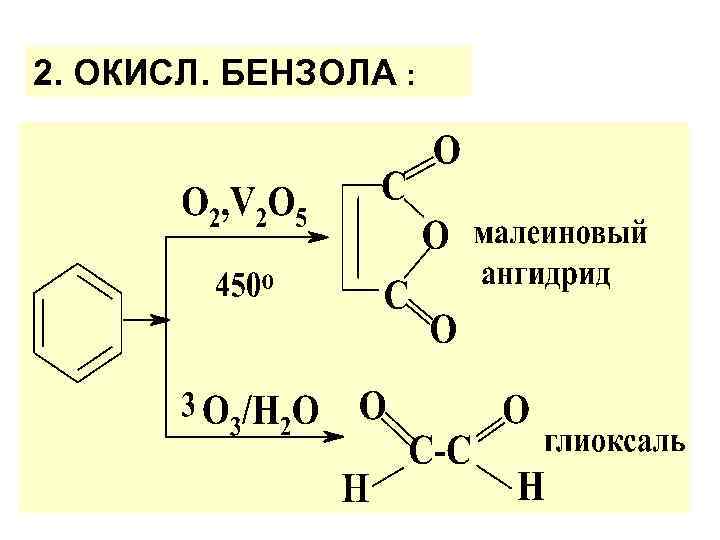
2. ОКИСЛ. БЕНЗОЛА :

IV. Р-ЦИИ SE В ПРОИЗВОД. БЕНЗОЛА Правила замещения в бенз. ядре При введ. второго замест. в бенз. кольцо возможны изомеры:

Местополож. второго (и последующих) замест-лей зависит от: - природы замест-ля в бенз. ядре, ; -характ-ра действ. реагента (Е, Nuc, R·); - условий р-ции. Реагент – электрофильн. , т. к. р-ции SE.

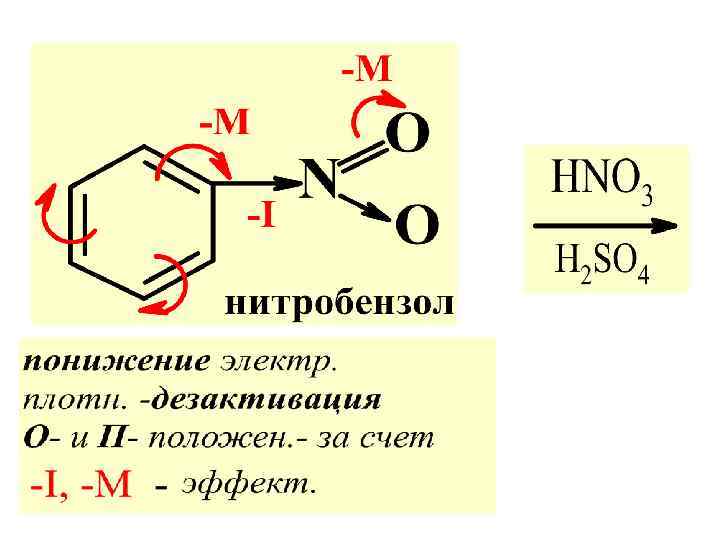
Различ. два рода замест-лей (ориент-тов): I рода (электронодонор. ) и II рода (электроноакцепт. ) Ориент-ты I рода или орто- и параориентанты: О > NR 2 > NHR > NH 2 > OH > OR > Alk> >галогены. Ориент-ты II рода или мета-ориентанты: NR 3 >NO 2 >CCl 3 > SO 3 H >COR >CN >COOH

При взаимодейст. замест. с бенз. ядром возможны два эффекта: индуктивный ( I) и мезомерный ( М). Смещен. электр. в сторону бенз. кольца обознач-ся знаком плюс (+I или +М) , ( активация бенз. ядра). Смещение электр. от бенз. ядра обознач. знаком минус (-I или –М), т. е. дезактивация бенз. ядра

Правило 1. В р-х SЕ ориен-ты I рода направл. последующ. замест-ль преимуществ. в орто- и параположения:

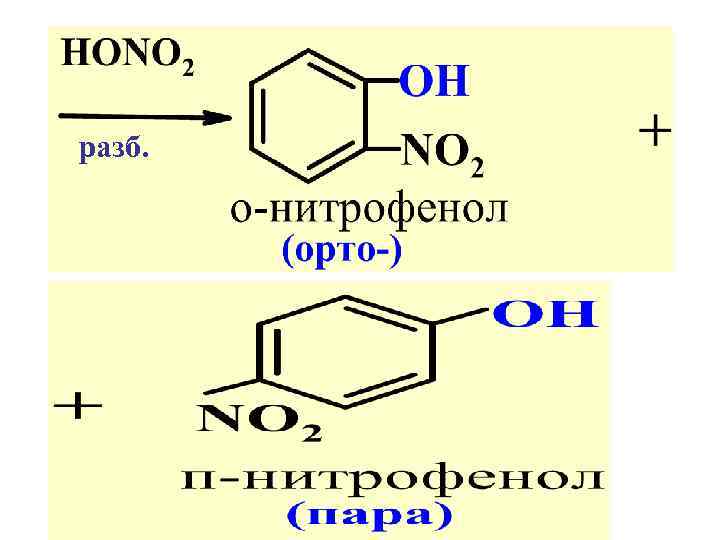
разб.

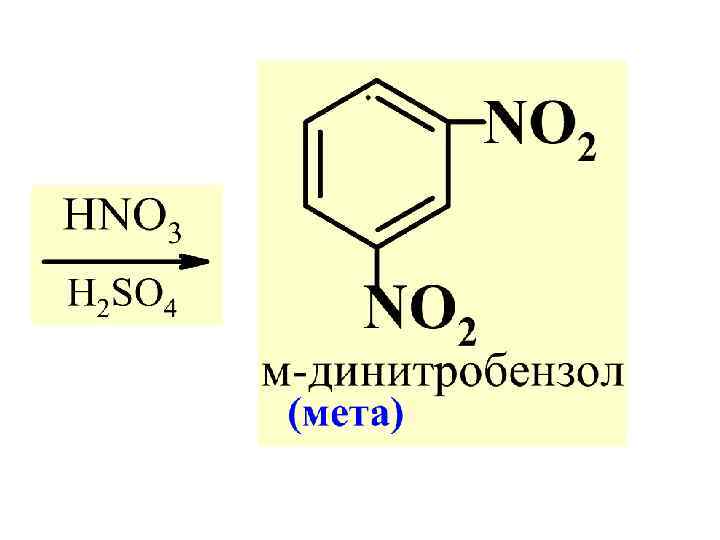
Правило 2. В р-х SЕ ориент. II рода направл. послед. замест-ль преимущест. в мета-положение.
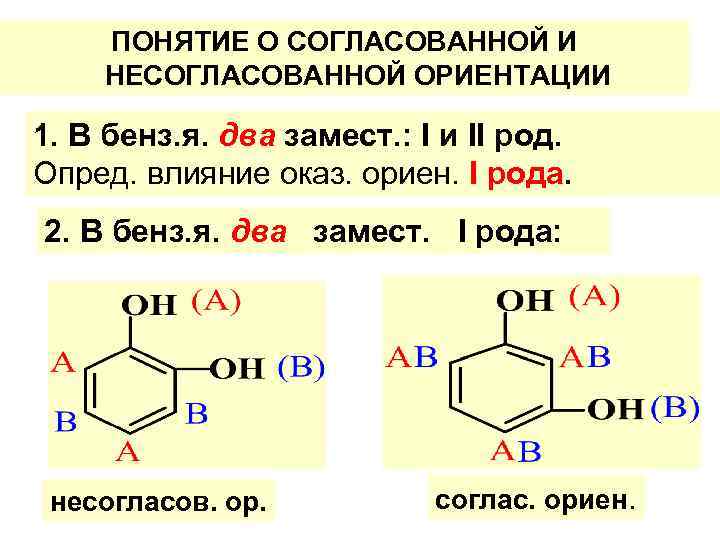
ПОНЯТИЕ О СОГЛАСОВАННОЙ И НЕСОГЛАСОВАННОЙ ОРИЕНТАЦИИ 1. В бенз. я. два замест. : I и II род. Опред. влияние оказ. ориен. I рода. 2. В бенз. я. два замест. I рода: несогласов. ор. соглас. ориен.
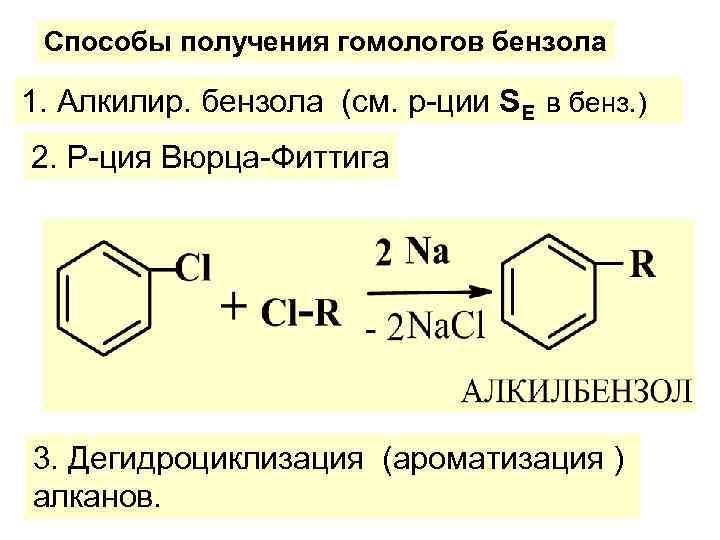
Способы получения гомологов бензола 1. Алкилир. бензола (см. р-ции SE в бенз. ) 2. Р-ция Вюрца-Фиттига 3. Дегидроциклизация (ароматизация ) алканов.

АЛИЦИКЛИЧЕСКИЕ У/В КЛАССИФИКАЦИЯ МОНОЦИКЛ. : малые (C 3 С 4) обычн. (С 5 С 7) средние (С 8 С 11) большие (C 12 и более) ПОЛИЦИКЛ. : БИциклич. : ТРИциклич. и др
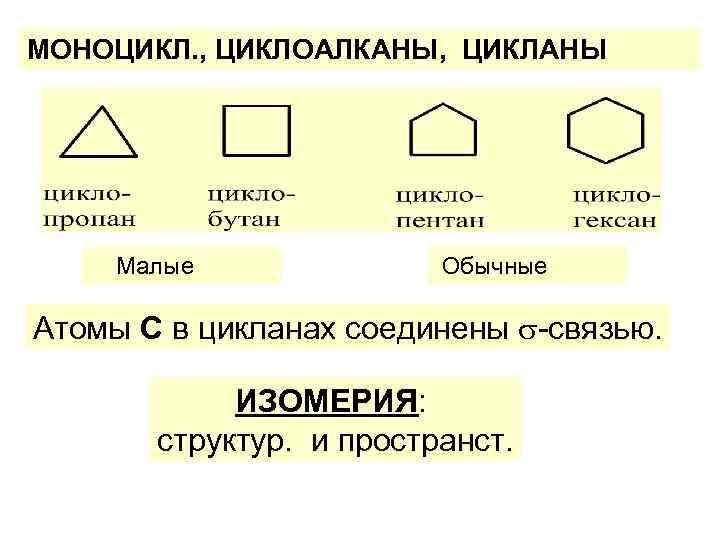
МОНОЦИКЛ. , ЦИКЛОАЛКАНЫ, ЦИКЛАНЫ Малые Обычные Атомы С в цикланах соединены -связью. ИЗОМЕРИЯ: структур. и пространст.

1. СТРУКТУРНАЯ: • размер цикла, • строение боков. цепей • их взаимн. полож. 2. ПРОСТРАНСТВЕННАЯ: • цис-, транс-; • оптическая; • конформационная.

СОВРЕМ. ПРЕДСТАВЛ. О СТРОЕНИИ И УСТОЙЧИВ. МАЛЫХ И ОБЫЧН. ЦИКЛОВ 1. Все циклы, за исключ. 3 х-член. , неплоские. 2. Устойчив-ть циклов зависит от : - углового напряж. : (откл. от угла 109, 5 гр. ) -торсионного (напряж. заслонения); - сил Ван-дер-Ваальса
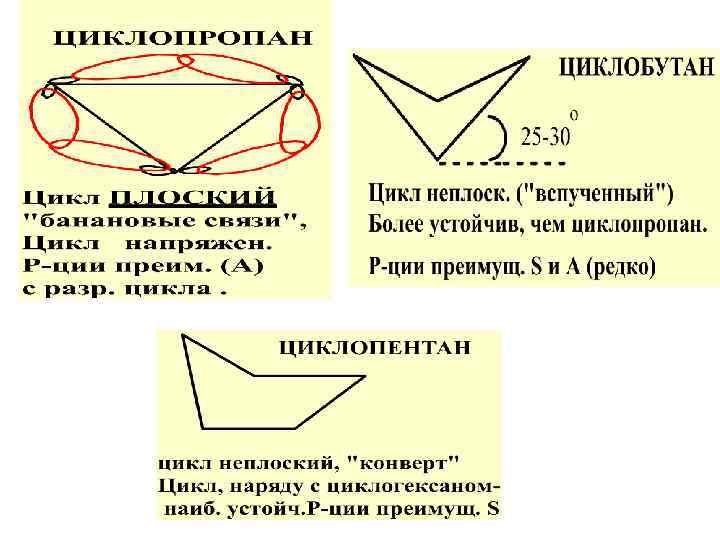
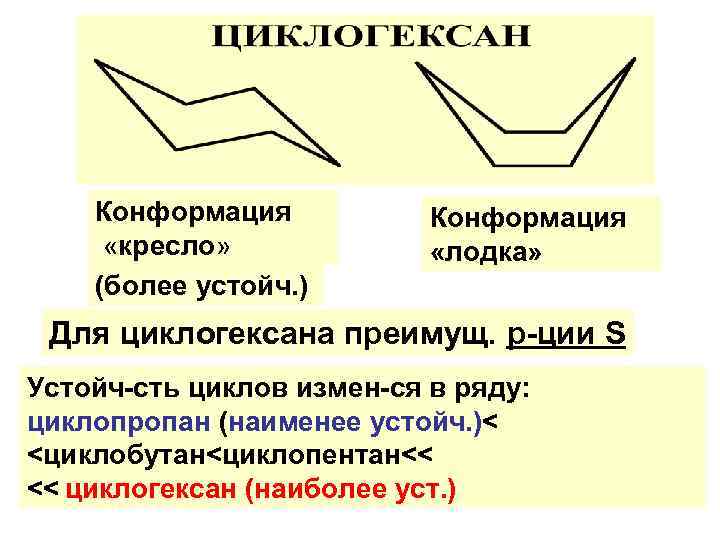
Конформация «кресло» (более устойч. ) Конформация «лодка» Для циклогексана преимущ. р-ции S Устойч-сть циклов измен-ся в ряду: циклопропан (наименее устойч. )< <циклобутан<циклопентан<< << циклогексан (наиболее уст. )
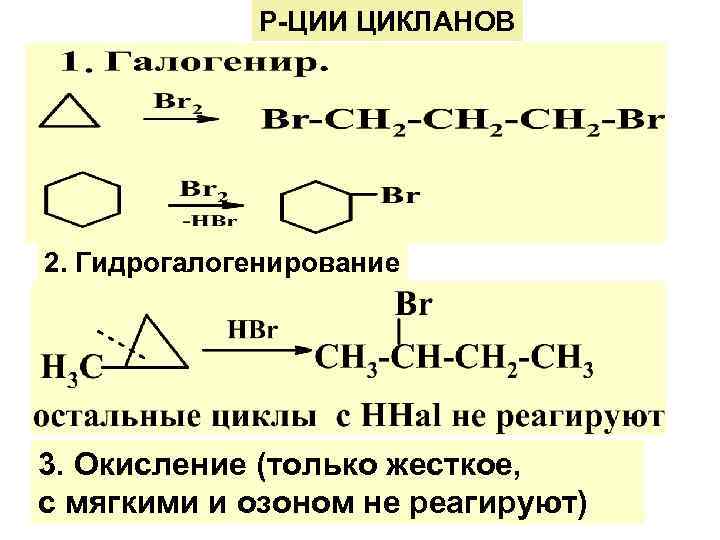
Р-ЦИИ ЦИКЛАНОВ 2. Гидрогалогенирование 3. Окисление (только жесткое, с мягкими и озоном не реагируют)
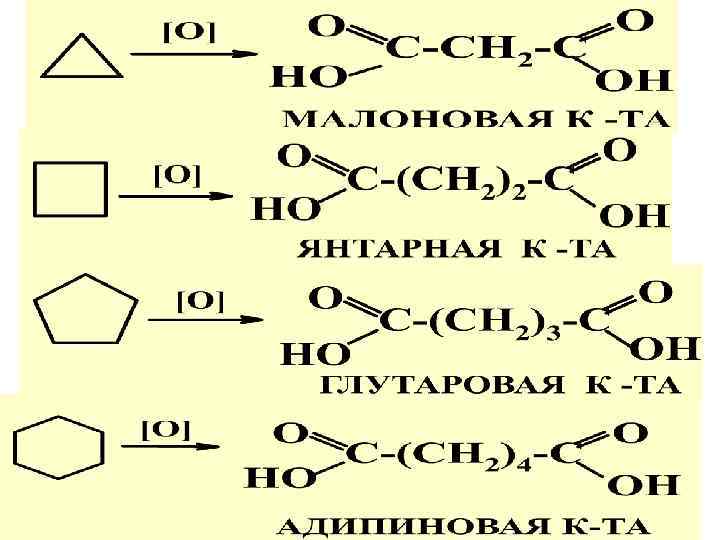
1 ВВед.+углв-род.ppt