Биогео ЛК3 цикл серы през.ppt
- Количество слайдов: 15

ГЛОБАЛЬНЫЙ ЦИКЛ СЕРЫ 1. Общая характеристика серы и её соединений. 2. Распределение масс серы в биосфере. 3. Круговорот серы: 3. 1 Выделение сероводорода из сульфидов и его окисление. 3. 2 Окисление серы в сульфаты. 3. 3 Восстановление сульфатов в почвах и воде. 4. Роль живого вещества в круговороте серы. Литература: Глинка Н. Л. Общая химия, гл. 18. 2. Добровольский В. В. Биогеохимия. 2003. – гл. 7. 3. Гусакова Н. В. Химия окружающей среды. Ростов/Д: Феникс. 2004. – с. 152.

СОЕДИНЕНИЯ СЕРЫ Электронная формула: 16 S – 2, 8, 6 … 3 s 13 p 33 d 2 1 s 22 p 63 s 23 p 4 3 d 0 sp 3 d 2 –гибридизация. Степени окисления серы равны – 2, 0, +4, +6, из них самая устойчивая в биосфере степень окисления – (+6) -2 0 +4 +6 H 2 S, S, SO 2 , H 2 SO 4 В низшей степени окисления (-2) сера обладает восстановительными свойствами (E 0 = - 0, 48 В). У серы в степени окисления (+4) проявляется двойственный характер с преобладанием восстановительных свойств, а в степени окисления (+6) она обладает только свойствами окислителя (E 0 = 0, 36 В).
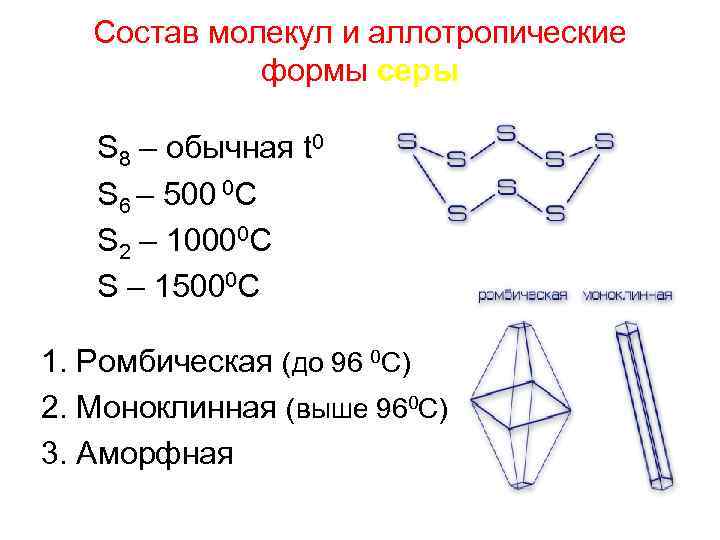
Состав молекул и аллотропические формы серы S 8 – обычная t 0 S 6 – 500 0 C S 2 – 10000 C S – 15000 C 1. Ромбическая (до 96 0 С) 2. Моноклинная (выше 960 С) 3. Аморфная

Природные соединения 1. 2. 3. 4. Самородная сера Природные газы: SO 2, H 2 S Сульфиды: Fe. S 2 – пирит, Zn. S, Pb. S, Hg. S Сульфаты: Ca. SO 4 - ангидрит Ca. SO 4∙ 2 H 2 O - гипс Ba. SO 4 – тяжелый шпат Mg. SO 4∙ 7 H 2 O – горькая соль Na 2 SO 4∙ 10 H 2 O – мирабилит, глауберова соль

S в нефтях, углях, растительных и животных белках • Цистеин HOOCCH(NH 2)CH 2 SH – α-амно-β-тиопропионовая кислота • Цистин [HOOCCH(NH 2)CH 2 S]2 • Метионин HOOCCH(NH 2)CH 2 SСH 3 – α-амно-γ-метил-тиомасляная кислота Кларк серы в земной коре 0, 95 масс. %. В атмосфере содержится мало серы – 1· 106 т. В живом веществе Земли - 33, 7· 109 т серы, причем в педосфере - 25· 109 т, растениях - 8, 5· 109 т, животных - 0, 15· 109 т. В океане в виде растворимых сульфатов 11, 4%серы.

Применение серы • Получение Н 2 SO 4 (50% производимой S). • Получение сульфитов в производстве бумаги (25%). • Борьба с болезнями винограда и хлопчатника (10 -15%). • Вулканизация каучука для превращения в резину. • Производство красителей (ультрамарин) Na 2 Al 4 Si 6 S 4 O 24. • Взрывчатых веществ (черный порох). • БОВ – иприт S(CH 2 Cl)2. • Люминофоров: Zn. S, Cd. S, Ва. S. • Производство сероуглерода CS 2. • Головок спичек. • Кожных мазей (чесотка).

H 2 S – сероводород – бесцветный газ, обладающий характерным запахом гниющего белка. ЯД!!! H 2 S ↔ H+ + HS- ; К 1 = 6 ∙ 10 -8 HS- ↔ H+ + S 2 - ; К 2 = 10 -14 Гидросульфиды – Na. HS, Сульфиды - Na 2 S, Cu. S, Pb. S, Cd. S, Zn. S, Ag 2 S. Полисульфиды: Na 2 S 2, Na 2 S 5

Качественные реакции на Н 2 S: Pb 2++S 2 -=Pb. S (черно-коричневый), Сd 2++S 2 -=Cd. S (желтый), Zn 2++S 2 -=Zn. S (белый). Восстановитель 2 H 2 S + O 2 = S↓ + 2 H 2 O, серобактерии почвы. Окисление пиритов Fe. S 2 в Fe+3 бактериями Thiobacillus ferrooxidans.

SO 2, H 2 SO 3 SO 2 - диоксид серы, сернистый газ. Сульфур (ІV) оксид. Яд! (“пронзительный” запах), 4 Fe. S 2 + 11 O 2 = 8 SO 2 + 2 Fe 2 O 3 выбросы 250 -300 млн т/год, кислотные дожди. Уничтожение плесени, обесцвечивание H 2 SO 3 K 1 =2· 10 -2 , K 2 =6· 10 -8 Na. HSO 3 - гидросульфит, Na 2 SO 3 - сульфит 2 H 2 SO 3+O 2 =2 H 2 SO 4

H 2 SO 4 Мировое производство 140 млн. т/год, кровь химии. K 1 =1000 , K 2 =10 -2 ; Na. HSO 4, Na 2 SO 4 H 2 SO 4∙n. H 2 O + Q, n=1 -6. Сначала вода, потом кислота Иначе случится большая беда! Потребители: получ. к-т, солей, минеральных удобрений, хлора; оргсинтез (красители, лекарства, искусственные волокна, ВВ), очистка нефтепродуктов, гидрометаллургия…
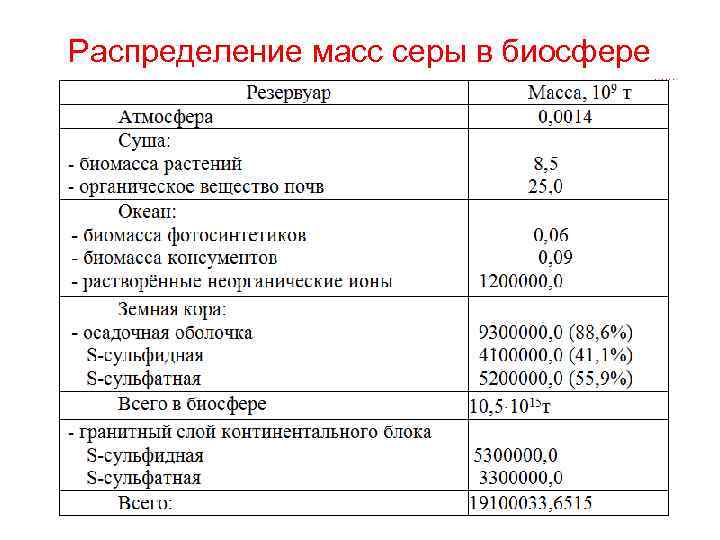
Распределение масс серы в биосфере
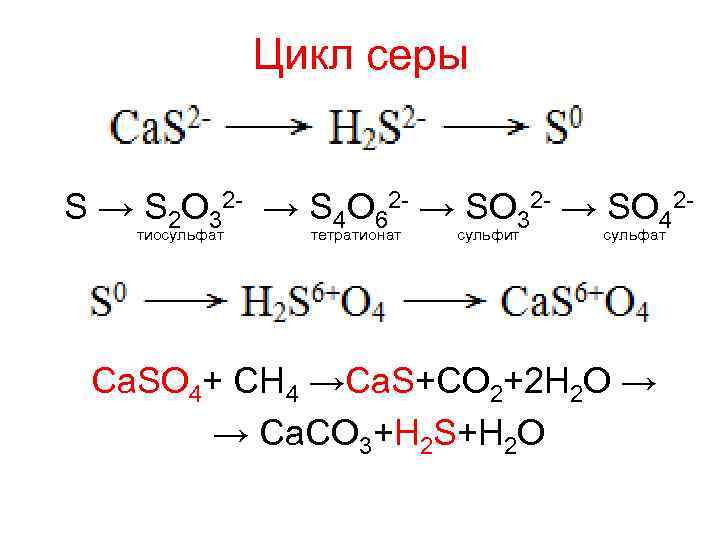
Цикл серы S → S 2 O 32 - → S 4 O 62 - → SO 32 - → SO 42 тиосульфат тетратионат сульфит сульфат Ca. SO 4+ CH 4 →Ca. S+CO 2+2 H 2 O → → Ca. CO 3+H 2 S+H 2 O

Биогеохимический круговорот серы 1. Основной резервуар серы находится в осадочных породах Земли и в почвах. 2. Происходит тесное взаимодействие геохимических процессов (эрозия, дождь, выщелачивание, осадкообразование) с биологическими процессами продукции и разложения живого вещества. 3. Живые организмы, особенно специфические бактерии, играют важнейшую роль в быстропротекающих обменных процессах.
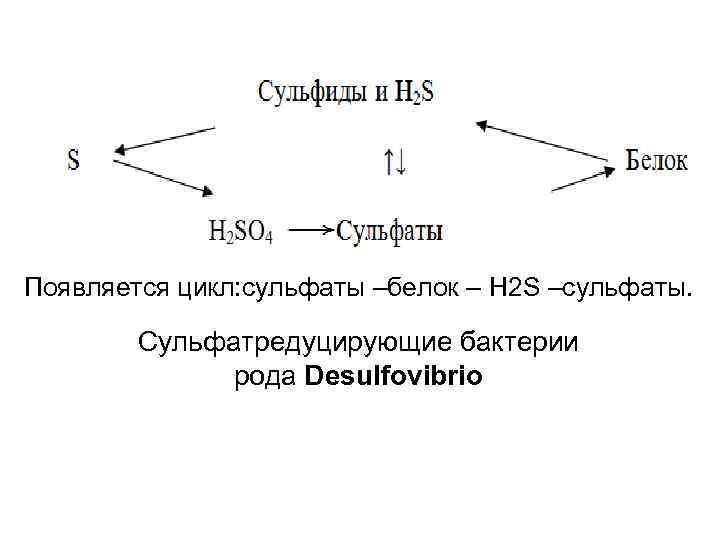
Появляется цикл: сульфаты –белок – H 2 S –cульфаты. Сульфатредуцирующие бактерии рода Desulfovibrio
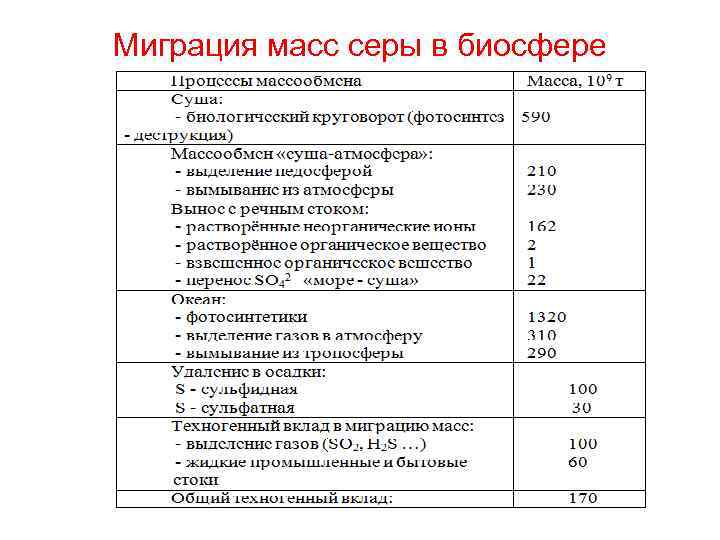
Миграция масс серы в биосфере
Биогео ЛК3 цикл серы през.ppt