Лекция 3-арены-спирты.ppt
- Количество слайдов: 93

Главная опасность, от которой необходимо оберегать детей, – их родители Бернард Шоу

Лекция № 3 (темы 6 и 7)

Арены (ароматические углеводороды)
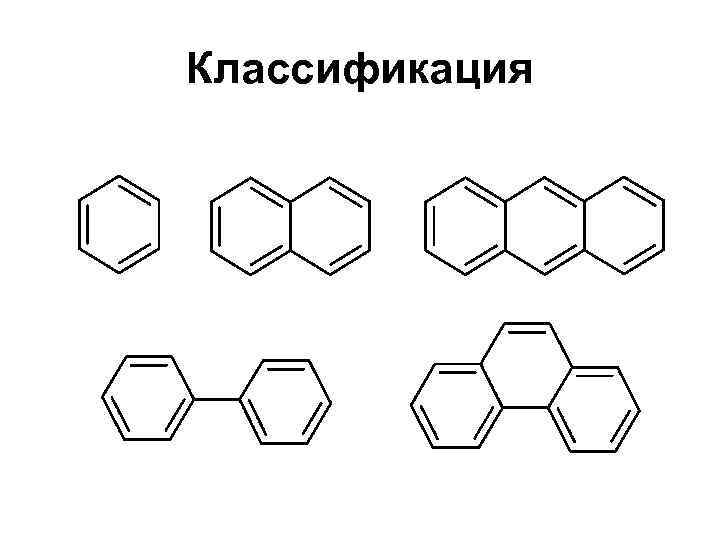
Классификация

Ароматические соединения • С молекулярной формулой, указывающей на высокую степень ненасыщенности, но которые вступают в реакции электрофильного (нуклеофильного) замещения с сохранением термодинамически устойчивой ароматической системы
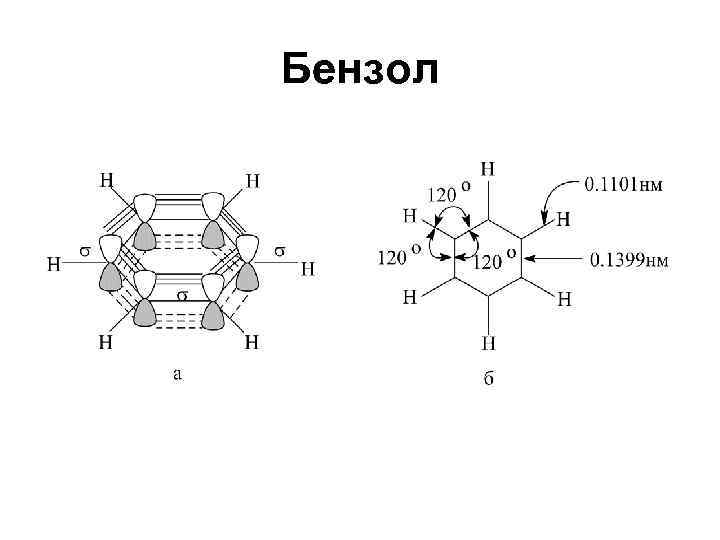
Бензол

• Стабилизация за счет энергии резонанса является причиной термодинамической устойчивости бензола (аренов)

Условие ароматичности • правило Хюккеля: ароматическими свойствами обладает такое соединение, в молекуле которого имеется циклическая система делокализованных -электронов, число -электронов должно равняться (4 n 2), где n=0, 1, 2. . .
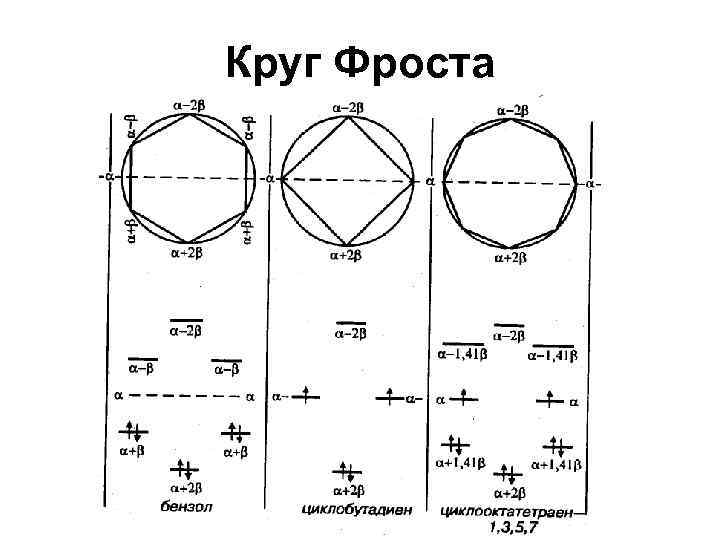
Круг Фроста
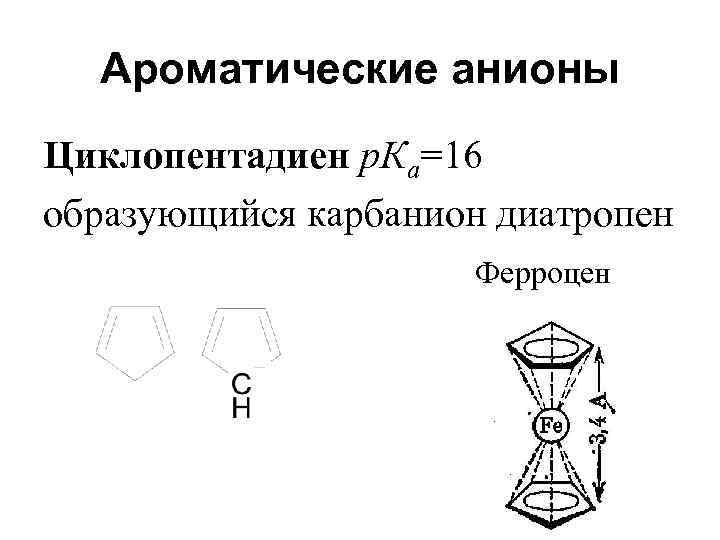
Ароматические анионы Циклопентадиен р. Ка=16 образующийся карбанион диатропен Ферроцен
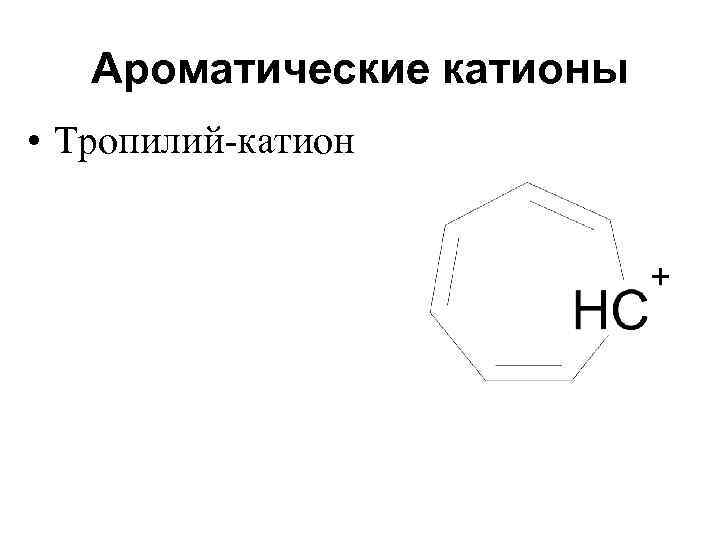
Ароматические катионы • Тропилий-катион
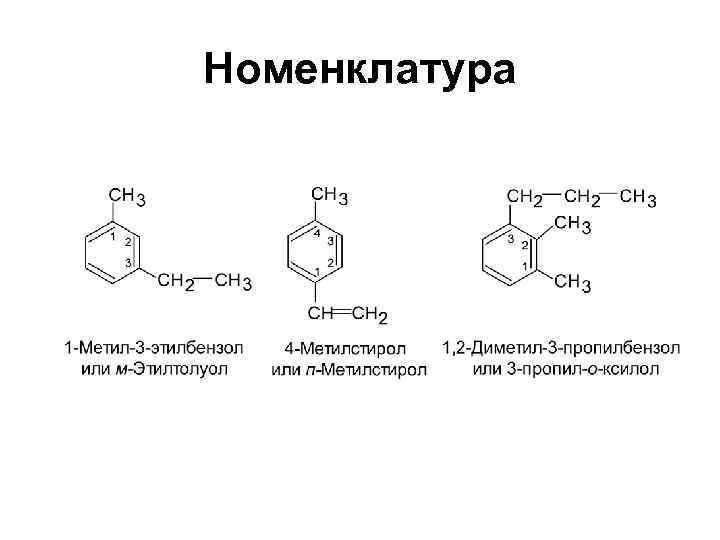
Номенклатура
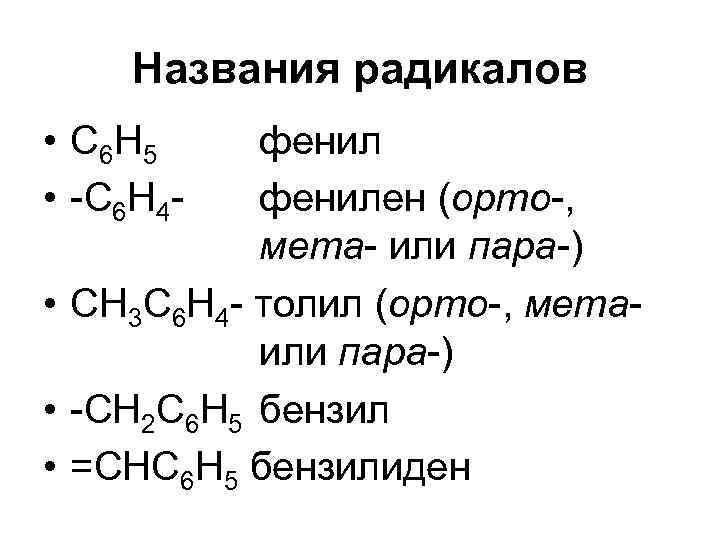
Названия радикалов • С 6 Н 5 • -С 6 Н 4 - фенилен (орто-, мета- или пара-) • СН 3 С 6 Н 4 - толил (орто-, мета- или пара-) • -СН 2 С 6 Н 5 бензил • =СНС 6 Н 5 бензилиден

Изомерия • Положения заместителей (не менее двух) • Структуры заместителя

Физические свойства • Бензол и его ближайшие гомологи – жидкости • Обладают специфическим резким запахом • Температура кипения бензола (80 о. С) выше температуры кипения гексана (68, 8 о. С) • Каждая новая группа СН 2 повышает температуру на 30 о. С

Физические свойства • Плотность углеводородов ароматического ряда выше плотностей углеводородов жирного и алициклического рядов • Ароматические углеводороды почти нерастворимы в воде • Они являются ядовитыми веществами

Химические свойства • Более характерны реакции замещения (электрофильного) чем присоединения
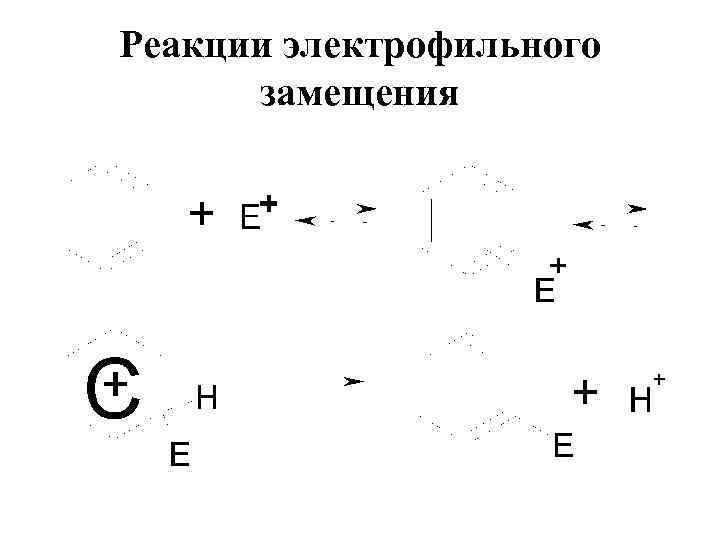
Реакции электрофильного замещения
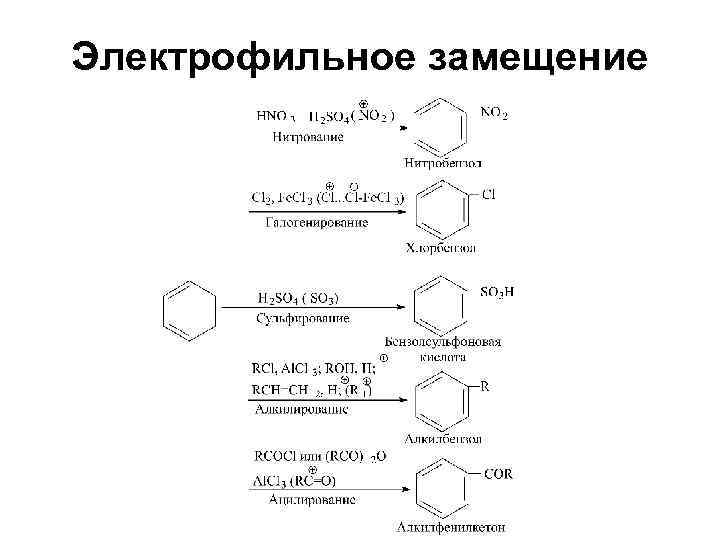
Электрофильное замещение
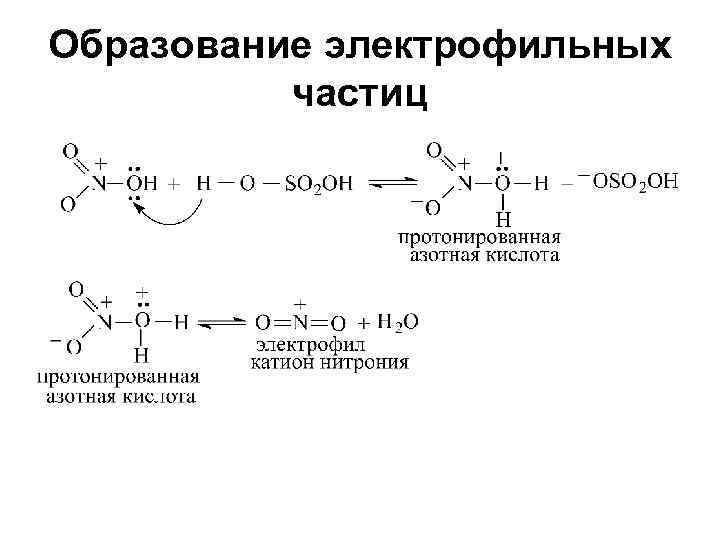
Образование электрофильных частиц

Правила ориентации • Место вступления нового заместителя определяется природой имеющегося заместителя

Заместители • Электродонорные (Активирующие группы, под их влиянием повышается реакционная способность кольца по сравнению с бензолом) • Электроноакцепторные (дезактивирующие группы, уменьшающие реакционную способность кольца по сравнению с бензолом)
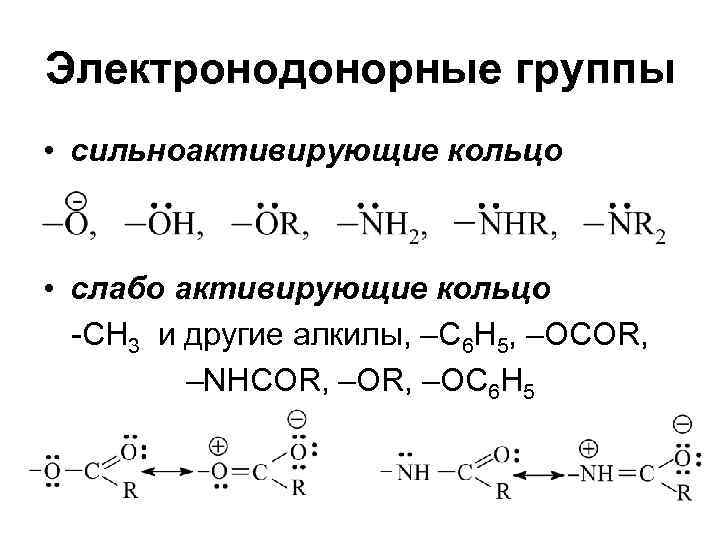
Электронодонорные группы • сильноактивирующие кольцо • слабо активирующие кольцо -CH 3 и другие алкилы, –С 6 Н 5, –OCOR, –NHCOR, –ОR, –OC 6 H 5

Электроноакцепторные группы • Слабо дезактивирующие кольцо:
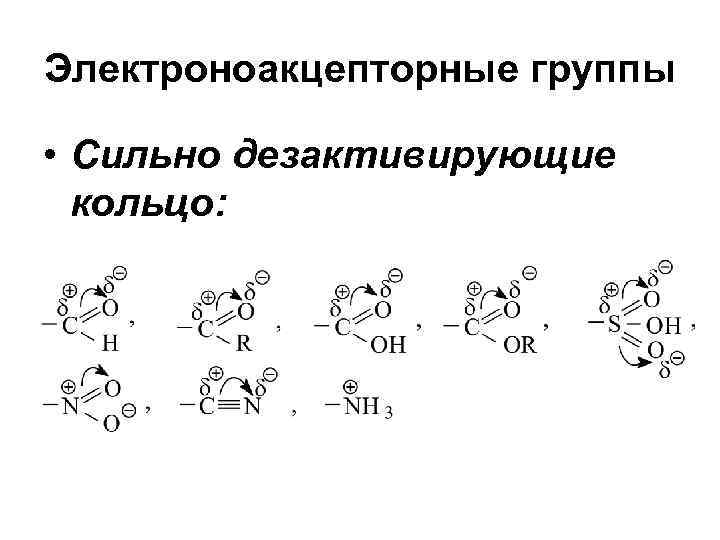
Электроноакцепторные группы • Сильно дезактивирующие кольцо:

Правила ориентации • При наличии двух заместителей разного рода вступление следующего заместителя в кольцо определяет заместитель 1 рода • Если оба ориентанта одного рода, то место вступления определяет более сильный ориентант

Правила ориентации Совместное влияние двух заместителей: • Согласованная ориентация • Несогласованная ориентация
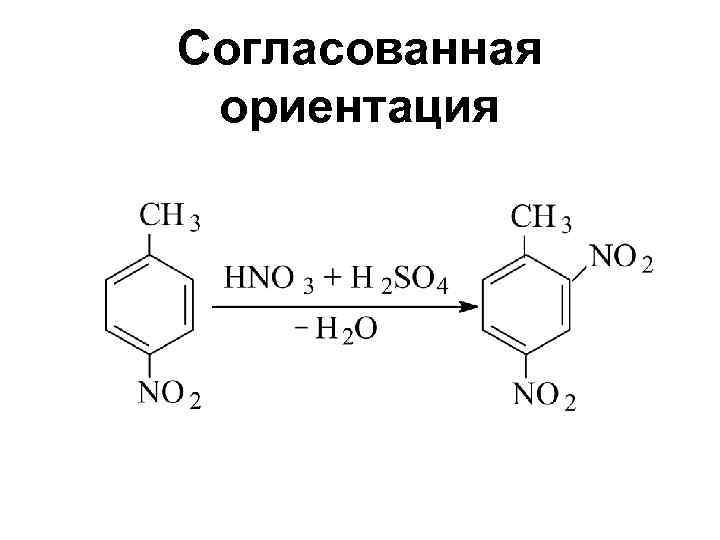
Согласованная ориентация
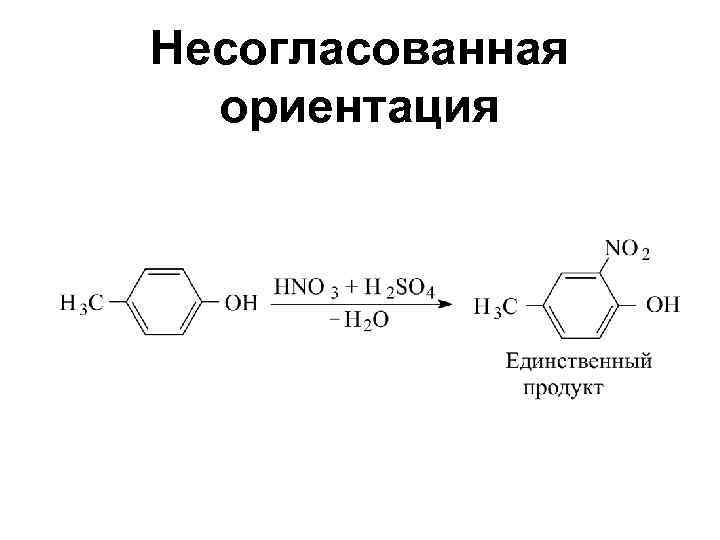
Несогласованная ориентация
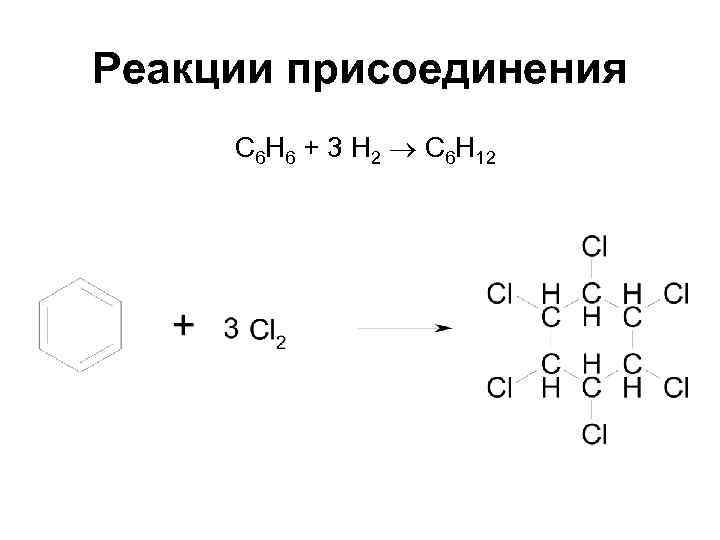
Реакции присоединения С 6 Н 6 + 3 Н 2 С 6 Н 12
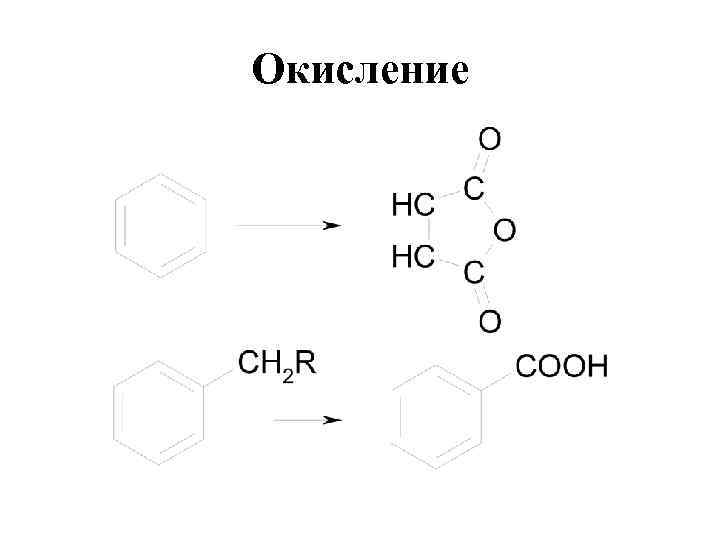
Окисление

Применение в промышленности • В производстве пластмасс, искусственных волокон, каучуков, красителей, лекарственных и биологически активных веществ, моющих средств, взрывчатых веществ, растворителей

Многоядерные арены (конденсированные)
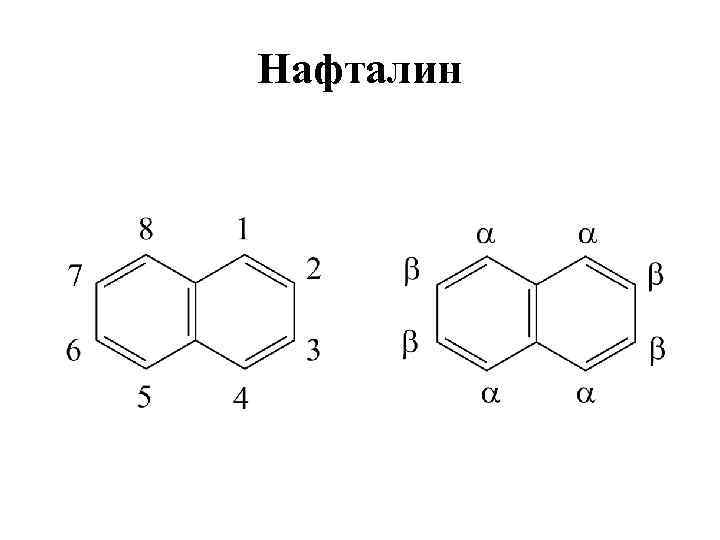
Нафталин
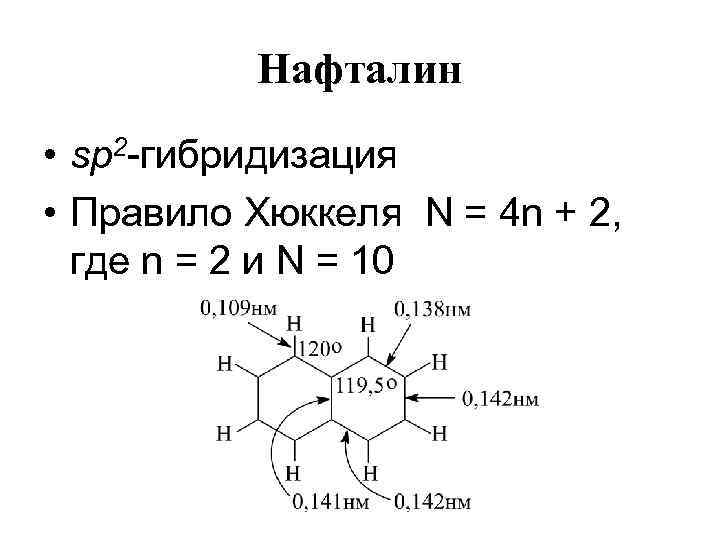
Нафталин • sp 2 -гибридизация • Правило Хюккеля N = 4 n + 2, где n = 2 и N = 10
Нафталин • SEAr
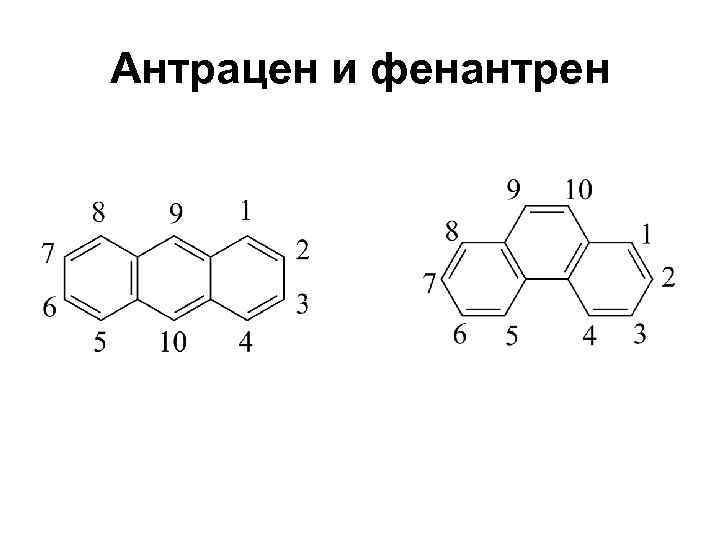
Антрацен и фенантрен
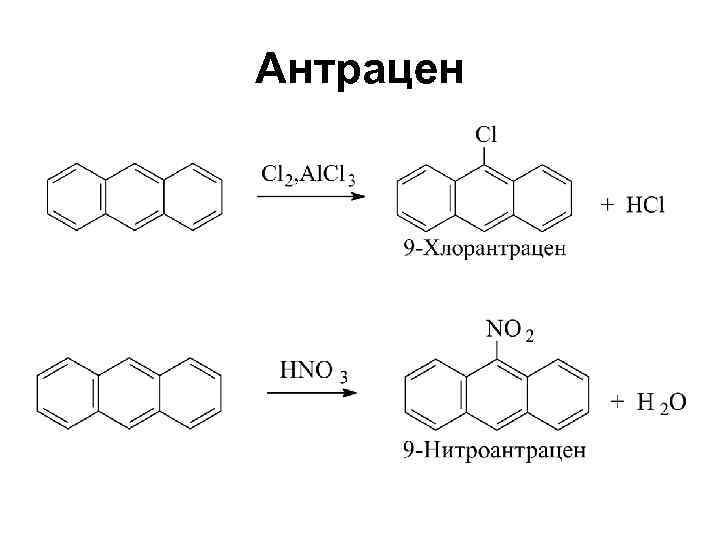
Антрацен
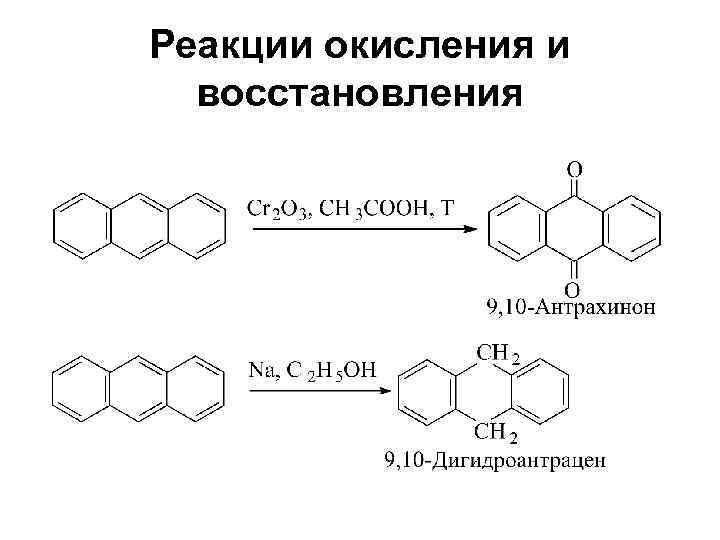
Реакции окисления и восстановления

Гидроксипроизводные углеводородов

Спирты RОН • По количеству групп ОН: одноатомные и многоатомные • По радикалу R: предельные, непредельные, ароматические, фенолы
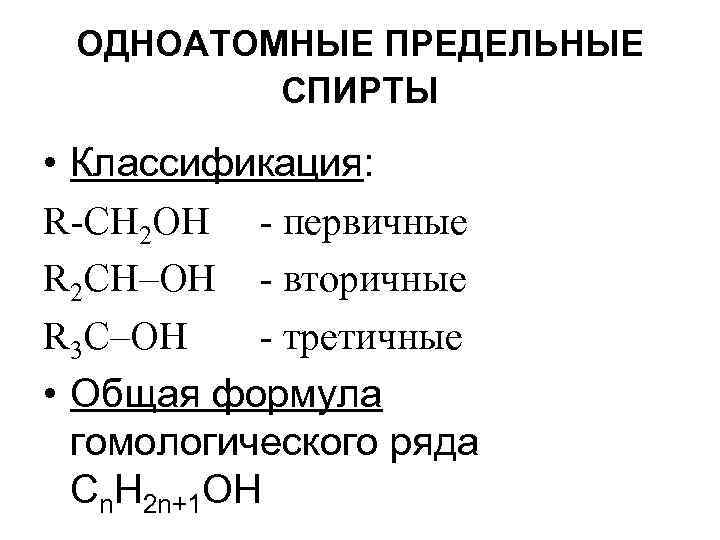
ОДНОАТОМНЫЕ ПРЕДЕЛЬНЫЕ СПИРТЫ • Классификация: R-СН 2 ОН - первичные R 2 СН–ОН - вторичные R 3 С–ОН - третичные • Общая формула гомологического ряда Сn. Н 2 n+1 ОН

Изомерия • Углерод-углеродной цепи • Положения функциональной группы • Межклассовая (с простыми эфирами) • Оптическая (для соединений с асимметрическим атомом углерода)

ОДНОАТОМНЫЕ СПИРТЫ • Номенклатура • СН 3 ОН метанол, карбинол, метиловый спирт • СН 3 -СН 2 ОН этанол, метилкарбинол, этиловый спирт
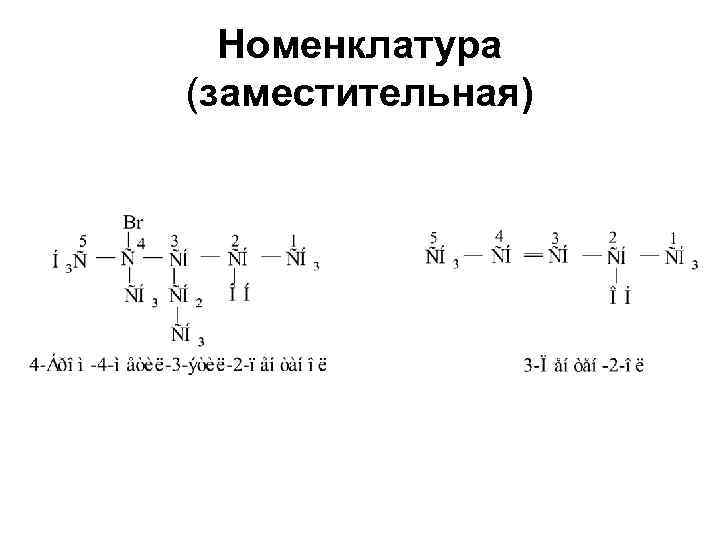
Номенклатура (заместительная)
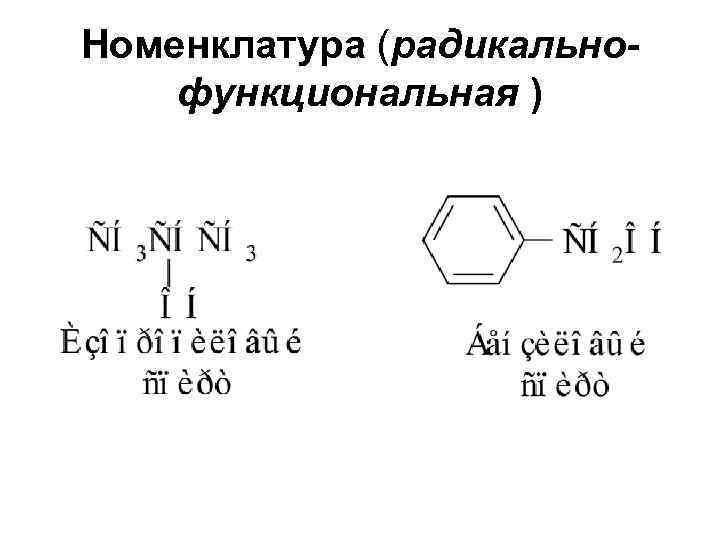
Номенклатура (радикальнофункциональная )

Получение спиртов • Гидролизом галогеналкилов (SN 1 и SN 2) R-I + OH- R-OH + I-

Получение спиртов • Гидратация олефинов (правило Марковникова) • Биохимический способ • Гидрирование окиси углерода
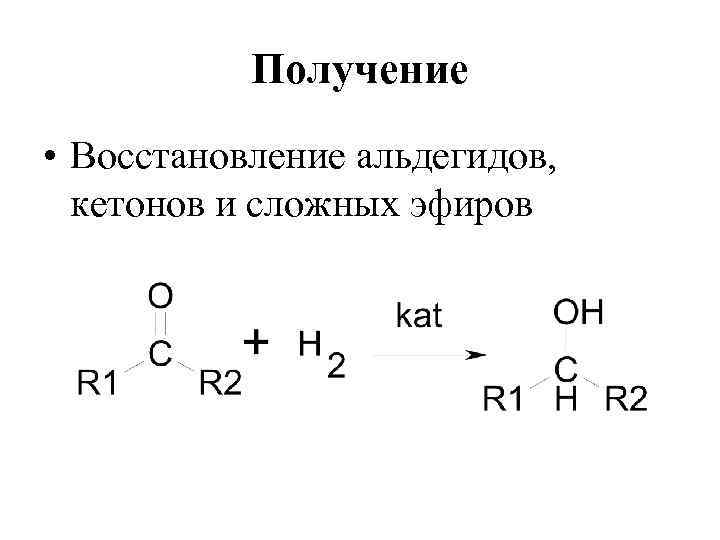
Получение • Восстановление альдегидов, кетонов и сложных эфиров
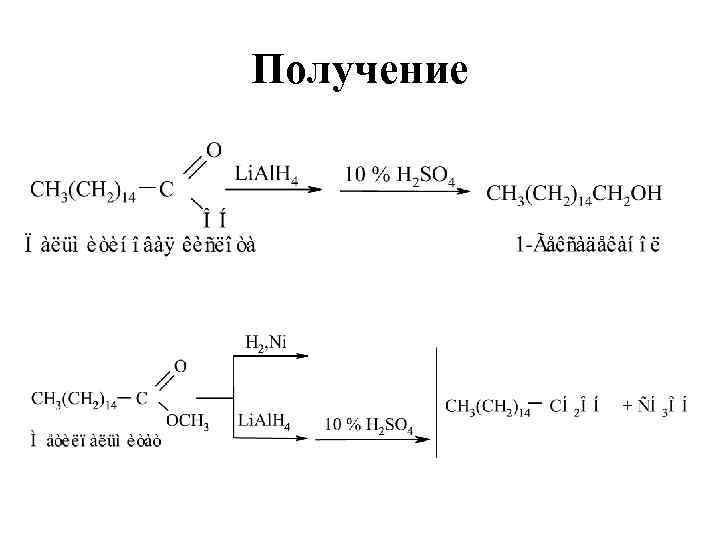
Получение
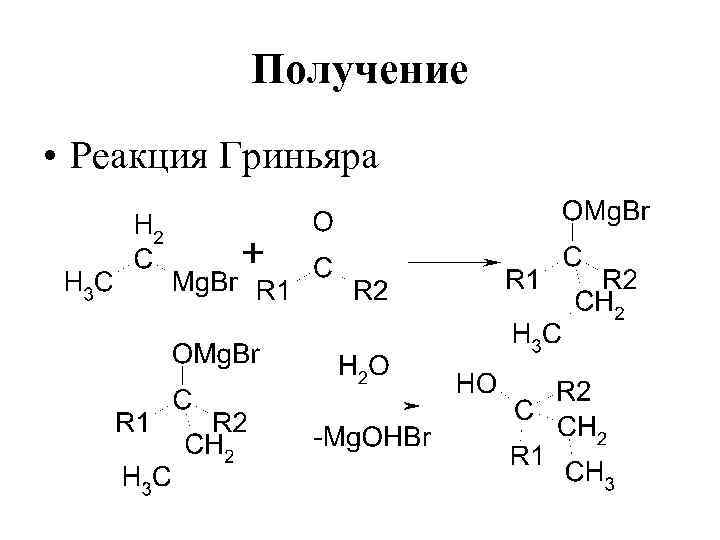
Получение • Реакция Гриньяра

Физические свойства • При нормальных условиях спирты до С 10 - жидкости, начиная с С 11 - твердые тела • Спирты имеют более высокие температуры кипения, плавления и растворимость в воде

Водородная связь

Кислотные свойства

Основания Льюиса
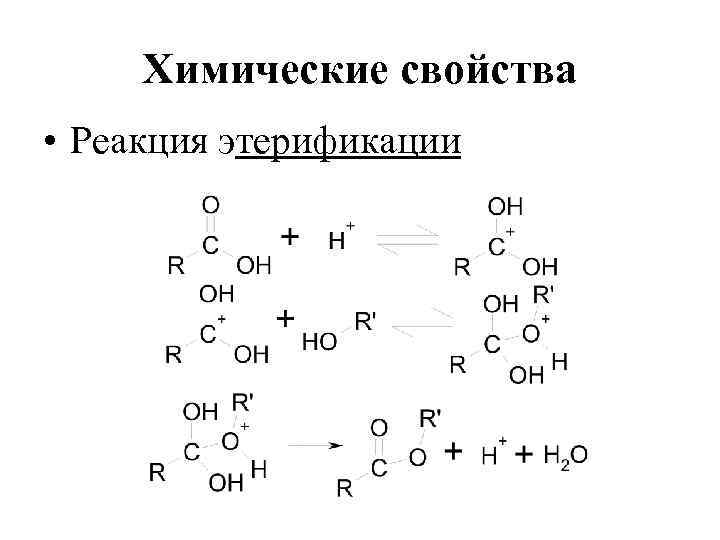
Химические свойства • Реакция этерификации

Химические свойства • Реакция этерификации

Химические свойства • Внутримолекулярная дегидратация (получение алкенов) • Правило Зайцева Элиминирование спиртов происходит с образованием более устойчивого, т. е. более алкилированного алкена

Механизм дегидратации Е 1

Химические свойства • Межмолекулярная дегидратация R-OH + НО-R R-O-R + Н 2 О
SN 2

Химические свойства • Замещение гидроксильной группы (SN) R-OH + НСl R-Cl + Н 2 О Реакционная способность падает в ряду НI > HBr > HCl

Химические свойства

Окисление

Окисление, дегидрирование • Третичные спирты в присутствии кислот превращаются в алкены, которые далее легко окисляются • В щелочной и нейтральной средах третичные спирты не окисляются

Многоатомные спирты • HO-CH 2 -СН 2 -OH этиленгликоль (этандиол-1, 2) • СН 2(ОН)СН 2(ОН) глицерин (1, 2, 3 -пропантриол)

1, 2 -Диолы (гликоли) обычно получают окислением АЛКЕНОВ перманганатом калия или перекисью водорода Глицерин ранее получали как продукт омыления жиров. Сейчас основным источником глицерина служит пропилен

Многоатомные спирты • Обладают более сильными кислотными свойствами – результат влияния соседней гидроксильной группы
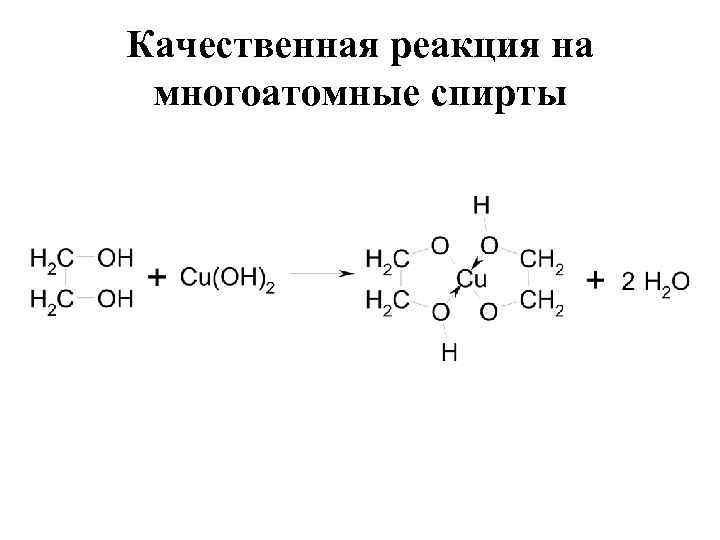
Качественная реакция на многоатомные спирты

Непредельные спирты • СН 2=СН-ОН - виниловый спирт Неустойчив (правило Эльтекова) и перегруппировывается в уксусный альдегид • СН 2=СН-СН 2 -ОН - аллиловый спирт, пропенол, винилкарбинол

ФЕНОЛЫ И АРОМАТИЧЕСКИЕ СПИРТЫ • Ph. OH - гидроксибензол, оксибензол (русское название), фенол (тривиальное название) разделяют: одноатомные, двухатомные и многоатомные фенолы • Ph. CH 2 OH - бензиловый спирт

Номенклатура

Способы получения фенола • Сплавлением натриевой соли бензолсульфокислоты с гидроксидом натрия Ph. SO 3 Na + Na. OH Ph. ONa + Na. HSO 3
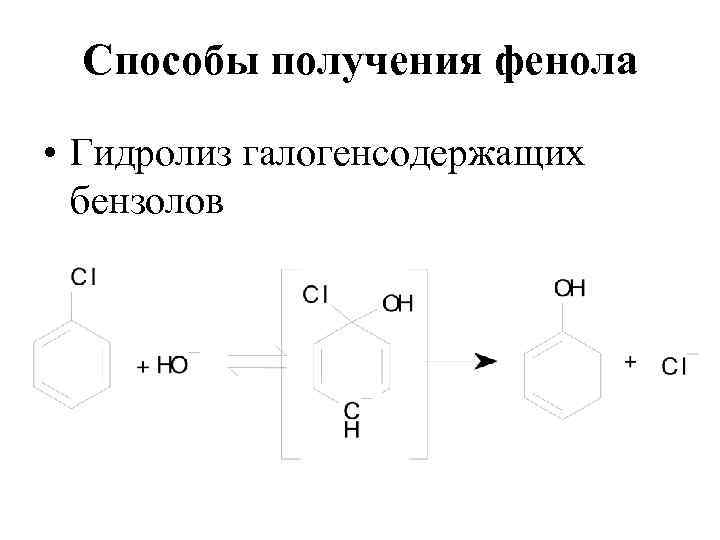
Способы получения фенола • Гидролиз галогенсодержащих бензолов
![Способы получения фенола • Из солей диазония [Ph-N+ N]Cl + Н 2 О Ph. Способы получения фенола • Из солей диазония [Ph-N+ N]Cl + Н 2 О Ph.](https://present5.com/presentation/93795182_65526994/image-75.jpg)
Способы получения фенола • Из солей диазония [Ph-N+ N]Cl + Н 2 О Ph. OH + N 2 + НCl
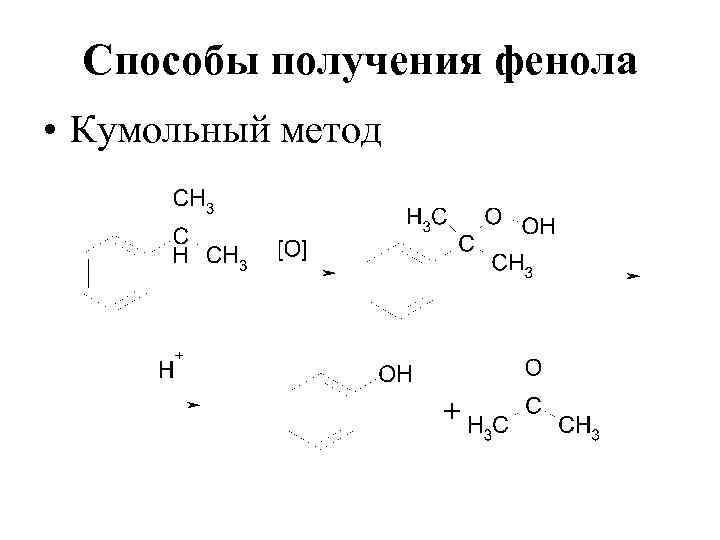
Способы получения фенола • Кумольный метод

Физические свойства • Простейшие фенолы – высококипящие жидкости или низкоплавкие твердые соединения

Кислотность • Фенолы (Ка~10 -10) более сильные кислоты, чем вода (Ка~10 -16) и спирты (Ка~10 -18), но значительно более слабые, чем карбоновые кислоты (Kа~10 -5)

Кислотность

Свойства фенолов

Образование сложных эфиров

Свойства фенолов • Фенольные соединения взаимодействуют с хлоридом железа и образуют характерные цветные комплексы (качественная реакция) • фенол окрашивается в краснофиолетовый цвет, крезол - в синий, резорцин - в темно-фиолетовый

Галогенирование

Галогенирование

Нитрование

Фенолформальдегидные смолы

Окисление

Восстановление

Простые эфиры

Простые эфиры • R-O-R’ • R-О-Ar • Ar-О-Ar’ • Симметричные • Несимметричные
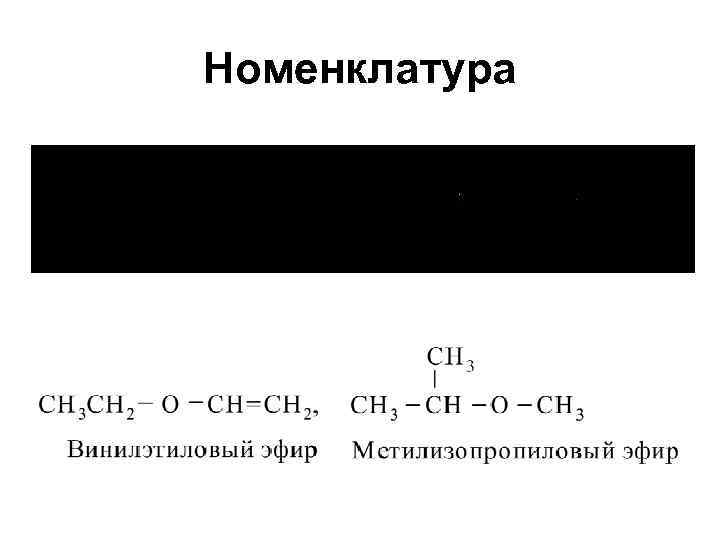
Номенклатура

Номенклатура

Контрольное задание № 3 • • • Какой тип реакций наиболее характерен для аренов? В какое положение ароматического кольца нитруется бензойная кислота? Напишите схемы реакций: Дегидратации 2 -метил-2 -пропанола Бромирования фенола Окисления пирокатехина (1, 2 дигидроксибензола)
Лекция 3-арены-спирты.ppt