UNIVERSITY 3 2012.ppt
- Количество слайдов: 106
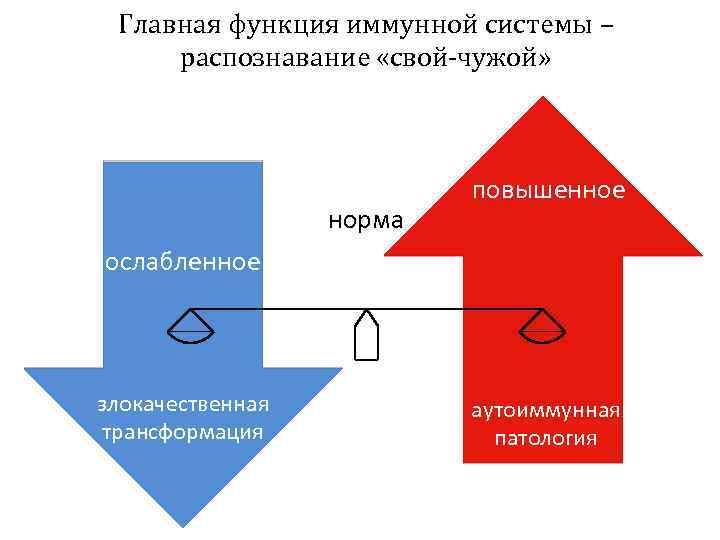 Главная функция иммунной системы – распознавание «свой-чужой» норма повышенное ослабленное злокачественная трансформация аутоиммунная патология
Главная функция иммунной системы – распознавание «свой-чужой» норма повышенное ослабленное злокачественная трансформация аутоиммунная патология
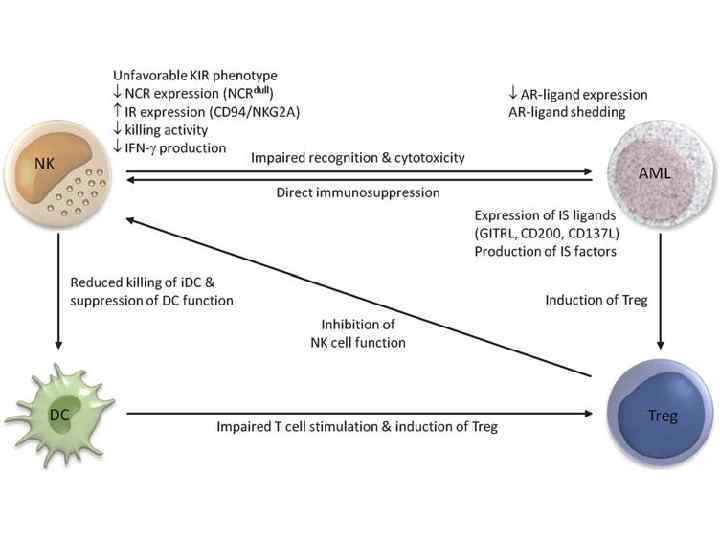
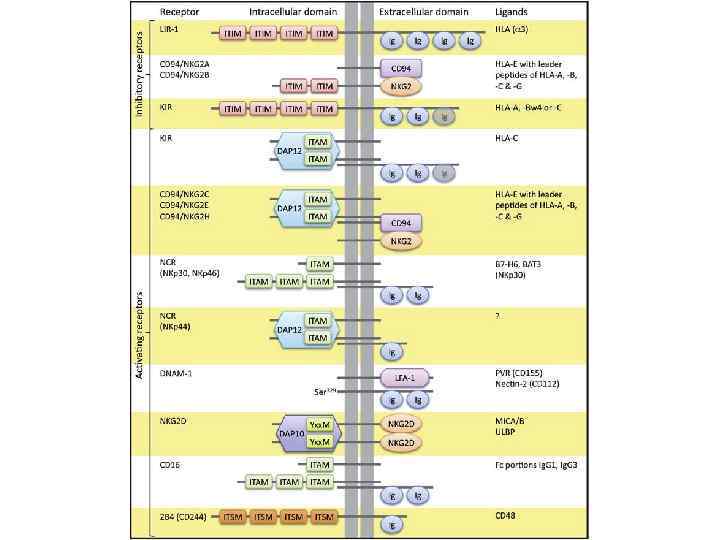
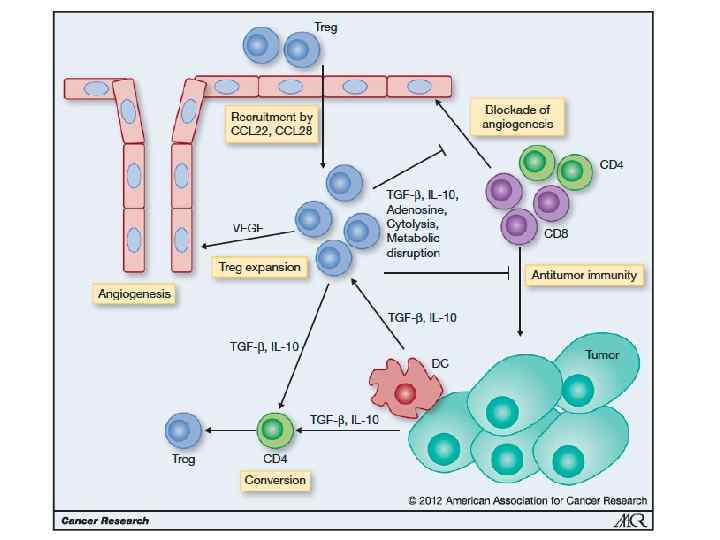
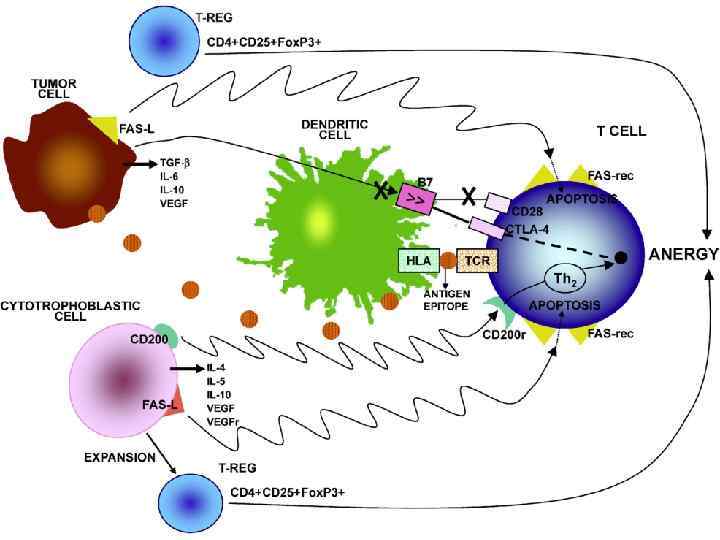
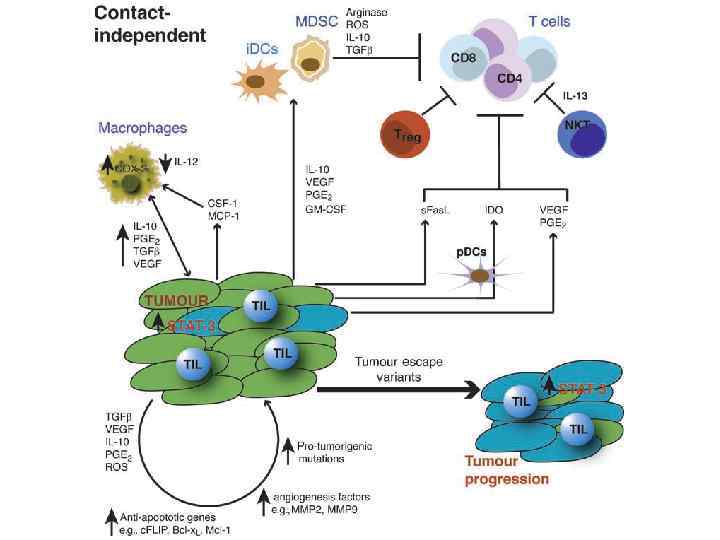
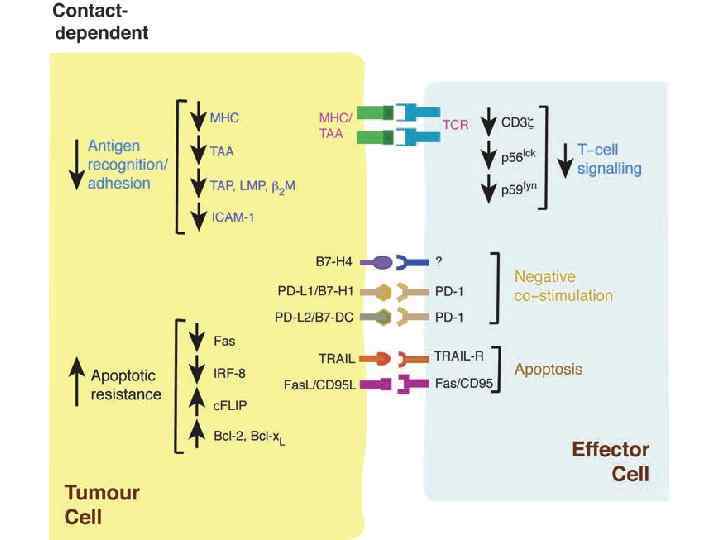
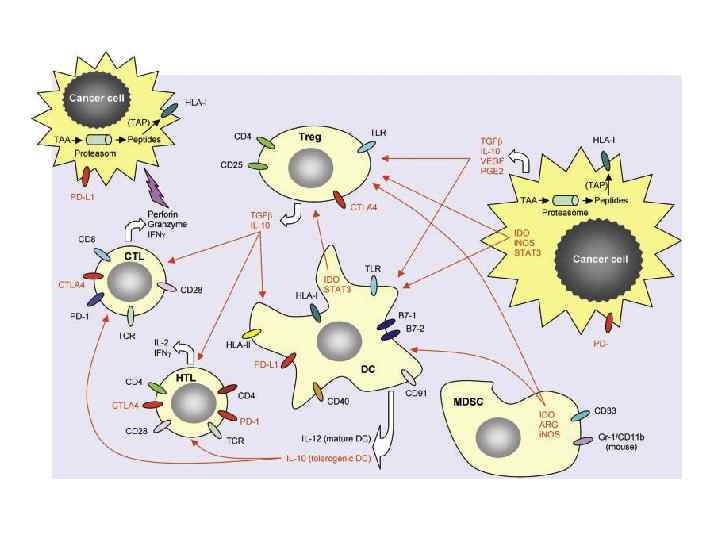
 • • • Несостоятельность противоопухолевого иммунитета: Неполноценность опухолевого АГ Нарушения экспрессии MHC (отсутствуют или изменены) Нарушения костимуляции Феномен усиления опухолевого роста (противоопухолевые АТ защищают опухоль) Синтез супрессорных цитокинов (TGF α, β, IL-10, простагландин E 2) Иммунологическая толерантность к опухолевому АГ Активация Т-лимфоцитов супрессоров (Treg) Опухоль индуцирует апоптоз в микроокружении Нарушение сигнальной трансдукции (нет апоптоза в опухоли) Большое количество опухолевой ткани – недостаточно эффекторов
• • • Несостоятельность противоопухолевого иммунитета: Неполноценность опухолевого АГ Нарушения экспрессии MHC (отсутствуют или изменены) Нарушения костимуляции Феномен усиления опухолевого роста (противоопухолевые АТ защищают опухоль) Синтез супрессорных цитокинов (TGF α, β, IL-10, простагландин E 2) Иммунологическая толерантность к опухолевому АГ Активация Т-лимфоцитов супрессоров (Treg) Опухоль индуцирует апоптоз в микроокружении Нарушение сигнальной трансдукции (нет апоптоза в опухоли) Большое количество опухолевой ткани – недостаточно эффекторов
 Биотерапия опухолей Биологическая терапия – метод лечения злокачественных опухолей, основанный на использовании модификаторов биологического ответа, непосредственно или косвенно влияющих на уменьшение объема опухолевой массы. Под термином "иммунотерапия" подразумевается раздел биотерапии, ограниченный применением методов, воздействующих на эффекторы иммунной системы.
Биотерапия опухолей Биологическая терапия – метод лечения злокачественных опухолей, основанный на использовании модификаторов биологического ответа, непосредственно или косвенно влияющих на уменьшение объема опухолевой массы. Под термином "иммунотерапия" подразумевается раздел биотерапии, ограниченный применением методов, воздействующих на эффекторы иммунной системы.
 Общие свойства методов БТ: - подавляют ростовые факторы, обуславливающие опухолевую прогрессию, - повышают распознаваемость опухолевых клеток клетками иммунной системы, - повышают цитотоксичность клеток иммунной системы, таких как Т-клетки, NK-клетки, макрофаги, - блокируют процессы трансформации клеток в злокачественные,
Общие свойства методов БТ: - подавляют ростовые факторы, обуславливающие опухолевую прогрессию, - повышают распознаваемость опухолевых клеток клетками иммунной системы, - повышают цитотоксичность клеток иммунной системы, таких как Т-клетки, NK-клетки, макрофаги, - блокируют процессы трансформации клеток в злокачественные,
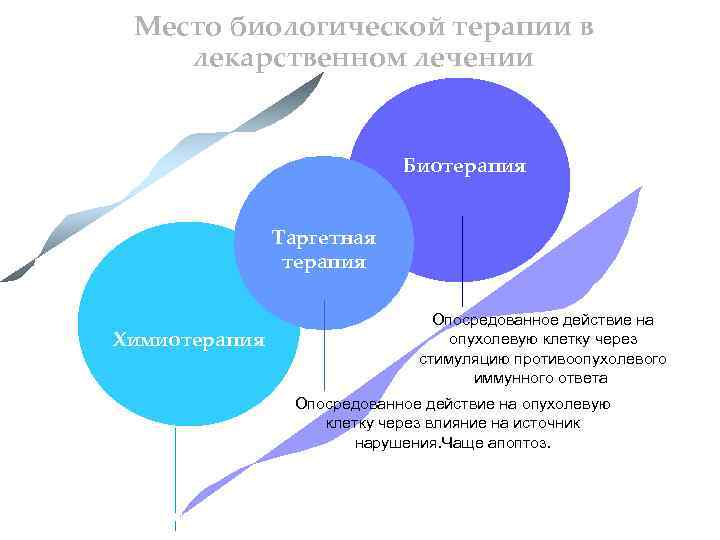 Место биологической терапии в лекарственном лечении Биотерапия Таргетная терапия Опосредованное действие на опухолевую клетку через стимуляцию противоопухолевого иммунного ответа. Химиотерапия Опосредованное действие на опухолевую клетку через влияние на источник нарушения. Чаще апоптоз. Прямое цитотоксическое действие
Место биологической терапии в лекарственном лечении Биотерапия Таргетная терапия Опосредованное действие на опухолевую клетку через стимуляцию противоопухолевого иммунного ответа. Химиотерапия Опосредованное действие на опухолевую клетку через влияние на источник нарушения. Чаще апоптоз. Прямое цитотоксическое действие
 Общие свойства методов БТ: - регулируют апоптоз, - блокируют неоангиогенез - блокируют некоторые регуляторные системы иммунной системы, ответственные за иммуносупрессию, - снижают риск метастазирования, - повышают восстановление числа иммунокомпетентных клеток после воздействия химио- или лучевой терапии.
Общие свойства методов БТ: - регулируют апоптоз, - блокируют неоангиогенез - блокируют некоторые регуляторные системы иммунной системы, ответственные за иммуносупрессию, - снижают риск метастазирования, - повышают восстановление числа иммунокомпетентных клеток после воздействия химио- или лучевой терапии.
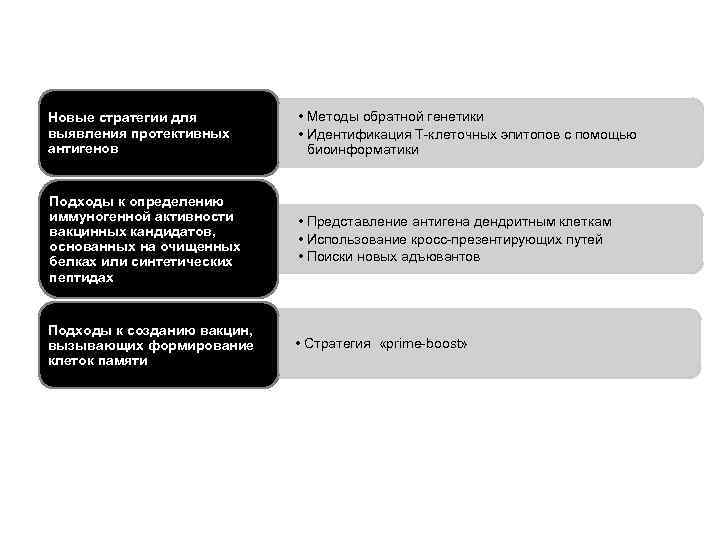 Новые стратегии для выявления протективных антигенов • Методы обратной генетики • Идентификация Т-клеточных эпитопов с помощью биоинформатики Подходы к определению иммуногенной активности вакцинных кандидатов, основанных на очищенных белках или синтетических пептидах • Представление антигена дендритным клеткам • Использование кросс-презентирующих путей • Поиски новых адъювантов Подходы к созданию вакцин, вызывающих формирование клеток памяти • Стратегия «prime-boost»
Новые стратегии для выявления протективных антигенов • Методы обратной генетики • Идентификация Т-клеточных эпитопов с помощью биоинформатики Подходы к определению иммуногенной активности вакцинных кандидатов, основанных на очищенных белках или синтетических пептидах • Представление антигена дендритным клеткам • Использование кросс-презентирующих путей • Поиски новых адъювантов Подходы к созданию вакцин, вызывающих формирование клеток памяти • Стратегия «prime-boost»
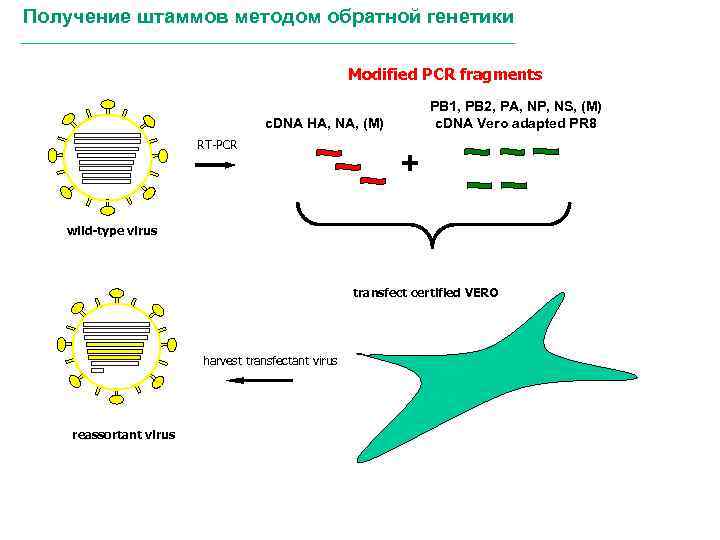 Получение штаммов методом обратной генетики Modified PCR fragments PB 1, PB 2, PA, NP, NS, (M) c. DNA Vero adapted PR 8 c. DNA HA, NA, (M) RT-PCR + wild-type virus transfect certified VERO harvest transfectant virus reassortant virus
Получение штаммов методом обратной генетики Modified PCR fragments PB 1, PB 2, PA, NP, NS, (M) c. DNA Vero adapted PR 8 c. DNA HA, NA, (M) RT-PCR + wild-type virus transfect certified VERO harvest transfectant virus reassortant virus
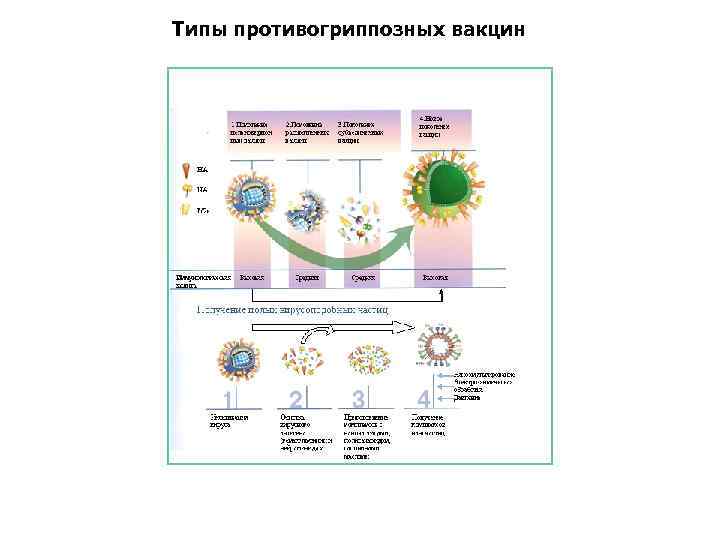 Типы противогриппозных вакцин
Типы противогриппозных вакцин
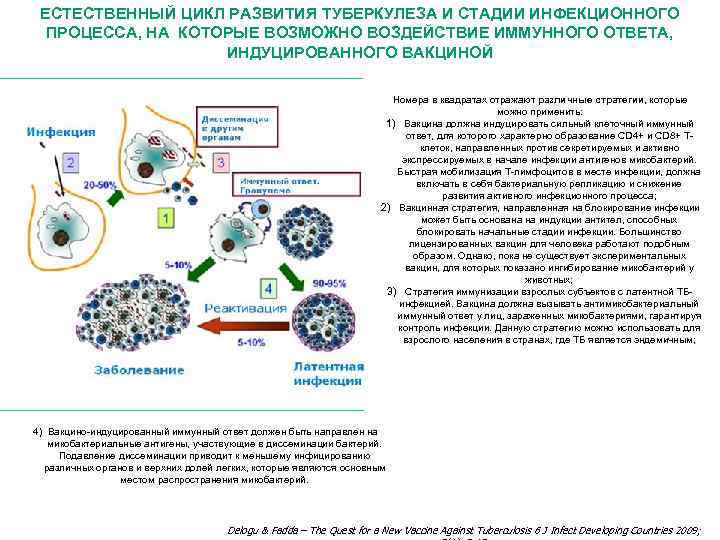 ЕСТЕСТВЕННЫЙ ЦИКЛ РАЗВИТИЯ ТУБЕРКУЛЕЗА И СТАДИИ ИНФЕКЦИОННОГО ПРОЦЕССА, НА КОТОРЫЕ ВОЗМОЖНО ВОЗДЕЙСТВИЕ ИММУННОГО ОТВЕТА, ИНДУЦИРОВАННОГО ВАКЦИНОЙ Номера в квадратах отражают различные стратегии, которые можно применить: 1) Вакцина должна индуцировать сильный клеточный иммунный ответ, для которого характерно образование CD 4+ и CD 8+ Тклеток, направленных против секретируемых и активно экспрессируемых в начале инфекции антигенов микобактерий. Быстрая мобилизация Т-лимфоцитов в месте инфекции, должна включать в себя бактериальную репликацию и снижение развития активного инфекционного процесса; 2) Вакцинная стратегия, направленная на блокирование инфекции может быть основана на индукции антител, способных блокировать начальные стадии инфекции. Большинство лицензированных вакцин для человека работают подобным образом. Однако, пока не существует экспериментальных вакцин, для которых показано ингибирование микобактерий у животных; 3) Стратегия иммунизации взрослых субъектов с латентной ТБинфекцией. Вакцина должна вызывать антимикобактериальный иммунный ответ у лиц, зараженных микобактериями, гарантируя контроль инфекции. Данную стратегию можно использовать для взрослого населения в странах, где ТБ является эндемичным; 4) Вакцино-индуцированный иммунный ответ должен быть направлен на микобактериальные антигены, участвующие в диссеминации бактерий. Подавление диссеминации приводит к меньшему инфицированию различных органов и верхних долей легких, которые являются основным местом распространения микобактерий. Delogu & Fadda – The Quest for a New Vaccine Against Tuberculosis 6 J Infect Developing Countries 2009;
ЕСТЕСТВЕННЫЙ ЦИКЛ РАЗВИТИЯ ТУБЕРКУЛЕЗА И СТАДИИ ИНФЕКЦИОННОГО ПРОЦЕССА, НА КОТОРЫЕ ВОЗМОЖНО ВОЗДЕЙСТВИЕ ИММУННОГО ОТВЕТА, ИНДУЦИРОВАННОГО ВАКЦИНОЙ Номера в квадратах отражают различные стратегии, которые можно применить: 1) Вакцина должна индуцировать сильный клеточный иммунный ответ, для которого характерно образование CD 4+ и CD 8+ Тклеток, направленных против секретируемых и активно экспрессируемых в начале инфекции антигенов микобактерий. Быстрая мобилизация Т-лимфоцитов в месте инфекции, должна включать в себя бактериальную репликацию и снижение развития активного инфекционного процесса; 2) Вакцинная стратегия, направленная на блокирование инфекции может быть основана на индукции антител, способных блокировать начальные стадии инфекции. Большинство лицензированных вакцин для человека работают подобным образом. Однако, пока не существует экспериментальных вакцин, для которых показано ингибирование микобактерий у животных; 3) Стратегия иммунизации взрослых субъектов с латентной ТБинфекцией. Вакцина должна вызывать антимикобактериальный иммунный ответ у лиц, зараженных микобактериями, гарантируя контроль инфекции. Данную стратегию можно использовать для взрослого населения в странах, где ТБ является эндемичным; 4) Вакцино-индуцированный иммунный ответ должен быть направлен на микобактериальные антигены, участвующие в диссеминации бактерий. Подавление диссеминации приводит к меньшему инфицированию различных органов и верхних долей легких, которые являются основным местом распространения микобактерий. Delogu & Fadda – The Quest for a New Vaccine Against Tuberculosis 6 J Infect Developing Countries 2009;
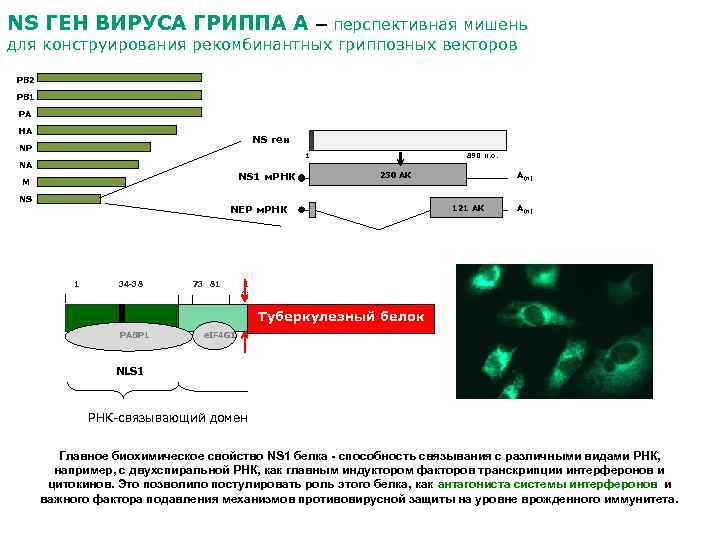 NS ГЕН ВИРУСА ГРИППА А – перспективная мишень для конструирования рекомбинантных гриппозных векторов PB 2 PB 1 PA HA NS ген NP 1 890 н. о. NA 230 АК NS 1 м. РНК M NS А(n) 121 АК NEP м. РНК 1 34 -38 73 81 113 237 142 186 А(n) 216 -221 PDZ-связывающий домен Туберкулезный белок PABP 1 e. IF 4 GI NLS 1 РНК-связывающий домен Сигнал экспорта из клеточного ядра NES 30 k. Да CPSF PABPII Сигнал ядерной локализации NLS 2 Эффекторный домен Главное биохимическое свойство NS 1 белка - способность связывания с различными видами РНК, например, с двухспиральной РНК, как главным индуктором факторов транскрипции интерферонов и цитокинов. Это позволило постулировать роль этого белка, как антагониста системы интерферонов и важного фактора подавления механизмов противовирусной защиты на уровне врожденного иммунитета.
NS ГЕН ВИРУСА ГРИППА А – перспективная мишень для конструирования рекомбинантных гриппозных векторов PB 2 PB 1 PA HA NS ген NP 1 890 н. о. NA 230 АК NS 1 м. РНК M NS А(n) 121 АК NEP м. РНК 1 34 -38 73 81 113 237 142 186 А(n) 216 -221 PDZ-связывающий домен Туберкулезный белок PABP 1 e. IF 4 GI NLS 1 РНК-связывающий домен Сигнал экспорта из клеточного ядра NES 30 k. Да CPSF PABPII Сигнал ядерной локализации NLS 2 Эффекторный домен Главное биохимическое свойство NS 1 белка - способность связывания с различными видами РНК, например, с двухспиральной РНК, как главным индуктором факторов транскрипции интерферонов и цитокинов. Это позволило постулировать роль этого белка, как антагониста системы интерферонов и важного фактора подавления механизмов противовирусной защиты на уровне врожденного иммунитета.
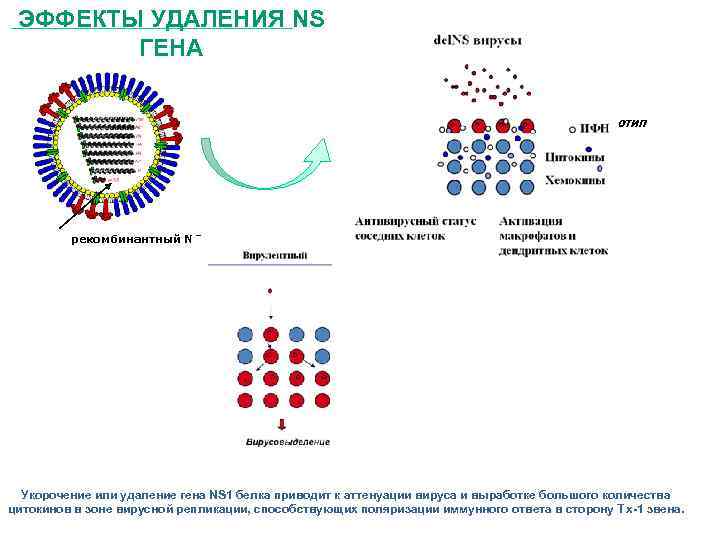 ЭФФЕКТЫ УДАЛЕНИЯ NS ГЕНА Репликативно-неполноценный фенотип Отсутствие вирусовыделения Адъювантный эффект рекомбинантный NS ген Укорочение или удаление гена NS 1 белка приводит к аттенуации вируса и выработке большого количества цитокинов в зоне вирусной репликации, способствующих поляризации иммунного ответа в сторону Тx-1 звена.
ЭФФЕКТЫ УДАЛЕНИЯ NS ГЕНА Репликативно-неполноценный фенотип Отсутствие вирусовыделения Адъювантный эффект рекомбинантный NS ген Укорочение или удаление гена NS 1 белка приводит к аттенуации вируса и выработке большого количества цитокинов в зоне вирусной репликации, способствующих поляризации иммунного ответа в сторону Тx-1 звена.
 Bia. Core T-200 - высочайшая чувствительность - отсутствие метки - количественная характеристика взаимодействия - возможность определить механизм взаимодействия
Bia. Core T-200 - высочайшая чувствительность - отсутствие метки - количественная характеристика взаимодействия - возможность определить механизм взаимодействия
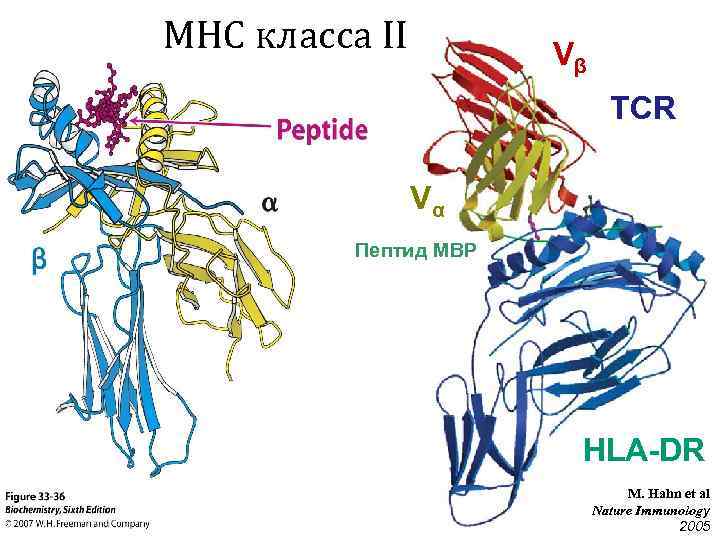 MHC класса II Vβ TCR Vα Пептид MBP HLA-DR M. Hahn et al Nature Immunology 2005
MHC класса II Vβ TCR Vα Пептид MBP HLA-DR M. Hahn et al Nature Immunology 2005
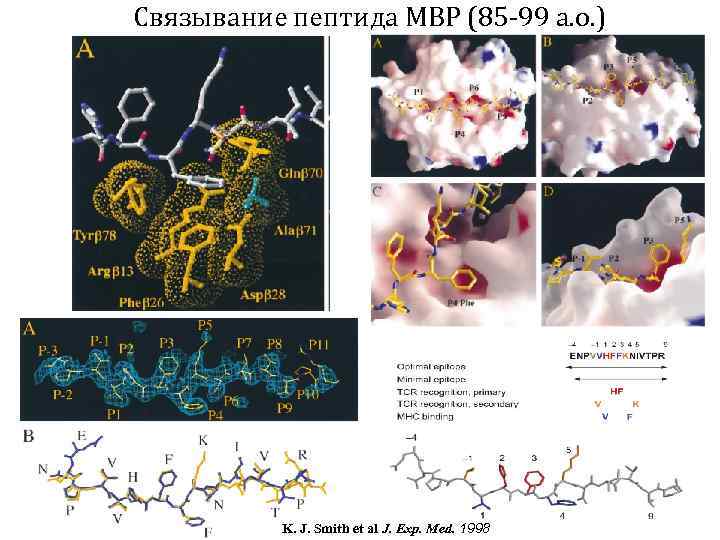 Связывание пептида MBP (85 -99 а. о. ) K. J. Smith et al J. Exp. Med. 1998
Связывание пептида MBP (85 -99 а. о. ) K. J. Smith et al J. Exp. Med. 1998
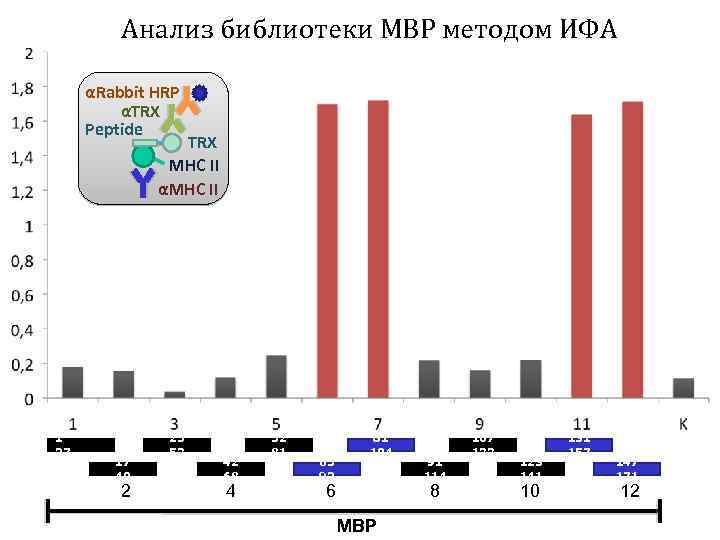 Анализ библиотеки MBP методом ИФА αRabbit HRP αTRX Peptide TRX MHC II αMHC II 1 27 17 40 2 25 53 42 68 4 52 81 65 92 81 104 6 91 114 8 MBP 107 133 123 141 10 131 157 147 171 12
Анализ библиотеки MBP методом ИФА αRabbit HRP αTRX Peptide TRX MHC II αMHC II 1 27 17 40 2 25 53 42 68 4 52 81 65 92 81 104 6 91 114 8 MBP 107 133 123 141 10 131 157 147 171 12
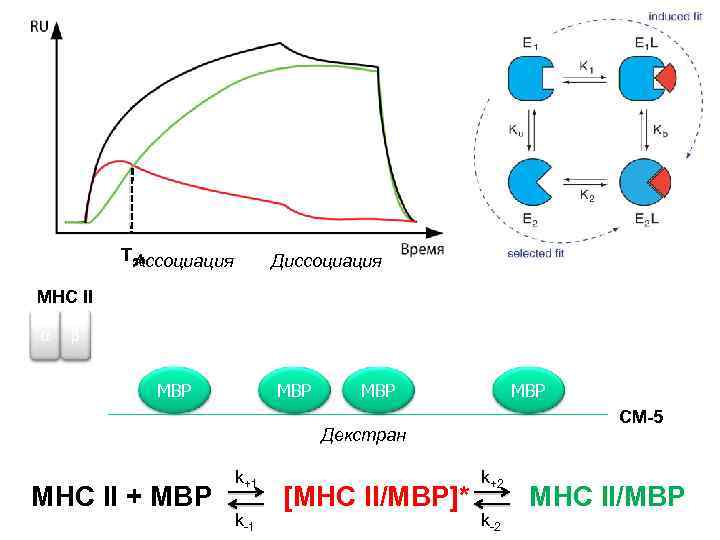 T 50 Ассоциация Диссоциация MHC II α β MBP MBP CM-5 Декстран MHC II + MBP k+1 k-1 [MHC II/MBP]* k+2 k-2 MHC II/MBP
T 50 Ассоциация Диссоциация MHC II α β MBP MBP CM-5 Декстран MHC II + MBP k+1 k-1 [MHC II/MBP]* k+2 k-2 MHC II/MBP
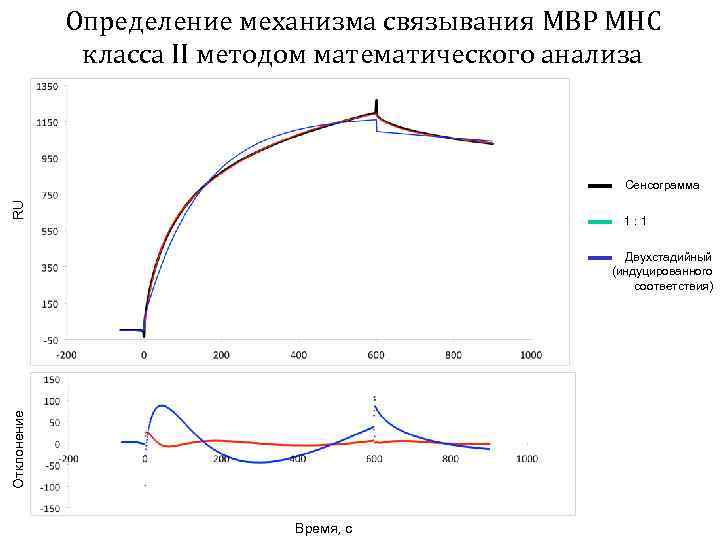 Определение механизма связывания MBP MHC класса II методом математического анализа RU Сенсограмма 1: 1 Отклонение Двухстадийный (индуцированного соответствия) Время, с
Определение механизма связывания MBP MHC класса II методом математического анализа RU Сенсограмма 1: 1 Отклонение Двухстадийный (индуцированного соответствия) Время, с
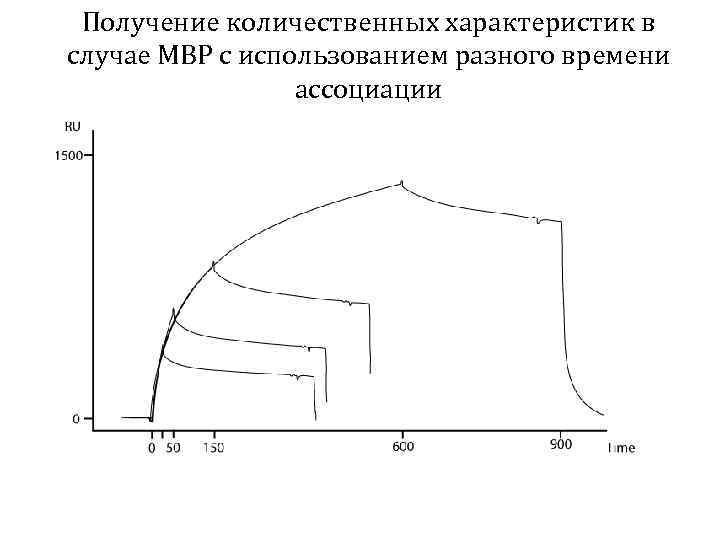 Получение количественных характеристик в случае MBP с использованием разного времени ассоциации
Получение количественных характеристик в случае MBP с использованием разного времени ассоциации
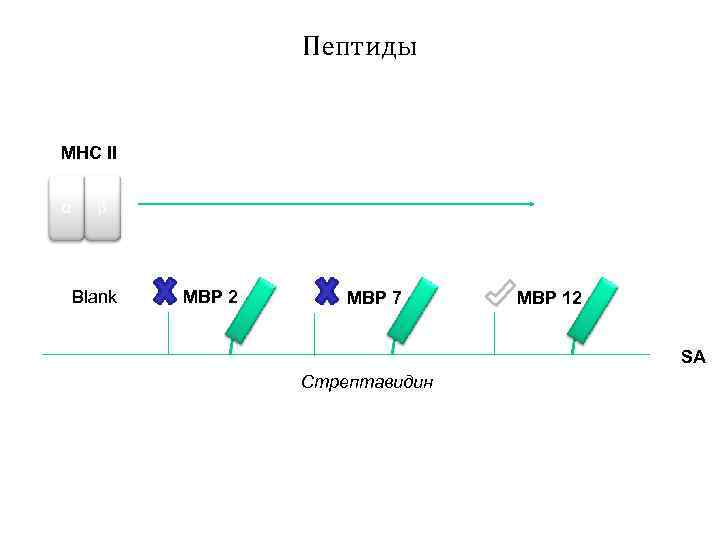 Пептиды MHC II α β Blank MBP 2 MBP 7 MBP 12 SA Стрептавидин
Пептиды MHC II α β Blank MBP 2 MBP 7 MBP 12 SA Стрептавидин
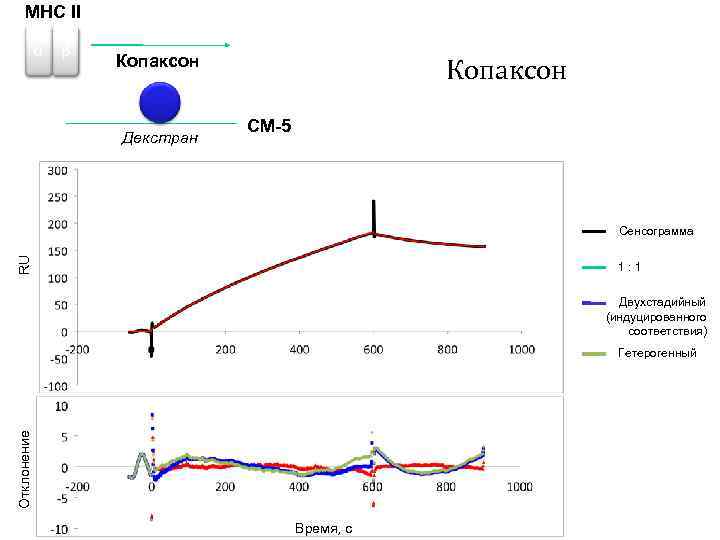 MHC II α β Копаксон Декстран Копаксон CM-5 RU Сенсограмма 1: 1 Двухстадийный (индуцированного соответствия) Отклонение Гетерогенный Время, с
MHC II α β Копаксон Декстран Копаксон CM-5 RU Сенсограмма 1: 1 Двухстадийный (индуцированного соответствия) Отклонение Гетерогенный Время, с
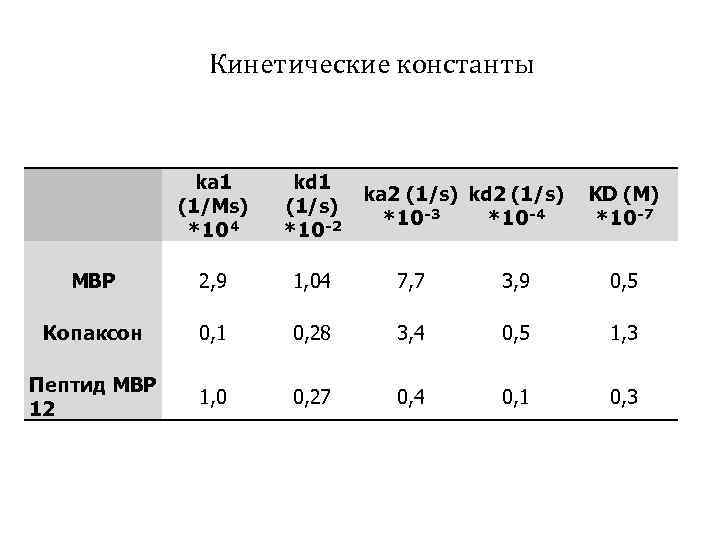 Кинетические константы ka 1 (1/Ms) *104 kd 1 (1/s) *10 -2 MBP 2, 9 1, 04 7, 7 3, 9 0, 5 Копаксон 0, 1 0, 28 3, 4 0, 5 1, 3 Пептид MBP 12 1, 0 0, 27 0, 4 0, 1 0, 3 ka 2 (1/s) kd 2 (1/s) *10 -3 *10 -4 KD (M) *10 -7
Кинетические константы ka 1 (1/Ms) *104 kd 1 (1/s) *10 -2 MBP 2, 9 1, 04 7, 7 3, 9 0, 5 Копаксон 0, 1 0, 28 3, 4 0, 5 1, 3 Пептид MBP 12 1, 0 0, 27 0, 4 0, 1 0, 3 ka 2 (1/s) kd 2 (1/s) *10 -3 *10 -4 KD (M) *10 -7
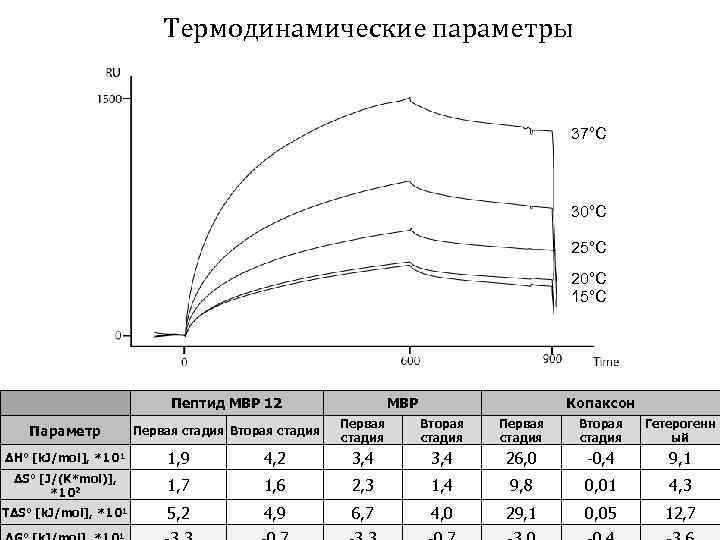 Термодинамические параметры 37°С 30°С 25°С 20°С 15°С Пептид MBP 12 Параметр Первая стадия Вторая стадия MBP Копаксон Первая стадия Вторая стадия Гетерогенн ый ΔH° [k. J/mol], *101 1, 9 4, 2 3, 4 26, 0 -0, 4 9, 1 ΔS° [J/(K*mol)], *102 1, 7 1, 6 2, 3 1, 4 9, 8 0, 01 4, 3 TΔS° [k. J/mol], *101 5, 2 4, 9 6, 7 4, 0 29, 1 0, 05 12, 7 1
Термодинамические параметры 37°С 30°С 25°С 20°С 15°С Пептид MBP 12 Параметр Первая стадия Вторая стадия MBP Копаксон Первая стадия Вторая стадия Гетерогенн ый ΔH° [k. J/mol], *101 1, 9 4, 2 3, 4 26, 0 -0, 4 9, 1 ΔS° [J/(K*mol)], *102 1, 7 1, 6 2, 3 1, 4 9, 8 0, 01 4, 3 TΔS° [k. J/mol], *101 5, 2 4, 9 6, 7 4, 0 29, 1 0, 05 12, 7 1
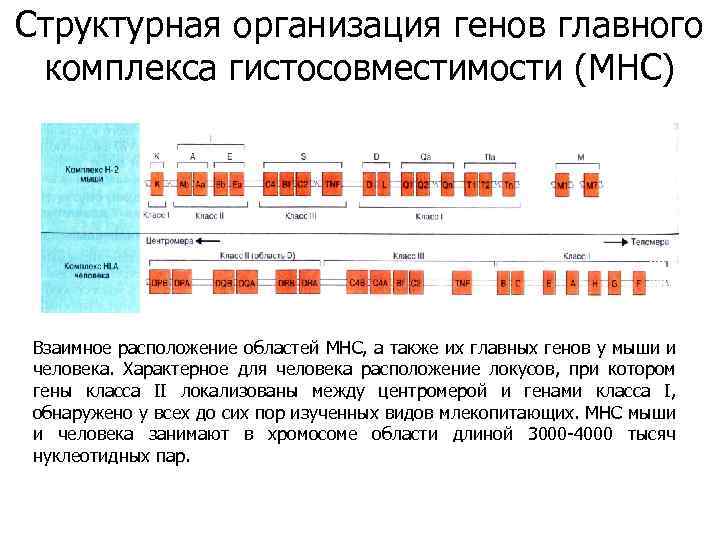 Структурная организация генов главного комплекса гистосовместимости (MHC) Взаимное расположение областей МНС, а также их главных генов у мыши и человека. Характерное для человека расположение локусов, при котором гены класса II локализованы между центромерой и генами класса I, обнаружено у всех до сих пор изученных видов млекопитающих. МНС мыши и человека занимают в хромосоме области длиной 3000 -4000 тысяч нуклеотидных пар.
Структурная организация генов главного комплекса гистосовместимости (MHC) Взаимное расположение областей МНС, а также их главных генов у мыши и человека. Характерное для человека расположение локусов, при котором гены класса II локализованы между центромерой и генами класса I, обнаружено у всех до сих пор изученных видов млекопитающих. МНС мыши и человека занимают в хромосоме области длиной 3000 -4000 тысяч нуклеотидных пар.
 HLA-гены класса I у человека В хромосоме человека гены класса I расположены ближе к теломере, чем гены классов II и III. В дополнение к генам классических трансплантационных антигенов (HLA-A, HLAB и HLA-C) в этом участке идентифицировано несколько «класс l-подобных» генов, вероятно, эквивалентных мышиным генам соответствующих областей. Здесь же содержится ряд других генов, отличных от генов класса I.
HLA-гены класса I у человека В хромосоме человека гены класса I расположены ближе к теломере, чем гены классов II и III. В дополнение к генам классических трансплантационных антигенов (HLA-A, HLAB и HLA-C) в этом участке идентифицировано несколько «класс l-подобных» генов, вероятно, эквивалентных мышиным генам соответствующих областей. Здесь же содержится ряд других генов, отличных от генов класса I.
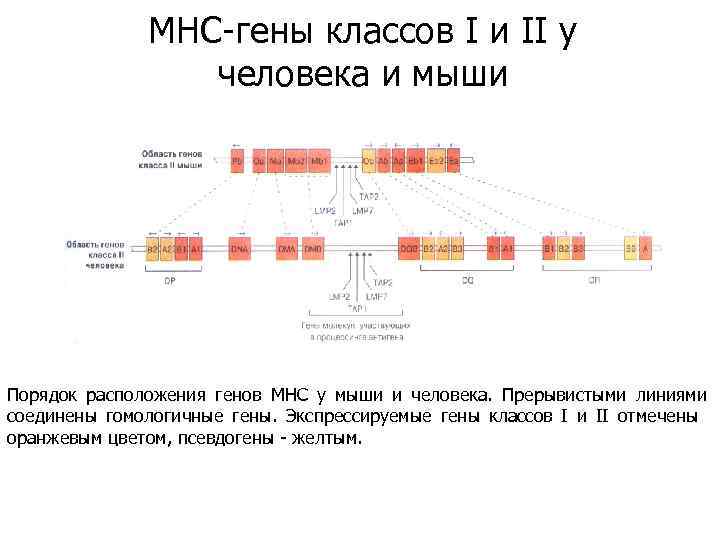 MHC-гены классов I и II у человека и мыши Порядок расположения генов МНС у мыши и человека. Прерывистыми линиями соединены гомологичные гены. Экспрессируемые гены классов I и II отмечены оранжевым цветом, псевдогены - желтым.
MHC-гены классов I и II у человека и мыши Порядок расположения генов МНС у мыши и человека. Прерывистыми линиями соединены гомологичные гены. Экспрессируемые гены классов I и II отмечены оранжевым цветом, псевдогены - желтым.
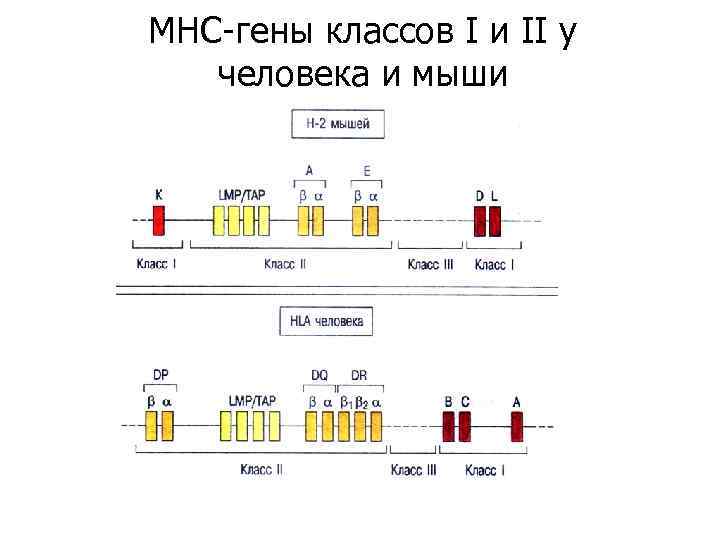 MHC-гены классов I и II у человека и мыши
MHC-гены классов I и II у человека и мыши
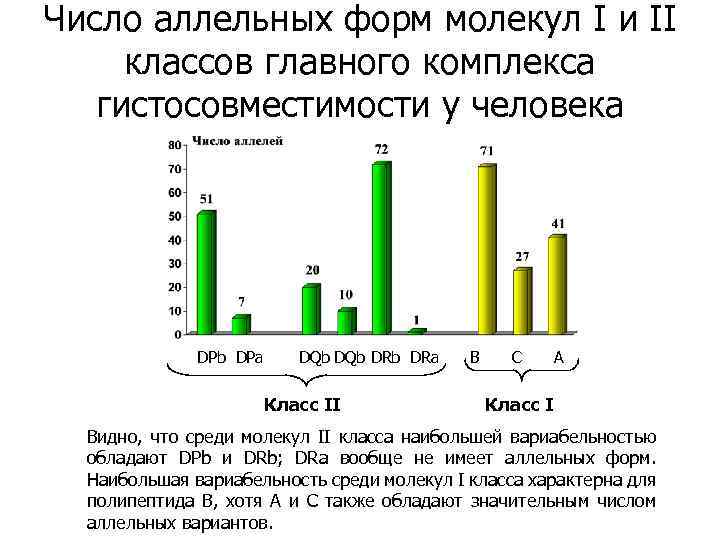 Число аллельных форм молекул I и II классов главного комплекса гистосовместимости у человека DPb DPa DQb DRb DRa Класс II B С A Класс I Видно, что среди молекул II класса наибольшей вариабельностью обладают DPb и DRb; DRa вообще не имеет аллельных форм. Наибольшая вариабельность среди молекул I класса характерна для полипептида В, хотя А и С также обладают значительным числом аллельных вариантов.
Число аллельных форм молекул I и II классов главного комплекса гистосовместимости у человека DPb DPa DQb DRb DRa Класс II B С A Класс I Видно, что среди молекул II класса наибольшей вариабельностью обладают DPb и DRb; DRa вообще не имеет аллельных форм. Наибольшая вариабельность среди молекул I класса характерна для полипептида В, хотя А и С также обладают значительным числом аллельных вариантов.
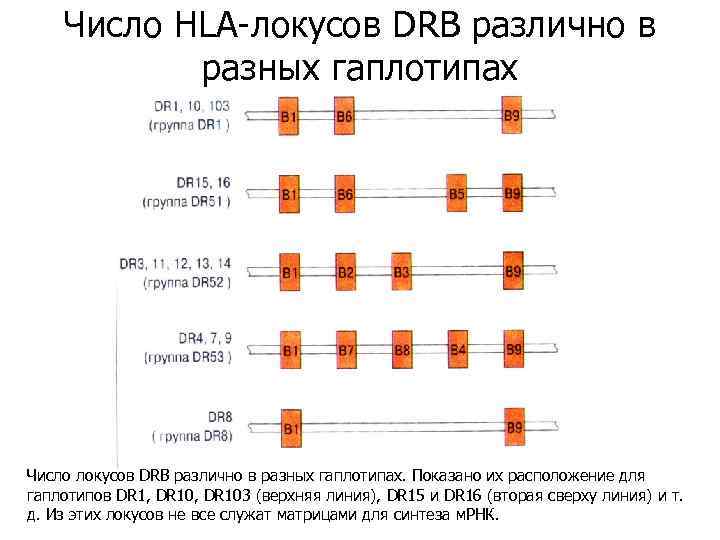 Число HLA-локусов DRB различно в разных гаплотипах Число локусов DRB различно в разных гаплотипах. Показано их расположение для гаплотипов DR 1, DR 103 (верхняя линия), DR 15 и DR 16 (вторая сверху линия) и т. д. Из этих локусов не все служат матрицами для синтеза м. РНК.
Число HLA-локусов DRB различно в разных гаплотипах Число локусов DRB различно в разных гаплотипах. Показано их расположение для гаплотипов DR 1, DR 103 (верхняя линия), DR 15 и DR 16 (вторая сверху линия) и т. д. Из этих локусов не все служат матрицами для синтеза м. РНК.
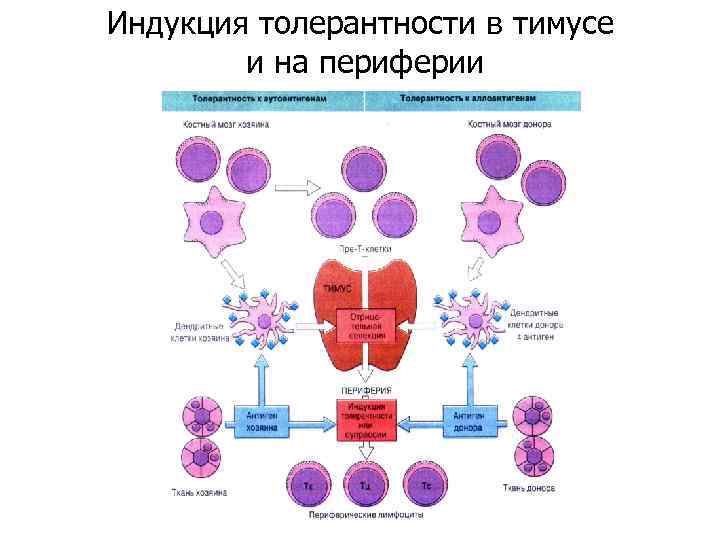 Индукция толерантности в тимусе и на периферии
Индукция толерантности в тимусе и на периферии
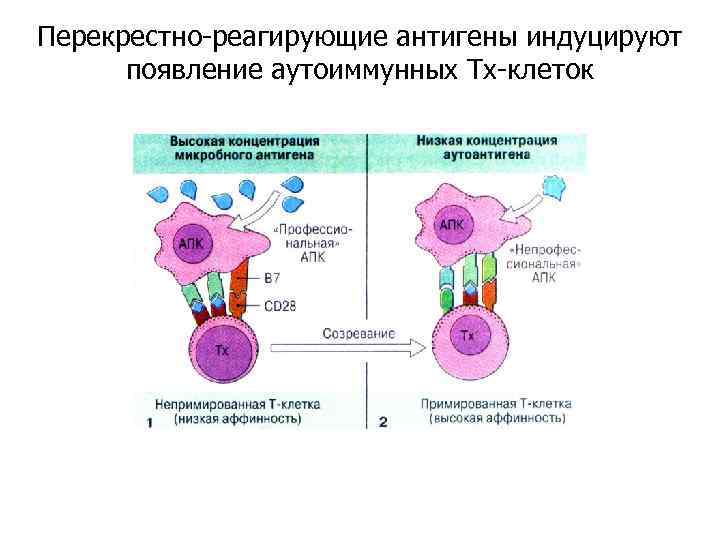 Перекрестно-реагирующие антигены индуцируют появление аутоиммунных Тх-клеток
Перекрестно-реагирующие антигены индуцируют появление аутоиммунных Тх-клеток
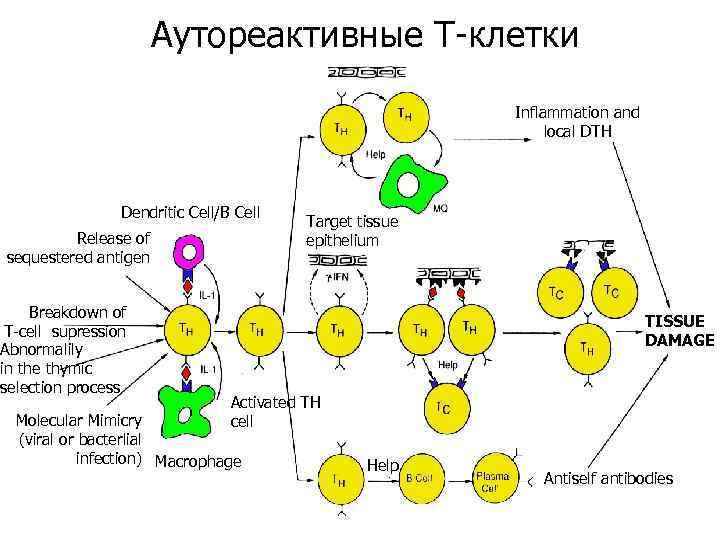 Аутореактивные Т-клетки Inflammation and local DTH Dendritic Cell/B Cell Release of sequestered antigen Breakdown of T-cell supression Abnormalily in the thymic selection process Target tissue epithelium b TISSUE DAMAGE Activated TH cell Molecular Mimicry (viral or bacterlial infection) Macrophage Help Antiself antibodies
Аутореактивные Т-клетки Inflammation and local DTH Dendritic Cell/B Cell Release of sequestered antigen Breakdown of T-cell supression Abnormalily in the thymic selection process Target tissue epithelium b TISSUE DAMAGE Activated TH cell Molecular Mimicry (viral or bacterlial infection) Macrophage Help Antiself antibodies
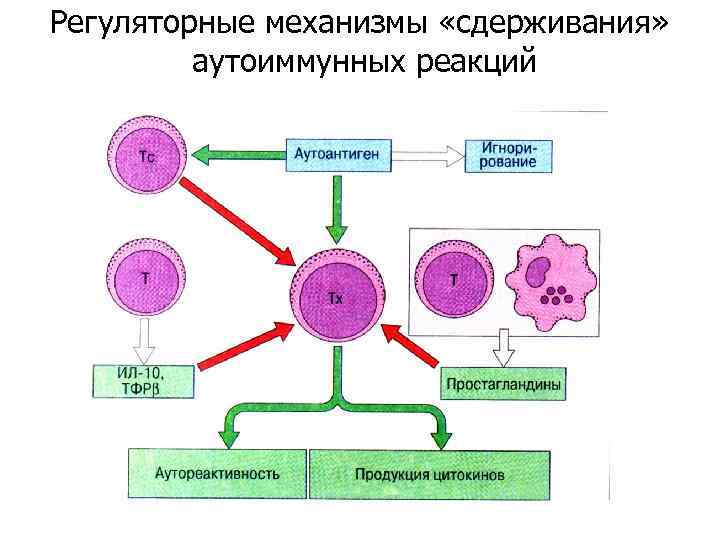 Регуляторные механизмы «сдерживания» аутоиммунных реакций
Регуляторные механизмы «сдерживания» аутоиммунных реакций
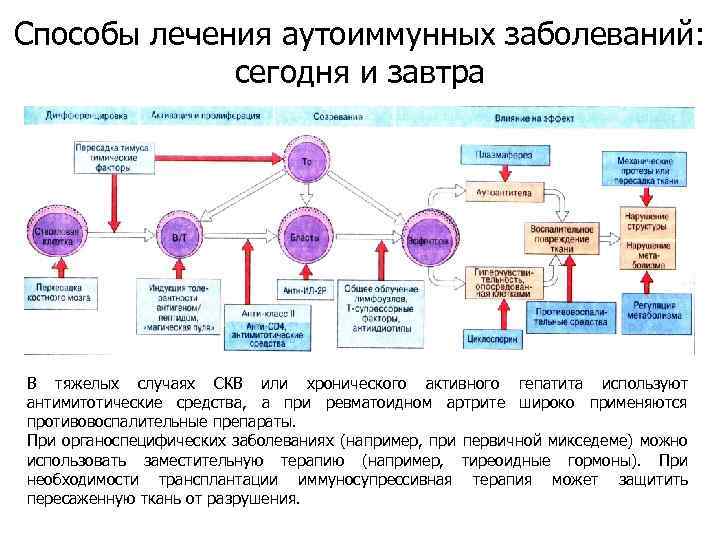 Способы лечения аутоиммунных заболеваний: сегодня и завтра В тяжелых случаях СКВ или хронического активного гепатита используют антимитотические средства, а при ревматоидном артрите широко применяются противовоспалительные препараты. При органоспецифических заболеваниях (например, при первичной микседеме) можно использовать заместительную терапию (например, тиреоидные гормоны). При необходимости трансплантации иммуносупрессивная терапия может защитить пересаженную ткань от разрушения.
Способы лечения аутоиммунных заболеваний: сегодня и завтра В тяжелых случаях СКВ или хронического активного гепатита используют антимитотические средства, а при ревматоидном артрите широко применяются противовоспалительные препараты. При органоспецифических заболеваниях (например, при первичной микседеме) можно использовать заместительную терапию (например, тиреоидные гормоны). При необходимости трансплантации иммуносупрессивная терапия может защитить пересаженную ткань от разрушения.
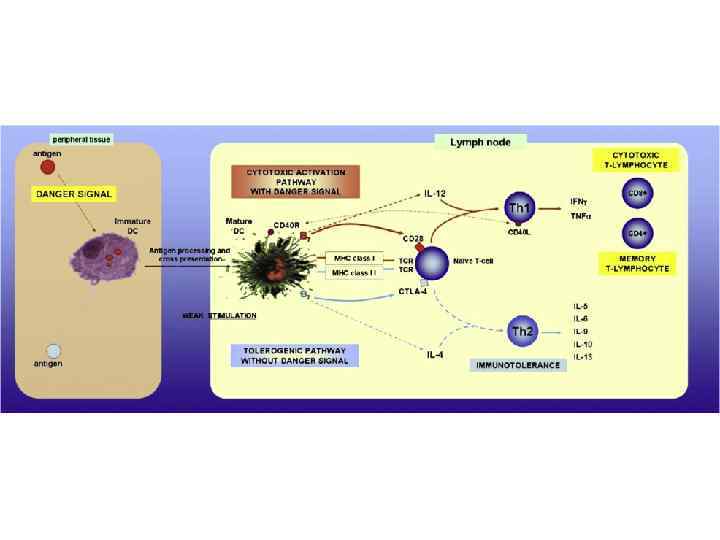
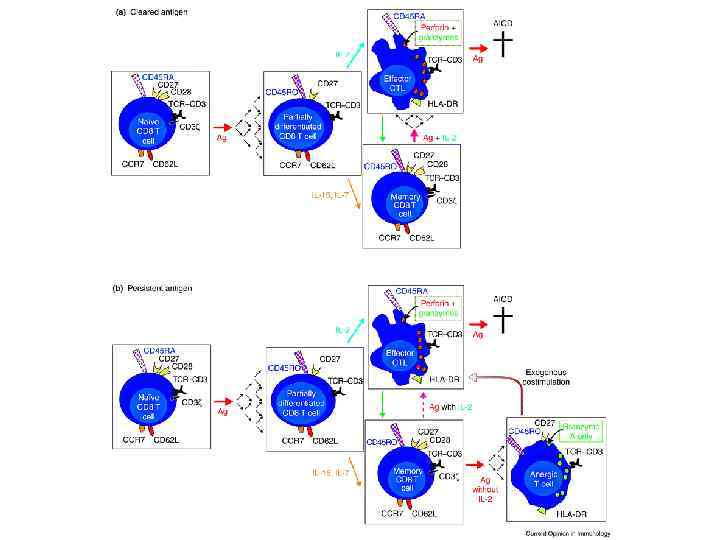
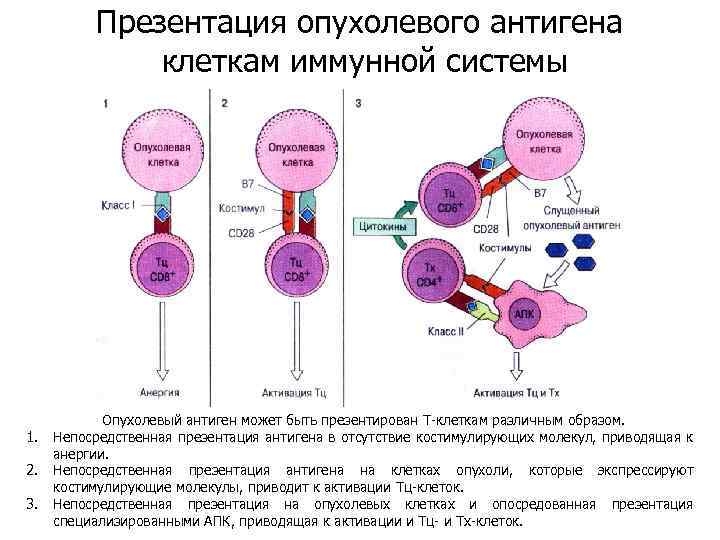 Презентация опухолевого антигена клеткам иммунной системы 1. 2. 3. Опухолевый антиген может быть презентирован Т-клеткам различным образом. Непосредственная презентация антигена в отсутствие костимулирующих молекул, приводящая к анергии. Непосредственная презентация антигена на клетках опухоли, которые экспрессируют костимулирующие молекулы, приводит к активации Тц-клеток. Непосредственная презентация на опухолевых клетках и опосредованная презентация специализированными АПК, приводящая к активации и Тц- и Тх-клеток.
Презентация опухолевого антигена клеткам иммунной системы 1. 2. 3. Опухолевый антиген может быть презентирован Т-клеткам различным образом. Непосредственная презентация антигена в отсутствие костимулирующих молекул, приводящая к анергии. Непосредственная презентация антигена на клетках опухоли, которые экспрессируют костимулирующие молекулы, приводит к активации Тц-клеток. Непосредственная презентация на опухолевых клетках и опосредованная презентация специализированными АПК, приводящая к активации и Тц- и Тх-клеток.
 Лекция 4 В-клеточный иммунный ответ Габибов А. Г.
Лекция 4 В-клеточный иммунный ответ Габибов А. Г.
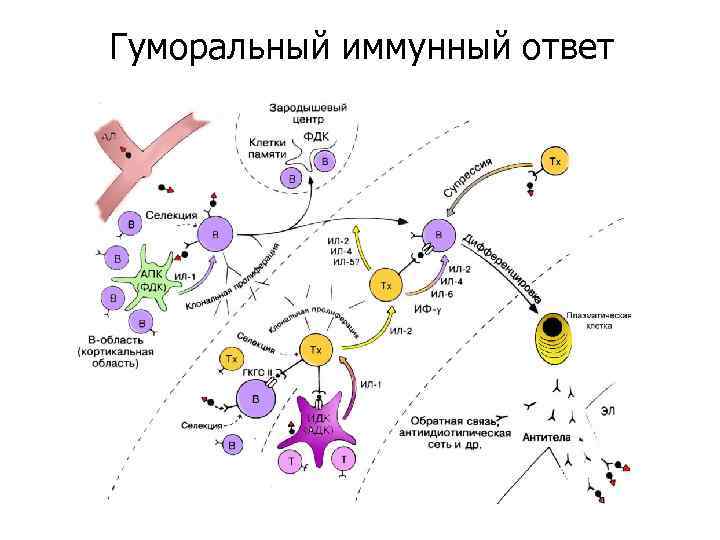 Гуморальный иммунный ответ
Гуморальный иммунный ответ
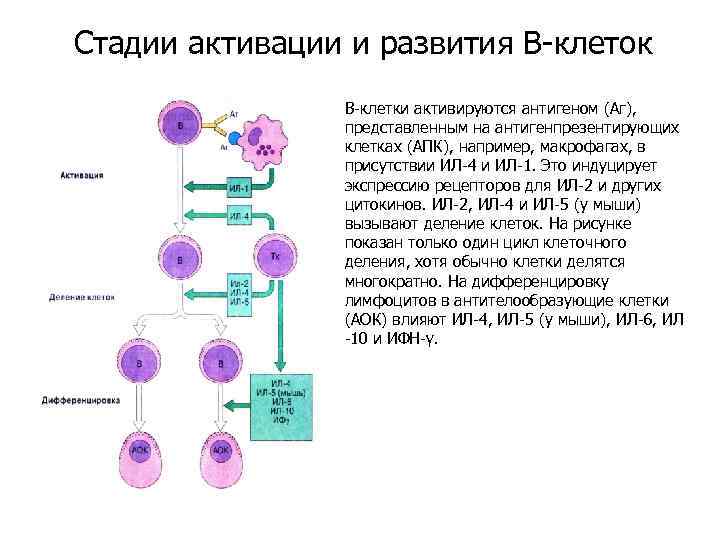 Стадии активации и развития В-клеток В-клетки активируются антигеном (Аг), представленным на антигенпрезентирующих клетках (АПК), например, макрофагах, в присутствии ИЛ-4 и ИЛ-1. Это индуцирует экспрессию рецепторов для ИЛ-2 и других цитокинов. ИЛ-2, ИЛ-4 и ИЛ-5 (у мыши) вызывают деление клеток. На рисунке показан только один цикл клеточного деления, хотя обычно клетки делятся многократно. На дифференцировку лимфоцитов в антителообразующие клетки (АОК) влияют ИЛ-4, ИЛ-5 (у мыши), ИЛ-6, ИЛ -10 и ИФН-γ.
Стадии активации и развития В-клеток В-клетки активируются антигеном (Аг), представленным на антигенпрезентирующих клетках (АПК), например, макрофагах, в присутствии ИЛ-4 и ИЛ-1. Это индуцирует экспрессию рецепторов для ИЛ-2 и других цитокинов. ИЛ-2, ИЛ-4 и ИЛ-5 (у мыши) вызывают деление клеток. На рисунке показан только один цикл клеточного деления, хотя обычно клетки делятся многократно. На дифференцировку лимфоцитов в антителообразующие клетки (АОК) влияют ИЛ-4, ИЛ-5 (у мыши), ИЛ-6, ИЛ -10 и ИФН-γ.

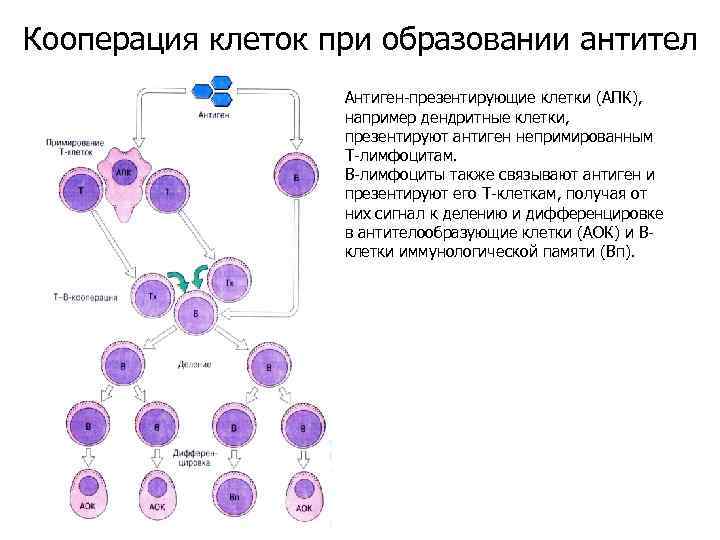 Кооперация клеток при образовании антител Антиген-презентирующие клетки (АПК), например дендритные клетки, презентируют антиген непримированным Т-лимфоцитам. В-лимфоциты также связывают антиген и презентируют его Т-клеткам, получая от них сигнал к делению и дифференцировке в антителообразующие клетки (АОК) и Вклетки иммунологической памяти (Вп).
Кооперация клеток при образовании антител Антиген-презентирующие клетки (АПК), например дендритные клетки, презентируют антиген непримированным Т-лимфоцитам. В-лимфоциты также связывают антиген и презентируют его Т-клеткам, получая от них сигнал к делению и дифференцировке в антителообразующие клетки (АОК) и Вклетки иммунологической памяти (Вп).
 Биологическое значение синтеза иммуноглобулинов разных классов Ig. D Первичное распознавание свободного АГ, участие в активации В-лимфоцитов, участие в презентации АГ Т-лимфоцитам m. Ig. М Первичное распознавание свободного АГ, участие в регуляции пула зрелых В-клеток, модулирующая роль в активации В-лимфоцитов, участие в презентации АГ Т-лимфоцитам Ig. М Нейтрализация инфекционных свойств патогенов; элиминация антигена в корпускулярной форме из кровотока с участием комплемента; элиминация антигена путем его присоединения к поверхности эритроцитов с последующим фагоцитозом; регуляция процессов дифференцировки Т-лимфоцитов и ЕК Ig. G 1 -3 Элиминация антигена из кровотока, ЦНС: в молекулярной форформе – с участием фагоцитов, в корпускулярной форме - с участием комплемента; нейтрализация инфекционных свойств патогенов, включая вирусы; обеспечение плацентарного иммунитета; реализация антителозависимой цитотоксичности Ig. А Формирование барьера на поверхности слизистых оболочек для проникновения антигенов во внутренние среды организма, нейтрализация инфекционных свойств патогенов, в т. ч. вирусов Ig. E, G 4 Формирование тканевого барьера для распространения антигенов по организму, нейтрализация инфекционных свойств патогенов, в т. ч. гельминтов и вирусов; развитие воспаления и шока
Биологическое значение синтеза иммуноглобулинов разных классов Ig. D Первичное распознавание свободного АГ, участие в активации В-лимфоцитов, участие в презентации АГ Т-лимфоцитам m. Ig. М Первичное распознавание свободного АГ, участие в регуляции пула зрелых В-клеток, модулирующая роль в активации В-лимфоцитов, участие в презентации АГ Т-лимфоцитам Ig. М Нейтрализация инфекционных свойств патогенов; элиминация антигена в корпускулярной форме из кровотока с участием комплемента; элиминация антигена путем его присоединения к поверхности эритроцитов с последующим фагоцитозом; регуляция процессов дифференцировки Т-лимфоцитов и ЕК Ig. G 1 -3 Элиминация антигена из кровотока, ЦНС: в молекулярной форформе – с участием фагоцитов, в корпускулярной форме - с участием комплемента; нейтрализация инфекционных свойств патогенов, включая вирусы; обеспечение плацентарного иммунитета; реализация антителозависимой цитотоксичности Ig. А Формирование барьера на поверхности слизистых оболочек для проникновения антигенов во внутренние среды организма, нейтрализация инфекционных свойств патогенов, в т. ч. вирусов Ig. E, G 4 Формирование тканевого барьера для распространения антигенов по организму, нейтрализация инфекционных свойств патогенов, в т. ч. гельминтов и вирусов; развитие воспаления и шока
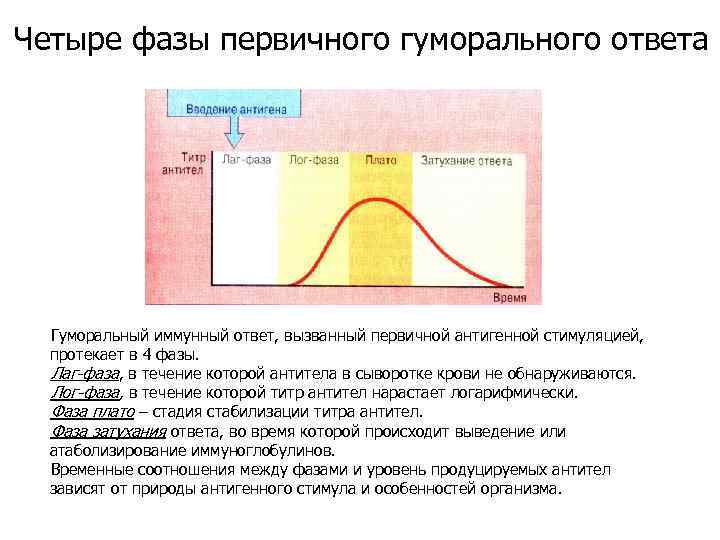 Четыре фазы первичного гуморального ответа Гуморальный иммунный ответ, вызванный первичной антигенной стимуляцией, протекает в 4 фазы. Лаг-фаза, в течение которой антитела в сыворотке крови не обнаруживаются. Лог-фаза, в течение которой титр антител нарастает логарифмически. Фаза плато – стадия стабилизации титра антител. Фаза затухания ответа, во время которой происходит выведение или атаболизирование иммуноглобулинов. Временные соотношения между фазами и уровень продуцируемых антител зависят от природы антигенного стимула и особенностей организма.
Четыре фазы первичного гуморального ответа Гуморальный иммунный ответ, вызванный первичной антигенной стимуляцией, протекает в 4 фазы. Лаг-фаза, в течение которой антитела в сыворотке крови не обнаруживаются. Лог-фаза, в течение которой титр антител нарастает логарифмически. Фаза плато – стадия стабилизации титра антител. Фаза затухания ответа, во время которой происходит выведение или атаболизирование иммуноглобулинов. Временные соотношения между фазами и уровень продуцируемых антител зависят от природы антигенного стимула и особенностей организма.
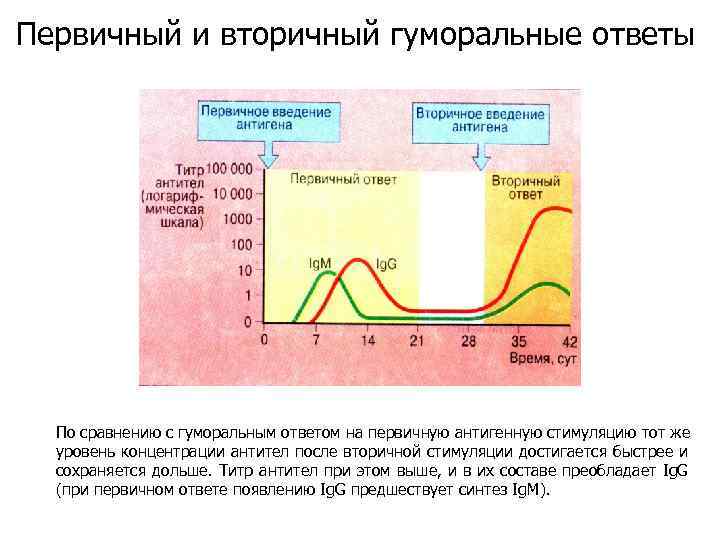 Первичный и вторичный гуморальные ответы По сравнению с гуморальным ответом на первичную антигенную стимуляцию тот же уровень концентрации антител после вторичной стимуляции достигается быстрее и сохраняется дольше. Титр антител при этом выше, и в их составе преобладает Ig. G (при первичном ответе появлению Ig. G предшествует синтез Ig. M).
Первичный и вторичный гуморальные ответы По сравнению с гуморальным ответом на первичную антигенную стимуляцию тот же уровень концентрации антител после вторичной стимуляции достигается быстрее и сохраняется дольше. Титр антител при этом выше, и в их составе преобладает Ig. G (при первичном ответе появлению Ig. G предшествует синтез Ig. M).
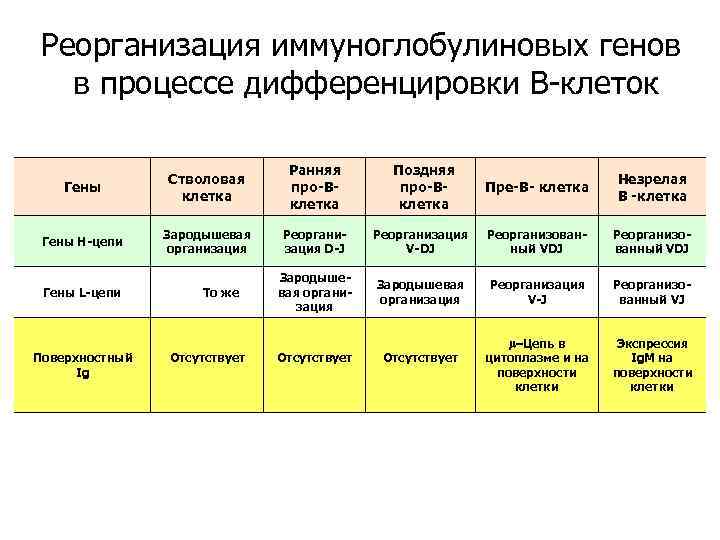 Реорганизация иммуноглобулиновых генов в процессе дифференцировки В-клеток Гены Стволовая клетка Ранняя про-Вклетка Гены Н-цепи Зародышевая организация Реорганизация D-J Зародышевая организация Гены L-цепи Поверхностный Ig То же Отсутствует Поздняя про-Вклетка Пре-В- клетка Незрелая В -клетка Реорганизация V-DJ Реорганизованный VDJ Зародышевая организация Реорганизация V-J Реорганизованный VJ -Цепь в цитоплазме и на поверхности клетки Экспрессия Ig. M на поверхности клетки Отсутствует
Реорганизация иммуноглобулиновых генов в процессе дифференцировки В-клеток Гены Стволовая клетка Ранняя про-Вклетка Гены Н-цепи Зародышевая организация Реорганизация D-J Зародышевая организация Гены L-цепи Поверхностный Ig То же Отсутствует Поздняя про-Вклетка Пре-В- клетка Незрелая В -клетка Реорганизация V-DJ Реорганизованный VDJ Зародышевая организация Реорганизация V-J Реорганизованный VJ -Цепь в цитоплазме и на поверхности клетки Экспрессия Ig. M на поверхности клетки Отсутствует
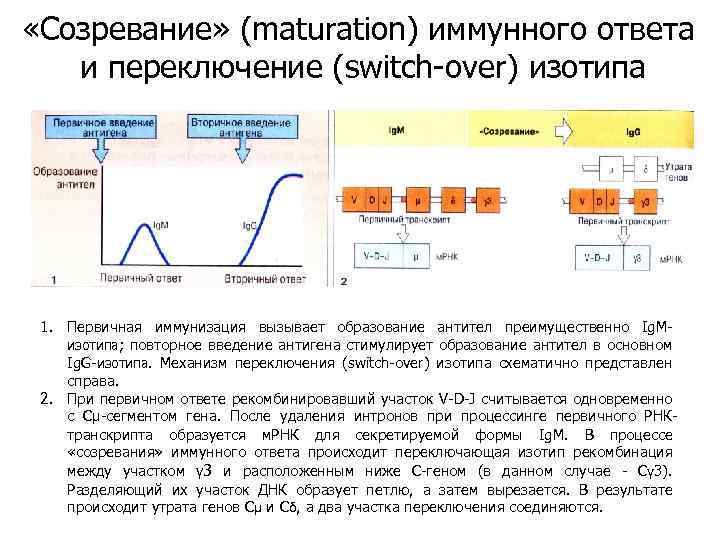 «Созревание» (maturation) иммунного ответа и переключение (switch-over) изотипа 1. Первичная иммунизация вызывает образование антител преимущественно Ig. Mизотипа; повторное введение антигена стимулирует образование антител в основном Ig. G-изотипа. Механизм переключения (switch-over) изотипа схематично представлен справа. 2. При первичном ответе рекомбинировавший участок V-D-J считывается одновременно с Сμ-сегментом гена. После удаления интронов при процессинге первичного РНКтранскрипта образуется м. РНК для секретируемой формы Ig. M. В процессе «созревания» иммунного ответа происходит переключающая изотип рекомбинация между участком γ 3 и расположенным ниже С-геном (в данном случае - Сγ 3). Разделяющий их участок ДНК образует петлю, а затем вырезается. В результате происходит утрата генов Сμ и Сδ, а два участка переключения соединяются.
«Созревание» (maturation) иммунного ответа и переключение (switch-over) изотипа 1. Первичная иммунизация вызывает образование антител преимущественно Ig. Mизотипа; повторное введение антигена стимулирует образование антител в основном Ig. G-изотипа. Механизм переключения (switch-over) изотипа схематично представлен справа. 2. При первичном ответе рекомбинировавший участок V-D-J считывается одновременно с Сμ-сегментом гена. После удаления интронов при процессинге первичного РНКтранскрипта образуется м. РНК для секретируемой формы Ig. M. В процессе «созревания» иммунного ответа происходит переключающая изотип рекомбинация между участком γ 3 и расположенным ниже С-геном (в данном случае - Сγ 3). Разделяющий их участок ДНК образует петлю, а затем вырезается. В результате происходит утрата генов Сμ и Сδ, а два участка переключения соединяются.
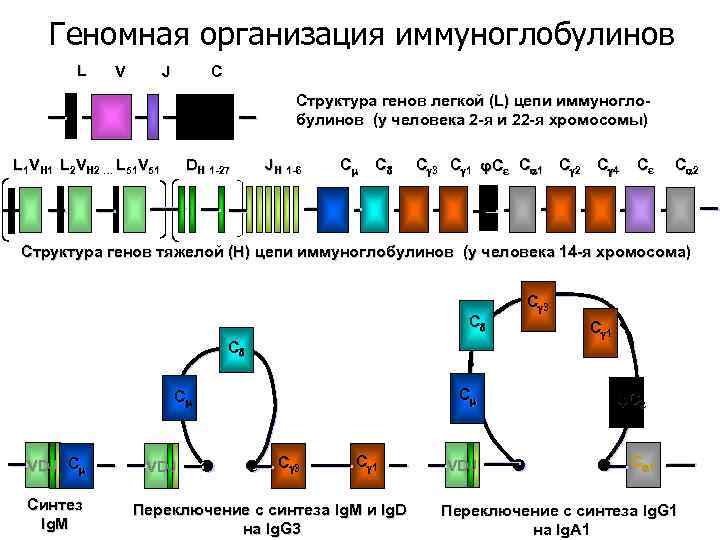 Геномная организация иммуноглобулинов L V J C Структура генов легкой (L) цепи иммуноглобулинов (у человека 2 -я и 22 -я хромосомы) L 1 VH 1 L 2 VH 2 … L 51 V 51 DH 1 -27 JH 1 -6 C C C 3 C 1 φCε C 1 C 2 C 4 Cε C 2 Структура генов тяжелой (Н) цепи иммуноглобулинов (у человека 14 -я хромосома) C C C C VDJ C Cинтез Ig. M VDJ C 3 C 1 Переключение с синтеза Ig. M и Ig. D на Ig. G 3 VDJ C 3 C 1 φ Cε C 1 Переключение с синтеза Ig. G 1 на Ig. A 1
Геномная организация иммуноглобулинов L V J C Структура генов легкой (L) цепи иммуноглобулинов (у человека 2 -я и 22 -я хромосомы) L 1 VH 1 L 2 VH 2 … L 51 V 51 DH 1 -27 JH 1 -6 C C C 3 C 1 φCε C 1 C 2 C 4 Cε C 2 Структура генов тяжелой (Н) цепи иммуноглобулинов (у человека 14 -я хромосома) C C C C VDJ C Cинтез Ig. M VDJ C 3 C 1 Переключение с синтеза Ig. M и Ig. D на Ig. G 3 VDJ C 3 C 1 φ Cε C 1 Переключение с синтеза Ig. G 1 на Ig. A 1
 Рекомбинация генов, кодирующих k-цепи иммуноглобулинов В некоммитированной В-клетке гены, кодирующие k-цепь иммуноглобу-линов, отделены в ДНК значительным расстоянием. Процесс рекомбинации начинается с объединения одного из Vkгенов (Vk 2) с одним из J-мини-генов (J 4). В результате формируется k-локус, контролирующий незрелую пре-м. РНК ядра. При созревании такой РНК происходит слияние (сплайсинг) VJ с Сkгеном за счет делеции некодируемой последовательности нуклеотидов. Зрелая м. РНК представляет собой единый информационный участок (LVk 2 J 4 Ck), транслирующий первичную к-цепь. При созревании k-цепи лидерная последовательность аминокислотных остатков (L) удаляется, что и приводит, наконец, к формированию полноценной k -цепи
Рекомбинация генов, кодирующих k-цепи иммуноглобулинов В некоммитированной В-клетке гены, кодирующие k-цепь иммуноглобу-линов, отделены в ДНК значительным расстоянием. Процесс рекомбинации начинается с объединения одного из Vkгенов (Vk 2) с одним из J-мини-генов (J 4). В результате формируется k-локус, контролирующий незрелую пре-м. РНК ядра. При созревании такой РНК происходит слияние (сплайсинг) VJ с Сkгеном за счет делеции некодируемой последовательности нуклеотидов. Зрелая м. РНК представляет собой единый информационный участок (LVk 2 J 4 Ck), транслирующий первичную к-цепь. При созревании k-цепи лидерная последовательность аминокислотных остатков (L) удаляется, что и приводит, наконец, к формированию полноценной k -цепи
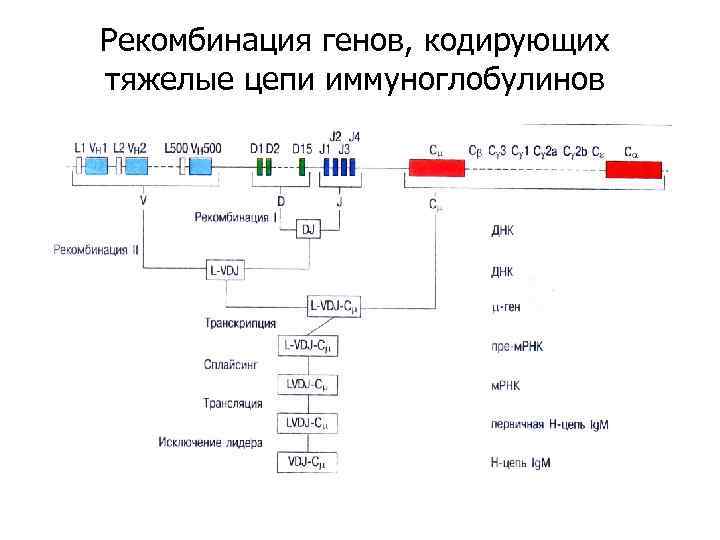 Рекомбинация генов, кодирующих тяжелые цепи иммуноглобулинов
Рекомбинация генов, кодирующих тяжелые цепи иммуноглобулинов
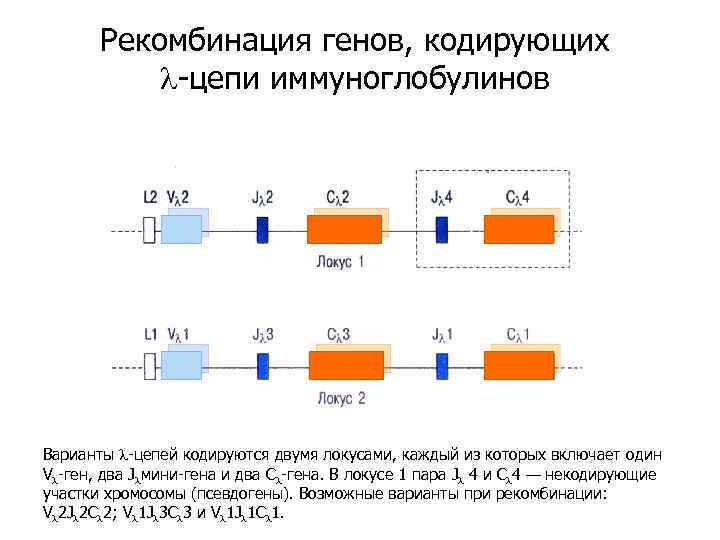 Рекомбинация генов, кодирующих l-цепи иммуноглобулинов Варианты l-цепей кодируются двумя локусами, каждый из которых включает один Vl-ген, два Jlмини-гена и два Сl-гена. В локусе 1 пара Jl 4 и Сl 4 — некодирующие участки хромосомы (псевдогены). Возможные варианты при рекомбинации: Vl 2 Jl 2 Cl 2; Vl 1 Jl 3 Cl 3 и Vl 1 Jl 1 Cl 1.
Рекомбинация генов, кодирующих l-цепи иммуноглобулинов Варианты l-цепей кодируются двумя локусами, каждый из которых включает один Vl-ген, два Jlмини-гена и два Сl-гена. В локусе 1 пара Jl 4 и Сl 4 — некодирующие участки хромосомы (псевдогены). Возможные варианты при рекомбинации: Vl 2 Jl 2 Cl 2; Vl 1 Jl 3 Cl 3 и Vl 1 Jl 1 Cl 1.
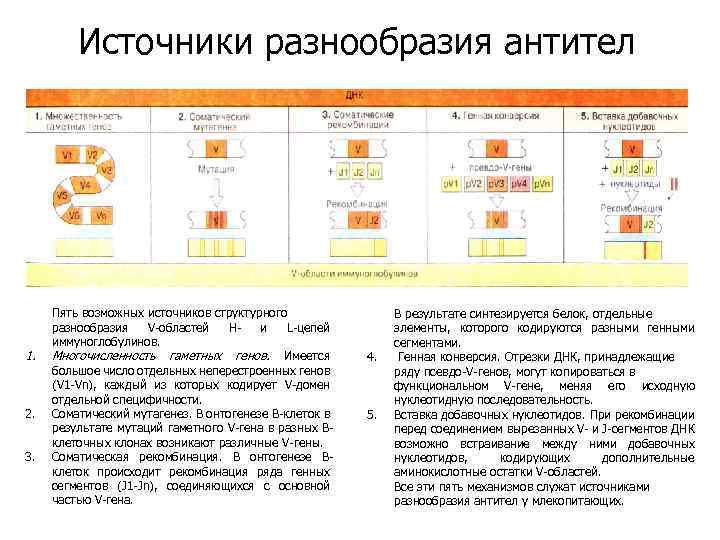 Источники разнообразия антител 1. 2. 3. Пять возможных источников структурного разнообразия V-областей Ни L-цепей иммуноглобулинов. Многочисленность гаметных генов. Имеется большое число отдельных неперестроенных генов (V 1 -Vn), каждый из которых кодирует V-домен отдельной специфичности. Соматический мутагенез. В онтогенезе В-клеток в результате мутаций гаметного V-гена в разных Вклеточных клонах возникают различные V-гены. Соматическая рекомбинация. В онтогенезе Вклеток происходит рекомбинация ряда генных сегментов (J 1 -Jn), соединяющихся с основной частью V-гена. 4. 5. В результате синтезируется белок, отдельные элементы, которого кодируются разными генными сегментами. Генная конверсия. Отрезки ДНК, принадлежащие ряду псевдо-V-генов, могут копироваться в функциональном V-гене, меняя его исходную нуклеотидную последовательность. Вставка добавочных нуклеотидов. При рекомбинации перед соединением вырезанных V- и J-сегментов ДНК возможно встраивание между ними добавочных нуклеотидов, кодирующих дополнительные аминокислотные остатки V-областей. Все эти пять механизмов служат источниками разнообразия антител у млекопитающих.
Источники разнообразия антител 1. 2. 3. Пять возможных источников структурного разнообразия V-областей Ни L-цепей иммуноглобулинов. Многочисленность гаметных генов. Имеется большое число отдельных неперестроенных генов (V 1 -Vn), каждый из которых кодирует V-домен отдельной специфичности. Соматический мутагенез. В онтогенезе В-клеток в результате мутаций гаметного V-гена в разных Вклеточных клонах возникают различные V-гены. Соматическая рекомбинация. В онтогенезе Вклеток происходит рекомбинация ряда генных сегментов (J 1 -Jn), соединяющихся с основной частью V-гена. 4. 5. В результате синтезируется белок, отдельные элементы, которого кодируются разными генными сегментами. Генная конверсия. Отрезки ДНК, принадлежащие ряду псевдо-V-генов, могут копироваться в функциональном V-гене, меняя его исходную нуклеотидную последовательность. Вставка добавочных нуклеотидов. При рекомбинации перед соединением вырезанных V- и J-сегментов ДНК возможно встраивание между ними добавочных нуклеотидов, кодирующих дополнительные аминокислотные остатки V-областей. Все эти пять механизмов служат источниками разнообразия антител у млекопитающих.
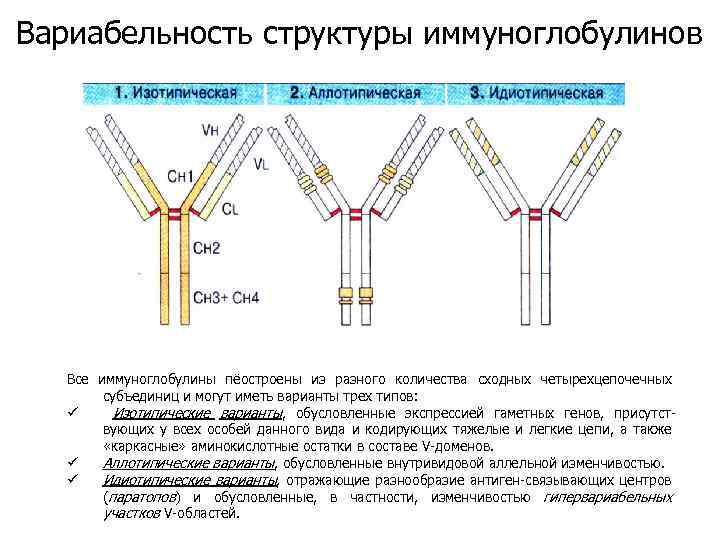 Вариабельность структуры иммуноглобулинов Все иммуноглобулины пёостроены из разного количества сходных четырехцепочечных субъединиц и могут иметь варианты трех типов: ü Изотипические варианты, обусловленные экспрессией гаметных генов, присутствующих у всех особей данного вида и кодирующих тяжелые и легкие цепи, а также «каркасные» аминокислотные остатки в составе V-доменов. ü Аллотипические варианты, обусловленные внутривидовой аллельной изменчивостью. ü Идиотипические варианты, отражающие разнообразие антиген-связывающих центров (паратопов) и обусловленные, в частности, изменчивостью гипервариабельных участков V-областей.
Вариабельность структуры иммуноглобулинов Все иммуноглобулины пёостроены из разного количества сходных четырехцепочечных субъединиц и могут иметь варианты трех типов: ü Изотипические варианты, обусловленные экспрессией гаметных генов, присутствующих у всех особей данного вида и кодирующих тяжелые и легкие цепи, а также «каркасные» аминокислотные остатки в составе V-доменов. ü Аллотипические варианты, обусловленные внутривидовой аллельной изменчивостью. ü Идиотипические варианты, отражающие разнообразие антиген-связывающих центров (паратопов) и обусловленные, в частности, изменчивостью гипервариабельных участков V-областей.
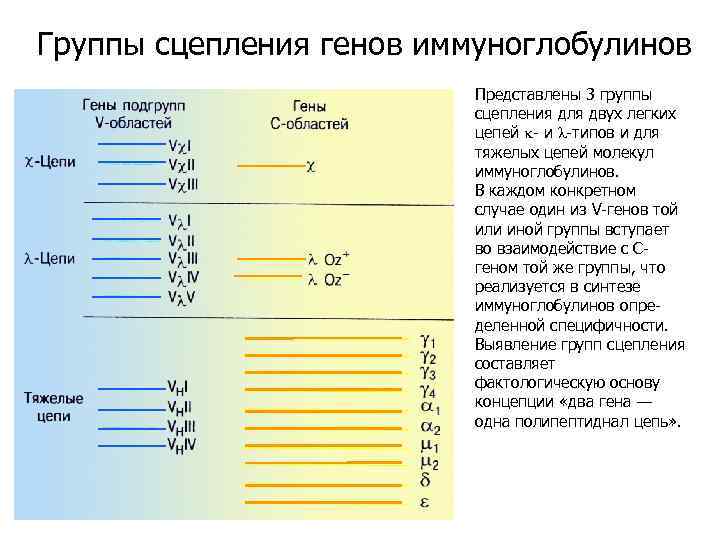 Группы сцепления генов иммуноглобулинов Представлены 3 группы сцепления для двух легких цепей k- и l-типов и для тяжелых цепей молекул иммуноглобулинов. В каждом конкретном случае один из V-генов той или иной группы вступает во взаимодействие с Сгеном той же группы, что реализуется в синтезе иммуноглобулинов определенной специфичности. Выявление групп сцепления составляет фактологическую основу концепции «два гена — одна полипептиднал цепь» .
Группы сцепления генов иммуноглобулинов Представлены 3 группы сцепления для двух легких цепей k- и l-типов и для тяжелых цепей молекул иммуноглобулинов. В каждом конкретном случае один из V-генов той или иной группы вступает во взаимодействие с Сгеном той же группы, что реализуется в синтезе иммуноглобулинов определенной специфичности. Выявление групп сцепления составляет фактологическую основу концепции «два гена — одна полипептиднал цепь» .
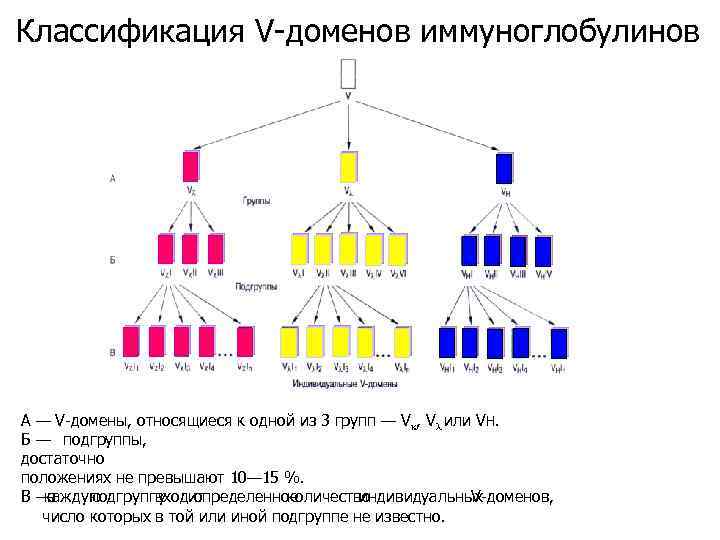 Классификация V-доменов иммуноглобулинов А — V-домены, относящиеся к одной из 3 групп — Vk, Vl или VH. Б — подгруппы, достаточно положениях не превышают 10— 15 %. В— каждую в подгруппу входит определенное количество индивидуальных V-доменов, число которых в той или иной подгруппе не известно.
Классификация V-доменов иммуноглобулинов А — V-домены, относящиеся к одной из 3 групп — Vk, Vl или VH. Б — подгруппы, достаточно положениях не превышают 10— 15 %. В— каждую в подгруппу входит определенное количество индивидуальных V-доменов, число которых в той или иной подгруппе не известно.
 Классы и подклассы иммуноглобулинов у человека. Классы и подклассы Ig. G 1 Типы цепей Н L 1 c, l Ig. G 2 2 c, l Ig. G 3 3 c, l Ig. G 4 4 c, l Ig. A 1 1 c, l Ig. A 2 2 c, l Ig. D c
Классы и подклассы иммуноглобулинов у человека. Классы и подклассы Ig. G 1 Типы цепей Н L 1 c, l Ig. G 2 2 c, l Ig. G 3 3 c, l Ig. G 4 4 c, l Ig. A 1 1 c, l Ig. A 2 2 c, l Ig. D c
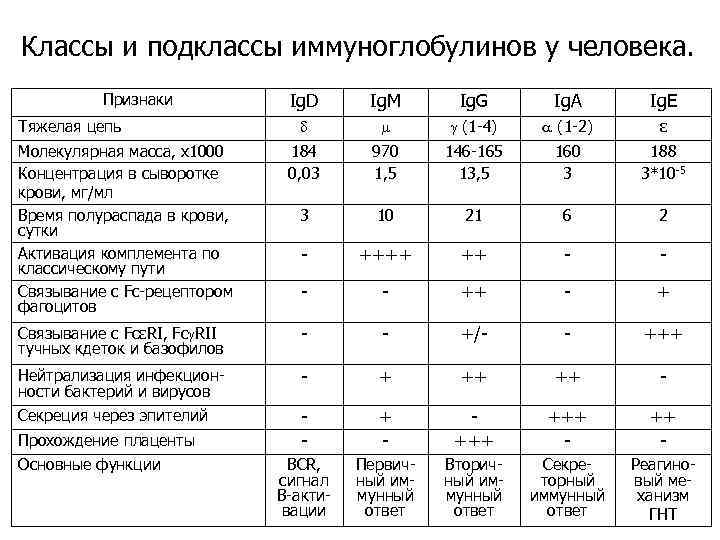 Классы и подклассы иммуноглобулинов у человека. Ig. D Ig. M Ig. G Ig. A Ig. E (1 -4) (1 -2) ε Молекулярная масса, х1000 Концентрация в сыворотке крови, мг/мл Время полураспада в крови, сутки Активация комплемента по классическому пути Связывание с Fc-рецептором фагоцитов 184 0, 03 970 1, 5 146 -165 13, 5 160 3 188 3*10 -5 3 10 21 6 2 - ++++ ++ - - ++ - + Связывание с FcεRI, Fc RII тучных кдеток и базофилов - - +/- - +++ Нейтрализация инфекционности бактерий и вирусов - + ++ ++ - Секреция через эпителий - +++ +++ - ВСR, cигнал В-активации Первичный иммунный ответ Вторичный иммунный ответ Секреторный иммунный ответ Реагиновый механизм ГНТ Признаки Тяжелая цепь Прохождение плаценты Основные функции
Классы и подклассы иммуноглобулинов у человека. Ig. D Ig. M Ig. G Ig. A Ig. E (1 -4) (1 -2) ε Молекулярная масса, х1000 Концентрация в сыворотке крови, мг/мл Время полураспада в крови, сутки Активация комплемента по классическому пути Связывание с Fc-рецептором фагоцитов 184 0, 03 970 1, 5 146 -165 13, 5 160 3 188 3*10 -5 3 10 21 6 2 - ++++ ++ - - ++ - + Связывание с FcεRI, Fc RII тучных кдеток и базофилов - - +/- - +++ Нейтрализация инфекционности бактерий и вирусов - + ++ ++ - Секреция через эпителий - +++ +++ - ВСR, cигнал В-активации Первичный иммунный ответ Вторичный иммунный ответ Секреторный иммунный ответ Реагиновый механизм ГНТ Признаки Тяжелая цепь Прохождение плаценты Основные функции
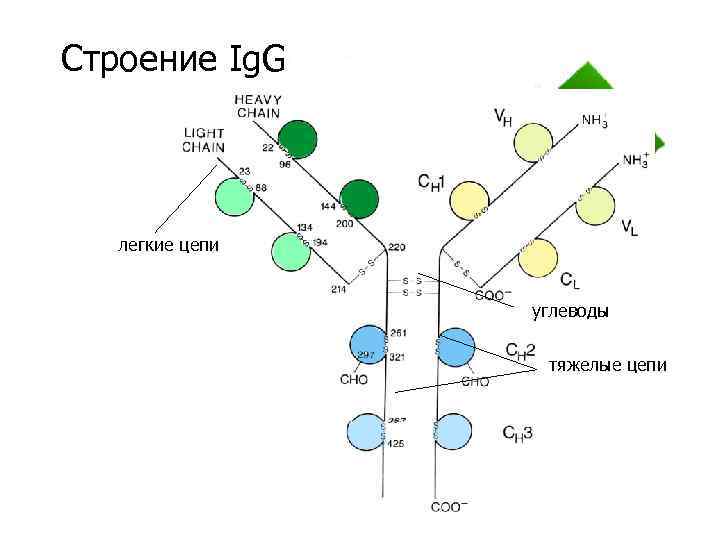 Строение Ig. G легкие цепи углеводы тяжелые цепи
Строение Ig. G легкие цепи углеводы тяжелые цепи
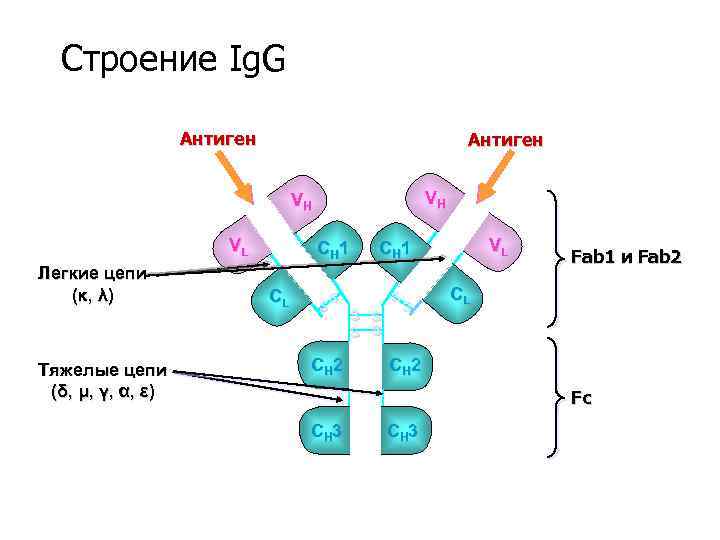 Строение Ig. G Антиген VH VH VL Легкие цепи (κ , λ ) Тяжелые цепи (δ , μ , γ , α , ε ) CH 1 CL S S VL CH 1 S CH 2 S S S Fab 1 и Fab 2 CL CH 2 Fc CH 3
Строение Ig. G Антиген VH VH VL Легкие цепи (κ , λ ) Тяжелые цепи (δ , μ , γ , α , ε ) CH 1 CL S S VL CH 1 S CH 2 S S S Fab 1 и Fab 2 CL CH 2 Fc CH 3
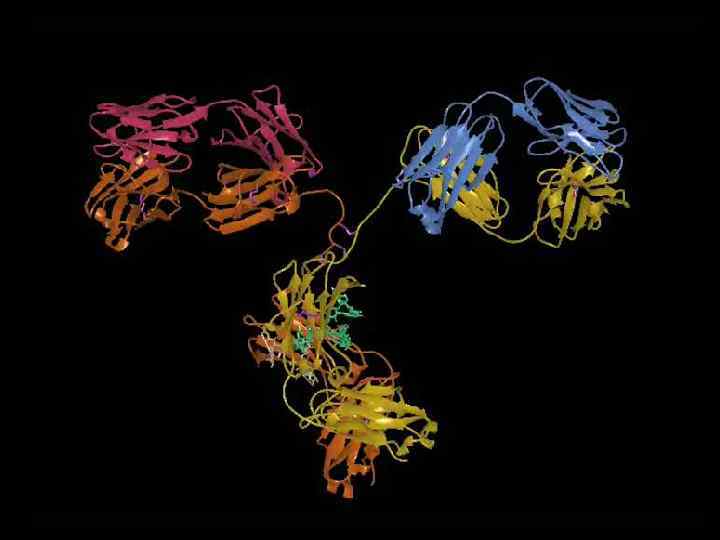
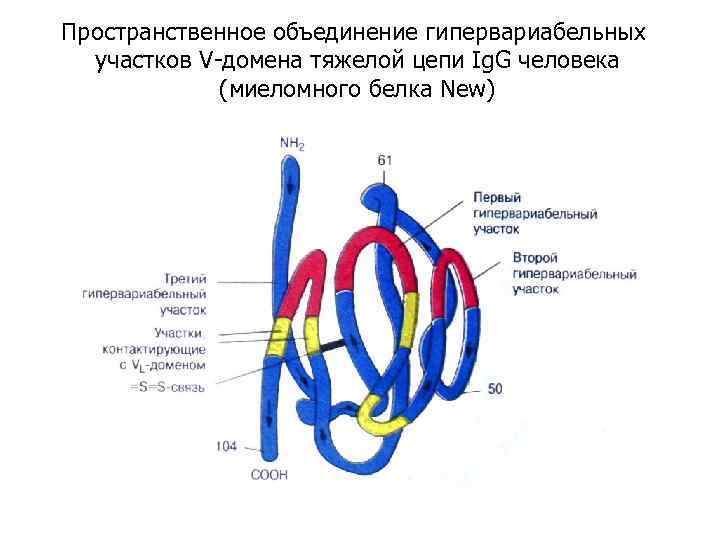 Пространственное объединение гипервариабельных участков V-домена тяжелой цепи Ig. G человека (миеломного белка New)
Пространственное объединение гипервариабельных участков V-домена тяжелой цепи Ig. G человека (миеломного белка New)
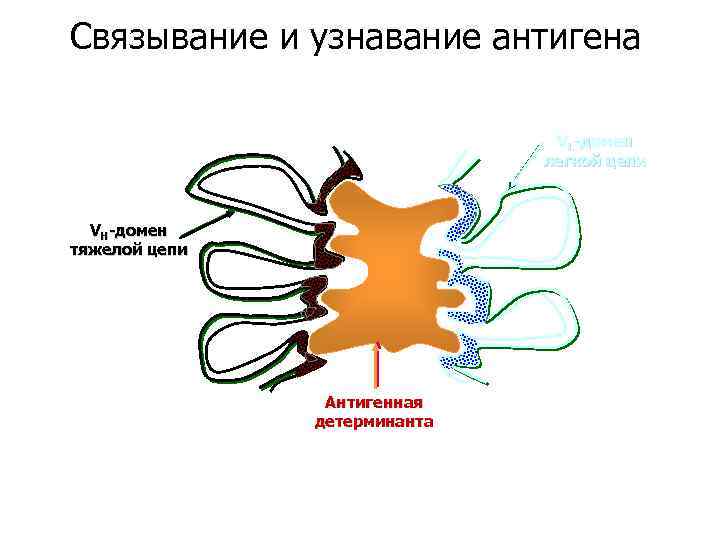 Связывание и узнавание антигена VL-домен легкой цепи VH-домен тяжелой цепи Антигенная детерминанта
Связывание и узнавание антигена VL-домен легкой цепи VH-домен тяжелой цепи Антигенная детерминанта
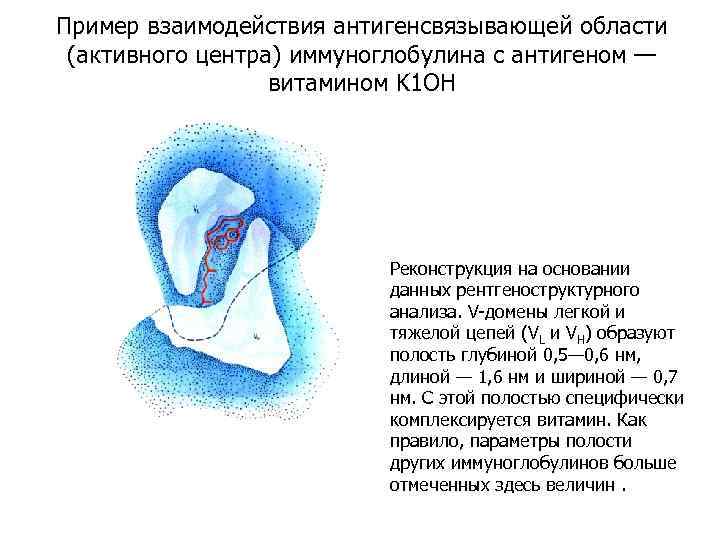 Пример взаимодействия антигенсвязывающей области (активного центра) иммуноглобулина с антигеном — витамином K 1 OH Реконструкция на основании данных рентгеноструктурного анализа. V-домены легкой и тяжелой цепей (VL и VH) образуют полость глубиной 0, 5— 0, 6 нм, длиной — 1, 6 нм и шириной — 0, 7 нм. С этой полостью специфически комплексируется витамин. Как правило, параметры полости других иммуноглобулинов больше отмеченных здесь величин.
Пример взаимодействия антигенсвязывающей области (активного центра) иммуноглобулина с антигеном — витамином K 1 OH Реконструкция на основании данных рентгеноструктурного анализа. V-домены легкой и тяжелой цепей (VL и VH) образуют полость глубиной 0, 5— 0, 6 нм, длиной — 1, 6 нм и шириной — 0, 7 нм. С этой полостью специфически комплексируется витамин. Как правило, параметры полости других иммуноглобулинов больше отмеченных здесь величин.
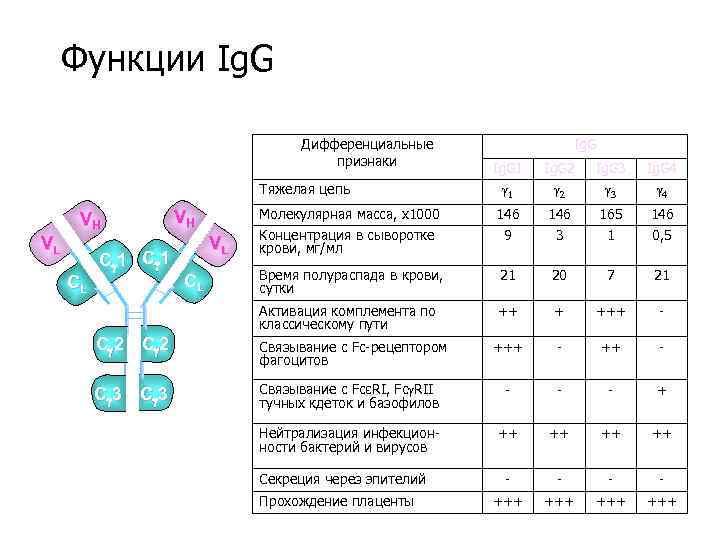 Функции Ig. G Дифференциальные признаки Ig. G 1 1 Ig. G 2 2 Ig. G 3 3 Ig. G 4 4 Молекулярная масса, х1000 Концентрация в сыворотке крови, мг/мл 146 9 146 3 165 1 146 0, 5 Время полураспада в крови, сутки 21 20 7 21 Активация комплемента по классическому пути ++ + +++ - Тяжелая цепь VH VL CL Ig. G C 1 VH VL CL C 2 Связывание с Fc-рецептором фагоцитов +++ - C 3 Связывание с FcεRI, Fc RII тучных кдеток и базофилов - - - + Нейтрализация инфекционности бактерий и вирусов ++ ++ - - +++ +++ Секреция через эпителий Прохождение плаценты
Функции Ig. G Дифференциальные признаки Ig. G 1 1 Ig. G 2 2 Ig. G 3 3 Ig. G 4 4 Молекулярная масса, х1000 Концентрация в сыворотке крови, мг/мл 146 9 146 3 165 1 146 0, 5 Время полураспада в крови, сутки 21 20 7 21 Активация комплемента по классическому пути ++ + +++ - Тяжелая цепь VH VL CL Ig. G C 1 VH VL CL C 2 Связывание с Fc-рецептором фагоцитов +++ - C 3 Связывание с FcεRI, Fc RII тучных кдеток и базофилов - - - + Нейтрализация инфекционности бактерий и вирусов ++ ++ - - +++ +++ Секреция через эпителий Прохождение плаценты
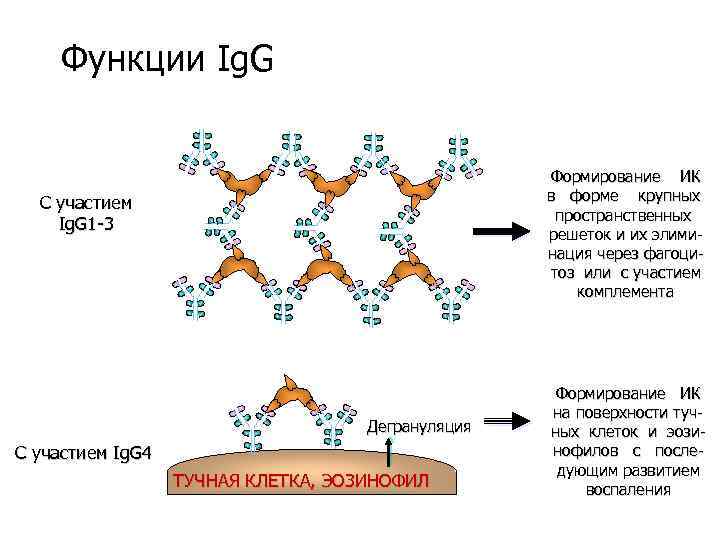 Функции Ig. G Формирование ИК в форме крупных пространственных решеток и их элиминация через фагоцитоз или с участием комплемента С участием Ig. G 1 -3 Дегрануляция C участием Ig. G 4 ТУЧНАЯ КЛЕТКА, ЭОЗИНОФИЛ Формирование ИК на поверхности тучных клеток и эозинофилов с последующим развитием воспаления
Функции Ig. G Формирование ИК в форме крупных пространственных решеток и их элиминация через фагоцитоз или с участием комплемента С участием Ig. G 1 -3 Дегрануляция C участием Ig. G 4 ТУЧНАЯ КЛЕТКА, ЭОЗИНОФИЛ Формирование ИК на поверхности тучных клеток и эозинофилов с последующим развитием воспаления
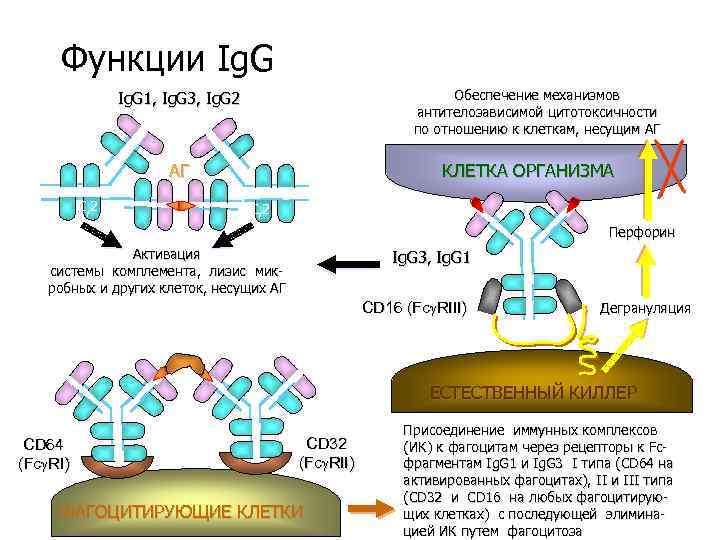 Функции Ig. G Обеспечение механизмов антителозависимой цитотоксичности по отношению к клеткам, несущим АГ Ig. G 1, Ig. G 3, Ig. G 2 АГ C 2 КЛЕТКА ОРГАНИЗМА C 2 Перфорин Активация системы комплемента, лизис микробных и других клеток, несущих АГ Ig. G 3, Ig. G 1 CD 16 (Fc RIII) Дегрануляция ЕСТЕСТВЕННЫЙ КИЛЛЕР CD 64 (Fc RI) CD 32 (Fc RII) ФАГОЦИТИРУЮЩИЕ КЛЕТКИ Присоединение иммунных комплексов (ИК) к фагоцитам через рецепторы к Fcфрагментам Ig. G 1 и Ig. G 3 I типа (СD 64 на активированных фагоцитах), II и III типа (СD 32 и СD 16 на любых фагоцитирующих клетках) с последующей элиминацией ИК путем фагоцитоза
Функции Ig. G Обеспечение механизмов антителозависимой цитотоксичности по отношению к клеткам, несущим АГ Ig. G 1, Ig. G 3, Ig. G 2 АГ C 2 КЛЕТКА ОРГАНИЗМА C 2 Перфорин Активация системы комплемента, лизис микробных и других клеток, несущих АГ Ig. G 3, Ig. G 1 CD 16 (Fc RIII) Дегрануляция ЕСТЕСТВЕННЫЙ КИЛЛЕР CD 64 (Fc RI) CD 32 (Fc RII) ФАГОЦИТИРУЮЩИЕ КЛЕТКИ Присоединение иммунных комплексов (ИК) к фагоцитам через рецепторы к Fcфрагментам Ig. G 1 и Ig. G 3 I типа (СD 64 на активированных фагоцитах), II и III типа (СD 32 и СD 16 на любых фагоцитирующих клетках) с последующей элиминацией ИК путем фагоцитоза
 Структура Ig. M человека
Структура Ig. M человека
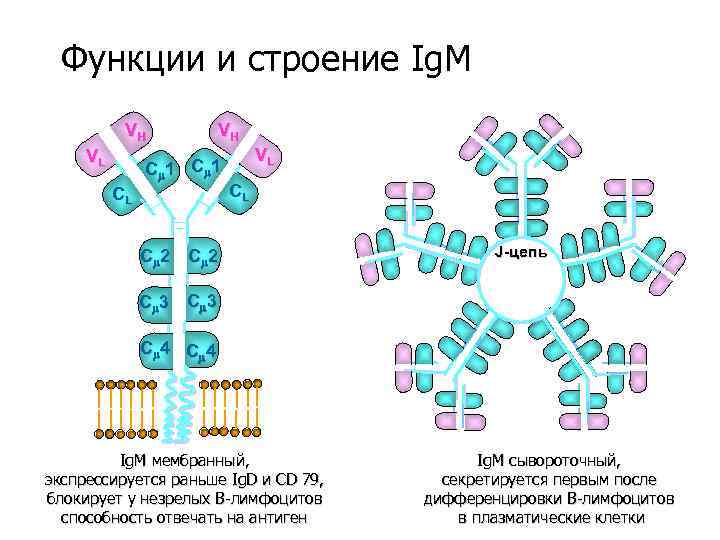 Функции и строение Ig. M VH VL VH C 1 CL VL CL C 2 J-цепь C 3 C 4 Ig. M мембранный, экспрессируется раньше Ig. D и CD 79, блокирует у незрелых В-лимфоцитов способность отвечать на антиген Ig. M сывороточный, секретируется первым после дифференцировки В-лимфоцитов в плазматические клетки
Функции и строение Ig. M VH VL VH C 1 CL VL CL C 2 J-цепь C 3 C 4 Ig. M мембранный, экспрессируется раньше Ig. D и CD 79, блокирует у незрелых В-лимфоцитов способность отвечать на антиген Ig. M сывороточный, секретируется первым после дифференцировки В-лимфоцитов в плазматические клетки
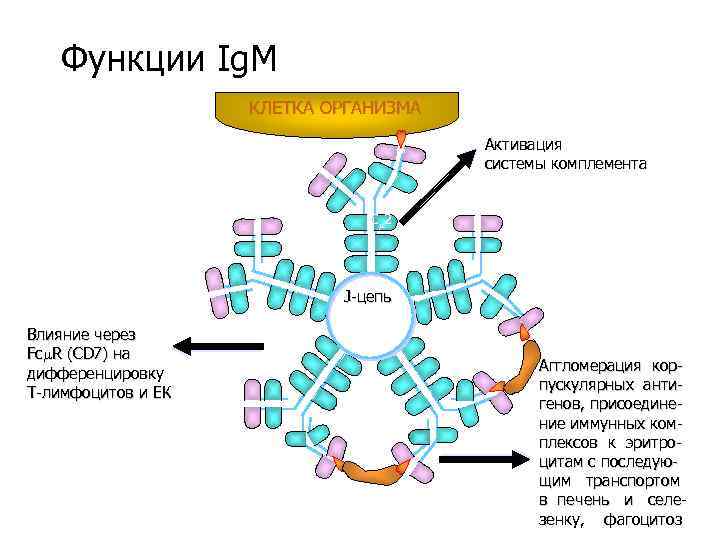 Функции Ig. M КЛЕТКА ОРГАНИЗМА Активация системы комплемента C 2 J-цепь Влияние через Fc R (CD 7) на дифференцировку Т-лимфоцитов и ЕК Аггломерация корпускулярных антигенов, присоединение иммунных комплексов к эритроцитам с последующим транспортом в печень и селезенку, фагоцитоз
Функции Ig. M КЛЕТКА ОРГАНИЗМА Активация системы комплемента C 2 J-цепь Влияние через Fc R (CD 7) на дифференцировку Т-лимфоцитов и ЕК Аггломерация корпускулярных антигенов, присоединение иммунных комплексов к эритроцитам с последующим транспортом в печень и селезенку, фагоцитоз
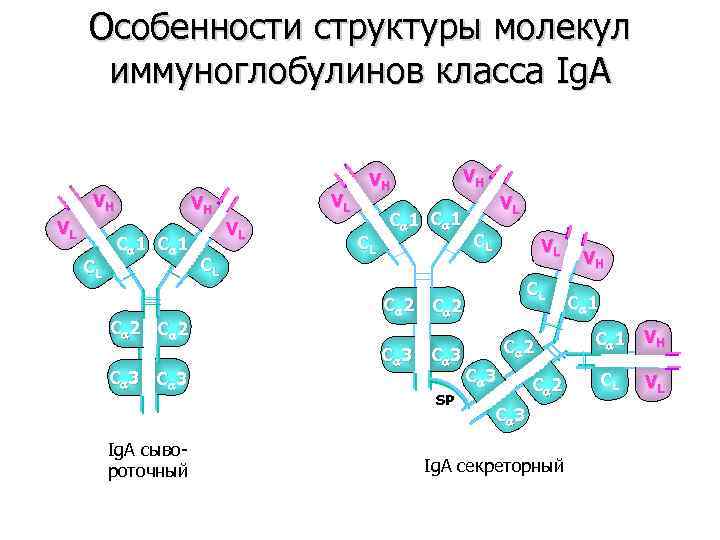 Особенности структуры молекул иммуноглобулинов класса Ig. A VH VL CL VH C 1 C 2 C 3 Ig. A сывороточный CL VL VL VH VH CL C 1 VL CL C 2 C 3 SP C 2 C 3 Ig. A секреторный VH C 1 V H CL VL
Особенности структуры молекул иммуноглобулинов класса Ig. A VH VL CL VH C 1 C 2 C 3 Ig. A сывороточный CL VL VL VH VH CL C 1 VL CL C 2 C 3 SP C 2 C 3 Ig. A секреторный VH C 1 V H CL VL
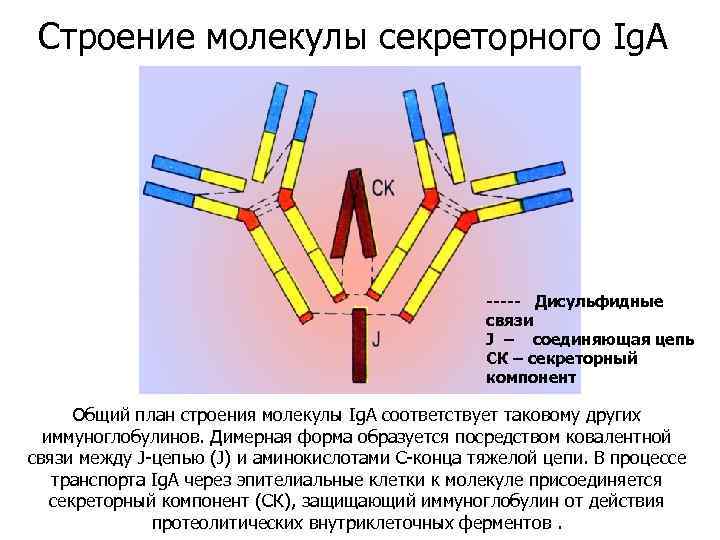 Строение молекулы секреторного Ig. A ----- Дисульфидные связи J – соединяющая цепь СК – секреторный компонент Общий план строения молекулы Ig. A соответствует таковому других иммуноглобулинов. Димерная форма образуется посредством ковалентной связи между J-цепью (J) и аминокислотами С-конца тяжелой цепи. В процессе транспорта Ig. A через эпителиальные клетки к молекуле присоединяется секреторный компонент (СК), защищающий иммуноглобулин от действия протеолитических внутриклеточных ферментов.
Строение молекулы секреторного Ig. A ----- Дисульфидные связи J – соединяющая цепь СК – секреторный компонент Общий план строения молекулы Ig. A соответствует таковому других иммуноглобулинов. Димерная форма образуется посредством ковалентной связи между J-цепью (J) и аминокислотами С-конца тяжелой цепи. В процессе транспорта Ig. A через эпителиальные клетки к молекуле присоединяется секреторный компонент (СК), защищающий иммуноглобулин от действия протеолитических внутриклеточных ферментов.
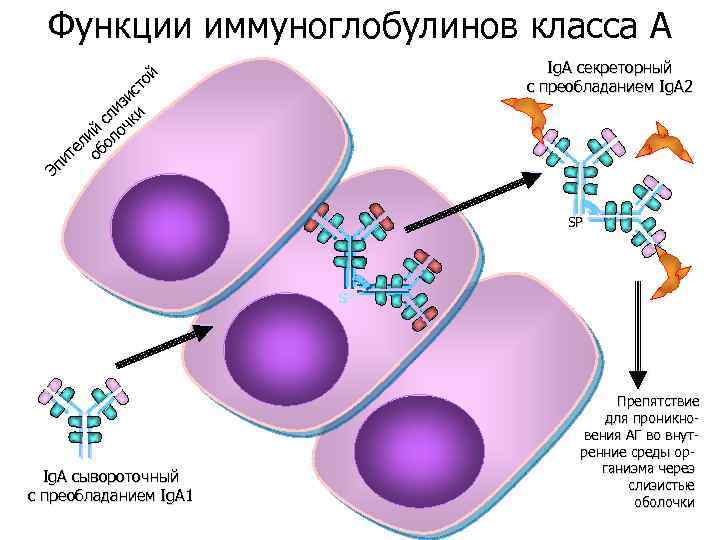 Функции иммуноглобулинов класса A й то с зи и сл чки й о ли ол е б ит о Эп Ig. A секреторный c преобладанием Ig. A 2 SP SP SP Ig. A сывороточный c преобладанием Ig. A 1 Препятствие для проникновения АГ во внутренние среды организма через слизистые оболочки
Функции иммуноглобулинов класса A й то с зи и сл чки й о ли ол е б ит о Эп Ig. A секреторный c преобладанием Ig. A 2 SP SP SP Ig. A сывороточный c преобладанием Ig. A 1 Препятствие для проникновения АГ во внутренние среды организма через слизистые оболочки
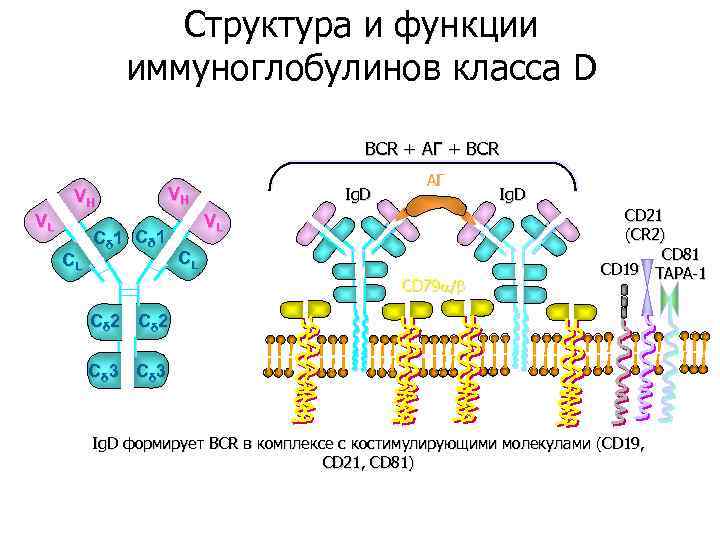 Структура и функции иммуноглобулинов класса D BCR + АГ + BCR VH VL CL VH Cδ 1 Ig. D АГ VL CL CD 79 / Ig. D CD 21 (CR 2) CD 81 CD 19 TAPA-1 Cδ 2 Cδ 3 Ig. D формирует ВСR в комплексе с костимулирующими молекулами (CD 19, CD 21, CD 81)
Структура и функции иммуноглобулинов класса D BCR + АГ + BCR VH VL CL VH Cδ 1 Ig. D АГ VL CL CD 79 / Ig. D CD 21 (CR 2) CD 81 CD 19 TAPA-1 Cδ 2 Cδ 3 Ig. D формирует ВСR в комплексе с костимулирующими молекулами (CD 19, CD 21, CD 81)
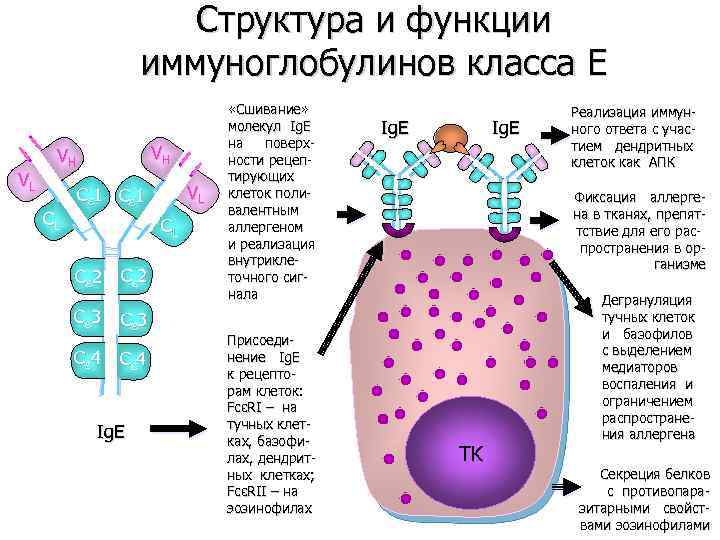 Структура и функции иммуноглобулинов класса E VL VH VH CL VL Cε 1 CL Cε 2 Cε 3 Cε 4 Ig. E «Сшивание» молекул Ig. E на поверхности рецептирующих клеток поливалентным аллергеном и реализация внутриклеточного сигнала Присоединение Ig. E к рецепторам клеток: FcεRI – на тучных клетках, базофилах, дендритных клетках; FcεRII – на эозинофилах Ig. E Реализация иммунного ответа с участием дендритных клеток как АПК Фиксация аллергена в тканях, препяттствие для его распространения в организме TK Дегрануляция тучных клеток и базофилов с выделением медиаторов воспаления и ограничением распространения аллергена Секреция белков с противопаразитарными свойствами эозинофилами
Структура и функции иммуноглобулинов класса E VL VH VH CL VL Cε 1 CL Cε 2 Cε 3 Cε 4 Ig. E «Сшивание» молекул Ig. E на поверхности рецептирующих клеток поливалентным аллергеном и реализация внутриклеточного сигнала Присоединение Ig. E к рецепторам клеток: FcεRI – на тучных клетках, базофилах, дендритных клетках; FcεRII – на эозинофилах Ig. E Реализация иммунного ответа с участием дендритных клеток как АПК Фиксация аллергена в тканях, препяттствие для его распространения в организме TK Дегрануляция тучных клеток и базофилов с выделением медиаторов воспаления и ограничением распространения аллергена Секреция белков с противопаразитарными свойствами эозинофилами
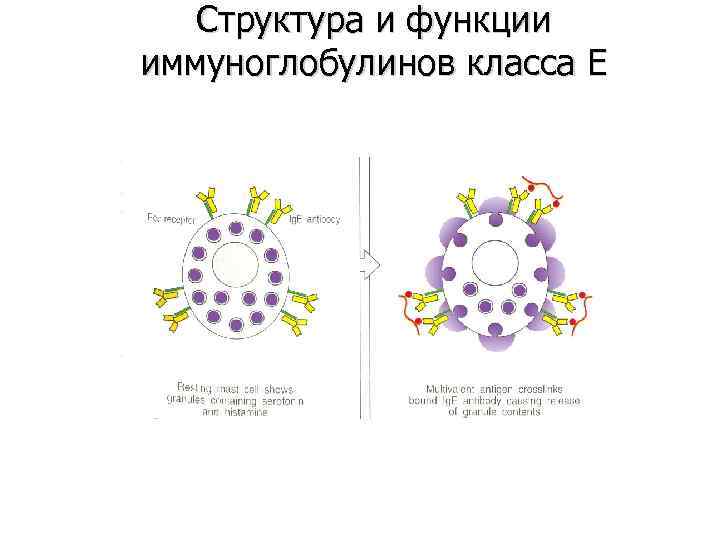 Структура и функции иммуноглобулинов класса E
Структура и функции иммуноглобулинов класса E
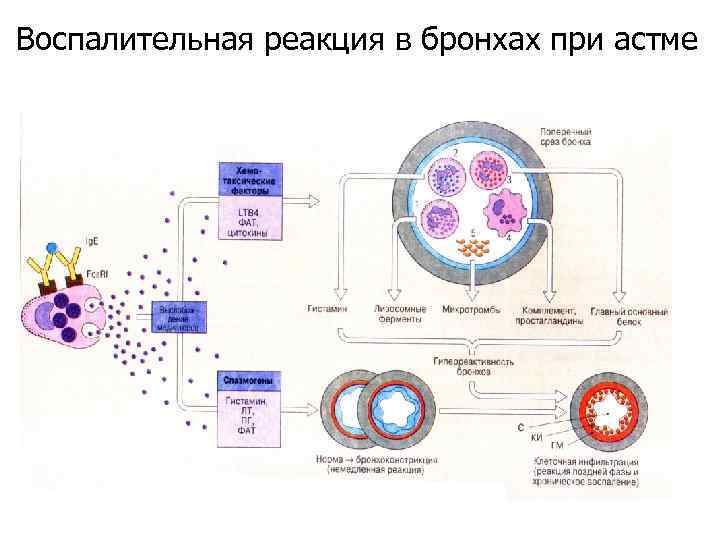 Воспалительная реакция в бронхах при астме
Воспалительная реакция в бронхах при астме
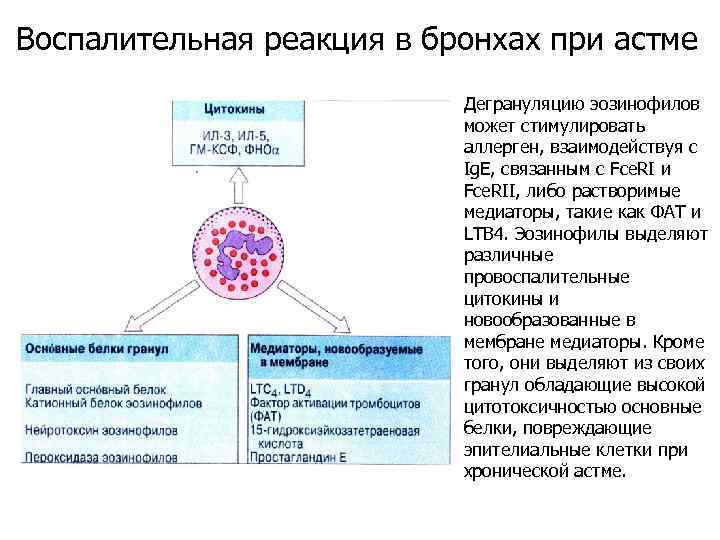 Воспалительная реакция в бронхах при астме Дегрануляцию эозинофилов может стимулировать аллерген, взаимодействуя с Ig. E, связанным с Fce. RI и Fce. RII, либо растворимые медиаторы, такие как ФАТ и LTB 4. Эозинофилы выделяют различные провоспалительные цитокины и новообразованные в мембране медиаторы. Кроме того, они выделяют из своих гранул обладающие высокой цитотоксичностью основные белки, повреждающие эпителиальные клетки при хронической астме.
Воспалительная реакция в бронхах при астме Дегрануляцию эозинофилов может стимулировать аллерген, взаимодействуя с Ig. E, связанным с Fce. RI и Fce. RII, либо растворимые медиаторы, такие как ФАТ и LTB 4. Эозинофилы выделяют различные провоспалительные цитокины и новообразованные в мембране медиаторы. Кроме того, они выделяют из своих гранул обладающие высокой цитотоксичностью основные белки, повреждающие эпителиальные клетки при хронической астме.
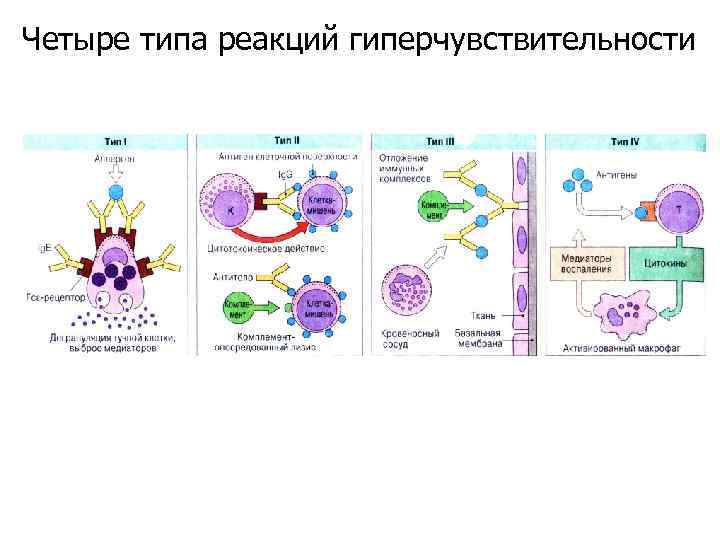 Четыре типа реакций гиперчувствительности
Четыре типа реакций гиперчувствительности
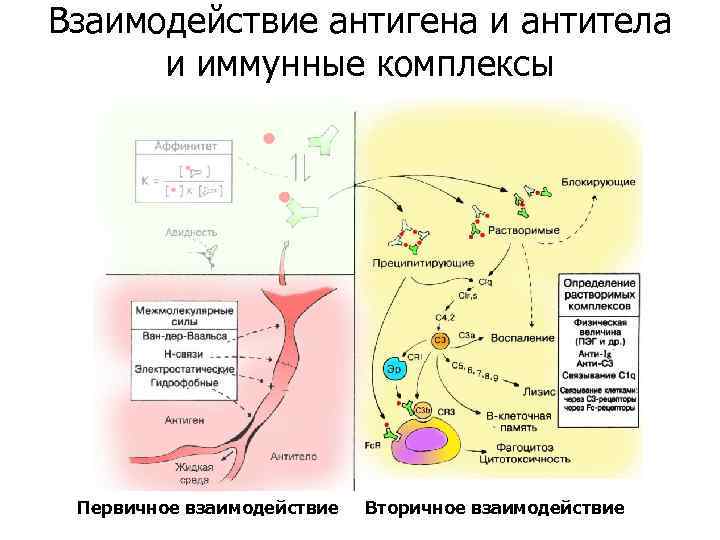 Взаимодействие антигена и антитела и иммунные комплексы Первичное взаимодействие Вторичное взаимодействие
Взаимодействие антигена и антитела и иммунные комплексы Первичное взаимодействие Вторичное взаимодействие
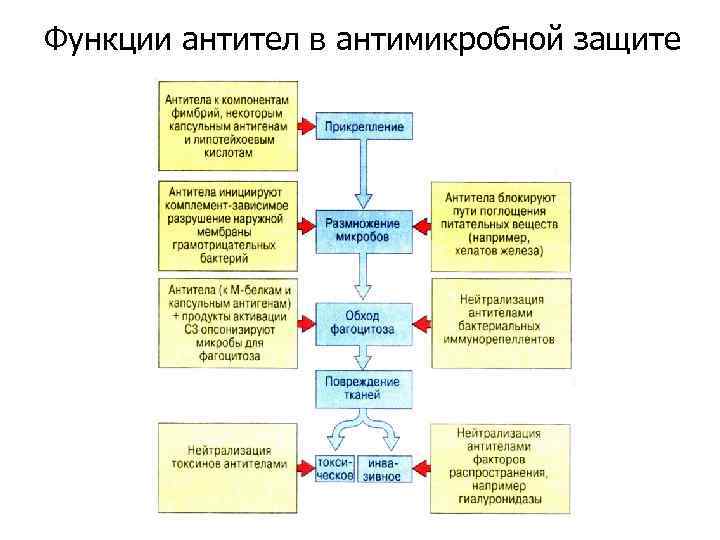 Функции антител в антимикробной защите
Функции антител в антимикробной защите
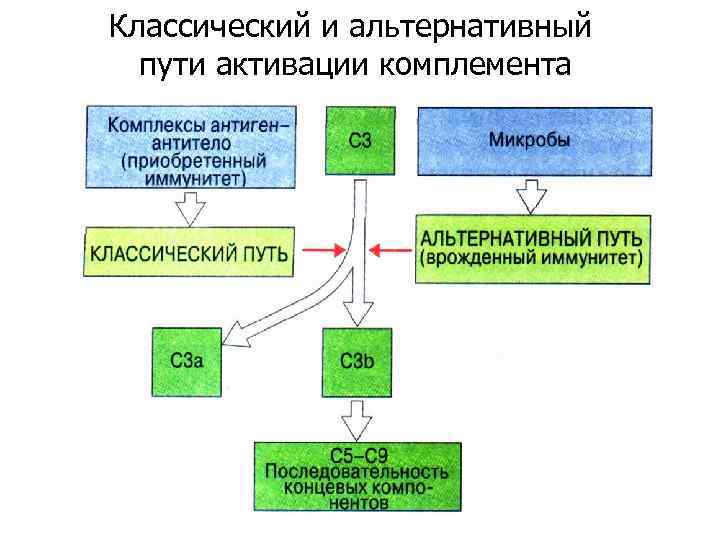 Классический и альтернативный пути активации комплемента
Классический и альтернативный пути активации комплемента
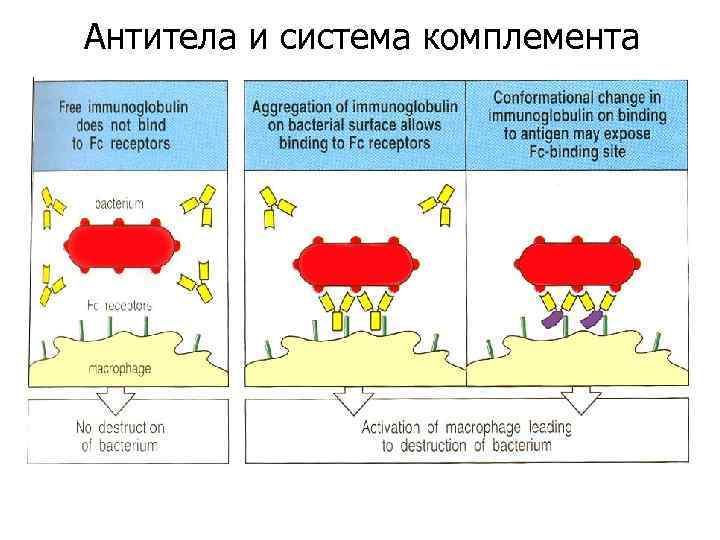 Антитела и система комплемента
Антитела и система комплемента
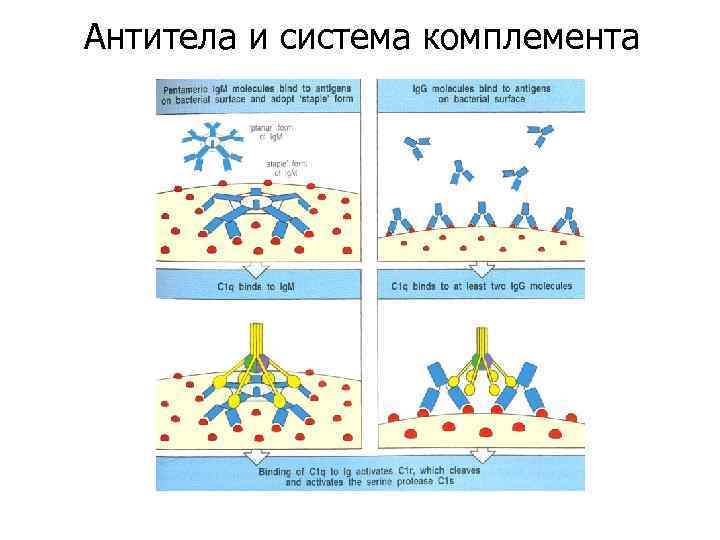 Антитела и система комплемента
Антитела и система комплемента
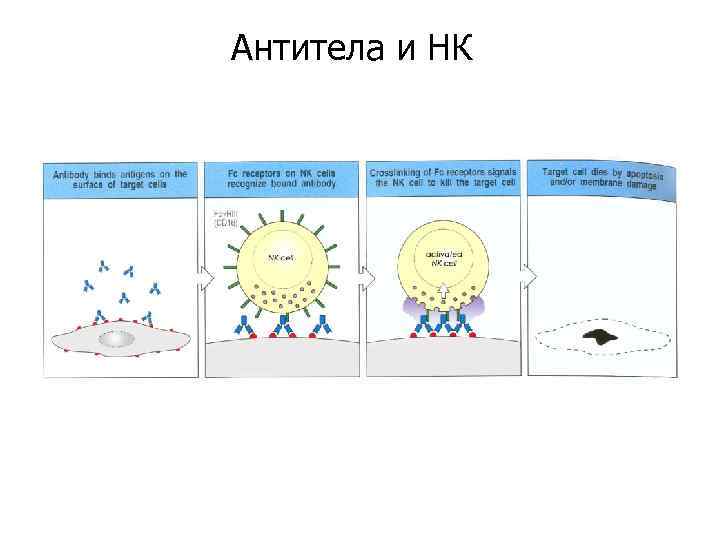 Антитела и НК
Антитела и НК
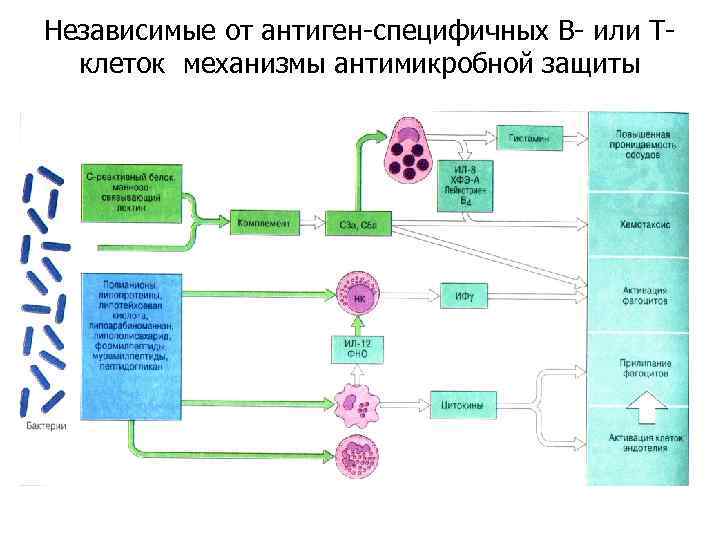 Независимые от антиген-специфичных В- или Тклеток механизмы антимикробной защиты
Независимые от антиген-специфичных В- или Тклеток механизмы антимикробной защиты
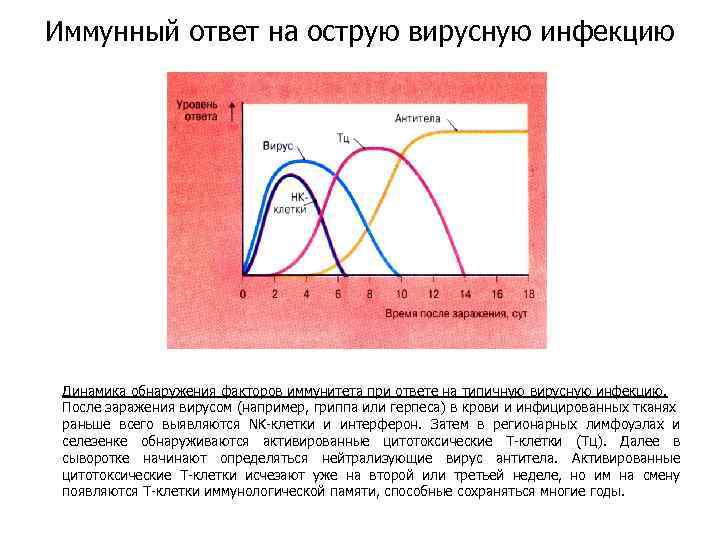 Иммунный ответ на острую вирусную инфекцию Динамика обнаружения факторов иммунитета при ответе на типичную вирусную инфекцию. После заражения вирусом (например, гриппа или герпеса) в крови и инфицированных тканях раньше всего выявляются NK-клетки и интерферон. Затем в регионарных лимфоузлах и селезенке обнаруживаются активированные цитотоксические Т-клетки (Тц). Далее в сыворотке начинают определяться нейтрализующие вирус антитела. Активированные цитотоксические Т-клетки исчезают уже на второй или третьей неделе, но им на смену появляются Т-клетки иммунологической памяти, способные сохраняться многие годы.
Иммунный ответ на острую вирусную инфекцию Динамика обнаружения факторов иммунитета при ответе на типичную вирусную инфекцию. После заражения вирусом (например, гриппа или герпеса) в крови и инфицированных тканях раньше всего выявляются NK-клетки и интерферон. Затем в регионарных лимфоузлах и селезенке обнаруживаются активированные цитотоксические Т-клетки (Тц). Далее в сыворотке начинают определяться нейтрализующие вирус антитела. Активированные цитотоксические Т-клетки исчезают уже на второй или третьей неделе, но им на смену появляются Т-клетки иммунологической памяти, способные сохраняться многие годы.
 Противовирусное действие антител Антитела нейтрализуют свободные вирусные частицы или участвуют в разрушении инфицированных вирусами клеток.
Противовирусное действие антител Антитела нейтрализуют свободные вирусные частицы или участвуют в разрушении инфицированных вирусами клеток.
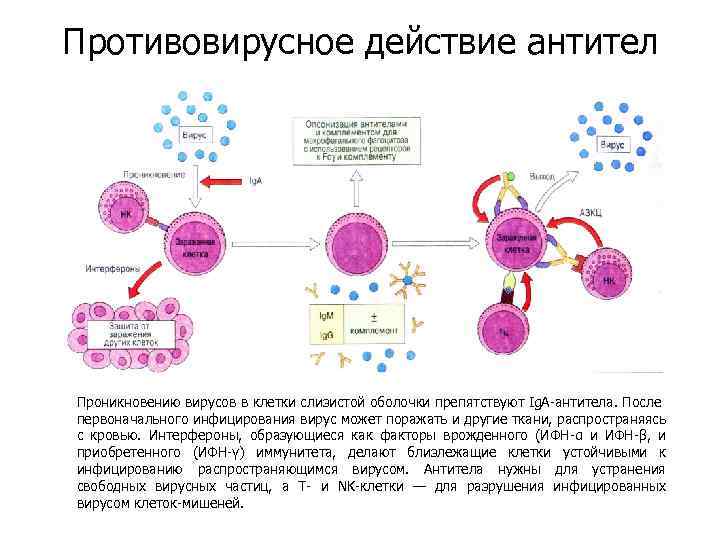 Противовирусное действие антител Проникновению вирусов в клетки слизистой оболочки препятствуют Ig. A-антитела. После первоначального инфицирования вирус может поражать и другие ткани, распространяясь с кровью. Интерфероны, образующиеся как факторы врожденного (ИФН-α и ИФН-β, и приобретенного (ИФН-γ) иммунитета, делают близлежащие клетки устойчивыми к инфицированию распространяющимся вирусом. Антитела нужны для устранения свободных вирусных частиц, а Т- и NK-клетки — для разрушения инфицированных вирусом клеток-мишеней.
Противовирусное действие антител Проникновению вирусов в клетки слизистой оболочки препятствуют Ig. A-антитела. После первоначального инфицирования вирус может поражать и другие ткани, распространяясь с кровью. Интерфероны, образующиеся как факторы врожденного (ИФН-α и ИФН-β, и приобретенного (ИФН-γ) иммунитета, делают близлежащие клетки устойчивыми к инфицированию распространяющимся вирусом. Антитела нужны для устранения свободных вирусных частиц, а Т- и NK-клетки — для разрушения инфицированных вирусом клеток-мишеней.
 В-клеточный ответ на собственные или чужеродные антигены Если отсутствуют Тх-клетки (либо потому, что их вообще нет в Тклеточном репертуаре, либо по причине делеции при индукции толерантности к собственным антигенам в тимусе), соответствующие аутореактивные В -клетки будут неспособны продуцировать аутоантитела. Продукция аутоантител может происходить в том случае, если аутореактивные В-клетки взаимодействуют с Тх-клетками, специфичными к другим, перекрестно-реагирующим антигенам, которые содержат как «свои» , так и «чужие» детерминанты.
В-клеточный ответ на собственные или чужеродные антигены Если отсутствуют Тх-клетки (либо потому, что их вообще нет в Тклеточном репертуаре, либо по причине делеции при индукции толерантности к собственным антигенам в тимусе), соответствующие аутореактивные В -клетки будут неспособны продуцировать аутоантитела. Продукция аутоантител может происходить в том случае, если аутореактивные В-клетки взаимодействуют с Тх-клетками, специфичными к другим, перекрестно-реагирующим антигенам, которые содержат как «свои» , так и «чужие» детерминанты.
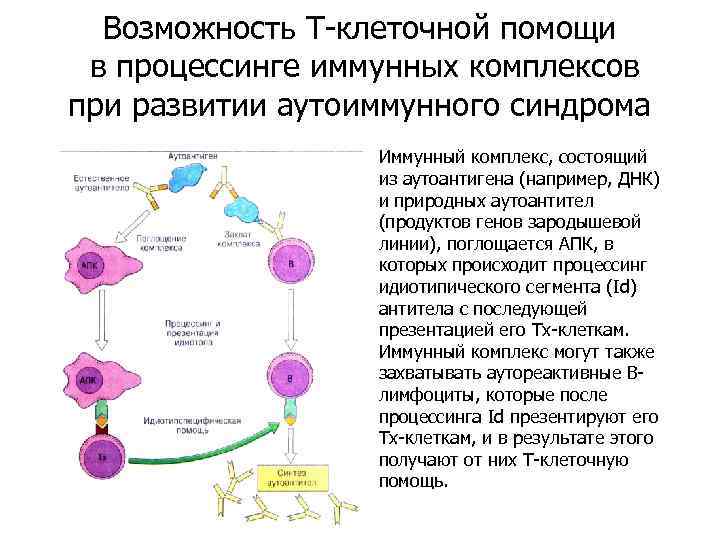 Возможность Т-клеточной помощи в процессинге иммунных комплексов при развитии аутоиммунного синдрома Иммунный комплекс, состоящий из аутоантигена (например, ДНК) и природных аутоантител (продуктов генов зародышевой линии), поглощается АПК, в которых происходит процессинг идиотипического сегмента (Id) антитела с последующей презентацией его Тх-клеткам. Иммунный комплекс могут также захватывать аутореактивные Влимфоциты, которые после процессинга Id презентируют его Тх-клеткам, и в результате этого получают от них Т-клеточную помощь.
Возможность Т-клеточной помощи в процессинге иммунных комплексов при развитии аутоиммунного синдрома Иммунный комплекс, состоящий из аутоантигена (например, ДНК) и природных аутоантител (продуктов генов зародышевой линии), поглощается АПК, в которых происходит процессинг идиотипического сегмента (Id) антитела с последующей презентацией его Тх-клеткам. Иммунный комплекс могут также захватывать аутореактивные Влимфоциты, которые после процессинга Id презентируют его Тх-клеткам, и в результате этого получают от них Т-клеточную помощь.
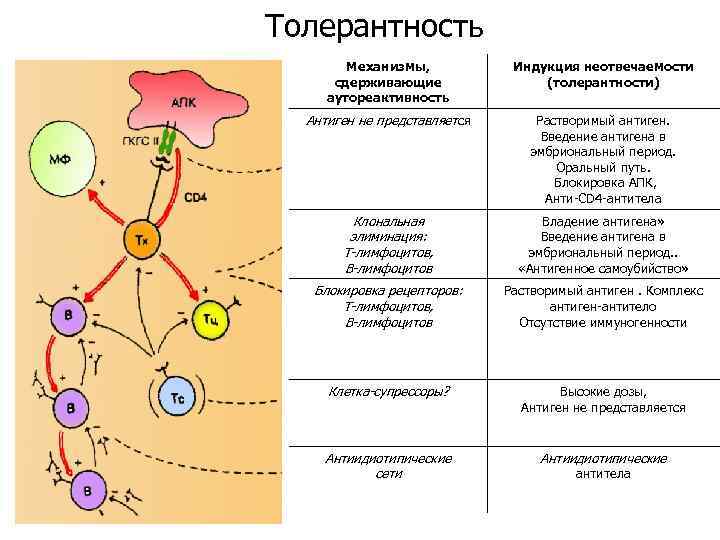 Толерантность Механизмы, сдерживающие аутореактивность Индукция неотвечаемости (толерантности) Антиген не представляется Растворимый антиген. Введение антигена в эмбриональный период. Оральный путь. Блокировка АПК, Анти-СD 4 -антитела Клональная элиминация: Т-лимфоцитов, В-лимфоцитов Владение антигена» Введение антигена в эмбриональный период. . «Антигенное самоубийство» Блокировка рецепторов: Т-лимфоцитов, В-лимфоцитов Растворимый антиген. Комплекс антиген-антитело Отсутствие иммуногенности Клетка-супрессоры? Высокие дозы, Антиген не представляется Антиидиотипические сети Антиидиотипические антитела
Толерантность Механизмы, сдерживающие аутореактивность Индукция неотвечаемости (толерантности) Антиген не представляется Растворимый антиген. Введение антигена в эмбриональный период. Оральный путь. Блокировка АПК, Анти-СD 4 -антитела Клональная элиминация: Т-лимфоцитов, В-лимфоцитов Владение антигена» Введение антигена в эмбриональный период. . «Антигенное самоубийство» Блокировка рецепторов: Т-лимфоцитов, В-лимфоцитов Растворимый антиген. Комплекс антиген-антитело Отсутствие иммуногенности Клетка-супрессоры? Высокие дозы, Антиген не представляется Антиидиотипические сети Антиидиотипические антитела
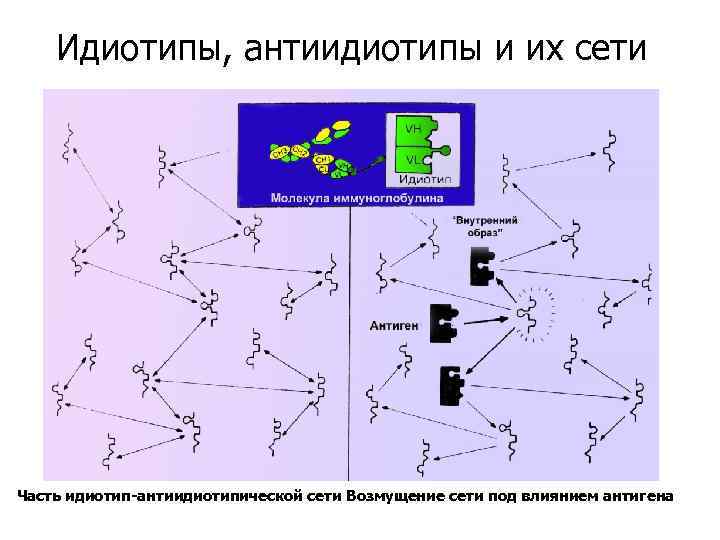 Идиотипы, антиидиотипы и их сети Часть идиотип-антиидиотипической сети Возмущение сети под влиянием антигена
Идиотипы, антиидиотипы и их сети Часть идиотип-антиидиотипической сети Возмущение сети под влиянием антигена
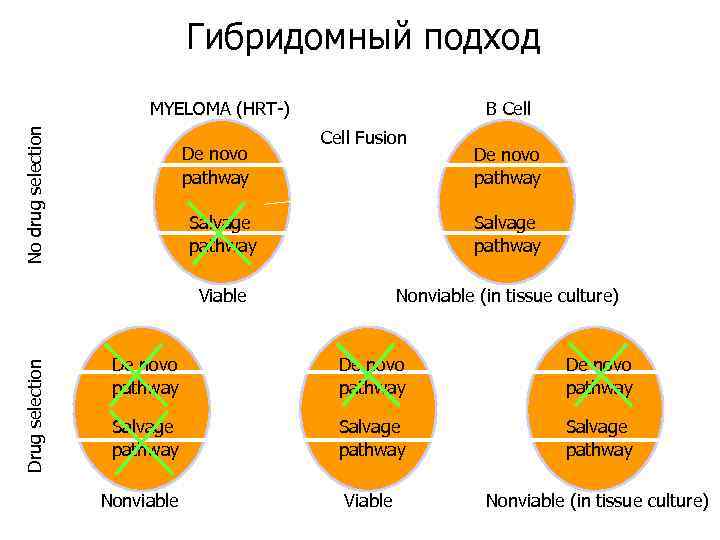 Гибридомный подход No drug selection MYELOMA (HRT-) De novo pathway B Cell Fusion De novo pathway Salvage pathway Viable Drug selection Salvage pathway Nonviable (in tissue culture) De novo pathway Salvage pathway Viable Nonviable (in tissue culture) Nonviable
Гибридомный подход No drug selection MYELOMA (HRT-) De novo pathway B Cell Fusion De novo pathway Salvage pathway Viable Drug selection Salvage pathway Nonviable (in tissue culture) De novo pathway Salvage pathway Viable Nonviable (in tissue culture) Nonviable
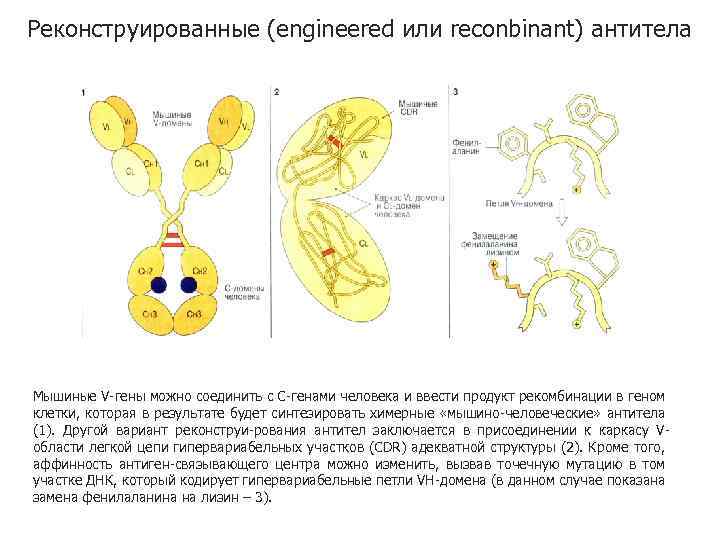 Реконструированные (engineered или reconbinant) антитела Мышиные V-гены можно соединить с С-генами человека и ввести продукт рекомбинации в геном клетки, которая в результате будет синтезировать химерные «мышино-человеческие» антитела (1). Другой вариант реконструи-рования антител заключается в присоединении к каркасу Vобласти легкой цепи гипервариабельных участков (CDR) адекватной структуры (2). Кроме того, аффинность антиген-связывающего центра можно изменить, вызвав точечную мутацию в том участке ДНК, который кодирует гипервариабельные петли VH-домена (в данном случае показана замена фенилаланина на лизин – 3).
Реконструированные (engineered или reconbinant) антитела Мышиные V-гены можно соединить с С-генами человека и ввести продукт рекомбинации в геном клетки, которая в результате будет синтезировать химерные «мышино-человеческие» антитела (1). Другой вариант реконструи-рования антител заключается в присоединении к каркасу Vобласти легкой цепи гипервариабельных участков (CDR) адекватной структуры (2). Кроме того, аффинность антиген-связывающего центра можно изменить, вызвав точечную мутацию в том участке ДНК, который кодирует гипервариабельные петли VH-домена (в данном случае показана замена фенилаланина на лизин – 3).
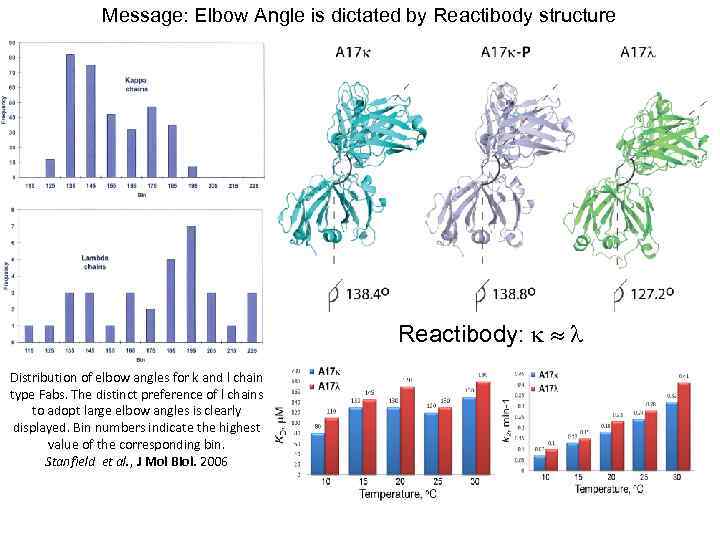 Message: Elbow Angle is dictated by Reactibody structure Reactibody: k l Distribution of elbow angles for k and l chain type Fabs. The distinct preference of l chains to adopt large elbow angles is clearly displayed. Bin numbers indicate the highest value of the corresponding bin. Stanfield et al. , J Mol Biol. 2006
Message: Elbow Angle is dictated by Reactibody structure Reactibody: k l Distribution of elbow angles for k and l chain type Fabs. The distinct preference of l chains to adopt large elbow angles is clearly displayed. Bin numbers indicate the highest value of the corresponding bin. Stanfield et al. , J Mol Biol. 2006
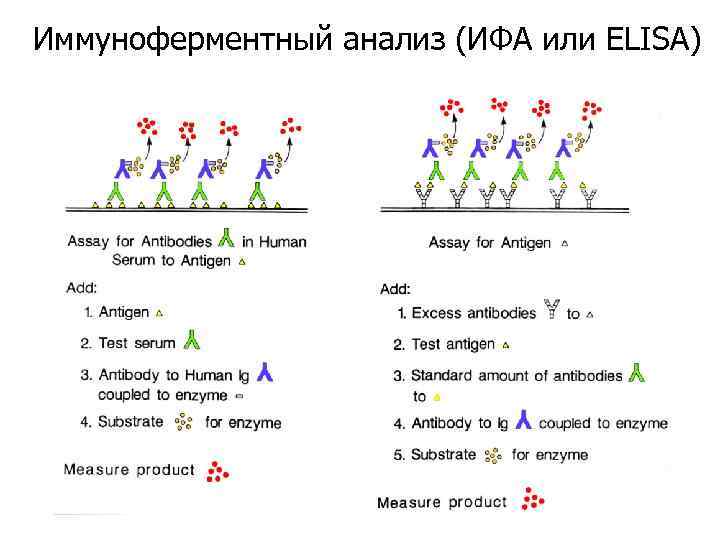 Иммуноферментный анализ (ИФА или ELISA)
Иммуноферментный анализ (ИФА или ELISA)


