ВОДА.ppt
- Количество слайдов: 44
 Гидросфера. Происхождение
Гидросфера. Происхождение
 Гидросфера - составная часть географической оболочки. К гидросфере относится водная оболочка Земли, включающая всю химически не связанную воду независимо от состояния: жидкую, твердую, газообразную. Ø Вода - самый распространенный на Земле минерал. Богатство водой - космическая особенность нашей планеты. Все или почти все процессы в географической оболочке протекают при участии воды. Ø
Гидросфера - составная часть географической оболочки. К гидросфере относится водная оболочка Земли, включающая всю химически не связанную воду независимо от состояния: жидкую, твердую, газообразную. Ø Вода - самый распространенный на Земле минерал. Богатство водой - космическая особенность нашей планеты. Все или почти все процессы в географической оболочке протекают при участии воды. Ø
 Происхождение воды. В последнее время принято считать, что основные массы воды поступили в результате дегазации магмы. При формировании первичной базальтовой коры из мантии образовалось 92 % базальтов и 8 % воды. Ø Современные лавы тоже содержат водяных паров от 4 до 8 %. В настоящее время ежегодно путем дегазации образуется до 1 км 3 воды. Эти воды называются ювинильными (юнными). Ø
Происхождение воды. В последнее время принято считать, что основные массы воды поступили в результате дегазации магмы. При формировании первичной базальтовой коры из мантии образовалось 92 % базальтов и 8 % воды. Ø Современные лавы тоже содержат водяных паров от 4 до 8 %. В настоящее время ежегодно путем дегазации образуется до 1 км 3 воды. Эти воды называются ювинильными (юнными). Ø
 Ø Вода поступает и из космоса. В межпланетном веществе по данным А. М, Аппатьева (1969) содержится около 0, 5 % воды. Ø За геологическое время выпало на Землю 0, 7*1017 кг. воды или слой толщиной 150 мм.
Ø Вода поступает и из космоса. В межпланетном веществе по данным А. М, Аппатьева (1969) содержится около 0, 5 % воды. Ø За геологическое время выпало на Землю 0, 7*1017 кг. воды или слой толщиной 150 мм.
 Считают, что уже к началу палеозоя гидросфера Земли приобрела объем, близкий к современному. В это время развивающиеся живые организмы начинают изымать воду на свое развитие (фотосинтез). Ø
Считают, что уже к началу палеозоя гидросфера Земли приобрела объем, близкий к современному. В это время развивающиеся живые организмы начинают изымать воду на свое развитие (фотосинтез). Ø
 Водный баланс В гидросфере появляются два противоположно направленных процесса: Ø 1. поступление воды в результате дегазации; Ø 2. изъятие воды: Ø - на фотосинтез. Интенсивность фотосинтеза увеличивается по мере увеличения свободного кислорода в атмосфере. Ø - изъятие воды на химическое выветривание. Ø Соотношение этих процессов определяет и водность Земли. Ø
Водный баланс В гидросфере появляются два противоположно направленных процесса: Ø 1. поступление воды в результате дегазации; Ø 2. изъятие воды: Ø - на фотосинтез. Интенсивность фотосинтеза увеличивается по мере увеличения свободного кислорода в атмосфере. Ø - изъятие воды на химическое выветривание. Ø Соотношение этих процессов определяет и водность Земли. Ø
 ВОДА и её свойства
ВОДА и её свойства
 Происхождение воды Ø Принято считать, что основные массы воды поступили в результате дегазации магмы. При формировании первичной базальтовой коры из мантии образовалось 92 % базальтов и 8 % воды. Современные лавы тоже содержат водяных паров от 4 до 8%. В настоящее время ежегодно путем дегазации образуется до 1 км 3 воды. Эти воды называются ювинильными (юнными).
Происхождение воды Ø Принято считать, что основные массы воды поступили в результате дегазации магмы. При формировании первичной базальтовой коры из мантии образовалось 92 % базальтов и 8 % воды. Современные лавы тоже содержат водяных паров от 4 до 8%. В настоящее время ежегодно путем дегазации образуется до 1 км 3 воды. Эти воды называются ювинильными (юнными).
 Происхождение воды Ø Вода поступает и из космоса. За геологическое время по данным А. М. Аппатьева (1969) выпало на Землю 0, 7*1017 кг воды или слой толщиной 150 мм.
Происхождение воды Ø Вода поступает и из космоса. За геологическое время по данным А. М. Аппатьева (1969) выпало на Землю 0, 7*1017 кг воды или слой толщиной 150 мм.
 Вода (Н 2 О)—простейшее устойчивое соединение водорода(11, 19%) с кислородом (88, 81%). Молекулярная масса - 18, 01629. При нормальной температуре и в отсутствие катализаторов вода из элементов не образуется. При 300°С реакция протекает медленно, а при 550°С - со взрывом.
Вода (Н 2 О)—простейшее устойчивое соединение водорода(11, 19%) с кислородом (88, 81%). Молекулярная масса - 18, 01629. При нормальной температуре и в отсутствие катализаторов вода из элементов не образуется. При 300°С реакция протекает медленно, а при 550°С - со взрывом.
 Химический состав воды Ø В природе существует три изотопа водорода: Ø обычный «легкий» водород, протий Н, с массовым числом 1, 00797, Ø дейтерий D с массовым числом 2; Ø тритий Т с массовым числом 3.
Химический состав воды Ø В природе существует три изотопа водорода: Ø обычный «легкий» водород, протий Н, с массовым числом 1, 00797, Ø дейтерий D с массовым числом 2; Ø тритий Т с массовым числом 3.
 Химический состав воды Ø Изотопов кислорода три - (О 16, О 17, О 18). Больше всего легкого кислорода О 16, Ø меньше — тяжелого О 18, Ø совсем мало — кислорода О 17. Ø
Химический состав воды Ø Изотопов кислорода три - (О 16, О 17, О 18). Больше всего легкого кислорода О 16, Ø меньше — тяжелого О 18, Ø совсем мало — кислорода О 17. Ø
 Химический состав воды Ø Природная вода - речная, озерная, дождевая, снеговая, ледниковая, подземная и океаническая - состоит смеси молекул, включающих изотопы водорода и стабильные изотопы кислорода. В ней встречается восемнадцать следующих разновидностей: Н 2 О 16, Н 2 О 17, Н 2 О 18, HDO 16, HDO 17, HDO 18, D 2016, D 2 O 17, D 2 O 18, T 2 O 16, T 2 О 17, T 2 O 18, THO 16, THO 17, THO 18, TDO 16, TDO 17 и ТDО 18.
Химический состав воды Ø Природная вода - речная, озерная, дождевая, снеговая, ледниковая, подземная и океаническая - состоит смеси молекул, включающих изотопы водорода и стабильные изотопы кислорода. В ней встречается восемнадцать следующих разновидностей: Н 2 О 16, Н 2 О 17, Н 2 О 18, HDO 16, HDO 17, HDO 18, D 2016, D 2 O 17, D 2 O 18, T 2 O 16, T 2 О 17, T 2 O 18, THO 16, THO 17, THO 18, TDO 16, TDO 17 и ТDО 18.
 Химический состав воды Ø Основной является вода, образованная изотопами Н и О 16 (Н 2 О 16). Ø Остальные виды воды в природной воде содержатся в незначительных концентрациях (от 0, 04% Н 2 017 до 0, 9· 10 -9 D 2 O 17).
Химический состав воды Ø Основной является вода, образованная изотопами Н и О 16 (Н 2 О 16). Ø Остальные виды воды в природной воде содержатся в незначительных концентрациях (от 0, 04% Н 2 017 до 0, 9· 10 -9 D 2 O 17).
 По изотопному составу вода в разных естественных условиях неодинакова. Содержание изотопных молекул меняется в зависимости от источника происхождения и от того, что с ней происходило в бесконечном и многообразном процессе ее круговорота в природе. При испарении вода обогащается протием, поэтому дождевая вода не похожа на речную или морскую. При замерзании в воде уменьшается содержание тяжелого водорода, но зато повышается количество тяжелого кислорода. Поэтому вода из растаявшего льда уже другая и отличается от той, из которой лед был получен.
По изотопному составу вода в разных естественных условиях неодинакова. Содержание изотопных молекул меняется в зависимости от источника происхождения и от того, что с ней происходило в бесконечном и многообразном процессе ее круговорота в природе. При испарении вода обогащается протием, поэтому дождевая вода не похожа на речную или морскую. При замерзании в воде уменьшается содержание тяжелого водорода, но зато повышается количество тяжелого кислорода. Поэтому вода из растаявшего льда уже другая и отличается от той, из которой лед был получен.
 Структура молекулы Три атома, составляющие молекулу H 2 O, образуют равнобедренный треугольник, в вершине которого находится атом кислорода, а в углах при основании атомы водорода. При равновесном положении ядер молекула воды в парообразном состоянии имеет следующие характеристики: расстояние О—Н=0, 96 Å (ангстрема), т. е. 10 -10 м; расстояние Н—H=1, 50 Å, угол НОН— 104° 27'.
Структура молекулы Три атома, составляющие молекулу H 2 O, образуют равнобедренный треугольник, в вершине которого находится атом кислорода, а в углах при основании атомы водорода. При равновесном положении ядер молекула воды в парообразном состоянии имеет следующие характеристики: расстояние О—Н=0, 96 Å (ангстрема), т. е. 10 -10 м; расстояние Н—H=1, 50 Å, угол НОН— 104° 27'.
 Молекула воды имеет два положительных (атом водорода) и два отрицательных (на неподеленных электронных парах атомов кислорода) полюса зарядов, расположенных под углом, близким к тетраэдрическому. Четыре полюса зарядов позволяют каждой молекуле воды образовывать четыре водородные связи с соседними молекула.
Молекула воды имеет два положительных (атом водорода) и два отрицательных (на неподеленных электронных парах атомов кислорода) полюса зарядов, расположенных под углом, близким к тетраэдрическому. Четыре полюса зарядов позволяют каждой молекуле воды образовывать четыре водородные связи с соседними молекула.
 Тетраэдральное расположение молекул воды за счёт водородных связей
Тетраэдральное расположение молекул воды за счёт водородных связей
 Водородные связи примерно в 10 раз сильнее межмолекулярных взаимодействий, которые характерны для большинства других жидкостей. Поэтому для плавления, испарения и нагревания воды необходима гораздо большая энергия, чем и объясняются аномально высокие удельная теплота плавления, испарения и теплоемкость.
Водородные связи примерно в 10 раз сильнее межмолекулярных взаимодействий, которые характерны для большинства других жидкостей. Поэтому для плавления, испарения и нагревания воды необходима гораздо большая энергия, чем и объясняются аномально высокие удельная теплота плавления, испарения и теплоемкость.
 Аномальные свойства воды Водородные связи обусловили сильное сцепление молекул. Ø Поэтому вода стала жидкостью с tплав= ОºС. (Как обычная окись вода должна была превращаться в пар при -80ºС). Ø Единственный минерал который может одновременно находиться в трех состояниях жидком, газообразном, твердом. Температура, при которой все три фазы равновесны, +0, 01ºС. Ø
Аномальные свойства воды Водородные связи обусловили сильное сцепление молекул. Ø Поэтому вода стала жидкостью с tплав= ОºС. (Как обычная окись вода должна была превращаться в пар при -80ºС). Ø Единственный минерал который может одновременно находиться в трех состояниях жидком, газообразном, твердом. Температура, при которой все три фазы равновесны, +0, 01ºС. Ø
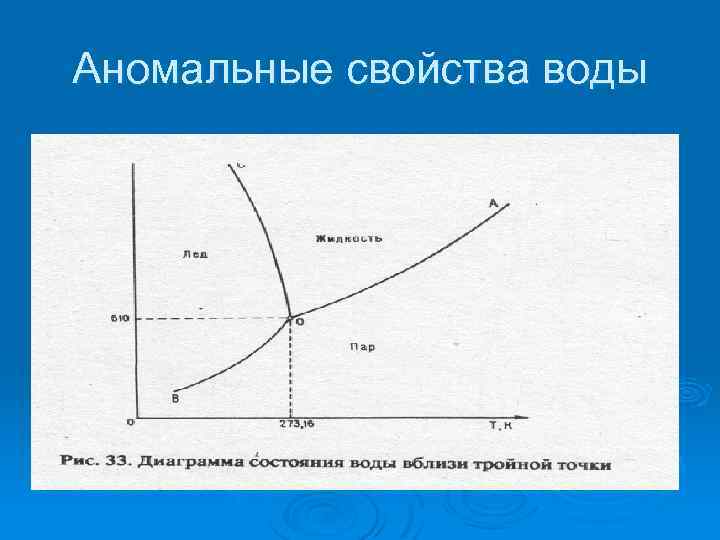 Аномальные свойства воды
Аномальные свойства воды
 Аномальные свойства воды При замерзании воды удельный объем увеличивается примерно на 10 %. Плотность чистого льда при 0 ºС равна 0, 9167· 103 кг/м 3, т. е. меньше чем у воды (0, 9999· 103 кг/м 3). Поэтому лед держится на поверхности воды, предохраняя водоемы от промерзания до дна.
Аномальные свойства воды При замерзании воды удельный объем увеличивается примерно на 10 %. Плотность чистого льда при 0 ºС равна 0, 9167· 103 кг/м 3, т. е. меньше чем у воды (0, 9999· 103 кг/м 3). Поэтому лед держится на поверхности воды, предохраняя водоемы от промерзания до дна.
 Аномальные свойства воды Максимальная плотность чистой воды наблюдается при +4 ºС. По этой причине зимой не возможна циркуляция воды в водоемах. Охлажденная (более легкая) вода остается на поверхности. Ø Плотность вначале увеличивается в связи с частичным разрушением тетраэдальной структуры, а при повышении температуры более 4º С плотность уменьшается вследствие увеличения расстояний между молекулами. Ø
Аномальные свойства воды Максимальная плотность чистой воды наблюдается при +4 ºС. По этой причине зимой не возможна циркуляция воды в водоемах. Охлажденная (более легкая) вода остается на поверхности. Ø Плотность вначале увеличивается в связи с частичным разрушением тетраэдальной структуры, а при повышении температуры более 4º С плотность уменьшается вследствие увеличения расстояний между молекулами. Ø
 Аномальные свойства воды Ø Ослабляя взаимодействие электронных зарядов (в 80 раз в сравнении с воздухом), вода поддерживает растворенные в ней вещества в ионизированном состоянии. Ø Вода - универсальный растворитель. Универсальная растворительная способность воды обеспечивает перенос вещества в географической оболочке, в том числе солевой обмен. Эта способность лежит в основе обмена веществами между организмами и средой, в основе питания.
Аномальные свойства воды Ø Ослабляя взаимодействие электронных зарядов (в 80 раз в сравнении с воздухом), вода поддерживает растворенные в ней вещества в ионизированном состоянии. Ø Вода - универсальный растворитель. Универсальная растворительная способность воды обеспечивает перенос вещества в географической оболочке, в том числе солевой обмен. Эта способность лежит в основе обмена веществами между организмами и средой, в основе питания.
 Аномальные свойства воды Ø Теплоемкость воды аномально велика - 1 кал/г град (4186 дж/(кг К) при 15°С). Вода уступает по теплоемкости водороду 3, 4 кал/г град (14200 дж/(кг К) и жидком аммиаку 1, 2 кал/г град (5020 дж/(кг К), но выше, чем у всех остальных веществ на Земле.
Аномальные свойства воды Ø Теплоемкость воды аномально велика - 1 кал/г град (4186 дж/(кг К) при 15°С). Вода уступает по теплоемкости водороду 3, 4 кал/г град (14200 дж/(кг К) и жидком аммиаку 1, 2 кал/г град (5020 дж/(кг К), но выше, чем у всех остальных веществ на Земле.
 Аномальные свойства воды Чистая вода кипит при нормальном давлении при температуре 100 ºС. С увеличением давления температура кипения воды повышается, а с его уменьшением понижается. Ø Температура кипения воды зависит не только от внешнего давления, но и от тех примесей, которые находятся в ней. С увеличением, солености температура кипения незначительно повышается. Ø
Аномальные свойства воды Чистая вода кипит при нормальном давлении при температуре 100 ºС. С увеличением давления температура кипения воды повышается, а с его уменьшением понижается. Ø Температура кипения воды зависит не только от внешнего давления, но и от тех примесей, которые находятся в ней. С увеличением, солености температура кипения незначительно повышается. Ø
 Аномальные свойства воды Ø Самое высокое капиллярное натяжение. Оно обуславливает особые свойства. Не замерзает кап. вода при -30 ºС. Обеспечивает смачивающие свойства. Ø Разлагаясь при фотосинтезе, пополняет атмосферу кислородом.
Аномальные свойства воды Ø Самое высокое капиллярное натяжение. Оно обуславливает особые свойства. Не замерзает кап. вода при -30 ºС. Обеспечивает смачивающие свойства. Ø Разлагаясь при фотосинтезе, пополняет атмосферу кислородом.
 Аномальные свойства воды Ø Вода самоочищается. Вода фильтруется в почвах, при испарении, при осаждении осадков. Ø Вода вездесуща. Она пронизывает всю географическую оболочку.
Аномальные свойства воды Ø Вода самоочищается. Вода фильтруется в почвах, при испарении, при осаждении осадков. Ø Вода вездесуща. Она пронизывает всю географическую оболочку.
 Структура гидросферы Ø ГИДРОСФЕРА состоит из ярусов: Ø НАДЗЕМНОГО Ø НАЗЕМНОГО Ø ПОДЗЕМНОГО
Структура гидросферы Ø ГИДРОСФЕРА состоит из ярусов: Ø НАДЗЕМНОГО Ø НАЗЕМНОГО Ø ПОДЗЕМНОГО
 Надземный ярус Прдставляет влагу атмосферы. Общий объём 14 тыс. куб. км. Выделяют нижний подъярус и верхний.
Надземный ярус Прдставляет влагу атмосферы. Общий объём 14 тыс. куб. км. Выделяют нижний подъярус и верхний.
 Подземный ярус Ø Представлен подземными водами земной коры. Ø Общий объём 60 млн. куб. км. Ø Объём зоны активного водообмена 4 млн. куб. км.
Подземный ярус Ø Представлен подземными водами земной коры. Ø Общий объём 60 млн. куб. км. Ø Объём зоны активного водообмена 4 млн. куб. км.
 Наземный ярус Ø Океаносфера – 1 370 млн. км 3 Ø Вода суши – 231, 2 тыс. км 3 Ø Хионосфера (ледяная оболочка Земли) – 24 млн. км 3
Наземный ярус Ø Океаносфера – 1 370 млн. км 3 Ø Вода суши – 231, 2 тыс. км 3 Ø Хионосфера (ледяная оболочка Земли) – 24 млн. км 3
 Океаносфера Ø Океаны Ø Моря Ø Заливы Ø Проливы Ø Бухты
Океаносфера Ø Океаны Ø Моря Ø Заливы Ø Проливы Ø Бухты
 Воды суши Ø Реки Ø Озера Ø Болота
Воды суши Ø Реки Ø Озера Ø Болота
 Хионосфера ØГорные ледники ØМатериковые ледники
Хионосфера ØГорные ледники ØМатериковые ледники
 Круговорот воды Ø Заключается в способности воды переходить из жидкого состояния в газообразное или твердое при изменении температуры воздуха. Ø Основные звенья – испарение, атмосферные осадки и сток.
Круговорот воды Ø Заключается в способности воды переходить из жидкого состояния в газообразное или твердое при изменении температуры воздуха. Ø Основные звенья – испарение, атмосферные осадки и сток.
 Выделяют следующие круговороты воды: Ø Большой круговорот (мировой); Ø Малые круговороты (материковый, океанский, атмосферный).
Выделяют следующие круговороты воды: Ø Большой круговорот (мировой); Ø Малые круговороты (материковый, океанский, атмосферный).
 Большой круговорот
Большой круговорот
 Водный баланс Соотношение составляющих влагооборота в числовом значении называется водным балансом. Ø Водный баланс материкового звена: Ø Xc = Ec + Yс + f , где Ø Xc - кол-во осадков, выпадающих на сушу; Ø Ec - кол-во испарившейся влаги с пов. суши; Ø Yс – сток поверхностных вод; Ø f - кол-во просочившейся в почвогрунты влаги. Ø
Водный баланс Соотношение составляющих влагооборота в числовом значении называется водным балансом. Ø Водный баланс материкового звена: Ø Xc = Ec + Yс + f , где Ø Xc - кол-во осадков, выпадающих на сушу; Ø Ec - кол-во испарившейся влаги с пов. суши; Ø Yс – сток поверхностных вод; Ø f - кол-во просочившейся в почвогрунты влаги. Ø
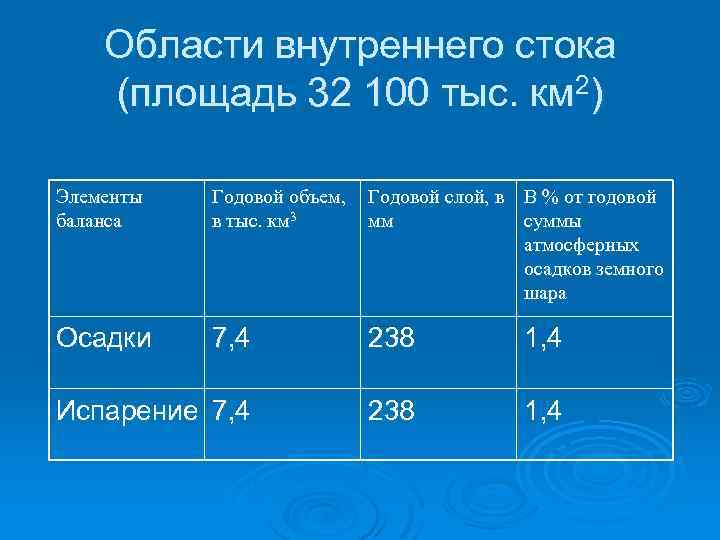 Области внутреннего стока (площадь 32 100 тыс. км 2) Элементы баланса Годовой объем, в тыс. км 3 Годовой слой, в В % от годовой мм суммы атмосферных осадков земного шара Осадки 7, 4 238 1, 4 Испарение 7, 4 238 1, 4
Области внутреннего стока (площадь 32 100 тыс. км 2) Элементы баланса Годовой объем, в тыс. км 3 Годовой слой, в В % от годовой мм суммы атмосферных осадков земного шара Осадки 7, 4 238 1, 4 Испарение 7, 4 238 1, 4
 Водный баланс Ø Океанское звено Ø Eo = Xo + Yc Ø где Ео – испарение с поверхности океана; • Хо – осадки на поверхн. океана; • Yс –сток с материка.
Водный баланс Ø Океанское звено Ø Eo = Xo + Yc Ø где Ео – испарение с поверхности океана; • Хо – осадки на поверхн. океана; • Yс –сток с материка.
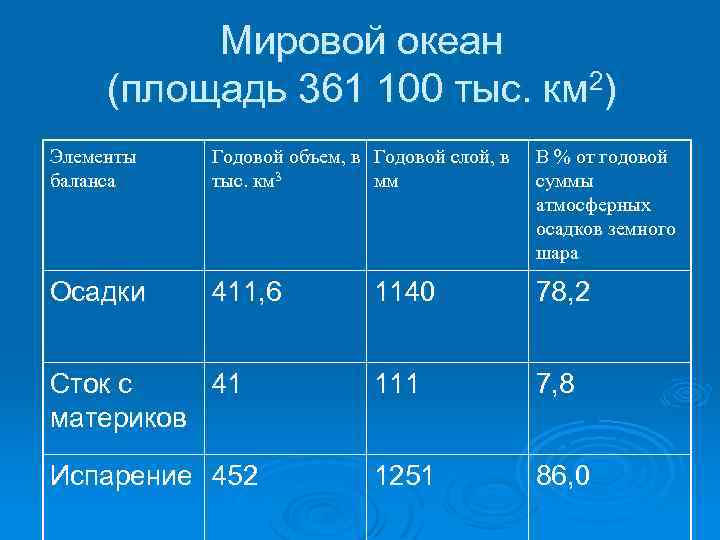 Мировой океан (площадь 361 100 тыс. км 2) Элементы баланса Годовой объем, в Годовой слой, в тыс. км 3 мм В % от годовой суммы атмосферных осадков земного шара Осадки 411, 6 1140 78, 2 Сток с 41 материков 111 7, 8 Испарение 452 1251 86, 0
Мировой океан (площадь 361 100 тыс. км 2) Элементы баланса Годовой объем, в Годовой слой, в тыс. км 3 мм В % от годовой суммы атмосферных осадков земного шара Осадки 411, 6 1140 78, 2 Сток с 41 материков 111 7, 8 Испарение 452 1251 86, 0
 Значение круговорота воды Ø Обновление и очищение воды Ø Перенос влаги на материки Ø Перенос тепла
Значение круговорота воды Ø Обновление и очищение воды Ø Перенос влаги на материки Ø Перенос тепла
 Обновление гидросферы круговоротом воды Подземные воды сотни тысяч, млн. лет; Ø Ледники 8000 лет; Ø Океан 3000 лет; Ø Проточные озера за десятки лет; Ø Бессточ. озера 200 -300 лет; Ø Почвен. влага 1 год; Ø Реки 30 раз в год; Ø Атмосфера 40 -45 раз в год. Ø
Обновление гидросферы круговоротом воды Подземные воды сотни тысяч, млн. лет; Ø Ледники 8000 лет; Ø Океан 3000 лет; Ø Проточные озера за десятки лет; Ø Бессточ. озера 200 -300 лет; Ø Почвен. влага 1 год; Ø Реки 30 раз в год; Ø Атмосфера 40 -45 раз в год. Ø


