ФЭн, РЭФ 2017 Лекция -10 Гидролиз.ppt
- Количество слайдов: 23

ГИДРОЛИЗ СОЛЕЙ

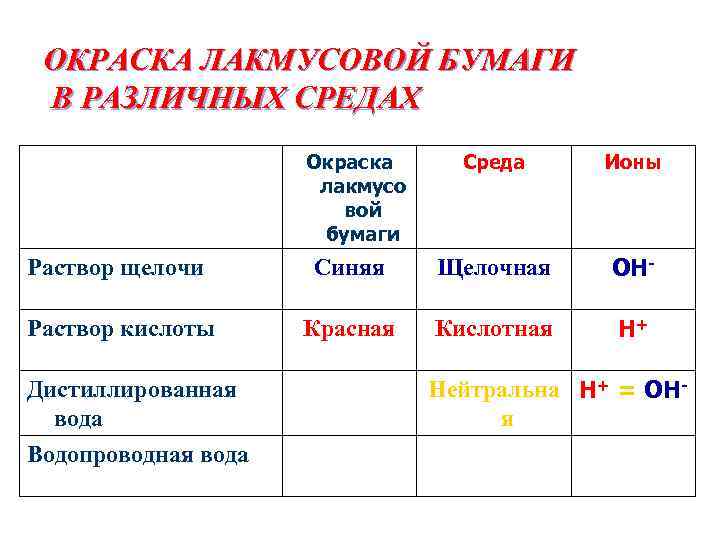
ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ Окраска лакмусо вой бумаги Среда Ионы Раствор щелочи Синяя Щелочная ОН- Раствор кислоты Красная Кислотная Н+ Дистиллированная вода Водопроводная вода Бесцветная Нейтральна Н+ = ОНя

Гидролиз солей определение понятия «гидролиз» Цели: • научиться объяснять химические протекающие в водных растворах солей процессы, • записывать уравнения реакций гидролиза • предсказывать и объяснять изменение кислотности среды и образование кислых и основных солей в этом процессе • познакомиться с ролью гидролиза солей в природе, хозяйственной деятельности и повседневной жизни человека.

«ГИДРОЛИЗ» от греческого «гидро» - вода «лизис» - разложение
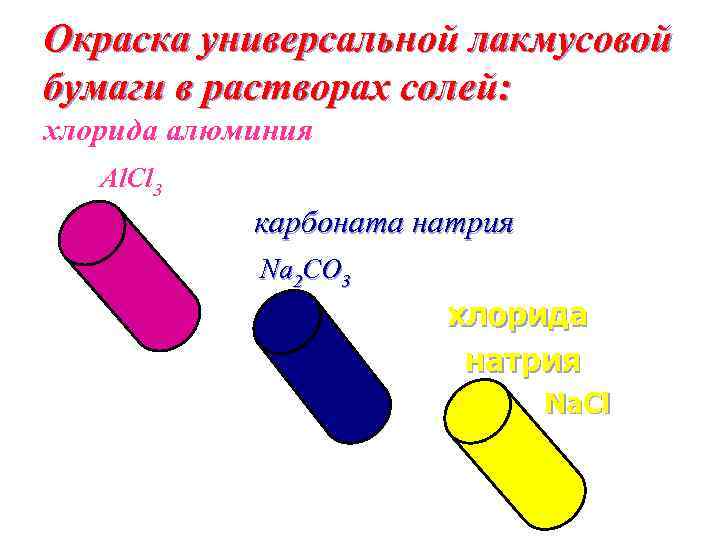
Окраска универсальной лакмусовой бумаги в растворах солей: хлорида алюминия Al. Cl 3 карбоната натрия Na 2 CO 3 хлорида натрия Na. Cl

Механизм гидролиза хлорида алюминия 1) Диссоциация молекул воды: H 2 O H+ + OH- 2) Диссоциация молекул соли (под действием молекул воды): Al. Cl 3 Al 3+ + 3 Cl- 3) Гидролиз по катиону слабого основания 1 ступень: Al 3+ +3 Cl- +HOH Al (OH)3: Al OH 2+ +H+ + 3 Clкислая среда
![Схема гидролиза хлорида алюминия Al. Cl 3 Al(OH)3 слабое основание [OH]- < + HCl Схема гидролиза хлорида алюминия Al. Cl 3 Al(OH)3 слабое основание [OH]- < + HCl](https://present5.com/presentation/-128008481_444261702/image-8.jpg)
Схема гидролиза хлорида алюминия Al. Cl 3 Al(OH)3 слабое основание [OH]- < + HCl сильная кислота [H]+ (что сильней того и больше!) К и с л о т н а я среда

СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ • Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза. • Написать на основании краткого ионного уравнения молекулярное уравнение. Исходные вещества известны – соль и вода. Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.

Al 3+ + HOH Al. Cl 3 + H 2 O Al. OH 2+ + H+ Al. OHCl 2 + HCl Одним из продуктов данной обменной реакции является основная соль. Вывод: Раствор соли, образованной катионом слабого основания имеет кислую реакцию, так как в растворе избыток протонов.

Гидролиз карбоната натрия H 2 O Na 2 CO 3 H+ + OH 2 Na+ + CO 32 - 2 Na+ +CO 32 - +H +OH - HCO 3 - +2 Na+ +OH-

Гидролиз карбоната натрия Na 2 CO 3 Na. OH H 2 CO 3 сильное основание [OH]- > слабая кислота [H]+ (что сильней того и больше!) Щ е л о ч н а я среда

СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ солей ГИДРОЛИЗА ПО АНИОНУ СЛАБОЙ КИСЛОТЫ • Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. • Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза. • Написать на основании краткого ионного уравнения молекулярное уравнение. Исходные вещества известны – соль и вода. Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.
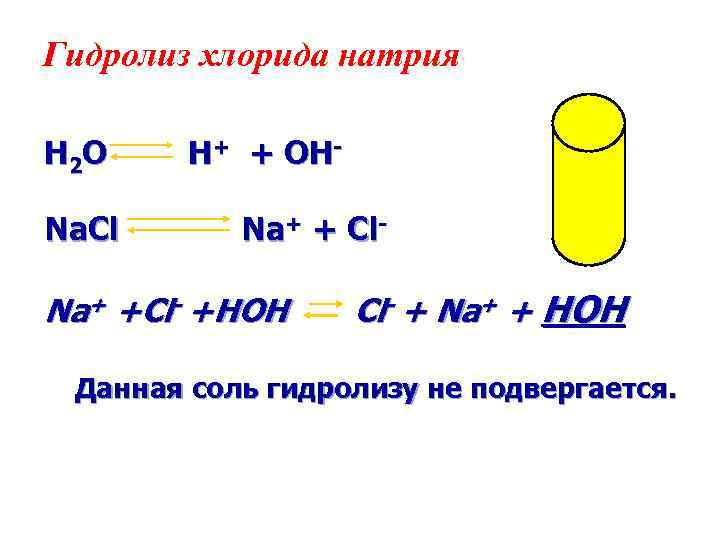
Гидролиз хлорида натрия H 2 O Na. Сl H+ + OHNa+ + Cl- Na+ +Cl- +HOH Cl- + Na+ + HOH Данная соль гидролизу не подвергается.
![Схема гидролиза хлорида натрия Na. Cl Na. OH HCl сильное основание [OH]- сильная кислота Схема гидролиза хлорида натрия Na. Cl Na. OH HCl сильное основание [OH]- сильная кислота](https://present5.com/presentation/-128008481_444261702/image-15.jpg)
Схема гидролиза хлорида натрия Na. Cl Na. OH HCl сильное основание [OH]- сильная кислота = [H ]+ Н е й т р а л ь н а я среда

Na. Cl + Н 2 О = Вывод: Раствор соли, образованной катионом сильного основания и анионом сильной кислоты, имеет нейтральную реакцию. В этом случае гидролиз не идет.

ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.

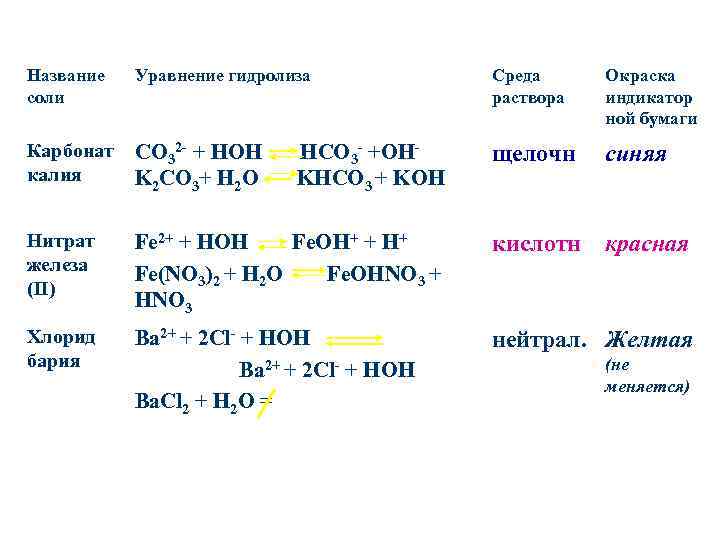
Название соли Уравнение гидролиза Среда раствора Окраска индикатор ной бумаги Карбонат калия CO 32 - + HOH K 2 CO 3+ H 2 O HCO 3 - +OHKHCO 3 + KOH щелочн синяя Нитрат железа (II) Fe 2+ + HOH Fe. OH+ + H+ Fe(NO 3)2 + H 2 O Fe. OHNO 3 + HNO 3 кислотн красная Хлорид бария Ba 2+ + 2 Cl- + HOH Ba. Cl 2 + H 2 O = нейтрал. Желтая (не меняется)

Роль гидролиза в природе • Преобразование земной коры • Обеспечение слабощелочной среды морской воды

Роль гидролиза в народном хозяйстве • Порча производственного оборудования • Выработка из непищевого сырья ценных продуктов • • • (бумага, мыло, спирт, глюкоза, белковые дрожжи) Очистка промышленных стоков и питьевой воды (сульфат алюминия + вода гидроксид алюминия + разбавленная серная кислота) Подготовка тканей к окрашиванию Известкование почв основано на гидролизе

Гидролиз в повседневной жизни человека • Стирка • Мытье посуды • Умывание с мылом • Процессы пищеварения

• 1 вариант: S 2 - + HOH HS- + OH- • 2 вариант: Mg 2+ + HOH Mg. OH+ + H+ Приведены краткие ионные уравнения гидролиза. Напишите: молекулярные уравнения гидролиза солей, которым соответствуют эти краткие ионные уравнения.
ФЭн, РЭФ 2017 Лекция -10 Гидролиз.ppt