 ГИДРОЛИЗ СОЛЕЙ .
ГИДРОЛИЗ СОЛЕЙ .
 Гидролиз - это разложение веществ молекулами воды (гидро - вода, лизис - расщепление, разложение). Гидролиз солей - это разложение солей молекулами воды. С точки зрения теории электролитической диссоциации все соли можно разделить на 4 группы.
Гидролиз - это разложение веществ молекулами воды (гидро - вода, лизис - расщепление, разложение). Гидролиз солей - это разложение солей молекулами воды. С точки зрения теории электролитической диссоциации все соли можно разделить на 4 группы.
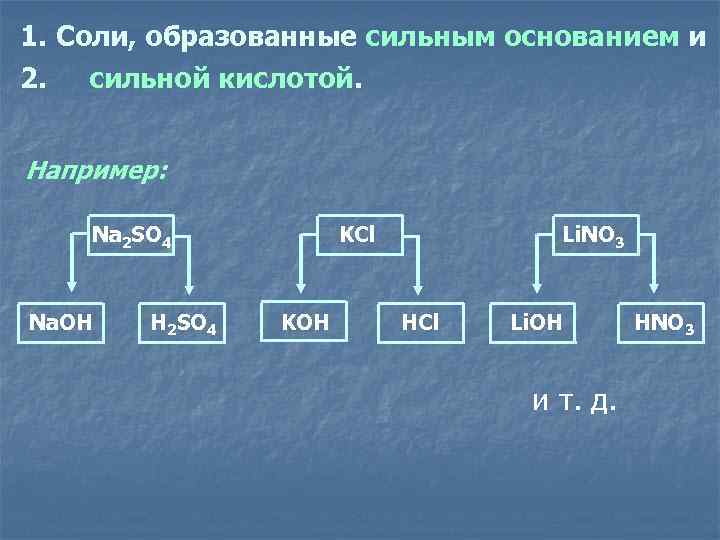 1. Соли, образованные сильным основанием и 2. сильной кислотой. Например: Na 2 SO 4 KCl Li. NO 3 Na. OH H 2 SO 4 KOH HCl Li. OH HNO 3 и т. д.
1. Соли, образованные сильным основанием и 2. сильной кислотой. Например: Na 2 SO 4 KCl Li. NO 3 Na. OH H 2 SO 4 KOH HCl Li. OH HNO 3 и т. д.
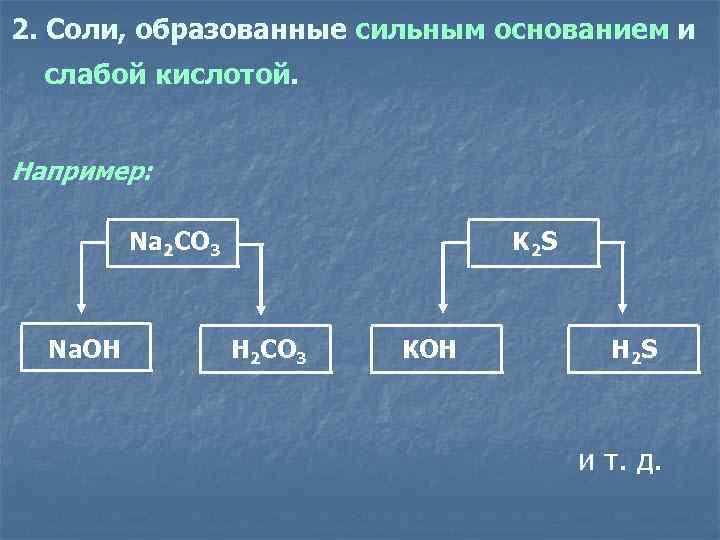 2. Соли, образованные сильным основанием и слабой кислотой. Например: Na 2 CO 3 K 2 S Na. OH H 2 CO 3 KOH H 2 S и т. д.
2. Соли, образованные сильным основанием и слабой кислотой. Например: Na 2 CO 3 K 2 S Na. OH H 2 CO 3 KOH H 2 S и т. д.
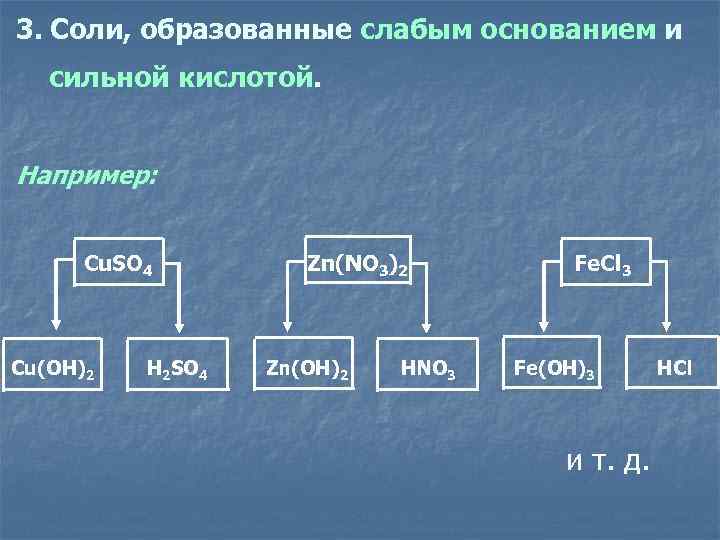 3. Соли, образованные слабым основанием и сильной кислотой. Например: Cu. SO 4 Zn(NO 3)2 Fe. Cl 3 Cu(OH)2 H 2 SO 4 Zn(OH)2 HNO 3 Fe(OH)3 HCl и т. д.
3. Соли, образованные слабым основанием и сильной кислотой. Например: Cu. SO 4 Zn(NO 3)2 Fe. Cl 3 Cu(OH)2 H 2 SO 4 Zn(OH)2 HNO 3 Fe(OH)3 HCl и т. д.
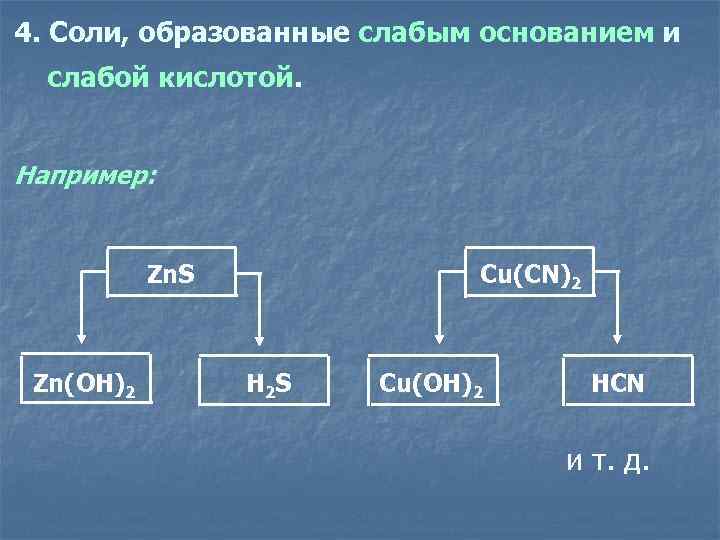 4. Соли, образованные слабым основанием и слабой кислотой. Например: Zn. S Cu(CN)2 Zn(OH)2 H 2 S Cu(OH)2 HCN и т. д.
4. Соли, образованные слабым основанием и слабой кислотой. Например: Zn. S Cu(CN)2 Zn(OH)2 H 2 S Cu(OH)2 HCN и т. д.
 Гидролиз - процесс чаще всего обратимый. Обратимые реакции обозначают <==>. Обратимые реакции - это реакции, идущие как в сторону прямой, так и обратной реакции. Прямая реакция - реакция, в результате которой образуются продукты реакции. Обратная реакция - реакция, в результате которой образуются вновь исходные вещества. прямая реакция Cu. Cl 2 + H 2 O <=======> Cu. OHCl + HCl обратная реакция
Гидролиз - процесс чаще всего обратимый. Обратимые реакции обозначают <==>. Обратимые реакции - это реакции, идущие как в сторону прямой, так и обратной реакции. Прямая реакция - реакция, в результате которой образуются продукты реакции. Обратная реакция - реакция, в результате которой образуются вновь исходные вещества. прямая реакция Cu. Cl 2 + H 2 O <=======> Cu. OHCl + HCl обратная реакция
 1. Соли, образованные сильным основанием и основанием 2. сильной кислотой гидролизу не кислотой подвергаются. Например: Na 2 SO 4 + H 2 O гидролизу не подвергается. подвергается
1. Соли, образованные сильным основанием и основанием 2. сильной кислотой гидролизу не кислотой подвергаются. Например: Na 2 SO 4 + H 2 O гидролизу не подвергается. подвергается
 2. Соли, образованные сильным основанием и основанием слабой кислотой, при гидролизе образуют кислотой сильное основание и кислую соль. соль (Исключение составляют соли, образованные сильным основанием и одноосновной кислотой ). Гидролиз по аниону, среда щелочная.
2. Соли, образованные сильным основанием и основанием слабой кислотой, при гидролизе образуют кислотой сильное основание и кислую соль. соль (Исключение составляют соли, образованные сильным основанием и одноосновной кислотой ). Гидролиз по аниону, среда щелочная.
 Например: Na 2 CO 3 + H 2 O ↔ Na. OH + Na. HCO 3 / Na. OH H 2 CO 3 cильн. слабая основан. кислота СO 32 - + H+OH ↔ HCO 3 - + OH- (краткое ионное уравнение) 2 Na+ + CO 32 - + H 2 O ↔ HCO 3 - + OH- + 2 Na+ (полное ионное уравнение) гидролиз по аниону (СO 32 -) среда щелочная (OH-) р. Н > 7
Например: Na 2 CO 3 + H 2 O ↔ Na. OH + Na. HCO 3 / Na. OH H 2 CO 3 cильн. слабая основан. кислота СO 32 - + H+OH ↔ HCO 3 - + OH- (краткое ионное уравнение) 2 Na+ + CO 32 - + H 2 O ↔ HCO 3 - + OH- + 2 Na+ (полное ионное уравнение) гидролиз по аниону (СO 32 -) среда щелочная (OH-) р. Н > 7
 3. Соли, образованные слабым основанием и основанием сильной кислотой, при гидролизе образуют кислотой сильную кислоту и основную соль. соль (Исключение составляют соли, образованные одновалентными металлами). Гидролиз по катиону, среда кислая.
3. Соли, образованные слабым основанием и основанием сильной кислотой, при гидролизе образуют кислотой сильную кислоту и основную соль. соль (Исключение составляют соли, образованные одновалентными металлами). Гидролиз по катиону, среда кислая.
 Например: Cu. Cl 2 + H 2 O ↔ HCl + Cu. OHCl / Cu(OH)2 HCl cлабое сильная основан. кислота Сu 2++ H+OH ↔ Cu. OH+ + H+ (краткое ионное уравнение) Сu 2+ + H+OH- + 2 Сl- ↔ Cu. OH+ + 2 Сl- + Н+ (полное ионное уравнение) гидролиз по катиону (Сu 2+) среда кислая (H+) р. Н < 7
Например: Cu. Cl 2 + H 2 O ↔ HCl + Cu. OHCl / Cu(OH)2 HCl cлабое сильная основан. кислота Сu 2++ H+OH ↔ Cu. OH+ + H+ (краткое ионное уравнение) Сu 2+ + H+OH- + 2 Сl- ↔ Cu. OH+ + 2 Сl- + Н+ (полное ионное уравнение) гидролиз по катиону (Сu 2+) среда кислая (H+) р. Н < 7
 4. Соли, образованные слабым основанием и слабой кислотой, при гидролизе образуют слабое основание и слабую кислоту. Гидролиз по катиону и аниону. Среда зависит от продуктов реакции.
4. Соли, образованные слабым основанием и слабой кислотой, при гидролизе образуют слабое основание и слабую кислоту. Гидролиз по катиону и аниону. Среда зависит от продуктов реакции.
 Например: Al 2 S 3 + 6 H 2 O ↔ 2 Al(OH)3↓ + 3 H 2 S / Al(OH)3 H 2 S слабое слабая основан. кислота 2 Al 3+ + 3 S 2 - + 6 H+OH- ↔ 2 Al(OH)3↓ + 3 H 2 S (полное и краткое ионные уравнения совпадают) гидролиз по катиону и аниону. среда нейтральная р. Н = 7
Например: Al 2 S 3 + 6 H 2 O ↔ 2 Al(OH)3↓ + 3 H 2 S / Al(OH)3 H 2 S слабое слабая основан. кислота 2 Al 3+ + 3 S 2 - + 6 H+OH- ↔ 2 Al(OH)3↓ + 3 H 2 S (полное и краткое ионные уравнения совпадают) гидролиз по катиону и аниону. среда нейтральная р. Н = 7
 Степень гидролиза по аниону зависит от степени диссоциации слабой кислоты. Чем слабее кислота, тем выше степень гидролиза (ниже дан ряд анионов, расположенных по увеличению степени гидролиза, показан и продукт гидролиза - молекула кислоты или содержащий на один атом водорода больше ее анион): F- --> HF HPO 42 - --> H 2 PO 4 - NO 2 - --> HNO 2 Cl. O- --> HCl. O CH 3 COO- --> CH 3 COOH CN- --> HCN HCO 3 - --> H 2 CO 3 CO 32 - --> HCO 3 - Cr. O 42 - --> HCr. O 4 - PO 43 - --> HPO 42 - HS- --> H 2 S S 2 - --> HS- SO 32 - --> HSO 3 - Si. O 44 - --> H 3 Si. O 4 -
Степень гидролиза по аниону зависит от степени диссоциации слабой кислоты. Чем слабее кислота, тем выше степень гидролиза (ниже дан ряд анионов, расположенных по увеличению степени гидролиза, показан и продукт гидролиза - молекула кислоты или содержащий на один атом водорода больше ее анион): F- --> HF HPO 42 - --> H 2 PO 4 - NO 2 - --> HNO 2 Cl. O- --> HCl. O CH 3 COO- --> CH 3 COOH CN- --> HCN HCO 3 - --> H 2 CO 3 CO 32 - --> HCO 3 - Cr. O 42 - --> HCr. O 4 - PO 43 - --> HPO 42 - HS- --> H 2 S S 2 - --> HS- SO 32 - --> HSO 3 - Si. O 44 - --> H 3 Si. O 4 -
 Степень гидролиза катионов увеличивается в следующем порядке: Mg 2+, Ni 2+, La 3+, Mn 2+, NH 4+, Co 2+, Zn 2+, Cd 2+, Cu 2+, Fe 2+, Pb 2+, Al 3+, Cr 3+, Fe 3+. Степенью гидролиза соли называют отношение количества гидролизованной соли к общему количеству растворенной соли.
Степень гидролиза катионов увеличивается в следующем порядке: Mg 2+, Ni 2+, La 3+, Mn 2+, NH 4+, Co 2+, Zn 2+, Cd 2+, Cu 2+, Fe 2+, Pb 2+, Al 3+, Cr 3+, Fe 3+. Степенью гидролиза соли называют отношение количества гидролизованной соли к общему количеству растворенной соли.
 На степень гидролиза влияют следующие факторы: 1. Природа солей. 2. Разбавление. 3. Температура. При разбавлении и нагревании растворов степень гидролиза увеличивается. Гидролиз может идти ступенчато, если: Ø соль образована слабой многоосновной кислотой и сильным основанием; Ø слабым многокислотным основанием и сильной кислотой.
На степень гидролиза влияют следующие факторы: 1. Природа солей. 2. Разбавление. 3. Температура. При разбавлении и нагревании растворов степень гидролиза увеличивается. Гидролиз может идти ступенчато, если: Ø соль образована слабой многоосновной кислотой и сильным основанием; Ø слабым многокислотным основанием и сильной кислотой.


