Гидролиз







 Гидролиз ПЛАН 1. Гидролиз и его значение 2. Гидролиз солей
Гидролиз ПЛАН 1. Гидролиз и его значение 2. Гидролиз солей
 1. Гидролиз и его значение Гидролиз – реакции обменного взаимодействия вещества с водой, приводящие к их разложению. РОЛЬ ГИДРОЛИЗА • преобразование земной коры В ПРИРОДЕ • обеспечение слабощелочной среды морской воды В ОРГАНИЗМЕ • процессы пищеварения
1. Гидролиз и его значение Гидролиз – реакции обменного взаимодействия вещества с водой, приводящие к их разложению. РОЛЬ ГИДРОЛИЗА • преобразование земной коры В ПРИРОДЕ • обеспечение слабощелочной среды морской воды В ОРГАНИЗМЕ • процессы пищеварения
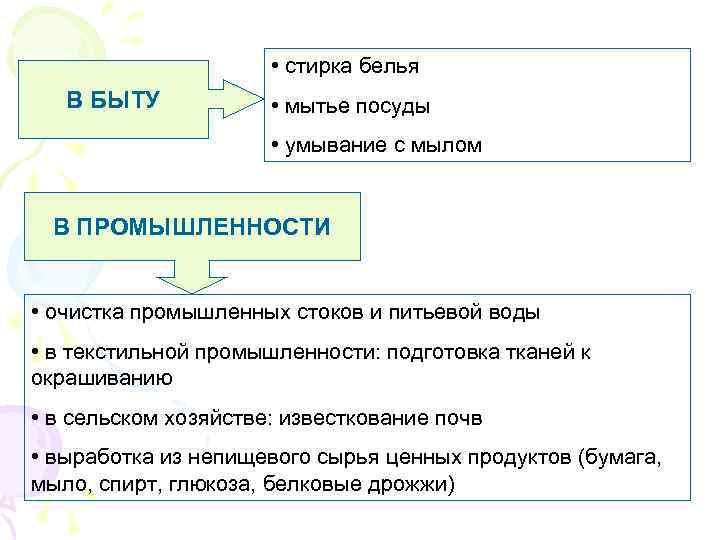
 • стирка белья В БЫТУ • мытье посуды • умывание с мылом В ПРОМЫШЛЕННОСТИ • очистка промышленных стоков и питьевой воды • в текстильной промышленности: подготовка тканей к окрашиванию • в сельском хозяйстве: известкование почв • выработка из непищевого сырья ценных продуктов (бумага, мыло, спирт, глюкоза, белковые дрожжи)
• стирка белья В БЫТУ • мытье посуды • умывание с мылом В ПРОМЫШЛЕННОСТИ • очистка промышленных стоков и питьевой воды • в текстильной промышленности: подготовка тканей к окрашиванию • в сельском хозяйстве: известкование почв • выработка из непищевого сырья ценных продуктов (бумага, мыло, спирт, глюкоза, белковые дрожжи)
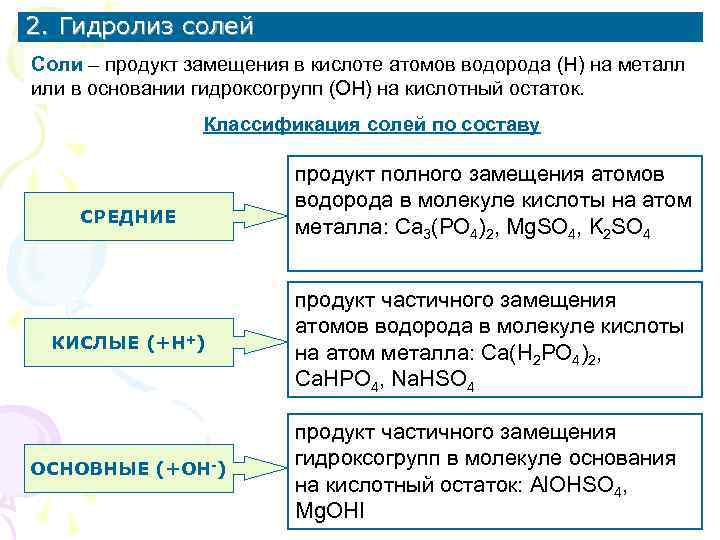
 2. Гидролиз солей Соли – продукт замещения в кислоте атомов водорода (Н) на металл или в основании гидроксогрупп (ОН) на кислотный остаток. Классификация солей по составу продукт полного замещения атомов водорода в молекуле кислоты на атом СРЕДНИЕ металла: Ca 3(PO 4)2, Mg. SO 4, K 2 SO 4 продукт частичного замещения атомов водорода в молекуле кислоты КИСЛЫЕ (+Н+) на атом металла: Ca(H 2 PO 4)2, Ca. HPO 4, Na. HSO 4 продукт частичного замещения ОСНОВНЫЕ (+ОН-) гидроксогрупп в молекуле основания на кислотный остаток: Al. OHSO 4, Mg. OHI
2. Гидролиз солей Соли – продукт замещения в кислоте атомов водорода (Н) на металл или в основании гидроксогрупп (ОН) на кислотный остаток. Классификация солей по составу продукт полного замещения атомов водорода в молекуле кислоты на атом СРЕДНИЕ металла: Ca 3(PO 4)2, Mg. SO 4, K 2 SO 4 продукт частичного замещения атомов водорода в молекуле кислоты КИСЛЫЕ (+Н+) на атом металла: Ca(H 2 PO 4)2, Ca. HPO 4, Na. HSO 4 продукт частичного замещения ОСНОВНЫЕ (+ОН-) гидроксогрупп в молекуле основания на кислотный остаток: Al. OHSO 4, Mg. OHI
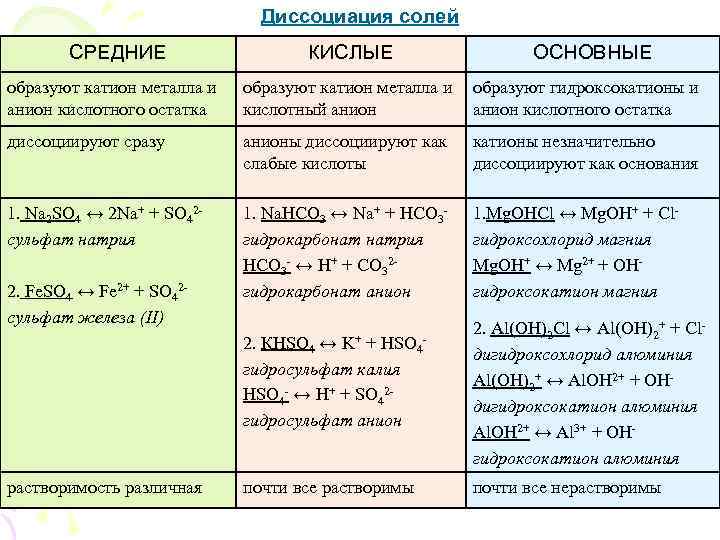
 Диссоциация солей СРЕДНИЕ КИСЛЫЕ ОСНОВНЫЕ образуют катион металла и образуют гидроксокатионы и анион кислотного остатка кислотный анион кислотного остатка диссоциируют сразу анионы диссоциируют как катионы незначительно слабые кислоты диссоциируют как основания 1. Na 2 SO 4 ↔ 2 Na+ + SO 42 - 1. Na. HCO 3 ↔ Na+ + HCO 3 - 1. Mg. OHCl ↔ Mg. OH+ + Cl- сульфат натрия гидрокарбонат натрия гидроксохлорид магния HCO 3 - ↔ H+ + CO 32 - Mg. OH+ ↔ Mg 2+ + OH- 2. Fe. SO 4 ↔ Fe 2+ + SO 42 - гидрокарбонат анион гидроксокатион магния сульфат железа (II) 2. Al(OH)2 Cl ↔ Al(OH)2+ + Cl- 2. КHSO 4 ↔ K+ + HSO 4 - дигидроксохлорид алюминия гидросульфат калия Al(OH)2+ ↔ Al. OH 2+ + OH- HSO 4 - ↔ H+ + SO 42 - дигидроксокатион алюминия гидросульфат анион Al. OH 2+ ↔ Al 3+ + OH- гидроксокатион алюминия растворимость различная почти все растворимы почти все нерастворимы
Диссоциация солей СРЕДНИЕ КИСЛЫЕ ОСНОВНЫЕ образуют катион металла и образуют гидроксокатионы и анион кислотного остатка кислотный анион кислотного остатка диссоциируют сразу анионы диссоциируют как катионы незначительно слабые кислоты диссоциируют как основания 1. Na 2 SO 4 ↔ 2 Na+ + SO 42 - 1. Na. HCO 3 ↔ Na+ + HCO 3 - 1. Mg. OHCl ↔ Mg. OH+ + Cl- сульфат натрия гидрокарбонат натрия гидроксохлорид магния HCO 3 - ↔ H+ + CO 32 - Mg. OH+ ↔ Mg 2+ + OH- 2. Fe. SO 4 ↔ Fe 2+ + SO 42 - гидрокарбонат анион гидроксокатион магния сульфат железа (II) 2. Al(OH)2 Cl ↔ Al(OH)2+ + Cl- 2. КHSO 4 ↔ K+ + HSO 4 - дигидроксохлорид алюминия гидросульфат калия Al(OH)2+ ↔ Al. OH 2+ + OH- HSO 4 - ↔ H+ + SO 42 - дигидроксокатион алюминия гидросульфат анион Al. OH 2+ ↔ Al 3+ + OH- гидроксокатион алюминия растворимость различная почти все растворимы почти все нерастворимы
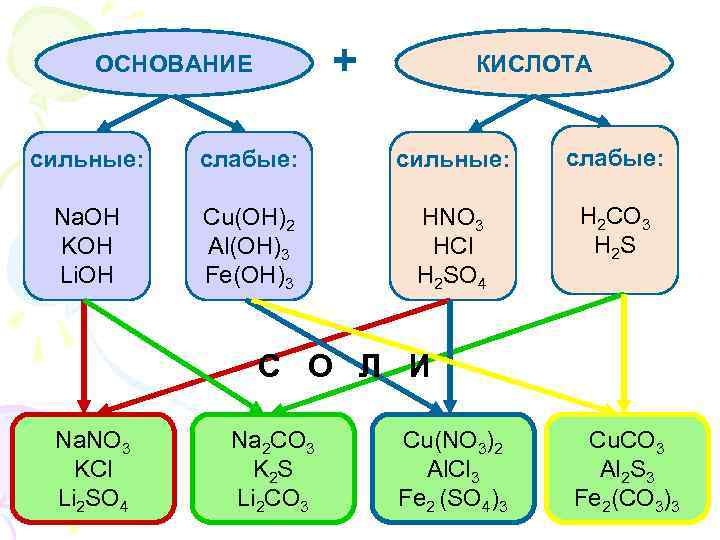
 ОСНОВАНИЕ + КИСЛОТА сильные: слабые: сильные: слабые: Na. OH Cu(OH)2 HNO 3 H 2 CO 3 KOH Al(OH)3 HCl H 2 S Li. OH Fe(OH)3 H 2 SO 4 С О Л И Na. NO 3 Na 2 CO 3 Cu(NO 3)2 Cu. CO 3 KCl K 2 S Al. Cl 3 Al 2 S 3 Li 2 SO 4 Li 2 CO 3 Fe 2 (SO 4)3 Fe 2(CO 3)3
ОСНОВАНИЕ + КИСЛОТА сильные: слабые: сильные: слабые: Na. OH Cu(OH)2 HNO 3 H 2 CO 3 KOH Al(OH)3 HCl H 2 S Li. OH Fe(OH)3 H 2 SO 4 С О Л И Na. NO 3 Na 2 CO 3 Cu(NO 3)2 Cu. CO 3 KCl K 2 S Al. Cl 3 Al 2 S 3 Li 2 SO 4 Li 2 CO 3 Fe 2 (SO 4)3 Fe 2(CO 3)3
 Гидролиз соли – процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита. Гидролиз солей, образованных сильным основанием и сильной кислотой Na. Cl + HOH ≠ Соли этого типа гидролизу не подвергаются, т. к. , при взаимодействии с водой слабый электролит образоваться не может р. Н = 7 (среда нейтральная)
Гидролиз соли – процесс взаимодействия ионов соли с водой, приводящий к образованию слабого электролита. Гидролиз солей, образованных сильным основанием и сильной кислотой Na. Cl + HOH ≠ Соли этого типа гидролизу не подвергаются, т. к. , при взаимодействии с водой слабый электролит образоваться не может р. Н = 7 (среда нейтральная)
 Гидролиз солей, образованных сильным основанием и слабой кислотой Гидролиз идет по аниону: Na 2 CO 3 + HOH ↔ Na. HCO 3 + Na. OH ионное уравнение: 2 Na+ + CO 32 - + HOH ↔ Na+ + HCO 3 - + Na+ + OH- сокращенное ионное уравнение: CO 32 - + HOH ↔ HCO 3 - + OH- р. Н > 7 (среда щелочная)
Гидролиз солей, образованных сильным основанием и слабой кислотой Гидролиз идет по аниону: Na 2 CO 3 + HOH ↔ Na. HCO 3 + Na. OH ионное уравнение: 2 Na+ + CO 32 - + HOH ↔ Na+ + HCO 3 - + Na+ + OH- сокращенное ионное уравнение: CO 32 - + HOH ↔ HCO 3 - + OH- р. Н > 7 (среда щелочная)
 Гидролиз солей, образованных слабым основанием и сильной кислотой Гидролиз идет по катиону: Cu. Cl 2 + HOH ↔ Cu. OHCl + HCl ионное уравнение: Cu 2+ + 2 Cl- + HOH ↔ Cu. OH+ + Cl- + H+ + Cl- сокращенное ионное уравнение: Cu 2+ + HOH ↔ Cu. OH+ + H+ р. Н < 7 (среда кислая)
Гидролиз солей, образованных слабым основанием и сильной кислотой Гидролиз идет по катиону: Cu. Cl 2 + HOH ↔ Cu. OHCl + HCl ионное уравнение: Cu 2+ + 2 Cl- + HOH ↔ Cu. OH+ + Cl- + H+ + Cl- сокращенное ионное уравнение: Cu 2+ + HOH ↔ Cu. OH+ + H+ р. Н < 7 (среда кислая)
 Гидролиз солей, образованных слабым основанием и слабой кислотой Гидролиз идет по катиону и аниону: Al 2 S 3 + 6 HOH → 2 Al(OH)3 ↓ + 3 H 2 S ↑ ионное уравнение: 2 Al 3+ + 3 S 2 - + 6 HOH → 2 Al(OH)3 ↓ + 3 H 2 S ↑ Реакция идет до конца и гидролиз необратим р. Н реакции зависит от относительной силы образующихся слабых кислот и слабых оснований
Гидролиз солей, образованных слабым основанием и слабой кислотой Гидролиз идет по катиону и аниону: Al 2 S 3 + 6 HOH → 2 Al(OH)3 ↓ + 3 H 2 S ↑ ионное уравнение: 2 Al 3+ + 3 S 2 - + 6 HOH → 2 Al(OH)3 ↓ + 3 H 2 S ↑ Реакция идет до конца и гидролиз необратим р. Н реакции зависит от относительной силы образующихся слабых кислот и слабых оснований

