1_Spirty_Fenoly_Tioly.ppt
- Количество слайдов: 42
 ГИДРОКСИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРОИЗВОДНЫЕ Важнейшие подгруппы: СПИРТЫ И ФЕНОЛЫ
ГИДРОКСИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРОИЗВОДНЫЕ Важнейшие подгруппы: СПИРТЫ И ФЕНОЛЫ
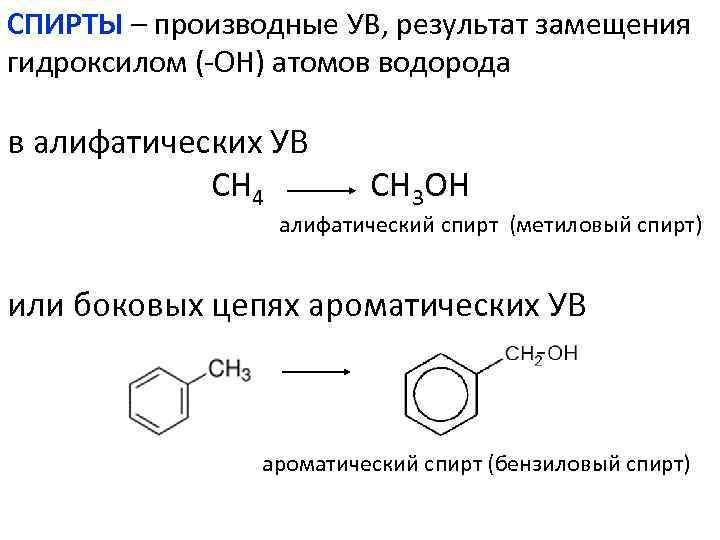 СПИРТЫ – производные УВ, результат замещения гидроксилом (-ОН) атомов водорода в алифатических УВ СН 4 СН 3 ОН алифатический спирт (метиловый спирт) или боковых цепях ароматических УВ ароматический спирт (бензиловый спирт)
СПИРТЫ – производные УВ, результат замещения гидроксилом (-ОН) атомов водорода в алифатических УВ СН 4 СН 3 ОН алифатический спирт (метиловый спирт) или боковых цепях ароматических УВ ароматический спирт (бензиловый спирт)
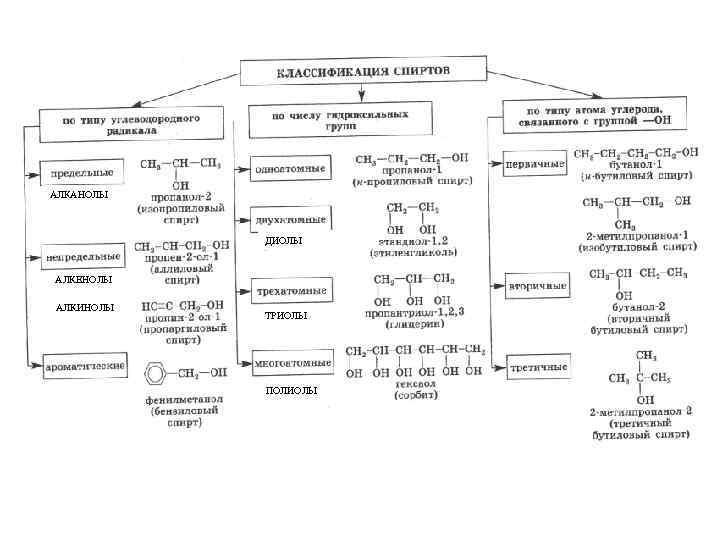 АЛКАНОЛЫ ДИОЛЫ АЛКЕНОЛЫ АЛКИНОЛЫ ТРИОЛЫ ПОЛИОЛЫ
АЛКАНОЛЫ ДИОЛЫ АЛКЕНОЛЫ АЛКИНОЛЫ ТРИОЛЫ ПОЛИОЛЫ
 Химические свойства спиртов 4
Химические свойства спиртов 4
 Химические свойства одноатомных спиртов Химические свойства спиртов связаны с наличием в их молекуле группы –ОН. Для спиртов характерны два типа реакций: разрыв связи С-О и связи О-Н. Cпирты взаимодействуют с: 1. Меакт 2. ННal 3. Карбоновыми кислотами 4. NH 3 5. РCl 5 и SOCl 2 6. H 2 SO 4 7. HNO 3 8. Подвергаются межмолекулярной и внутримолекулярной дегидратации 5
Химические свойства одноатомных спиртов Химические свойства спиртов связаны с наличием в их молекуле группы –ОН. Для спиртов характерны два типа реакций: разрыв связи С-О и связи О-Н. Cпирты взаимодействуют с: 1. Меакт 2. ННal 3. Карбоновыми кислотами 4. NH 3 5. РCl 5 и SOCl 2 6. H 2 SO 4 7. HNO 3 8. Подвергаются межмолекулярной и внутримолекулярной дегидратации 5
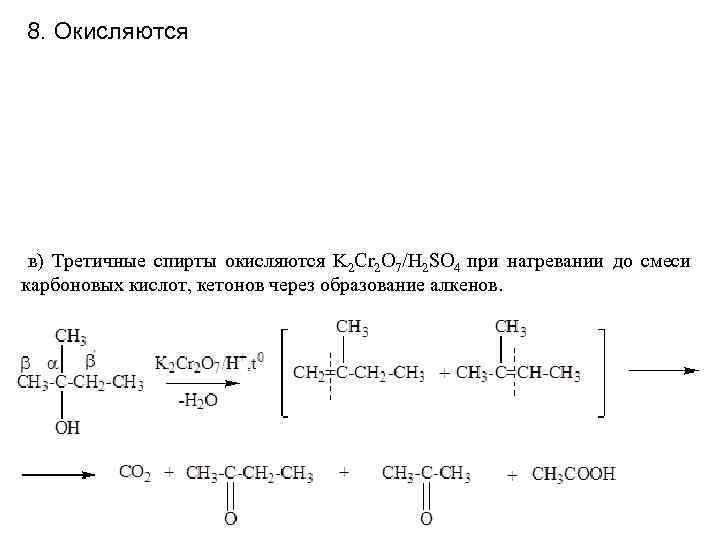 8. Окисляются в) Третичные спирты окисляются K 2 Cr 2 O 7/H 2 SO 4 при нагревании до смеси карбоновых кислот, кетонов через образование алкенов.
8. Окисляются в) Третичные спирты окисляются K 2 Cr 2 O 7/H 2 SO 4 при нагревании до смеси карбоновых кислот, кетонов через образование алкенов.
 Окисление спирта в клетке: (дегидрирование) Образование ацетальдегида из этанола катализируется специфическим ферментом алкогольдегидрогеназой, связанной с НАД (кофермент) НАД+ CH 3 -CH 2 -OH CH 3 -CH=O + НАДН+ Н+ Алькогольдегидрогеназа окисляет и метанол до формальдегида (сильный яд) СН 3 ОН НСН=О +2 Н
Окисление спирта в клетке: (дегидрирование) Образование ацетальдегида из этанола катализируется специфическим ферментом алкогольдегидрогеназой, связанной с НАД (кофермент) НАД+ CH 3 -CH 2 -OH CH 3 -CH=O + НАДН+ Н+ Алькогольдегидрогеназа окисляет и метанол до формальдегида (сильный яд) СН 3 ОН НСН=О +2 Н
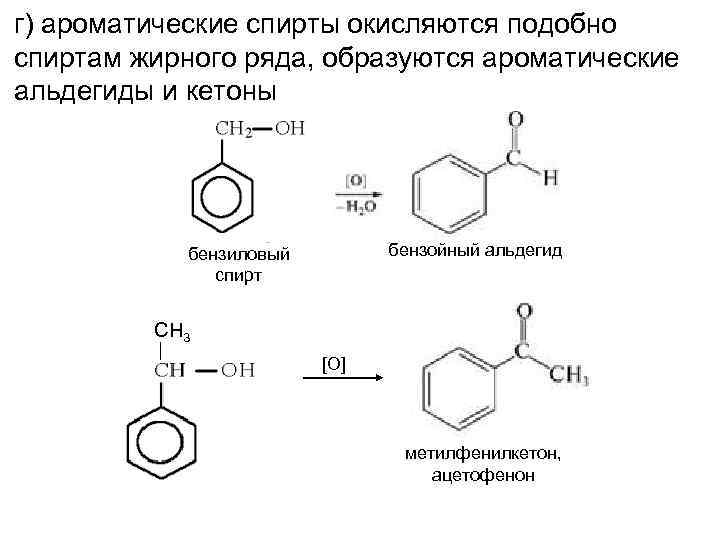 г) ароматические спирты окисляются подобно спиртам жирного ряда, образуются ароматические альдегиды и кетоны бензойный альдегид бензиловый спирт СН 3 [O] метилфенилкетон, ацетофенон
г) ароматические спирты окисляются подобно спиртам жирного ряда, образуются ароматические альдегиды и кетоны бензойный альдегид бензиловый спирт СН 3 [O] метилфенилкетон, ацетофенон
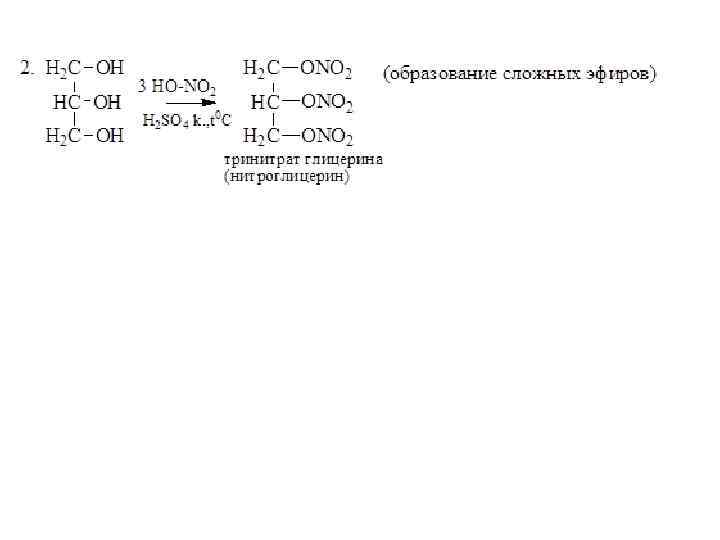
 Дегидратация спиртов 1. Межмолекулярная дегидратация спиртов. При нагревании спирта в присутствии каталитических количеств сильной кислоты происходит отщепление молекулы воды от двух молекул спирта и образуется простой эфир: Простые эфиры — это органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R'—О— R", где R' и R" — радикалы, которые могут быть различными или одинаковыми. Диэтиловый эфир используется в медицине при хирургических операциях, так как обладает анестезирующим действием. 2. Реакция элиминирования, или внутримолекулярной дегидратации.
Дегидратация спиртов 1. Межмолекулярная дегидратация спиртов. При нагревании спирта в присутствии каталитических количеств сильной кислоты происходит отщепление молекулы воды от двух молекул спирта и образуется простой эфир: Простые эфиры — это органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R'—О— R", где R' и R" — радикалы, которые могут быть различными или одинаковыми. Диэтиловый эфир используется в медицине при хирургических операциях, так как обладает анестезирующим действием. 2. Реакция элиминирования, или внутримолекулярной дегидратации.
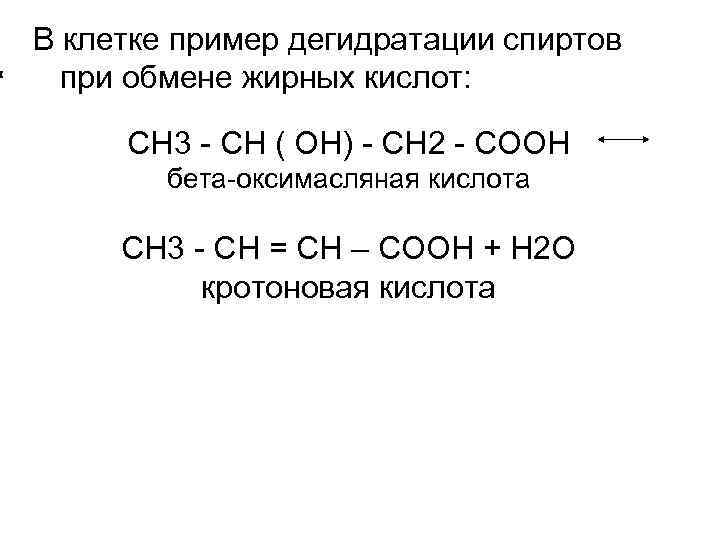 В клетке пример дегидратации спиртов при обмене жирных кислот: СН 3 - СН ( ОН) - СН 2 - СООН бета-оксимасляная кислота СН 3 - СН = СН – СООН + Н 2 О кротоновая кислота
В клетке пример дегидратации спиртов при обмене жирных кислот: СН 3 - СН ( ОН) - СН 2 - СООН бета-оксимасляная кислота СН 3 - СН = СН – СООН + Н 2 О кротоновая кислота
 • 1 -бутилпропаноат и 2 -пропилбутаноат. • бутиловый эфир пропионовой кислоты, бутилпропионат • изопропиловый эфир масляной кислоты, изопропилбутират.
• 1 -бутилпропаноат и 2 -пропилбутаноат. • бутиловый эфир пропионовой кислоты, бутилпропионат • изопропиловый эфир масляной кислоты, изопропилбутират.
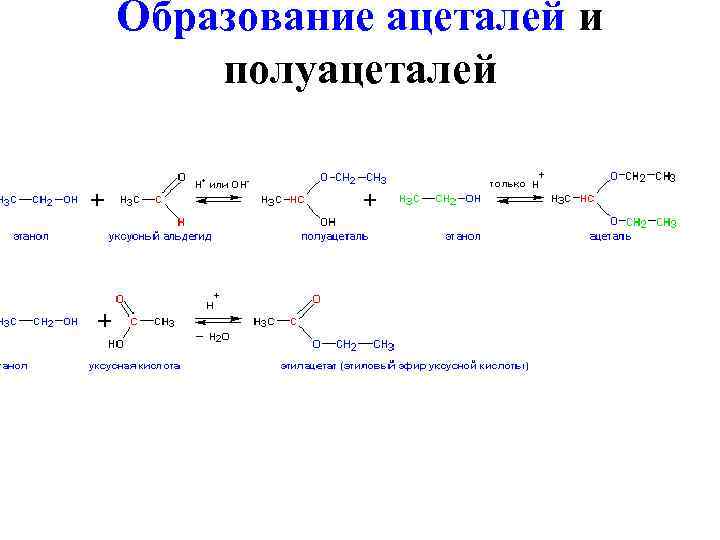 Образование ацеталей и полуацеталей
Образование ацеталей и полуацеталей
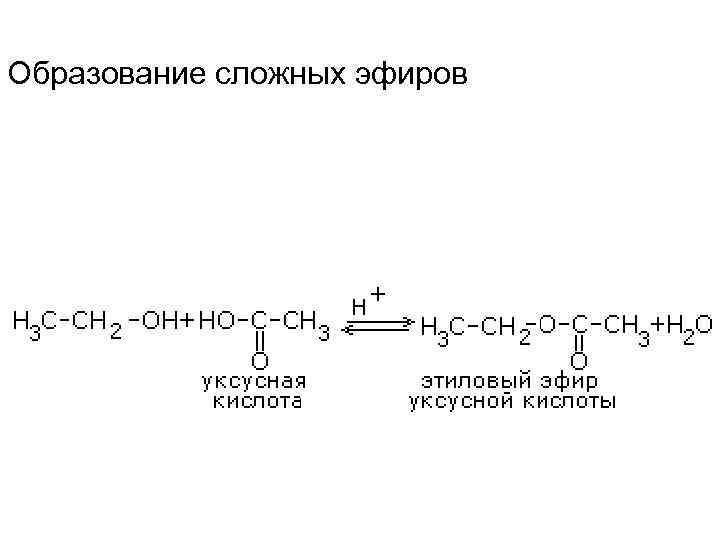 Образование сложных эфиров
Образование сложных эфиров
 Химические свойства многоатомных спиртов 1. Многоатомные спирты более сильные кислоты, чем одноатомные спирты. Гликоли и глицерины образуют алкоголяты, аналогично одноатомным спиртам. Отличительным свойством является образование соединений типа хелатов с ионами тяжелых металлов. С Cu(ОН)2 образуется раствор ярко-синего цвета (качественная реакция). 14
Химические свойства многоатомных спиртов 1. Многоатомные спирты более сильные кислоты, чем одноатомные спирты. Гликоли и глицерины образуют алкоголяты, аналогично одноатомным спиртам. Отличительным свойством является образование соединений типа хелатов с ионами тяжелых металлов. С Cu(ОН)2 образуется раствор ярко-синего цвета (качественная реакция). 14
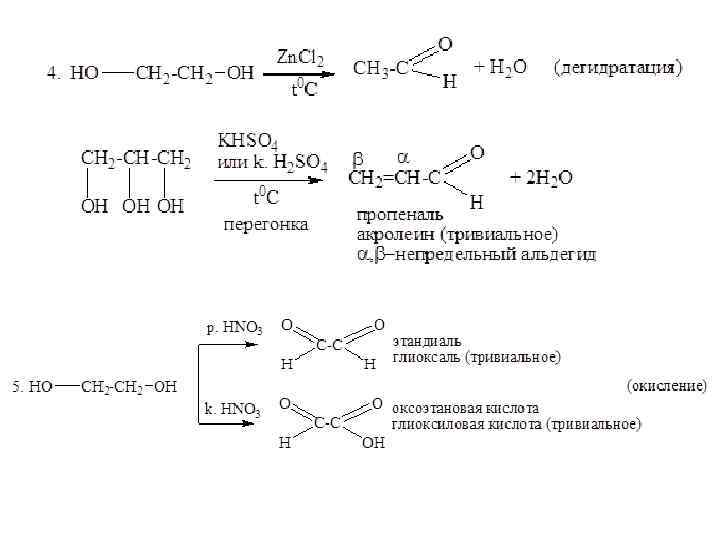
 Отдельные представители Метанол (метиловый спирт). Принятие внутрь вызывает опьянение и тяжелое отравление, потерю зрения и часто смерть. Этанол (этиловый спирт). Обеззараживающее средство. В небольших дозах действует опьяняюще, при больших количествах вызывает состояние близкое к наркозу, иногда заканчивающееся смертью.
Отдельные представители Метанол (метиловый спирт). Принятие внутрь вызывает опьянение и тяжелое отравление, потерю зрения и часто смерть. Этанол (этиловый спирт). Обеззараживающее средство. В небольших дозах действует опьяняюще, при больших количествах вызывает состояние близкое к наркозу, иногда заканчивающееся смертью.
 Авертин, или нарколан (трибромэтанол). Средством для ректального наркоза. Позволяет усыплять больного в палате и уменьшать психическую травму. Диэтиловый эфир Обладает общеанастезирующим действием. В хирургии - ингаляционный наркоз, в стоматологии - для обработки кариозных полостей и корневых каналов зуба при подготовке к пломбированию.
Авертин, или нарколан (трибромэтанол). Средством для ректального наркоза. Позволяет усыплять больного в палате и уменьшать психическую травму. Диэтиловый эфир Обладает общеанастезирующим действием. В хирургии - ингаляционный наркоз, в стоматологии - для обработки кариозных полостей и корневых каналов зуба при подготовке к пломбированию.
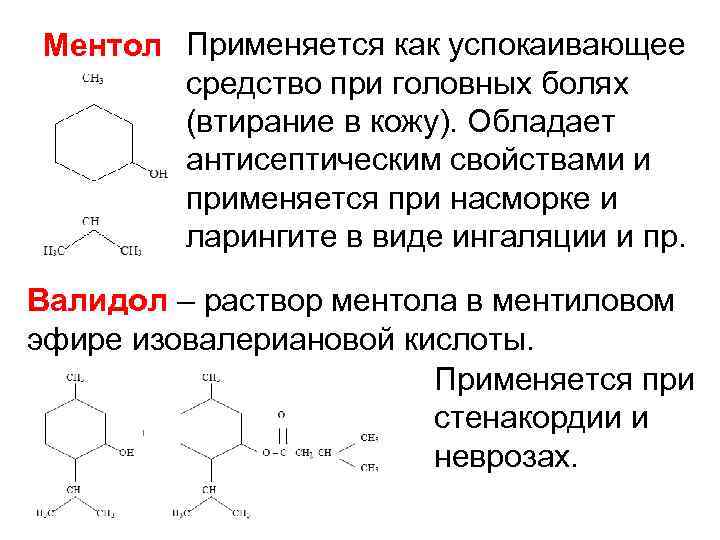 Ментол Применяется как успокаивающее средство при головных болях (втирание в кожу). Обладает антисептическим свойствами и применяется при насморке и ларингите в виде ингаляции и пр. Валидол – раствор ментола в ментиловом эфире изовалериановой кислоты. Применяется при стенакордии и неврозах.
Ментол Применяется как успокаивающее средство при головных болях (втирание в кожу). Обладает антисептическим свойствами и применяется при насморке и ларингите в виде ингаляции и пр. Валидол – раствор ментола в ментиловом эфире изовалериановой кислоты. Применяется при стенакордии и неврозах.
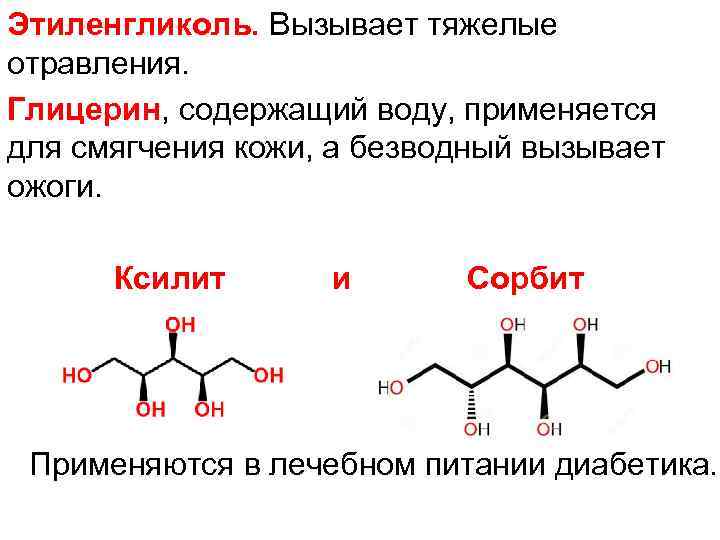 Этиленгликоль. Вызывает тяжелые отравления. Глицерин, содержащий воду, применяется для смягчения кожи, а безводный вызывает ожоги. Ксилит и Сорбит Применяются в лечебном питании диабетика.
Этиленгликоль. Вызывает тяжелые отравления. Глицерин, содержащий воду, применяется для смягчения кожи, а безводный вызывает ожоги. Ксилит и Сорбит Применяются в лечебном питании диабетика.
 ОКСИСОЕДИНЕНИЯ ФЕНОЛЫ
ОКСИСОЕДИНЕНИЯ ФЕНОЛЫ
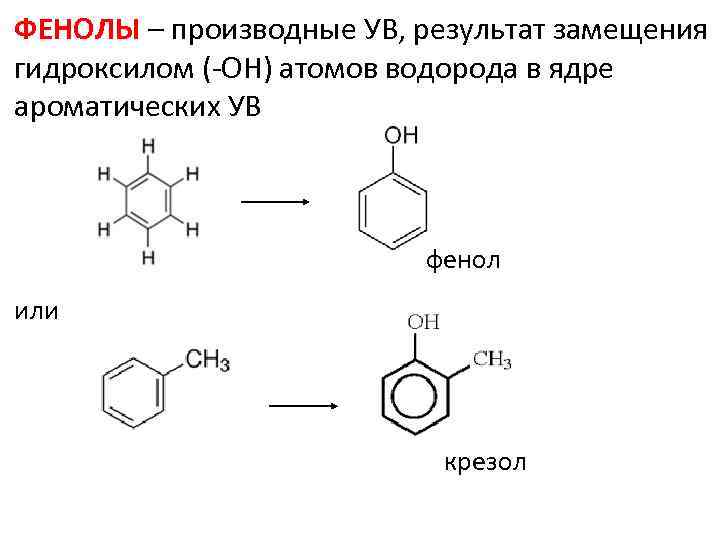 ФЕНОЛЫ – производные УВ, результат замещения гидроксилом (-ОН) атомов водорода в ядре ароматических УВ фенол или крезол
ФЕНОЛЫ – производные УВ, результат замещения гидроксилом (-ОН) атомов водорода в ядре ароматических УВ фенол или крезол
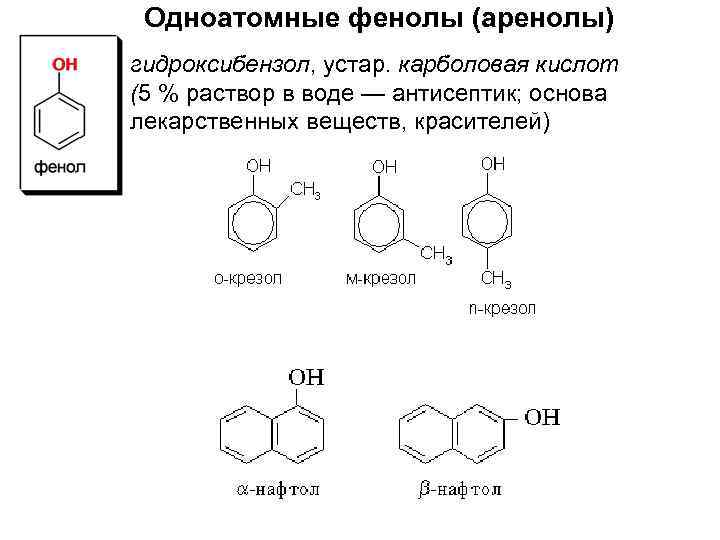 Одноатомные фенолы (аренолы) гидроксибензол, устар. карболовая кислот (5 % раствор в воде — антисептик; основа лекарственных веществ, красителей)
Одноатомные фенолы (аренолы) гидроксибензол, устар. карболовая кислот (5 % раствор в воде — антисептик; основа лекарственных веществ, красителей)
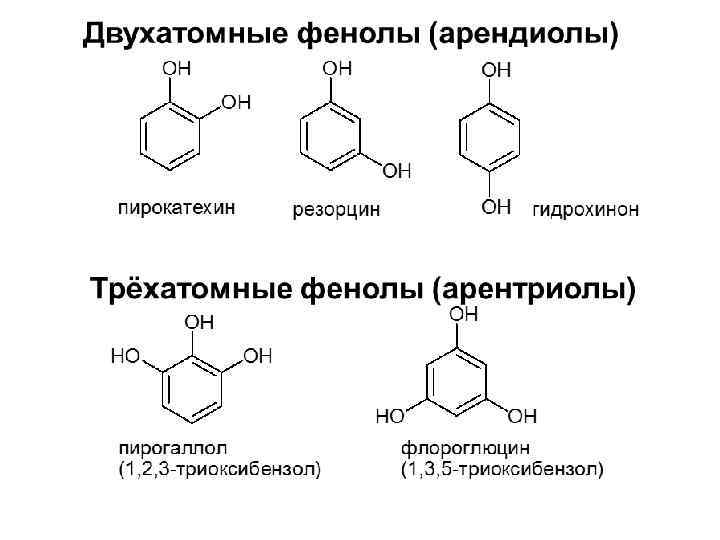
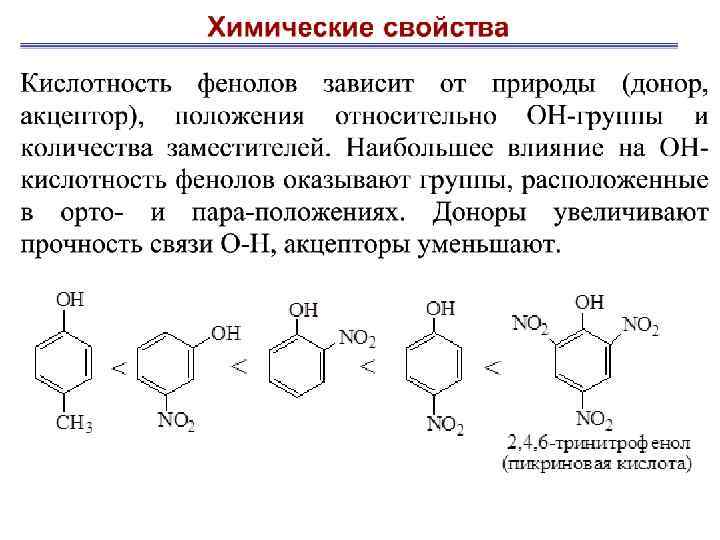
 Гидроксильная группа – ориентант I рода, облегчает реакции по бензольному кольцу, направляя атаку электрофильного реагента в орто-, пара-положения. ацилирования [O] Н 2 хинон [O] циклогексанол НСООН -Н 2 О фенолформальдегидная смола гидрохинон 26
Гидроксильная группа – ориентант I рода, облегчает реакции по бензольному кольцу, направляя атаку электрофильного реагента в орто-, пара-положения. ацилирования [O] Н 2 хинон [O] циклогексанол НСООН -Н 2 О фенолформальдегидная смола гидрохинон 26
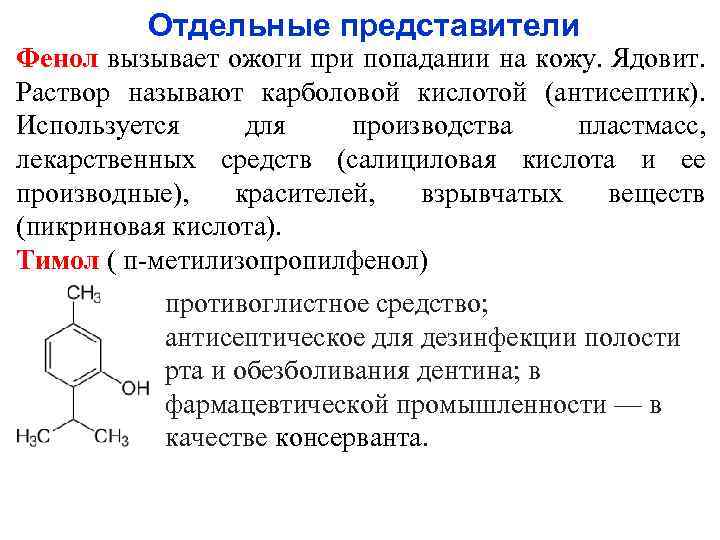 Отдельные представители Фенол вызывает ожоги при попадании на кожу. Ядовит. Раствор называют карболовой кислотой (антисептик). Используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ (пикриновая кислота). Тимол ( п-метилизопропилфенол) противоглистное средство; антисептическое для дезинфекции полости рта и обезболивания дентина; в фармацевтической промышленности — в качестве консерванта.
Отдельные представители Фенол вызывает ожоги при попадании на кожу. Ядовит. Раствор называют карболовой кислотой (антисептик). Используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ (пикриновая кислота). Тимол ( п-метилизопропилфенол) противоглистное средство; антисептическое для дезинфекции полости рта и обезболивания дентина; в фармацевтической промышленности — в качестве консерванта.
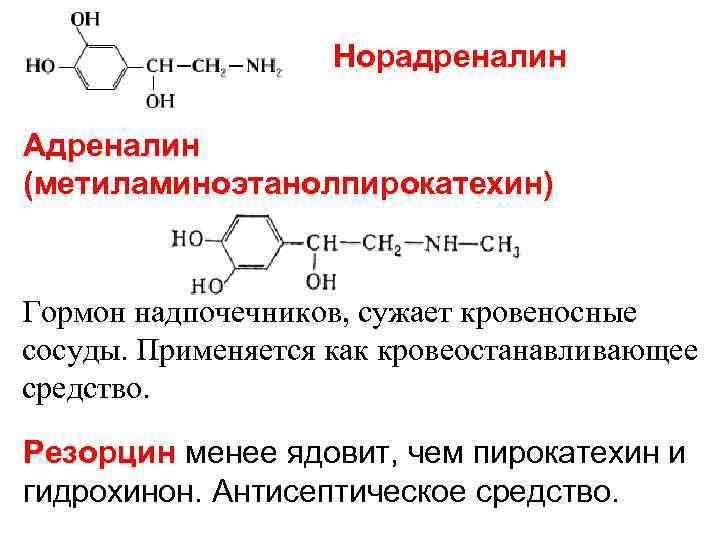 Норадреналин Адреналин (метиламиноэтанолпирокатехин) Гормон надпочечников, сужает кровеносные сосуды. Применяется как кровеостанавливающее средство. Резорцин менее ядовит, чем пирокатехин и гидрохинон. Антисептическое средство.
Норадреналин Адреналин (метиламиноэтанолпирокатехин) Гормон надпочечников, сужает кровеносные сосуды. Применяется как кровеостанавливающее средство. Резорцин менее ядовит, чем пирокатехин и гидрохинон. Антисептическое средство.
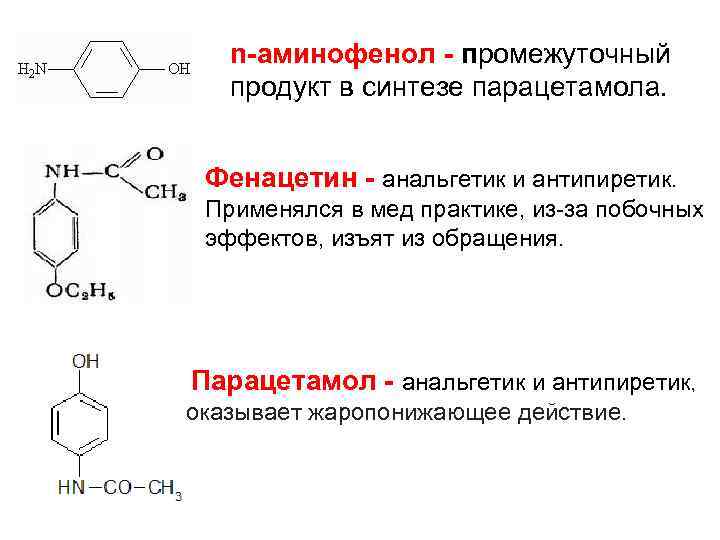 n-аминофенол - промежуточный продукт в синтезе парацетамола. Фенацетин - анальгетик и антипиретик. Применялся в мед практике, из-за побочных эффектов, изъят из обращения. Парацетамол - анальгетик и антипиретик, оказывает жаропонижающее действие.
n-аминофенол - промежуточный продукт в синтезе парацетамола. Фенацетин - анальгетик и антипиретик. Применялся в мед практике, из-за побочных эффектов, изъят из обращения. Парацетамол - анальгетик и антипиретик, оказывает жаропонижающее действие.
 ТИОЛЫ
ТИОЛЫ
 ТИОЛЫ (меркаптаны) R – SH - сернистые аналоги спиртов (производные сероводорода). ХИМИЧЕСКИЕ СВОЙСТВА Тиолы проявляют слабые кислотные свойства (на 5 -6 порядков больше, чем у спиртов) 1. С 2 Н 5 SH + Na = C 2 H 5 SNa + H 2 O этантиолят натрия (этилмеркаптан) 2. С 2 Н 5 SH + Na. OH = C 2 H 5 SNa + H 2 O 3. С 2 Н 5 SH + Hg. O = (C 2 H 5 S)2 Hg + H 2 O этантиолят ртути (II) 4. С 2 Н 5 SH + Hg. Cl 2 = (C 2 H 5 S)2 Hg + H 2 O
ТИОЛЫ (меркаптаны) R – SH - сернистые аналоги спиртов (производные сероводорода). ХИМИЧЕСКИЕ СВОЙСТВА Тиолы проявляют слабые кислотные свойства (на 5 -6 порядков больше, чем у спиртов) 1. С 2 Н 5 SH + Na = C 2 H 5 SNa + H 2 O этантиолят натрия (этилмеркаптан) 2. С 2 Н 5 SH + Na. OH = C 2 H 5 SNa + H 2 O 3. С 2 Н 5 SH + Hg. O = (C 2 H 5 S)2 Hg + H 2 O этантиолят ртути (II) 4. С 2 Н 5 SH + Hg. Cl 2 = (C 2 H 5 S)2 Hg + H 2 O
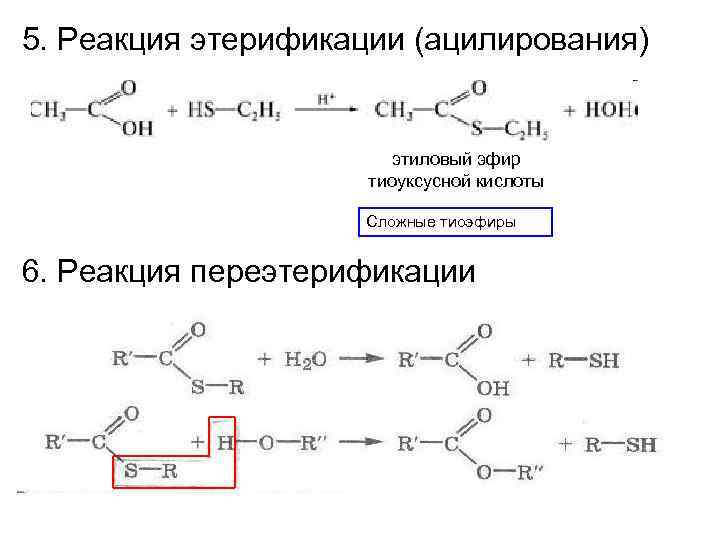 5. Реакция этерификации (ацилирования) этиловый эфир тиоуксусной кислоты Сложные тиоэфиры 6. Реакция переэтерификации
5. Реакция этерификации (ацилирования) этиловый эфир тиоуксусной кислоты Сложные тиоэфиры 6. Реакция переэтерификации
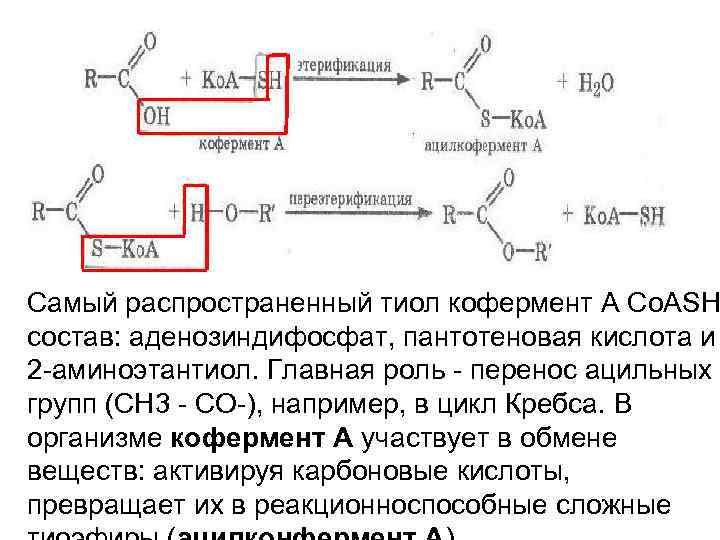 Самый распространенный тиол кофермент А Со. АSH состав: аденозиндифосфат, пантотеновая кислота и 2 -аминоэтантиол. Главная роль - перенос ацильных групп (СН 3 - СО-), например, в цикл Кребса. В организме кофермент А участвует в обмене веществ: активируя карбоновые кислоты, превращает их в реакционноспособные сложные
Самый распространенный тиол кофермент А Со. АSH состав: аденозиндифосфат, пантотеновая кислота и 2 -аминоэтантиол. Главная роль - перенос ацильных групп (СН 3 - СО-), например, в цикл Кребса. В организме кофермент А участвует в обмене веществ: активируя карбоновые кислоты, превращает их в реакционноспособные сложные
 7. Окислительно-восстановительные реакции. Тиолы сильные восстановители. окисление 2 RSH R – S –R + 2 H+ восстановление Тиол Дисульфид Тиол-дисульфидная система – сопряженная окислительно-восстановительная пара. Используется для поддержания Ox/Red гомеостата в организме и в работе антиоксидантной системы.
7. Окислительно-восстановительные реакции. Тиолы сильные восстановители. окисление 2 RSH R – S –R + 2 H+ восстановление Тиол Дисульфид Тиол-дисульфидная система – сопряженная окислительно-восстановительная пара. Используется для поддержания Ox/Red гомеостата в организме и в работе антиоксидантной системы.
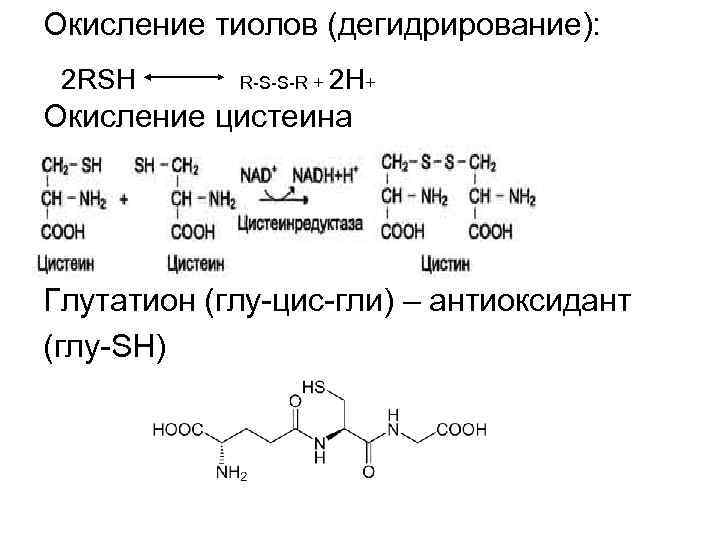 Окисление тиолов (дегидрирование): 2 RSH R-S-S-R + 2 H+ Окисление цистеина Глутатион (глу-цис-гли) – антиоксидант (глу-SH)
Окисление тиолов (дегидрирование): 2 RSH R-S-S-R + 2 H+ Окисление цистеина Глутатион (глу-цис-гли) – антиоксидант (глу-SH)
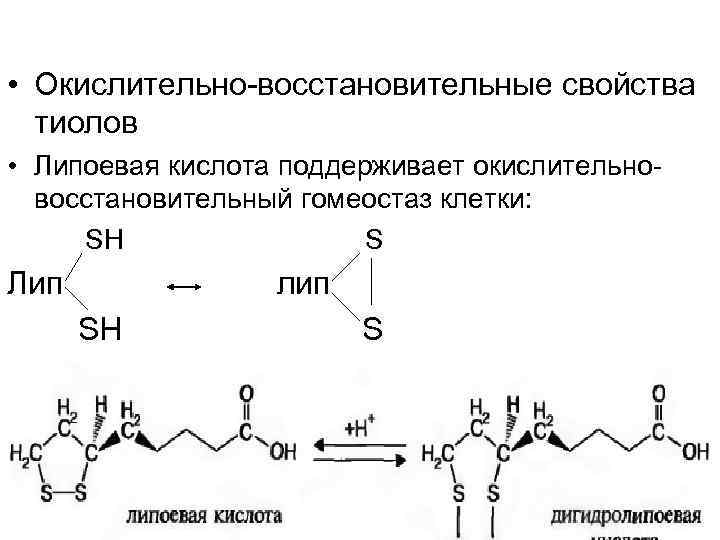 • Окислительно-восстановительные свойства тиолов • Липоевая кислота поддерживает окислительновосстановительный гомеостаз клетки: SH S Лип лип SH S
• Окислительно-восстановительные свойства тиолов • Липоевая кислота поддерживает окислительновосстановительный гомеостаз клетки: SH S Лип лип SH S
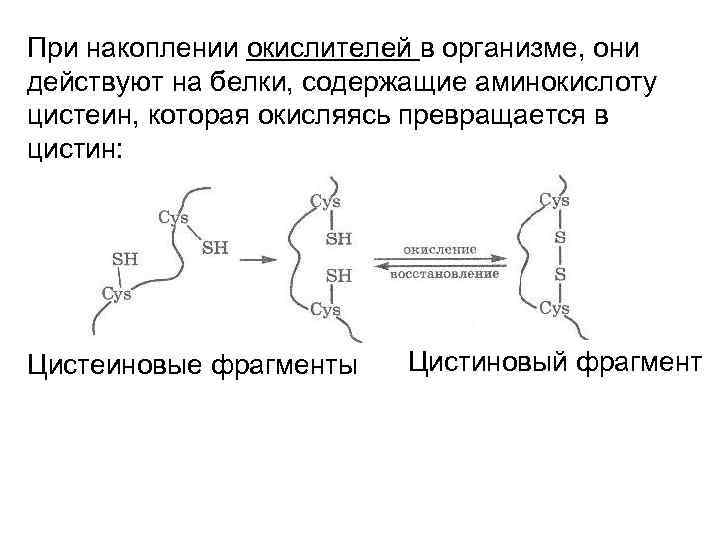 При накоплении окислителей в организме, они действуют на белки, содержащие аминокислоту цистеин, которая окисляясь превращается в цистин: Цистеиновые фрагменты Цистиновый фрагмент
При накоплении окислителей в организме, они действуют на белки, содержащие аминокислоту цистеин, которая окисляясь превращается в цистин: Цистеиновые фрагменты Цистиновый фрагмент
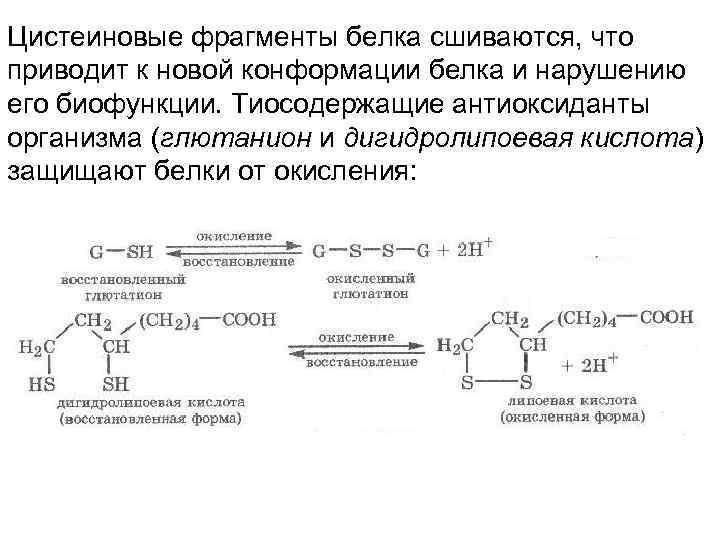 Цистеиновые фрагменты белка сшиваются, что приводит к новой конформации белка и нарушению его биофункции. Тиосодержащие антиоксиданты организма (глютанион и дигидролипоевая кислота) защищают белки от окисления:
Цистеиновые фрагменты белка сшиваются, что приводит к новой конформации белка и нарушению его биофункции. Тиосодержащие антиоксиданты организма (глютанион и дигидролипоевая кислота) защищают белки от окисления:
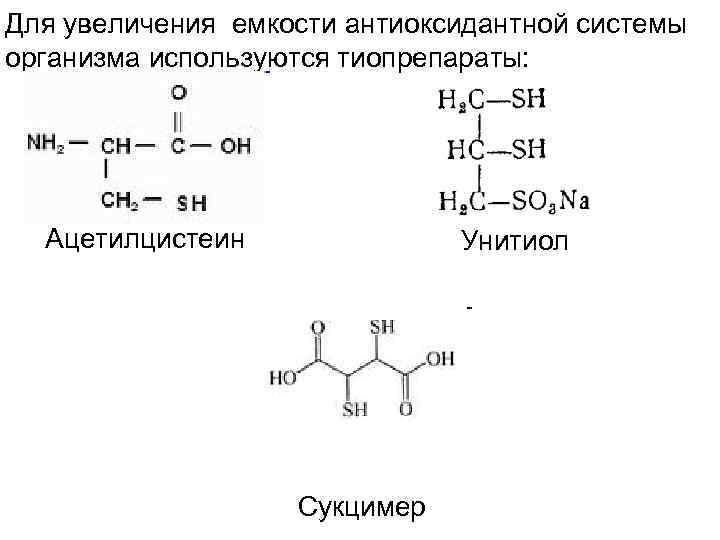 Для увеличения емкости антиоксидантной системы организма используются тиопрепараты: Ацетилцистеин Унитиол Сукцимер
Для увеличения емкости антиоксидантной системы организма используются тиопрепараты: Ацетилцистеин Унитиол Сукцимер
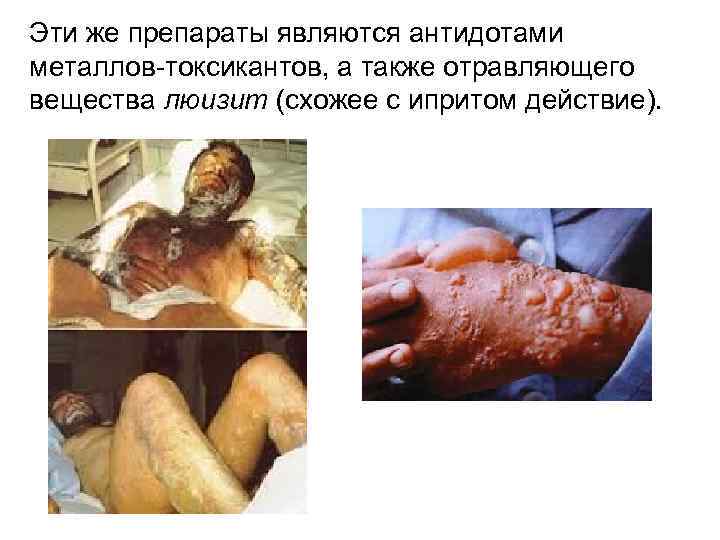 Эти же препараты являются антидотами металлов-токсикантов, а также отравляющего вещества люизит (схожее с ипритом действие).
Эти же препараты являются антидотами металлов-токсикантов, а также отравляющего вещества люизит (схожее с ипритом действие).
 Нарушение окислительно-восстановительного гомеостаза наблюдается при радиоактивном облучении. Для предотвращения тяжелых последствий используют радиопротекторы (вещества, смягчающие последствия радиации), например меркамин (аминотиол) меркамин цистамин
Нарушение окислительно-восстановительного гомеостаза наблюдается при радиоактивном облучении. Для предотвращения тяжелых последствий используют радиопротекторы (вещества, смягчающие последствия радиации), например меркамин (аминотиол) меркамин цистамин
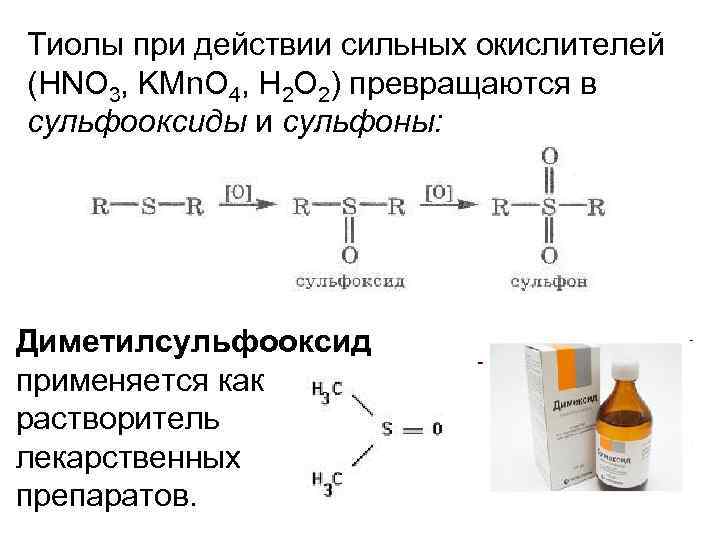 Тиолы при действии сильных окислителей (HNO 3, KMn. O 4, H 2 O 2) превращаются в сульфооксиды и сульфоны: Диметилсульфооксид применяется как растворитель лекарственных препаратов.
Тиолы при действии сильных окислителей (HNO 3, KMn. O 4, H 2 O 2) превращаются в сульфооксиды и сульфоны: Диметилсульфооксид применяется как растворитель лекарственных препаратов.


