Гидроксикислоты. Оксокислоты. Аминоспирты.pptx
- Количество слайдов: 53
 «Гидроксикислоты. Оксокислоты. Аминоспирты»
«Гидроксикислоты. Оксокислоты. Аминоспирты»
 2 Оглавление 1 Гидроксикислоты 2 Оксокислоты 3 Аминоспирты 4 Список использованных источников
2 Оглавление 1 Гидроксикислоты 2 Оксокислоты 3 Аминоспирты 4 Список использованных источников
 3 Гидроксикислоты – это гетерофункциональные соединения, содержащие гидроксильную (-ОН) и карбоксильную (-СООН) группы. По взаимному расположению функциональных групп различают α -, β -, γ - и т. д. гидроксикислоты.
3 Гидроксикислоты – это гетерофункциональные соединения, содержащие гидроксильную (-ОН) и карбоксильную (-СООН) группы. По взаимному расположению функциональных групп различают α -, β -, γ - и т. д. гидроксикислоты.
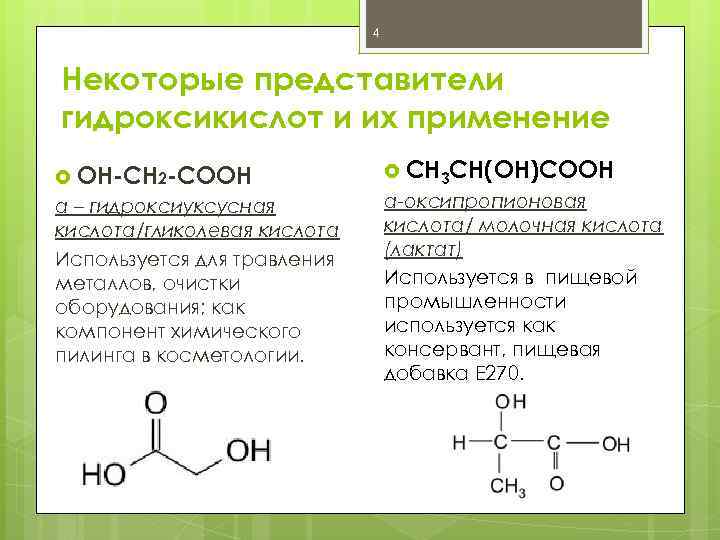 4 Некоторые представители гидроксикислот и их применение ОН-СН 2 -СООН α – гидроксиуксусная кислота/гликолевая кислота Используется для травления металлов, очистки оборудования; как компонент химического пилинга в косметологии. CH 3 CH(OH)COOH α-оксипропионовая кислота/ молочная кислота (лактат) Используется в пищевой промышленности используется как консервант, пищевая добавка E 270.
4 Некоторые представители гидроксикислот и их применение ОН-СН 2 -СООН α – гидроксиуксусная кислота/гликолевая кислота Используется для травления металлов, очистки оборудования; как компонент химического пилинга в косметологии. CH 3 CH(OH)COOH α-оксипропионовая кислота/ молочная кислота (лактат) Используется в пищевой промышленности используется как консервант, пищевая добавка E 270.
 5 НООС-СН(ОН)-СН 2 -СООН 2 -гидроксибутановая кислота/яблочная /кислота Используется в медицине, и в пищевой промышленности как пищевая добавка (Е 296) природного происхождения при изготовлении фруктовых вод и кондитерских изделий. (HOOC-CH 2)2 C(OH)COOH 2 -гидрокси-1, 2, 3 пропантрикарбоновая кислота/лимонная кислота Используется в нефтяной промышленности при бурении нефтяных и газовых скважин. Лимонная кислота удаляет ионы кальция из бурового раствора.
5 НООС-СН(ОН)-СН 2 -СООН 2 -гидроксибутановая кислота/яблочная /кислота Используется в медицине, и в пищевой промышленности как пищевая добавка (Е 296) природного происхождения при изготовлении фруктовых вод и кондитерских изделий. (HOOC-CH 2)2 C(OH)COOH 2 -гидрокси-1, 2, 3 пропантрикарбоновая кислота/лимонная кислота Используется в нефтяной промышленности при бурении нефтяных и газовых скважин. Лимонная кислота удаляет ионы кальция из бурового раствора.
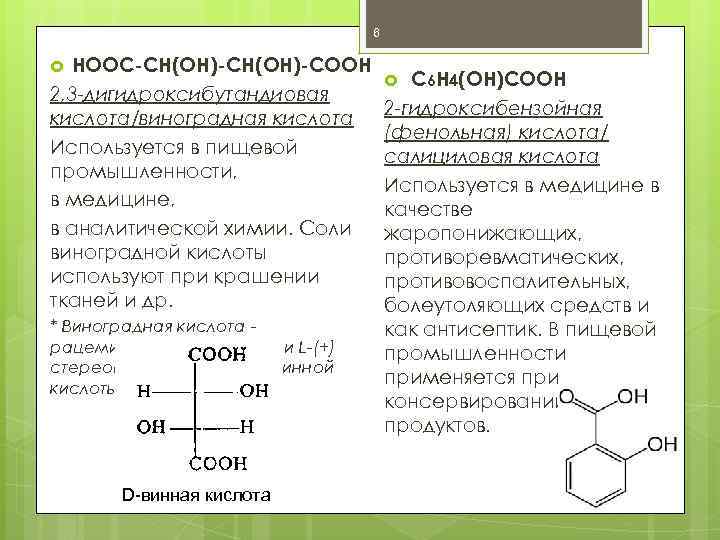 6 НООС-СН(ОН)-СООН 2, 3 -дигидроксибутандиовая кислота/виноградная кислота Используется в пищевой промышленности, в медицине, в аналитической химии. Соли виноградной кислоты используют при крашении тканей и др. * Виноградная кислота рацемическая смесь D-(-) и L-(+) стереоизомерных форм винной кислоты. D-винная кислота С 6 Н 4(ОН)СООН 2 -гидроксибензойная (фенольная) кислота/ салициловая кислота Используется в медицине в качестве жаропонижающих, противоревматических, противовоспалительных, болеутоляющих средств и как антисептик. В пищевой промышленности применяется при консервировании пищевых продуктов.
6 НООС-СН(ОН)-СООН 2, 3 -дигидроксибутандиовая кислота/виноградная кислота Используется в пищевой промышленности, в медицине, в аналитической химии. Соли виноградной кислоты используют при крашении тканей и др. * Виноградная кислота рацемическая смесь D-(-) и L-(+) стереоизомерных форм винной кислоты. D-винная кислота С 6 Н 4(ОН)СООН 2 -гидроксибензойная (фенольная) кислота/ салициловая кислота Используется в медицине в качестве жаропонижающих, противоревматических, противовоспалительных, болеутоляющих средств и как антисептик. В пищевой промышленности применяется при консервировании пищевых продуктов.
 7 Основные методы получения гидроксикислот Гидролиз галогензамещенных кислот Взаимодействие кислотой аминокислот с азотистой
7 Основные методы получения гидроксикислот Гидролиз галогензамещенных кислот Взаимодействие кислотой аминокислот с азотистой
 8 Восстановление оксокислот Присоединение кислотам воды к непредельным
8 Восстановление оксокислот Присоединение кислотам воды к непредельным
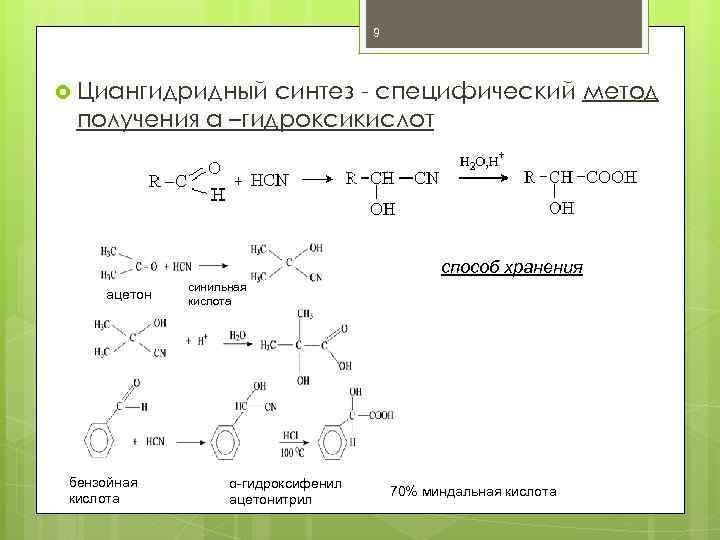 9 Циангидридный синтез - специфический метод получения a –гидроксикислот способ хранения ацетон бензойная кислота синильная кислота α-гидроксифенил ацетонитрил 70% миндальная кислота
9 Циангидридный синтез - специфический метод получения a –гидроксикислот способ хранения ацетон бензойная кислота синильная кислота α-гидроксифенил ацетонитрил 70% миндальная кислота
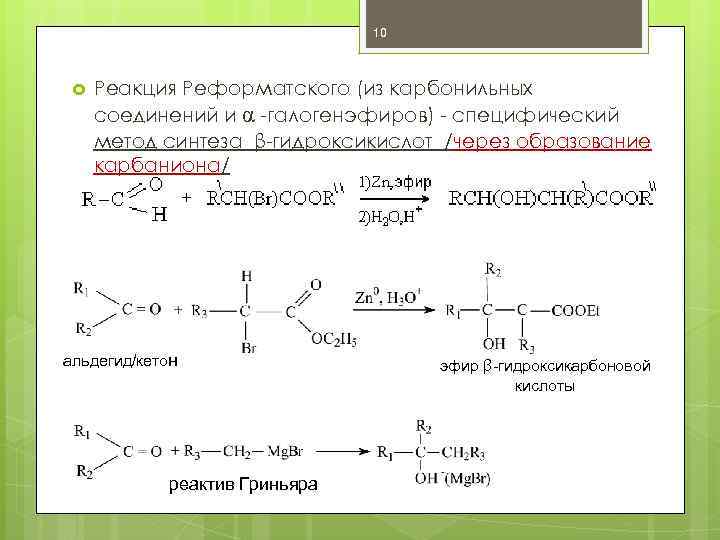 10 Реакция Реформатского (из карбонильных соединений и α -галогенэфиров) - специфический метод синтеза β-гидроксикислот /через образование карбаниона/ альдегид/кетон реактив Гриньяра эфир β-гидроксикарбоновой кислоты
10 Реакция Реформатского (из карбонильных соединений и α -галогенэфиров) - специфический метод синтеза β-гидроксикислот /через образование карбаниона/ альдегид/кетон реактив Гриньяра эфир β-гидроксикарбоновой кислоты
 11 Окисление β –гидроксикарбонильных соединений - специфический метод синтеза β-гидроксикислот Получение полигидроксиполикарбоновых кислот окислением непредельных кислот /щелочь, вода/
11 Окисление β –гидроксикарбонильных соединений - специфический метод синтеза β-гидроксикислот Получение полигидроксиполикарбоновых кислот окислением непредельных кислот /щелочь, вода/
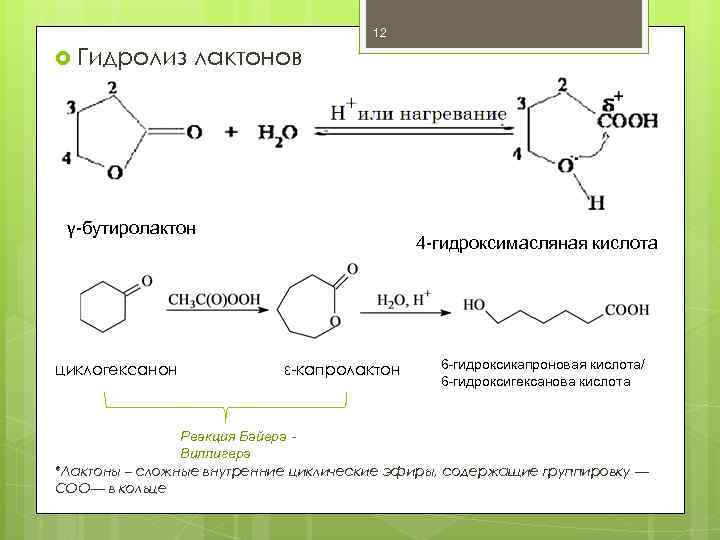 12 Гидролиз лактонов γ-бутиролактон циклогексанон 4 -гидроксимасляная кислота ε-капролактон 6 -гидроксикапроновая кислота/ 6 -гидроксигексанова кислота Реакция Байера - Виллигера *Лактоны – сложные внутренние циклические эфиры, содержащие группировку — COO— в кольце
12 Гидролиз лактонов γ-бутиролактон циклогексанон 4 -гидроксимасляная кислота ε-капролактон 6 -гидроксикапроновая кислота/ 6 -гидроксигексанова кислота Реакция Байера - Виллигера *Лактоны – сложные внутренние циклические эфиры, содержащие группировку — COO— в кольце
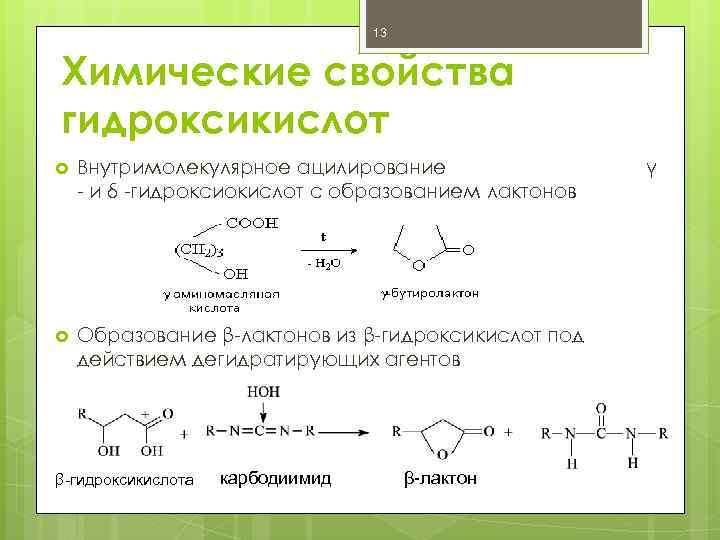 13 Химические свойства гидроксикислот Внутримолекулярное ацилирование - и δ -гидроксиокислот с образованием лактонов Образование β-лактонов из β-гидроксикислот под действием дегидратирующих агентов β-гидроксикислота карбодиимид β-лактон γ
13 Химические свойства гидроксикислот Внутримолекулярное ацилирование - и δ -гидроксиокислот с образованием лактонов Образование β-лактонов из β-гидроксикислот под действием дегидратирующих агентов β-гидроксикислота карбодиимид β-лактон γ
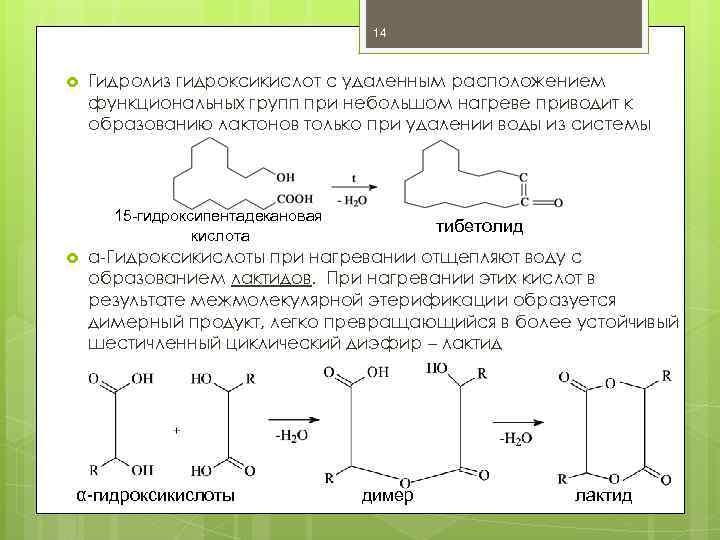 14 Гидролиз гидроксикислот с удаленным расположением функциональных групп при небольшом нагреве приводит к образованию лактонов только при удалении воды из системы 15 -гидроксипентадекановая кислота тибетолид α-Гидроксикислоты при нагревании отщепляют воду с образованием лактидов. При нагревании этих кислот в результате межмолекулярной этерификации образуется димерный продукт, легко превращающийся в более устойчивый шестичленный циклический диэфир – лактид α-гидроксикислоты димер лактид
14 Гидролиз гидроксикислот с удаленным расположением функциональных групп при небольшом нагреве приводит к образованию лактонов только при удалении воды из системы 15 -гидроксипентадекановая кислота тибетолид α-Гидроксикислоты при нагревании отщепляют воду с образованием лактидов. При нагревании этих кислот в результате межмолекулярной этерификации образуется димерный продукт, легко превращающийся в более устойчивый шестичленный циклический диэфир – лактид α-гидроксикислоты димер лактид
 15 Особое свойство α-гидроксикислот заключается в их легкой способности разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты
15 Особое свойство α-гидроксикислот заключается в их легкой способности разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты
 16 У β-гидроксикислот между двумя функциональными группами появляется СН-кислотный центр, что предопределяет протекание реакций внутримолекулярного элиминирования воды
16 У β-гидроксикислот между двумя функциональными группами появляется СН-кислотный центр, что предопределяет протекание реакций внутримолекулярного элиминирования воды
 17 Гидроксикислоты дают все реакции характерные для карбоксильной, гидроксильной групп и реакции, характерные только для гидроксикислот. Свойства по карбоксильной группе Диссоциация. Гидроксикислоты, как правило, являются более сильными кислотами, чем обычные кислоты с тем же числом атомов углерода. Это связано с электроноакцепторным влиянием группы ОН, что приводит к повышению устойчивости образующегося карбоксилат-иона. Чем ближе ОНгруппа располагается к карбоксильной группе, тем сильнее данная кислота.
17 Гидроксикислоты дают все реакции характерные для карбоксильной, гидроксильной групп и реакции, характерные только для гидроксикислот. Свойства по карбоксильной группе Диссоциация. Гидроксикислоты, как правило, являются более сильными кислотами, чем обычные кислоты с тем же числом атомов углерода. Это связано с электроноакцепторным влиянием группы ОН, что приводит к повышению устойчивости образующегося карбоксилат-иона. Чем ближе ОНгруппа располагается к карбоксильной группе, тем сильнее данная кислота.
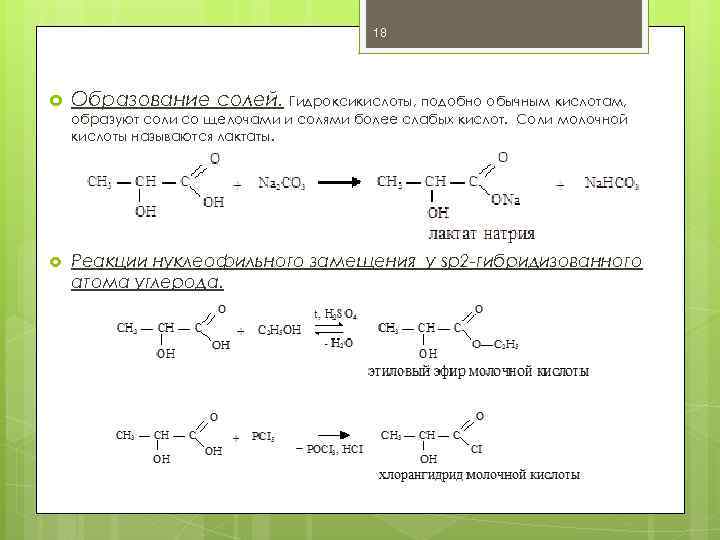 18 Образование солей. Гидроксикислоты, подобно обычным кислотам, образуют соли со щелочами и солями более слабых кислот. Соли молочной кислоты называются лактаты. Реакции нуклеофильного замещения у sp 2 -гибридизованного атома углерода.
18 Образование солей. Гидроксикислоты, подобно обычным кислотам, образуют соли со щелочами и солями более слабых кислот. Соли молочной кислоты называются лактаты. Реакции нуклеофильного замещения у sp 2 -гибридизованного атома углерода.
 19 Метилсалицат образуется при этерификации салициловой кислоты метанолом: Низкая нуклеофильность фенолов не позволяет таким же способом получить фенилсалицилат. Поэтому салициловую кислоту превращают предварительно в более активный ацилирующий агент – хлорангидрид, которым затем ацилируют фенол:
19 Метилсалицат образуется при этерификации салициловой кислоты метанолом: Низкая нуклеофильность фенолов не позволяет таким же способом получить фенилсалицилат. Поэтому салициловую кислоту превращают предварительно в более активный ацилирующий агент – хлорангидрид, которым затем ацилируют фенол:
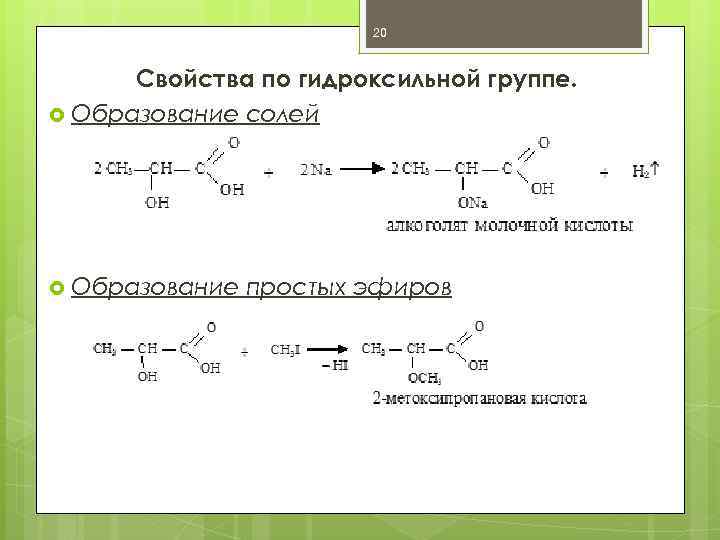 20 Свойства по гидроксильной группе. Образование солей Образование простых эфиров
20 Свойства по гидроксильной группе. Образование солей Образование простых эфиров
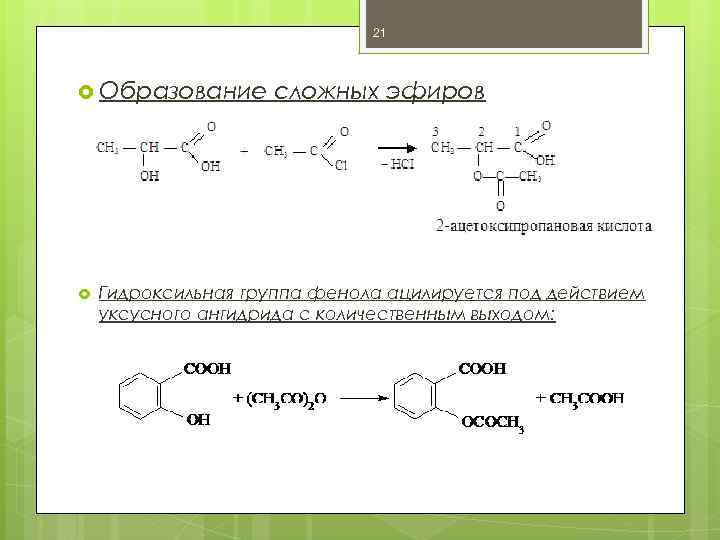 21 Образование сложных эфиров Гидроксильная группа фенола ацилируется под действием уксусного ангидрида с количественным выходом:
21 Образование сложных эфиров Гидроксильная группа фенола ацилируется под действием уксусного ангидрида с количественным выходом:
 22 Оксокислоты – гетерофункциональные соединения, содержащие карбоксильную ( -СООН) и карбонильную (альдегидную или кетонную) группы. В зависимости от взаимного расположения этих групп различают a -, β -, γ - и т. д. оксокарбоновые кислоты.
22 Оксокислоты – гетерофункциональные соединения, содержащие карбоксильную ( -СООН) и карбонильную (альдегидную или кетонную) группы. В зависимости от взаимного расположения этих групп различают a -, β -, γ - и т. д. оксокарбоновые кислоты.
 23 Некоторые представители оксокислот. Их применение и получение
23 Некоторые представители оксокислот. Их применение и получение
 24
24
 25 «КЕТОНОВЫЕ» ТЕЛА «Кетоновые» или «ацетоновые» образуются in vivo в процессе метаболизма высших жирных кислот. Процесс образования кетоновых тел активируется при сахарном диабете и голодании.
25 «КЕТОНОВЫЕ» ТЕЛА «Кетоновые» или «ацетоновые» образуются in vivo в процессе метаболизма высших жирных кислот. Процесс образования кетоновых тел активируется при сахарном диабете и голодании.
 26 Способы получение различных типов оксокислот Оксокислоты разных типов могут быть получены гидролизом геминальных дигалогензамещённых карбоновых кислот дихлоруксусная кислота глиоксалевая (глиоксиловая) кислота α-Оксокислоты также получают гидролизом α-оксонитрилов, гидролизом α-оксонитрилов которые, в свою очередь, синтезируют из ацилгалогенидов и солей циановодородной кислоты ацетилбромид пирувонитрил, 87% пировиноградная кислота
26 Способы получение различных типов оксокислот Оксокислоты разных типов могут быть получены гидролизом геминальных дигалогензамещённых карбоновых кислот дихлоруксусная кислота глиоксалевая (глиоксиловая) кислота α-Оксокислоты также получают гидролизом α-оксонитрилов, гидролизом α-оксонитрилов которые, в свою очередь, синтезируют из ацилгалогенидов и солей циановодородной кислоты ацетилбромид пирувонитрил, 87% пировиноградная кислота
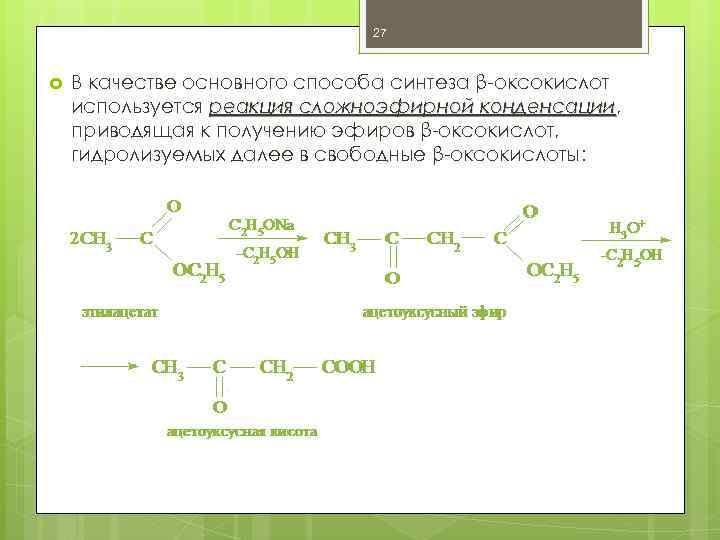 27 В качестве основного способа синтеза β-оксокислот используется реакция сложноэфирной конденсации, конденсации приводящая к получению эфиров β-оксокислот, гидролизуемых далее в свободные β-оксокислоты:
27 В качестве основного способа синтеза β-оксокислот используется реакция сложноэфирной конденсации, конденсации приводящая к получению эфиров β-оксокислот, гидролизуемых далее в свободные β-оксокислоты:
 28 Частный случай получения β-оксокарбоновых кислот состоит в дегидратации и декарбонилировании лимонной кислоты олеумом на холоду: лимонная кислота ацетондикарбоновая кислота Синтез γ-оксокислот из янтарного ангидрида. Эти кислоты ангидрида синтезируют из янтарного ангидрида и магнийорганических соединений, например: янтарный ангидрид 4 -оксогексановая кислота
28 Частный случай получения β-оксокарбоновых кислот состоит в дегидратации и декарбонилировании лимонной кислоты олеумом на холоду: лимонная кислота ацетондикарбоновая кислота Синтез γ-оксокислот из янтарного ангидрида. Эти кислоты ангидрида синтезируют из янтарного ангидрида и магнийорганических соединений, например: янтарный ангидрид 4 -оксогексановая кислота
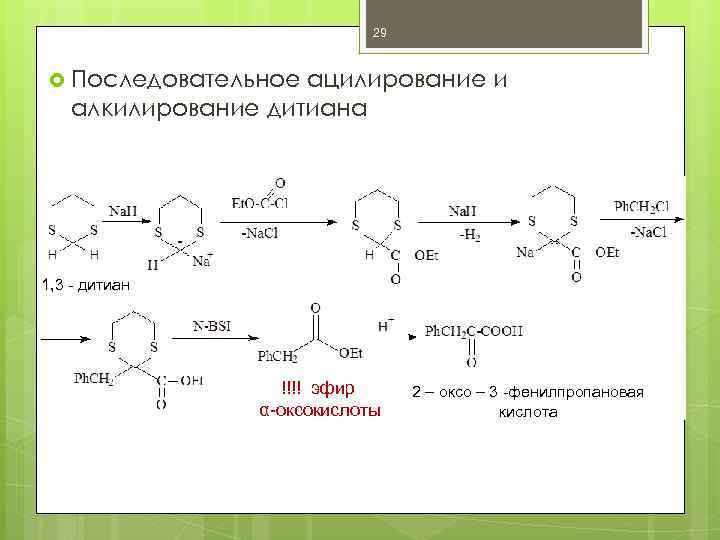 29 Последовательное ацилирование и алкилирование дитиана 1, 3 - дитиан !!!! эфир α-оксокислоты 2 – оксо – 3 -фенилпропановая кислота
29 Последовательное ацилирование и алкилирование дитиана 1, 3 - дитиан !!!! эфир α-оксокислоты 2 – оксо – 3 -фенилпропановая кислота
 30 Химические свойства оксокислот Оксокарбоновые кислоты сильнее, чем соответствующие гироксикарбоновые кислоты. Поэтому в биосредах организма (р. Н≈7) они обычно находятся в виде анионов. Оксокислоты проявляют многие свойства, характерные как для карбоновых кислот, так и для альдегидов и кетонов. Оксокислоты образуют производные по карбоксильной группе – соли, сложные эфиры амиды и т. д. , по оксогруппе – оксимы, гидразоны, гидроксинитрилы и т. д. Химические свойства оксокислот существенно зависят от взаимного расположения функциональных групп. Обе группы оказывают друг на друга определенное влияние. В частности, при близком их расположении наблюдается взаимное усиление электрофильных свойств атомов углерода карбонильной и карбоксильной групп и, как следствие, усиление их реакционной способности при взаимодействии с нуклеофилами. Кислотные свойства оксокарбоновых кислот снижаются по мере удаления оксогруппы от карбоксильной группы.
30 Химические свойства оксокислот Оксокарбоновые кислоты сильнее, чем соответствующие гироксикарбоновые кислоты. Поэтому в биосредах организма (р. Н≈7) они обычно находятся в виде анионов. Оксокислоты проявляют многие свойства, характерные как для карбоновых кислот, так и для альдегидов и кетонов. Оксокислоты образуют производные по карбоксильной группе – соли, сложные эфиры амиды и т. д. , по оксогруппе – оксимы, гидразоны, гидроксинитрилы и т. д. Химические свойства оксокислот существенно зависят от взаимного расположения функциональных групп. Обе группы оказывают друг на друга определенное влияние. В частности, при близком их расположении наблюдается взаимное усиление электрофильных свойств атомов углерода карбонильной и карбоксильной групп и, как следствие, усиление их реакционной способности при взаимодействии с нуклеофилами. Кислотные свойства оксокарбоновых кислот снижаются по мере удаления оксогруппы от карбоксильной группы.
 31 a -оксокислоты легко отщепляют СO 2 и СО при нагревании в присутствии серной кислоты: β -оксокислоты неустойчивы и самопроизвольно декарбоксилируются с образованием кетонов: CH 3 COCH 2 COOH CH 3 COCH 3 + CO 2 Однако их эфиры вполне устойчивы. Их можно получить из сложных эфиров конденсацией Клайзена:
31 a -оксокислоты легко отщепляют СO 2 и СО при нагревании в присутствии серной кислоты: β -оксокислоты неустойчивы и самопроизвольно декарбоксилируются с образованием кетонов: CH 3 COCH 2 COOH CH 3 COCH 3 + CO 2 Однако их эфиры вполне устойчивы. Их можно получить из сложных эфиров конденсацией Клайзена:
 32 α-оксокислоты, у которых карбонильная группа находится в непосредственном соседстве с электроноакцепторной группой, легко вступают в реакции нуклеофильного присоединения Например, некоторые α-оксокислоты легко присоединяют воду и образуют устойчивые гидратные формы: мезоксалевая кислота гидрат мезоксалевой кислоты
32 α-оксокислоты, у которых карбонильная группа находится в непосредственном соседстве с электроноакцепторной группой, легко вступают в реакции нуклеофильного присоединения Например, некоторые α-оксокислоты легко присоединяют воду и образуют устойчивые гидратные формы: мезоксалевая кислота гидрат мезоксалевой кислоты
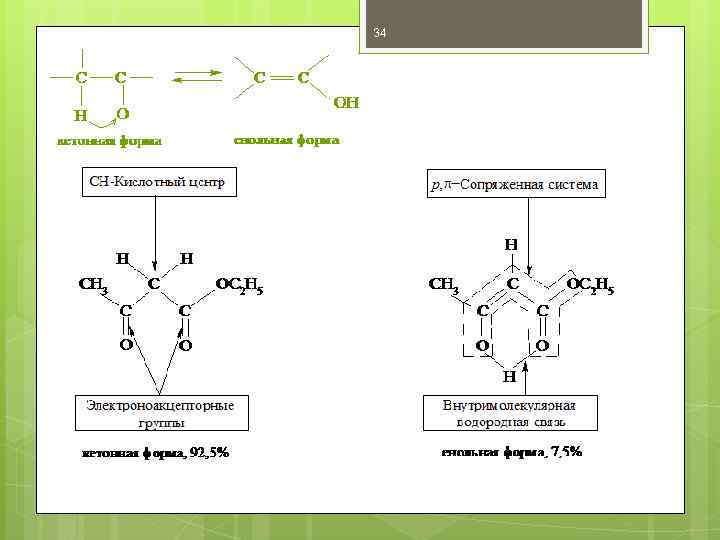
 33 Кето-енольная таутомерия β -оксокислот и их сложных эфиров Таутомерия — вид динамической изомерии, при которой изомеры могут переходить друг в друга, находясь одновременно в растворе в состоянии подвижного термодинамического равновесия. Такие соединения могут прореагировать полностью как в одной, так и в другой форме. В большинстве случаев таутомерные превращения сопровождаются переносом протона от одного атома к другому, поэтому такие виды таутомерии объединяются общим понятием прототропной таутомерии. ***************************************** β -Оксокислоты и их эфиры обладают специфическими свойствами, которые связаны с их повышенной СН-кислотностью. Повышенная подвижность протонов метиленовой группы обусловлена электроноакцепторным влиянием двух карбонильных групп. В результате β-оксокислоты существуют в виде двух таутомерных форм: кетонной и енольной , причем содержание енольной формы в равновесной смеси значительное. Енольные формы дополнительно стабилизируются за счет наличия в них системы сопряженных p -связей и внутримолекулярной водородной связи.
33 Кето-енольная таутомерия β -оксокислот и их сложных эфиров Таутомерия — вид динамической изомерии, при которой изомеры могут переходить друг в друга, находясь одновременно в растворе в состоянии подвижного термодинамического равновесия. Такие соединения могут прореагировать полностью как в одной, так и в другой форме. В большинстве случаев таутомерные превращения сопровождаются переносом протона от одного атома к другому, поэтому такие виды таутомерии объединяются общим понятием прототропной таутомерии. ***************************************** β -Оксокислоты и их эфиры обладают специфическими свойствами, которые связаны с их повышенной СН-кислотностью. Повышенная подвижность протонов метиленовой группы обусловлена электроноакцепторным влиянием двух карбонильных групп. В результате β-оксокислоты существуют в виде двух таутомерных форм: кетонной и енольной , причем содержание енольной формы в равновесной смеси значительное. Енольные формы дополнительно стабилизируются за счет наличия в них системы сопряженных p -связей и внутримолекулярной водородной связи.
 34
34
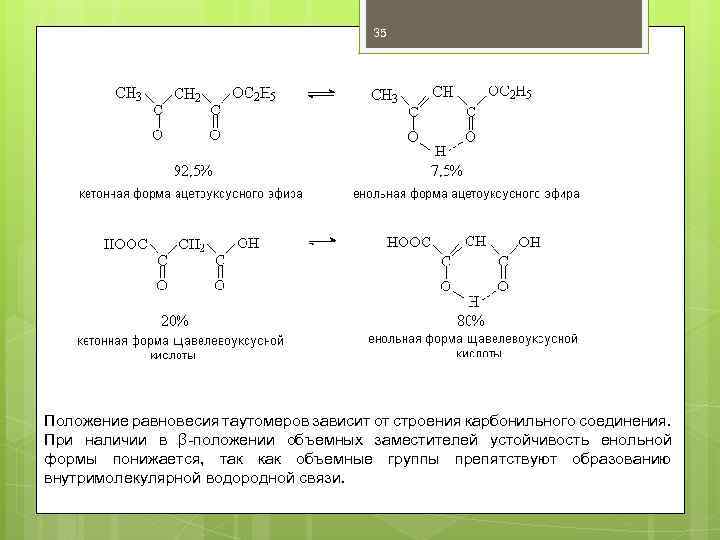 35 Положение равновесия таутомеров зависит от строения карбонильного соединения. При наличии в β-положении объемных заместителей устойчивость енольной формы понижается, так как объемные группы препятствуют образованию внутримолекулярной водородной связи.
35 Положение равновесия таутомеров зависит от строения карбонильного соединения. При наличии в β-положении объемных заместителей устойчивость енольной формы понижается, так как объемные группы препятствуют образованию внутримолекулярной водородной связи.
 36 Наличие у соединения таутометрии значительно расширяет и повышает его реакционную способность. Такое соединение вступает в реакции, характерные для каждого таутомера и проявляет двойственную реакционную способность, характерную для их общего амбидентного аниона. При этом таутомерная система прежде всего вступает в те реакции, которые протекают быстрее (кинетический фактор) и приводят к более устойчивым продуктам (термодинамический фактор). Поскольку все компоненты таутомерной системы находятся в равновесии, то убыль реагирующего компонента сразу восполняется за счет других компонентов. Поэтому таутомерная система реагирует как одно целое. В организме время установления равновесия в таутомерной системе уменьшается с помощью ферментов-таутомераз, что обеспечивает необходимую скорость жизненно важных биохимических реакций .
36 Наличие у соединения таутометрии значительно расширяет и повышает его реакционную способность. Такое соединение вступает в реакции, характерные для каждого таутомера и проявляет двойственную реакционную способность, характерную для их общего амбидентного аниона. При этом таутомерная система прежде всего вступает в те реакции, которые протекают быстрее (кинетический фактор) и приводят к более устойчивым продуктам (термодинамический фактор). Поскольку все компоненты таутомерной системы находятся в равновесии, то убыль реагирующего компонента сразу восполняется за счет других компонентов. Поэтому таутомерная система реагирует как одно целое. В организме время установления равновесия в таутомерной системе уменьшается с помощью ферментов-таутомераз, что обеспечивает необходимую скорость жизненно важных биохимических реакций .
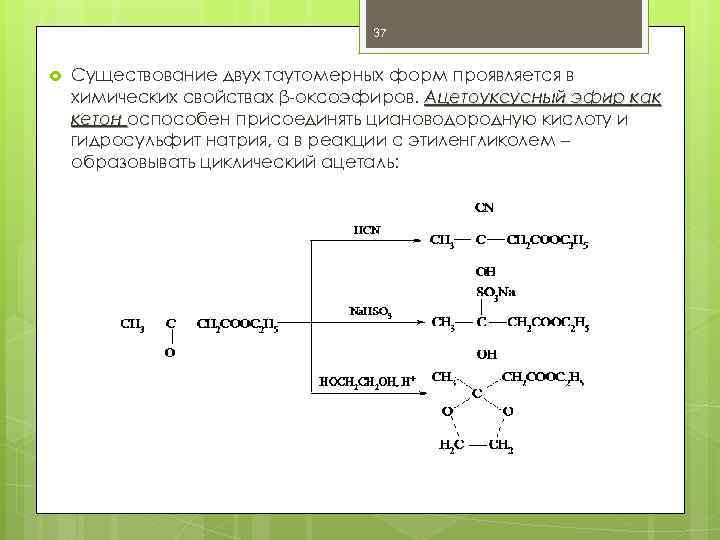 37 Существование двух таутомерных форм проявляется в химических свойствах β-оксоэфиров. Ацетоуксусный эфир как кетон оспособен присоединять циановодородную кислоту и гидросульфит натрия, а в реакции с этиленгликолем – образовывать циклический ацеталь:
37 Существование двух таутомерных форм проявляется в химических свойствах β-оксоэфиров. Ацетоуксусный эфир как кетон оспособен присоединять циановодородную кислоту и гидросульфит натрия, а в реакции с этиленгликолем – образовывать циклический ацеталь:
 38 В енольной форме ацетоуксусный эфир при взаимодействии с хлоридом фосфора (V) превращается в эфир галогенозамещенной α, β-ненасыщенной кислоты: Качественной пробой для обнаружения енольной формы ацетоуксусного эфира служит реакция с Fe. Cl 3, приводящая к появлению вишневого окрашивания реакционной смеси.
38 В енольной форме ацетоуксусный эфир при взаимодействии с хлоридом фосфора (V) превращается в эфир галогенозамещенной α, β-ненасыщенной кислоты: Качественной пробой для обнаружения енольной формы ацетоуксусного эфира служит реакция с Fe. Cl 3, приводящая к появлению вишневого окрашивания реакционной смеси.
 39 Для количественного определения содержания енольной формы в равновесной смеси применяют титрование бромом. Бромирование двойной связи протекает значительно быстрее, чем енолизация карбонильного соединения, поэтому при быстром проведении титрования удается довольно точно установить содержание енольной формы:
39 Для количественного определения содержания енольной формы в равновесной смеси применяют титрование бромом. Бромирование двойной связи протекает значительно быстрее, чем енолизация карбонильного соединения, поэтому при быстром проведении титрования удается довольно точно установить содержание енольной формы:
 40 Ацетоуксусный эфир, как эфир β-кетокислоты, расщепляется щелочами по связи С―С: Разбавленные щелочи вызывают кетонное расщепление эфира (а), концентрированные – кислотное (b). Кислотное расщепление приводит к образованию сложных эфиров замещенных уксусных кислот. Гидролиз образующегося сложного эфира обычно осуществляют в кислой среде:
40 Ацетоуксусный эфир, как эфир β-кетокислоты, расщепляется щелочами по связи С―С: Разбавленные щелочи вызывают кетонное расщепление эфира (а), концентрированные – кислотное (b). Кислотное расщепление приводит к образованию сложных эфиров замещенных уксусных кислот. Гидролиз образующегося сложного эфира обычно осуществляют в кислой среде:
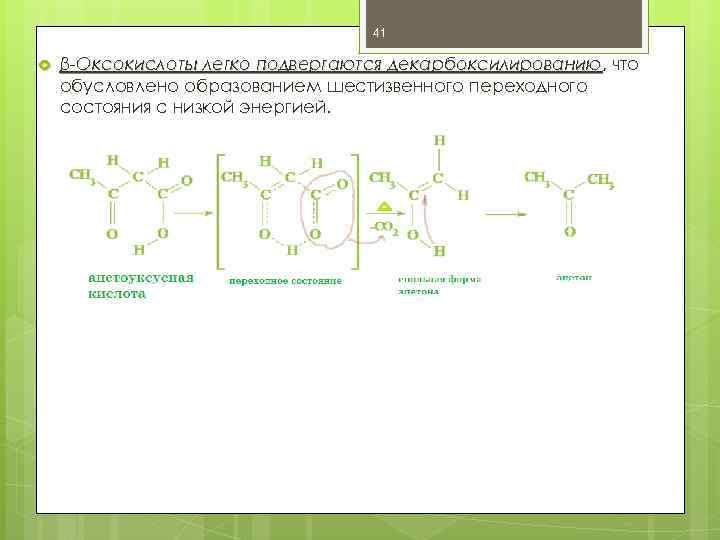 41 β-Оксокислоты легко подвергаются декарбоксилированию, что декарбоксилированию обусловлено образованием шестизвенного переходного состояния с низкой энергией.
41 β-Оксокислоты легко подвергаются декарбоксилированию, что декарбоксилированию обусловлено образованием шестизвенного переходного состояния с низкой энергией.
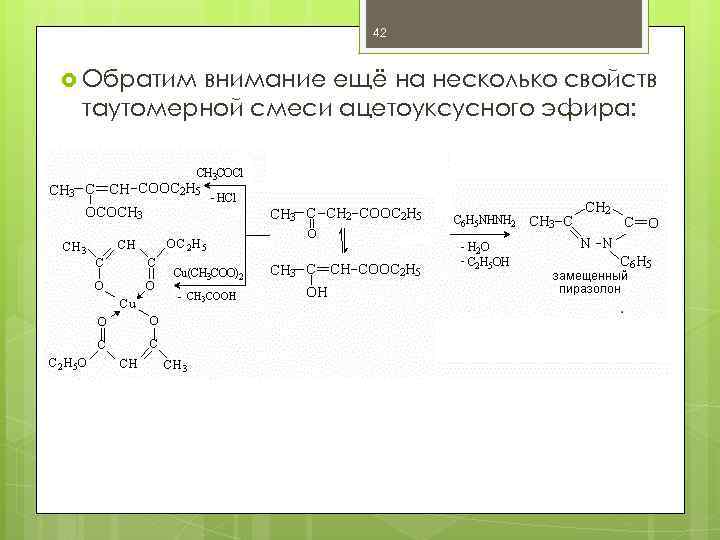 42 Обратим внимание ещё на несколько свойств таутомерной смеси ацетоуксусного эфира:
42 Обратим внимание ещё на несколько свойств таутомерной смеси ацетоуксусного эфира:
 43 Аминоспирты (аминоалкоголи, алканоламины, гидроксиамины) - алифатические соединения, содержащие амино- и оксигруппы. По взаимному расположению этих групп в молекуле различают 1, 1 -аминоспирты (напр. , H 2 NCH 2 OH), 1, 2 -аминоспирты (напр. , H 2 NCH 2 OH) и т. п. Из-за электронно-акцепторных свойств гидроксильной группы нуклеофильность аминогруппы меньше, чем у алифатических аминов. Нуклеофильность атома кислорода в гидроксильной группе уменьшается из-за –Jэфф. –NH 2 группы, следовательно, аминоспирты сложнее этерифицируются.
43 Аминоспирты (аминоалкоголи, алканоламины, гидроксиамины) - алифатические соединения, содержащие амино- и оксигруппы. По взаимному расположению этих групп в молекуле различают 1, 1 -аминоспирты (напр. , H 2 NCH 2 OH), 1, 2 -аминоспирты (напр. , H 2 NCH 2 OH) и т. п. Из-за электронно-акцепторных свойств гидроксильной группы нуклеофильность аминогруппы меньше, чем у алифатических аминов. Нуклеофильность атома кислорода в гидроксильной группе уменьшается из-за –Jэфф. –NH 2 группы, следовательно, аминоспирты сложнее этерифицируются.
 44 Некоторые представители аминоспиртов и их применение + HO-CH 2 -N(CН 3)3 НО-СН 2 -NH 2 2 -Аминоэтанол -этаноламин)/ коламин Триметил-2(β гидроксиэтиламмоний /холин Используется для синтеза лекарственных препаратов. Входит в состав фосфолипидов тканей животных (кефалинов). В организме из холина синтезируется важнейший нейромедиаторпередатчик нервного импульса — ацетилхолин. Холин является важным веществом для нервной системы и улучшает память. Входит в состав фосфолипидов (например, лецитина, сфингомиелина). Влияет на углеводный обмен, регулируя уровень инсулина в организме.
44 Некоторые представители аминоспиртов и их применение + HO-CH 2 -N(CН 3)3 НО-СН 2 -NH 2 2 -Аминоэтанол -этаноламин)/ коламин Триметил-2(β гидроксиэтиламмоний /холин Используется для синтеза лекарственных препаратов. Входит в состав фосфолипидов тканей животных (кефалинов). В организме из холина синтезируется важнейший нейромедиаторпередатчик нервного импульса — ацетилхолин. Холин является важным веществом для нервной системы и улучшает память. Входит в состав фосфолипидов (например, лецитина, сфингомиелина). Влияет на углеводный обмен, регулируя уровень инсулина в организме.
 45 Получение аминоспиртов Получают аминоспирты путем аммонолиза и аминолиза оксирана и его производных, галогеноспиртов, а также восстановлением соответствующих нитроспиртов: 1, 2 -этиленоксид 2 -хлорэтанол 2 -аминоэтанол 2 -N, N-диметиламиноэтанол
45 Получение аминоспиртов Получают аминоспирты путем аммонолиза и аминолиза оксирана и его производных, галогеноспиртов, а также восстановлением соответствующих нитроспиртов: 1, 2 -этиленоксид 2 -хлорэтанол 2 -аминоэтанол 2 -N, N-диметиламиноэтанол
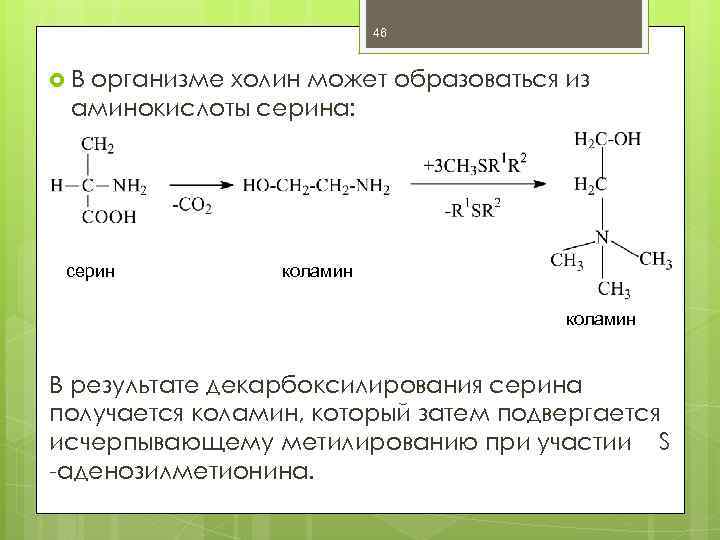 46 В организме холин может образоваться из аминокислоты серина: серин коламин В результате декарбоксилирования серина получается коламин, который затем подвергается исчерпывающему метилированию при участии S -аденозилметионина.
46 В организме холин может образоваться из аминокислоты серина: серин коламин В результате декарбоксилирования серина получается коламин, который затем подвергается исчерпывающему метилированию при участии S -аденозилметионина.
 47 Химические свойства аминоспиртов Разбавленные минеральные и сильные карбоновые к-ты образуют с аминоспиртами кристаллич. аммониевые соли: СО 2 и H 2 S в водном р-ре при комнатной т-ре дают непрочные соли, распадающиеся при нагр. на исходные компоненты: При взаимодействии с СО 2 в безводной среде аминоспирты превращаются в замещенные карбаминовые к-ты, разлагающиеся в воде на карбонаты и затем на исходные компоненты:
47 Химические свойства аминоспиртов Разбавленные минеральные и сильные карбоновые к-ты образуют с аминоспиртами кристаллич. аммониевые соли: СО 2 и H 2 S в водном р-ре при комнатной т-ре дают непрочные соли, распадающиеся при нагр. на исходные компоненты: При взаимодействии с СО 2 в безводной среде аминоспирты превращаются в замещенные карбаминовые к-ты, разлагающиеся в воде на карбонаты и затем на исходные компоненты:
 48 Первичные и вторичные аминоспирты реагируют с COS и CS 2 в водном р-ре на холоду: Аммонолиз и аминирование аминоспиртов приводят к дии полиаминам: В более жестких условиях этанол- и диэтаноламин с NH 3 образуют пиперазин:
48 Первичные и вторичные аминоспирты реагируют с COS и CS 2 в водном р-ре на холоду: Аммонолиз и аминирование аминоспиртов приводят к дии полиаминам: В более жестких условиях этанол- и диэтаноламин с NH 3 образуют пиперазин:
 49 Реакция моноэтаноламинов с 48 %-ной НВr приводит к виниламинам: При взаимодействие со сложными эфирами и карбоновыми кислотами или их ангидридами и хлорат-нарядами моно- и диэтаноламины превращаются соответственно в N-(2 -гидрооксиэтил)- и N, N-ди(2 -гидрооксиэтил)амиды кислот. Триэтаноламин реагирует с карбоновыми кислотами и хлорангидридами при повышенных температурах, например:
49 Реакция моноэтаноламинов с 48 %-ной НВr приводит к виниламинам: При взаимодействие со сложными эфирами и карбоновыми кислотами или их ангидридами и хлорат-нарядами моно- и диэтаноламины превращаются соответственно в N-(2 -гидрооксиэтил)- и N, N-ди(2 -гидрооксиэтил)амиды кислот. Триэтаноламин реагирует с карбоновыми кислотами и хлорангидридами при повышенных температурах, например:
 50 Диэтаноламин с высшими альдегидами в присутствии К 2 СО 3 образует третичные аминоспирты, которые далее превращаются в-ненасыщенные аминоспирты: Реакция моно- и диэтаноламинов с формальдегидом в присутствии щелочи приводит к метилольным производным, последние могут вступать в реакцию со второй молекулой диэтаноламина с образованием N, N, N"-тетра(2 -гидроксиэтил)метилендиамина:
50 Диэтаноламин с высшими альдегидами в присутствии К 2 СО 3 образует третичные аминоспирты, которые далее превращаются в-ненасыщенные аминоспирты: Реакция моно- и диэтаноламинов с формальдегидом в присутствии щелочи приводит к метилольным производным, последние могут вступать в реакцию со второй молекулой диэтаноламина с образованием N, N, N"-тетра(2 -гидроксиэтил)метилендиамина:
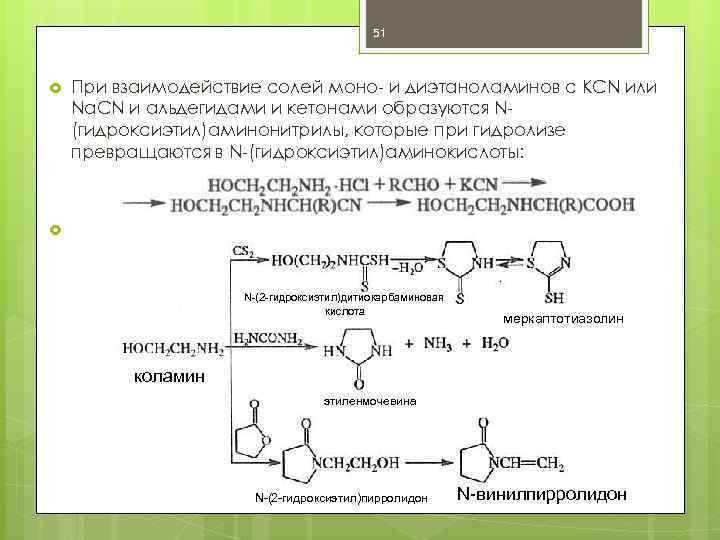 51 При взаимодействие солей моно- и диэтаноламинов с KCN или Na. CN и альдегидами и кетонами образуются N(гидроксиэтил)аминонитрилы, которые при гидролизе превращаются в N-(гидроксиэтил)аминокислоты: N-(2 -гидроксиэтил)дитиокарбаминовая кислота меркаптотиазолин коламин этиленмочевина N-(2 -гидроксиэтил)пирролидон N-винилпирролидон
51 При взаимодействие солей моно- и диэтаноламинов с KCN или Na. CN и альдегидами и кетонами образуются N(гидроксиэтил)аминонитрилы, которые при гидролизе превращаются в N-(гидроксиэтил)аминокислоты: N-(2 -гидроксиэтил)дитиокарбаминовая кислота меркаптотиазолин коламин этиленмочевина N-(2 -гидроксиэтил)пирролидон N-винилпирролидон
 52 Аммонолиз диэтаноламин в присутствии Н 2 и катализаторов гидрирования превращается в пиперазин и полиэтиленполиамин:
52 Аммонолиз диэтаноламин в присутствии Н 2 и катализаторов гидрирования превращается в пиперазин и полиэтиленполиамин:
 53 Список использованных источников 1. Н. А. Тюкавкина. Биоорганическая химия: Учебн. для вузов/ Н. А. Тюкавкина, Ю. И. Бауков. – 4 -е изд. , стереотип. – М. : Дрофа, 2005. – 542 с. 2. Н. А. Тюкавкина «Руководство к лабораторным занятиям по органической химии» / под редакцией Дрофа. - М. : 2003. С. К. Огородников. Справочник нефтехимика. -т. 2, изд. М: Химия, 1978. — 592 с. 4. Травень В. Ф. Органическая химия: Академкнига. – изд. М. : 2008. 5. Грандберг И. И. Органическая химия: Академкнига. - М. : 2008. 6. Википедия [Электронный ресурс]: беспл. свободная энциклопедия. - Режим доступа http: //ru. wikipedia. org/ - Загл. с экрана.
53 Список использованных источников 1. Н. А. Тюкавкина. Биоорганическая химия: Учебн. для вузов/ Н. А. Тюкавкина, Ю. И. Бауков. – 4 -е изд. , стереотип. – М. : Дрофа, 2005. – 542 с. 2. Н. А. Тюкавкина «Руководство к лабораторным занятиям по органической химии» / под редакцией Дрофа. - М. : 2003. С. К. Огородников. Справочник нефтехимика. -т. 2, изд. М: Химия, 1978. — 592 с. 4. Травень В. Ф. Органическая химия: Академкнига. – изд. М. : 2008. 5. Грандберг И. И. Органическая химия: Академкнига. - М. : 2008. 6. Википедия [Электронный ресурс]: беспл. свободная энциклопедия. - Режим доступа http: //ru. wikipedia. org/ - Загл. с экрана.


