лекция оптика.ppt
- Количество слайдов: 38
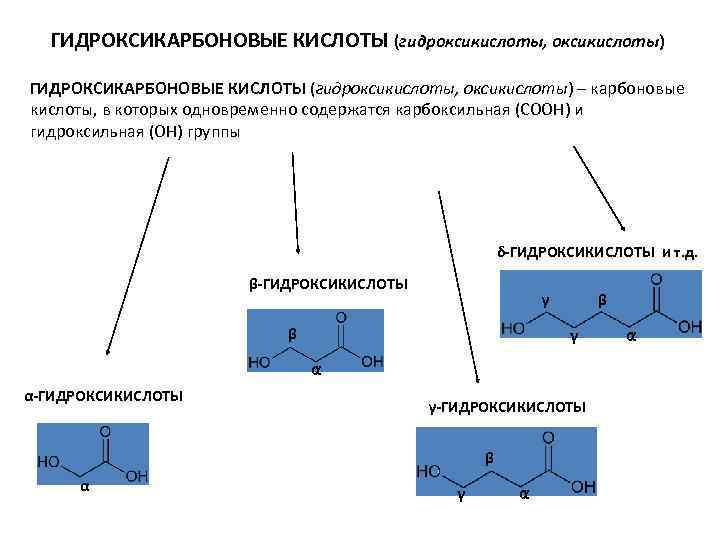
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) – карбоновые кислоты, в которых одновременно содержатся карбоксильная (СООН) и гидроксильная (ОН) группы δ-ГИДРОКСИКИСЛОТЫ и т. д. β-ГИДРОКСИКИСЛОТЫ γ β α α-ГИДРОКСИКИСЛОТЫ γ-ГИДРОКСИКИСЛОТЫ β α γ α α
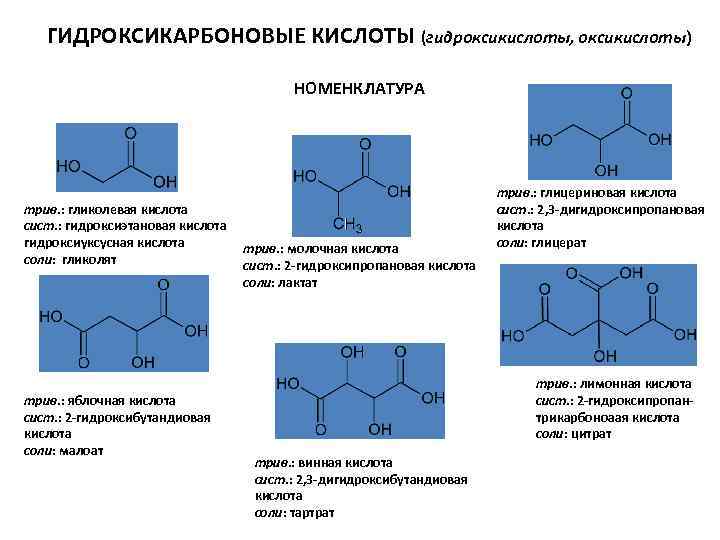
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) НОМЕНКЛАТУРА трив. : гликолевая кислота сист. : гидроксиэтановая кислота гидроксиуксусная кислота соли: гликолят трив. : яблочная кислота сист. : 2 -гидроксибутандиовая кислота соли: малоат трив. : молочная кислота сист. : 2 -гидроксипропановая кислота соли: лактат трив. : глицериновая кислота сист. : 2, 3 -дигидроксипропановая кислота соли: глицерат трив. : лимонная кислота сист. : 2 -гидроксипропантрикарбоноаая кислота соли: цитрат трив. : винная кислота сист. : 2, 3 -дигидроксибутандиовая кислота соли: тартрат
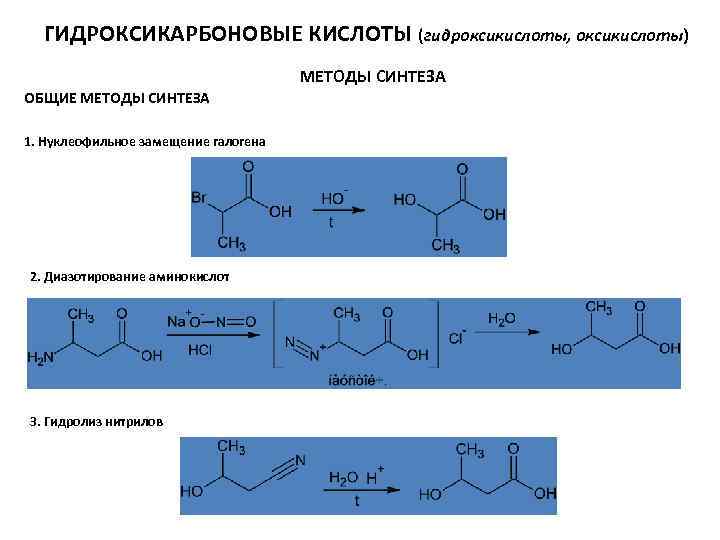
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) МЕТОДЫ СИНТЕЗА ОБЩИЕ МЕТОДЫ СИНТЕЗА 1. Нуклеофильное замещение галогена 2. Диазотирование аминокислот 3. Гидролиз нитрилов
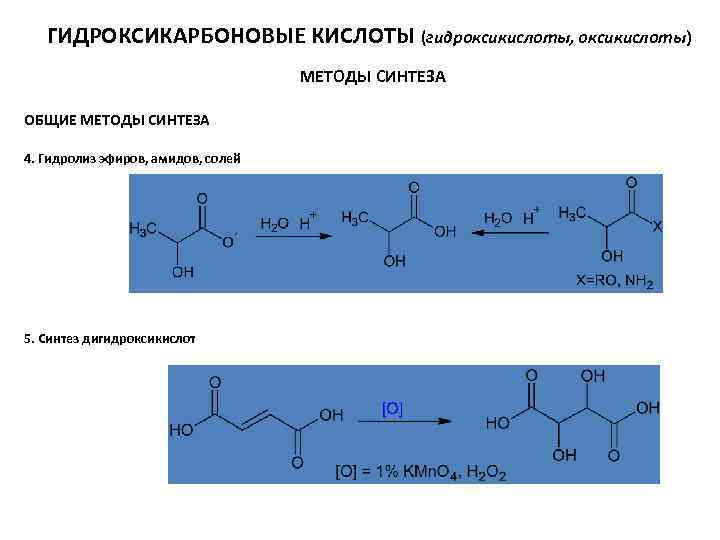
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) МЕТОДЫ СИНТЕЗА ОБЩИЕ МЕТОДЫ СИНТЕЗА 4. Гидролиз эфиров, амидов, солей 5. Синтез дигидроксикислот
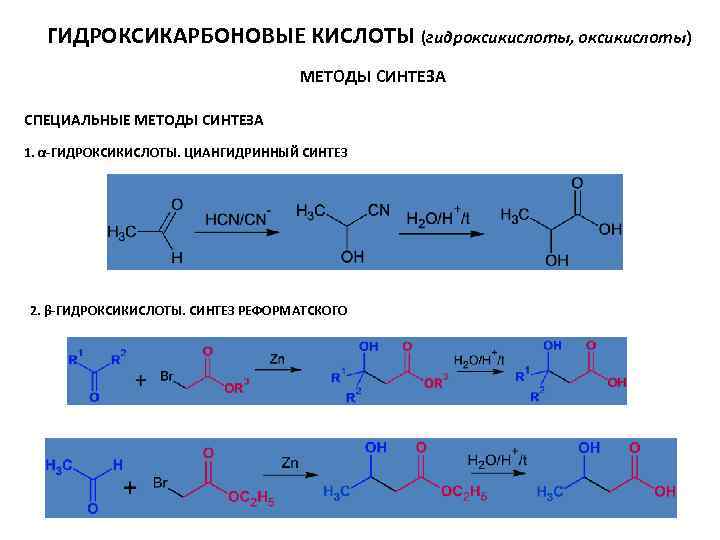
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) МЕТОДЫ СИНТЕЗА СПЕЦИАЛЬНЫЕ МЕТОДЫ СИНТЕЗА 1. α-ГИДРОКСИКИСЛОТЫ. ЦИАНГИДРИННЫЙ СИНТЕЗ 2. β-ГИДРОКСИКИСЛОТЫ. СИНТЕЗ РЕФОРМАТСКОГО
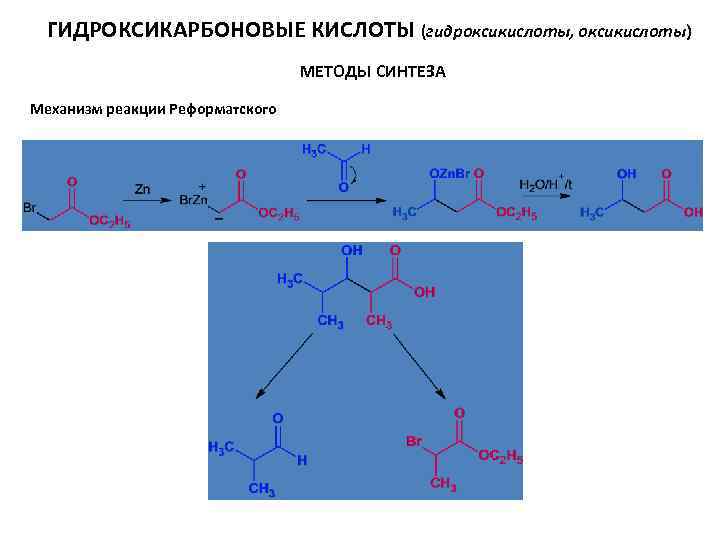
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) МЕТОДЫ СИНТЕЗА Механизм реакции Реформатского
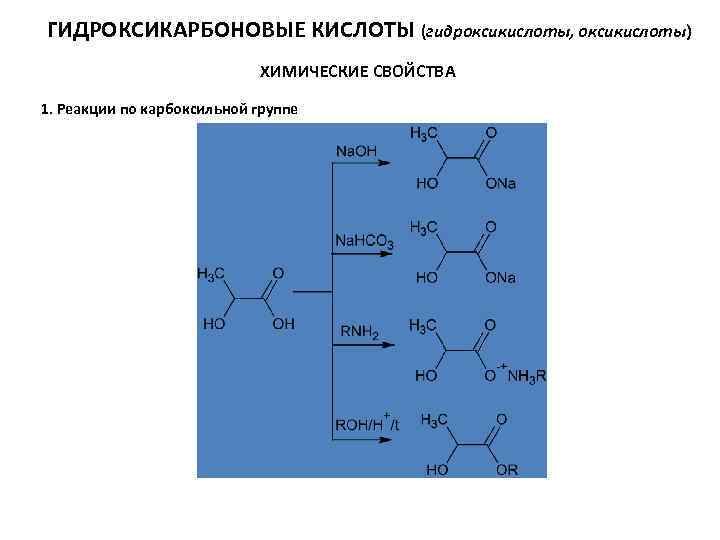
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) ХИМИЧЕСКИЕ СВОЙСТВА 1. Реакции по карбоксильной группе
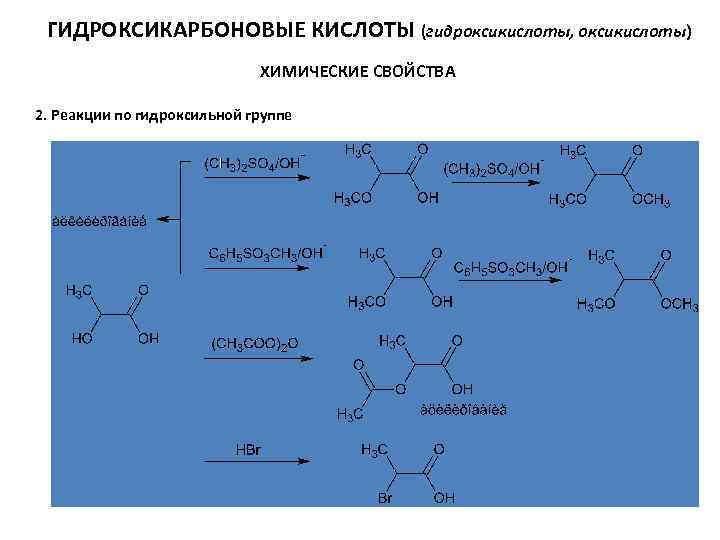
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) ХИМИЧЕСКИЕ СВОЙСТВА 2. Реакции по гидроксильной группе
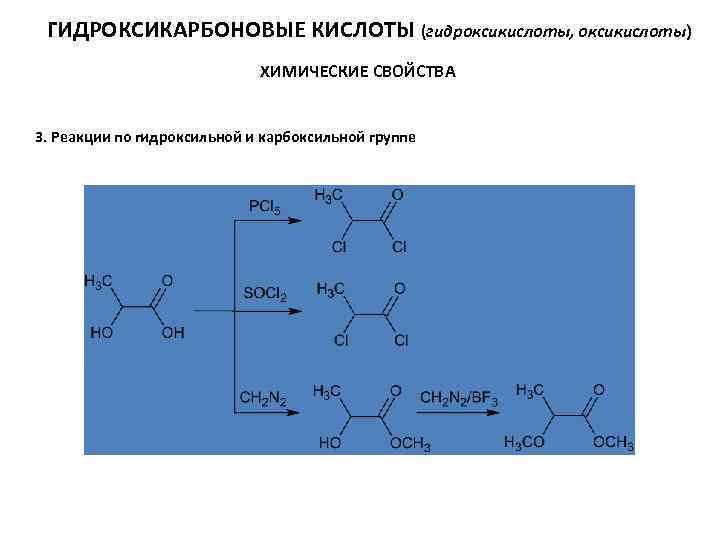
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) ХИМИЧЕСКИЕ СВОЙСТВА 3. Реакции по гидроксильной и карбоксильной группе
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) Нуклеофильность выше
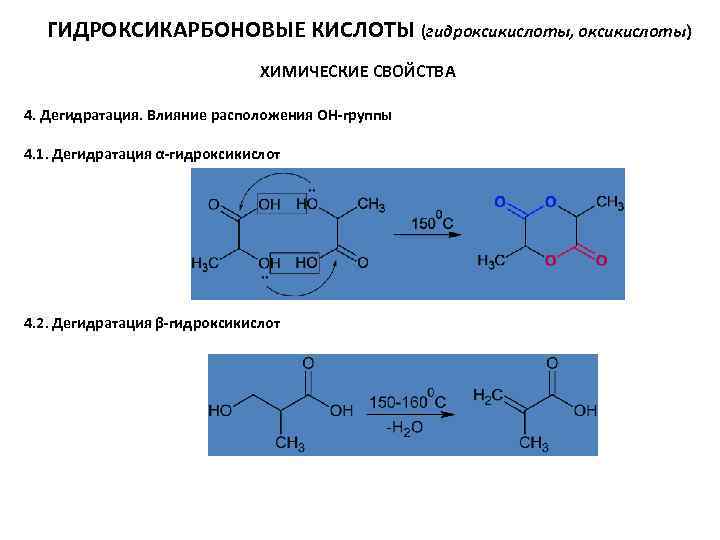
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) ХИМИЧЕСКИЕ СВОЙСТВА 4. Дегидратация. Влияние расположения ОН-группы 4. 1. Дегидратация α-гидроксикислот 4. 2. Дегидратация β-гидроксикислот
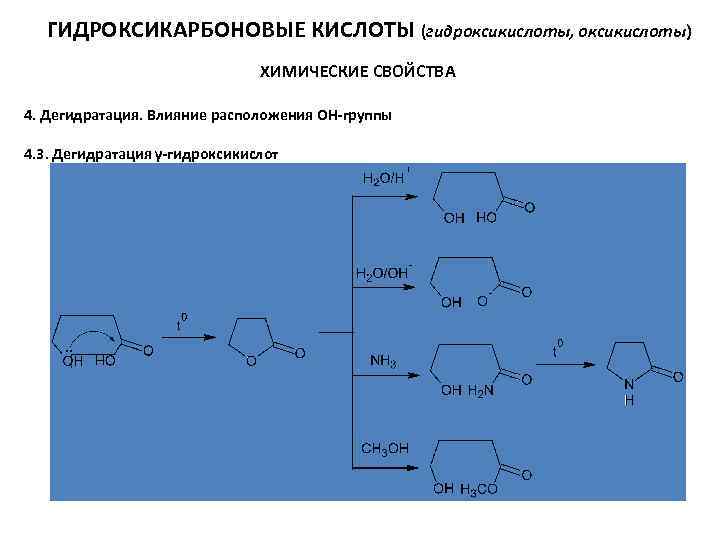
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) ХИМИЧЕСКИЕ СВОЙСТВА 4. Дегидратация. Влияние расположения ОН-группы 4. 3. Дегидратация γ-гидроксикислот γ-Бутиролактон
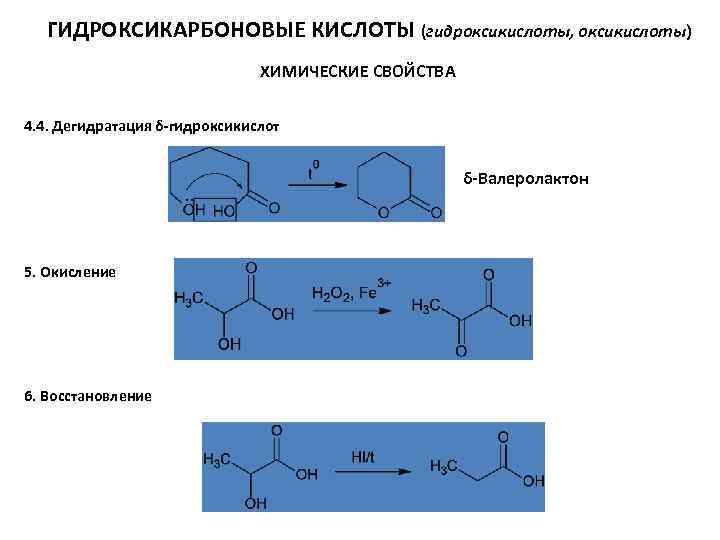
ГИДРОКСИКАРБОНОВЫЕ КИСЛОТЫ (гидроксикислоты, оксикислоты) ХИМИЧЕСКИЕ СВОЙСТВА 4. 4. Дегидратация δ-гидроксикислот δ-Валеролактон 5. Окисление 6. Восстановление
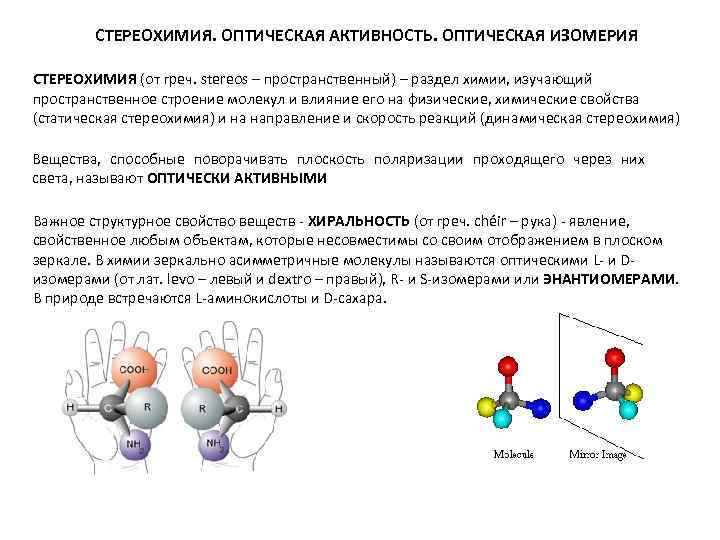
СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ АКТИВНОСТЬ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ СТЕРЕОХИМИЯ (от греч. stereos – пространственный) – раздел химии, изучающий пространственное строение молекул и влияние его на физические, химические свойства (статическая стереохимия) и на направление и скорость реакций (динамическая стереохимия) Вещества, способные поворачивать плоскость поляризации проходящего через них света, называют ОПТИЧЕСКИ АКТИВНЫМИ Важное структурное свойство веществ - ХИРАЛЬНОСТЬ (от греч. chéir – рука) - явление, свойственное любым объектам, которые несовместимы со своим отображением в плоском зеркале. В химии зеркально асимметричные молекулы называются оптическими L- и Dизомерами (от лат. levo – левый и dextro – правый), R- и S-изомерами или ЭНАНТИОМЕРАМИ. В природе встречаются L-аминокислоты и D-сахара.

ХИРАЛЬНОСТЬ. ЗЕРКАЛЬНОЕ ОТОБРАЖЕНИЕ
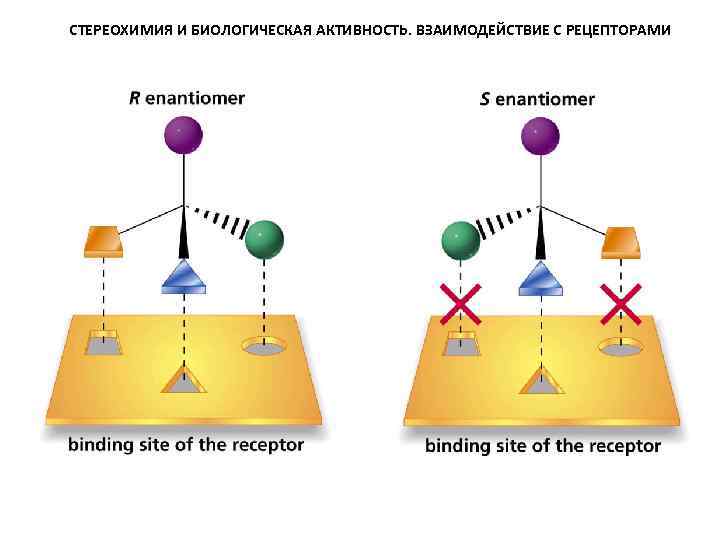
СТЕРЕОХИМИЯ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ. ВЗАИМОДЕЙСТВИЕ С РЕЦЕПТОРАМИ

СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (стереоизомерия) ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ (СТЕРЕОИЗОМЕРИЯ, ОПТИЧЕСКАЯ ИЗОМЕРИЯ) - изомерия возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Этот тип изомеров подразделяют на энантиомерию (оптическую изомерию) и диастереомерию. КОНФИГУРАЦИЯ СТЕРЕОХИМИЧЕСКАЯ — характеризует относительное пространственное расположение атомов или групп атомов в молекуле химического соединения. ЭНАНТИОМЕРАМИ (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с др. оптически активными веществами). Необходимая и достаточная причина возникновения оптических антиподов — наличие асимметрического атома углерода - sp 3 -гибридного атома углерода, связанного с четырьмя разными заместителями. Эквимолярная смесь энантиомеров не обладает оптической активностью. Такая смесь называется РАЦЕМИЧЕСКОЙ СМЕСЬЮ или РАЦЕМАТОМ. ДИАСТЕРИОМЕРЫ – оптические изомеры, характеризующиеся наличием хотя бы одного асимметрического атома углерода с одинаковой конфигурацией и хотя бы одного с различной. Диастериомеры характеризуются различными физическими свойствами и одинаковыми химическими
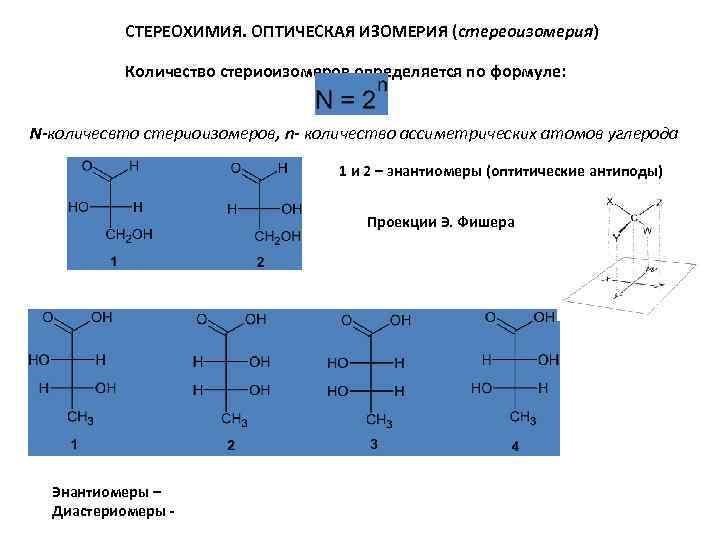
СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (стереоизомерия) Количество стериоизомеров определяется по формуле: N-количесвто стериоизомеров, n- количество ассиметрических атомов углерода 1 и 2 – энантиомеры (оптитические антиподы) Проекции Э. Фишера Энантиомеры – Диастериомеры -
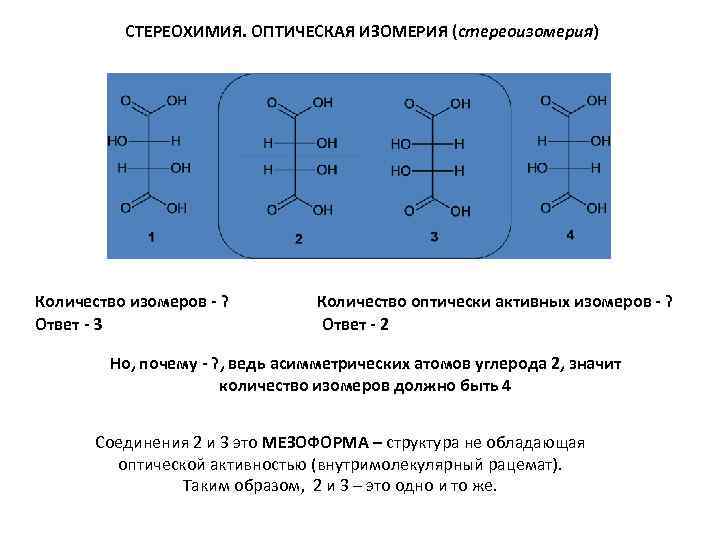
СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (стереоизомерия) Количество изомеров - ? Ответ - 3 Количество оптически активных изомеров - ? Ответ - 2 Но, почему - ? , ведь асимметрических атомов углерода 2, значит количество изомеров должно быть 4 Соединения 2 и 3 это МЕЗОФОРМА – структура не обладающая оптической активностью (внутримолекулярный рацемат). Таким образом, 2 и 3 – это одно и то же.
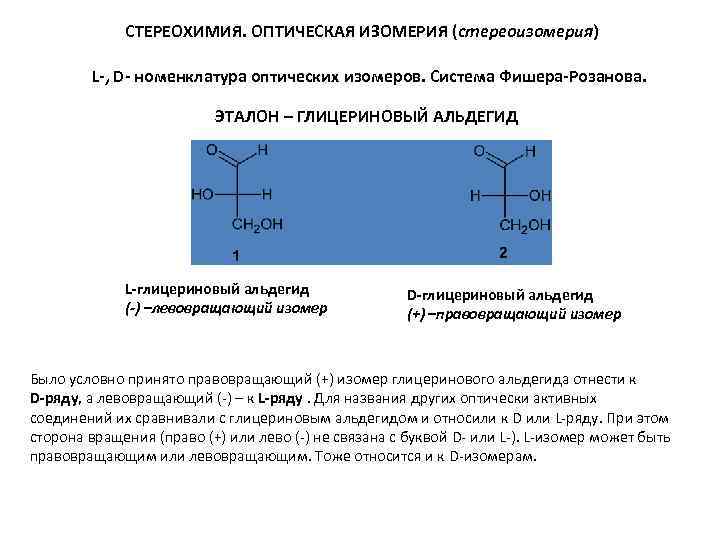
СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (стереоизомерия) L-, D- номенклатура оптических изомеров. Система Фишера-Розанова. ЭТАЛОН – ГЛИЦЕРИНОВЫЙ АЛЬДЕГИД L-глицериновый альдегид (-) –левовращающий изомер D-глицериновый альдегид (+) –правовращающий изомер Было условно принято правовращающий (+) изомер глицеринового альдегида отнести к D-ряду, а левовращающий (-) – к L-ряду. Для названия других оптически активных соединений их сравнивали с глицериновым альдегидом и относили к D или L-ряду. При этом сторона вращения (право (+) или лево (-) не связана с буквой D- или L-). L-изомер может быть правовращающим или левовращающим. Тоже относится и к D-изомерам.
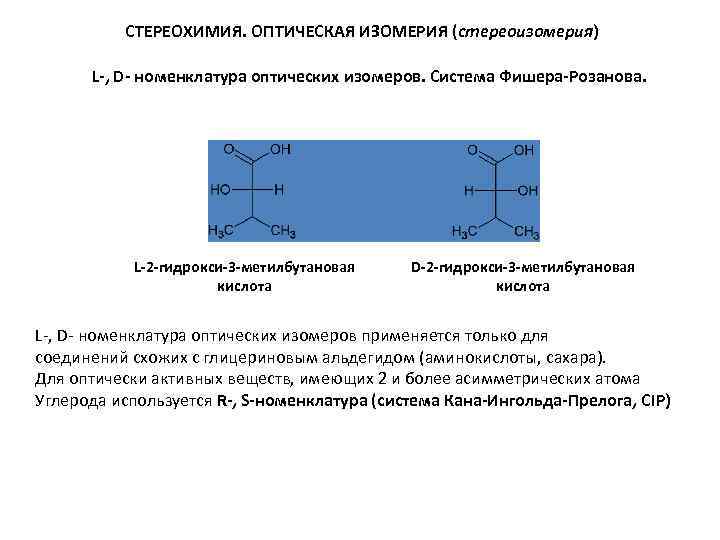
СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (стереоизомерия) L-, D- номенклатура оптических изомеров. Система Фишера-Розанова. L-2 -гидрокси-3 -метилбутановая кислота D-2 -гидрокси-3 -метилбутановая кислота L-, D- номенклатура оптических изомеров применяется только для соединений схожих с глицериновым альдегидом (аминокислоты, сахара). Для оптически активных веществ, имеющих 2 и более асимметрических атома Углерода используется R-, S-номенклатура (система Кана-Ингольда-Прелога, CIP)

СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (стереоизомерия) R-, S-НОМЕНКЛАТУРА (СИСТЕМА КАНА-ИНГОЛЬДА-ПРЕЛОГА, CIP) СИСТЕМА КАНА-ИНГОЛЬДА-ПРЕЛОГА использует символы R (от лат. rectus-правый) или S (от лат. sinister-левый) для обозначения каждого хирального центра в зависимости от его конфигурации. В основе большинства стереохим. обозначений лежит правило старшинства заместителей, которое определяется атомным номером или массой атома, связанного с асимметрическим центром. Чем больше номер, тем старше заместитель. Если эти атомы одинаковы по старшинству, то рассматривают "ВТОРОЙ СЛОЙ", в который входят атомы, связанные с атомами "ПЕРВОГО СЛОЯ", и т. д. , до появления первого различия; номера атомов, связанных двойной связью, при определении старшинства удваивают. Обозначение R получает тот из энантиомеров, в к-ром при рассмотрении модели со стороны, противоположной младшему заместителю, старшинство остальных заместителей уменьшается по часовой стрелке. Падение старшинства против часовой стрелки соответствует S-обозначению R, S-изомеры можно определять и по проекционной формуле Фишера. Если в ней младший заместитель расположен в нижней части формулы, а старшинство заместителей a–>b–>c уменьшается по часовой стрелке, то конфигурацию обозначают знаком R, а если против часовой стрелки, то знаком S.
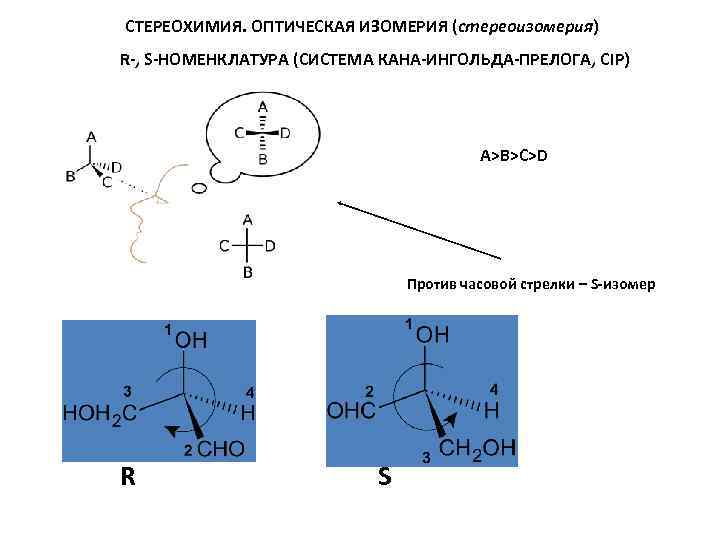
СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (стереоизомерия) R-, S-НОМЕНКЛАТУРА (СИСТЕМА КАНА-ИНГОЛЬДА-ПРЕЛОГА, CIP) A>B>C>D Против часовой стрелки – S-изомер R S
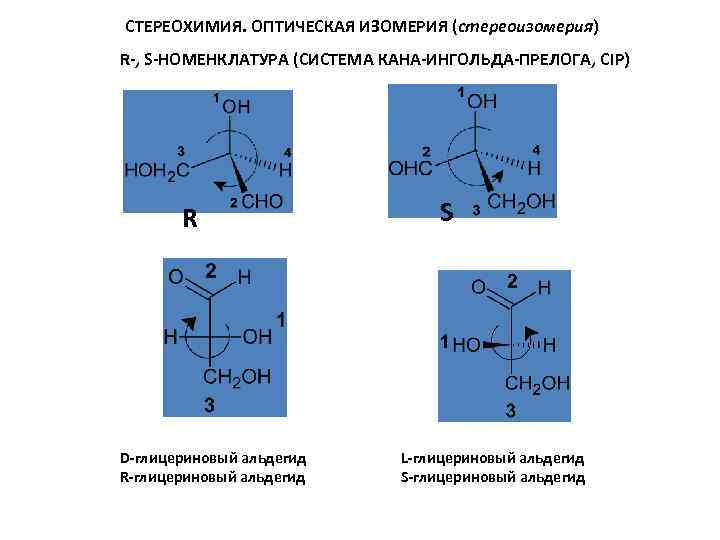
СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (стереоизомерия) R-, S-НОМЕНКЛАТУРА (СИСТЕМА КАНА-ИНГОЛЬДА-ПРЕЛОГА, CIP) R D-глицериновый альдегид R-глицериновый альдегид S L-глицериновый альдегид S-глицериновый альдегид
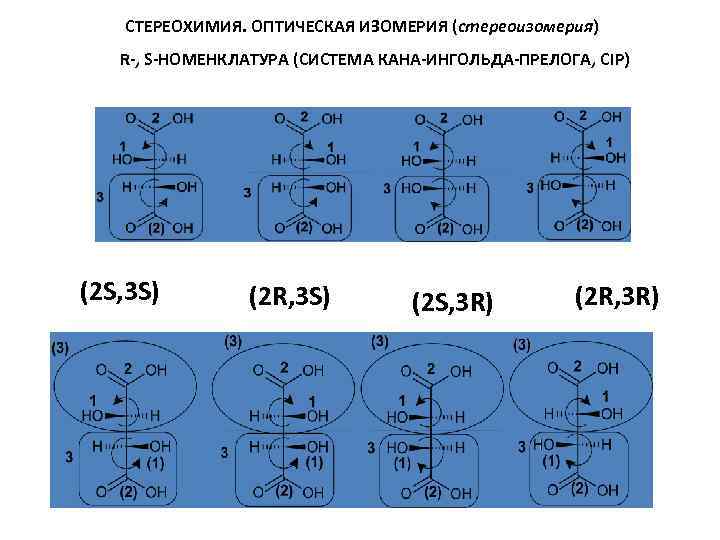
СТЕРЕОХИМИЯ. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (стереоизомерия) R-, S-НОМЕНКЛАТУРА (СИСТЕМА КАНА-ИНГОЛЬДА-ПРЕЛОГА, CIP) (2 S, 3 S) (2 R, 3 S) (2 S, 3 R) (2 R, 3 R)
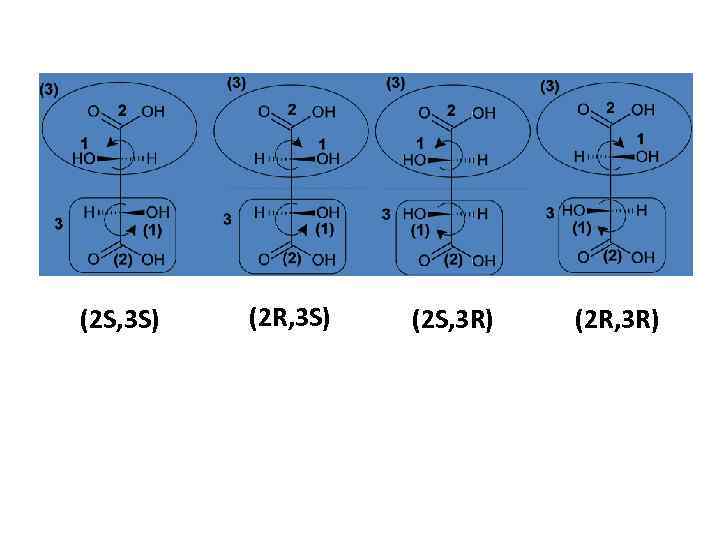
(2 S, 3 S) (2 R, 3 S) (2 S, 3 R) (2 R, 3 R)

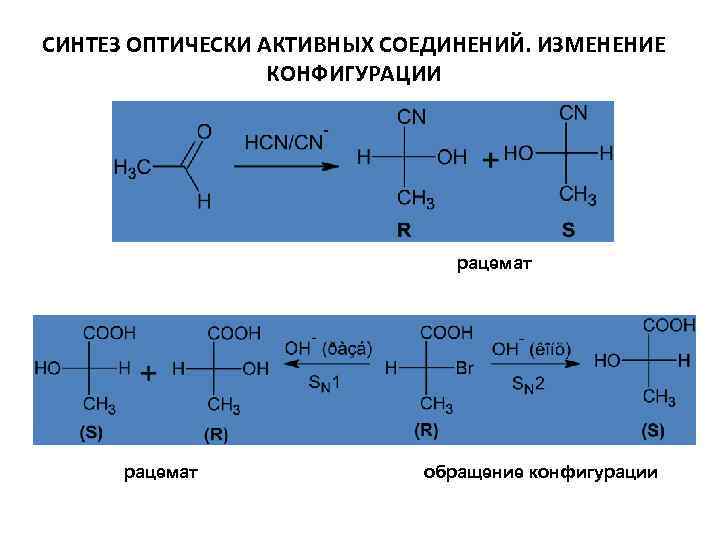
СИНТЕЗ ОПТИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ. ИЗМЕНЕНИЕ КОНФИГУРАЦИИ рацемат обращение конфигурации
ОБРАЩЕНИЕ КОНФИГУРАЦИИ (SN 2)

РАЦЕМИЗАЦИЯ (SN 1) ОБРАЩЕНИЕ КОНФИГУРАЦИИ СОХРАНЕНИЕ КОНФИГУРАЦИИ
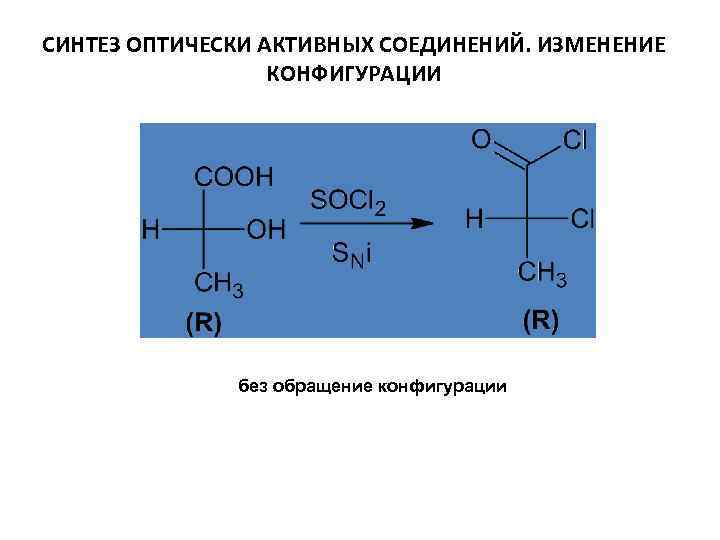
СИНТЕЗ ОПТИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ. ИЗМЕНЕНИЕ КОНФИГУРАЦИИ без обращение конфигурации
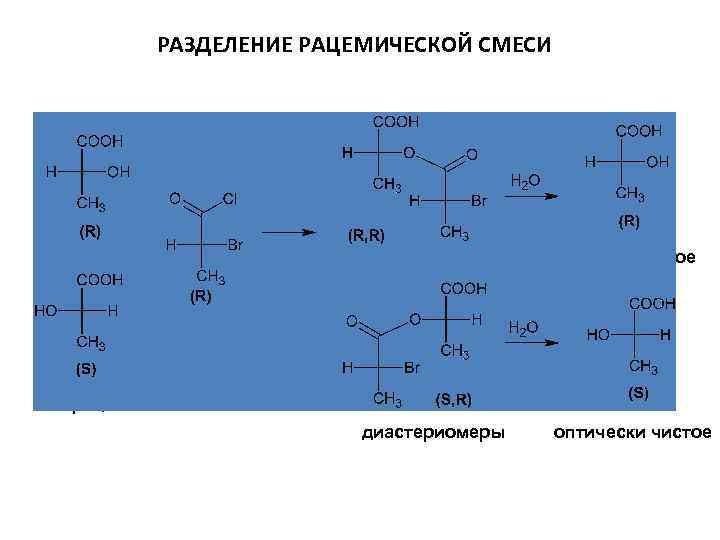
РАЗДЕЛЕНИЕ РАЦЕМИЧЕСКОЙ СМЕСИ оптически чистое рацемат диастериомеры оптически чистое
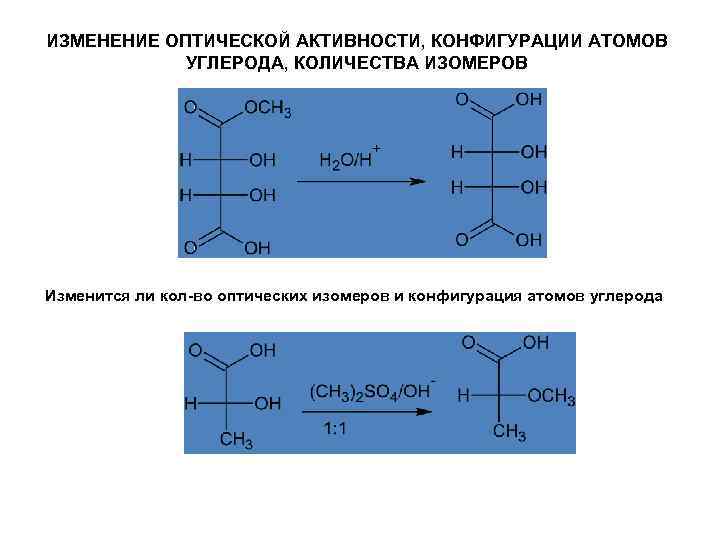
ИЗМЕНЕНИЕ ОПТИЧЕСКОЙ АКТИВНОСТИ, КОНФИГУРАЦИИ АТОМОВ УГЛЕРОДА, КОЛИЧЕСТВА ИЗОМЕРОВ Изменится ли кол-во оптических изомеров и конфигурация атомов углерода
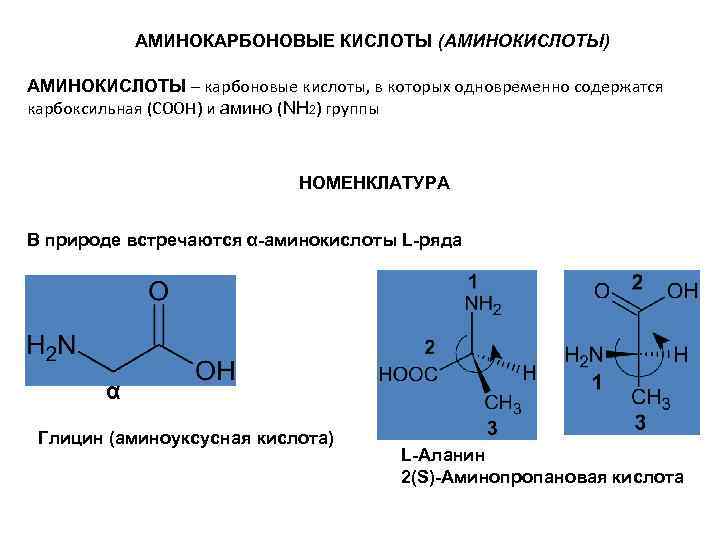
АМИНОКАРБОНОВЫЕ КИСЛОТЫ (АМИНОКИСЛОТЫ) АМИНОКИСЛОТЫ – карбоновые кислоты, в которых одновременно содержатся карбоксильная (СООН) и амино (NH 2) группы НОМЕНКЛАТУРА В природе встречаются α-аминокислоты L-ряда α Глицин (аминоуксусная кислота) L-Аланин 2(S)-Аминопропановая кислота
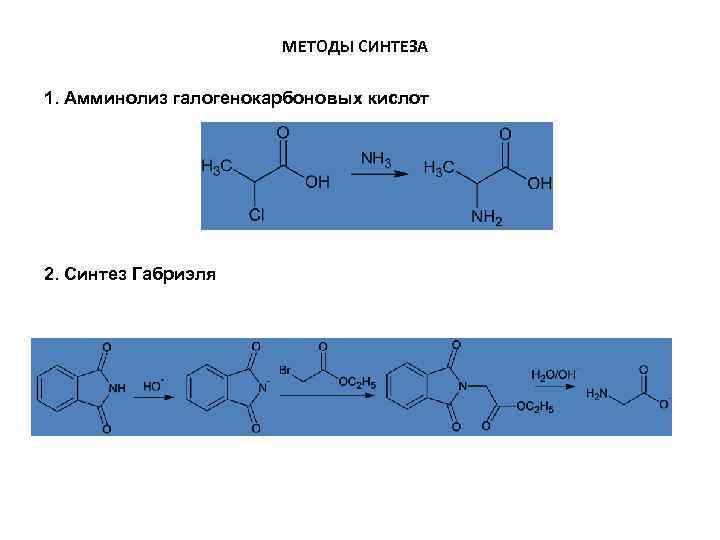
МЕТОДЫ СИНТЕЗА 1. Амминолиз галогенокарбоновых кислот 2. Синтез Габриэля
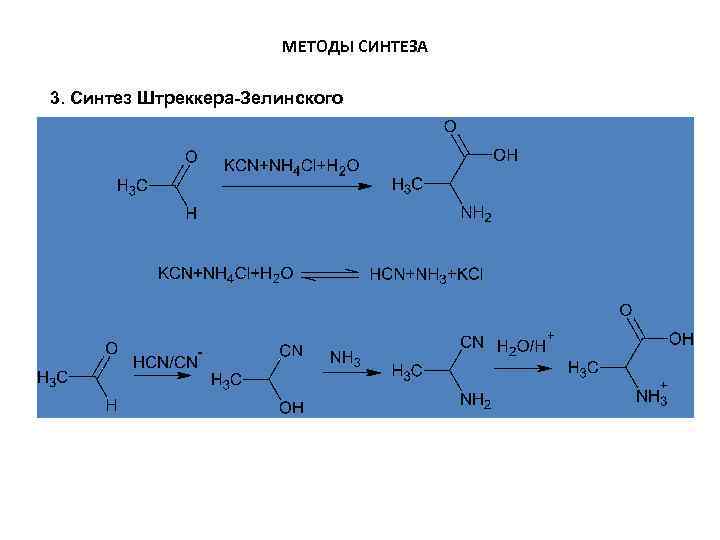
МЕТОДЫ СИНТЕЗА 3. Синтез Штреккера-Зелинского
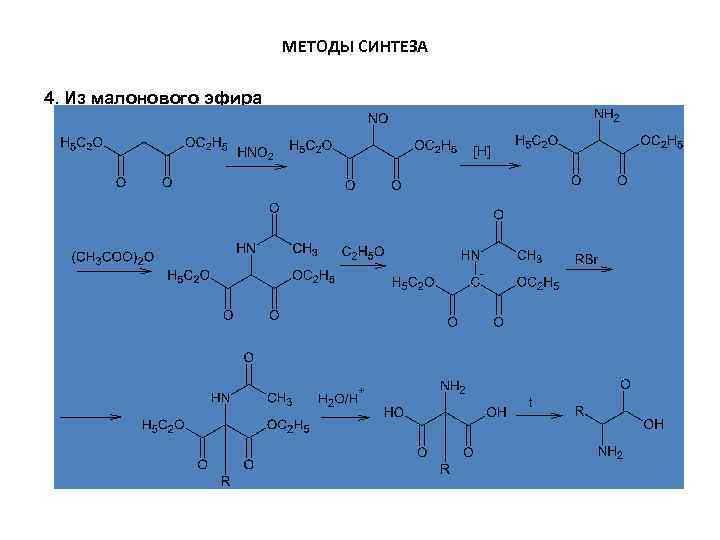
МЕТОДЫ СИНТЕЗА 4. Из малонового эфира
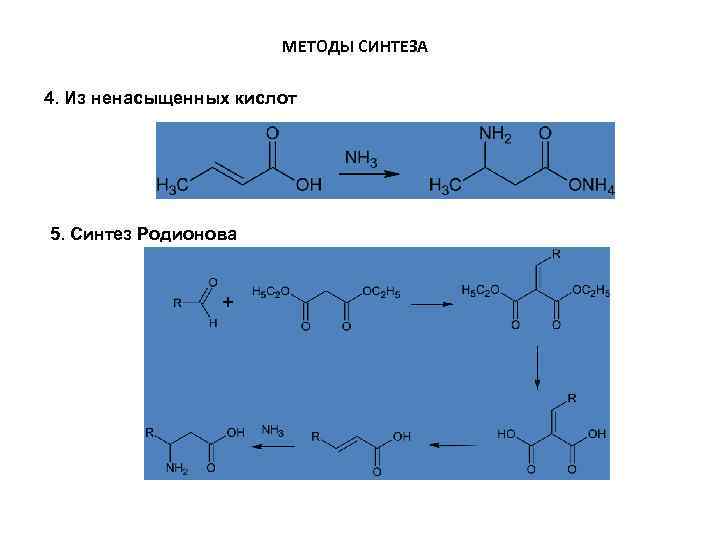
МЕТОДЫ СИНТЕЗА 4. Из ненасыщенных кислот 5. Синтез Родионова
лекция оптика.ppt