ггхГИДРОГЕОЛОГИ_1-2011.ppt
- Количество слайдов: 59
 ГИДРОГЕОХИМИЯ
ГИДРОГЕОХИМИЯ
 Подземные воды – сложные природные водные растворы Растворитель – вода Механические взвеси Коллоидные растворы Истинные растворы Неорганические химические вещества Органические вещества Микрофлора Газы Изотопы (естественные и искусственные) Химические элементы в виде простых и сложных ионов, комплексных соединений В настоящее время более 80 химических элементов таблицы Менделеева уже обнаружены в подземных водах
Подземные воды – сложные природные водные растворы Растворитель – вода Механические взвеси Коллоидные растворы Истинные растворы Неорганические химические вещества Органические вещества Микрофлора Газы Изотопы (естественные и искусственные) Химические элементы в виде простых и сложных ионов, комплексных соединений В настоящее время более 80 химических элементов таблицы Менделеева уже обнаружены в подземных водах

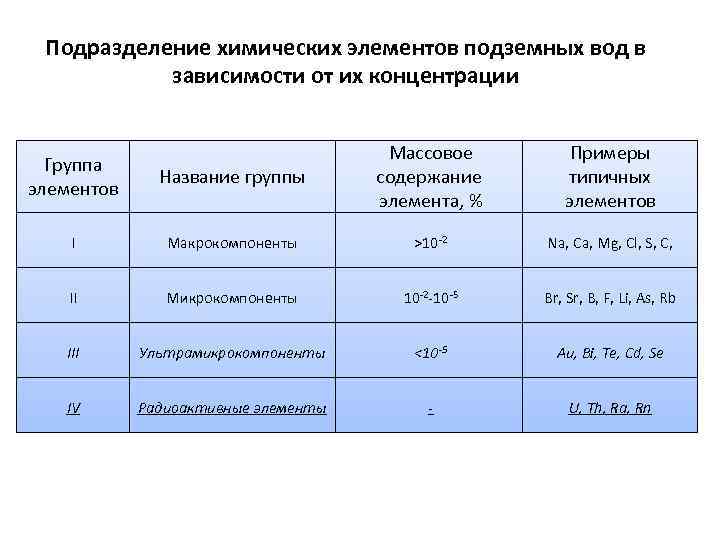 Подразделение химических элементов подземных вод в зависимости от их концентрации Название группы Массовое содержание элемента, % Примеры типичных элементов I Макрокомпоненты >10 -2 Na, Ca, Mg, Cl, S, C, II Микрокомпоненты 10 -2 -10 -5 Br, Sr, B, F, Li, As, Rb III Ультрамикрокомпоненты <10 -5 Au, Bi, Te, Cd, Se IV Радиоактивные элементы - U, Th, Ra, Rn Группа элементов
Подразделение химических элементов подземных вод в зависимости от их концентрации Название группы Массовое содержание элемента, % Примеры типичных элементов I Макрокомпоненты >10 -2 Na, Ca, Mg, Cl, S, C, II Микрокомпоненты 10 -2 -10 -5 Br, Sr, B, F, Li, As, Rb III Ультрамикрокомпоненты <10 -5 Au, Bi, Te, Cd, Se IV Радиоактивные элементы - U, Th, Ra, Rn Группа элементов
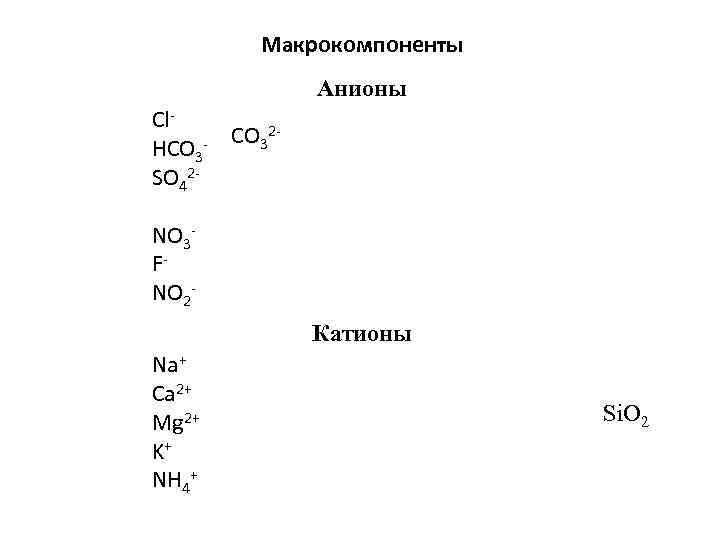 Макрокомпоненты Анионы Cl. CO 32 HCO 3 SO 42 NO 3 FNO 2 Катионы Na+ Ca 2+ Mg 2+ K+ NH 4+ Si. O 2
Макрокомпоненты Анионы Cl. CO 32 HCO 3 SO 42 NO 3 FNO 2 Катионы Na+ Ca 2+ Mg 2+ K+ NH 4+ Si. O 2
 Анионы Cl. Горные породы соли Галит Сельвин Карналит Газово жидкие включения Атмосферные осадки HCO 3 -, CO 32 - , CO 2 Горные породы карбонаты Ca. CO 3 + H 2 O+CO 2 = Ca 2++2 HCO 3 Органическое вещество почв СН 2 О + О 2= CO 2 + Н 2 О = H 2 CO 3 = HCO 3 + Н+ H 2 CO 3 = CO 3 + 2 Н+ Алюмосиликаты 2 Ca[Al 2 Si 2 O 8] + 6 Н 2 О = [Al 4 Si 4 O 10](OH)8+ 2 Са 2+ + 4 ОН ОН + CО 2 = HCO 3 SO 42 - Горные породы сульфаты, сульфиды
Анионы Cl. Горные породы соли Галит Сельвин Карналит Газово жидкие включения Атмосферные осадки HCO 3 -, CO 32 - , CO 2 Горные породы карбонаты Ca. CO 3 + H 2 O+CO 2 = Ca 2++2 HCO 3 Органическое вещество почв СН 2 О + О 2= CO 2 + Н 2 О = H 2 CO 3 = HCO 3 + Н+ H 2 CO 3 = CO 3 + 2 Н+ Алюмосиликаты 2 Ca[Al 2 Si 2 O 8] + 6 Н 2 О = [Al 4 Si 4 O 10](OH)8+ 2 Са 2+ + 4 ОН ОН + CО 2 = HCO 3 SO 42 - Горные породы сульфаты, сульфиды
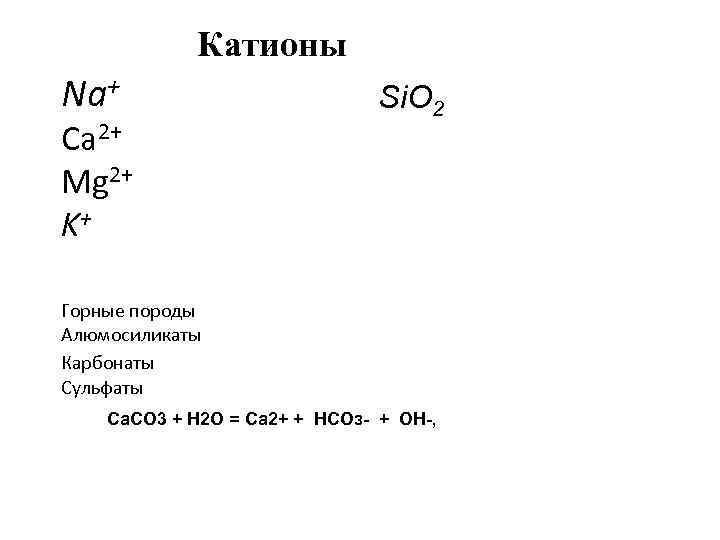 Катионы Na+ Ca 2+ Mg 2+ K+ Si. O 2 Горные породы Алюмосиликаты Карбонаты Сульфаты Са. СО 3 + Н 2 О = Са 2+ + НСОз- + ОН-,
Катионы Na+ Ca 2+ Mg 2+ K+ Si. O 2 Горные породы Алюмосиликаты Карбонаты Сульфаты Са. СО 3 + Н 2 О = Са 2+ + НСОз- + ОН-,
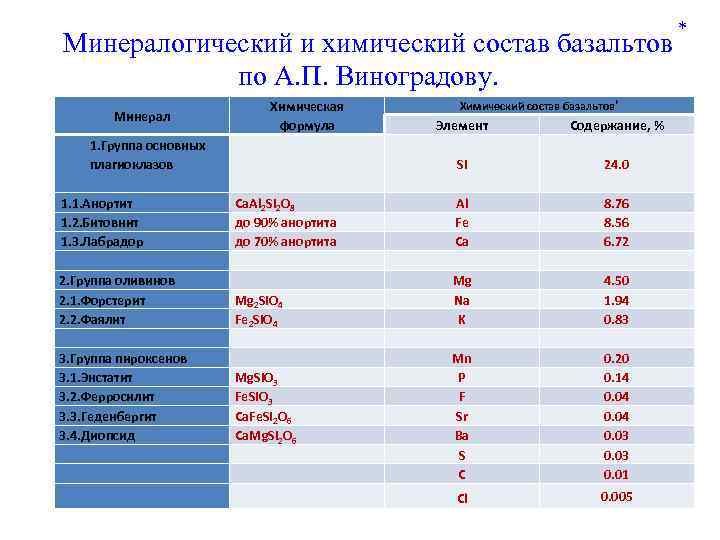 Минералогический и химический состав базальтов по А. П. Виноградову. Химическая формула Минерал 1. Группа основных плагиоклазов 1. 1. Анортит 1. 2. Битовнит 1. 3. Лабрадор 2. Группа оливинов 2. 1. Форстерит 2. 2. Фаялит 3. Группа пироксенов 3. 1. Энстатит 3. 2. Ферросилит 3. 3. Геденбергит 3. 4. Диопсид Химический состав базальтов* Элемент Содержание, % Si 24. 0 Al Fe Ca Mg Na K Mn P F Sr Ba S C 8. 76 8. 56 6. 72 4. 50 1. 94 0. 83 0. 20 0. 14 0. 04 0. 03 0. 01 Cl 0. 005 Ca. Al 2 Si 2 O 8 до 90% анортита до 70% анортита Mg 2 Si. O 4 Fe 2 Si. O 4 Mg. Si. O 3 Fe. Si. O 3 Ca. Fe. Si 2 O 6 Ca. Mg. Si 2 O 6 *
Минералогический и химический состав базальтов по А. П. Виноградову. Химическая формула Минерал 1. Группа основных плагиоклазов 1. 1. Анортит 1. 2. Битовнит 1. 3. Лабрадор 2. Группа оливинов 2. 1. Форстерит 2. 2. Фаялит 3. Группа пироксенов 3. 1. Энстатит 3. 2. Ферросилит 3. 3. Геденбергит 3. 4. Диопсид Химический состав базальтов* Элемент Содержание, % Si 24. 0 Al Fe Ca Mg Na K Mn P F Sr Ba S C 8. 76 8. 56 6. 72 4. 50 1. 94 0. 83 0. 20 0. 14 0. 04 0. 03 0. 01 Cl 0. 005 Ca. Al 2 Si 2 O 8 до 90% анортита до 70% анортита Mg 2 Si. O 4 Fe 2 Si. O 4 Mg. Si. O 3 Fe. Si. O 3 Ca. Fe. Si 2 O 6 Ca. Mg. Si 2 O 6 *
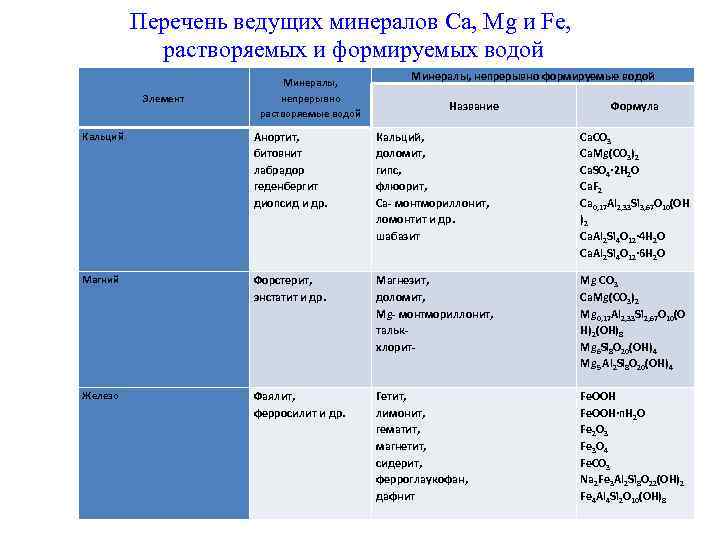 Перечень ведущих минералов Ca, Mg и Fe, растворяемых и формируемых водой Элемент Минералы, непрерывно растворяемые водой Минералы, непрерывно формируемые водой Название Формула Кальций Анортит, битовнит лабрадор геденбергит диопсид и др. Кальций, доломит, гипс, флюорит, Ca- монтмориллонит, ломонтит и др. шабазит Ca. CO 3 Ca. Mg(CO 3)2 Ca. SO 4∙ 2 H 2 O Ca. F 2 Ca 0, 17 Al 2, 33 Si 3, 67 O 10(OH )2 Ca. Al 2 Si 4 O 12∙ 4 H 2 O Ca. Al 2 Si 4 O 12∙ 6 H 2 O Магний Форстерит, энстатит и др. Магнезит, доломит, Mg- монтмориллонит, талькхлорит- Mg CO 3 Ca. Mg(CO 3)2 Mg 0, 17 Al 2, 33 Si 2, 67 O 10(O H)2(OH)8 Mg 6 Si 8 O 20(OH)4 Mg 5 Al 2 Si 8 O 20(OH)4 Железо Фаялит, ферросилит и др. Гетит, лимонит, гематит, магнетит, сидерит, ферроглаукофан, дафнит Fe. OOH∙n. H 2 O Fe 2 O 3 Fe 3 O 4 Fe. CO 3 Na 2 Fe 3 Al 2 Si 8 O 22(OH)2 Fe 4 Al 4 Si 2 O 10(OH)8
Перечень ведущих минералов Ca, Mg и Fe, растворяемых и формируемых водой Элемент Минералы, непрерывно растворяемые водой Минералы, непрерывно формируемые водой Название Формула Кальций Анортит, битовнит лабрадор геденбергит диопсид и др. Кальций, доломит, гипс, флюорит, Ca- монтмориллонит, ломонтит и др. шабазит Ca. CO 3 Ca. Mg(CO 3)2 Ca. SO 4∙ 2 H 2 O Ca. F 2 Ca 0, 17 Al 2, 33 Si 3, 67 O 10(OH )2 Ca. Al 2 Si 4 O 12∙ 4 H 2 O Ca. Al 2 Si 4 O 12∙ 6 H 2 O Магний Форстерит, энстатит и др. Магнезит, доломит, Mg- монтмориллонит, талькхлорит- Mg CO 3 Ca. Mg(CO 3)2 Mg 0, 17 Al 2, 33 Si 2, 67 O 10(O H)2(OH)8 Mg 6 Si 8 O 20(OH)4 Mg 5 Al 2 Si 8 O 20(OH)4 Железо Фаялит, ферросилит и др. Гетит, лимонит, гематит, магнетит, сидерит, ферроглаукофан, дафнит Fe. OOH∙n. H 2 O Fe 2 O 3 Fe 3 O 4 Fe. CO 3 Na 2 Fe 3 Al 2 Si 8 O 22(OH)2 Fe 4 Al 4 Si 2 O 10(OH)8
 Ca. Al 2 Si 2 O 8+ 8 H 2 O + 2 CO 2 = 2 Al(OH)3 + Ca 2+ +2 HCO 3 -+ 2 H 4 Si. O 4 2 Ca. Al 2 Si 2 O 8 + 6 Н 2 О + 4 CO 2 = [Al 4 Si 4 O 10](OH)8+ 2 Са 2+ + 4 HCO 3 - 1, 83 Ca. Al 2 Si 2 O 8+ 3, 67 H 2 O + 3, 32 CO 2 = Ca 0, 17 Al 2, 33 Si 3, 67 O 10(OH)2 + 1, 66 Ca 2+ +3, 32 HCO 3 -+ 1, 34 Al(OH)3 1, 83 Ca. Al 2 Si 2 O 8+ 3 H 2 O + 1, 66 CO 2 = Ca 0, 17 Al 2, 33 Si 3, 67 O 10(OH)2 + 1, 66 Ca. CO 3 +1, 34 Al(OH)3
Ca. Al 2 Si 2 O 8+ 8 H 2 O + 2 CO 2 = 2 Al(OH)3 + Ca 2+ +2 HCO 3 -+ 2 H 4 Si. O 4 2 Ca. Al 2 Si 2 O 8 + 6 Н 2 О + 4 CO 2 = [Al 4 Si 4 O 10](OH)8+ 2 Са 2+ + 4 HCO 3 - 1, 83 Ca. Al 2 Si 2 O 8+ 3, 67 H 2 O + 3, 32 CO 2 = Ca 0, 17 Al 2, 33 Si 3, 67 O 10(OH)2 + 1, 66 Ca 2+ +3, 32 HCO 3 -+ 1, 34 Al(OH)3 1, 83 Ca. Al 2 Si 2 O 8+ 3 H 2 O + 1, 66 CO 2 = Ca 0, 17 Al 2, 33 Si 3, 67 O 10(OH)2 + 1, 66 Ca. CO 3 +1, 34 Al(OH)3
 Макрокомпоненты составляют основу солености воды, которая называется общей минерализацией — суммой ведущих солей (сумма ионов), растворенных в воде. Общая минерализация Подсчитывается по результатам химического анализа отдельных компонентов Определяется экспериментально путем выпаривания одного литра воды. В последнем случае получаемый осадок носит название сухого остатка. При выпаривании воды часть гидрокарбонат - ионов разрушается и улетучивается по реакции 2 НСОз- = СО 32 - + Н 2 О + СО 2 для сравнения экспериментального сухого остатка и вычисленного сухого остатка в последний включают не всю, а только 0, 5 части НСОз, Величину общей минерализации, сухой остаток выражаются в единицах массы на объем или массу воды (г/л, мкг/л, г/кг и т. д. )
Макрокомпоненты составляют основу солености воды, которая называется общей минерализацией — суммой ведущих солей (сумма ионов), растворенных в воде. Общая минерализация Подсчитывается по результатам химического анализа отдельных компонентов Определяется экспериментально путем выпаривания одного литра воды. В последнем случае получаемый осадок носит название сухого остатка. При выпаривании воды часть гидрокарбонат - ионов разрушается и улетучивается по реакции 2 НСОз- = СО 32 - + Н 2 О + СО 2 для сравнения экспериментального сухого остатка и вычисленного сухого остатка в последний включают не всю, а только 0, 5 части НСОз, Величину общей минерализации, сухой остаток выражаются в единицах массы на объем или массу воды (г/л, мкг/л, г/кг и т. д. )
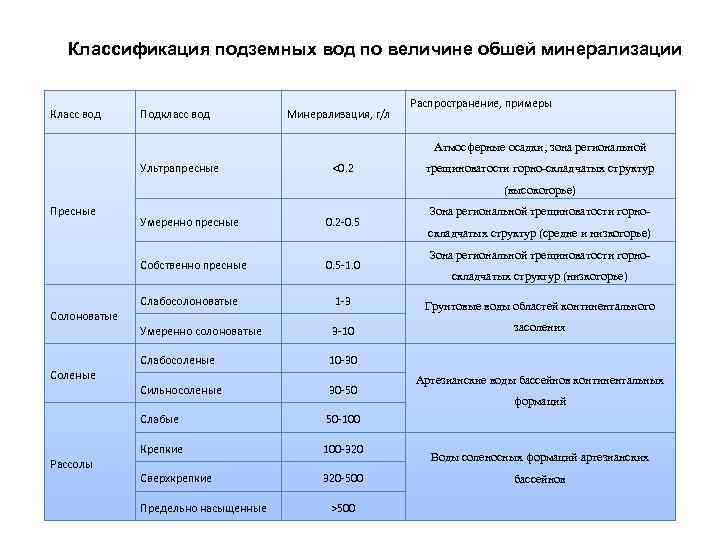 Классификация подземных вод по величине обшей минерализации Класс вод Подкласс вод Минерализация, г/л Распространение, примеры Атмосферные осадки, зона региональной Ультрапресные <0. 2 трещиноватости горно-складчатых структур (высокогорье) Пресные Умеренно пресные 0. 2 -0. 5 Собственно пресные 0. 5 -1. 0 Зона региональной трещиноватости горноскладчатых структур (средне и низкогорье) Зона региональной трещиноватости горноскладчатых структур (низкогорье) Слабосолоноватые 1 -3 Грунтовые воды областей континентального Умеренно солоноватые 3 -10 засоления Слабосоленые 10 -30 Сильносоленые 30 -50 Слабые 50 -100 Крепкие 100 -320 Сверхкрепкие 320 -500 Солоноватые Соленые Рассолы Предельно насыщенные >500 Артезианские воды бассейнов континентальных формаций Воды соленосных формаций артезианских бассейнов
Классификация подземных вод по величине обшей минерализации Класс вод Подкласс вод Минерализация, г/л Распространение, примеры Атмосферные осадки, зона региональной Ультрапресные <0. 2 трещиноватости горно-складчатых структур (высокогорье) Пресные Умеренно пресные 0. 2 -0. 5 Собственно пресные 0. 5 -1. 0 Зона региональной трещиноватости горноскладчатых структур (средне и низкогорье) Зона региональной трещиноватости горноскладчатых структур (низкогорье) Слабосолоноватые 1 -3 Грунтовые воды областей континентального Умеренно солоноватые 3 -10 засоления Слабосоленые 10 -30 Сильносоленые 30 -50 Слабые 50 -100 Крепкие 100 -320 Сверхкрепкие 320 -500 Солоноватые Соленые Рассолы Предельно насыщенные >500 Артезианские воды бассейнов континентальных формаций Воды соленосных формаций артезианских бассейнов
 Средний состав подземных вод зоны гипергенеза и рек мира (Шварцев, 1996) Химические компоненты p. H HCO 3 SO 42 Cl. NO 3 FNO 2 Na+ Ca 2+ Mg 2+ K+ NH 4+ Si. O 2 Сумма CO 29 св) Сорг(нел) Грунтовые воды выщелачивания 6. 7 132 11. 9 8. 3 1. 7 0. 3 0. 06 13. 9 26. 1 8. 4 1. 9 0. 4 15. 3 220 25. 9 6. 2 Грунтовые воды континетального засоления 7. 5 344 328 202 10. 4 1. 0 0. 5 172 115 59 15. 2 1. 1 26. 0 1273 26. 3 4. 3 Воды зоны гипергенеза Реки мира 6. 9 174 75. 1 47. 0 3. 4 0. 45 0. 14 45 44 18. 6 4. 6 0. 56 17. 4 431 26. 0 5. 9 58. 4 11. 2 7. 8 1. 0 0. 1 6. 3 15. 0 4. 1 2. 3 13. 1 120 6. 9
Средний состав подземных вод зоны гипергенеза и рек мира (Шварцев, 1996) Химические компоненты p. H HCO 3 SO 42 Cl. NO 3 FNO 2 Na+ Ca 2+ Mg 2+ K+ NH 4+ Si. O 2 Сумма CO 29 св) Сорг(нел) Грунтовые воды выщелачивания 6. 7 132 11. 9 8. 3 1. 7 0. 3 0. 06 13. 9 26. 1 8. 4 1. 9 0. 4 15. 3 220 25. 9 6. 2 Грунтовые воды континетального засоления 7. 5 344 328 202 10. 4 1. 0 0. 5 172 115 59 15. 2 1. 1 26. 0 1273 26. 3 4. 3 Воды зоны гипергенеза Реки мира 6. 9 174 75. 1 47. 0 3. 4 0. 45 0. 14 45 44 18. 6 4. 6 0. 56 17. 4 431 26. 0 5. 9 58. 4 11. 2 7. 8 1. 0 0. 1 6. 3 15. 0 4. 1 2. 3 13. 1 120 6. 9
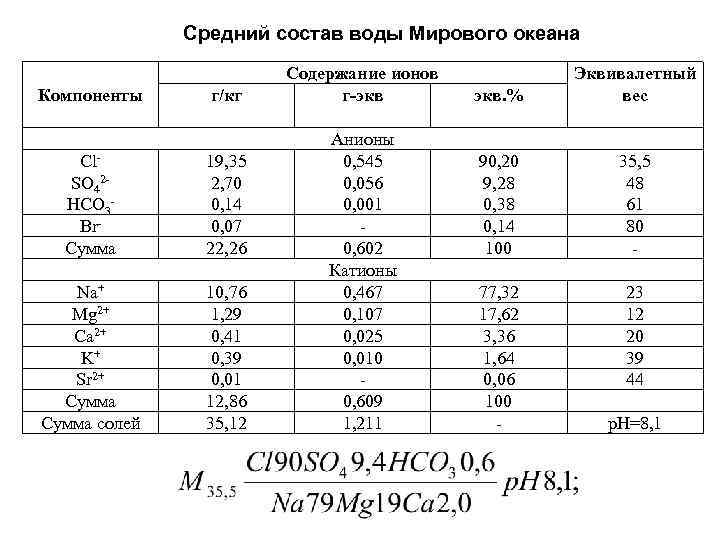 Средний состав воды Мирового океана Компоненты г/кг Cl. SO 42 HCO 3 Br. Сумма 19, 35 2, 70 0, 14 0, 07 22, 26 Na+ Mg 2+ Ca 2+ K+ Sr 2+ Сумма солей 10, 76 1, 29 0, 41 0, 39 0, 01 12, 86 35, 12 Содержание ионов г-экв Анионы 0, 545 0, 056 0, 001 0, 602 Катионы 0, 467 0, 107 0, 025 0, 010 0, 609 1, 211 экв. % Эквивалетный вес 90, 20 9, 28 0, 38 0, 14 100 35, 5 48 61 80 - 77, 32 17, 62 3, 36 1, 64 0, 06 100 - 23 12 20 39 44 р. Н=8, 1
Средний состав воды Мирового океана Компоненты г/кг Cl. SO 42 HCO 3 Br. Сумма 19, 35 2, 70 0, 14 0, 07 22, 26 Na+ Mg 2+ Ca 2+ K+ Sr 2+ Сумма солей 10, 76 1, 29 0, 41 0, 39 0, 01 12, 86 35, 12 Содержание ионов г-экв Анионы 0, 545 0, 056 0, 001 0, 602 Катионы 0, 467 0, 107 0, 025 0, 010 0, 609 1, 211 экв. % Эквивалетный вес 90, 20 9, 28 0, 38 0, 14 100 35, 5 48 61 80 - 77, 32 17, 62 3, 36 1, 64 0, 06 100 - 23 12 20 39 44 р. Н=8, 1
 Среднее содержание химических элементов в седиментационных водах Западно-Сибирского артезианского бассейна (по данным A. 3. Конторовича, В. М. Матусевича, С. Л. Шварцева) Химические компоненты p. H Cl SO HCO Na Ca Mg K Si. O 2 Сумма Sr Br Fe NH B I Li Mn Содержан Подземные воды ие г/л “ “ “ “ мг/л “ “ “ “ 6, 9 9, 4 0, 015 0, 65 6, 2 1, 2 0, 17 0, 12 0, 03 17, 8 183 51 17 16 13 12 2, 7 1, 1 Воды Мирового океана Степень относительного концентрирования (по хлору) 8, 1 19, 3 2, 7 0, 16 10, 7 0, 40 1, 35 0, 38 0, 006 35, 5 8, 0 65, 0 0, 01 0, 5 4, 6 0, 06 0, 2 0, 002 1, 0 0, 001 8, 35 1, 19 6, 20 0, 26 0, 68 10, 3 1, 03 47, 3 1, 63 3560 63, 5 6, 0 423 27, 8 1132
Среднее содержание химических элементов в седиментационных водах Западно-Сибирского артезианского бассейна (по данным A. 3. Конторовича, В. М. Матусевича, С. Л. Шварцева) Химические компоненты p. H Cl SO HCO Na Ca Mg K Si. O 2 Сумма Sr Br Fe NH B I Li Mn Содержан Подземные воды ие г/л “ “ “ “ мг/л “ “ “ “ 6, 9 9, 4 0, 015 0, 65 6, 2 1, 2 0, 17 0, 12 0, 03 17, 8 183 51 17 16 13 12 2, 7 1, 1 Воды Мирового океана Степень относительного концентрирования (по хлору) 8, 1 19, 3 2, 7 0, 16 10, 7 0, 40 1, 35 0, 38 0, 006 35, 5 8, 0 65, 0 0, 01 0, 5 4, 6 0, 06 0, 2 0, 002 1, 0 0, 001 8, 35 1, 19 6, 20 0, 26 0, 68 10, 3 1, 03 47, 3 1, 63 3560 63, 5 6, 0 423 27, 8 1132
 Средний состав рассолов различной степени концентрирования Ангаро-Ленского бассейна, г/л (соленосные породы) Типы рассолов р. Н Слабые K+ Na+ Mg 2+ Ca 2+ Cl- Br- I- SO 42 - HCO 3 - Sr 2+ M 7, 2 0, 14 31, 5 0, 43 2, 85 50, 4 0, 10 0, 001 4, 13 0, 26 0, 03 89, 7 3, 68 85, 4 3, 15 21, 3 173 1, 72 0, 003 1, 82 0, 21 0, 89 289 Весьма крепкие 6, 4 11, 2 35, 1 13, 2 77, 3 238 4, 90 0, 007 0, 36 3, 36 378 Предельно насыщенные Среднее 5, 3 19, 3 8, 53 15, 0 153 341 6, 97 0, 004 0, 08 1, 08 6, 04 546 6, 0 8, 58 40, 2 7, 95 63, 3 201 4, 42 0, 004 1, 60 0, 48 2, 58 330 Крепкие
Средний состав рассолов различной степени концентрирования Ангаро-Ленского бассейна, г/л (соленосные породы) Типы рассолов р. Н Слабые K+ Na+ Mg 2+ Ca 2+ Cl- Br- I- SO 42 - HCO 3 - Sr 2+ M 7, 2 0, 14 31, 5 0, 43 2, 85 50, 4 0, 10 0, 001 4, 13 0, 26 0, 03 89, 7 3, 68 85, 4 3, 15 21, 3 173 1, 72 0, 003 1, 82 0, 21 0, 89 289 Весьма крепкие 6, 4 11, 2 35, 1 13, 2 77, 3 238 4, 90 0, 007 0, 36 3, 36 378 Предельно насыщенные Среднее 5, 3 19, 3 8, 53 15, 0 153 341 6, 97 0, 004 0, 08 1, 08 6, 04 546 6, 0 8, 58 40, 2 7, 95 63, 3 201 4, 42 0, 004 1, 60 0, 48 2, 58 330 Крепкие
 Средний состав глубинных вод Тихоокеанского сегмента Земли Ведущие компоненты р. Н Сl. SO 42 HCO 3 Na+ Ca 2+ К+ Mg 2+ Si 02 Сумма Fe В Al Вг F Li As V Mn Zn Содержание, мг/л 6, 4 4462 1241 374 1813 518 245 159 129 8985 28, 9 22, 1 19, 3 6, 8 5, 1 2, 8 2, 3 1, 8 1, 7 1, 5 ММикрокомпонен ты Sr Ti Rb Cs Ba Cr Sb Pb Sc Сu Y Co Mo Zr Ge Sn Ga Hg Ag Ni Be Содержание, мкг/л 826 777 400 378 347 345 200 98 89 86 80 56 26 24 22 21 19 16 11 9, 6 6, 3
Средний состав глубинных вод Тихоокеанского сегмента Земли Ведущие компоненты р. Н Сl. SO 42 HCO 3 Na+ Ca 2+ К+ Mg 2+ Si 02 Сумма Fe В Al Вг F Li As V Mn Zn Содержание, мг/л 6, 4 4462 1241 374 1813 518 245 159 129 8985 28, 9 22, 1 19, 3 6, 8 5, 1 2, 8 2, 3 1, 8 1, 7 1, 5 ММикрокомпонен ты Sr Ti Rb Cs Ba Cr Sb Pb Sc Сu Y Co Mo Zr Ge Sn Ga Hg Ag Ni Be Содержание, мкг/л 826 777 400 378 347 345 200 98 89 86 80 56 26 24 22 21 19 16 11 9, 6 6, 3
 Резкое изменение состава подземных вод происходит и по мере роста общей минерализации. Пресные воды с минерализацией до 1 г/л обычно являются гидрокарбонатными, так как последний резко доминирует над сульфат и хлор ионами. При минерализации от 1 до 3 г/л воды чаще всего являются сульфатными, а при еще более высокой минерализации — хлоридными. В целом же, практически все пресные воды на земле являются гидрокарбонатными, а солоноватые, соленые и рассолы — хлоридными. Сульфатные воды имеют ограниченное распространение, главным образом в районах незначительного континентального засоления, активного вулканизма и рудных месторождений.
Резкое изменение состава подземных вод происходит и по мере роста общей минерализации. Пресные воды с минерализацией до 1 г/л обычно являются гидрокарбонатными, так как последний резко доминирует над сульфат и хлор ионами. При минерализации от 1 до 3 г/л воды чаще всего являются сульфатными, а при еще более высокой минерализации — хлоридными. В целом же, практически все пресные воды на земле являются гидрокарбонатными, а солоноватые, соленые и рассолы — хлоридными. Сульфатные воды имеют ограниченное распространение, главным образом в районах незначительного континентального засоления, активного вулканизма и рудных месторождений.
 По катионному составу также наблюдаются строгие закономерности. Ультрапресные и пресные воды с общей минерализацией до 0, 4 г/л обычно являются кальциевыми, так как содержание натрия и магния в них значительно ниже. Но натрий более высокими темпами, чем кальций, концентрируется в водах и уже при общей минерализации более 0, 4 г/л, как правило, доминирует над кальцием, и воды поэтому становятся натриевыми. Тенденция преимущественного концентрирования натрия сохраняется вплоть до крепких рассолов, и только при общей минерализации более 300 г/л натрий больше в водах не растет и весьма крепкие рассолы становятся кальциевыми. Содержания магния в подземных водах, за редким исключением, ниже, чем натрия и кальция, и магниевые воды поэтому являются экзотическими. Исключение составляют воды морей, океанов и соленых озер, где содержания магния значительно выше, чем кальция.
По катионному составу также наблюдаются строгие закономерности. Ультрапресные и пресные воды с общей минерализацией до 0, 4 г/л обычно являются кальциевыми, так как содержание натрия и магния в них значительно ниже. Но натрий более высокими темпами, чем кальций, концентрируется в водах и уже при общей минерализации более 0, 4 г/л, как правило, доминирует над кальцием, и воды поэтому становятся натриевыми. Тенденция преимущественного концентрирования натрия сохраняется вплоть до крепких рассолов, и только при общей минерализации более 300 г/л натрий больше в водах не растет и весьма крепкие рассолы становятся кальциевыми. Содержания магния в подземных водах, за редким исключением, ниже, чем натрия и кальция, и магниевые воды поэтому являются экзотическими. Исключение составляют воды морей, океанов и соленых озер, где содержания магния значительно выше, чем кальция.
 Отмеченные особенности изменения состава подземных вод с ростом общей минерализации обусловлены скрытой глубокой эволюцией их состава по мере взаимодействия с горными породами. Главная особенность такого эволюционного развития состоит в том, что вода, разрушая горную породу, концентрирует только те соединения, степень растворимости которых позволяет такое накопление. Так, высокоминерализованные воды не могут быть гидрокарбонатными кальциевыми по той простой причине, что растворимость карбонатных соединений кальция низка. В гидросфере концентрируются наиболее охотно те элементы, которые не склонны к образованию устойчивой кристаллической решетки в термодинамических условиях верхней части земной коры.
Отмеченные особенности изменения состава подземных вод с ростом общей минерализации обусловлены скрытой глубокой эволюцией их состава по мере взаимодействия с горными породами. Главная особенность такого эволюционного развития состоит в том, что вода, разрушая горную породу, концентрирует только те соединения, степень растворимости которых позволяет такое накопление. Так, высокоминерализованные воды не могут быть гидрокарбонатными кальциевыми по той простой причине, что растворимость карбонатных соединений кальция низка. В гидросфере концентрируются наиболее охотно те элементы, которые не склонны к образованию устойчивой кристаллической решетки в термодинамических условиях верхней части земной коры.
 Другой важный параметр воды — жесткость, которая обусловлена суммой ионов кальция и магния, выраженных в миллиграмм эквивалентах (мг экв) на 1 л воды. Жесткость подземных вод имеет большое значение при их оценке для практического использования. Жесткая вода плохо взмыливается, дает накипь в паровых котлах, вспенивается, в жесткой воде хуже развариваются пищевые продукты. Различают общую, устранимую, или временную, и постоянную жесткость. Общая жесткость обусловлена общим содержанием в воде ионов кальция и магния, устранимая, или временная, — той частью названных ионов, которые выпадают из раствора в осадок при кипячении воды вследствие ее дегазации по реакции Са 2+ + 2 НСОз = Са. СО 3↓+Н 2 О + СО 2 ↑ Постоянная жесткость обусловлена той частью ионов кальция и магния, которая остается в растворе после кипячения (равна общей минус устранимая). Жесткость подземных вод колеблется в широких пределах — от десятых долей до сотен мг экв/л.
Другой важный параметр воды — жесткость, которая обусловлена суммой ионов кальция и магния, выраженных в миллиграмм эквивалентах (мг экв) на 1 л воды. Жесткость подземных вод имеет большое значение при их оценке для практического использования. Жесткая вода плохо взмыливается, дает накипь в паровых котлах, вспенивается, в жесткой воде хуже развариваются пищевые продукты. Различают общую, устранимую, или временную, и постоянную жесткость. Общая жесткость обусловлена общим содержанием в воде ионов кальция и магния, устранимая, или временная, — той частью названных ионов, которые выпадают из раствора в осадок при кипячении воды вследствие ее дегазации по реакции Са 2+ + 2 НСОз = Са. СО 3↓+Н 2 О + СО 2 ↑ Постоянная жесткость обусловлена той частью ионов кальция и магния, которая остается в растворе после кипячения (равна общей минус устранимая). Жесткость подземных вод колеблется в широких пределах — от десятых долей до сотен мг экв/л.
 Принято подразделять пресные подземные воды по степени общей жесткости на: Тип воды Очень мягкие Общая жесткость, мг-экв/л <1. 5 Характеристика вод Ультрапресные или содовые Мягкие 1. 5 -3. 0 Умеренно пресные Умеренно жесткие 3. 0 -6. 0 Собственно пресные Жесткие 6. 0 -9. 0 Собственно пресные Очень жесткие >9. 0 Солоноватые Для питья наиболее пригодны воды с общей жесткостью 3 7 мг экв/л, а для бумажной, сахарной, кожевенной, пивоваренной и других отраслей промышленности — менее 3 мг экв/л.
Принято подразделять пресные подземные воды по степени общей жесткости на: Тип воды Очень мягкие Общая жесткость, мг-экв/л <1. 5 Характеристика вод Ультрапресные или содовые Мягкие 1. 5 -3. 0 Умеренно пресные Умеренно жесткие 3. 0 -6. 0 Собственно пресные Жесткие 6. 0 -9. 0 Собственно пресные Очень жесткие >9. 0 Солоноватые Для питья наиболее пригодны воды с общей жесткостью 3 7 мг экв/л, а для бумажной, сахарной, кожевенной, пивоваренной и других отраслей промышленности — менее 3 мг экв/л.
 Микрокомпоненты
Микрокомпоненты
 Органические вещества Разнообразие состава подземных вод во многом определяется наличием в них широкой гаммы органических соединений. Образование живого вещества на поверхности земли происходит главным образом в результате фотосинтеза зеленых растений по следующей схематизированной реакции: СО 2 + Н 2 О + световая энергия → СН 2 О + О 2 , т. е. из воды и СО 2 под влиянием хлорофилла, играющего роль катализатора, и солнечной энергии зеленые растения синтезируют углеводы и другие органические соединения, условно изображаемые как СН 2 О. В подземных водах, где солнечный свет отсутствует, происходит микробиологическое разложение растительных и животных остатков, которые в основном растворяются в воде. При разложении органического вещества в присутствии свободного кислорода большая их часть минерализуется, т. е. окисляется с образованием исходных минеральных продуктов СО 2 и Н 2 О. Следовательно, минерализация — это процесс противоположный фотосинтезу. Вместе с тем далеко не все разлагающееся органическое вещество минерализуется, так как значительная его часть трансформируется в новые соединения. В почвах и илах чаще всего синтезируются специфические высокомолекулярные соединения темного цвета — гумусовые вещества, играющие важную роль в подземных водах. Среди них выделяются соединения сложного строения — гуминовые кислоты и фульвокислоты, участвующие в комплексообразовании многих металлов.
Органические вещества Разнообразие состава подземных вод во многом определяется наличием в них широкой гаммы органических соединений. Образование живого вещества на поверхности земли происходит главным образом в результате фотосинтеза зеленых растений по следующей схематизированной реакции: СО 2 + Н 2 О + световая энергия → СН 2 О + О 2 , т. е. из воды и СО 2 под влиянием хлорофилла, играющего роль катализатора, и солнечной энергии зеленые растения синтезируют углеводы и другие органические соединения, условно изображаемые как СН 2 О. В подземных водах, где солнечный свет отсутствует, происходит микробиологическое разложение растительных и животных остатков, которые в основном растворяются в воде. При разложении органического вещества в присутствии свободного кислорода большая их часть минерализуется, т. е. окисляется с образованием исходных минеральных продуктов СО 2 и Н 2 О. Следовательно, минерализация — это процесс противоположный фотосинтезу. Вместе с тем далеко не все разлагающееся органическое вещество минерализуется, так как значительная его часть трансформируется в новые соединения. В почвах и илах чаще всего синтезируются специфические высокомолекулярные соединения темного цвета — гумусовые вещества, играющие важную роль в подземных водах. Среди них выделяются соединения сложного строения — гуминовые кислоты и фульвокислоты, участвующие в комплексообразовании многих металлов.
 Основными источниками поступления органических веществ в подземную воду являются почвы, горные породы, морские илы, нефтяные залежи. Часть органических веществ поступает в подземную воду в готовом виде. Это в основном химически и биологически стойкие соединения типа гумусовых веществ, фенолов, углеводородов и др. Другая часть является продуктом сложных физико химических и биохимических превращений, протекающих в процессе круговорота воды.
Основными источниками поступления органических веществ в подземную воду являются почвы, горные породы, морские илы, нефтяные залежи. Часть органических веществ поступает в подземную воду в готовом виде. Это в основном химически и биологически стойкие соединения типа гумусовых веществ, фенолов, углеводородов и др. Другая часть является продуктом сложных физико химических и биохимических превращений, протекающих в процессе круговорота воды.
 В связи с трудностью анализа всех форм органических соединений на практике используют интегрированный показатель Сорг, характеризующий суммарное содержание всех водорастворенных органических соединений в 1 л воды. Сорг = Ссо Спр. со Окисляемость (бихроматная, перманганатная) – количество кислорода пошедшего на окисление органических веществ Окислитель КМn. O 4, KCr 2 O 7 ХПК (Химическое потребление кислорода) – количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе органических веществ, т. е. всех способных окисляться элементов из состава органического соединения. БПК (Биохимическое потребление кислорода) – количество кислорода в миллиграммах, требуемое для окисления находящихся в 1 л воды органических веществ в аэробных условиях, без доступа света, при 20°С, за определенный период в результате протекающих в воде биохимических процессов Для характеристики индивидуальных органических веществ используют также интегрированные показатели Nорг, Pорг и др.
В связи с трудностью анализа всех форм органических соединений на практике используют интегрированный показатель Сорг, характеризующий суммарное содержание всех водорастворенных органических соединений в 1 л воды. Сорг = Ссо Спр. со Окисляемость (бихроматная, перманганатная) – количество кислорода пошедшего на окисление органических веществ Окислитель КМn. O 4, KCr 2 O 7 ХПК (Химическое потребление кислорода) – количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе органических веществ, т. е. всех способных окисляться элементов из состава органического соединения. БПК (Биохимическое потребление кислорода) – количество кислорода в миллиграммах, требуемое для окисления находящихся в 1 л воды органических веществ в аэробных условиях, без доступа света, при 20°С, за определенный период в результате протекающих в воде биохимических процессов Для характеристики индивидуальных органических веществ используют также интегрированные показатели Nорг, Pорг и др.
 Количественная характеристика (в мг/л) органического вещества Сорг различных типов природных вод (по В. М. Швецу) Природные воды Содержание, мг/л Атмосферные осадки n∙ 10 -1 — n∙ 10° Поверхностные воды суши n∙ 10° — n∙ 101 Почвенные растворы n∙ 10° — n∙ 101 Морские и океанические воды n∙ 10° Иловые растворы n∙ 10° —- n∙ 101 Поровые растворы n∙ 101 — 102 Подземные воды n∙ 10 -1 — n∙ 102 Содержание Сорг в подземных водах колеблется в весьма широких пределах: от не скольких единиц до 1000 мг/л. Наиболее высокие его содержания связаны с газоконденсатными нефтяными месторождениями.
Количественная характеристика (в мг/л) органического вещества Сорг различных типов природных вод (по В. М. Швецу) Природные воды Содержание, мг/л Атмосферные осадки n∙ 10 -1 — n∙ 10° Поверхностные воды суши n∙ 10° — n∙ 101 Почвенные растворы n∙ 10° — n∙ 101 Морские и океанические воды n∙ 10° Иловые растворы n∙ 10° —- n∙ 101 Поровые растворы n∙ 101 — 102 Подземные воды n∙ 10 -1 — n∙ 102 Содержание Сорг в подземных водах колеблется в весьма широких пределах: от не скольких единиц до 1000 мг/л. Наиболее высокие его содержания связаны с газоконденсатными нефтяными месторождениями.
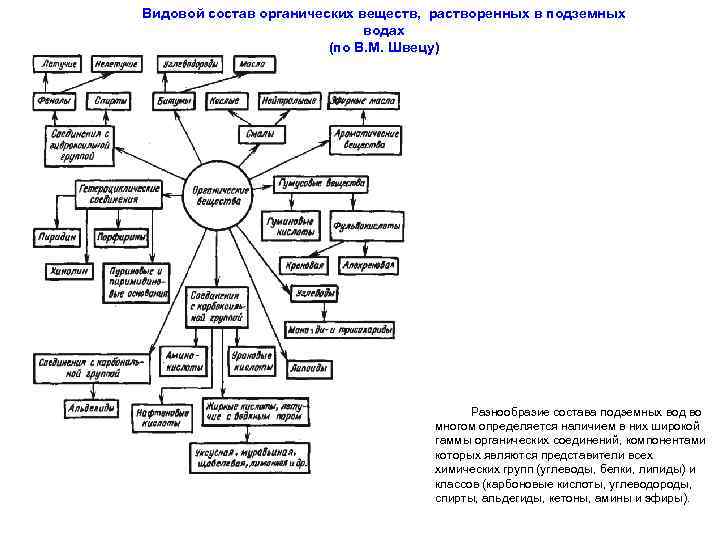 Видовой состав органических веществ, растворенных в подземных водах (по В. М. Швецу) Разнообразие состава подземных вод во многом определяется наличием в них широкой гаммы органических соединений, компонентами которых являются представители всех химических групп (углеводы, белки, липиды) и классов (карбоновые кислоты, углеводороды, спирты, альдегиды, кетоны, амины и эфиры).
Видовой состав органических веществ, растворенных в подземных водах (по В. М. Швецу) Разнообразие состава подземных вод во многом определяется наличием в них широкой гаммы органических соединений, компонентами которых являются представители всех химических групп (углеводы, белки, липиды) и классов (карбоновые кислоты, углеводороды, спирты, альдегиды, кетоны, амины и эфиры).
 Микрофлора Одним из главных факторов преобразования органического вещества выступает микрофлора мельчайшие живые организмы (простейшие, водоросли, бактерии, дрожжи и плесени). В подземных водах изучены главным образом бактериальные микроорганизмы, имеющие размер от 0, n – n микрометров. В процессе своего развития бактерии используют питательные вещества, которые, с одной стороны, служат источником энергии, а с другой — дают материал для построения клетки. Питательными веществами могут быть практически все органические соединения (жиры, протеины, углеводы, липиды, целлюлоза, хитин, углеводороды и др. ), а также минеральные вещества, вода и газы.
Микрофлора Одним из главных факторов преобразования органического вещества выступает микрофлора мельчайшие живые организмы (простейшие, водоросли, бактерии, дрожжи и плесени). В подземных водах изучены главным образом бактериальные микроорганизмы, имеющие размер от 0, n – n микрометров. В процессе своего развития бактерии используют питательные вещества, которые, с одной стороны, служат источником энергии, а с другой — дают материал для построения клетки. Питательными веществами могут быть практически все органические соединения (жиры, протеины, углеводы, липиды, целлюлоза, хитин, углеводороды и др. ), а также минеральные вещества, вода и газы.
 По отношению к кислороду различают аэробные и анаэробные бактерии. Аэробы развиваются только при наличии свободного кислорода, Aнаэробы — при отсутствии или ограниченном доступе кислорода. Последние используют сульфаты, нитраты, углекислоту и органические вещества в качестве источника кислорода. Микробиологическая зональность
По отношению к кислороду различают аэробные и анаэробные бактерии. Аэробы развиваются только при наличии свободного кислорода, Aнаэробы — при отсутствии или ограниченном доступе кислорода. Последние используют сульфаты, нитраты, углекислоту и органические вещества в качестве источника кислорода. Микробиологическая зональность
 По характеру обмена бактерии подразделяются на автотрофные и гетеротрофные. Автотрофы для своего развития используют исключительно минеральные вещества. Углерод, необходимый для построения своего тела, они получают из СО 2, а водород — из воды, H 2 S или Н 2 газообразного. Гетеротрофы для построения своих клеток используют готовые органические соединения. В подземных водах распространены обе группы бактерий, но преобладают вторые.
По характеру обмена бактерии подразделяются на автотрофные и гетеротрофные. Автотрофы для своего развития используют исключительно минеральные вещества. Углерод, необходимый для построения своего тела, они получают из СО 2, а водород — из воды, H 2 S или Н 2 газообразного. Гетеротрофы для построения своих клеток используют готовые органические соединения. В подземных водах распространены обе группы бактерий, но преобладают вторые.
 Содержание бактерий в подземных водах, изученных до глубины 3 4 км, составляет от 10 до 500 тыс. клеток в 1 мл воды, достигая в особо благоприятных условиях несколько миллионов клеток в 1 мл. 1. При высоких содержаниях Сорг в воде, активнее развивается микрофлора 2. Важным лимитирующим фактором для развития бактерий ранее считалась температура, верхний предел которой ограничивался 100° С (на дне Тихого океана в местах выхода гидротерм открыли принципиально новый вид бактерий, так называемые хемосинтетики, живущие при температуре 300° С) 3. Соленость подземных вод влияет на жизнедеятельность бактерий лишь при очень большом ее значении. Многие микроорганизмы способны развиваться при концентрации солей до 250 300 г/л. 4. Отмечено угнетающее влияние на рост бактерий некоторых металлов, среди которых в первую очередь следует назвать серебро, ртуть, медь, свинец и др. 5. Большинство бактерий лучше всего развивается при р. Н в пределах 6 7, 5, однако известны и такие, которые хорошо размножаются в кислых и щелочных средах.
Содержание бактерий в подземных водах, изученных до глубины 3 4 км, составляет от 10 до 500 тыс. клеток в 1 мл воды, достигая в особо благоприятных условиях несколько миллионов клеток в 1 мл. 1. При высоких содержаниях Сорг в воде, активнее развивается микрофлора 2. Важным лимитирующим фактором для развития бактерий ранее считалась температура, верхний предел которой ограничивался 100° С (на дне Тихого океана в местах выхода гидротерм открыли принципиально новый вид бактерий, так называемые хемосинтетики, живущие при температуре 300° С) 3. Соленость подземных вод влияет на жизнедеятельность бактерий лишь при очень большом ее значении. Многие микроорганизмы способны развиваться при концентрации солей до 250 300 г/л. 4. Отмечено угнетающее влияние на рост бактерий некоторых металлов, среди которых в первую очередь следует назвать серебро, ртуть, медь, свинец и др. 5. Большинство бактерий лучше всего развивается при р. Н в пределах 6 7, 5, однако известны и такие, которые хорошо размножаются в кислых и щелочных средах.
 Состав бактериальной микрофлоры подземных вод чрезвычайно широк и разнообразен. физиологические группы бактерий, обнаруженные в подземных водах: сапрофиты и гнилостные бактерии, разлагающие вещества белкового характера, окисляющие нафталин и газообразные углеводороды, разрушающие органические кислоты, углеводороды, вещества углеводного характера. железобактерии, серобактерии, азотфикаторы, нитрификаторы, денитрификаторы, аммонификаторы, тионовые и десульфирующие бактерии. Важным достижением последних лет является открытие бактерий в физически связанных водах глинистых отложений, что значительно расширяет область развития микроорганизмов в подземных водах
Состав бактериальной микрофлоры подземных вод чрезвычайно широк и разнообразен. физиологические группы бактерий, обнаруженные в подземных водах: сапрофиты и гнилостные бактерии, разлагающие вещества белкового характера, окисляющие нафталин и газообразные углеводороды, разрушающие органические кислоты, углеводороды, вещества углеводного характера. железобактерии, серобактерии, азотфикаторы, нитрификаторы, денитрификаторы, аммонификаторы, тионовые и десульфирующие бактерии. Важным достижением последних лет является открытие бактерий в физически связанных водах глинистых отложений, что значительно расширяет область развития микроорганизмов в подземных водах
 Использование данных по микробиологическому составу подземных вод
Использование данных по микробиологическому составу подземных вод
 Газы По условиям нахождения выделяются: Газы сорбированные, растворенные и свободные. Между свободными и растворенными также существует динамическое равновесие, определяемое температурой, давлением и соленостью воды. Основными газами подземной гидросферы являются О 2, N 2, СО 2, H 2 S, CH 4, Н 2, He, Rn
Газы По условиям нахождения выделяются: Газы сорбированные, растворенные и свободные. Между свободными и растворенными также существует динамическое равновесие, определяемое температурой, давлением и соленостью воды. Основными газами подземной гидросферы являются О 2, N 2, СО 2, H 2 S, CH 4, Н 2, He, Rn
 Объем газа, растворенный при 0° С и нормальном давлении в 1 л воды называется газонасыщенностью. Газонасыщенность обычно выражается в объемных (мл/л) или весовых (мг/л) единицах. Объем растворенного газа в воде характеризуется также давлением насыщения или упругостью газа, т. е. величиной давления, которая удерживает газ в водорастворенном состоянии. В единицах СИ давление насыщения выражается в мегапаскалях (МПа)*. * 1 атм = 0, 1 МПа.
Объем газа, растворенный при 0° С и нормальном давлении в 1 л воды называется газонасыщенностью. Газонасыщенность обычно выражается в объемных (мл/л) или весовых (мг/л) единицах. Объем растворенного газа в воде характеризуется также давлением насыщения или упругостью газа, т. е. величиной давления, которая удерживает газ в водорастворенном состоянии. В единицах СИ давление насыщения выражается в мегапаскалях (МПа)*. * 1 атм = 0, 1 МПа.
 Растворимость - предельный объем газа растворенного в воде данного состава при данных температуре и давлении (см 3/дм 3). Для разных газов он различен. Растворимость газа пропорциональна давлению (закон Генри): С = k. Р, где: С концентрация газа в насыщенном растворе; k - коэффициент растворимости – количество газа насыщающего 1 л воды при 0 о. С; Р - давление. Коэффициент k зависит от температуры, состава газа и растворителя и не зависит от давления. Растворимость некоторых газов в воде (давление 0, 102 МПа) Газ Температура, °C 0 25 0 0 60 0 20 Растворимость, мл/100 мл 4, 9 3, 2 2, 3 437 184 171 90 Метан 20 3 Пропан 20 6, 5 Гелий Аргон 0 0 0, 9 5, 6 Кислород Азот Сероводород Диоксид углерода
Растворимость - предельный объем газа растворенного в воде данного состава при данных температуре и давлении (см 3/дм 3). Для разных газов он различен. Растворимость газа пропорциональна давлению (закон Генри): С = k. Р, где: С концентрация газа в насыщенном растворе; k - коэффициент растворимости – количество газа насыщающего 1 л воды при 0 о. С; Р - давление. Коэффициент k зависит от температуры, состава газа и растворителя и не зависит от давления. Растворимость некоторых газов в воде (давление 0, 102 МПа) Газ Температура, °C 0 25 0 0 60 0 20 Растворимость, мл/100 мл 4, 9 3, 2 2, 3 437 184 171 90 Метан 20 3 Пропан 20 6, 5 Гелий Аргон 0 0 0, 9 5, 6 Кислород Азот Сероводород Диоксид углерода
 Способность к растворению газов в воде определяется коэффициентом растворимости каждого газа, т. е. количеством газа насыщающего 1 л воды при 0° С и нормальном давлении. С ростом температуры коэффициент растворимости газов, а значит, и их растворимость вначале понижается, но при температуре выше 80 90° С растет. С ростом же давления растворимость газов растет значительно быстрее. Например, растворимость метана в дистиллированной воде при T=70° С с повышением давления уве личивается следующим образом: при 7 МПа оно составляет 1175, 5, а при 28 МПа 3129, 9 см 3/л. Коэффициент растворимости газов в подземных водах в зависимости от температуры
Способность к растворению газов в воде определяется коэффициентом растворимости каждого газа, т. е. количеством газа насыщающего 1 л воды при 0° С и нормальном давлении. С ростом температуры коэффициент растворимости газов, а значит, и их растворимость вначале понижается, но при температуре выше 80 90° С растет. С ростом же давления растворимость газов растет значительно быстрее. Например, растворимость метана в дистиллированной воде при T=70° С с повышением давления уве личивается следующим образом: при 7 МПа оно составляет 1175, 5, а при 28 МПа 3129, 9 см 3/л. Коэффициент растворимости газов в подземных водах в зависимости от температуры

 По генезису газы в подземных водах делятся на четыре основные группы: 1) газы атмосферного происхождения (О 2, СО 2, N 2, Аr, Кг, Ne), которые проникают в подземную атмосферу из воздуха; 2) газы биохимического происхождения (СН 4, H 2 S, CO 2, N 2, тяжелые углеводороды), образующиеся при разложении микроорганизмами органических и минеральных веществ; 3) газы метаморфического и магматического происхождения (СО 2, Н 2, СО, N 2, реже НСl, HF, SO 2), образующиеся при повышенных температурах и давлениях в результате преобразования карбонатных и глинистых минералов и воздействия магматических расплавов; 4) газы радиоактивного происхождения (Не, Rn, Аr), образующиеся в результате радиоактивного распада зональность
По генезису газы в подземных водах делятся на четыре основные группы: 1) газы атмосферного происхождения (О 2, СО 2, N 2, Аr, Кг, Ne), которые проникают в подземную атмосферу из воздуха; 2) газы биохимического происхождения (СН 4, H 2 S, CO 2, N 2, тяжелые углеводороды), образующиеся при разложении микроорганизмами органических и минеральных веществ; 3) газы метаморфического и магматического происхождения (СО 2, Н 2, СО, N 2, реже НСl, HF, SO 2), образующиеся при повышенных температурах и давлениях в результате преобразования карбонатных и глинистых минералов и воздействия магматических расплавов; 4) газы радиоактивного происхождения (Не, Rn, Аr), образующиеся в результате радиоактивного распада зональность
 Изотопы (естественные и искусственные) Изотопы — разновидности одного и того же химического элемента, различающиеся массой атома, но имеющие одинаковые химические свойства. Различают стабильные и радиоактивные изотопы химических элементов как самой воды (Н и О), так и содержащихся в ней макро и микрокомпонентов. В настоящее время известно более 260 стабильных изотопов, около 50 естественных радиоактивных (космического и радиогенного происхождения) и более 1000 искусственных радиоактивных изотопов. Изотопный состав воды оценивается стабильными изотопами водорода (протий 1 Н и дейтерий 2 Н ) и кислорода (16 О, 17 О и 18 О), распространенность которых различна. В природных водах встречаются также короткоживущие радиогенные изотопы. У водорода их два: 3 Н (тритий) с периодом полураспада 12, 26 лет и весьма неустойчивый 4 Н. Четыре короткоживущих изотопа кислорода обладают следующими периодами полураспада: 14 О 74 с, 15 О 2, 1 мин, 19 О 29 с и 20 О менее 10 мин.
Изотопы (естественные и искусственные) Изотопы — разновидности одного и того же химического элемента, различающиеся массой атома, но имеющие одинаковые химические свойства. Различают стабильные и радиоактивные изотопы химических элементов как самой воды (Н и О), так и содержащихся в ней макро и микрокомпонентов. В настоящее время известно более 260 стабильных изотопов, около 50 естественных радиоактивных (космического и радиогенного происхождения) и более 1000 искусственных радиоактивных изотопов. Изотопный состав воды оценивается стабильными изотопами водорода (протий 1 Н и дейтерий 2 Н ) и кислорода (16 О, 17 О и 18 О), распространенность которых различна. В природных водах встречаются также короткоживущие радиогенные изотопы. У водорода их два: 3 Н (тритий) с периодом полураспада 12, 26 лет и весьма неустойчивый 4 Н. Четыре короткоживущих изотопа кислорода обладают следующими периодами полураспада: 14 О 74 с, 15 О 2, 1 мин, 19 О 29 с и 20 О менее 10 мин.

 Вода состава 2 H 216 O называется тяжелой. Распространение тяжелой воды в природе крайне неравномерно: ее содержание ничтожно мало в снеге, дождевых и поверхностных водах, значительно больше в океанах, ее максимальные содержания характерны для седиментационных вод. В качестве эталона для оценки концентрации 2 Н и 18 О используется SMOW — стандарт среднеокеанической воды, который отвечает абсолютному содержанию дейтерия — 0, 01985‰ и тяжелого кис лорода — 0, 1985‰. Концентрации дейтерия и тяжелого кислорода измеряются в виде отклонения от стандарта, приравненного к нулю, и оцениваются как отношение (δ) в ‰ (промилле). Положительные значения δD и δ 18 О показывают "утяжеление", а отрицательные — "облегчение" конкретной воды по отношению к стандарту. Установлено, что изменение изотопного состава метеорных вод разных широт происходит вдоль прямой линии, которая получила название линии Крейга в честь исследователя, впервые обосновавшего ее положение и внесшего большой вклад в изучение изотопного соста ва воды. Линия Крейга для метеорных вод земного шара имеет вид: δ 2 Н = 8δ 18 О + 10%,
Вода состава 2 H 216 O называется тяжелой. Распространение тяжелой воды в природе крайне неравномерно: ее содержание ничтожно мало в снеге, дождевых и поверхностных водах, значительно больше в океанах, ее максимальные содержания характерны для седиментационных вод. В качестве эталона для оценки концентрации 2 Н и 18 О используется SMOW — стандарт среднеокеанической воды, который отвечает абсолютному содержанию дейтерия — 0, 01985‰ и тяжелого кис лорода — 0, 1985‰. Концентрации дейтерия и тяжелого кислорода измеряются в виде отклонения от стандарта, приравненного к нулю, и оцениваются как отношение (δ) в ‰ (промилле). Положительные значения δD и δ 18 О показывают "утяжеление", а отрицательные — "облегчение" конкретной воды по отношению к стандарту. Установлено, что изменение изотопного состава метеорных вод разных широт происходит вдоль прямой линии, которая получила название линии Крейга в честь исследователя, впервые обосновавшего ее положение и внесшего большой вклад в изучение изотопного соста ва воды. Линия Крейга для метеорных вод земного шара имеет вид: δ 2 Н = 8δ 18 О + 10%,
 Schematic overview of the hydrological cycle showing approximate depletions in d 18 O [based on: GNIP Brochure, IAEA, 1996].
Schematic overview of the hydrological cycle showing approximate depletions in d 18 O [based on: GNIP Brochure, IAEA, 1996].
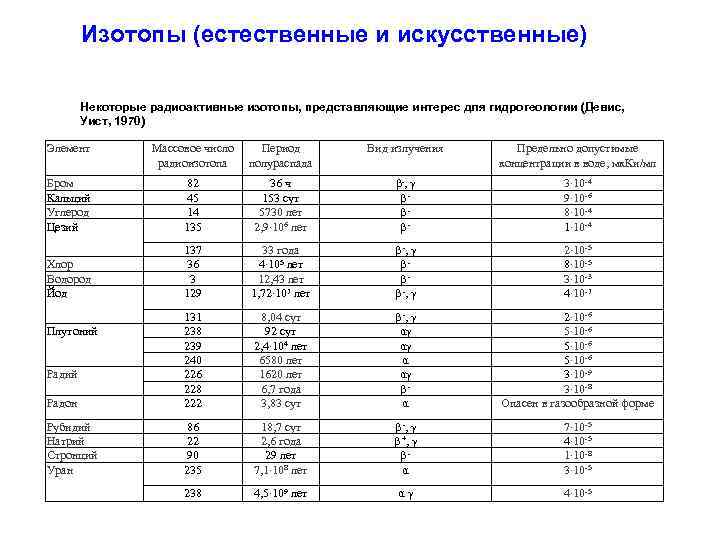 Изотопы (естественные и искусственные) Некоторые радиоактивные изотопы, представляющие интерес для гидрогеологии (Девис, Уист, 1970) Элемент Массовое число радиоизотопа Период полураспада Вид излучения Предельно допустимые концентрации в воде, мк. Ки/мл Бром Кальций Углерод Цезий 82 45 14 135 36 ч 153 сут 5730 лет 2, 9∙ 106 лет β-, γ βββ- 3∙ 10 -4 9∙ 10 -6 8∙ 10 -4 1∙ 10 -4 Хлор Водород Йод 137 36 3 129 33 года 4∙ 105 лет 12, 43 лет 1, 72∙ 107 лет β -, γ βββ -, γ 2∙ 10 -5 8∙ 10 -5 З∙ 10 -3 4∙ 10 -7 Радон 131 238 239 240 226 228 222 8, 04 сут 92 сут 2, 4∙ 104 лет 6580 лет 1620 лет 6, 7 года 3, 83 сут β -, γ αγ αγ α αγ βα 2∙ 10 -6 5∙ 10 -6 3∙ 10 -9 3∙ 10 -8 Опасен в газообразной форме Рубидий Натрий Стронций Уран 86 22 90 235 18, 7 сут 2, 6 года 29 лет 7, 1∙ 108 лет β -, γ β +, γ βα 7∙ 10 -5 4∙ 10 -5 1∙ 10 -8 3∙ 10 -5 238 4, 5∙ 109 лет αγ 4∙ 10 -5 Плутоний Радий
Изотопы (естественные и искусственные) Некоторые радиоактивные изотопы, представляющие интерес для гидрогеологии (Девис, Уист, 1970) Элемент Массовое число радиоизотопа Период полураспада Вид излучения Предельно допустимые концентрации в воде, мк. Ки/мл Бром Кальций Углерод Цезий 82 45 14 135 36 ч 153 сут 5730 лет 2, 9∙ 106 лет β-, γ βββ- 3∙ 10 -4 9∙ 10 -6 8∙ 10 -4 1∙ 10 -4 Хлор Водород Йод 137 36 3 129 33 года 4∙ 105 лет 12, 43 лет 1, 72∙ 107 лет β -, γ βββ -, γ 2∙ 10 -5 8∙ 10 -5 З∙ 10 -3 4∙ 10 -7 Радон 131 238 239 240 226 228 222 8, 04 сут 92 сут 2, 4∙ 104 лет 6580 лет 1620 лет 6, 7 года 3, 83 сут β -, γ αγ αγ α αγ βα 2∙ 10 -6 5∙ 10 -6 3∙ 10 -9 3∙ 10 -8 Опасен в газообразной форме Рубидий Натрий Стронций Уран 86 22 90 235 18, 7 сут 2, 6 года 29 лет 7, 1∙ 108 лет β -, γ β +, γ βα 7∙ 10 -5 4∙ 10 -5 1∙ 10 -8 3∙ 10 -5 238 4, 5∙ 109 лет αγ 4∙ 10 -5 Плутоний Радий
 р. Н Кислотно-щелочные условия важная характеристика состояния подземных вод , определяются величиной водородного показателя р. Н (отрицательный логарифм активности ионов водорода в воде) Некоторое количество воды всегда диссоциирует на ионы по реакции Н 2 О = Н+ + ОН В соответствии с законом действующих масс произведение активностей продуктов данной реакции при температуре 25°С (активность воды равна единице), называемое константой реакции, равно 10 14, т. е. [Н +] • [ОН ]= 10 14 При условии, что [Н+] = [ОН ] значение [Н+] = 10 7. Отсюда отрицательный логарифм активности [Н+] равен 7 или р. Н=7. При увеличении ионов Н+ в растворе обязательно уменьшается содержание ОН и воды становятся более кислыми и, наоборот, при уменьшении концентрации Н+ и увеличении ОН — щелочными
р. Н Кислотно-щелочные условия важная характеристика состояния подземных вод , определяются величиной водородного показателя р. Н (отрицательный логарифм активности ионов водорода в воде) Некоторое количество воды всегда диссоциирует на ионы по реакции Н 2 О = Н+ + ОН В соответствии с законом действующих масс произведение активностей продуктов данной реакции при температуре 25°С (активность воды равна единице), называемое константой реакции, равно 10 14, т. е. [Н +] • [ОН ]= 10 14 При условии, что [Н+] = [ОН ] значение [Н+] = 10 7. Отсюда отрицательный логарифм активности [Н+] равен 7 или р. Н=7. При увеличении ионов Н+ в растворе обязательно уменьшается содержание ОН и воды становятся более кислыми и, наоборот, при уменьшении концентрации Н+ и увеличении ОН — щелочными
 • Fe. S 2 + 2 О 2 + 2 Н 2 О = Fe 2+ + 2 SO 4 2 - + 4 H+ +4 е • 2 Ca[Al 2 Si 2 O 8] + 6 Н 2 О = [Al 4 Si 4 O 10](OH)8+ 2 Са 2+ + 4 ОН-
• Fe. S 2 + 2 О 2 + 2 Н 2 О = Fe 2+ + 2 SO 4 2 - + 4 H+ +4 е • 2 Ca[Al 2 Si 2 O 8] + 6 Н 2 О = [Al 4 Si 4 O 10](OH)8+ 2 Са 2+ + 4 ОН-
 Подразделения вод по величине р. Н Тип воды р. Н Сильнокислые <3. 0 Кислые 3. 0 -5. 0 Слабокислые 5. 0 -6. 5 Нейтральные 6, 5 -7, 5 Слабощелочные 7, 5 -8, 5 Щелочные 8, 5 -10 Примеры распространения Рудничные воды, воды районов современной вулканической деятельности Сильнощелочные Широко распространенные пресные воды Воды щелочных горных пород >10 В земных недрах широко представлены разные типы вод по величине р. Н — от сильнокислых до сильнощелочных. Однако наиболее широко распространены воды околонейтральные, т. е. нейтральные, слабокислые и слабощелочные. Практически все пресные воды земли относятся к этому типу.
Подразделения вод по величине р. Н Тип воды р. Н Сильнокислые <3. 0 Кислые 3. 0 -5. 0 Слабокислые 5. 0 -6. 5 Нейтральные 6, 5 -7, 5 Слабощелочные 7, 5 -8, 5 Щелочные 8, 5 -10 Примеры распространения Рудничные воды, воды районов современной вулканической деятельности Сильнощелочные Широко распространенные пресные воды Воды щелочных горных пород >10 В земных недрах широко представлены разные типы вод по величине р. Н — от сильнокислых до сильнощелочных. Однако наиболее широко распространены воды околонейтральные, т. е. нейтральные, слабокислые и слабощелочные. Практически все пресные воды земли относятся к этому типу.

 окислительно-восстановительный потенциал подземных вод (Eh) — показатель степени окисленности или восстановленности переменно валентных элементов состава подземных вод. Окислительно восстановительные (или редокс ) реакции в природных условиях протекают широко. Примером может служить реакция окисления двухвалентного железа: 2 Fe 2+ + 0, 5 О 2 + 2 Н+ = 2 Fe 3+ + Н 2 О В любой окислительно восстановительной системе всякое окисление сопровождается восстановлением. В связи с этим окислительно восстановительные реакции обычно делят на две полуреакции, соответствующие различным сторонам процесса. Приведенную выше реакцию можно поэтому записать в виде следующих полуреакций: 2 Fe 2+ – 2 е = 2 Fe 3+ 0, 5 О 2 + 2 Н+ + 2 е = Н 2 О где е — электрон.
окислительно-восстановительный потенциал подземных вод (Eh) — показатель степени окисленности или восстановленности переменно валентных элементов состава подземных вод. Окислительно восстановительные (или редокс ) реакции в природных условиях протекают широко. Примером может служить реакция окисления двухвалентного железа: 2 Fe 2+ + 0, 5 О 2 + 2 Н+ = 2 Fe 3+ + Н 2 О В любой окислительно восстановительной системе всякое окисление сопровождается восстановлением. В связи с этим окислительно восстановительные реакции обычно делят на две полуреакции, соответствующие различным сторонам процесса. Приведенную выше реакцию можно поэтому записать в виде следующих полуреакций: 2 Fe 2+ – 2 е = 2 Fe 3+ 0, 5 О 2 + 2 Н+ + 2 е = Н 2 О где е — электрон.
 Из уравнений можно видеть, что такие реакции сопровождаются переносом электронов, который в свою очередь свидетельствует о наличии разности потенциалов Е между восстановленным и окисленным элементами. Потенциал реакции можно было измерить Для того, чтобы можно было измерить этот потенциал нужен стандарт. За такой стандарт по международной конвенции был принят потенциал реакции Н 2 = 2 Н+ + 2 е , равный в стандартных условиях нулю, т. е. при активности Н+ и Н 2, равной единице. Следовательно, замеряя электрический потенциал окислительно восстановительной реакции, мы получаем потенциал электрода в полуячейке относительно стандартного водородного электрода (СВЭ). Этот замеренный потенциал и называется величиной Eh раствора.
Из уравнений можно видеть, что такие реакции сопровождаются переносом электронов, который в свою очередь свидетельствует о наличии разности потенциалов Е между восстановленным и окисленным элементами. Потенциал реакции можно было измерить Для того, чтобы можно было измерить этот потенциал нужен стандарт. За такой стандарт по международной конвенции был принят потенциал реакции Н 2 = 2 Н+ + 2 е , равный в стандартных условиях нулю, т. е. при активности Н+ и Н 2, равной единице. Следовательно, замеряя электрический потенциал окислительно восстановительной реакции, мы получаем потенциал электрода в полуячейке относительно стандартного водородного электрода (СВЭ). Этот замеренный потенциал и называется величиной Eh раствора.

 Значения Eh могут быть положительными или отрицательными в зависимости от того, будет ли активность электронов в измеренном растворе выше или ниже их активности в СЭВ. По международной конвенции Eh считается положительным, если активность электронов в измеренной жидкости меньше, чем в СЭВ. Активность электронов в растворе при наличии окислительно восстановительных процессов может быть выражена как в вольтах (В), так и единицах активности электронов [е]. Последнее удобнее выражать в форме отрицательного логарифма р ре = lg[e] по аналогии с р. Н = lg[H+]. Значения Eh и ре связаны уравнением ре = (F/2, 303 RT)Eh , где F — постоянная Фарадея; R — газовая постоянная; Т — абсолютная температура. При 25° С ре = 16, 9 Eh или Eh = 0, 059 ре.
Значения Eh могут быть положительными или отрицательными в зависимости от того, будет ли активность электронов в измеренном растворе выше или ниже их активности в СЭВ. По международной конвенции Eh считается положительным, если активность электронов в измеренной жидкости меньше, чем в СЭВ. Активность электронов в растворе при наличии окислительно восстановительных процессов может быть выражена как в вольтах (В), так и единицах активности электронов [е]. Последнее удобнее выражать в форме отрицательного логарифма р ре = lg[e] по аналогии с р. Н = lg[H+]. Значения Eh и ре связаны уравнением ре = (F/2, 303 RT)Eh , где F — постоянная Фарадея; R — газовая постоянная; Т — абсолютная температура. При 25° С ре = 16, 9 Eh или Eh = 0, 059 ре.
 Значения Eh природных вод по данным Е 0 могут быть рассчитаны по уравнению Нернста, которое при 25° С имеет следующий вид: где N — любой химический элемент с переменной валентностью; n , т — соответственно число электронов и протонов, участвующих в реакции, Е 0 — измеренные величины нормальных или стандартных электродные потенциалов отдельных полуреакций в стандартных условиях (т. е. когда активности окисленных и восстановленных форм химического элемента, а также ионов водорода равны 1) приводятся в различных справочниках по химии и геохимии
Значения Eh природных вод по данным Е 0 могут быть рассчитаны по уравнению Нернста, которое при 25° С имеет следующий вид: где N — любой химический элемент с переменной валентностью; n , т — соответственно число электронов и протонов, участвующих в реакции, Е 0 — измеренные величины нормальных или стандартных электродные потенциалов отдельных полуреакций в стандартных условиях (т. е. когда активности окисленных и восстановленных форм химического элемента, а также ионов водорода равны 1) приводятся в различных справочниках по химии и геохимии
 В природных водах Eh колеблется от +0, 7 до 0, 5 В. Поверхностные и грунтовые воды, содержащие свободный кислород, чаще всего характеризуются более узким интервалом Eh (от +0, 15 до +0, 70 В). Трещинно грунтовые воды изверженных пород даже на. глубине 350 300 м имеют Eh более 0. Для подземных вод, связанных с битуминозными породами и нефтяными залежами, величина Eh значительно ниже 0 (местами до 0, 5 В), в этих условиях развиваются процессы восстановления SO 42 , Fe 3+ и других ионов.
В природных водах Eh колеблется от +0, 7 до 0, 5 В. Поверхностные и грунтовые воды, содержащие свободный кислород, чаще всего характеризуются более узким интервалом Eh (от +0, 15 до +0, 70 В). Трещинно грунтовые воды изверженных пород даже на. глубине 350 300 м имеют Eh более 0. Для подземных вод, связанных с битуминозными породами и нефтяными залежами, величина Eh значительно ниже 0 (местами до 0, 5 В), в этих условиях развиваются процессы восстановления SO 42 , Fe 3+ и других ионов.
 Термобарические условия подземной гидросферы • Температурный режим подземных вод • Пластовое давление
Термобарические условия подземной гидросферы • Температурный режим подземных вод • Пластовое давление
 Методы изучения состава подземных вод
Методы изучения состава подземных вод
 Общий вид полевого измерителя окислительно-восстановительного потенциала
Общий вид полевого измерителя окислительно-восстановительного потенциала
 Общий вид прибора Water-Test
Общий вид прибора Water-Test


