янович фабушева презентац.pptx
- Количество слайдов: 14

Гибридизация нуклеиновых кислот. Детекционные методы в молекулярной биологии. Гены-репортеры.

Гибридизация нуклеиновых кислот — соединение комплементарных одноцепочечных нуклеиновых кислот в одну молекулу. Возможна гибридизация ДНК-ДНК и ДНК-РНК. Для чего же используется гибридизация? 1. Для нахождения числа определенных нуклеотидных последовательностей (генов) в ДНК. Для этой цели применяют ДНК-зонды- радиоактивные фрагменты ДНК с известной нуклеотидной последовательностью. 2. Для выявления транскрибируемых и нетранскрибируемых последовательностей, анализируя продукты гибридизации ДНК и РНК, что позволяет выделить активные (транскрибируемые) участки. 3. Для выявления определенных нуклеотидных последовательностей в смеси рестрикционных фрагментов.

Выделяют несколько основных видов гибридизации: 1. Саузерн 2. блоттинг гибридизация Нозерн-блот 3. Вестерн-блоттинг 4. Флюоресце нтная гибридиза ция
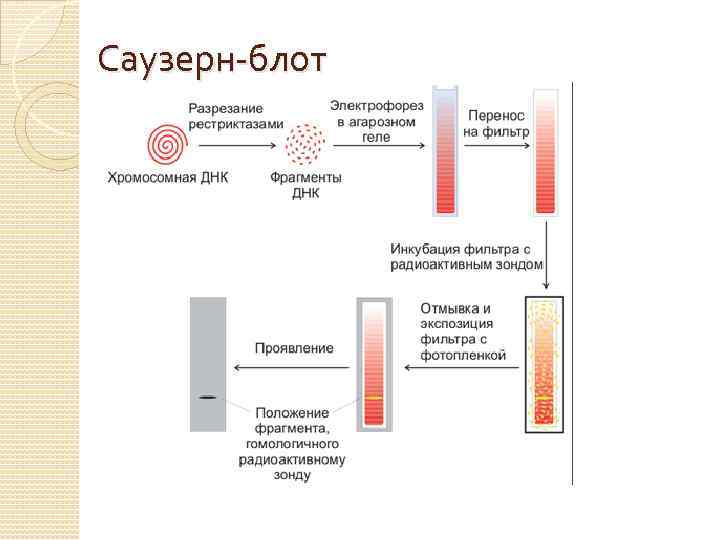
Саузерн-блот
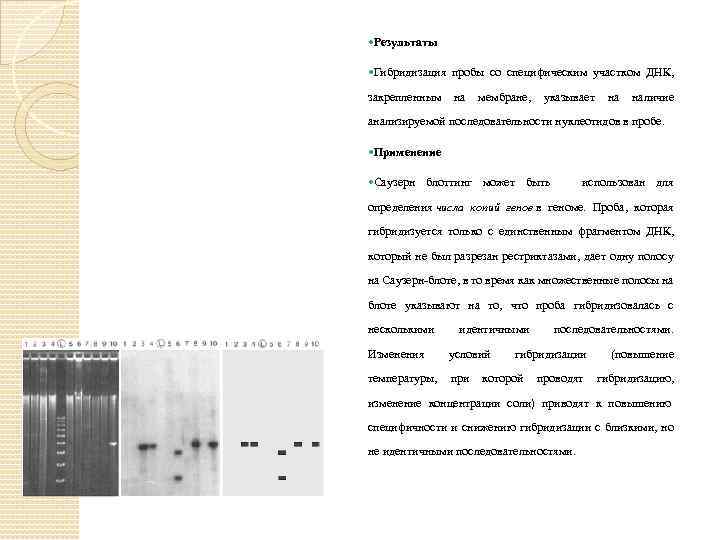
Результаты Гибридизация пробы со специфическим участком ДНК, закрепленным на мембране, указывает на наличие анализируемой последовательности нуклеотидов в пробе. Применение Саузерн блоттинг может быть использован для определения числа копий генов в геноме. Проба, которая гибридизуется только с единственным фрагментом ДНК, который не был разрезан рестриктазами, дает одну полосу на Саузерн-блоте, в то время как множественные полосы на блоте указывают на то, что проба гибридизовалась с несколькими Изменения идентичными условий последовательностями. гибридизации (повышение температуры, при которой проводят гибридизацию, изменение концентрации соли) приводят к повышению специфичности и снижению гибридизации с близкими, но не идентичными последовательностями.
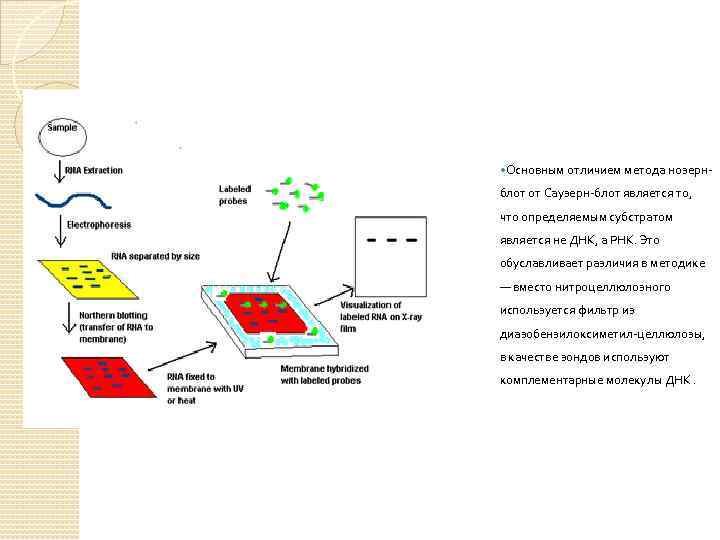
Основным отличием метода нозерн- блот от Саузерн-блот является то, что определяемым субстратом является не ДНК, а РНК. Это обуславливает различия в методике — вместо нитроцеллюлозного используется фильтр из диазобензилоксиметил-целлюлозы, в качестве зондов используют комплементарные молекулы ДНК.

Вестерн-блот Белки разделяются при помощи электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS). SDS вызывает денатурацию белков и поддерживает их в денатурированном состоянии Разделение белков можно производить по изоэлектрической точке (p. I), молекулярной массе, электрическому заряду или по сочетанию этих параметров. Также возможно использование двухмерного электрофореза(2 -Д). В таком случае разделение белков производят в двух направлениях — в соответствии с их изоэлектрической точкой в первом направлении, и в соответствии с молекулярной массой — во втором. Чтобы сделать белки доступными для антител и дальнейшей детекции, их вместе с полоской геля переносят на мембрану, изготовленную из нитроцеллюлозы. Мембрана накладывается поверх геля, а поверх неё кладут стопку фильтровальной бумаги. Всю стопку помещают в буфер для переноса, который продвигается верх по бумаге под действием капиллярных сил, уносит с собой белки. Другой метод переноса белков называется электроблоттингоми использует электрический ток, который переносит белки из геля на мембрану Как только выбрана мембрана за её способность связывать белки, выбраны антитела и целевой белок, должны быть приняты меры по исключению взаимодействия между мембраной и антителом, используемым для детекции целевого белка (ибо антитело само по себе белок). Блокирование неспецифичных связываний достигается помещение мембраны в разбавленный раствор белка — обычно бычий сывороточный альбумин или нежирное сухое молоко с небольшим процентом детергента типа Tween-20 или Triton X-100.

Колориметрическая детекция Метод колориметрической детекции основан на инкубации вестерн блота с субстратом, который реагирует с репортерным ферментом (таким как перексидаза хрена) «сидящем» на вторичном антителе. Растворимый краситель переходит в нерастворимую форму другого цвета, осаждаясь рядом с ферментом и окрашивая мембрану. Рост пятна ограничивается смыванием растворимого красителя. Уровень количества белка оценивается спектрофотометрически. Хемилюминесцентная детекция Данный метод детекции основывается на инкубации нитроцеллюлозной мембраны с субстратом, который люминесцирует после взаимодействия с репортером вторичного антитела. Свет регистрируется фотопленкой. CCД камерой, которая производит цифровую съемку вестерн блота. Изображение анализируется оценивая относительное количество окрашенного белка и даёт количественный результат в единицах оптической плотности. Новое программное обеспечение позволяет провести дальнейший анализ данных, например, определить молекулярный вес, если использовался соответствующий стандарт.
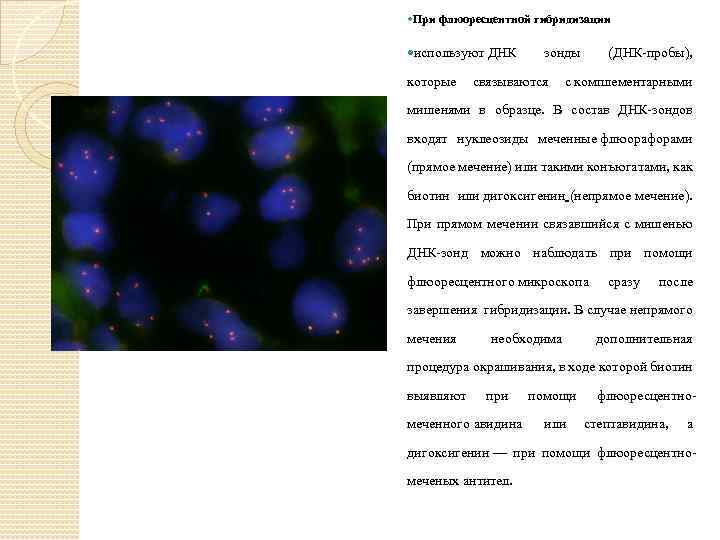
При флюоресцентной гибридизации используют ДНК зонды (ДНК-пробы), которые связываются с комплементарными мишенями в образце. В состав ДНК-зондов входят нуклеозиды меченные флюорафорами (прямое мечение) или такими конъюгатами, как биотин или дигоксигенин (непрямое мечение). При прямом мечении связавшийся с мишенью ДНК-зонд можно наблюдать при помощи флюоресцентного микроскопа сразу после завершения гибридизации. В случае непрямого мечения необходима дополнительная процедура окрашивания, в ходе которой биотин выявляют при меченного авидина помощи или флюоресцентностептавидина, а дигоксигенин — при помощи флюоресцентномеченых антител.

Хотя непрямой вариант мечения ДНКпроб требует дополнительных реактивов и временных затрат, этот способ позволяет добиться обычно более высокого уровня сигнала за счёт присутствия на молекуле антитела или авидина 3— 4 молекул флюорохрома. Кроме того, в случае непрямого мечения возможно каскадное усиление сигнала Флуоресцентная in situ гибридизация позволяет выявлять хромосомные аномалии. Метод FISH продвинул вперед цитогенетическую диагностику, т. к. позволил изучать небольшие хромосомные перестройки, которые не видны под микроскопом при использовании стандартных методов цитогенетики.

Гены-репортеры (репортерные гены, reporter gene) Ген-репортер - это ген, встраиваемый в генно-инженерную конструкцию, за экспрессией которого легко следить, поскольку существует легкий путь анализа его продукта, обычно фермента. Интересующий исследователя ген и ген-репортёр обычно встраивают в одну генетическую конструкцию, а затем вводят её в клетку или организм. В случае клеток бактерий и эукариот для введения обычно используют кольцевые молекулы ДНК — плазмиды. Важно, чтобы ген-репортёр в норме не экспрессировался в клетке, тогда экспрессия генарепортёра будет свидетельствовать о том, что интересующий ген попал в клетку. При любом способе переноса генов необходимо тестирование: встроились ли конструкции в геном и работают ли перенесенные гены. Для этого в любой генетической конструкции есть ген-репортер, который и сообщает, что вектор встроился в геном и работает (экспрессирует). В качестве репортеров используются гены, определяющие устойчивость растительных и животных клеток к антибиотикам. Для растений существенна устойчивость к канамицину, для животных - к неомицину. На среде с антибиотиками клетки, не имеющие в геноме встройки, гибнут, выживают только трансгенные, в геном которых введены чужие гены, в том числе и устойчивости к антибиотикам.

Генов-репортеров много - в их числе ген бактериальной b- галактозидазы (Lac. Z), Использование Lac. Z как репортера имеет длинную историю количественных исследований. Однако когда используют этот репортер с флуоресцентной бета-галактозидазой в качестве субстрата для локализации экспрессии гена, клетки должны быть подвергнуты фиксации глютаральдегидом требует наличия кислорода для образования и стабилизации светящегося продукта, его созревание происходит в течение нескольких часов и можно столкнуться с проблемой фотовыцветания. Широкое применение находят репортёрные гены, кодирующие флюоресцентные и люминесцентные белки: ген медузы, кодирующий зеленый флуоресцентный белок (англ. GFP), экспрессия которого проявляется в появлении зелёного свечения при освещении синим светом; ген фермента люциферазы, которая катализирует реакцию с люциферином и вызывает свечение; ген красного флуоресцентного белка ds. Red;

Молекулярная биология возникла как наука в 30 х годах двадцатого столетия. С тех пор эта наука расширяется захватывая приграничные области между химией, физикой, биологией. Первоначально молекулярная биология развивалась как биохимия нуклеиновых кислот. В дальнейшем молекулярная биология стала изучать путь передачи наследственной информации и биологического синтеза белковых структур. Сейчас область молекулярной биологии покрывает множество смежных наук, таких как биоинформатика, геномика и т. д. Методы молекулярной биологии делятся на две большие группы. Первая группа занимается исследованием структуры и функции белковых молекул. К этим методам относятся генетические методы модификации первичной структуры белка, всевозможные методы определения наличия белка, а также его функциональной активности, в том числе и ферментативной активности; Методы выделения и очистки белков, а также методы определения пространственных структур белковых молекул, таких как белковая кристаллография. Среди методов работы с генами и нуклеиновыми кислотами в наборе молекулярной биологии можно отметить экспрессию генов, полимерно-цепную реакцию, различные виды блоттинга генов, а также методики по определению последовательностей ДНК.

Спасибо за внимание!!!
янович фабушева презентац.pptx