Л.9.Гет.р-я.ppt
- Количество слайдов: 34
 Гетерогенные равновесия n Равновесие, в котором находится система, состоящая более чем из одной равновесием. фазы, называется гетерогенным n Джозайя Уиллард Гиббс (1839 - 1903) – Американский химик и физико-химик сформулировал основные лежащие в основе гетерогенных равновесий. принципы,
Гетерогенные равновесия n Равновесие, в котором находится система, состоящая более чем из одной равновесием. фазы, называется гетерогенным n Джозайя Уиллард Гиббс (1839 - 1903) – Американский химик и физико-химик сформулировал основные лежащие в основе гетерогенных равновесий. принципы,
 Гетерогенные равновесия n Основные принципы, лежащие в основе гетерогенных равновесий: - система приходит в состояние термодинамического равновесия при установлении термического, механического и химического равновесий между фазами, входящими в состав данной системы d. G = Vd. P - Sd. T + Σ μidni, где объем V, энтропия S и число молей ni компонента i – экстенсивные (зависящие от количества вещества) переменные, а температура Т, давление Р и химический потенциал μi – интенсивные (не зависящие от количества вещества); - при химическом равновесии μi для любого компонента одинаков во всех фазах и перенос вещества через фазовые границы отсутствует.
Гетерогенные равновесия n Основные принципы, лежащие в основе гетерогенных равновесий: - система приходит в состояние термодинамического равновесия при установлении термического, механического и химического равновесий между фазами, входящими в состав данной системы d. G = Vd. P - Sd. T + Σ μidni, где объем V, энтропия S и число молей ni компонента i – экстенсивные (зависящие от количества вещества) переменные, а температура Т, давление Р и химический потенциал μi – интенсивные (не зависящие от количества вещества); - при химическом равновесии μi для любого компонента одинаков во всех фазах и перенос вещества через фазовые границы отсутствует.
 Гетерогенные равновесия n Правило фаз Гиббса: число степеней свободы (F) равновесной термодинамической системы, на которую из внешних факторов влияют только Т и Р, равно числу независимых компонентов системы (K) минус число фаз (N) плюс 2 F = K - N + 2 Число степеней свободы (F) – число независимых интенсивных переменных, которые можно варьировать не изменяя фазового состояния системы. ■ Как и для гомогенной системы константу равновесия процесса можно рассчитать по данным термодинамических функций: Kт = е-∆G 0 /RT
Гетерогенные равновесия n Правило фаз Гиббса: число степеней свободы (F) равновесной термодинамической системы, на которую из внешних факторов влияют только Т и Р, равно числу независимых компонентов системы (K) минус число фаз (N) плюс 2 F = K - N + 2 Число степеней свободы (F) – число независимых интенсивных переменных, которые можно варьировать не изменяя фазового состояния системы. ■ Как и для гомогенной системы константу равновесия процесса можно рассчитать по данным термодинамических функций: Kт = е-∆G 0 /RT
 Равновесие в системе осадок-раствор n Упрощенная схема равновесия осадок Am. Bn - раствор: для соединений с кристаллической решеткой (Вa. SO 4, Ca. SO 4) преобладает процесс (1), а для соединений с молекулярной решеткой (C 6 H 5 COOH, Hg 2 CI 2) – процесс (2).
Равновесие в системе осадок-раствор n Упрощенная схема равновесия осадок Am. Bn - раствор: для соединений с кристаллической решеткой (Вa. SO 4, Ca. SO 4) преобладает процесс (1), а для соединений с молекулярной решеткой (C 6 H 5 COOH, Hg 2 CI 2) – процесс (2).
 Равновесие в системе осадок-раствор ■ Соответствующие константы равновесия (произведения растворимости): K тs = a A m • a B n ; Kcs = [A]m • [B]n; термодинамическое; реальное; (концентрационное) K уs = С A m • С B n ; условное;
Равновесие в системе осадок-раствор ■ Соответствующие константы равновесия (произведения растворимости): K тs = a A m • a B n ; Kcs = [A]m • [B]n; термодинамическое; реальное; (концентрационное) K уs = С A m • С B n ; условное;
 Равновесие в системе осадок-раствор n Правило произведения растворимости: произведение активностей ионов в степенях, равных стехиометрическим коэффициентам, в насыщенном растворе малорастворимого электролита, есть величина постоянная для данного растворителя, температуры и давления. n Связь между различными произведениями растворимости осадка Am. Bn↓ выражается формулами: Ку s = Кc s K тs ———— = —————. Аm • Bn f. Am • f. Bn • Аm • Bn
Равновесие в системе осадок-раствор n Правило произведения растворимости: произведение активностей ионов в степенях, равных стехиометрическим коэффициентам, в насыщенном растворе малорастворимого электролита, есть величина постоянная для данного растворителя, температуры и давления. n Связь между различными произведениями растворимости осадка Am. Bn↓ выражается формулами: Ку s = Кc s K тs ———— = —————. Аm • Bn f. Am • f. Bn • Аm • Bn
 Равновесие в системе осадок-раствор n Растворимость (массовая, молярная, ионная и др. ) есть концентрация вещества (S) в его насыщенном растворе при определенной Ти Р. n Растворимость складывается из концентраций всех форм нахождения данного вещества в растворе (сольватированные ионы А и В, ассоциаты, нейтральные молекулы Аm. Bn). Например, в насыщенном водном растворе Fe 2 O 3 • H 2 O могут существовать частицы Fe(H 2 O)63+, Fe(H 2 O)5(OH)2+, Fe(H 2 O)4(OH)2+, Fe(H 2 O)3(OH)3, Fe 2(OH)2(H 2 O)84+ и др.
Равновесие в системе осадок-раствор n Растворимость (массовая, молярная, ионная и др. ) есть концентрация вещества (S) в его насыщенном растворе при определенной Ти Р. n Растворимость складывается из концентраций всех форм нахождения данного вещества в растворе (сольватированные ионы А и В, ассоциаты, нейтральные молекулы Аm. Bn). Например, в насыщенном водном растворе Fe 2 O 3 • H 2 O могут существовать частицы Fe(H 2 O)63+, Fe(H 2 O)5(OH)2+, Fe(H 2 O)4(OH)2+, Fe(H 2 O)3(OH)3, Fe 2(OH)2(H 2 O)84+ и др.
 Равновесие в системе осадок-раствор n При растворении в 1 л S моль осадка Am. Bn его ионы переходят в раствор в стехиометрических количествах: Тогда: Am. Bn ↔ (ms)m • (ns)n Kтs = a. Am • a. Bn = (ms)m • f. Am • Аm • (ns)n • f. Bn • Bn n Ионная растворимость (S): Kтs Kуs S = m+n√——————— = m+n√—————. mm • nn • f. Am • Аm • f. Bn • Bn mm • n n
Равновесие в системе осадок-раствор n При растворении в 1 л S моль осадка Am. Bn его ионы переходят в раствор в стехиометрических количествах: Тогда: Am. Bn ↔ (ms)m • (ns)n Kтs = a. Am • a. Bn = (ms)m • f. Am • Аm • (ns)n • f. Bn • Bn n Ионная растворимость (S): Kтs Kуs S = m+n√——————— = m+n√—————. mm • nn • f. Am • Аm • f. Bn • Bn mm • n n
 Равновесие в системе осадок-раствор n В присутствии избытка одноименного иона, например, А растворимость осадка Am. Bn определяется концентрацией иона В (n. S = CВ ): Kуs = (CA)m • (ns)n, отсюда Kуs S = n √———— ; (CA)m Kуs S = m √———— если избыток B. (CB)n
Равновесие в системе осадок-раствор n В присутствии избытка одноименного иона, например, А растворимость осадка Am. Bn определяется концентрацией иона В (n. S = CВ ): Kуs = (CA)m • (ns)n, отсюда Kуs S = n √———— ; (CA)m Kуs S = m √———— если избыток B. (CB)n
 Равновесие в системе осадок-раствор n Молекулярная растворимость (S 0): обусловлена наличием в растворе нейтральных молекул Am. Bn(тв) ↔ Am. Bn(р-р) = S 0 Молекулярная растворимость для данных Т, Р и растворителя есть величина постоянная и не зависящая от концентрации одноименного иона. n Расчет значений S 0: - малорастворимые комплексы состава [АВ] [AB] β = ———; Ks = [A] [B]; [AB] = S 0 = β • Ks. [A] [B] n
Равновесие в системе осадок-раствор n Молекулярная растворимость (S 0): обусловлена наличием в растворе нейтральных молекул Am. Bn(тв) ↔ Am. Bn(р-р) = S 0 Молекулярная растворимость для данных Т, Р и растворителя есть величина постоянная и не зависящая от концентрации одноименного иона. n Расчет значений S 0: - малорастворимые комплексы состава [АВ] [AB] β = ———; Ks = [A] [B]; [AB] = S 0 = β • Ks. [A] [B] n
 Равновесие в системе осадок-раствор n Расчет значений S 0: - малорастворимые кислоты типа НА [H] [A] Ks Ka = ———— = ———; [HA] = S 0 = Ks/ Ka. [HA] n Общая растворимость (SΣ): - для электролита АВ в отсутствии побочных реакций и избытка одноименных ионов SΣ = √Ks + S 0; - для малорастворимых сильных электролитов √Ks >> S 0; - для малорастворимых слабых электролитов S 0 >> √Ks.
Равновесие в системе осадок-раствор n Расчет значений S 0: - малорастворимые кислоты типа НА [H] [A] Ks Ka = ———— = ———; [HA] = S 0 = Ks/ Ka. [HA] n Общая растворимость (SΣ): - для электролита АВ в отсутствии побочных реакций и избытка одноименных ионов SΣ = √Ks + S 0; - для малорастворимых сильных электролитов √Ks >> S 0; - для малорастворимых слабых электролитов S 0 >> √Ks.
 Равновесие в системе осадок-раствор n Растворимость нахождения. рассчитывают с учетом всех форм
Равновесие в системе осадок-раствор n Растворимость нахождения. рассчитывают с учетом всех форм
 Расчеты растворимости осадков
Расчеты растворимости осадков
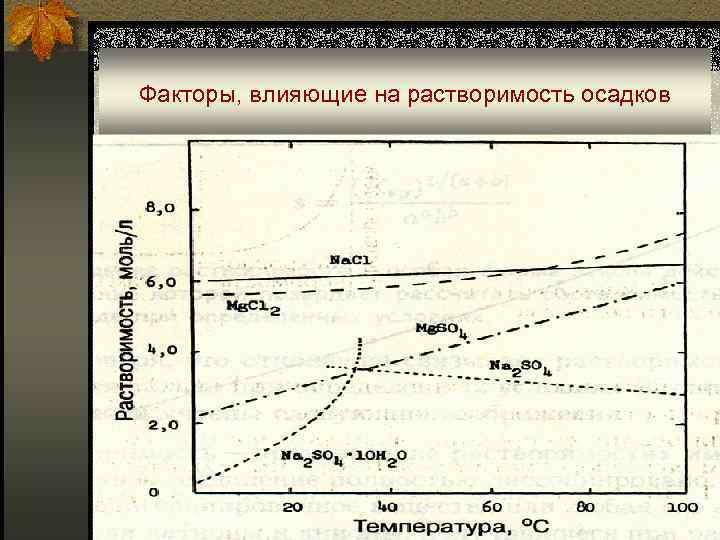
 Факторы, влияющие на растворимость осадков n Температура: при ∆H < 0 (экзотермические процессы) величина КS 0 с ростом Т уменьшается; при ∆H > 0 (эндотермические процессы) величина КS 0 с ростом Т увеличивается; в подавляющем большинстве случаев процессы растворения твердых веществ – эндотермические.
Факторы, влияющие на растворимость осадков n Температура: при ∆H < 0 (экзотермические процессы) величина КS 0 с ростом Т уменьшается; при ∆H > 0 (эндотермические процессы) величина КS 0 с ростом Т увеличивается; в подавляющем большинстве случаев процессы растворения твердых веществ – эндотермические.
 Факторы, влияющие на растворимость осадков
Факторы, влияющие на растворимость осадков
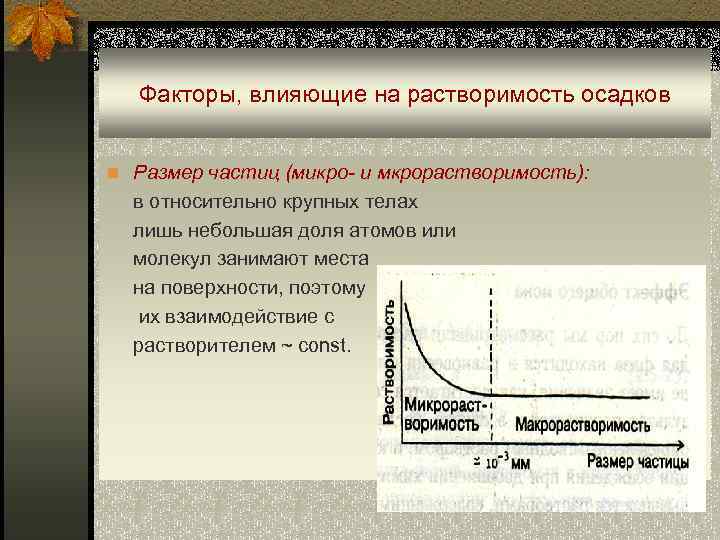 Факторы, влияющие на растворимость осадков n Размер частиц (микро- и мкрорастворимость): в относительно крупных телах лишь небольшая доля атомов или молекул занимают места на поверхности, поэтому их взаимодействие с растворителем ~ const.
Факторы, влияющие на растворимость осадков n Размер частиц (микро- и мкрорастворимость): в относительно крупных телах лишь небольшая доля атомов или молекул занимают места на поверхности, поэтому их взаимодействие с растворителем ~ const.
 Факторы, влияющие на растворимость осадков n Влияние одноименного иона. n При большом избытке одноименного иона, вследствие «солевого эффекта» (обусловленного увеличением ионной силы) и образования растворимых комплексов может наблюдаться увеличение растворимости. n Пример: Ag. CI↓+ Na. CI (0, 01 M) ↔ Ag. CI + Ag. CI 32 - Ag. CI 2 - + (β 1 = 5, 0 • 102; β 2 = 1, 7 • 105; β 3 = 1, 1 • 105) S = [Ag+] + [Ag. CI 2 -] + [Ag. CI 3 2 -] = Ks / [CI-] + S 0 (Ks • β 1) + Ks • β 2 • [CI-] + Ks • β 3 • [CI-]2.
Факторы, влияющие на растворимость осадков n Влияние одноименного иона. n При большом избытке одноименного иона, вследствие «солевого эффекта» (обусловленного увеличением ионной силы) и образования растворимых комплексов может наблюдаться увеличение растворимости. n Пример: Ag. CI↓+ Na. CI (0, 01 M) ↔ Ag. CI + Ag. CI 32 - Ag. CI 2 - + (β 1 = 5, 0 • 102; β 2 = 1, 7 • 105; β 3 = 1, 1 • 105) S = [Ag+] + [Ag. CI 2 -] + [Ag. CI 3 2 -] = Ks / [CI-] + S 0 (Ks • β 1) + Ks • β 2 • [CI-] + Ks • β 3 • [CI-]2.
 Факторы, влияющие на растворимость осадков n Влияние одноименного иона: S = 1, 8 • 10 -10 /1. 0 • 10 -2 + 9, 0 • 10 -8 + 1, 8 • 10 -10 • 1, 7 • 105 • 1. 0 • 10 -2 + 1, 8 • 10 -10 • 1, 1 • 105 • 1. 0 • 10 -4 = 4, 2 • 10 -7; основной вклад в растворимость вносят [Ag. CI] и [Ag. CI 2 -] : d. SAg. CI Ks ——— = - —— + Ks • β 2; d. S[CI-] [CI]2 [CI]min = √ Ks / Ks • β 2 ~ 2, 4 • 10 -2 M;
Факторы, влияющие на растворимость осадков n Влияние одноименного иона: S = 1, 8 • 10 -10 /1. 0 • 10 -2 + 9, 0 • 10 -8 + 1, 8 • 10 -10 • 1, 7 • 105 • 1. 0 • 10 -2 + 1, 8 • 10 -10 • 1, 1 • 105 • 1. 0 • 10 -4 = 4, 2 • 10 -7; основной вклад в растворимость вносят [Ag. CI] и [Ag. CI 2 -] : d. SAg. CI Ks ——— = - —— + Ks • β 2; d. S[CI-] [CI]2 [CI]min = √ Ks / Ks • β 2 ~ 2, 4 • 10 -2 M;
 Факторы, влияющие на растворимость осадков n Влияние конкурирующих реакций: Kтs S = m+n√——————— mm • nn • f. Am • Аm • f. Bn • Bn
Факторы, влияющие на растворимость осадков n Влияние конкурирующих реакций: Kтs S = m+n√——————— mm • nn • f. Am • Аm • f. Bn • Bn
 Факторы, влияющие на растворимость осадков n Протолитические конкурирующие реакции: B K a, 1 • Ka, 2 • Ka, 3 • • • Ka, n = ——————————————. [H 3 O+]n + Ka, 1 • [H 3 O+]n-1 + Ka, 1 • Ka, 2 • [H 3 O+]n-2 + Ka, 1 • Ka, 2 • • • Ka, n
Факторы, влияющие на растворимость осадков n Протолитические конкурирующие реакции: B K a, 1 • Ka, 2 • Ka, 3 • • • Ka, n = ——————————————. [H 3 O+]n + Ka, 1 • [H 3 O+]n-1 + Ka, 1 • Ka, 2 • [H 3 O+]n-2 + Ka, 1 • Ka, 2 • • • Ka, n
 Факторы, влияющие на растворимость осадков n Протолитические конкурирующие реакции: Kтs S = m+n√——————— mm • nn • f. Am • Аm • f. Bn • Bn
Факторы, влияющие на растворимость осадков n Протолитические конкурирующие реакции: Kтs S = m+n√——————— mm • nn • f. Am • Аm • f. Bn • Bn
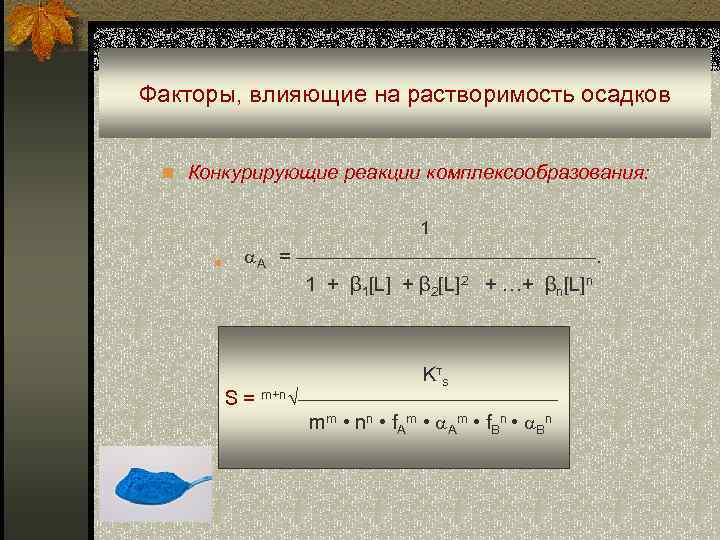 Факторы, влияющие на растворимость осадков n Конкурирующие реакции комплексообразования: 1 n A = ————————. 1 + β 1[L] + β 2[L]2 + …+ βn[L]n Kтs S = m+n√——————— mm • nn • f. Am • Аm • f. Bn • Bn
Факторы, влияющие на растворимость осадков n Конкурирующие реакции комплексообразования: 1 n A = ————————. 1 + β 1[L] + β 2[L]2 + …+ βn[L]n Kтs S = m+n√——————— mm • nn • f. Am • Аm • f. Bn • Bn
 Факторы, влияющие на растворимость осадков n Конкурирующие реакции комплексообразования:
Факторы, влияющие на растворимость осадков n Конкурирующие реакции комплексообразования:
 Использование процессов осаждения и растворения в анализе n Обнаружение ионов (САm • CBn > KSу): Hg. CI 2 + 2 KI ↔ Hg. I 2↓ + 2 KCI Hg. I 2↓ + 2 KI ↔ K 2[Hg. I 4] n Отделение мешающего иона (CA ≤ 10 -6 M): ПРт. Аm. Bn CA = m√ ————— ≤ 10 -6 M; CBn • f. Am • Am обнаружению К+ по реакции с Na. HC 4 H 4 O 6 мешает NH 4+, который маскируют в виде осадка с формальдегидом: 4 NH 4 CI + 6 CH 2 O + 2 Na 2 CO 3 ↔ (CH 2)6 N 4↓ + 8 H 2 O + 2 CO 2 + 4 Na. CI, после этого определяют К+ KCI + Na. HC 4 H 4 O 6 ↔ KHC 4 H 4 O 6↓ + Na. CI
Использование процессов осаждения и растворения в анализе n Обнаружение ионов (САm • CBn > KSу): Hg. CI 2 + 2 KI ↔ Hg. I 2↓ + 2 KCI Hg. I 2↓ + 2 KI ↔ K 2[Hg. I 4] n Отделение мешающего иона (CA ≤ 10 -6 M): ПРт. Аm. Bn CA = m√ ————— ≤ 10 -6 M; CBn • f. Am • Am обнаружению К+ по реакции с Na. HC 4 H 4 O 6 мешает NH 4+, который маскируют в виде осадка с формальдегидом: 4 NH 4 CI + 6 CH 2 O + 2 Na 2 CO 3 ↔ (CH 2)6 N 4↓ + 8 H 2 O + 2 CO 2 + 4 Na. CI, после этого определяют К+ KCI + Na. HC 4 H 4 O 6 ↔ KHC 4 H 4 O 6↓ + Na. CI
 Использование процессов осаждения и растворения в анализе n Разделение (обнаружение) ионов при контролируемой концентрации осадителя пример 1: разделить 0, 1 M Fe 3+ и Mg 2+ с помощью OH- → ? ПРт. Fe(OH)3 = 4 • 10 -38; ПРт. Mg(OH)2 = 1, 8 • 10 -11; приняв fi, I = 1, получаем 1 • 10 -6 • [OH-]3 = 4 • 10 -38; [OH-] = 3, 4 • 10 -11 M; 0, 1 • [OH-]2 = 1, 8 • 10 -11; [OH-] = 1, 3 • 10 -5 M; таким образом, если поддерживать [OH-] в интервале 3, 4 • 10 -11 M - 1, 3 • 10 -5 M, получим Fe(OH)3↓ в осадке, а Mg 2+ в растворе;
Использование процессов осаждения и растворения в анализе n Разделение (обнаружение) ионов при контролируемой концентрации осадителя пример 1: разделить 0, 1 M Fe 3+ и Mg 2+ с помощью OH- → ? ПРт. Fe(OH)3 = 4 • 10 -38; ПРт. Mg(OH)2 = 1, 8 • 10 -11; приняв fi, I = 1, получаем 1 • 10 -6 • [OH-]3 = 4 • 10 -38; [OH-] = 3, 4 • 10 -11 M; 0, 1 • [OH-]2 = 1, 8 • 10 -11; [OH-] = 1, 3 • 10 -5 M; таким образом, если поддерживать [OH-] в интервале 3, 4 • 10 -11 M - 1, 3 • 10 -5 M, получим Fe(OH)3↓ в осадке, а Mg 2+ в растворе;
 Использование процессов осаждения и растворения в анализе n Разделение (обнаружение) ионов при контролируемой концентрации осадителя пример 2: найти условия количественного разделения 0, 1 М Pb 2+ и TI+ с помощью H 2 S; ПРт. Pb. S = 7 • 10 -28; ПРт. TI 2 S = 1, 0 • 10 -22; приняв fi, I = 1, получаем 1 • 10 -6 • [S 2 -] = 7 • 10 -28; [S 2 -] = 7, 0 • 10 -22 M; (0, 1)2 • [S 2 -] = 1 • 10 -22; [S 2 -] = 1, 0 • 10 -20 M; т. о. , поддерживая [S 2 -] в интервале 7, 0 • 10 -22 - 1, 0 • 10 -20 M, получим осадок Pb. S↓ и TI+ в растворе.
Использование процессов осаждения и растворения в анализе n Разделение (обнаружение) ионов при контролируемой концентрации осадителя пример 2: найти условия количественного разделения 0, 1 М Pb 2+ и TI+ с помощью H 2 S; ПРт. Pb. S = 7 • 10 -28; ПРт. TI 2 S = 1, 0 • 10 -22; приняв fi, I = 1, получаем 1 • 10 -6 • [S 2 -] = 7 • 10 -28; [S 2 -] = 7, 0 • 10 -22 M; (0, 1)2 • [S 2 -] = 1 • 10 -22; [S 2 -] = 1, 0 • 10 -20 M; т. о. , поддерживая [S 2 -] в интервале 7, 0 • 10 -22 - 1, 0 • 10 -20 M, получим осадок Pb. S↓ и TI+ в растворе.
 Использование процессов осаждения и растворения в анализе n Разделение (обнаружение) ионов при контролируемой концентрации осадителя ([S 2 -] в интервале 7, 0 • 10 -22 - 1, 0 • 10 -20 M): CS = [S 2 -] + [HS-] + [H 2 S]; S 2 - = [S 2 -] / CS; растворимость H 2 S в воде составляет около 0, 1 М, тогда 1 = 7, 0 • 10 -22 /0, 1 = 7, 0 • 10 -21; 2 = 1, 0 • 10 -20 /0, 1 = 1, 0 • 10 -19; [H 3 O+]2 • [S 2 -] [H 3 O+]2 • { [S 2 -]} Ka, 1 • Ka, 2 = —————— { S 2 - } [H 2 S] {CS 2 -} для 1 [H 3 O+] = √ Ka, 1 • Ka, 2 / 1 = √ 6, 8 • 10 -23 / 7, 0 • 10 -21 ~ 0, 1 M; для 2 [H 3 O+] = √ Ka, 1 • Ka, 2 / 2 = √ 6, 8 • 10 -23 / 1, 0 • 10 -19 ~ 0, 03 M.
Использование процессов осаждения и растворения в анализе n Разделение (обнаружение) ионов при контролируемой концентрации осадителя ([S 2 -] в интервале 7, 0 • 10 -22 - 1, 0 • 10 -20 M): CS = [S 2 -] + [HS-] + [H 2 S]; S 2 - = [S 2 -] / CS; растворимость H 2 S в воде составляет около 0, 1 М, тогда 1 = 7, 0 • 10 -22 /0, 1 = 7, 0 • 10 -21; 2 = 1, 0 • 10 -20 /0, 1 = 1, 0 • 10 -19; [H 3 O+]2 • [S 2 -] [H 3 O+]2 • { [S 2 -]} Ka, 1 • Ka, 2 = —————— { S 2 - } [H 2 S] {CS 2 -} для 1 [H 3 O+] = √ Ka, 1 • Ka, 2 / 1 = √ 6, 8 • 10 -23 / 7, 0 • 10 -21 ~ 0, 1 M; для 2 [H 3 O+] = √ Ka, 1 • Ka, 2 / 2 = √ 6, 8 • 10 -23 / 1, 0 • 10 -19 ~ 0, 03 M.
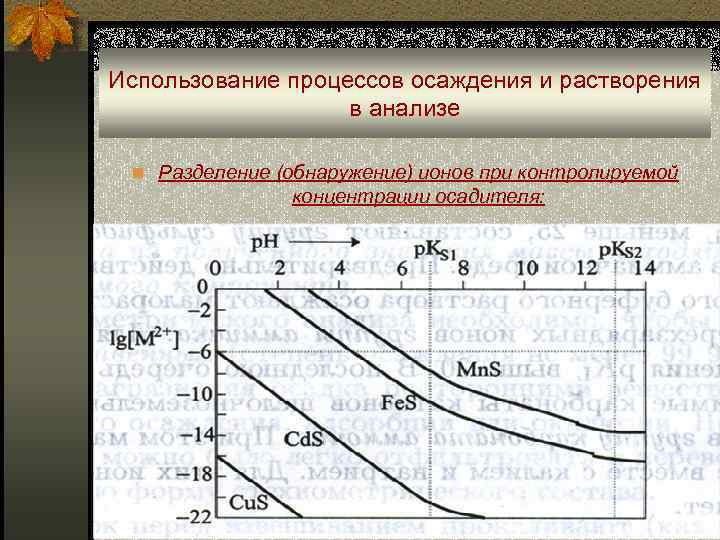 Использование процессов осаждения и растворения в анализе n Разделение (обнаружение) ионов при контролируемой концентрации осадителя:
Использование процессов осаждения и растворения в анализе n Разделение (обнаружение) ионов при контролируемой концентрации осадителя:
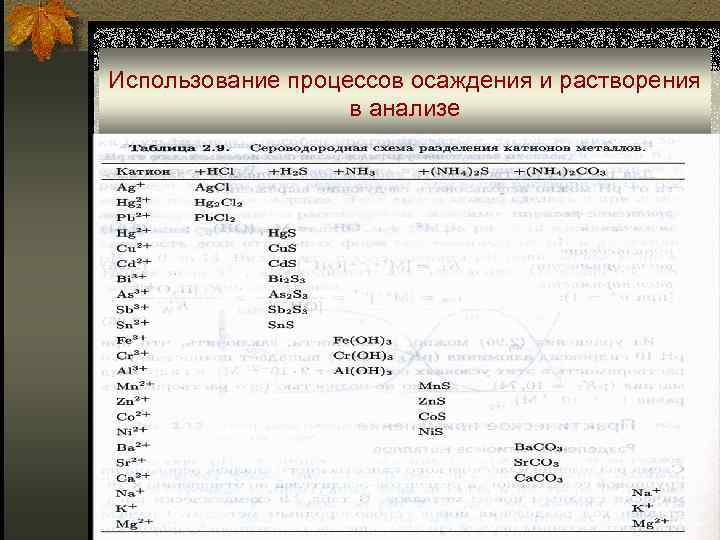 Использование процессов осаждения и растворения в анализе
Использование процессов осаждения и растворения в анализе
 Использование процессов осаждения и растворения в анализе ■ Превращение одних малорастворимых соединений в другие: Ba. SO 4 → Ba. CO 3 ; ПРBa. SO 4 = 1 • 10 -10; ПРBa. CO 3 = 5, 1 • 10 -9; [Ba 2+] • [CO 32 -] > ПРBa. CO 3; отсюда [Ba 2+] > ПРBa. CO 3 / [CO 32 -]; ПРBa. SO 4 ПРBa. CO 3 [CO 32 -] ПРBa. CO 3 5, 1 • 10 -9; ———— > ———— или ———— > ————. [SO 42 -] [CO 32 -] [SO 42 -] ПРBa. SO 4 1 • 10 -10
Использование процессов осаждения и растворения в анализе ■ Превращение одних малорастворимых соединений в другие: Ba. SO 4 → Ba. CO 3 ; ПРBa. SO 4 = 1 • 10 -10; ПРBa. CO 3 = 5, 1 • 10 -9; [Ba 2+] • [CO 32 -] > ПРBa. CO 3; отсюда [Ba 2+] > ПРBa. CO 3 / [CO 32 -]; ПРBa. SO 4 ПРBa. CO 3 [CO 32 -] ПРBa. CO 3 5, 1 • 10 -9; ———— > ———— или ———— > ————. [SO 42 -] [CO 32 -] [SO 42 -] ПРBa. SO 4 1 • 10 -10
 Использование процессов осаждения и растворения в анализе ■ Растворение осадков (протолитические конкурирующие реакции): M(OH)n↓ ↔ Mn+ + n. OH- + n. H+ ↔ n. H 2 O M(OH)n↓ + n. H+ ↔ n. H 2 O + Mn+ a. Mn+ ПРт. M(OH)n Kw • n√ 1 • 10 -6 K = ————; an. H+ = —————— n√ ПРт an. H+ Kn w M(OH)n
Использование процессов осаждения и растворения в анализе ■ Растворение осадков (протолитические конкурирующие реакции): M(OH)n↓ ↔ Mn+ + n. OH- + n. H+ ↔ n. H 2 O M(OH)n↓ + n. H+ ↔ n. H 2 O + Mn+ a. Mn+ ПРт. M(OH)n Kw • n√ 1 • 10 -6 K = ————; an. H+ = —————— n√ ПРт an. H+ Kn w M(OH)n
 Использование процессов осаждения и растворения в анализе n Растворение осадков: n при [H 3 O+] = 1 M полностью растворяются ПР M(OH) 10 -20 M(OH)2 10 -34 M(OH)3 10 -48 M(OH)4 10 -62 Am. Bn + nm H 3 O+ ↔ m. An+ + n. BHm + nm H 2 O Kтs • ([H 3 O+]n + Ka, 1 • [H 3 O+]n-1 + Ka, 1 • Ka, 2 • • • Ka, n)n S = m+n√———————————— mm • nn • f. Am • Аm • f. Bn • (Ka, 1 • Ka, 2 • Ka, 3 • • • Ka, n)n
Использование процессов осаждения и растворения в анализе n Растворение осадков: n при [H 3 O+] = 1 M полностью растворяются ПР M(OH) 10 -20 M(OH)2 10 -34 M(OH)3 10 -48 M(OH)4 10 -62 Am. Bn + nm H 3 O+ ↔ m. An+ + n. BHm + nm H 2 O Kтs • ([H 3 O+]n + Ka, 1 • [H 3 O+]n-1 + Ka, 1 • Ka, 2 • • • Ka, n)n S = m+n√———————————— mm • nn • f. Am • Аm • f. Bn • (Ka, 1 • Ka, 2 • Ka, 3 • • • Ka, n)n
 Использование процессов осаждения и растворения в анализе n Растворение осадков (конкурирующие реакции комплексообразования): n Ag. Br↓ ↔ Ag+ + Brn Ag+ + n. NH 3 ↔ Ag[(NH 3)n ]+ Am. Bn + nm L- ↔ m. ALn + n. Bm. Kтs • (1 + β 1[L] + β 2[L]2 + …+ βn[L]n)m S = m+n√——————————. mm • nn • f. Am • Bn • f. Bn
Использование процессов осаждения и растворения в анализе n Растворение осадков (конкурирующие реакции комплексообразования): n Ag. Br↓ ↔ Ag+ + Brn Ag+ + n. NH 3 ↔ Ag[(NH 3)n ]+ Am. Bn + nm L- ↔ m. ALn + n. Bm. Kтs • (1 + β 1[L] + β 2[L]2 + …+ βn[L]n)m S = m+n√——————————. mm • nn • f. Am • Bn • f. Bn
 Использование процессов осаждения и растворения в анализе n Растворение осадков (конкурирующие реакции окисления- восстановления): Hg 2 CI 2↓ (H 2 O 2) → Hg. CI 2↓ Hg. S↓ + CI 2 ↔ Hg. CI 2↓ + S↓
Использование процессов осаждения и растворения в анализе n Растворение осадков (конкурирующие реакции окисления- восстановления): Hg 2 CI 2↓ (H 2 O 2) → Hg. CI 2↓ Hg. S↓ + CI 2 ↔ Hg. CI 2↓ + S↓


