Geterocikli-V-11.ppt
- Количество слайдов: 14
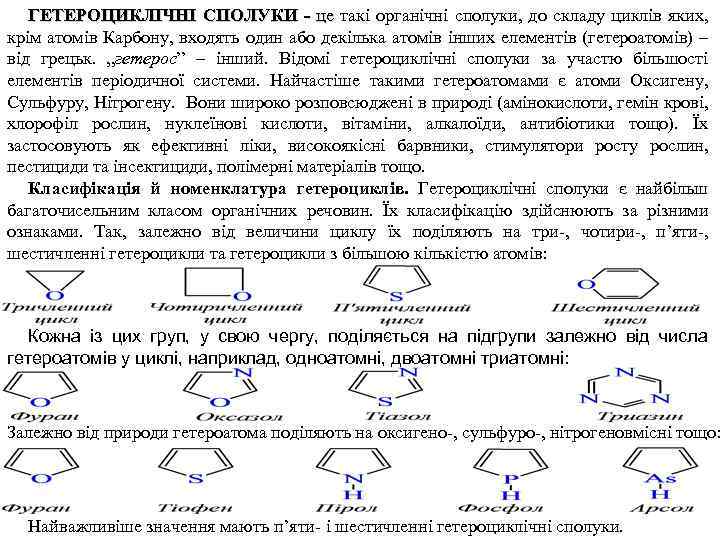 ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ - це такі органічні сполуки, до складу циклів яких, крім атомів Карбону, входять один або декілька атомів інших елементів (гетероатомів) – від грецьк. „гетерос” – інший. Відомі гетероциклічні сполуки за участю більшості елементів періодичної системи. Найчастіше такими гетероатомами є атоми Оксигену, Сульфуру, Нітрогену. Вони широко розповсюджені в природі (амінокислоти, гемін крові, хлорофіл рослин, нуклеїнові кислоти, вітаміни, алкалоїди, антибіотики тощо). Їх застосовують як ефективні ліки, високоякісні барвники, стимулятори росту рослин, пестициди та інсектициди, полімерні матеріалів тощо. Класифікація й номенклатура гетероциклів. Гетероциклічні сполуки є найбільш багаточисельним класом органічних речовин. Їх класифікацію здійснюють за різними ознаками. Так, залежно від величини циклу їх поділяють на три , чотири , п’яти , шестичленні гетероцикли та гетероцикли з більшою кількістю атомів: Кожна із цих груп, у свою чергу, поділяється на підгрупи залежно від числа гетероатомів у циклі, наприклад, одноатомні, двоатомні триатомні: Залежно від природи гетероатома поділяють на оксигено , сульфуро , нітрогеновмісні тощо: Найважливіше значення мають п’яти і шестичленні гетероциклічні сполуки.
ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ - це такі органічні сполуки, до складу циклів яких, крім атомів Карбону, входять один або декілька атомів інших елементів (гетероатомів) – від грецьк. „гетерос” – інший. Відомі гетероциклічні сполуки за участю більшості елементів періодичної системи. Найчастіше такими гетероатомами є атоми Оксигену, Сульфуру, Нітрогену. Вони широко розповсюджені в природі (амінокислоти, гемін крові, хлорофіл рослин, нуклеїнові кислоти, вітаміни, алкалоїди, антибіотики тощо). Їх застосовують як ефективні ліки, високоякісні барвники, стимулятори росту рослин, пестициди та інсектициди, полімерні матеріалів тощо. Класифікація й номенклатура гетероциклів. Гетероциклічні сполуки є найбільш багаточисельним класом органічних речовин. Їх класифікацію здійснюють за різними ознаками. Так, залежно від величини циклу їх поділяють на три , чотири , п’яти , шестичленні гетероцикли та гетероцикли з більшою кількістю атомів: Кожна із цих груп, у свою чергу, поділяється на підгрупи залежно від числа гетероатомів у циклі, наприклад, одноатомні, двоатомні триатомні: Залежно від природи гетероатома поділяють на оксигено , сульфуро , нітрогеновмісні тощо: Найважливіше значення мають п’яти і шестичленні гетероциклічні сполуки.
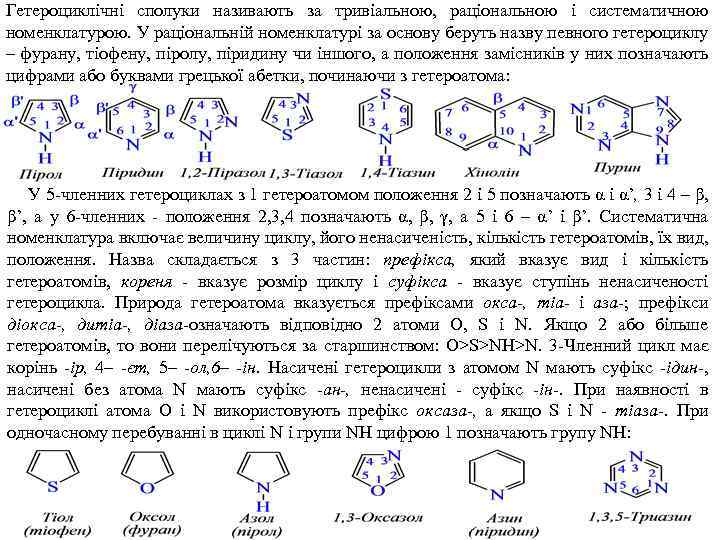 Гетероциклічні сполуки називають за тривіальною, раціональною і систематичною номенклатурою. У раціональній номенклатурі за основу беруть назву певного гетероциклу – фурану, тіофену, піролу, піридину чи іншого, а положення замісників у них позначають цифрами або буквами грецької абетки, починаючи з гетероатома: У 5 членних гетероциклах з 1 гетероатомом положення 2 і 5 позначають α і α’, 3 і 4 – β, β’, а у 6 членних положення 2, 3, 4 позначають α, β, γ, а 5 і 6 – α’ і β’. Систематична номенклатура включає величину циклу, його ненасиченість, кількість гетероатомів, їх вид, положення. Назва складається з 3 частин: префікса, який вказує вид і кількість гетероатомів, кореня - вказує розмір циклу і суфікса вказує ступінь ненасиченості гетероцикла. Природа гетероатома вказується префіксами окса-, тіа- і аза-; префікси діокса-, дитіа-, діаза-означають відповідно 2 атоми O, S і N. Якщо 2 або більше гетероатомів, то вони перелічуються за старшинством: O>S>NH>N. 3 Членний цикл має корінь -ір, 4– -єт, 5– -ол, 6– -ін. Насичені гетероцикли з атомом N мають суфікс ідин , насичені без атома N мають суфікс -ан-, ненасичені суфікс -ін-. При наявності в гетероциклі атома О і N використовують префікс оксаза-, а якщо S і N тіаза-. При одночасному перебуванні в циклі N і групи NH цифрою 1 позначають групу NH:
Гетероциклічні сполуки називають за тривіальною, раціональною і систематичною номенклатурою. У раціональній номенклатурі за основу беруть назву певного гетероциклу – фурану, тіофену, піролу, піридину чи іншого, а положення замісників у них позначають цифрами або буквами грецької абетки, починаючи з гетероатома: У 5 членних гетероциклах з 1 гетероатомом положення 2 і 5 позначають α і α’, 3 і 4 – β, β’, а у 6 членних положення 2, 3, 4 позначають α, β, γ, а 5 і 6 – α’ і β’. Систематична номенклатура включає величину циклу, його ненасиченість, кількість гетероатомів, їх вид, положення. Назва складається з 3 частин: префікса, який вказує вид і кількість гетероатомів, кореня - вказує розмір циклу і суфікса вказує ступінь ненасиченості гетероцикла. Природа гетероатома вказується префіксами окса-, тіа- і аза-; префікси діокса-, дитіа-, діаза-означають відповідно 2 атоми O, S і N. Якщо 2 або більше гетероатомів, то вони перелічуються за старшинством: O>S>NH>N. 3 Членний цикл має корінь -ір, 4– -єт, 5– -ол, 6– -ін. Насичені гетероцикли з атомом N мають суфікс ідин , насичені без атома N мають суфікс -ан-, ненасичені суфікс -ін-. При наявності в гетероциклі атома О і N використовують префікс оксаза-, а якщо S і N тіаза-. При одночасному перебуванні в циклі N і групи NH цифрою 1 позначають групу NH:
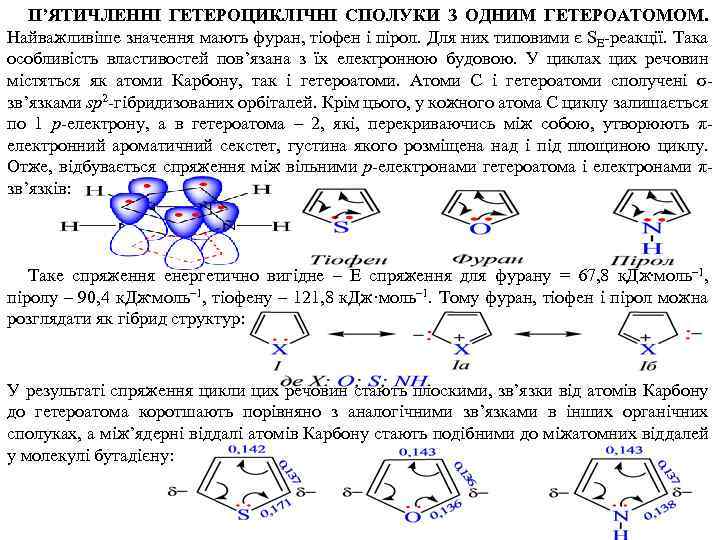 П’ЯТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ. Найважливіше значення мають фуран, тіофен і пірол. Для них типовими є SE реакції. Така особливість властивостей пов’язана з їх електронною будовою. У циклах цих речовин містяться як атоми Карбону, так і гетероатоми. Атоми С і гетероатоми сполучені σ зв’язками sp 2 гібридизованих орбіталей. Крім цього, у кожного атома С циклу залишається по 1 р електрону, а в гетероатома – 2, які, перекриваючись між собою, утворюють π електронний ароматичний секстет, густина якого розміщена над і під площиною циклу. Отже, відбувається спряження між вільними р електронами гетероатома і електронами π зв’язків: Таке спряження енергетично вигідне – Е спряження для фурану = 67, 8 к. Дж. моль– 1, піролу – 90, 4 к. Дж. моль– 1, тіофену – 121, 8 к. Дж·моль– 1. Тому фуран, тіофен і пірол можна розглядати як гібрид структур: У результаті спряження цикли цих речовин стають плоскими, зв’язки від атомів Карбону до гетероатома коротшають порівняно з аналогічними зв’язками в інших органічних сполуках, а між’ядерні віддалі атомів Карбону стають подібними до міжатомних віддалей у молекулі бутадієну:
П’ЯТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ. Найважливіше значення мають фуран, тіофен і пірол. Для них типовими є SE реакції. Така особливість властивостей пов’язана з їх електронною будовою. У циклах цих речовин містяться як атоми Карбону, так і гетероатоми. Атоми С і гетероатоми сполучені σ зв’язками sp 2 гібридизованих орбіталей. Крім цього, у кожного атома С циклу залишається по 1 р електрону, а в гетероатома – 2, які, перекриваючись між собою, утворюють π електронний ароматичний секстет, густина якого розміщена над і під площиною циклу. Отже, відбувається спряження між вільними р електронами гетероатома і електронами π зв’язків: Таке спряження енергетично вигідне – Е спряження для фурану = 67, 8 к. Дж. моль– 1, піролу – 90, 4 к. Дж. моль– 1, тіофену – 121, 8 к. Дж·моль– 1. Тому фуран, тіофен і пірол можна розглядати як гібрид структур: У результаті спряження цикли цих речовин стають плоскими, зв’язки від атомів Карбону до гетероатома коротшають порівняно з аналогічними зв’язками в інших органічних сполуках, а між’ядерні віддалі атомів Карбону стають подібними до міжатомних віддалей у молекулі бутадієну:
 Утворення в циклах цих сполук молекулярної орбіталі з шести π електронів (число π електронів відповідає правилу ароматичності Xюккеля: 4 n + 2, п=1) приводить до того, що ці речовини виявляють ароматичні властивості. Гетероатом у цих сполуках виявляє +М ефект і –I ефект. Реакційна здатність гетероциклів визначається густиною π електронного секстету, тому основний вплив на властивості фурану, тіофену, піролу має М ефект. У фурану, тіофену, піролу, на відміну від бензену, спостерігається нерівномірний розподіл π електронної густини в молекулі вона зміщена від гетероатома в бік атомів С циклу і найбільша в α, α’ положеннях. Оскільки в циклах цих сполук електронна густина більша, ніж у бензену, то фуран, тіофен, пірол активніші до SE реакцій, ніж бензен. За здатністю до реакцій електрофільного заміщення фуран, пірол і тіофен можна розмістити в такий ряд: За ароматичністю п’ятичленні гетероцикли розміщуються в такий ряд: Фізико хімічні властивості гетероциклічних сполук залежать від природи гетероатома та характеру зв’язків у циклі. Якщо гетероцикли не мають у кільці спряження, то нагадують аліциклічні сполуки. Наприклад: За хімічними властивостями вони суттєво не відрізняються від аміну та етеру відповідно. Якщо ж у циклі є спряжені подвійні зв’язки, то за хімічними властивостями вони нагадують ароматичні сполуки, тому їх називають ароматичними гетероциклами.
Утворення в циклах цих сполук молекулярної орбіталі з шести π електронів (число π електронів відповідає правилу ароматичності Xюккеля: 4 n + 2, п=1) приводить до того, що ці речовини виявляють ароматичні властивості. Гетероатом у цих сполуках виявляє +М ефект і –I ефект. Реакційна здатність гетероциклів визначається густиною π електронного секстету, тому основний вплив на властивості фурану, тіофену, піролу має М ефект. У фурану, тіофену, піролу, на відміну від бензену, спостерігається нерівномірний розподіл π електронної густини в молекулі вона зміщена від гетероатома в бік атомів С циклу і найбільша в α, α’ положеннях. Оскільки в циклах цих сполук електронна густина більша, ніж у бензену, то фуран, тіофен, пірол активніші до SE реакцій, ніж бензен. За здатністю до реакцій електрофільного заміщення фуран, пірол і тіофен можна розмістити в такий ряд: За ароматичністю п’ятичленні гетероцикли розміщуються в такий ряд: Фізико хімічні властивості гетероциклічних сполук залежать від природи гетероатома та характеру зв’язків у циклі. Якщо гетероцикли не мають у кільці спряження, то нагадують аліциклічні сполуки. Наприклад: За хімічними властивостями вони суттєво не відрізняються від аміну та етеру відповідно. Якщо ж у циклі є спряжені подвійні зв’язки, то за хімічними властивостями вони нагадують ароматичні сполуки, тому їх називають ароматичними гетероциклами.
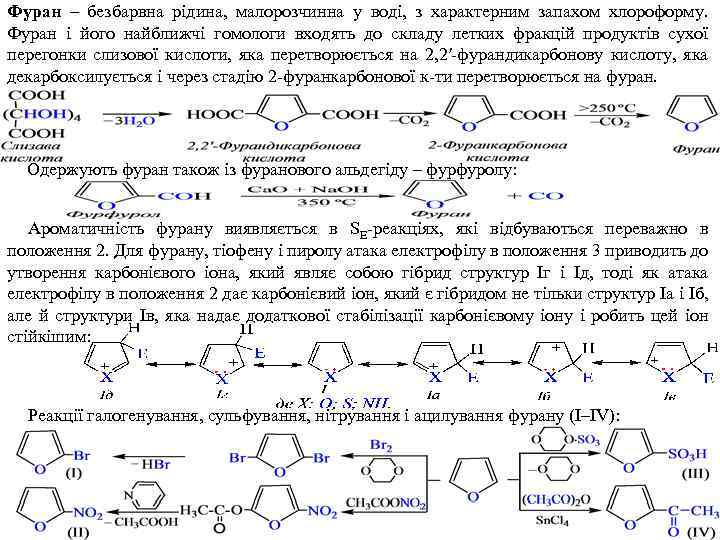 Фуран – безбарвна рідина, малорозчинна у воді, з характерним запахом хлороформу. Фуран і його найближчі гомологи входять до складу летких фракцій продуктів сухої перегонки слизової кислоти, яка перетворюється на 2, 2′‑фурандикарбонову кислоту, яка декарбоксилується і через стадію 2 фуранкарбонової к ти перетворюється на фуран. Одержують фуран також із фуранового альдегіду – фурфуролу: Ароматичність фурану виявляється в SE реакціях, які відбуваються переважно в положення 2. Для фурану, тіофену і пиролу атака електрофілу в положення 3 приводить до утворення карбонієвого іона, який являє собою гібрид структур Iг і Ід, тоді як атака електрофілу в положення 2 дає карбонієвий іон, який є гібридом не тільки структур Ia і Іб, але й структури Iв, яка надає додаткової стабілізації карбонієвому іону і робить цей іон стійкішим: Реакції галогенування, сульфування, нітрування і ацилування фурану (I–IV):
Фуран – безбарвна рідина, малорозчинна у воді, з характерним запахом хлороформу. Фуран і його найближчі гомологи входять до складу летких фракцій продуктів сухої перегонки слизової кислоти, яка перетворюється на 2, 2′‑фурандикарбонову кислоту, яка декарбоксилується і через стадію 2 фуранкарбонової к ти перетворюється на фуран. Одержують фуран також із фуранового альдегіду – фурфуролу: Ароматичність фурану виявляється в SE реакціях, які відбуваються переважно в положення 2. Для фурану, тіофену і пиролу атака електрофілу в положення 3 приводить до утворення карбонієвого іона, який являє собою гібрид структур Iг і Ід, тоді як атака електрофілу в положення 2 дає карбонієвий іон, який є гібридом не тільки структур Ia і Іб, але й структури Iв, яка надає додаткової стабілізації карбонієвому іону і робить цей іон стійкішим: Реакції галогенування, сульфування, нітрування і ацилування фурану (I–IV):
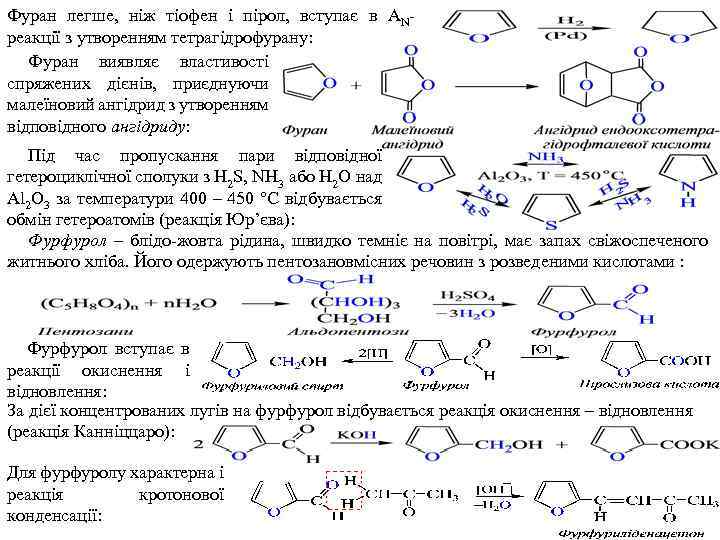 Фуран легше, ніж тіофен і пірол, вступає в AN реакції з утворенням тетрагідрофурану: Фуран виявляє властивості спряжених дієнів, приєднуючи малеїновий ангідрид з утворенням відповідного ангідриду: Під час пропускання пари відповідної гетероциклічної сполуки з H 2 S, NH 3 або H 2 O над Al 2 O 3 за температури 400 – 450 °C відбувається обмін гетероатомів (реакція Юр’єва): Фурфурол – блідо жовта рідина, швидко темніє на повітрі, має запах свіжоспеченого житнього хліба. Його одержують пентозановмісних речовин з розведеними кислотами : Фурфурол вступає в реакції окиснення і відновлення: За дієї концентрованих лугів на фурфурол відбувається реакція окиснення – відновлення (реакція Канніццаро): Для фурфуролу характерна і реакція кротонової конденсації:
Фуран легше, ніж тіофен і пірол, вступає в AN реакції з утворенням тетрагідрофурану: Фуран виявляє властивості спряжених дієнів, приєднуючи малеїновий ангідрид з утворенням відповідного ангідриду: Під час пропускання пари відповідної гетероциклічної сполуки з H 2 S, NH 3 або H 2 O над Al 2 O 3 за температури 400 – 450 °C відбувається обмін гетероатомів (реакція Юр’єва): Фурфурол – блідо жовта рідина, швидко темніє на повітрі, має запах свіжоспеченого житнього хліба. Його одержують пентозановмісних речовин з розведеними кислотами : Фурфурол вступає в реакції окиснення і відновлення: За дієї концентрованих лугів на фурфурол відбувається реакція окиснення – відновлення (реакція Канніццаро): Для фурфуролу характерна і реакція кротонової конденсації:
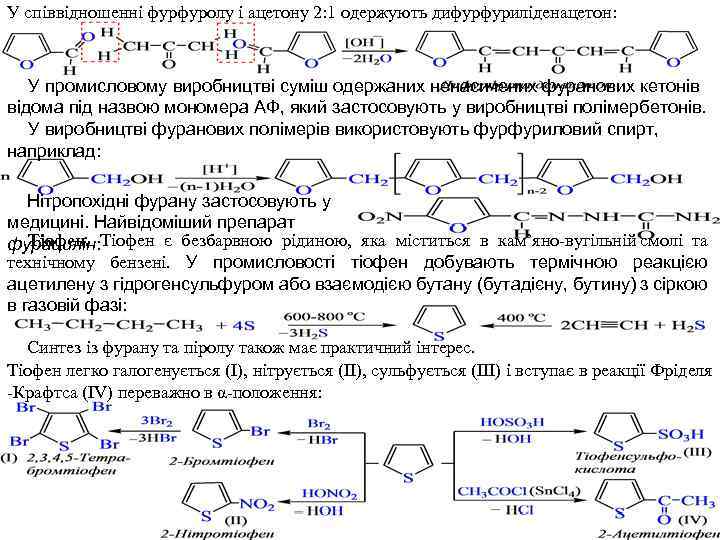 У співвідношенні фурфуролу і ацетону 2: 1 одержують дифурфуриліденацетон: У промисловому виробництві суміш одержаних ненасичених фуранових кетонів відома під назвою мономера АФ, який застосовують у виробництві полімербетонів. У виробництві фуранових полімерів використовують фурфуриловий спирт, наприклад: Нітропохідні фурану застосовують у медицині. Найвідоміший препарат Тіофен. фурацилін: Тіофен є безбарвною рідиною, яка міститься в кам’яно вугільній смолі та технічному бензені. У промисловості тіофен добувають термічною реакцією ацетилену з гідрогенсульфуром або взаємодією бутану (бутадієну, бутину) з сіркою в газовій фазі: Синтез із фурану та піролу також має практичний інтерес. Тіофен легко галогенується (І), нітрується (ІІ), сульфується (ІІІ) і вступає в реакції Фріделя Крафтса (ІV) переважно в α положення:
У співвідношенні фурфуролу і ацетону 2: 1 одержують дифурфуриліденацетон: У промисловому виробництві суміш одержаних ненасичених фуранових кетонів відома під назвою мономера АФ, який застосовують у виробництві полімербетонів. У виробництві фуранових полімерів використовують фурфуриловий спирт, наприклад: Нітропохідні фурану застосовують у медицині. Найвідоміший препарат Тіофен. фурацилін: Тіофен є безбарвною рідиною, яка міститься в кам’яно вугільній смолі та технічному бензені. У промисловості тіофен добувають термічною реакцією ацетилену з гідрогенсульфуром або взаємодією бутану (бутадієну, бутину) з сіркою в газовій фазі: Синтез із фурану та піролу також має практичний інтерес. Тіофен легко галогенується (І), нітрується (ІІ), сульфується (ІІІ) і вступає в реакції Фріделя Крафтса (ІV) переважно в α положення:
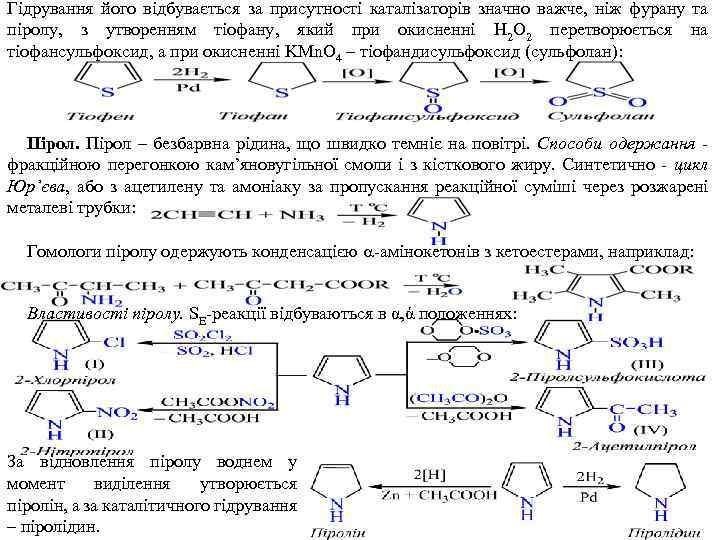 Гідрування його відбувається за присутності каталізаторів значно важче, ніж фурану та піролу, з утворенням тіофану, який при окисненні H 2 O 2 перетворюється на тіофансульфоксид, а при окисненні KMn. O 4 – тіофандисульфоксид (сульфолан): Пірол – безбарвна рідина, що швидко темніє на повітрі. Способи одержання фракційною перегонкою кам’яновугільної смоли і з кісткового жиру. Синтетично цикл Юр’єва, або з ацетилену та амоніаку за пропускання реакційної суміші через розжарені металеві трубки: Гомологи піролу одержують конденсацією амінокетонів з кетоестерами, наприклад: Властивості піролу. SE реакції відбуваються в α, ά положеннях: За відновлення піролу воднем у момент виділення утворюється піролін, а за каталітичного гідрування – піролідин.
Гідрування його відбувається за присутності каталізаторів значно важче, ніж фурану та піролу, з утворенням тіофану, який при окисненні H 2 O 2 перетворюється на тіофансульфоксид, а при окисненні KMn. O 4 – тіофандисульфоксид (сульфолан): Пірол – безбарвна рідина, що швидко темніє на повітрі. Способи одержання фракційною перегонкою кам’яновугільної смоли і з кісткового жиру. Синтетично цикл Юр’єва, або з ацетилену та амоніаку за пропускання реакційної суміші через розжарені металеві трубки: Гомологи піролу одержують конденсацією амінокетонів з кетоестерами, наприклад: Властивості піролу. SE реакції відбуваються в α, ά положеннях: За відновлення піролу воднем у момент виділення утворюється піролін, а за каталітичного гідрування – піролідин.
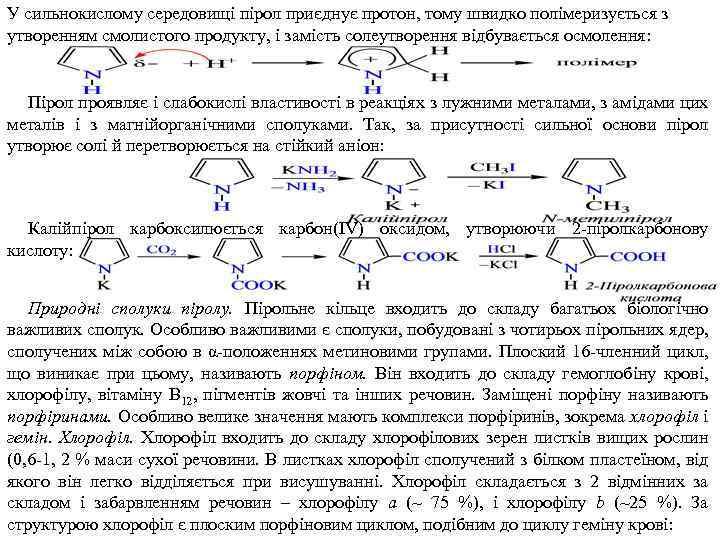 У сильнокислому середовищі пірол приєднує протон, тому швидко полімеризується з утворенням смолистого продукту, і замість солеутворення відбувається осмолення: Пірол проявляє і слабокислі властивості в реакціях з лужними металами, з амідами цих металів і з магнійорганічними сполуками. Так, за присутності сильної основи пірол утворює солі й перетворюється на стійкий аніон: Калійпірол карбоксилюється карбон(IV) оксидом, утворюючи 2 піролкарбонову кислоту: Природні сполуки піролу. Пірольне кільце входить до складу багатьох біологічно важливих сполук. Особливо важливими є сполуки, побудовані з чотирьох пірольних ядер, сполучених між собою в α положеннях метиновими групами. Плоский 16 членний цикл, що виникає при цьому, називають порфіном. Він входить до складу гемоглобіну крові, хлорофілу, вітаміну B 12, пігментів жовчі та інших речовин. Заміщені порфіну називають порфіринами. Особливо велике значення мають комплекси порфіринів, зокрема хлорофіл і гемін. Хлорофіл входить до складу хлорофілових зерен листків вищих рослин (0, 6 1, 2 % маси сухої речовини. В листках хлорофіл сполучений з білком пластеїном, від якого він легко відділяється при висушуванні. Хлорофіл складається з 2 відмінних за складом і забарвленням речовин – хлорофілу а (~ 75 %), і хлорофілу b (~25 %). За структурою хлорофіл є плоским порфіновим циклом, подібним до циклу геміну крові:
У сильнокислому середовищі пірол приєднує протон, тому швидко полімеризується з утворенням смолистого продукту, і замість солеутворення відбувається осмолення: Пірол проявляє і слабокислі властивості в реакціях з лужними металами, з амідами цих металів і з магнійорганічними сполуками. Так, за присутності сильної основи пірол утворює солі й перетворюється на стійкий аніон: Калійпірол карбоксилюється карбон(IV) оксидом, утворюючи 2 піролкарбонову кислоту: Природні сполуки піролу. Пірольне кільце входить до складу багатьох біологічно важливих сполук. Особливо важливими є сполуки, побудовані з чотирьох пірольних ядер, сполучених між собою в α положеннях метиновими групами. Плоский 16 членний цикл, що виникає при цьому, називають порфіном. Він входить до складу гемоглобіну крові, хлорофілу, вітаміну B 12, пігментів жовчі та інших речовин. Заміщені порфіну називають порфіринами. Особливо велике значення мають комплекси порфіринів, зокрема хлорофіл і гемін. Хлорофіл входить до складу хлорофілових зерен листків вищих рослин (0, 6 1, 2 % маси сухої речовини. В листках хлорофіл сполучений з білком пластеїном, від якого він легко відділяється при висушуванні. Хлорофіл складається з 2 відмінних за складом і забарвленням речовин – хлорофілу а (~ 75 %), і хлорофілу b (~25 %). За структурою хлорофіл є плоским порфіновим циклом, подібним до циклу геміну крові:
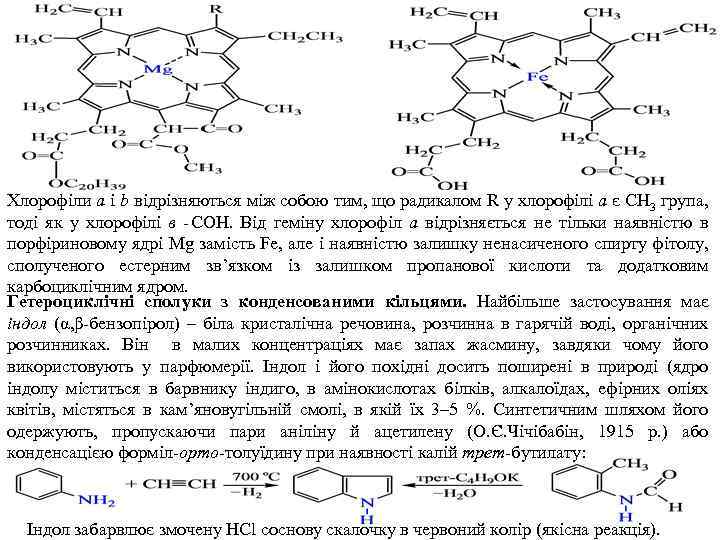 Хлорофіли а і b відрізняються між собою тим, що радикалом R у хлорофілі а є СН 3 група, тоді як у хлорофілі в СОН. Від геміну хлорофіл а відрізняється не тільки наявністю в порфіриновому ядрі Mg замість Fe, але і наявністю залишку ненасиченого спирту фітолу, сполученого естерним зв’язком із залишком пропанової кислоти та додатковим карбоциклічним ядром. Гетероциклічні сполуки з конденсованими кільцями. Найбільше застосування має індол (α, β бензопірол) – біла кристалічна речовина, розчинна в гарячій воді, органічних розчинниках. Він в малих концентраціях має запах жасмину, завдяки чому його використовують у парфюмерії. Індол і його похідні досить поширені в природі (ядро індолу міститься в барвнику індиго, в амінокислотах білків, алкалоїдах, ефірних оліях квітів, містяться в кам’яновугільній смолі, в якій їх 3– 5 %. Синтетичним шляхом його одержують, пропускаючи пари аніліну й ацетилену (O. Є. Чічібабін, 1915 р. ) або конденсацією форміл орто толуїдину при наявності калій трет-бутилату: Індол забарвлює змочену HCl соснову скалочку в червоний колір (якісна реакція).
Хлорофіли а і b відрізняються між собою тим, що радикалом R у хлорофілі а є СН 3 група, тоді як у хлорофілі в СОН. Від геміну хлорофіл а відрізняється не тільки наявністю в порфіриновому ядрі Mg замість Fe, але і наявністю залишку ненасиченого спирту фітолу, сполученого естерним зв’язком із залишком пропанової кислоти та додатковим карбоциклічним ядром. Гетероциклічні сполуки з конденсованими кільцями. Найбільше застосування має індол (α, β бензопірол) – біла кристалічна речовина, розчинна в гарячій воді, органічних розчинниках. Він в малих концентраціях має запах жасмину, завдяки чому його використовують у парфюмерії. Індол і його похідні досить поширені в природі (ядро індолу міститься в барвнику індиго, в амінокислотах білків, алкалоїдах, ефірних оліях квітів, містяться в кам’яновугільній смолі, в якій їх 3– 5 %. Синтетичним шляхом його одержують, пропускаючи пари аніліну й ацетилену (O. Є. Чічібабін, 1915 р. ) або конденсацією форміл орто толуїдину при наявності калій трет-бутилату: Індол забарвлює змочену HCl соснову скалочку в червоний колір (якісна реакція).
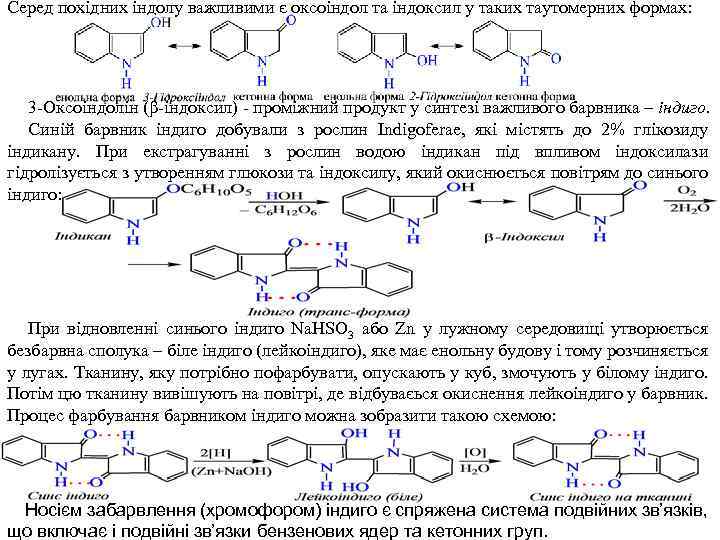 Серед похідних індолу важливими є оксоіндол та індоксил у таких таутомерних формах: 3 Оксоіндолін (β-індоксил) проміжний продукт у синтезі важливого барвника – індиго. Синій барвник індиго добували з рослин Indigoferae, які містять до 2% глікозиду індикану. При екстрагуванні з рослин водою індикан під впливом індоксилази гідролізується з утворенням глюкози та індоксилу, який окиснюється повітрям до синього індиго: При відновленні синього індиго Na. HSO 3 або Zn у лужному середовищі утворюється безбарвна сполука – біле індиго (лейкоіндиго), яке має енольну будову і тому розчиняється у лугах. Тканину, яку потрібно пофарбувати, опускають у куб, змочують у білому індиго. Потім цю тканину вивішують на повітрі, де відбуваєься окиснення лейкоіндиго у барвник. Процес фарбування барвником індиго можна зобразити такою схемою: Носієм забарвлення (хромофором) індиго є спряжена система подвійних зв’язків, що включає і подвійні зв’язки бензенових ядер та кетонних груп.
Серед похідних індолу важливими є оксоіндол та індоксил у таких таутомерних формах: 3 Оксоіндолін (β-індоксил) проміжний продукт у синтезі важливого барвника – індиго. Синій барвник індиго добували з рослин Indigoferae, які містять до 2% глікозиду індикану. При екстрагуванні з рослин водою індикан під впливом індоксилази гідролізується з утворенням глюкози та індоксилу, який окиснюється повітрям до синього індиго: При відновленні синього індиго Na. HSO 3 або Zn у лужному середовищі утворюється безбарвна сполука – біле індиго (лейкоіндиго), яке має енольну будову і тому розчиняється у лугах. Тканину, яку потрібно пофарбувати, опускають у куб, змочують у білому індиго. Потім цю тканину вивішують на повітрі, де відбуваєься окиснення лейкоіндиго у барвник. Процес фарбування барвником індиго можна зобразити такою схемою: Носієм забарвлення (хромофором) індиго є спряжена система подвійних зв’язків, що включає і подвійні зв’язки бензенових ядер та кетонних груп.
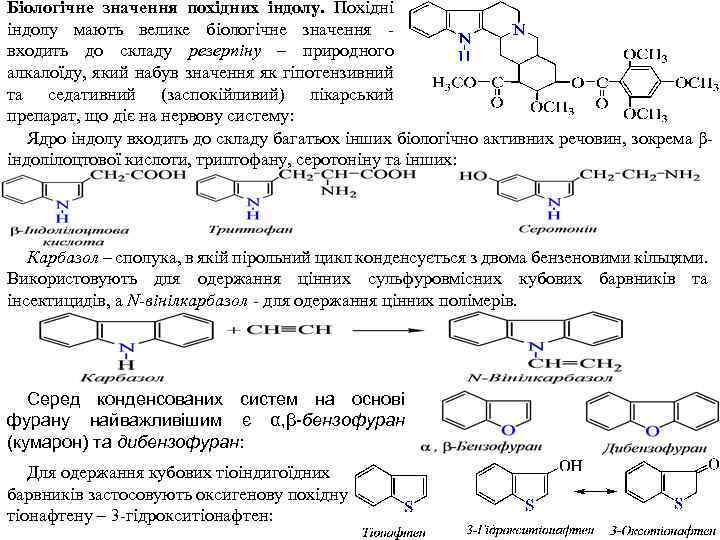 Біологічне значення похідних індолу. Похідні індолу мають велике біологічне значення входить до складу резерпіну – природного алкалоїду, який набув значення як гіпотензивний та седативний (заспокійливий) лікарський препарат, що діє на нервову систему: Ядро індолу входить до складу багатьох інших біологічно активних речовин, зокрема β індолілоцтової кислоти, триптофану, серотоніну та інших: Карбазол – сполука, в якій пірольний цикл конденсується з двома бензеновими кільцями. Використовують для одержання цінних сульфуровмісних кубових барвників та інсектицидів, а N-вінілкарбазол для одержання цінних полімерів. Серед конденсованих систем на основі фурану найважливішим є α, β-бензофуран (кумарон) та дибензофуран: Для одержання кубових тіоіндигоїдних барвників застосовують оксигенову похідну тіонафтену – 3 гідрокситіонафтен:
Біологічне значення похідних індолу. Похідні індолу мають велике біологічне значення входить до складу резерпіну – природного алкалоїду, який набув значення як гіпотензивний та седативний (заспокійливий) лікарський препарат, що діє на нервову систему: Ядро індолу входить до складу багатьох інших біологічно активних речовин, зокрема β індолілоцтової кислоти, триптофану, серотоніну та інших: Карбазол – сполука, в якій пірольний цикл конденсується з двома бензеновими кільцями. Використовують для одержання цінних сульфуровмісних кубових барвників та інсектицидів, а N-вінілкарбазол для одержання цінних полімерів. Серед конденсованих систем на основі фурану найважливішим є α, β-бензофуран (кумарон) та дибензофуран: Для одержання кубових тіоіндигоїдних барвників застосовують оксигенову похідну тіонафтену – 3 гідрокситіонафтен:
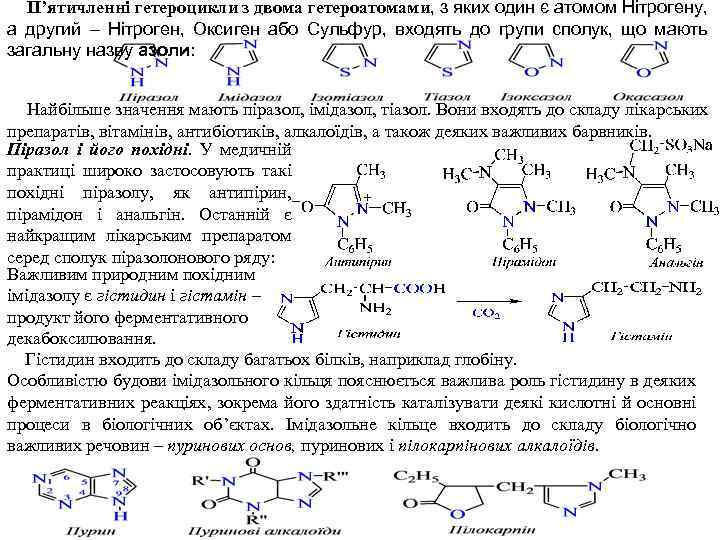 П’ятичленні гетероцикли з двома гетероатомами, з яких один є атомом Нітрогену, а другий – Нітроген, Оксиген або Сульфур, входять до групи сполук, що мають загальну назву азоли: Найбільше значення мають піразол, імідазол, тіазол. Вони входять до складу лікарських препаратів, вітамінів, антибіотиків, алкалоїдів, а також деяких важливих барвників. Піразол і його похідні. У медичній практиці широко застосовують такі похідні піразолу, як антипірин, пірамідон і анальгін. Останній є найкращим лікарським препаратом серед сполук піразолонового ряду: Важливим природним похідним імідазолу є гістидин і гістамін – продукт його ферментативного декабоксилювання. Гістидин входить до складу багатьох білків, наприклад глобіну. Особливістю будови імідазольного кільця пояснюється важлива роль гістидину в деяких ферментативних реакціях, зокрема його здатність каталізувати деякі кислотні й основні процеси в біологічних об’єктах. Імідазольне кільце входить до складу біологічно важливих речовин – пуринових основ, пуринових і пілокарпінових алкалоїдів.
П’ятичленні гетероцикли з двома гетероатомами, з яких один є атомом Нітрогену, а другий – Нітроген, Оксиген або Сульфур, входять до групи сполук, що мають загальну назву азоли: Найбільше значення мають піразол, імідазол, тіазол. Вони входять до складу лікарських препаратів, вітамінів, антибіотиків, алкалоїдів, а також деяких важливих барвників. Піразол і його похідні. У медичній практиці широко застосовують такі похідні піразолу, як антипірин, пірамідон і анальгін. Останній є найкращим лікарським препаратом серед сполук піразолонового ряду: Важливим природним похідним імідазолу є гістидин і гістамін – продукт його ферментативного декабоксилювання. Гістидин входить до складу багатьох білків, наприклад глобіну. Особливістю будови імідазольного кільця пояснюється важлива роль гістидину в деяких ферментативних реакціях, зокрема його здатність каталізувати деякі кислотні й основні процеси в біологічних об’єктах. Імідазольне кільце входить до складу біологічно важливих речовин – пуринових основ, пуринових і пілокарпінових алкалоїдів.
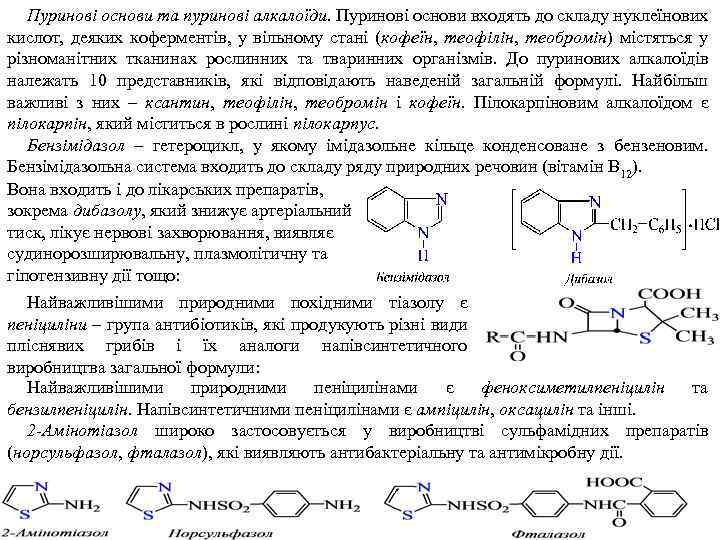 Пуринові основи та пуринові алкалоїди. Пуринові основи входять до складу нуклеїнових кислот, деяких коферментів, у вільному стані (кофеїн, теофілін, теобромін) містяться у різноманітних тканинах рослинних та тваринних організмів. До пуринових алкалоїдів належать 10 представників, які відповідають наведеній загальній формулі. Найбільш важливі з них – ксантин, теофілін, теобромін і кофеїн. Пілокарпіновим алкалоїдом є пілокарпін, який міститься в рослині пілокарпус. Бензімідазол – гетероцикл, у якому імідазольне кільце конденсоване з бензеновим. Бензімідазольна система входить до складу ряду природних речовин (вітамін В 12). Вона входить і до лікарських препаратів, зокрема дибазолу, який знижує артеріальний тиск, лікує нервові захворювання, виявляє судинорозширювальну, плазмолітичну та гіпотензивну дії тощо: Найважливішими природними похідними тіазолу є пеніциліни – група антибіотиків, які продукують різні види пліснявих грибів і їх аналоги напівсинтетичного виробництва загальної формули: Найважливішими природними пеніцилінами є феноксиметилпеніцилін та бензилпеніцилін. Напівсинтетичними пеніцилінами є ампіцилін, оксацилін та інші. 2 -Амінотіазол широко застосовується у виробництві сульфамідних препаратів (норсульфазол, фталазол), які виявляють антибактеріальну та антимікробну дії.
Пуринові основи та пуринові алкалоїди. Пуринові основи входять до складу нуклеїнових кислот, деяких коферментів, у вільному стані (кофеїн, теофілін, теобромін) містяться у різноманітних тканинах рослинних та тваринних організмів. До пуринових алкалоїдів належать 10 представників, які відповідають наведеній загальній формулі. Найбільш важливі з них – ксантин, теофілін, теобромін і кофеїн. Пілокарпіновим алкалоїдом є пілокарпін, який міститься в рослині пілокарпус. Бензімідазол – гетероцикл, у якому імідазольне кільце конденсоване з бензеновим. Бензімідазольна система входить до складу ряду природних речовин (вітамін В 12). Вона входить і до лікарських препаратів, зокрема дибазолу, який знижує артеріальний тиск, лікує нервові захворювання, виявляє судинорозширювальну, плазмолітичну та гіпотензивну дії тощо: Найважливішими природними похідними тіазолу є пеніциліни – група антибіотиків, які продукують різні види пліснявих грибів і їх аналоги напівсинтетичного виробництва загальної формули: Найважливішими природними пеніцилінами є феноксиметилпеніцилін та бензилпеніцилін. Напівсинтетичними пеніцилінами є ампіцилін, оксацилін та інші. 2 -Амінотіазол широко застосовується у виробництві сульфамідних препаратів (норсульфазол, фталазол), які виявляють антибактеріальну та антимікробну дії.


