Белковые вещества.ppt
- Количество слайдов: 57

Гетероциклические соединения, цветные реакции на аминокислоты и белки, белковые вещества

Кислородсодержащие гетероциклы Из кислородсодержащих шестичленных циклов наибольшее биологическое значение имеют пироны и конденсированные системы на их основе. -, и -пироны являются неустойчивыми соединениями, в кислой среде они переходят в катионы пирилия, которые представляют собой устойчивые соединения и распространенные в природных условиях в виде солей.

Хромон, флавон – это конденсированная с бензолом ядра -пирона, имеющие следующее строение:

Скелет хромона лежит в основе витаминов группы Е (токоферолов), впервые из масла ростков пшеницы. Строение наиболее биологически активного токоферола следующее: Известно семь соединений, близких по строению, обладающих действием вит. Е. Природные токоферолы антиоксидантами, тормозящими протекание радикальных процессов в организме.

Особенно распространены в растительном мире производные флавона (2 фенил-хромона) и флавана (2 фенил-хромана). Отличаются друг от друга по степени окисленности.
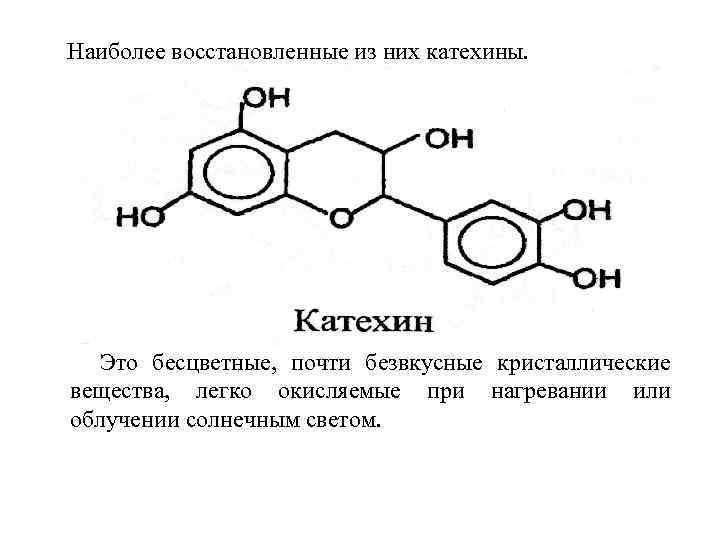
Наиболее восстановленные из них катехины. Это бесцветные, почти безвкусные кристаллические вещества, легко окисляемые при нагревании или облучении солнечным светом.

Полиоксипроизводным флавона является желтый пигмент – кверцетин: При восстановлении кверцетина получают катехин, содержащийся в дубильных экстратах и чае.

Соли бензопирилия называют антоцианидами; их гликозиды - антоцианы являются красящими пигментами большинства цветов, овощей и ягод, обеспечивая красные и синие цвета всех оттенков. Строение их отличается количеством окси- и метиленовых групп, а также углеводной компонентой.

Цветные реакции на белки и аминокислоты Для белков характерны некоторые цветные реакции, связанные с наличием в молекуле определенных группировок и аминокислотных остатков. Биуретовая реакция. Появлние розово-фиолетового окрашивания при обработке белка концентрированным раствором щелочи и насыщенным раствором Си. SO 4. Связана с наличием в молекуле пептидных связей. Нингидриновая реакция. Появление сине-фиолетового окрашивания при обработке белка раствором нингидрина. Связана с наличием в растворе белка свободных аминокислот.

Крантопротеиновая реакция. Появление желтой окраски в результате действия на белки концентрированной азотной кислоты. Реакция связана с наличием в белке остатков циклических аминокислот.

Реакция Миллона на тирозин. Появление мясо-красного сгустка при действии на белок реактива Миллона. Реакция объясняется присутствием в белке остатков тирозина.

Реакция Адамкевича на тирозин. Появление фиолетового окрашивания при добавлении к белку ледяной уксусной кислоты, содержащей примесь глиоксиловой кислоты и концентрированной серной кислоты связано с наличием в белке индольных группировок.

Продукт конденсации окисляется до бис-2 -триптофанилкарбинола

Реакция на аминокислоты, содержащие серу. Выпадение черного осадка сульфита свинца при нагревании белка с раствором плюмбита связана с наличием в нем остатков аминокислот, содержащих серу.

Реакция Паули на гистидин. Появление вишнево-красного цвета при добавлению к свежеприготовленного диазореактива связано с наличием в структуре белка остатков аминокислоты – гистидина.
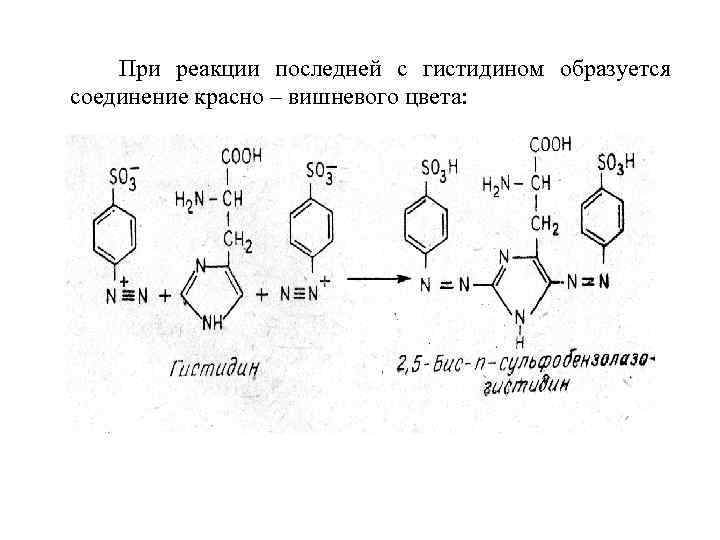
При реакции последней с гистидином образуется соединение красно – вишневого цвета:

Белковые вещества Белками, белковыми веществами (протеинами) называются высокомолекулярные органические вещества, молекулы которых построены из остатков -аминокислот. Белки играют исключительную роль в жизни живого организма, выполняя весьма разнообразные функции. Из них состоит основная масса протоплазмы клеток, они выполняют каталитические, строительные, энергетические, обменные, защитные и многие другие функции. Растения синтезируют белки (их составные части - аминокислоты) из СО 2 и Н 2 О за счет фотосинтеза, остальные усваивая из почвы. Животные организмы получают готовые аминокислоты с пищей и на их базе строят белки своего организма.

Строение белков. Несмотря на разнообразие в строении и функциях, элементный состав белковых веществ колеблется незначительно. Элементарный состав, в %: С - 50, 0 – 55, 0 Н - 6, 0 - 7, 5 N - 15, 0 – 18, 0 (К = 100/16=6, 25) О - 21, 0 – 22, 0 S - 0, 3 – 2, 5 Р - 1, 0 – 2, 0 Согласно общепринятой теории молекула белка состоит из остатков - аминокислот, связанных между собой пептидными связями. Впервые мысль о пептидных связях высказана выдающимся русским биохимиком А. Я. Данилевским

В состав белков входят от 20 до 30 аминокислотных остатков. Состав и последовательность расположения аминокислотных остатков в молекуле белка могут быть различными, поэтому разнообразие белков безгранично. Под понятием белок подразумевают макромолекулу (полипептид), содержащую 100 и более аминокислотных остатков, способную образовывать и самостоятельно стабилизировать свою пространственную структуру. Пептидные связи являются не единственными связями в белках. Отдельные пептидные цепи и их участки могут быть связаны между собой дисульфидными (-S-S-), солевыми и водородными связями. В молекуле белка также некоторые другие виды взаимодействия. Подробнее об этом см. в учебном пособии Сергеевой Н. Т. «Биологически активные вещества» .

Современные представления о строении белков Различают первичную, вторичную, третичную и четвертичную структуры белковых молекул. Под первичной структурой белка понимают строго определенный порядок чередования аминокислотных остатков, соединенных пептидными (ковалентными) связями в полипептидной цепи белка. Это конкретная последовательность аминокислотных остатков в полипептидной цепи генетический год. Определяется с помощью прибора, называемого секвинатором. В пептидной группе –СОNH- атом углерода находится в sp 2 гибридизации. Неподеленная пара электронов атома азота вступает в сопряжение с -электронами двойной связи С=О. Атомы С, О и N, образующие сопряженную систему находятся в одной плоскости.
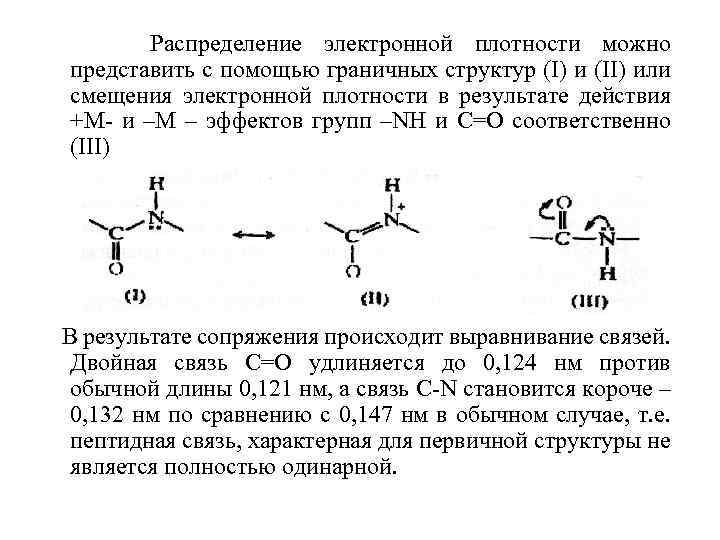
Распределение электронной плотности можно представить с помощью граничных структур (I) и (II) или смещения электронной плотности в результате действия +М- и –М – эффектов групп –NH и С=О соответственно (III) В результате сопряжения происходит выравнивание связей. Двойная связь С=О удлиняется до 0, 124 нм против обычной длины 0, 121 нм, а связь C-N cтановится короче – 0, 132 нм по сравнению с 0, 147 нм в обычном случае, т. е. пептидная связь, характерная для первичной структуры не является полностью одинарной.

Вторичная структура белка – это пространственная двухмерная ориентация аминокислотных остатков, соединенных в полипептидную цепь. Полипептидные цепи белков, организованные во вторичную, стабилизированы водородными связями. Атом кислорода одной пептидной группы образует водородную связь с NH - группой другой пептидной связи. При этом формируются следующие структуры: -спираль, структура, -изгиб и др. -Спираль. Наиболее термодинамически выгодной структурой является правая -спираль. В 1950 году Л. Полинг и Р. Кори расчетным путем определили это. При образовании -спирали полипептидная цепь закручивается вокруг оси. Стабилизация спирали достигается водородными связями между NH- группой данного остатка аминокислоты с СО- группой от него остатка. Направленность водородных связей параллельна продольной оси -спирали.

Пространственная структура полипептидной цепи и спирали следующая: На один виток спирали в среднем приходится 3, 6 аминокислотных остатков, диаметр – 0, 54 нм, расстояние между остатками – 0, 15 нм. Кроме правой -спирали, известны и другие спиральные вторичные структуры полипептидных цепей.

- структура. В отличие от -спирали -структура образована за счет межцепочечных водородных связей между соседними участками полипептидной цепи, так как внутри-цепочечные контакты отсутствуют. Полипептидная цепь в - структуре сильно вытянута и имеет не спиральную, а зигзагообразную форму. Расстояние между соседними аминокислотными остатками по оси составляет о, 35 нм, т. е. в три раза больше, чем в -спирали число остатков на виток равно двум. в параллельной - структуре ( «складчатом листе» ) пептидные цепи располагаются параллельно другу, образуя пространственную структуру, подобную складчатому листу, сложенному гармошкой. Различают два типа структур: параллельную, если направление полипептидных цепей одинаково, и антипараллельную, если полипептидные цепи направлены навстречу другу.

Вторичная структура в виде складчатого листа ( структура): Примером антипараллельной - структуры является вторичная структура фиброина шелка, вырабатываемого тутовым шелкопрядом.
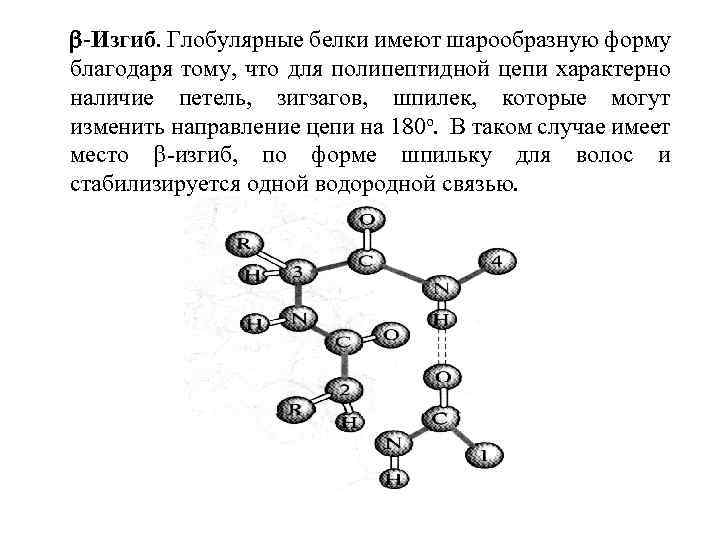
-Изгиб. Глобулярные белки имеют шарообразную форму благодаря тому, что для полипептидной цепи характерно наличие петель, зигзагов, шпилек, которые могут изменить направление цепи на 180 о. В таком случае имеет место -изгиб, по форме шпильку для волос и стабилизируется одной водородной связью.

Третичная структура белков – это пространственная трехмерная конформация белковых молекул; образуется самопроизвольно и зависит от размера, формы, полярности аминокислотных остатков, их последовательности расположения в полипептидной цепи, т. е. первичная структура белка, а также тип ее вторичной структуры определяет пространственную организацию белковой молекулы. Она возникает в результате взаимодействия между цепочками полипептидов и поддерживается дисульфидными, ионными, гидрофобными, электростатическими и другими взаимодействиями. При образовании многие атомы, находящиеся на удаленных участках полипептидной цепи, сближаются и, воздействуя друг на друга, приобретают новые свойства, отсутствующие у индивидуальных аминокислот или небольших полипептидов. По пространственной структуре белки делятся на два больших класса – глобулярные и фибрилярные. Такое деление сложилось исторически и продолжает использоваться в настоящее время.

Четвертичная структура белков. Четвертичной структурой белков называют ассоциированные между собой две и более субъединицы, ориентированные в пространстве. Система стабилизирована всеми видами ковалентной и нековалентной связи. В определенных условиях они способны диссоциировать на более мелкие «субмолекулы» , которые могут опять соединятся в первоначальную молекулу, но не у всех белков встречаются все четыре уровня структурной организации. Белки, имеющие четвертичную структуру, часто называют олигомерными. Примеры белков, имеющих четвертичную структуру: каталаза состоит из четырех абсолютно равноценных субъединиц; гемоглобин – из четырех полипептидных цепей (из них две цепи и две цепи ); белок РНКполимераза – из пяти субъединиц различного строения и с неодинаковыми функциями.

Физико-химические свойства белков Химические свойства белков определяются химическими свойствами аминокислот, образующих полипептидную цепь. Сохранение свободных аминогрупп и карбоксильных групп в молекулах белка обуславливает их амфотерность, возможности взаимодействия как с кислотами, так и основаниями. Различное соотношение NH 2 -групп и СООН-групп в молекулах белка определяет три их типа - кислые, нейтральные и основные. Соответственно, изоэлектрическая точка таких белков будет лежать в кислой среде, вблизи р. Н = 7 или в щелочной средах. Растворимые в воде белки могут образовывать как коллоидные растворы, так и истинные (молекулярные) растворы, что зависит от молекулярной массы, гидрофильности, концентрации макромолекул и других факторов.

Кислотно-основные свойства белков Белки как и аминокислоты проявляют как кислотные, так и основные свойства. Являясь амфотерными электролитами, белки мигрируют в электрическом поле со скоростью, зависящей от их суммарного заряда и р. Н среды. При определенном для каждого белка значении р. Н (изоэлектрическая точка) его молекулы электронейтральны, т. е. то значение р. Н при котором белок, помещенный в электрическое поле, не движется ни к катоду, ни к аноду, называется изоэлектрической точкой. В изоэлектрической точке белок обладает наименьшей растворимостью и наибольшей вязкостью, в результате чего происходит наиболее легкое осаждение белка из раствора.

Изоэлектрическая точка - одна из характерных констант белков. Однако если довести раствор белка до изоэлектрической точки, то сам по себе белок все же не выпадет в осадок. Значение р. Н, отвечающее изоэлектрической точке белка, будет выше 7, 0, если белок содержит большое число остатков основных аминокислот (лиз, арг), что характерно, например, для рибонуклеазы, или относительно низким, если в белке содержатся преимущественно остатки кислых аминокислот (асп, глу), как в случае пепсина. У большинства глобулярных белков изоэлектрические точки лежат в пределах р. Н 4, 5 - 6, 5.

Растворимость белков Гидрофильность белков. Способность белков связывать на своей контактной поверхности воду одно из характерных физико-химических свойств, имеющих исключительное значение в организации биологических систем. Содержание в молекуле белка большого количества функциональных групп аминных, гидроксильных, карбоксильных - обуславливает его высокую гидрофильность. С гидрофильностью связаны такие процессы, как растворимость и набухание белков, их осаждение и денатурация при воздействии различных физико-химических факторов внешней среды.

Гидратация белков - важнейший фактор, обуславливающий устойчивость их растворов. Гидратация – способность образовывать молекулами белков гидратную оболочку в результате взаимодействия полярных групп белка с молекулами воды с образованием водородных связей между ними. Если же имеются неполярные участки на поверхности белковой молекулы, то они свободны от воды и представляют собой отдельные островки на молекуле белка. Гидратация имеет огромное значение для роста тканей, тканевого обмена и осуществления других физико-химических процессов. Белки животных тканей связывают до 80 -95 % воды.
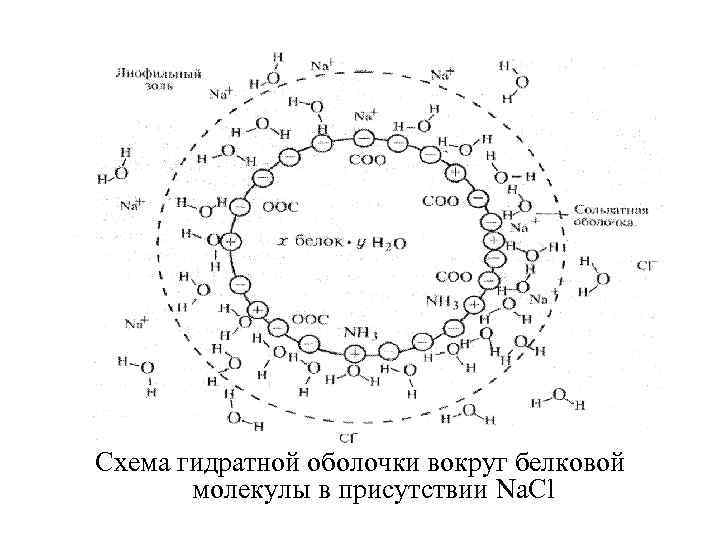
Схема гидратной оболочки вокруг белковой молекулы в присутствии Na. Cl

Растворимость белков связана с их химической структурой. Поскольку аминокислотный состав белков различен, растворимость белков колеблется в широких пределах и определяется соотношением гидрофильных и гидрофобных групп, спецификой их укладки в трехмерную структуру. Чем больше гидрофильных групп на поверхности белковой молекулы, тем выше ее растворимость, поверхностные гидрофобные группы снижают растворимость. Глобулярные белки обладают лучшей растворимостью, чем фибриллярные. Гидрофильность различных функциональных групп белка разная. Пептидная связь связывает одну молекулу воды, карбоксильная группа четыре молекулы воды, аминогруппа – одну.

Коллоидные свойства белковых растворов В растворах белки проявляют такие cвойства, как явление светорассеяния (эффект Тендаля), поэтому почти все белковые растворы в рассеянном свете кажутся мутными и опалесцируют. Их растворы также проявляют высокую вязкость, способность к образованию гелей и неспособность проходить через полупроницаемые мембраны и другие свойства. Вместе с тем белки не являются истинными коллоидами, так как они способны образовывать молекулярные растворы.

Белки так же, как и истинные коллоиды, могут образовывать гели, представляющие собой истинные коллоиды, и могут образовывать гели, представляющие собой сетчатые структуры, заполненные водой. Глобулярные белки сильно различаются по своей растворимости в водных системах; эти различия можно использовать для разделения белковых смесей. Четыре фактора оказывают существенное влияние на растворимость белков: 1) р. Н, 2) ионная сила, 3) диэлектрические свойства растворителя, 4) температура.

Влияние р. H на растворимость белков Рис. 1 Зависимость растворимости -лактоглобулина от р. Н и от концентрации соли при 25 о С (числа на кривых указывают концентрацию Na. Cl)

При любой концентрации Na. С 1 растворимость является минимальной в области р. Н 5, 2 -5, 3, так как в изоэлектрической точке гидрофильность белка наименьшая, снижается и устойчивость его растворов. По обе стороны от этого критического значения р. Н растворимость резко возрастает. Значение р. Н, при котором -лактоглобулин обладает наименьшей растворимостью, совпадает с его изоэлектрической точкой. Эта особенность характерна практически почти для всех глобулярных белков. Объясняется это тем, что в изоэлектрической точке молекула белка не несет суммарного заряда и, следовательно, между соседними молекулами белка отсутствует электростатическое отталкивание, они «слипаются» , растворимость падает.



При значениях р. Н выше или ниже изоэлектрической точки все молекулы белка имеют суммарный заряд одного знака, вследствие чего они отталкиваются друг от друга и образование или нерастворимых агрегатов (слипание) оказывается невозможным. Поскольку разные белки имеют разные изоэлектрические точки, их можно отделить друг от друга с помощью приема, известного под названием изоэлектрического осаждения. При достижении значения р. Н, соответствующего изоэлектрической точке одного из компонентов белковой смеси, этот компонент целиком или почти целиком выпадает в осадок, тогда как белки, изоэлектрические точки которых лежат при более низких или более высоких значениях р. Н, остаются в растворе.

Влияние концентрации солей на растворимость белков Рис. 2 Влияние нейтральной соли (K 2 SO 4) на растворимось (L) карбоксигемоглобина при значениях р. Н, соответсвующем изоэлектрической точке

Растворимость белков зависит не только от р. Н, а также от ионной силы раствора, которая определяется по уравнению: =1/2Σсzi 2, где - ионная сила раствора; c – молярная концентрация; zi – заряд иона Как видно из рис. 1 и 2, нейтральные соли оказывают заметное влияние на растворимость глобулярных белков. При низких концентрациях растворы нейтральных солей повышают растворимость многих белков. Этот эффект не зависит от природы нейтральной соли; он зависит от концентрации соли и числа зарядов каждого из ионов, присутствующих в растворе. Соли, содержащие двухвалентные ионы, например Мg. Сl 2 или Мg. SO 4, значительно эффективнее повышают растворимость белков чем такие соли, как Na. С 1, NH 4 Cl и КС 1. Повышение растворимости вызывается изменениями в степени диссоциации ионизируемых групп белка

При значительном повышении концентрации нейтральных солей растворимость белков начинает опять понижаться, и при очень высоких концентрациях соли белок может полностью выпасть в осадок. Это явление называется высаливанием. Механизм высаливания состоит в том, что анионы и катионы вносимой в раствор соли, имеющие достаточно большие по величине электростатические заряды, интенсивно гидротируются диполями воды. Поскольку молекулы солей более гидрофильны, чем белковые глобулы, они уменьшают их гидратацию. Молекулы белка начинают агрегировать, образуя более крупные частицы. Под действием собственной силы тяжести оседают из раствора в виде осадка. При высокой ионной силе белкового раствора наблюдается конкуренция между белковыми молекулами и ионами соли за молекулу воды. Степень гидратации белка снижается, взаимодействие белок-белок при этом становится эффективнее, чем белок-вода, и белок осаждается. Высаливание широко применяют для выделения белков, при этом денатурации не происходит.


Механизм действия солей тяжелых металлов(Cu, Pb, Hg, Ag и др. ) Ионы тяжелых металлов, взаимодействуя с белками, образуют нерастворимые в воде комплексы, поэтому коагуляция белка под влиянием солей тяжелых металлов, так же как при действии высоких температур, является необратимым процессом. При добавлении избытка солей тяжелых металлов к раствору белка происходит «перезарядка» молекул белка, т. е. все молекулы белка приобретают одноименный заряд (положительный) и образуются силы отталкивания между молекулами, что резко повышает растворимость денатурированных белков, о чем свидетельствует образование прозрачных растворов белков.



Влияние растворителя на растворимость белков Добавление смешивающихся с водой нейтральных органических растворителей, например этанола или ацетона, уменьшает растворимость большинства белков, и они выпадают из раствора в осадок. Поскольку молекулы спирта или ацетона более гидрофильны, чем белковые глобулы, они снимают с белка водную оболочку, в результате чего он легко выпадает в осадок. Растворимость белков при определенных значениях р. Н и ионной силы зависит от диэлектрической постоянной среды. У этанола диэлектрическая постоянная Д=24 при температуре 20° С) ниже, чем у воды (Д=80). При снижении диэлектрической постоянной силы притяжения между двумя противоположными зарядами возрастают, создаются условия для образования ионных пар, этанол способствует агрегации белков, т. е. снижает их растворимость. Это свойство растворителей используется для разделения белков.


Влияние температуры на растворимость белков В сравнительно узком интервале температур, приблизительно от 0 до 40°С, растворимость большинства белков возрастает при повышении температуры. При температурах, превышающих 4050°С, большинство белков утрачивает стабильность; начинается их денатурация, сопровождающаяся обычно резким снижением растворимости в области нейтральных значений р. Н. Это происходит в результате того, что энергия сообщаемая молекуле при повышении температуры, увеличивает энергию внутренних связей: водородных, гидрофобных, солевых мостиков и др. В результате этого «нативные» связи разрушаются, а полипептидная цепь раскручивается. Полипептидные цепи взаимодействуют между собой (агрегируя), выпадают в осадок – коагуляция (вторичное явление). Агрегация (коагуляция) всегда сопровождает тепловую денатурацию, поэтому количество осажденного белка может служить показателем скорости денатурации.

Денатурация белков - изменение природной (нативной) макроструктуры белка (при сохранении первичной структуры). При этом происходит изменение физикохимических и биологических свойств белков. Денатурация может быть обратимой и необратимой в зависимости от характера внешнего воздействия. При изменении третичной и четвертичной структуры белка возможна обратимая денатурация. В результате денатурации происходит нарушение четвертичной, третичной и вторичной структур белка, образованных нековалентными связями, утрачивается пространственное уникальное расположение и форма полипептидной цепочки, при этом первичная структура белка сохраняется - аминокислотная последовательность белка не изменяется.

Денатурирующие агенты делятся на химические и физические. К последним относится температурное воздействие, в частности, замораживание или нагревание, давление, ультразвуковое воздействие, облучение, токи высокой частоты и др. Химические агенты - это органические растворители (ацетон, хлороформ, спирт), концентрированные кислоты, щелочи, ионы тяжелых металлов. Обратимая денатурация, так называемая ренатурация, приводит к легко восстанавливаемому изменению в структуре. Необратимая денатурация часто происходит при тепловом воздействии, например, свертывание яичного альбумина при варке яиц
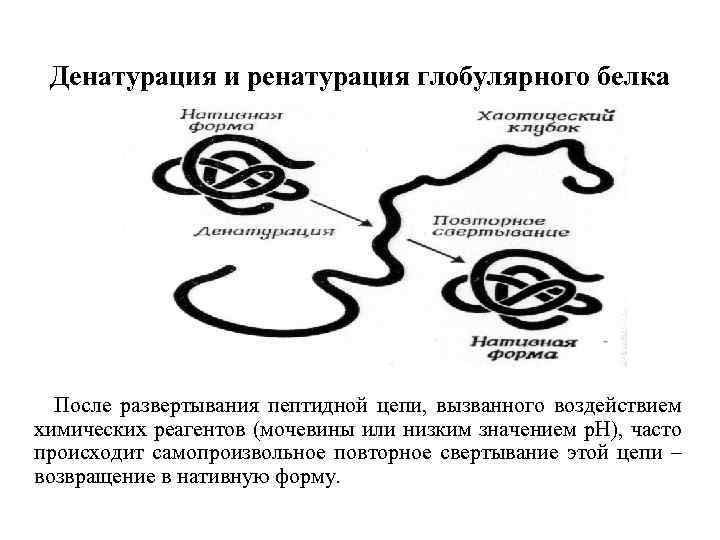
Денатурация и ренатурация глобулярного белка После развертывания пептидной цепи, вызванного воздействием химических реагентов (мочевины или низким значением р. Н), часто происходит самопроизвольное повторное свертывание этой цепи – возвращение в нативную форму.

Механизм действия денатурирующих агентов. Обработка белка денатурирующими агентами приводит к изменению конформации белка: разворачиванию, в случае олигомерных белков, и к диссоциации на протомеры - полимерных белков. Низкие р. Н подавляют диссоциацию – СОО- группы белка, превращая их в -СООН, а высокие – NН 3+ в - NН 2, может происходить разрыв дисульфидных мостиков, а также слабых водородных, гидрофобных и электростатических связей, поэтому связи в нативной белковой молекуле нарушаются. В результате вторичная и третичная структуры белка изменяются.

Под влиянием денатурации белки пищевых продуктов приобретают большую доступность протеолитических ферментов, возрастает реакционная способность химических групп входящих в состав белковой молекулы, изменяется форма белковой молекулы – она «разрыхляется» или становится более компактной в зависимости от условий денатурации, гидрофобность белка растет. Денатурация белков имеет большое значение во многих технологических процессах пищевой промышленности - при выпечке хлеба, сушке макарон, овощей, зерна и семян, отжиме растительного масла на прессах, консервировании, кулинарной обработке пищевых продуктов и ряде других, так как при нагревании ферменты, входящие в состав пищевых продуктов, теряют биологическую активность, в связи с чем пищевые продукты таким образом могут быть предохранены от автолиза. Этим объясняется значительно большая продолжительность хранения денатурированных пищевых продуктов.
Белковые вещества.ppt