геохимия лекция 2.ppt
- Количество слайдов: 21
 Геохимия. Лекция № 2 «Строение атомного ядра»
Геохимия. Лекция № 2 «Строение атомного ядра»
 Атом = ядро + электроны Строение атомного ядра влияет на распространенность элементов в природе. От конфигурации электронных оболочек зависит поведение химических элементов в различных процессах и особенности их миграции.
Атом = ядро + электроны Строение атомного ядра влияет на распространенность элементов в природе. От конфигурации электронных оболочек зависит поведение химических элементов в различных процессах и особенности их миграции.
 Ядро и атом… Размеры - Ядер химических элементов = 10 -13 – 10 -14 см. - Атомов (в среднем) = 10 -8 см = 1 ангстрем Плотность Ядер = 3600 млн. – 1 млрд. тонн/см 3 Масса ядра ≈ масса атома в целом
Ядро и атом… Размеры - Ядер химических элементов = 10 -13 – 10 -14 см. - Атомов (в среднем) = 10 -8 см = 1 ангстрем Плотность Ядер = 3600 млн. – 1 млрд. тонн/см 3 Масса ядра ≈ масса атома в целом
 Ядро состоит из нуклонов… Протон (р) – положительно заряженный нуклон. Нейтрон (n) – нуклон не имеющий заряда Масса протона = Масса нейтрона = 1/16 атомной массы кислорода = 10 -24 грамм = 1 Масса протонов и нейтронов в ядре всегда меньше их общей массы – дефект масс (масса переходит в энергию).
Ядро состоит из нуклонов… Протон (р) – положительно заряженный нуклон. Нейтрон (n) – нуклон не имеющий заряда Масса протона = Масса нейтрона = 1/16 атомной массы кислорода = 10 -24 грамм = 1 Масса протонов и нейтронов в ядре всегда меньше их общей массы – дефект масс (масса переходит в энергию).
 Соотношения протонов и нейтронов в ядрах атомов Массовое число (М) = количество протонов (р) + количество нейтронов (n) M=p+n p=M–n n=M-p n p Н M Порядковый номер химического элемента в периодической таблице Д. И. Менделеева совпадает с количеством протонов в ядре данного элемента
Соотношения протонов и нейтронов в ядрах атомов Массовое число (М) = количество протонов (р) + количество нейтронов (n) M=p+n p=M–n n=M-p n p Н M Порядковый номер химического элемента в периодической таблице Д. И. Менделеева совпадает с количеством протонов в ядре данного элемента
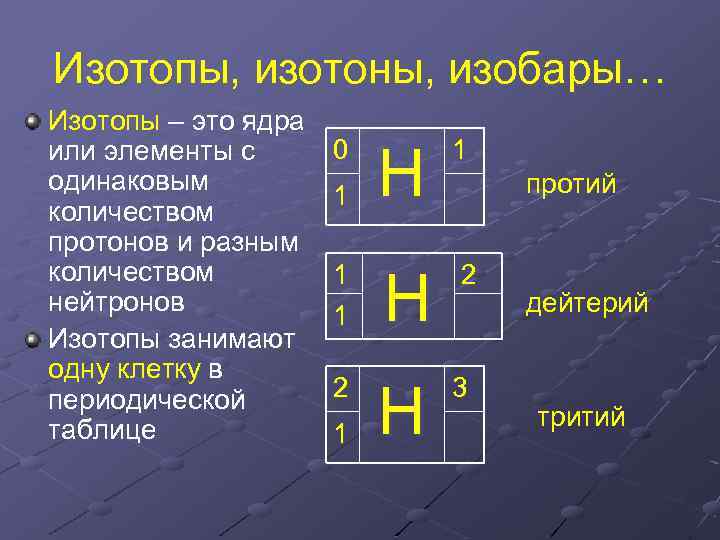 Изотопы, изотоны, изобары… Изотопы – это ядра или элементы с одинаковым количеством протонов и разным количеством нейтронов Изотопы занимают одну клетку в периодической таблице 0 1 1 1 2 1 Н Н Н 1 протий 2 3 дейтерий тритий
Изотопы, изотоны, изобары… Изотопы – это ядра или элементы с одинаковым количеством протонов и разным количеством нейтронов Изотопы занимают одну клетку в периодической таблице 0 1 1 1 2 1 Н Н Н 1 протий 2 3 дейтерий тритий
 Изотоны – это ядра или элементы с одинаковым количеством нейтронов (n) и разным количеством протонов (p) Изобары – это ядра или элементы с одинаковым массовым числом (М) В природе известно – 350 изотопов и более 150 изобаров
Изотоны – это ядра или элементы с одинаковым количеством нейтронов (n) и разным количеством протонов (p) Изобары – это ядра или элементы с одинаковым массовым числом (М) В природе известно – 350 изотопов и более 150 изобаров
 Структура ядра. Две основные гипотезы: Капельная Нейтроны и протоны находятся в непрерывном движении, образуя сферу (каплю), при этом нейтроны удерживают протоны от взаимного отталкивания. Оболочечная Протоны и нейтроны находятся в определенных количествах на определенных энергетических уровнях (как электроны в атомах). Их количество на орбитах строго ограничено.
Структура ядра. Две основные гипотезы: Капельная Нейтроны и протоны находятся в непрерывном движении, образуя сферу (каплю), при этом нейтроны удерживают протоны от взаимного отталкивания. Оболочечная Протоны и нейтроны находятся в определенных количествах на определенных энергетических уровнях (как электроны в атомах). Их количество на орбитах строго ограничено.
 Устойчивость ядра Дефект масс Соотношение протонов и нейтронов Четность / Нечетность нуклонов Радиоактивность Чем больше дефект масс тем устойчивее ядро. Разница в массах превращена в энергию, которая удерживает протоны от взаимного отталкивания.
Устойчивость ядра Дефект масс Соотношение протонов и нейтронов Четность / Нечетность нуклонов Радиоактивность Чем больше дефект масс тем устойчивее ядро. Разница в массах превращена в энергию, которая удерживает протоны от взаимного отталкивания.
 Соотношение протонов и нейтронов. Сила взаимодействия между протонами и нейтронами складывается из кулоновского отталкивания протонов и силы взаимного притяжения нейтронов. С увеличением массового числа элемента увеличивается сила отталкивания, для снижения которой необходимо увеличение количества нейтронов. Элементы начала периодической таблицы Д. И. Менделеева – более устойчивые
Соотношение протонов и нейтронов. Сила взаимодействия между протонами и нейтронами складывается из кулоновского отталкивания протонов и силы взаимного притяжения нейтронов. С увеличением массового числа элемента увеличивается сила отталкивания, для снижения которой необходимо увеличение количества нейтронов. Элементы начала периодической таблицы Д. И. Менделеева – более устойчивые
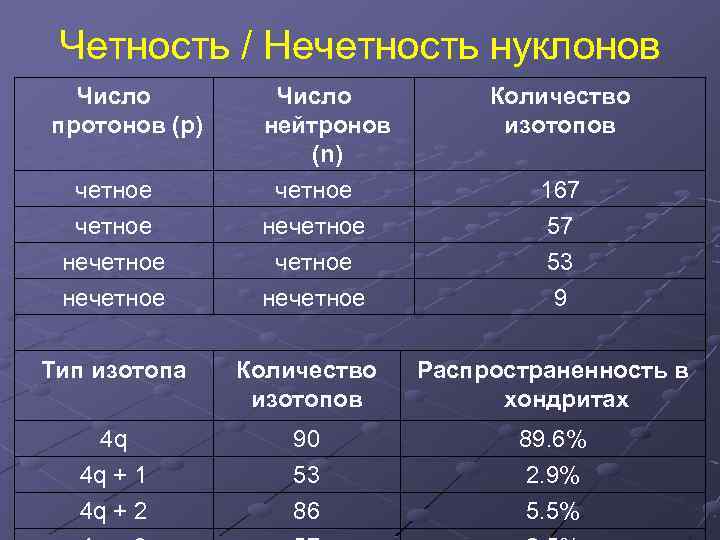 Четность / Нечетность нуклонов Число протонов (р) четное нечетное Число нейтронов (n) четное нечетное Количество изотопов 167 57 53 9 Тип изотопа Количество изотопов Распространенность в хондритах 4 q 4 q + 1 90 53 89. 6% 2. 9% 4 q + 2 86 5. 5%
Четность / Нечетность нуклонов Число протонов (р) четное нечетное Число нейтронов (n) четное нечетное Количество изотопов 167 57 53 9 Тип изотопа Количество изотопов Распространенность в хондритах 4 q 4 q + 1 90 53 89. 6% 2. 9% 4 q + 2 86 5. 5%
 Магические и дваждымагические ядра Ядра у которых количество протонов или нейтронов равно 2, 8, 20, 28, 40, 50, 82, 126 называются магическими. Дваждымагические ядра имеют магическое число и протонов и нейтронов. 2 28 2 He 4, 32 Ni 60, 56 8 8 O 16, 38 20 50 Sr 88, 82 Ba 138, 82 20 Ca 40, 50 70 Sn 120, 126 Pb 208
Магические и дваждымагические ядра Ядра у которых количество протонов или нейтронов равно 2, 8, 20, 28, 40, 50, 82, 126 называются магическими. Дваждымагические ядра имеют магическое число и протонов и нейтронов. 2 28 2 He 4, 32 Ni 60, 56 8 8 O 16, 38 20 50 Sr 88, 82 Ba 138, 82 20 Ca 40, 50 70 Sn 120, 126 Pb 208
 Радиоактивность - способность ядер (атомов) самопроизвольно распадаться с испусканием элементарных частиц и образованием ядра нового элемента (Беккерель и Мария Складовская-Кюри). Радиоактивность – необратимый процесс Виды радиоактивности: α-распад; β-распад; γ-излучение; к – захват; самопроизвольный распад тяжелых элементов на 2 легких элемента с примерно равным массовым числом – спонтанное деление
Радиоактивность - способность ядер (атомов) самопроизвольно распадаться с испусканием элементарных частиц и образованием ядра нового элемента (Беккерель и Мария Складовская-Кюри). Радиоактивность – необратимый процесс Виды радиоактивности: α-распад; β-распад; γ-излучение; к – захват; самопроизвольный распад тяжелых элементов на 2 легких элемента с примерно равным массовым числом – спонтанное деление
 α-распад – характерен для ядер с массовым числом больше 209; β-распад – характерен для ядер с избытком нейтронов; к – захват - характерен для ядер с избытком протонов; Самопроизвольный распад – характерен для самых тяжелых ядер
α-распад – характерен для ядер с массовым числом больше 209; β-распад – характерен для ядер с избытком нейтронов; к – захват - характерен для ядер с избытком протонов; Самопроизвольный распад – характерен для самых тяжелых ядер
 α-распад – поток α-частиц (атомов 22 Не 4) ядро теряет альфа-частицу и элемент смещается на 2 клетки влево в периодической таблице 138 Ra 226 → 2 Не 4 + 136 Rn 222 88 2 86 β-распад – поток β-частиц (электронов) – нейтрон распадается на протон + электрон + нейтрино. Заряд увеличивается на единицу и элемент смещается на 1 клетку вправо 49 Rb 86 → электрон + 48 Sr 86 37 38
α-распад – поток α-частиц (атомов 22 Не 4) ядро теряет альфа-частицу и элемент смещается на 2 клетки влево в периодической таблице 138 Ra 226 → 2 Не 4 + 136 Rn 222 88 2 86 β-распад – поток β-частиц (электронов) – нейтрон распадается на протон + электрон + нейтрино. Заряд увеличивается на единицу и элемент смещается на 1 клетку вправо 49 Rb 86 → электрон + 48 Sr 86 37 38
 к – захват – протоны превращаются в нейтроны в результате захвата орбитального электрона с ближайшей К – орбиты. Заряд уменьшается на 1 → и элемент смещается на 1 клетку влево. 21 K 40 + 19 электрон → 1822 Ar 40 γ-излучение это жесткое радиоизлучение обусловленное переходом ядра из возбужденного в стабильное состояние с выделением энергии. Спонтанное деление – ядра тяжелых элементов распадаются на 2 примерно равные части, соответствующие элементам середины периодической таблицы.
к – захват – протоны превращаются в нейтроны в результате захвата орбитального электрона с ближайшей К – орбиты. Заряд уменьшается на 1 → и элемент смещается на 1 клетку влево. 21 K 40 + 19 электрон → 1822 Ar 40 γ-излучение это жесткое радиоизлучение обусловленное переходом ядра из возбужденного в стабильное состояние с выделением энергии. Спонтанное деление – ядра тяжелых элементов распадаются на 2 примерно равные части, соответствующие элементам середины периодической таблицы.
 Основной закон радиоактивного распада: число распавшихся атомов за единицу времени пропорционально первоначальному числу атомов. Радиоактивность характеризуется постоянной скоростью, константой распада и периодом полураспада. Период полураспада – время, за которое распадается половина первоначального количества первоначального элемента. Константа распада – количество распадов в единицу времени.
Основной закон радиоактивного распада: число распавшихся атомов за единицу времени пропорционально первоначальному числу атомов. Радиоактивность характеризуется постоянной скоростью, константой распада и периодом полураспада. Период полураспада – время, за которое распадается половина первоначального количества первоначального элемента. Константа распада – количество распадов в единицу времени.
 Классификация изотопов Радиоактивные (неустойчивые) – определение абсолютного возраста горных пород и минералов. Стабильные (устойчивые) – период полураспада соизмерим с возрастом Земли. Используются для изучения генезиса минералов и горных пород. Радиогенные – изотопы, которые образовались в результате радиоактивного распада
Классификация изотопов Радиоактивные (неустойчивые) – определение абсолютного возраста горных пород и минералов. Стабильные (устойчивые) – период полураспада соизмерим с возрастом Земли. Используются для изучения генезиса минералов и горных пород. Радиогенные – изотопы, которые образовались в результате радиоактивного распада
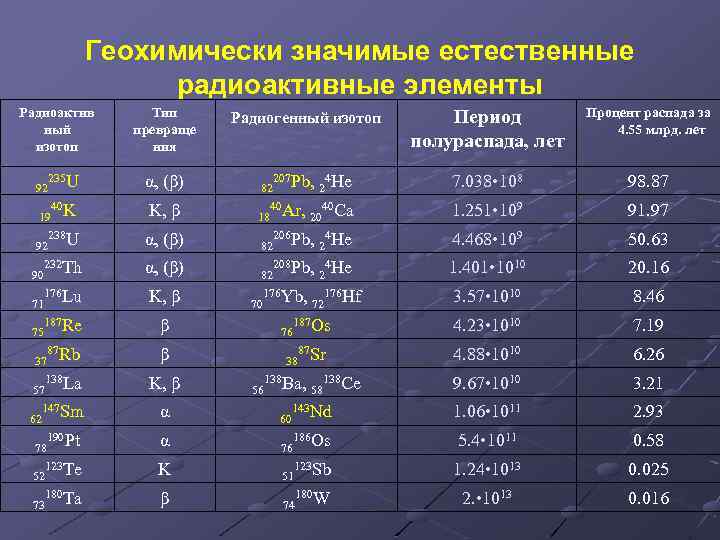 Геохимически значимые естественные радиоактивные элементы Радиоактив ный изотоп Тип превраще ния Период полураспада, лет Процент распада за 4. 55 млрд. лет 207 Pb, 4 He 2 7. 038 • 108 98. 87 40 Ar, 40 Ca 1. 251 • 109 91. 97 Радиогенный изотоп 235 U α, (β) 82 40 K K, β 18 238 U α, (β) 82 206 Pb, 4 He 2 4. 468 • 109 50. 63 90 232 Th α, (β) 82 208 Pb, 4 He 2 1. 401 • 1010 20. 16 71 176 Lu K, β 3. 57 • 1010 8. 46 75 187 Re β 187 Os 4. 23 • 1010 7. 19 87 Rb β 87 Sr 4. 88 • 1010 6. 26 138 La K, β 9. 67 • 1010 3. 21 147 Sm α 60 143 Nd 1. 06 • 1011 2. 93 190 Pt α 76 186 Os 5. 4 • 1011 0. 58 52 123 Te K 51 123 Sb 1. 24 • 1013 0. 025 73 180 Ta β 74 180 W 2. • 1013 0. 016 92 19 92 37 57 62 78 70 176 Yb, 76 38 56 138 Ba, 20 72 58 176 Hf 138 Ce
Геохимически значимые естественные радиоактивные элементы Радиоактив ный изотоп Тип превраще ния Период полураспада, лет Процент распада за 4. 55 млрд. лет 207 Pb, 4 He 2 7. 038 • 108 98. 87 40 Ar, 40 Ca 1. 251 • 109 91. 97 Радиогенный изотоп 235 U α, (β) 82 40 K K, β 18 238 U α, (β) 82 206 Pb, 4 He 2 4. 468 • 109 50. 63 90 232 Th α, (β) 82 208 Pb, 4 He 2 1. 401 • 1010 20. 16 71 176 Lu K, β 3. 57 • 1010 8. 46 75 187 Re β 187 Os 4. 23 • 1010 7. 19 87 Rb β 87 Sr 4. 88 • 1010 6. 26 138 La K, β 9. 67 • 1010 3. 21 147 Sm α 60 143 Nd 1. 06 • 1011 2. 93 190 Pt α 76 186 Os 5. 4 • 1011 0. 58 52 123 Te K 51 123 Sb 1. 24 • 1013 0. 025 73 180 Ta β 74 180 W 2. • 1013 0. 016 92 19 92 37 57 62 78 70 176 Yb, 76 38 56 138 Ba, 20 72 58 176 Hf 138 Ce
 Некоторые «вымершие» изотопы в Солнечной системе «Вымерший» радиоактивный изотоп Период полураспада, лет Al 13 41 Ca 20 53 Mn 25 92 Nb 41 107 Pd 46 129 I 53 135 Cs 55 146 Sm 62 182 Hf 72 244 Pu 94 0. 7 • 10 6 0. 144 • 10 6 3. 7 • 10 6 33 • 10 6 9. 4 • 10 6 16 • 10 6 3 • 10 6 103 • 10 6 ~9. • 10 6 83. • 10 6 26
Некоторые «вымершие» изотопы в Солнечной системе «Вымерший» радиоактивный изотоп Период полураспада, лет Al 13 41 Ca 20 53 Mn 25 92 Nb 41 107 Pd 46 129 I 53 135 Cs 55 146 Sm 62 182 Hf 72 244 Pu 94 0. 7 • 10 6 0. 144 • 10 6 3. 7 • 10 6 33 • 10 6 9. 4 • 10 6 16 • 10 6 3 • 10 6 103 • 10 6 ~9. • 10 6 83. • 10 6 26
 Самые важные стабильные изотопы Углерода – 66 С 12, 68 С 14 Кислорода – 88 О 16, 810 О 18 Серы – 1616 S 32, 1618 S 34 Водорода – 10 Н 1, 11 Н 2, 12 Н 3
Самые важные стабильные изотопы Углерода – 66 С 12, 68 С 14 Кислорода – 88 О 16, 810 О 18 Серы – 1616 S 32, 1618 S 34 Водорода – 10 Н 1, 11 Н 2, 12 Н 3


