Геохимический цикл углерода.ppt
- Количество слайдов: 100
 Геохимический цикл углерода Александр Иванович Попов кафедра почвоведения и экологии почв
Геохимический цикл углерода Александр Иванович Попов кафедра почвоведения и экологии почв
 Геохимия углерода Углерод – основной строительный кирпичик жизни. Углерод (от лат. carbo – уголь) – химический элемент 4 -ой группы главной подгруппы 2 -го периода периодической системы Д. И. Менделеева, порядковый номер 6, атомная масса 12, 0107 2
Геохимия углерода Углерод – основной строительный кирпичик жизни. Углерод (от лат. carbo – уголь) – химический элемент 4 -ой группы главной подгруппы 2 -го периода периодической системы Д. И. Менделеева, порядковый номер 6, атомная масса 12, 0107 2
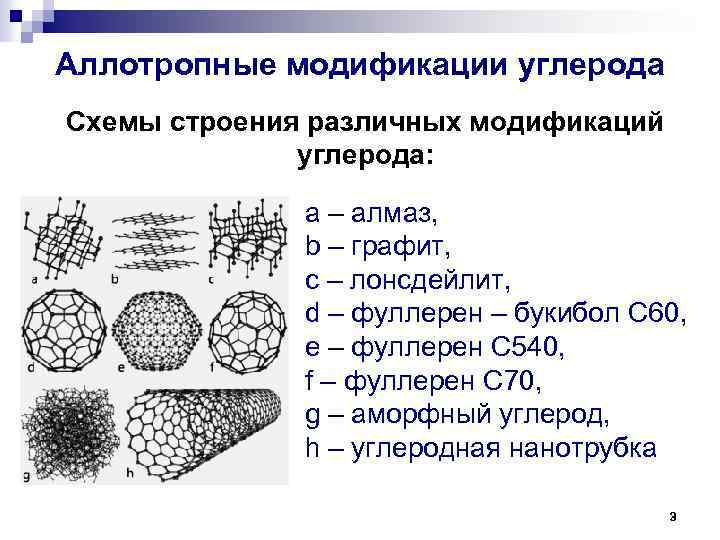 Аллотропные модификации углерода Схемы строения различных модификаций углерода: а – алмаз, b – графит, c – лонсдейлит, d – фуллерен – букибол C 60, e – фуллерен C 540, f – фуллерен C 70, g – аморфный углерод, h – углеродная нанотрубка 3
Аллотропные модификации углерода Схемы строения различных модификаций углерода: а – алмаз, b – графит, c – лонсдейлит, d – фуллерен – букибол C 60, e – фуллерен C 540, f – фуллерен C 70, g – аморфный углерод, h – углеродная нанотрубка 3
 Алмаз Бесцветные разности представляют собой чистый углерод. Окрашенные и непрозрачные алмазы содержат примеси двуокиси кремния (Si. O 2), окиси магния (Mg. O), окиси кальция (Са. О), закиси железа (Fe. O), окиси железа (Fe 2 O 3), окиси алюминия (Аl 2 О 3), окиси титана (Тi. O 2); в виде включений встречаются графит и другие минералы. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается за секунды. 4
Алмаз Бесцветные разности представляют собой чистый углерод. Окрашенные и непрозрачные алмазы содержат примеси двуокиси кремния (Si. O 2), окиси магния (Mg. O), окиси кальция (Са. О), закиси железа (Fe. O), окиси железа (Fe 2 O 3), окиси алюминия (Аl 2 О 3), окиси титана (Тi. O 2); в виде включений встречаются графит и другие минералы. При атмосферном давлении и температуре выше 1200 K алмаз начинает переходить в графит, выше 2100 K превращение совершается за секунды. 4
 Графит Углерод (С), тонкочешуйчатый, кристаллический, нередко загрязненный. При нормальных условиях из аллотропных модификаций углерода термодинамически устойчив только графит. При высоких давлениях и относительно низких температурах (около 1200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решеткой типа вюрцита – лонсдейлит. 5
Графит Углерод (С), тонкочешуйчатый, кристаллический, нередко загрязненный. При нормальных условиях из аллотропных модификаций углерода термодинамически устойчив только графит. При высоких давлениях и относительно низких температурах (около 1200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решеткой типа вюрцита – лонсдейлит. 5
 Лонсдейлит, или алмаз гексагональный. Открыт в 1966 г. или ранее, первая публикация 1967 г. Одновременно он обнаружен в природе, в метеоритном кратере. В настоящее время группе американских и китайских ученых удалось доказать, что самый твердый на сегодняшний день материал – специально обработанный лонсдейлит. Он оказался на 58 процентов твёрже алмаза. 6
Лонсдейлит, или алмаз гексагональный. Открыт в 1966 г. или ранее, первая публикация 1967 г. Одновременно он обнаружен в природе, в метеоритном кратере. В настоящее время группе американских и китайских ученых удалось доказать, что самый твердый на сегодняшний день материал – специально обработанный лонсдейлит. Он оказался на 58 процентов твёрже алмаза. 6
 Фуллерены, бакиболы или букиболы – молекулярные соединения, представляющие собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Своим названием эти соединения обязаны инженеру и дизайнеру Ричарду Бакминстеру Фуллеру. Астрономы из Университета Западного Онтарио (Канада) и Корнеллского университета установили, что в планетарной туманности Tc 1 находятся тяжёлые молекулы углерода – фуллерены С 60 и С 70. 7
Фуллерены, бакиболы или букиболы – молекулярные соединения, представляющие собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Своим названием эти соединения обязаны инженеру и дизайнеру Ричарду Бакминстеру Фуллеру. Астрономы из Университета Западного Онтарио (Канада) и Корнеллского университета установили, что в планетарной туманности Tc 1 находятся тяжёлые молекулы углерода – фуллерены С 60 и С 70. 7
 Шунгит Получил свое название от карельской деревни Шуньга (Россия, Олонецкий район). Именно там расположено единственное в мире месторождение этого уникального минерала. Старорусское название – аспидный камень. Шунгит представляет собой промежуточную форму между аморфным углеродом и графитом. В этом минерале также обнаружены фуллерены. 8
Шунгит Получил свое название от карельской деревни Шуньга (Россия, Олонецкий район). Именно там расположено единственное в мире месторождение этого уникального минерала. Старорусское название – аспидный камень. Шунгит представляет собой промежуточную форму между аморфным углеродом и графитом. В этом минерале также обнаружены фуллерены. 8
 Аморфный углерод В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, технический углерод, сажа, активный уголь 9
Аморфный углерод В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, технический углерод, сажа, активный уголь 9
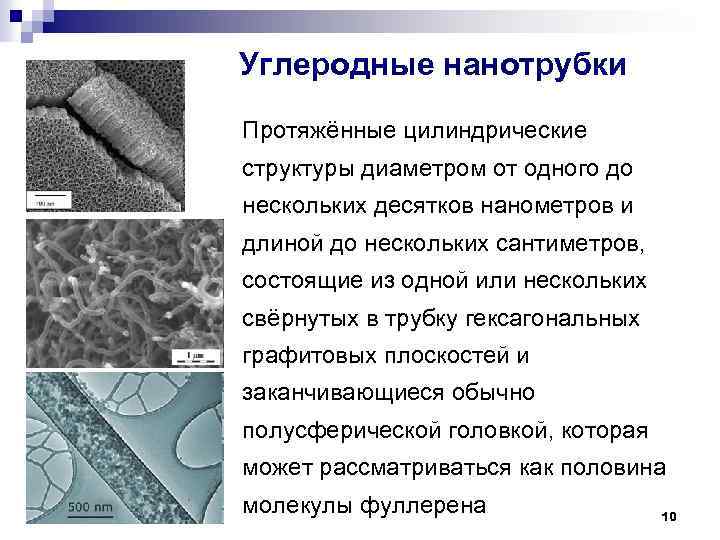 Углеродные нанотрубки Протяжённые цилиндрические структуры диаметром от одного до нескольких десятков нанометров и длиной до нескольких сантиметров, состоящие из одной или нескольких свёрнутых в трубку гексагональных графитовых плоскостей и заканчивающиеся обычно полусферической головкой, которая может рассматриваться как половина молекулы фуллерена 10
Углеродные нанотрубки Протяжённые цилиндрические структуры диаметром от одного до нескольких десятков нанометров и длиной до нескольких сантиметров, состоящие из одной или нескольких свёрнутых в трубку гексагональных графитовых плоскостей и заканчивающиеся обычно полусферической головкой, которая может рассматриваться как половина молекулы фуллерена 10
 Карбин Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=). Форма углерода на основе spгибридизации углеродных атомов. Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите), кроме того, получен искусственно 11
Карбин Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=). Форма углерода на основе spгибридизации углеродных атомов. Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите), кроме того, получен искусственно 11
 Геохимия изотопов углерода Изотопы углерода – разновидности атомов (и ядер) химического элемента углерода, имеющие разное содержание нейтронов в ядре. Углерод имеет два стабильных изотопа – 12 C и 13 C. Известны также 13 радиоактивных изотопов углерода (от 8 C до 22 C), из которых один – 14 C – встречается в природе (его содержание в атмосферном углероде около 10− 12) 12
Геохимия изотопов углерода Изотопы углерода – разновидности атомов (и ядер) химического элемента углерода, имеющие разное содержание нейтронов в ядре. Углерод имеет два стабильных изотопа – 12 C и 13 C. Известны также 13 радиоактивных изотопов углерода (от 8 C до 22 C), из которых один – 14 C – встречается в природе (его содержание в атмосферном углероде около 10− 12) 12
 Геохимия изотопов углерода Изотоп углерода 14 C образуется в атмосфере из атмосферного азота под действием космического излучения. С небольшой скоростью углерод-14 образуется и в земной коре. В живом организме 14 C находится в равновесии с окружающей средой. После гибели организма он перестаёт обмениваться углеродом со средой, и содержание 14 C начинает медленно уменьшаться (его период полураспада равен 5, 70 ± 0, 03 тыс. лет). 13
Геохимия изотопов углерода Изотоп углерода 14 C образуется в атмосфере из атмосферного азота под действием космического излучения. С небольшой скоростью углерод-14 образуется и в земной коре. В живом организме 14 C находится в равновесии с окружающей средой. После гибели организма он перестаёт обмениваться углеродом со средой, и содержание 14 C начинает медленно уменьшаться (его период полураспада равен 5, 70 ± 0, 03 тыс. лет). 13
 Геохимия изотопов углерода Распространенность в природе трёх изотопов углерода резко различна: - кларк 12 С составляет 98, 89 %, - кларк 13 С – 1, 10096 (по Ниру); - количество радиоактивного изотопа С 14 вообще совершенно ничтожно. Соотношение 12 С/13 С в подавляющем большинстве природных веществ составляет 88 -93. Решающее влияние на соотношение стабильных изотопов углерода оказывает несколько различное поведение изотопов в разных химических связях 14
Геохимия изотопов углерода Распространенность в природе трёх изотопов углерода резко различна: - кларк 12 С составляет 98, 89 %, - кларк 13 С – 1, 10096 (по Ниру); - количество радиоактивного изотопа С 14 вообще совершенно ничтожно. Соотношение 12 С/13 С в подавляющем большинстве природных веществ составляет 88 -93. Решающее влияние на соотношение стабильных изотопов углерода оказывает несколько различное поведение изотопов в разных химических связях 14
 Геохимия изотопов углерода Соотношения изотопов выражаются обычно при помощи величин «приращения» какого-либо одного из пары изотопов: где (13 С/12 С)обр – величины определенные для данного образца; (13 С/12 С)ст – то же для выбранного стандарта. Величины δС обычно положительные, если содержание более тяжелого изотопа в образце больше, чем у стандарта, и отрицательные – в обратном случае. 15
Геохимия изотопов углерода Соотношения изотопов выражаются обычно при помощи величин «приращения» какого-либо одного из пары изотопов: где (13 С/12 С)обр – величины определенные для данного образца; (13 С/12 С)ст – то же для выбранного стандарта. Величины δС обычно положительные, если содержание более тяжелого изотопа в образце больше, чем у стандарта, и отрицательные – в обратном случае. 15
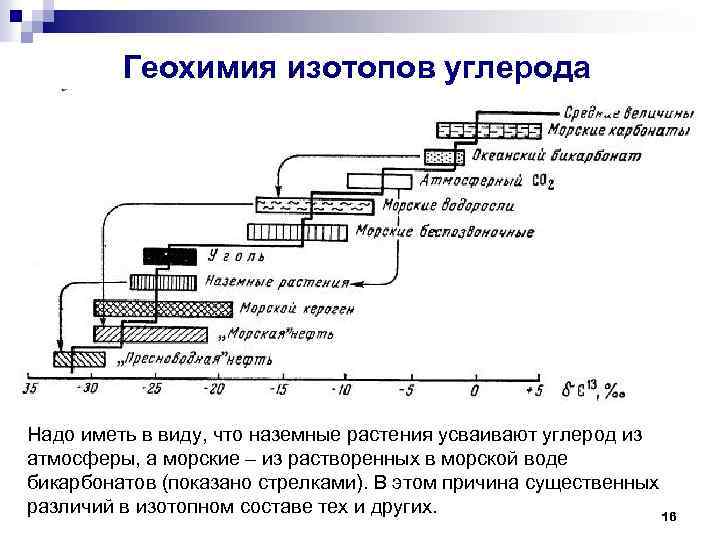 Геохимия изотопов углерода Надо иметь в виду, что наземные растения усваивают углерод из атмосферы, а морские – из растворенных в морской воде бикарбонатов (показано стрелками). В этом причина существенных различий в изотопном составе тех и других. 16
Геохимия изотопов углерода Надо иметь в виду, что наземные растения усваивают углерод из атмосферы, а морские – из растворенных в морской воде бикарбонатов (показано стрелками). В этом причина существенных различий в изотопном составе тех и других. 16
 Геохимия изотопов углерода Из диаграммы следует, что максимальные концентрации тяжелого стабильного изотопа углерода присущи веществам с кислородными связями углерода (карбонатам и СO 2), минимальные – веществам, в которых особенно развиты углерод-водородные связи (нефтям); в то же время вещество живых организмов, для которого характерны и те и другие связи, в определенной мере занимает промежуточное положение. 17
Геохимия изотопов углерода Из диаграммы следует, что максимальные концентрации тяжелого стабильного изотопа углерода присущи веществам с кислородными связями углерода (карбонатам и СO 2), минимальные – веществам, в которых особенно развиты углерод-водородные связи (нефтям); в то же время вещество живых организмов, для которого характерны и те и другие связи, в определенной мере занимает промежуточное положение. 17
 Геохимия изотопов углерода Геохимические исследования показали, что в природе все углеродсодержащие минералы (например, графит и алмаз) имеют определенное соотношение между этими двумя изотопами. Природные алмазы изотопно "тяжелее" природного графита, т. е. в них содержится относительно больше тяжелого изотопа углерода 13 С. Более того, в кимберлитовых трубках алмазы изотопно тяжелее карбонатов окружающих пород 18
Геохимия изотопов углерода Геохимические исследования показали, что в природе все углеродсодержащие минералы (например, графит и алмаз) имеют определенное соотношение между этими двумя изотопами. Природные алмазы изотопно "тяжелее" природного графита, т. е. в них содержится относительно больше тяжелого изотопа углерода 13 С. Более того, в кимберлитовых трубках алмазы изотопно тяжелее карбонатов окружающих пород 18
 Геохимия изотопов углерода Историческая геохимия изотопов углерода пока не разработана. Радиоактивный изотоп углерода 14 С представляет интерес для определения абсолютного возраста молодых геологических объектов (осадков возрастом не более 40 000 лет), для изучения геохимической роли технических факторов, в археологии. Измерение радиоактивности органических веществ растительного и животного происхождения, обусловленной изотопом 14 C, применяется также для радиоуглеродного анализа возраста старинных предметов и природных образцов 19
Геохимия изотопов углерода Историческая геохимия изотопов углерода пока не разработана. Радиоактивный изотоп углерода 14 С представляет интерес для определения абсолютного возраста молодых геологических объектов (осадков возрастом не более 40 000 лет), для изучения геохимической роли технических факторов, в археологии. Измерение радиоактивности органических веществ растительного и животного происхождения, обусловленной изотопом 14 C, применяется также для радиоуглеродного анализа возраста старинных предметов и природных образцов 19
 Нахождение в природе Содержание углерода в земной коре 0, 1 % по массе. Свободный углерод находится в природе в виде алмазов и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых – антрацита (94 -97 % С), бурых углей (64 -80 % С), каменных углей (76 -95 % С), горючих сланцев (56 -78 % С), нефти (82 -87 % С), горючих природных газов (до 99 % метана), торфа (53 -56 % С), а также битумов и др. В атмосфере и гидросфере находится в виде диоксида углерода СО 2, в воздухе 0, 046 % СО 2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %) 20
Нахождение в природе Содержание углерода в земной коре 0, 1 % по массе. Свободный углерод находится в природе в виде алмазов и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых – антрацита (94 -97 % С), бурых углей (64 -80 % С), каменных углей (76 -95 % С), горючих сланцев (56 -78 % С), нефти (82 -87 % С), горючих природных газов (до 99 % метана), торфа (53 -56 % С), а также битумов и др. В атмосфере и гидросфере находится в виде диоксида углерода СО 2, в воздухе 0, 046 % СО 2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %) 20
 Нахождение в природе В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина) 21
Нахождение в природе В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина) 21
 Формы углерода в природе Углерод встречается в нескольких основных формах: n n в виде метана и других углеводородов он содержится в мантии, земной коре, атмосфере и гидросфере (восстановленные соединения), в виде графита, алмаза и карбида в коре и мантии (нейтральное состояние), в виде углекислого газа, карбонатов и примеси в силикатах в мантии, земной коре, атмосфере и гидросфере (окисленные соединения), в виде сложных биоорганических соединений в биосфере, почве и океане. 22
Формы углерода в природе Углерод встречается в нескольких основных формах: n n в виде метана и других углеводородов он содержится в мантии, земной коре, атмосфере и гидросфере (восстановленные соединения), в виде графита, алмаза и карбида в коре и мантии (нейтральное состояние), в виде углекислого газа, карбонатов и примеси в силикатах в мантии, земной коре, атмосфере и гидросфере (окисленные соединения), в виде сложных биоорганических соединений в биосфере, почве и океане. 22
 Гидрат метана в природе Большинство природных газов (CH 4, C 2 H 6, C 3 H 8, CO 2, N 2, H 2 S, изобутан, и т. п. ) образуют гидраты, которые существуют при определённых термобарических условиях. Область их существования приурочена к морским донным осадкам и к областям многолетнемёрзлых пород. Преобладающими природными газовыми гидратами являются гидраты (клатраты) метана и диоксида углерода 23
Гидрат метана в природе Большинство природных газов (CH 4, C 2 H 6, C 3 H 8, CO 2, N 2, H 2 S, изобутан, и т. п. ) образуют гидраты, которые существуют при определённых термобарических условиях. Область их существования приурочена к морским донным осадкам и к областям многолетнемёрзлых пород. Преобладающими природными газовыми гидратами являются гидраты (клатраты) метана и диоксида углерода 23
 Клатрат метана – супрамолекулярное соединение метана с водой, наиболее широко распространённый в природе газовый гидрат. Название «клатраты» (от лат. Модель гидрата метана на молекулярном уровне. Вокруг молекулы метана образуется решетка молекул воды (льда). clathratus – «сажать в клетку» ), было введено Пауэллом в 1948 г. 24
Клатрат метана – супрамолекулярное соединение метана с водой, наиболее широко распространённый в природе газовый гидрат. Название «клатраты» (от лат. Модель гидрата метана на молекулярном уровне. Вокруг молекулы метана образуется решетка молекул воды (льда). clathratus – «сажать в клетку» ), было введено Пауэллом в 1948 г. 24
 Клатрат метана Внешне клатрат метана похож на грязный лед, а по консистенции на шербет, горюч. По различным оценкам, запасы углеводородов в гидратах составляют от 1, 8· 1014 до 7, 6· 1018 м 3 (!) По консервативным оценкам, мировые запасы клатрата метана составляют примерно 3 триллиона тонн: при нынешнем уровне потребления газа такого количества человечеству их хватит на тысячу лет. 25
Клатрат метана Внешне клатрат метана похож на грязный лед, а по консистенции на шербет, горюч. По различным оценкам, запасы углеводородов в гидратах составляют от 1, 8· 1014 до 7, 6· 1018 м 3 (!) По консервативным оценкам, мировые запасы клатрата метана составляют примерно 3 триллиона тонн: при нынешнем уровне потребления газа такого количества человечеству их хватит на тысячу лет. 25
 Клатрат метана 26
Клатрат метана 26
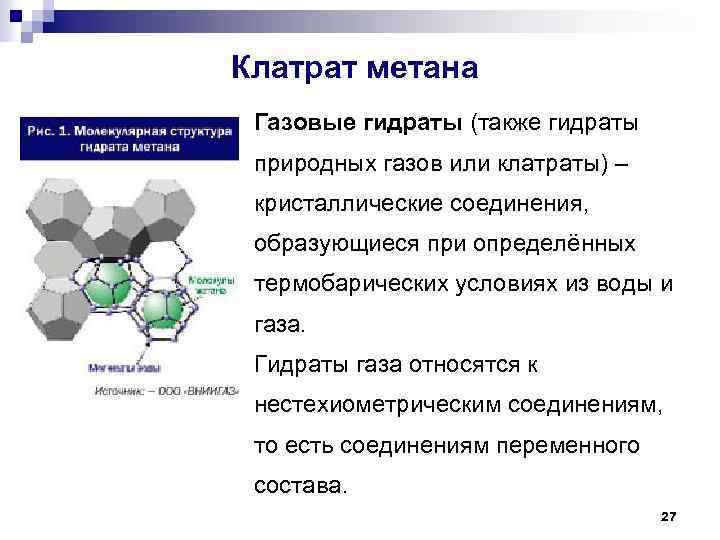 Клатрат метана Газовые гидраты (также гидраты природных газов или клатраты) – кристаллические соединения, образующиеся при определённых термобарических условиях из воды и газа. Гидраты газа относятся к нестехиометрическим соединениям, то есть соединениям переменного состава. 27
Клатрат метана Газовые гидраты (также гидраты природных газов или клатраты) – кристаллические соединения, образующиеся при определённых термобарических условиях из воды и газа. Гидраты газа относятся к нестехиометрическим соединениям, то есть соединениям переменного состава. 27
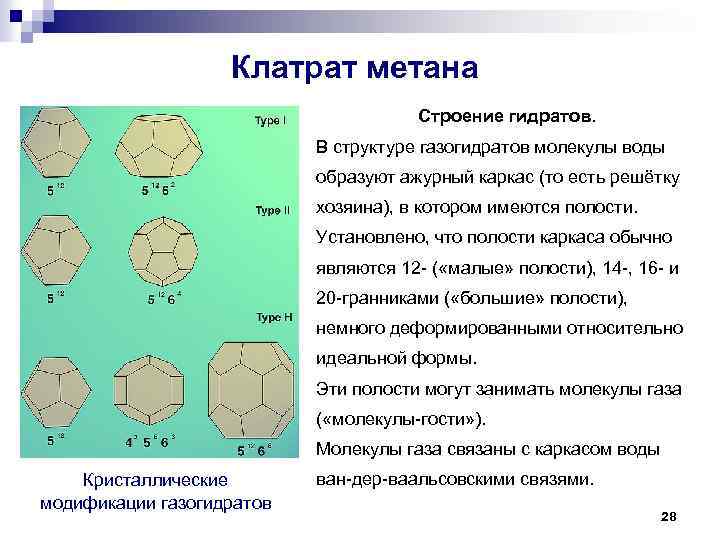 Клатрат метана Строение гидратов. В структуре газогидратов молекулы воды образуют ажурный каркас (то есть решётку хозяина), в котором имеются полости. Установлено, что полости каркаса обычно являются 12 - ( «малые» полости), 14 -, 16 - и 20 -гранниками ( «большие» полости), немного деформированными относительно идеальной формы. Эти полости могут занимать молекулы газа ( «молекулы-гости» ). Молекулы газа связаны с каркасом воды Кристаллические модификации газогидратов ван-дер-ваальсовскими связями. 28
Клатрат метана Строение гидратов. В структуре газогидратов молекулы воды образуют ажурный каркас (то есть решётку хозяина), в котором имеются полости. Установлено, что полости каркаса обычно являются 12 - ( «малые» полости), 14 -, 16 - и 20 -гранниками ( «большие» полости), немного деформированными относительно идеальной формы. Эти полости могут занимать молекулы газа ( «молекулы-гости» ). Молекулы газа связаны с каркасом воды Кристаллические модификации газогидратов ван-дер-ваальсовскими связями. 28
 Клатрат метана Кристаллогидраты – специфические соединения воды и углеводородов, в которых газы входят в полости структуры льда. Кристаллогидраты обладают высоким электрическим сопротивлением, хорошо проводят звук, и практически непроницаемы для свободных молекул воды и газа. Для них характерна аномальна низкая теплопроводность (для гидрата метана при 273 К в пять раз ниже, чем у льда) Плотность гидрата ниже плотности воды и льда (для гидрата метана около 900 кг/м³) 29
Клатрат метана Кристаллогидраты – специфические соединения воды и углеводородов, в которых газы входят в полости структуры льда. Кристаллогидраты обладают высоким электрическим сопротивлением, хорошо проводят звук, и практически непроницаемы для свободных молекул воды и газа. Для них характерна аномальна низкая теплопроводность (для гидрата метана при 273 К в пять раз ниже, чем у льда) Плотность гидрата ниже плотности воды и льда (для гидрата метана около 900 кг/м³) 29
 Клатрат метана Клатраты метана устойчивы при низкой температуре и повышенном давлении. Гидрат метана стабилен при температуре 0 °C и давлении порядка 25 бар и выше. Такое давление имеет место на глубине океана около 250 м. При атмосферном давлении гидрат метана сохраняет устойчивость при температуре − 80 °C. 30
Клатрат метана Клатраты метана устойчивы при низкой температуре и повышенном давлении. Гидрат метана стабилен при температуре 0 °C и давлении порядка 25 бар и выше. Такое давление имеет место на глубине океана около 250 м. При атмосферном давлении гидрат метана сохраняет устойчивость при температуре − 80 °C. 30
 Клатрат метана Кристаллы клатратного гидрата метана при обычном давлении плавится при очень низкой температуре, но уже при давлениях выше 25 атмосфер его температура плавления становится положительной. Следовательно, если такие кристаллы будут находиться под давлением водного слоя толще 250 м, они могут быть вполне устойчивыми в реальных условиях 31
Клатрат метана Кристаллы клатратного гидрата метана при обычном давлении плавится при очень низкой температуре, но уже при давлениях выше 25 атмосфер его температура плавления становится положительной. Следовательно, если такие кристаллы будут находиться под давлением водного слоя толще 250 м, они могут быть вполне устойчивыми в реальных условиях 31
 Клатрат метана Метангидраты всё же могут довольно долго существовать в условиях низких давлений и при более высокой температуре, но обязательно отрицательной – в этом случае они находятся в метастабильном состоянии, их существование обеспечивает эффект самоконсервации – при разложении метангидраты покрываются ледяной коркой, что мешает дальнейшему разложению 32
Клатрат метана Метангидраты всё же могут довольно долго существовать в условиях низких давлений и при более высокой температуре, но обязательно отрицательной – в этом случае они находятся в метастабильном состоянии, их существование обеспечивает эффект самоконсервации – при разложении метангидраты покрываются ледяной коркой, что мешает дальнейшему разложению 32
 Клатрат метана Благодаря своей клатратной структуре единичный объём газового гидрата может содержать до 160 -180 объёмов чистого газа. Если нагревать гидрат метана, либо понизить давление, соединение распадается на воду и природный газ (метан). Из одного кубического метра гидрата метана при нормальном атмосферном давлении можно получить 164 кубических метра природного газа 33
Клатрат метана Благодаря своей клатратной структуре единичный объём газового гидрата может содержать до 160 -180 объёмов чистого газа. Если нагревать гидрат метана, либо понизить давление, соединение распадается на воду и природный газ (метан). Из одного кубического метра гидрата метана при нормальном атмосферном давлении можно получить 164 кубических метра природного газа 33
 Клатрат метана При увеличении температуры и уменьшении давления гидраты метана становятся неустойчивы и могут разлагаться взрывным образом на газ и воду с поглощением большого количества теплоты. Разложение гидрата в замкнутом объёме либо в пористой среде (естественные условия) приводит к значительному повышению давления 34
Клатрат метана При увеличении температуры и уменьшении давления гидраты метана становятся неустойчивы и могут разлагаться взрывным образом на газ и воду с поглощением большого количества теплоты. Разложение гидрата в замкнутом объёме либо в пористой среде (естественные условия) приводит к значительному повышению давления 34
 Клатрат метана Клатраты метана образуются в толще вечной мерзлоты или под океанским дном на континентальном шельфе, но иногда и прямо на дне моря Несмотря на то, что запасы гидрата метана на планете огромны, тем не менее до сих пор это соединение практически не используется как энергетический ресурс 35
Клатрат метана Клатраты метана образуются в толще вечной мерзлоты или под океанским дном на континентальном шельфе, но иногда и прямо на дне моря Несмотря на то, что запасы гидрата метана на планете огромны, тем не менее до сих пор это соединение практически не используется как энергетический ресурс 35
 Гипотеза о метангидратном ружье Обобщённое название серии гипотез о том, что растущий уровень температур океана (и/или падение уровня океана) может запустить внезапное высвобождение метана из отложений гидратов метана под морским дном, по причине того, что метан сам по себе является сильным парниковым газом в свою очередь приведёт к дальнейшему росту температур и дальнейшей дестабилизации гидратов метана – в результате запуская самоусиливающийся процесс, в той же мере неостановимый, как уже начавшийся выстрел из ружья 36
Гипотеза о метангидратном ружье Обобщённое название серии гипотез о том, что растущий уровень температур океана (и/или падение уровня океана) может запустить внезапное высвобождение метана из отложений гидратов метана под морским дном, по причине того, что метан сам по себе является сильным парниковым газом в свою очередь приведёт к дальнейшему росту температур и дальнейшей дестабилизации гидратов метана – в результате запуская самоусиливающийся процесс, в той же мере неостановимый, как уже начавшийся выстрел из ружья 36
 Гипотеза о метангидратном ружье В своей исходной форме гипотеза предполагает, что «метангидратное ружьё» самоусиливающемуся может внезапному привести к глобальному потеплению в течение времени, меньшем, чем время человеческой жизни, и могло быть ответственным за периоды потепления в течение и в конце последнего ледникового периода. Правда, теперь это считается маловероятным 37
Гипотеза о метангидратном ружье В своей исходной форме гипотеза предполагает, что «метангидратное ружьё» самоусиливающемуся может внезапному привести к глобальному потеплению в течение времени, меньшем, чем время человеческой жизни, и могло быть ответственным за периоды потепления в течение и в конце последнего ледникового периода. Правда, теперь это считается маловероятным 37
 Гипотеза о метангидратном ружье Тем не менее появляется всё больше строгих доказательств того, что самоусиливающееся разложение метангидратов могло привести к резким изменениям океана и атмосферы Земли несколько раз в прошлом в течение промежутков времени в десятки тысяч лет; наиболее заметным среди этих событий Массовое было пермское вымирание, когда 96 % всех морских видов вымерло 251 миллион лет назад 38
Гипотеза о метангидратном ружье Тем не менее появляется всё больше строгих доказательств того, что самоусиливающееся разложение метангидратов могло привести к резким изменениям океана и атмосферы Земли несколько раз в прошлом в течение промежутков времени в десятки тысяч лет; наиболее заметным среди этих событий Массовое было пермское вымирание, когда 96 % всех морских видов вымерло 251 миллион лет назад 38
 Гипотеза о метангидратном ружье Считается, что это было основным фактором потепления на 6 °C в во время Пермского вымирания, поскольку метан является гораздо более сильным парниковым газом, чем CO 2 (несмотря на то, что время жизни метана в атмосфере только 12 лет, он имеет потенциал глобального потепления в 62 в течение 12 лет и 23 в течение 100 лет). Эта точка зрения высвобождение также метана предполагает, приведёт к что снижению доступного количества кислорода в атмосфере 39
Гипотеза о метангидратном ружье Считается, что это было основным фактором потепления на 6 °C в во время Пермского вымирания, поскольку метан является гораздо более сильным парниковым газом, чем CO 2 (несмотря на то, что время жизни метана в атмосфере только 12 лет, он имеет потенциал глобального потепления в 62 в течение 12 лет и 23 в течение 100 лет). Эта точка зрения высвобождение также метана предполагает, приведёт к что снижению доступного количества кислорода в атмосфере 39
 Гипотеза о метангидратном ружье И в настоящее время по мере наступления глобального потепления молекулярные соединения метана и льда могут начать распадаться. Уже сейчас из вечной мерзлоты выделяется чуть менее четырех миллионов тонн метана ежегодно. При этом известно, что процесс ускоряется – за тридцать лет наблюдения эмиссия парникового газа увеличилась на 58 %. 40
Гипотеза о метангидратном ружье И в настоящее время по мере наступления глобального потепления молекулярные соединения метана и льда могут начать распадаться. Уже сейчас из вечной мерзлоты выделяется чуть менее четырех миллионов тонн метана ежегодно. При этом известно, что процесс ускоряется – за тридцать лет наблюдения эмиссия парникового газа увеличилась на 58 %. 40
 Гипотеза о метангидратном ружье Дно большинства озёр севера Сибири покрыто едомой – вечной мерзлотой плейстоценового периода, богатой большим количеством органических соединений, в том числе и метаносодержащими соединениями. Когда потепление доберется до этих водоёмов, можно ожидать скачкообразного увеличения выброса метана 41
Гипотеза о метангидратном ружье Дно большинства озёр севера Сибири покрыто едомой – вечной мерзлотой плейстоценового периода, богатой большим количеством органических соединений, в том числе и метаносодержащими соединениями. Когда потепление доберется до этих водоёмов, можно ожидать скачкообразного увеличения выброса метана 41
 Гипотеза о метангидратном ружье Учёные также получили доказательства того, что со дна Арктики поднимается парниковый газ метан. У берегов Западного Шпицбергена обнаружено более 250 метановых шлейфов. Исследователи выяснили, что метан поднимается с глубин 150– 400 м, на глубине более 400 м с гидратом ничего не происходит. 30 лет назад этот порог находился на глубине 360 метров. За этот период температура океана увеличилась на один градус. Метановые пузырьки, обнаруженные сонаром 42
Гипотеза о метангидратном ружье Учёные также получили доказательства того, что со дна Арктики поднимается парниковый газ метан. У берегов Западного Шпицбергена обнаружено более 250 метановых шлейфов. Исследователи выяснили, что метан поднимается с глубин 150– 400 м, на глубине более 400 м с гидратом ничего не происходит. 30 лет назад этот порог находился на глубине 360 метров. За этот период температура океана увеличилась на один градус. Метановые пузырьки, обнаруженные сонаром 42
 Гипотеза о метангидратном ружье Возможные последствия Согласно Джорджу Рёскину, внезапное высвобождение метана (подобное взрыву озера Ниос) из толщи океанских вод может привести как к глобальному потеплению, так и к глобальному похолоданию. Взрыв и горение метана приведут к образованию большого количества смога и пыли, которые приведут к глобальному похолоданию. Результат соревнования между охлаждением и нагреванием предсказать трудно. 43
Гипотеза о метангидратном ружье Возможные последствия Согласно Джорджу Рёскину, внезапное высвобождение метана (подобное взрыву озера Ниос) из толщи океанских вод может привести как к глобальному потеплению, так и к глобальному похолоданию. Взрыв и горение метана приведут к образованию большого количества смога и пыли, которые приведут к глобальному похолоданию. Результат соревнования между охлаждением и нагреванием предсказать трудно. 43
 Углерод в атмосфере Перенос углерода между различными геохимическими резервуарами осуществляется через атмосферу и Мировой океан. В атмосфере углерод содержится в виде углекислого газа, угарного газа, метана и некоторых других углеводородов. Содержание СО 2 сейчас составляет ~0, 04 % (увеличилось на 31 %, по сравнению с доиндустриальной эпохой), метана ~1, 7 ppm (увеличилось на 149 %); содержание СО ~0, 1 ppm. Метан и углекислый газ обладают парниковым эффектом, угарный газ такого влияния не оказывает 44
Углерод в атмосфере Перенос углерода между различными геохимическими резервуарами осуществляется через атмосферу и Мировой океан. В атмосфере углерод содержится в виде углекислого газа, угарного газа, метана и некоторых других углеводородов. Содержание СО 2 сейчас составляет ~0, 04 % (увеличилось на 31 %, по сравнению с доиндустриальной эпохой), метана ~1, 7 ppm (увеличилось на 149 %); содержание СО ~0, 1 ppm. Метан и углекислый газ обладают парниковым эффектом, угарный газ такого влияния не оказывает 44
 Углерод в атмосфере Для атмосферных газов применяется понятие время жизни газа в атмосфере, это время за которое в атмосферу поступает столько же газа, сколько его содержится в атмосфере. Время жизни метана оценивается в 10 -14 лет, а время жизни углекислого газа оценивается в 3 -5 лет. Угарный газ (СО) окисляется до СО 2 за несколько месяцев. 45
Углерод в атмосфере Для атмосферных газов применяется понятие время жизни газа в атмосфере, это время за которое в атмосферу поступает столько же газа, сколько его содержится в атмосфере. Время жизни метана оценивается в 10 -14 лет, а время жизни углекислого газа оценивается в 3 -5 лет. Угарный газ (СО) окисляется до СО 2 за несколько месяцев. 45
 Углерод в атмосфере Метан поступает в атмосферу в результате анаэробного разложения растительных остатков. Основными источниками поступления метана в современную атмосферу являются болота и тропические леса. Современная атмосфера содержит большое количество кислорода, и метан в ней быстро окисляется. 46
Углерод в атмосфере Метан поступает в атмосферу в результате анаэробного разложения растительных остатков. Основными источниками поступления метана в современную атмосферу являются болота и тропические леса. Современная атмосфера содержит большое количество кислорода, и метан в ней быстро окисляется. 46
 Углерод в атмосфере В настоящее геологическое время доминирующим циклом является кругооборот CO 2, однако в ранней истории Земли ситуация была принципиально иной и метановый цикл доминировал, а углекислотный имел подчинённое значение. Углекислый газ атмосферы является источником углерода для других приповерхностных геосфер. 47
Углерод в атмосфере В настоящее геологическое время доминирующим циклом является кругооборот CO 2, однако в ранней истории Земли ситуация была принципиально иной и метановый цикл доминировал, а углекислотный имел подчинённое значение. Углекислый газ атмосферы является источником углерода для других приповерхностных геосфер. 47
 Углерод в океане Океан является исключительно важным резервуаром углерода. Общее количество элемента в нём в 100 раз больше, чем содержится в атмосфере. Океан через поверхность может обмениваться углекислым газом с атмосферой, и посредством осаждения и растворения карбонатов с осадочным чехлом Земли. 48
Углерод в океане Океан является исключительно важным резервуаром углерода. Общее количество элемента в нём в 100 раз больше, чем содержится в атмосфере. Океан через поверхность может обмениваться углекислым газом с атмосферой, и посредством осаждения и растворения карбонатов с осадочным чехлом Земли. 48
 Углерод в океане Гидросферу можно разделить на три геохимических резервуара: n приповерхностный слой, n глубокие воды, n слой морских осадков, способных к обмену углекислотой с водой. Эти резервуары различаются по времени отклика на внешние изменения углеродного цикла. 49
Углерод в океане Гидросферу можно разделить на три геохимических резервуара: n приповерхностный слой, n глубокие воды, n слой морских осадков, способных к обмену углекислотой с водой. Эти резервуары различаются по времени отклика на внешние изменения углеродного цикла. 49
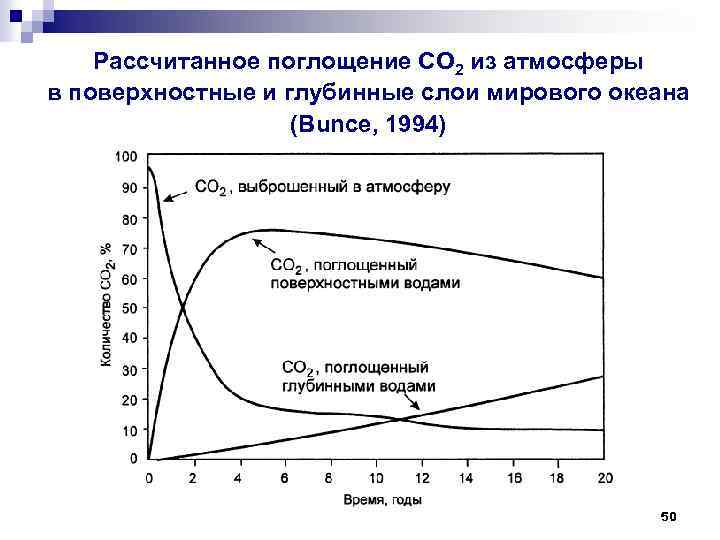 Рассчитанное поглощение СО 2 из атмосферы в поверхностные и глубинные слои мирового океана (Bunce, 1994) 50
Рассчитанное поглощение СО 2 из атмосферы в поверхностные и глубинные слои мирового океана (Bunce, 1994) 50
 Углерод в земной коре Содержание углерода в земной коре составляет порядка 0, 27 %. С началом индустриальной эпохи человечество стало извлекать углерод из этого резервуара и переводить его в атмосферу. Ещё академик В. И. Вернадский сравнивал этот процесс с мощной геологической силой, подобной эрозии или вулканизму. 51
Углерод в земной коре Содержание углерода в земной коре составляет порядка 0, 27 %. С началом индустриальной эпохи человечество стало извлекать углерод из этого резервуара и переводить его в атмосферу. Ещё академик В. И. Вернадский сравнивал этот процесс с мощной геологической силой, подобной эрозии или вулканизму. 51
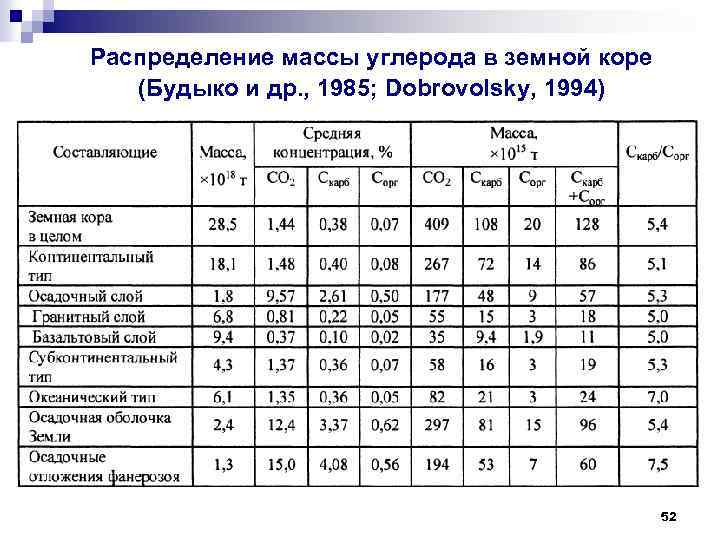 Распределение массы углерода в земной коре (Будыко и др. , 1985; Dobrovolsky, 1994) 52
Распределение массы углерода в земной коре (Будыко и др. , 1985; Dobrovolsky, 1994) 52
 Резервуары углерода Количество углерода, сосредоточенного в различных земных резервуарах, лучше рассматривать до начала индустриальной эры (до 1850 года), когда начались массовые выбросы в атмосферу продуктов сжигания ископаемого топлива. 53
Резервуары углерода Количество углерода, сосредоточенного в различных земных резервуарах, лучше рассматривать до начала индустриальной эры (до 1850 года), когда начались массовые выбросы в атмосферу продуктов сжигания ископаемого топлива. 53
 Резервуары углерода В атмосфере находится не много углерода по сравнению с океаном и земной корой, но углекислый газ атмосферы очень активен, он является строительным материалом для земной биосферы. Метан не стабилен в современной окислительной атмосфере, в верхних слоях атмосферы при участии гидроксил ионов он реагирует с кислородом, образуя всё тот же углекислый газ и воду. Основными производителями метана являются анаэробные бактерии, перерабатывающие образовавшийся в результате фотосинтеза органический материал. 54
Резервуары углерода В атмосфере находится не много углерода по сравнению с океаном и земной корой, но углекислый газ атмосферы очень активен, он является строительным материалом для земной биосферы. Метан не стабилен в современной окислительной атмосфере, в верхних слоях атмосферы при участии гидроксил ионов он реагирует с кислородом, образуя всё тот же углекислый газ и воду. Основными производителями метана являются анаэробные бактерии, перерабатывающие образовавшийся в результате фотосинтеза органический материал. 54
 Резервуары углерода Для газов атмосферы введено понятие времени жизни, это то время, за которое в атмосферу поступает масса газа равная массе этого газа в атмосфере. Для СО 2 время жизни оценивается в 5 лет. Как это не странно, но время жизни неустойчивого в атмосфере метана значительно больше — порядка 15 лет. Дело в том, что атмосферный углекислый газ участвует в исключительно активном кругообороте с наземной биосферой и мировым океаном, в то время как метан в атмосфере только разлагается. 55
Резервуары углерода Для газов атмосферы введено понятие времени жизни, это то время, за которое в атмосферу поступает масса газа равная массе этого газа в атмосфере. Для СО 2 время жизни оценивается в 5 лет. Как это не странно, но время жизни неустойчивого в атмосфере метана значительно больше — порядка 15 лет. Дело в том, что атмосферный углекислый газ участвует в исключительно активном кругообороте с наземной биосферой и мировым океаном, в то время как метан в атмосфере только разлагается. 55
 Представительные оценки количества углерода в различных геологических резервуарах для доиндустриальной эпохи Резервуар Атмосфера Океан поверхностный слой, неорганический углерод глубокие воды, неорганический углерод весь биологический углерод океанов Пресноводная биота Наземная биота и почвы растения почвы Количество углерода в мегатоннах С 590 (3, 71– 3, 9)× 104 700– 900 35600– 38000 685– 700 1– 3 2000– 2300 500– 600 1500– 1700 56
Представительные оценки количества углерода в различных геологических резервуарах для доиндустриальной эпохи Резервуар Атмосфера Океан поверхностный слой, неорганический углерод глубокие воды, неорганический углерод весь биологический углерод океанов Пресноводная биота Наземная биота и почвы растения почвы Количество углерода в мегатоннах С 590 (3, 71– 3, 9)× 104 700– 900 35600– 38000 685– 700 1– 3 2000– 2300 500– 600 1500– 1700 56
 Представительные оценки количества углерода в различных геологических резервуарах для доиндустриальной эпохи Резервуар Морские осадки способные к обмену углеродом с океанической водой неорганические, главным образом карбонатные осадки органические осадки Кора осадочные карбонаты органический углерод Мантия Ресурсы и резервы ископаемого топлива Нефть Природный газ Уголь Количество углерода в мегатоннах С 3000 2500 650 (7, 78– 9, 0)× 107 6, 53× 107 1, 25× 107 3, 24× 108 (7, 78– 9, 0)× 107 636– 842 483– 564 (3, 10– 4, 27)× 10³ 57
Представительные оценки количества углерода в различных геологических резервуарах для доиндустриальной эпохи Резервуар Морские осадки способные к обмену углеродом с океанической водой неорганические, главным образом карбонатные осадки органические осадки Кора осадочные карбонаты органический углерод Мантия Ресурсы и резервы ископаемого топлива Нефть Природный газ Уголь Количество углерода в мегатоннах С 3000 2500 650 (7, 78– 9, 0)× 107 6, 53× 107 1, 25× 107 3, 24× 108 (7, 78– 9, 0)× 107 636– 842 483– 564 (3, 10– 4, 27)× 10³ 57
 Деятельность человека в индустриальнуюй эру изменила баланс в естественном цикла углерода. Единицы ― гигатонны 58
Деятельность человека в индустриальнуюй эру изменила баланс в естественном цикла углерода. Единицы ― гигатонны 58
 Потоки углерода между резервуарами Потоки Захоронение карбонатов Захоронение углерода органических соединений Речной снос в океаны, растворимые неорганические соединения углерода Речной снос в океаны, весь углерод органических соединений Вынос реками растворимых органических соединений углерода Вынос реками углерода органических соединений в виде частиц Вулканизм Вынос из мантии мегатонн в год 0, 13 -0, 38 0, 05 -0, 13 0, 39 -0, 44 0, 30 -0, 41 0, 21 -0, 22 0, 17 -0, 30 0, 04 -0, 10 0, 022 -0, 07 59
Потоки углерода между резервуарами Потоки Захоронение карбонатов Захоронение углерода органических соединений Речной снос в океаны, растворимые неорганические соединения углерода Речной снос в океаны, весь углерод органических соединений Вынос реками растворимых органических соединений углерода Вынос реками углерода органических соединений в виде частиц Вулканизм Вынос из мантии мегатонн в год 0, 13 -0, 38 0, 05 -0, 13 0, 39 -0, 44 0, 30 -0, 41 0, 21 -0, 22 0, 17 -0, 30 0, 04 -0, 10 0, 022 -0, 07 59
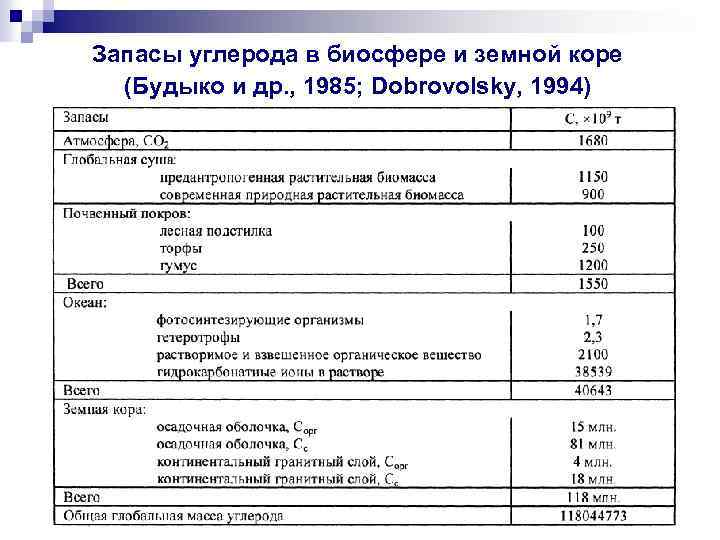 Запасы углерода в биосфере и земной коре (Будыко и др. , 1985; Dobrovolsky, 1994) 60
Запасы углерода в биосфере и земной коре (Будыко и др. , 1985; Dobrovolsky, 1994) 60
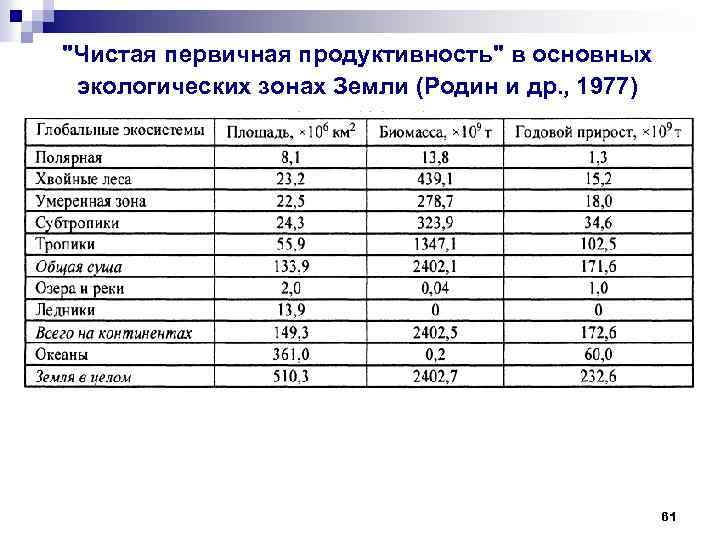 "Чистая первичная продуктивность" в основных экологических зонах Земли (Родин и др. , 1977) 61
"Чистая первичная продуктивность" в основных экологических зонах Земли (Родин и др. , 1977) 61
 Антропогенное влияние на углеродный цикл Сравнение баланса потоков CO 2 для экосистем (годичная продукция минус разложение гумуса минус эрозия почв минус вырубка лесов) стран, являющихся наибольшими "производителями" CO 2, и значения соответствующих индустриальных выбросов в 1995 г. Величины поглощения CO 2 экосистемами мира в целом и каждой из анализируемых стран. 62
Антропогенное влияние на углеродный цикл Сравнение баланса потоков CO 2 для экосистем (годичная продукция минус разложение гумуса минус эрозия почв минус вырубка лесов) стран, являющихся наибольшими "производителями" CO 2, и значения соответствующих индустриальных выбросов в 1995 г. Величины поглощения CO 2 экосистемами мира в целом и каждой из анализируемых стран. 62
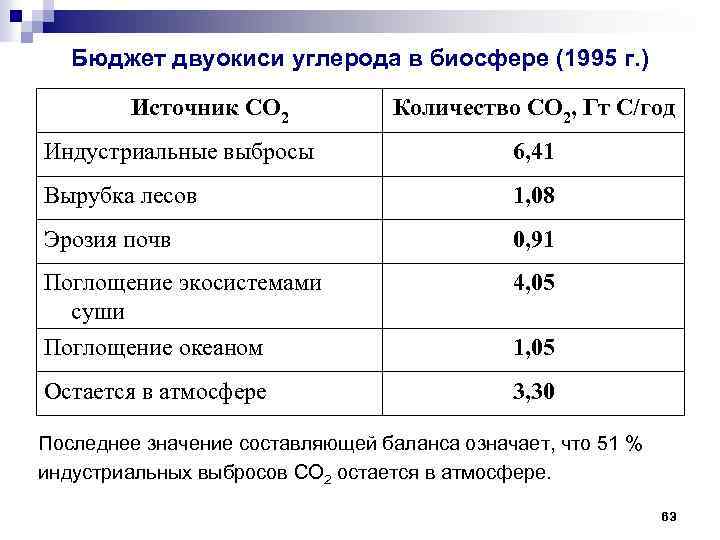 Бюджет двуокиси углерода в биосфере (1995 г. ) Источник CO 2 Количество CO 2, Гт С/год Индустриальные выбросы 6, 41 Вырубка лесов 1, 08 Эрозия почв 0, 91 Поглощение экосистемами суши Поглощение океаном 4, 05 Остается в атмосфере 3, 30 1, 05 Последнее значение составляющей баланса означает, что 51 % индустриальных выбросов CO 2 остается в атмосфере. 63
Бюджет двуокиси углерода в биосфере (1995 г. ) Источник CO 2 Количество CO 2, Гт С/год Индустриальные выбросы 6, 41 Вырубка лесов 1, 08 Эрозия почв 0, 91 Поглощение экосистемами суши Поглощение океаном 4, 05 Остается в атмосфере 3, 30 1, 05 Последнее значение составляющей баланса означает, что 51 % индустриальных выбросов CO 2 остается в атмосфере. 63
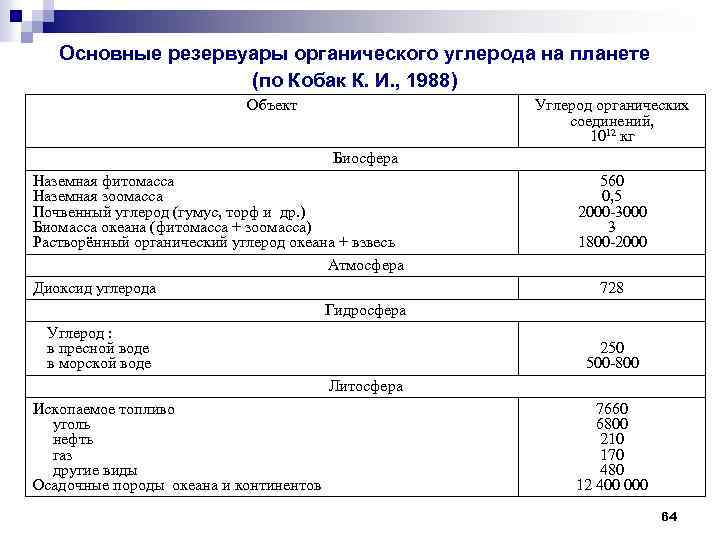 Основные резервуары органического углерода на планете (по Кобак К. И. , 1988) Объект Углерод органических соединений, 1012 кг Биосфера Наземная фитомасса Наземная зоомасса Почвенный углерод (гумус, торф и др. ) Биомасса океана (фитомасса + зоомасса) Растворённый органический углерод океана + взвесь Атмосфера Диоксид углерода Гидросфера Углерод : в пресной воде в морской воде Литосфера Ископаемое топливо уголь нефть газ другие виды Осадочные породы океана и континентов 560 0, 5 2000 -3000 3 1800 -2000 728 250 500 -800 7660 6800 210 170 480 12 400 000 64
Основные резервуары органического углерода на планете (по Кобак К. И. , 1988) Объект Углерод органических соединений, 1012 кг Биосфера Наземная фитомасса Наземная зоомасса Почвенный углерод (гумус, торф и др. ) Биомасса океана (фитомасса + зоомасса) Растворённый органический углерод океана + взвесь Атмосфера Диоксид углерода Гидросфера Углерод : в пресной воде в морской воде Литосфера Ископаемое топливо уголь нефть газ другие виды Осадочные породы океана и континентов 560 0, 5 2000 -3000 3 1800 -2000 728 250 500 -800 7660 6800 210 170 480 12 400 000 64
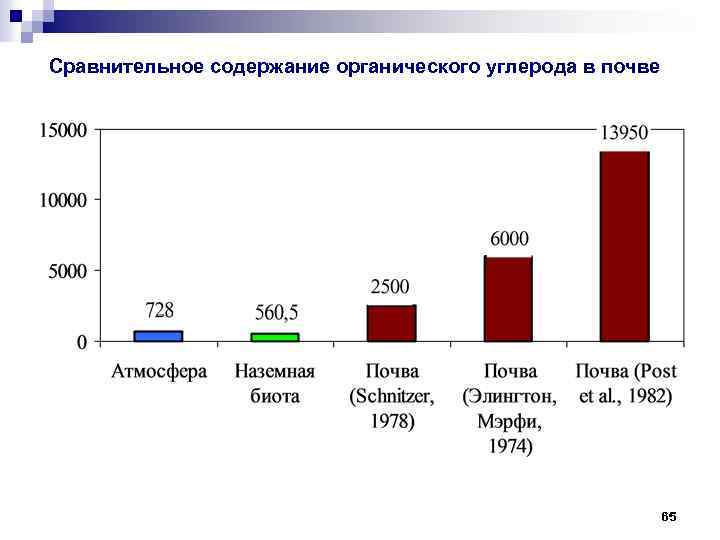 Сравнительное содержание органического углерода в почве 65
Сравнительное содержание органического углерода в почве 65
 Антропогенное влияние на углеродный цикл Деятельность людей привнесла новые изменения в цикл углерода. С началом индустриальной эры люди стали всё в возрастающем количестве сжигать ископаемое топливо: уголь, нефть и газ, накопленные за миллионы лет существования Земли. Человечество привнесло значительные изменения в землепользовании: вырубило леса, осушило болота, и затопило прежде сухие земли. В результате сжигания ископаемого топлива, человечество ежегодно добавляет в атмосферу 5, 5 гигатонн углерода 66
Антропогенное влияние на углеродный цикл Деятельность людей привнесла новые изменения в цикл углерода. С началом индустриальной эры люди стали всё в возрастающем количестве сжигать ископаемое топливо: уголь, нефть и газ, накопленные за миллионы лет существования Земли. Человечество привнесло значительные изменения в землепользовании: вырубило леса, осушило болота, и затопило прежде сухие земли. В результате сжигания ископаемого топлива, человечество ежегодно добавляет в атмосферу 5, 5 гигатонн углерода 66
 Модель цикла углерода, млрд. тонн (составлена В. А. Ковдой по данным Ничипоровича и Дювиньо): I – масса углерода в форме СО 2 в атмосфере и океане; II – количество СО 2, поступающего в атмосферу в процессах окисления; III – количество окисленного органического вещества (дыхание, горение); IV – биомасса сухопутных живых организмов; V – масса, использованная для питания этими организмами 67
Модель цикла углерода, млрд. тонн (составлена В. А. Ковдой по данным Ничипоровича и Дювиньо): I – масса углерода в форме СО 2 в атмосфере и океане; II – количество СО 2, поступающего в атмосферу в процессах окисления; III – количество окисленного органического вещества (дыхание, горение); IV – биомасса сухопутных живых организмов; V – масса, использованная для питания этими организмами 67
 Круговорот углерода циклическое перемещение углерода между миром живых существ и неорганическим миром атмосферы, морей, пресных вод, почвы и скал. Это один из важнейших биогеохимических циклов, включающий множество сложных реакций, в ходе которых углерод переходит из воздуха и водной среды в ткани растений и животных, а затем возвращается в атмосферу, воду и почву, становясь снова доступным для использования организмами 68
Круговорот углерода циклическое перемещение углерода между миром живых существ и неорганическим миром атмосферы, морей, пресных вод, почвы и скал. Это один из важнейших биогеохимических циклов, включающий множество сложных реакций, в ходе которых углерод переходит из воздуха и водной среды в ткани растений и животных, а затем возвращается в атмосферу, воду и почву, становясь снова доступным для использования организмами 68
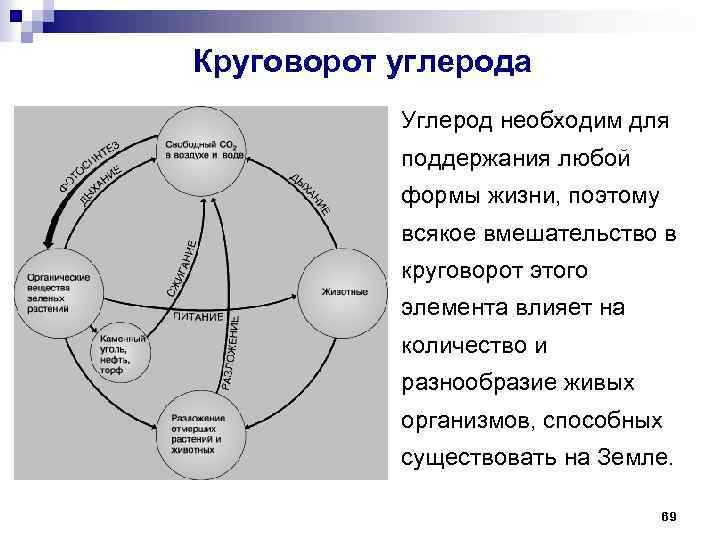 Круговорот углерода Углерод необходим для поддержания любой формы жизни, поэтому всякое вмешательство в круговорот этого элемента влияет на количество и разнообразие живых организмов, способных существовать на Земле. 69
Круговорот углерода Углерод необходим для поддержания любой формы жизни, поэтому всякое вмешательство в круговорот этого элемента влияет на количество и разнообразие живых организмов, способных существовать на Земле. 69
 Круговорот углерода Кругооборот углерода в природе включает биологический цикл, выделение СО 2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др. Биологический цикл состоит в том, что углерод в виде СО 2 поглощается из тропосферы растениями. Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов – в почву и в виде СО 2 – в атмосферу. 70
Круговорот углерода Кругооборот углерода в природе включает биологический цикл, выделение СО 2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др. Биологический цикл состоит в том, что углерод в виде СО 2 поглощается из тропосферы растениями. Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов – в почву и в виде СО 2 – в атмосферу. 70
 Геохимический цикл углерода Комплекс процессов переносящих углерод между различными геохимическими резервуарами. В истории Земли углеродный цикл менялся весьма значительно, эти изменения были как медленные и постепенные изменения, так и резкие катастрофические события. Важнейшую роль в круговороте углерода играли и играют живые организмы. В различных формах углерод присутствует во всех оболочках Земли 71
Геохимический цикл углерода Комплекс процессов переносящих углерод между различными геохимическими резервуарами. В истории Земли углеродный цикл менялся весьма значительно, эти изменения были как медленные и постепенные изменения, так и резкие катастрофические события. Важнейшую роль в круговороте углерода играли и играют живые организмы. В различных формах углерод присутствует во всех оболочках Земли 71
 Геохимический цикл углерода имеет несколько важных особенностей: n Разные процессы контролировали углеродный цикл на разных промежутках времени. n Резкие, катастрофические изменения цикла углерода играли ключевую роль в эволюции углеродного цикла в истории Земли. n Геохимический цикл углерода всегда происходит через атмосферу и гидросферу. Тем самым, даже самые глубинные процессы могут влиять на окружающую среду и биосферу. 72
Геохимический цикл углерода имеет несколько важных особенностей: n Разные процессы контролировали углеродный цикл на разных промежутках времени. n Резкие, катастрофические изменения цикла углерода играли ключевую роль в эволюции углеродного цикла в истории Земли. n Геохимический цикл углерода всегда происходит через атмосферу и гидросферу. Тем самым, даже самые глубинные процессы могут влиять на окружающую среду и биосферу. 72
 Геохимический цикл углерода Геохимическая запись углеродного цикла изучена неравномерно в геологической шкале времён. Наиболее полно в этом отношении изучен четвертичный период, самый недавний и кратчайший геологический период, так как с одной стороны история углеродного цикла в нём наиболее полно зафиксирована ледниками Арктики и Антарктики. С другой стороны в это время происходили значительные изменения углеродного цикла, и они неразрывно связаны с климатическими изменениями. 73
Геохимический цикл углерода Геохимическая запись углеродного цикла изучена неравномерно в геологической шкале времён. Наиболее полно в этом отношении изучен четвертичный период, самый недавний и кратчайший геологический период, так как с одной стороны история углеродного цикла в нём наиболее полно зафиксирована ледниками Арктики и Антарктики. С другой стороны в это время происходили значительные изменения углеродного цикла, и они неразрывно связаны с климатическими изменениями. 73
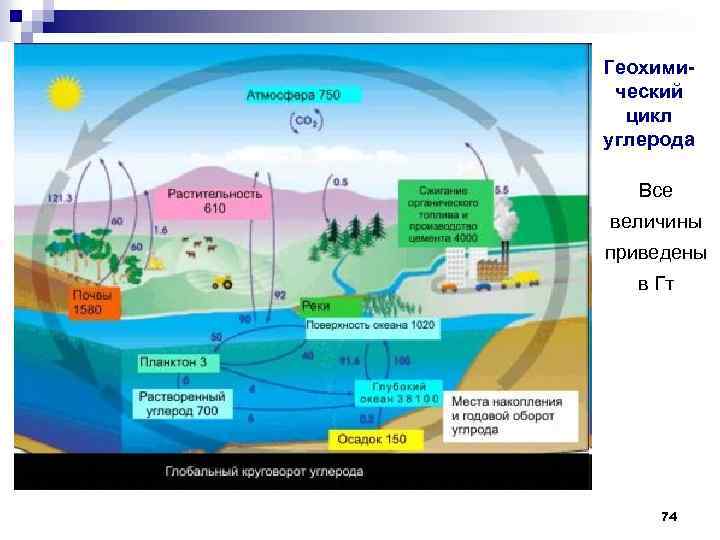 Геохимический цикл углерода Все величины приведены в Гт 74
Геохимический цикл углерода Все величины приведены в Гт 74
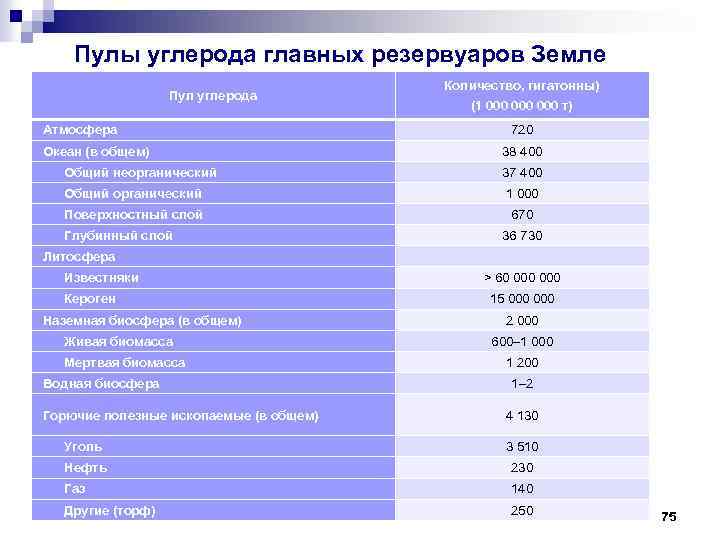 Пулы углерода главных резервуаров Земле Пул углерода Атмосфера Океан (в общем) Количество, гигатонны) (1 000 000 т) 720 38 400 Общий неорганический 37 400 Общий органический 1 000 Поверхностный слой 670 Глубинный слой Литосфера Известняки Кероген Наземная биосфера (в общем) Живая биомасса Мертвая биомасса Водная биосфера Горючие полезные ископаемые (в общем) 36 730 > 60 000 15 000 2 000 600– 1 000 1 200 1– 2 4 130 Уголь 3 510 Нефть 230 Газ 140 Другие (торф) 250 75
Пулы углерода главных резервуаров Земле Пул углерода Атмосфера Океан (в общем) Количество, гигатонны) (1 000 000 т) 720 38 400 Общий неорганический 37 400 Общий органический 1 000 Поверхностный слой 670 Глубинный слой Литосфера Известняки Кероген Наземная биосфера (в общем) Живая биомасса Мертвая биомасса Водная биосфера Горючие полезные ископаемые (в общем) 36 730 > 60 000 15 000 2 000 600– 1 000 1 200 1– 2 4 130 Уголь 3 510 Нефть 230 Газ 140 Другие (торф) 250 75
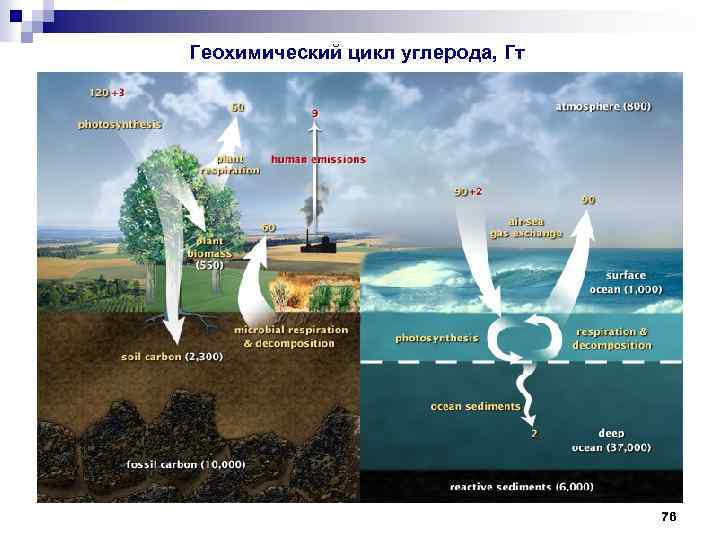 Геохимический цикл углерода, Гт 76
Геохимический цикл углерода, Гт 76
 Геохимический цикл углерода При изучении изменений в геохимических циклах элементов необходимо учитывать временной масштаб явлений. Одни процессы могут привносить малозаметные изменения, которые на длительных геологических промежутках времени становятся решающими. Иные изменения могут носить катастрофический характер, и происходить за очень короткое время. 77
Геохимический цикл углерода При изучении изменений в геохимических циклах элементов необходимо учитывать временной масштаб явлений. Одни процессы могут привносить малозаметные изменения, которые на длительных геологических промежутках времени становятся решающими. Иные изменения могут носить катастрофический характер, и происходить за очень короткое время. 77
 Пространственная модель глобального цикла двуокиси углерода в системе Океан - Атмосфера В океане можно выделить три слоя по вертикали: n n n верхний квазиоднородный слой (ВКС), термоклин с переменной глубиной, глубинный слой. Глубина ВКС изменяется во времени и в пространстве. Граница между термоклином и глубоким океаном фиксирована и находится на глубине 1100 м. Считается, что основная часть органического вещества разлагается в ВКС. Неразложившаяся в ВКС часть органического вещества опускается в более глубокие слои и там разлагается. 78
Пространственная модель глобального цикла двуокиси углерода в системе Океан - Атмосфера В океане можно выделить три слоя по вертикали: n n n верхний квазиоднородный слой (ВКС), термоклин с переменной глубиной, глубинный слой. Глубина ВКС изменяется во времени и в пространстве. Граница между термоклином и глубоким океаном фиксирована и находится на глубине 1100 м. Считается, что основная часть органического вещества разлагается в ВКС. Неразложившаяся в ВКС часть органического вещества опускается в более глубокие слои и там разлагается. 78
 Пространственная модель глобального цикла двуокиси углерода в системе Океан - Атмосфера В ВКС проявляются сезонные колебания концентрации углерода. Наибольшая амплитуда таких колебаний наблюдается в широтной зоне между 30 о и 60 о с. ш. Ярко выражено увеличение концентрации углерода от экватора к полюсам. Перепады концентрации между экватором и полюсами значительно больше, чем сезонные колебания в океанах. 79
Пространственная модель глобального цикла двуокиси углерода в системе Океан - Атмосфера В ВКС проявляются сезонные колебания концентрации углерода. Наибольшая амплитуда таких колебаний наблюдается в широтной зоне между 30 о и 60 о с. ш. Ярко выражено увеличение концентрации углерода от экватора к полюсам. Перепады концентрации между экватором и полюсами значительно больше, чем сезонные колебания в океанах. 79
 Пространственная модель глобального цикла двуокиси углерода в системе Океан - Атмосфера К полюсам парциальное давление растворенного углекислого газа убывает. Область максимальных значений смещается к югу от экватора в летние месяцы и к северу от экватора в зимние месяцы. Во всех океанах зоны выделения углекислого газа расположены вблизи экватора. Зоны с поглощением углекислого газа располагаются в высоких и средних широтах, причем в разных океанах поглощение происходит по-разному. 80
Пространственная модель глобального цикла двуокиси углерода в системе Океан - Атмосфера К полюсам парциальное давление растворенного углекислого газа убывает. Область максимальных значений смещается к югу от экватора в летние месяцы и к северу от экватора в зимние месяцы. Во всех океанах зоны выделения углекислого газа расположены вблизи экватора. Зоны с поглощением углекислого газа располагаются в высоких и средних широтах, причем в разных океанах поглощение происходит по-разному. 80
 Биологические круговороты углерода Помимо основного известного цикла углерода: углекислый газ – растения – опад и отпад (почва) – гумус – углекислый газ, существует второй цикл углерода (круговорот органических соединений – структурных и функциональных блоков биологических макромолекул, которые многократно используются на различных трофических уровнях экологических систем для построения, прежде всего, биомассы растений и гуминовых веществ почвы): растения – опад и отпад (почва) – гумус – арилгликопротеидные олиго(поли)меры – растения 81
Биологические круговороты углерода Помимо основного известного цикла углерода: углекислый газ – растения – опад и отпад (почва) – гумус – углекислый газ, существует второй цикл углерода (круговорот органических соединений – структурных и функциональных блоков биологических макромолекул, которые многократно используются на различных трофических уровнях экологических систем для построения, прежде всего, биомассы растений и гуминовых веществ почвы): растения – опад и отпад (почва) – гумус – арилгликопротеидные олиго(поли)меры – растения 81
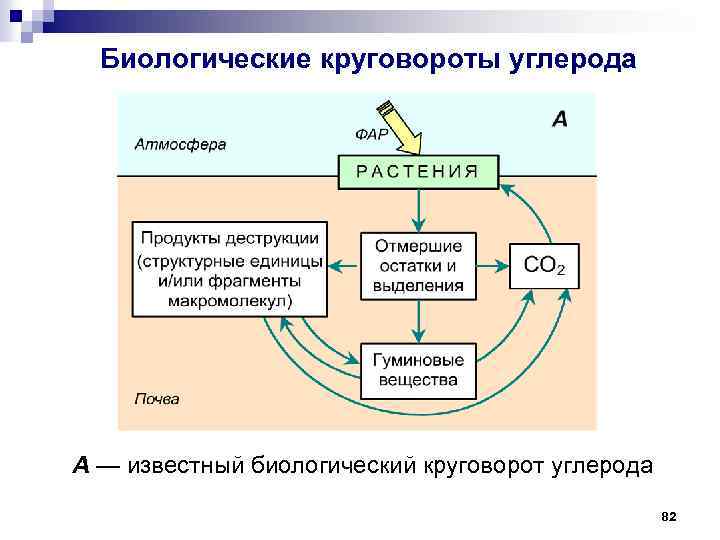 Биологические круговороты углерода А — известный биологический круговорот углерода 82
Биологические круговороты углерода А — известный биологический круговорот углерода 82
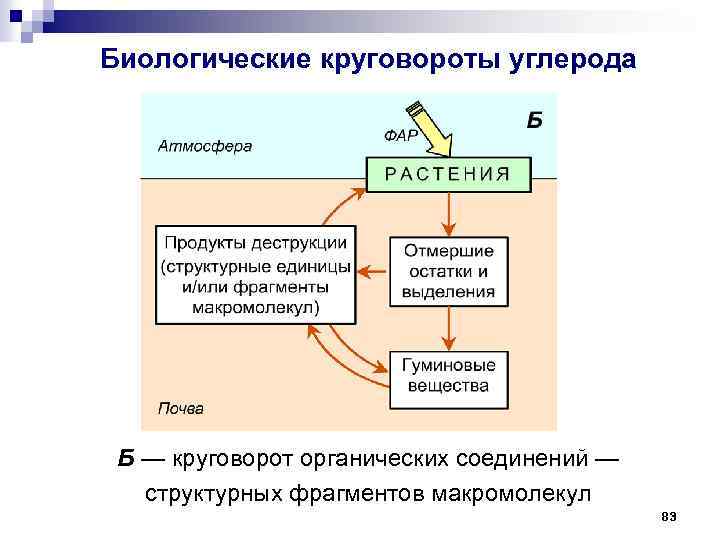 Биологические круговороты углерода Б — круговорот органических соединений — структурных фрагментов макромолекул 83
Биологические круговороты углерода Б — круговорот органических соединений — структурных фрагментов макромолекул 83
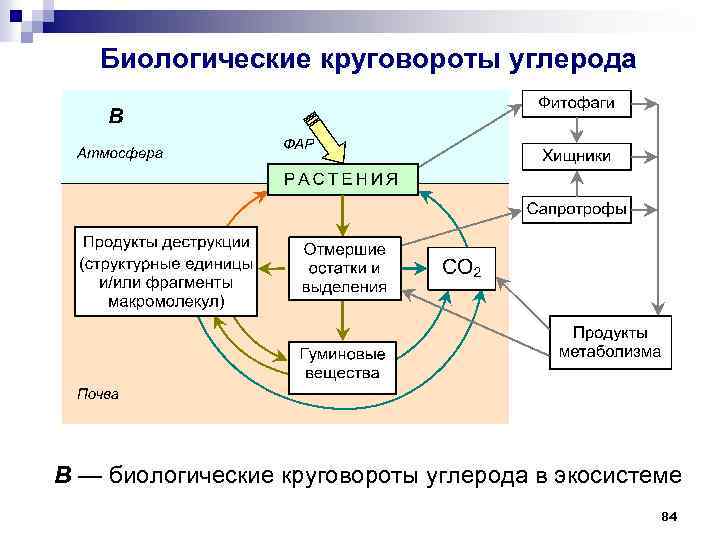 Биологические круговороты углерода В — биологические круговороты углерода в экосистеме 84
Биологические круговороты углерода В — биологические круговороты углерода в экосистеме 84
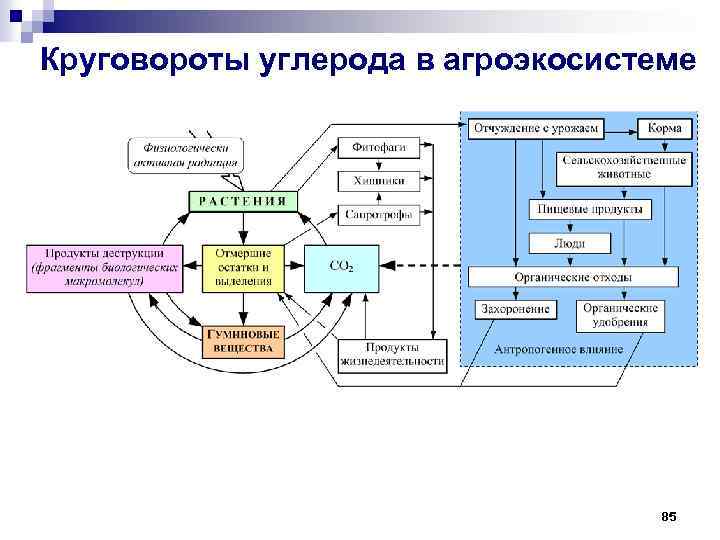 Круговороты углерода в агроэкосистеме 85
Круговороты углерода в агроэкосистеме 85
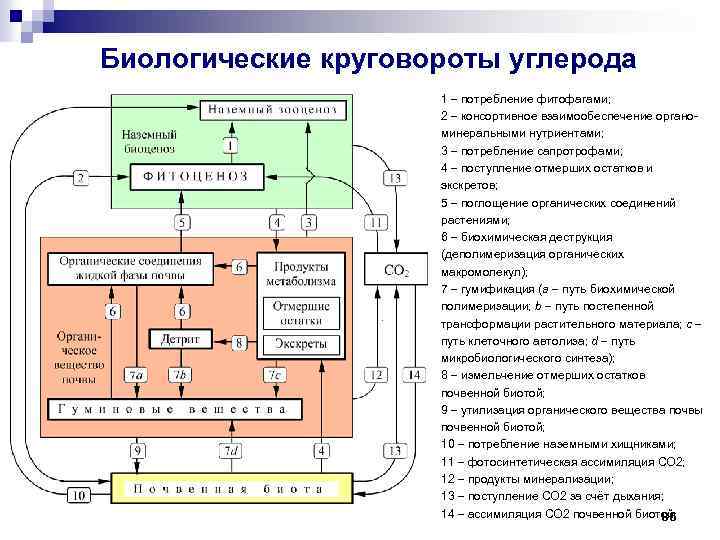 Биологические круговороты углерода 1 потребление фитофагами; 2 консортивное взаимообеспечение органоминеральными нутриентами; 3 потребление сапротрофами; 4 поступление отмерших остатков и экскретов; 5 поглощение органических соединений растениями; 6 биохимическая деструкция (деполимеризация органических макромолекул); 7 гумификация (a путь биохимической полимеризации; b путь постепенной трансформации растительного материала; c путь клеточного автолиза; d путь микробиологического синтеза); 8 измельчение отмерших остатков почвенной биотой; 9 утилизация органического вещества почвы почвенной биотой; 10 потребление наземными хищниками; 11 фотосинтетическая ассимиляция СО 2; 12 продукты минерализации; 13 поступление СО 2 за счёт дыхания; 14 ассимиляция СО 2 почвенной биотой. 86
Биологические круговороты углерода 1 потребление фитофагами; 2 консортивное взаимообеспечение органоминеральными нутриентами; 3 потребление сапротрофами; 4 поступление отмерших остатков и экскретов; 5 поглощение органических соединений растениями; 6 биохимическая деструкция (деполимеризация органических макромолекул); 7 гумификация (a путь биохимической полимеризации; b путь постепенной трансформации растительного материала; c путь клеточного автолиза; d путь микробиологического синтеза); 8 измельчение отмерших остатков почвенной биотой; 9 утилизация органического вещества почвы почвенной биотой; 10 потребление наземными хищниками; 11 фотосинтетическая ассимиляция СО 2; 12 продукты минерализации; 13 поступление СО 2 за счёт дыхания; 14 ассимиляция СО 2 почвенной биотой. 86
 Биологические круговороты углерода Биологический смысл потребления растениями органических соединений заключается в том, что растения в результате использования полученных извне органических веществ «экономят» энергию за счёт использования в синтетических процессах структурных блоков биологических макромолекул. Например, в системе почва–растение «ходят по кругу» структурные фрагменты лигнина. 87
Биологические круговороты углерода Биологический смысл потребления растениями органических соединений заключается в том, что растения в результате использования полученных извне органических веществ «экономят» энергию за счёт использования в синтетических процессах структурных блоков биологических макромолекул. Например, в системе почва–растение «ходят по кругу» структурные фрагменты лигнина. 87
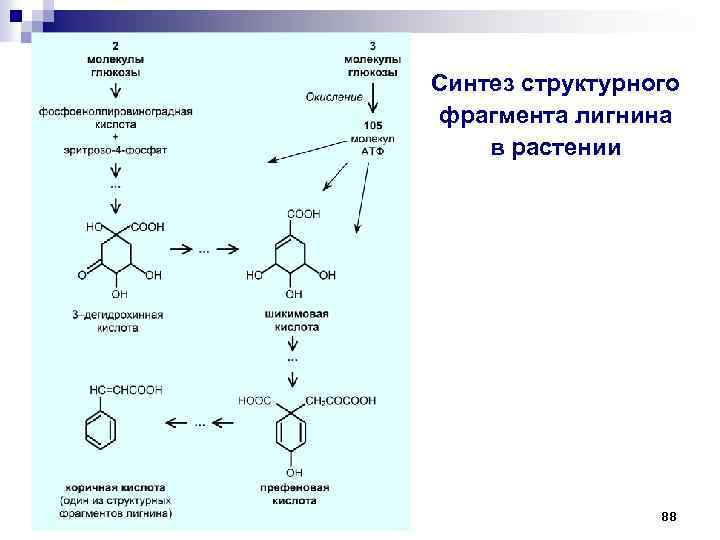 Синтез структурного фрагмента лигнина в растении 88
Синтез структурного фрагмента лигнина в растении 88
 Биологические круговороты углерода По нашему мнению, ещё одним экологическим следствием гетеротрофного питания фотосинтезирующих организмов является обогащение атмосферы кислородом. Поскольку во втором биологическом круговороте углерода (гелиотрофы отмершие остатки продукты деструкции гелиотрофы) органические молекулы, являясь структурными и функциональными блоками биологических макромолекул, встраиваются в тела фотосинтезирующих организмов без значительного химического изменения, при этом атмосфера обогащается на то количестве кислорода, которое потребовалось бы на окисление органических молекул, поглощённых гелиотрофными организмами 89
Биологические круговороты углерода По нашему мнению, ещё одним экологическим следствием гетеротрофного питания фотосинтезирующих организмов является обогащение атмосферы кислородом. Поскольку во втором биологическом круговороте углерода (гелиотрофы отмершие остатки продукты деструкции гелиотрофы) органические молекулы, являясь структурными и функциональными блоками биологических макромолекул, встраиваются в тела фотосинтезирующих организмов без значительного химического изменения, при этом атмосфера обогащается на то количестве кислорода, которое потребовалось бы на окисление органических молекул, поглощённых гелиотрофными организмами 89
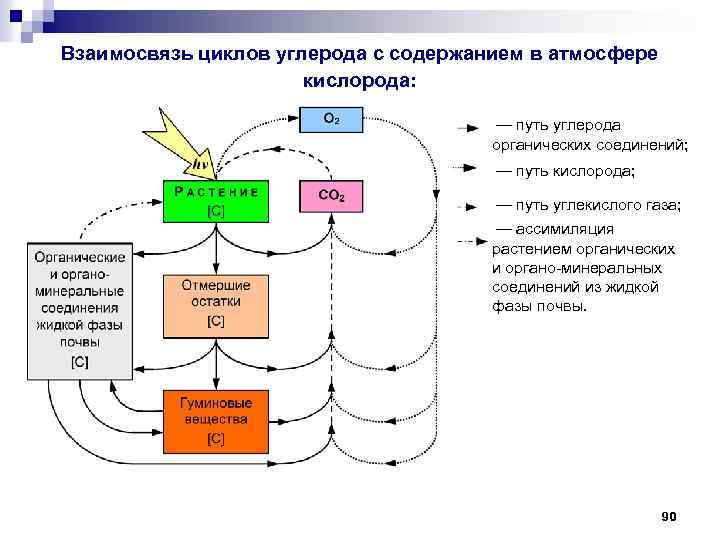 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: — путь углерода органических соединений; — путь кислорода; — путь углекислого газа; — ассимиляция растением органических и органо-минеральных соединений из жидкой фазы почвы. 90
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: — путь углерода органических соединений; — путь кислорода; — путь углекислого газа; — ассимиляция растением органических и органо-минеральных соединений из жидкой фазы почвы. 90
 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Если считать, что обогащение атмосферы кислородом – это «заслуга» только фотосинтеза, и при этом учитывается лишь известный круговорот углерода (CO 2 растения отмершие остатки гуминовые вещества CO 2), то атмосфера вряд ли обогатится кислородом. Ибо на окисление (биогенное и/или абиогенное) углерода органических веществ, связанного в процессе фотосинтеза, требуется ровно столько же кислорода, сколько образуется при фотосинтетической ассимиляции углекислого газа: 91
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Если считать, что обогащение атмосферы кислородом – это «заслуга» только фотосинтеза, и при этом учитывается лишь известный круговорот углерода (CO 2 растения отмершие остатки гуминовые вещества CO 2), то атмосфера вряд ли обогатится кислородом. Ибо на окисление (биогенное и/или абиогенное) углерода органических веществ, связанного в процессе фотосинтеза, требуется ровно столько же кислорода, сколько образуется при фотосинтетической ассимиляции углекислого газа: 91
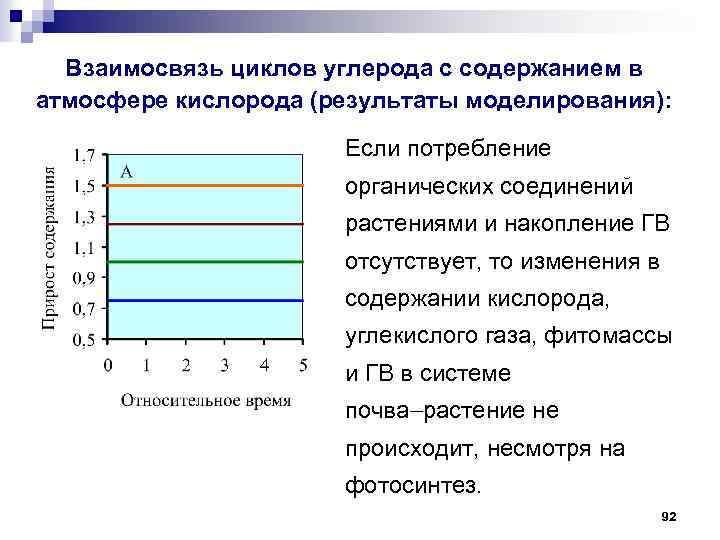 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода (результаты моделирования): Если потребление органических соединений растениями и накопление ГВ отсутствует, то изменения в содержании кислорода, углекислого газа, фитомассы и ГВ в системе почва растение не происходит, несмотря на фотосинтез. 92
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода (результаты моделирования): Если потребление органических соединений растениями и накопление ГВ отсутствует, то изменения в содержании кислорода, углекислого газа, фитомассы и ГВ в системе почва растение не происходит, несмотря на фотосинтез. 92
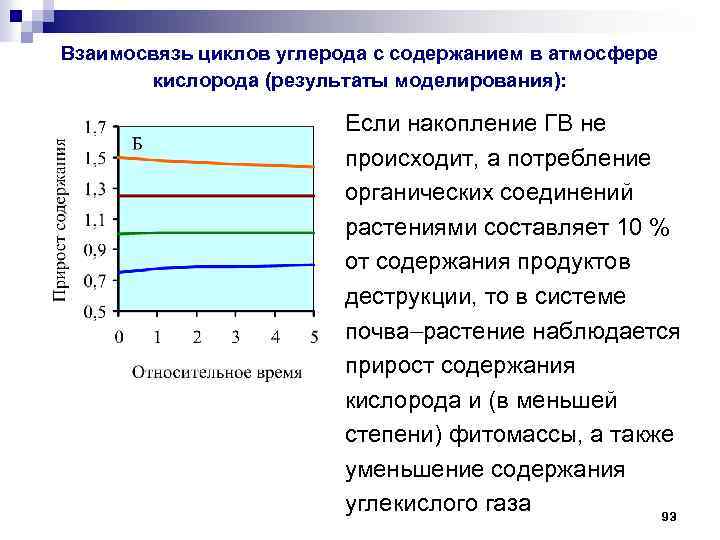 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода (результаты моделирования): Если накопление ГВ не происходит, а потребление органических соединений растениями составляет 10 % от содержания продуктов деструкции, то в системе почва растение наблюдается прирост содержания кислорода и (в меньшей степени) фитомассы, а также уменьшение содержания углекислого газа 93
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода (результаты моделирования): Если накопление ГВ не происходит, а потребление органических соединений растениями составляет 10 % от содержания продуктов деструкции, то в системе почва растение наблюдается прирост содержания кислорода и (в меньшей степени) фитомассы, а также уменьшение содержания углекислого газа 93
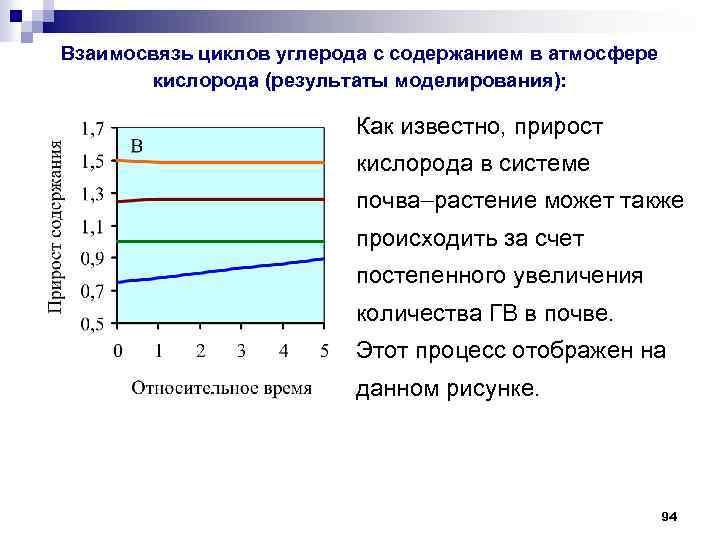 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода (результаты моделирования): Как известно, прирост кислорода в системе почва растение может также происходить за счет постепенного увеличения количества ГВ в почве. Этот процесс отображен на данном рисунке. 94
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода (результаты моделирования): Как известно, прирост кислорода в системе почва растение может также происходить за счет постепенного увеличения количества ГВ в почве. Этот процесс отображен на данном рисунке. 94
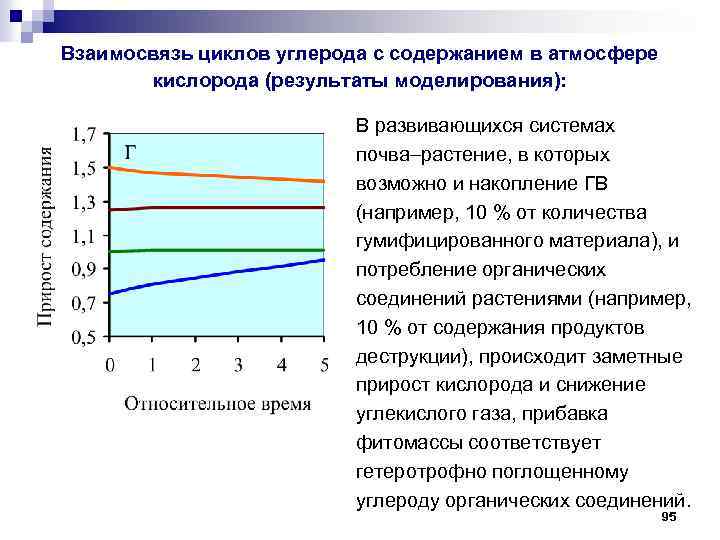 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода (результаты моделирования): В развивающихся системах почва растение, в которых возможно и накопление ГВ (например, 10 % от количества гумифицированного материала), и потребление органических соединений растениями (например, 10 % от содержания продуктов деструкции), происходит заметные прирост кислорода и снижение углекислого газа, прибавка фитомассы соответствует гетеротрофно поглощенному углероду органических соединений. 95
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода (результаты моделирования): В развивающихся системах почва растение, в которых возможно и накопление ГВ (например, 10 % от количества гумифицированного материала), и потребление органических соединений растениями (например, 10 % от содержания продуктов деструкции), происходит заметные прирост кислорода и снижение углекислого газа, прибавка фитомассы соответствует гетеротрофно поглощенному углероду органических соединений. 95
 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Иначе говоря, обогащение атмосферы кислородом возможно при условии, что вместе с фотосинтезом будет происходить ассимиляция растениями органических соединений ПОВ. 96
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Иначе говоря, обогащение атмосферы кислородом возможно при условии, что вместе с фотосинтезом будет происходить ассимиляция растениями органических соединений ПОВ. 96
 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Динамическое равновесие содержания кислорода в атмосфере (между образованным при фотосинтезе и израсходованным на окисление) может сместиться в сторону увеличения концентрации этого газа только тогда, когда часть аллохтонного органического материала (например, в виде мономеров, олиго- или полигетеромеров) будет усваиваться фотосинтезирующими организмами 97
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Динамическое равновесие содержания кислорода в атмосфере (между образованным при фотосинтезе и израсходованным на окисление) может сместиться в сторону увеличения концентрации этого газа только тогда, когда часть аллохтонного органического материала (например, в виде мономеров, олиго- или полигетеромеров) будет усваиваться фотосинтезирующими организмами 97
 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Прирост содержания кислорода, углерода углекислого газа. 98
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Прирост содержания кислорода, углерода углекислого газа. 98
 Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Таким образом, чем сильней будет происходить ассимиляция гелиотрофами органических молекул, являющихся либо структурными, либо функциональными блоками биологических макромолекул, на фоне достаточно интенсивного фотосинтеза, тем больше в атмосфере будет содержание кислорода. 99
Взаимосвязь циклов углерода с содержанием в атмосфере кислорода: Таким образом, чем сильней будет происходить ассимиляция гелиотрофами органических молекул, являющихся либо структурными, либо функциональными блоками биологических макромолекул, на фоне достаточно интенсивного фотосинтеза, тем больше в атмосфере будет содержание кислорода. 99
 Благодарю за внимание! 100
Благодарю за внимание! 100


