Биохимия. Геномные белки 2003.ppt
- Количество слайдов: 21

Геномные белки. Белкиферменты.

Геном — совокупность наследственного материала, заключенного в клетке организма. Геном содержит биологическую информацию, необходимую для построения и поддержания организма. Большинство геномов, в том числе геном человека и геномы всех остальных клеточных форм жизни, построены из ДНК, однако некоторые вирусы имеют геномы из РНК. В отличие от генотипа геном представляет собой характеристику вида, а не отдельной особи.

Геном отражает строгую клеточную последовательность строительства любой особи: от первого деления клетки до полного формирования особи, от первой клетки, ко второй, от неё к 3 й, к 4 й, к 5 й…. к «последней» .

Геномные белки Геномный белок ковалентно связан с нуклеиновой кислотой и участвует в ее репликации.

Ферменты — группа белков, обладающая специфическими каталитическими свойствами, то есть каждый фермент катализирует одну или несколько сходных реакций. Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации и репарации ДНК и матричного синтеза РНК.

Белки-ферменты В каждой живой клетке непрерывно происходят сотни биохимических реакций. В ходе этих реакций идут распад и окисление поступающих извне питательных веществ. Клетка использует энергию, полученную вследствие окисления питательных веществ; продукты их расщепления служат для синтеза необходимых клетке органических соединений. Быстрое протекание таких биохимических реакций обеспечивают катализаторы (ускорители реакции) – ферменты. Почти все ферменты являются белками (но не все белки – ферменты!). В последние годы стало известно, что некоторые молекулы РНК имеют свойства ферментов. Белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ.

Белки-ферменты Каждый фермент представляет собой своеобразную молекулярную машину. Благодаря определенной пространственной структуре молекулы ферментного белка и определенному расположению аминокислот в этом белке фермент узнает свой субстрат, присоединяет его и ускоряет его превращение. Однако этим не исчерпываются свойства фермента. В белковых молекулах большинства ферментов есть участки, которые узнают ещё и конечный продукт. Если такого продукта слишком много, то активность самого начального фермента тормозится им, и наоборот, если продукта мало, то фермент активируется. Так регулируется множество биохимических процессов. Это обратные связи, которые обеспечивают само регуляцию.

Белки-ферменты Известно более 2 -х тысяч ферментов, и количество их продолжает увеличиваться. Все ферменты условно разделены на шесть групп по характеру реакций, которые они катализируют перенос химических групп с одной молекулы на другую.

Классы ферментов Оксидоредуктазы. Трансферазы. Гидролазы. Лиазы (синтазы). Изомеразы. Лигазы (синтетазы).

Оксидоредуктазы — отдельный класс ферментов, катализирующих лежащие в основе биологического окисления реакции, сопровождающиеся переносом электронов с одной молекулы (восстановителя — акцептора протонов или донора электронов) на другую (окислитель — донора протонов или акцептора электронов).

Реакции, катализируемые оксидоредуктазами, в общем виде выглядят так: (A−) + B → A + (B−) Где A — восстановитель (донор электронов), а B — окислитель (акцептор электронов) В биохимических превращениях окислительно-восстановительные реакции иногда выглядят сложнее. Вот, например, одна из реакций гликолиза:
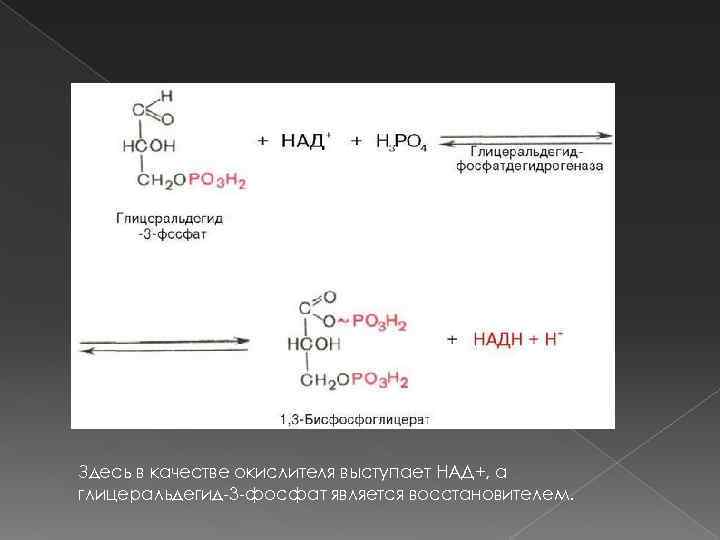
Здесь в качестве окислителя выступает НАД+, а глицеральдегид-3 -фосфат является восстановителем.

Трансферазы — осуществляют перенос функциональных групп и молекулярных остатков от одной молекулы к другой. Широко распространены в растительных и животных организмах, участвуют в превращениях углеводов, липидов, нуклеиновых и аминокислот. Реакции, катализируемые трансферазами, в общем случае выглядят так: A—X + B ↔ A + B—X. Молекула A здесь выступает в качестве донора группы атомов (X), а молекула B является акцептором группы. Часто в качестве донора в подобных реакциях переноса выступает один из коферментов. Многие из катализируемых трансферазами реакций являются обратимыми.

Фосфотрансферазы - это ферменты, катализирующие перенос остатка фосфорной кислоты. В результате действия фосфотрансфераз образуются фосфорные эфиры различных органических соединений, многие из которых обладают повышенной реакционной способностью и более легко вступают в последующие реакции. Следовательно, фосфорилирование органических соединений можно считать процессом их активации. Чаще всего донором фосфатных групп является молекула аденозинтрифосфорной кислоты (АТФ). Фосфотрансферазы, использующие в качестве донора фосфатной группы молекулу АТФ, называются киназами. К киназам относится, например, глицеролкиназа, ускоряющая перенос остатка фосфорной кислоты от молекулы АТФ к молекуле глицерина:

Гидролазы Эти ферменты ускоряют реакции гидролиза органических соединений; обязательным участником этих процессов является вода. В зависимости от характера гидролизуемой связи гидролазы подразделяют на ряд подклассов: эстеразы, гликозидазы, пептидгидролазы и др. Отличительной чертой всех гидролаз является то, что они являются однокомпонентными ферментами. Общий вид реакции выглядит следующим образом: A–B + H 2 O → A–OH + B–H

Лиазы — отдельный класс ферментов, катализирующих реакции негидролитического и неокислительного разрыва различных химических связей (C —C, C—O, C—N, C—S и других) субстрата, обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур.


Изомеразы — ферменты, катализирующие структурные превращения изомеров (рацемизация или эпимеризация). Изомеразы катализируют реакции, подобные следующей: A → B, где B является изомером A. Изомеразы ускоряют процессы превращений одних изомеров органических соединений в другие.

Лигазы Лигаза - фермент, катализирующий соединение двух молекул с образованием новой химической связи. При этом обычно происходит отщепление (гидролиз) небольшой химической группы от одной из молекул. Характерной чертой ферментов этого класса является использование соединений, способных поставлять энергию для осуществления биосинтеза. Одним из таких соединений является аденозинтрифосфорная кислота - АТФ. В качестве примера действия лигазы можно привести синтез щавелевоуксусной кислоты из пировиноградной путем ее карбоксилирования:

Следует заметить, что молекула АТФ не участвует в образовании продуктов реакции, а просто распадается на АДФ и фосфорную кислоту; при этом освобождается энергия, необходимая для осуществления биосинтеза.
Биохимия. Геномные белки 2003.ppt