 ГЕНОМ ЧЕЛОВЕКА 1
ГЕНОМ ЧЕЛОВЕКА 1
 Геномика • Геномика – комплексная наука, изучающая геномы. • Разделы геномики: • структурная геномика – содержание и организация геномной информации; • функциональная геномика – реализация информации, записанной в геноме, от гена – к признаку; • сравнительная геномика – сравнительные исследования содержания и организации геномов разных организмов; • • Все эти разделы геномики вносят вклад в фундаментальную биологию (индивидуальное развитие, эволюция), здравоохранение, сельское хозяйство и биотехнологию. Итог структурной геномики – получение последовательности нуклеотидов (сиквенс от англ. sequence), которая представляла бы полностью каждую из хромосом с первого нуклеотида до последнего. 2
Геномика • Геномика – комплексная наука, изучающая геномы. • Разделы геномики: • структурная геномика – содержание и организация геномной информации; • функциональная геномика – реализация информации, записанной в геноме, от гена – к признаку; • сравнительная геномика – сравнительные исследования содержания и организации геномов разных организмов; • • Все эти разделы геномики вносят вклад в фундаментальную биологию (индивидуальное развитие, эволюция), здравоохранение, сельское хозяйство и биотехнологию. Итог структурной геномики – получение последовательности нуклеотидов (сиквенс от англ. sequence), которая представляла бы полностью каждую из хромосом с первого нуклеотида до последнего. 2
 • Для того, чтобы получить такой сиквенс, сегодня приходится определять последовательность нуклеотидов в достаточно коротких отрезках ДНК, длиной примерно 1000 позиций. В геноме человека 3 миллиарда позиций, значит, его надо разбить на куски, которые и будут «читаться» . Затем нужно восстановить единую последовательность нуклеотидов из сравнения отдельных прочтенных отрезков текста. Восстановление основано на сравнении определенных последовательностей и выявлении в них перекрывающихся (идентичных) участков текста. Длина участка перекрывания должна превышать длину последовательности, которая может встретиться в данном геноме по причинам случайного характера. Например, в геноме человека 3 х109 п. н. случайно может встретится последовательность длиной 15 нуклеотидов – поскольку в каждой позиции может находится один из четырех нуклеотидов, то вероятность того, что заданные нуклеотиды окажутся в 15 позициях подряд 415 =230 что примерно равно 109. То есть в отрезке длиной 109 позиций заданная 15 -нуклеотидная последовательность может встретиться 1 раз по причинам случайного характера. 3
• Для того, чтобы получить такой сиквенс, сегодня приходится определять последовательность нуклеотидов в достаточно коротких отрезках ДНК, длиной примерно 1000 позиций. В геноме человека 3 миллиарда позиций, значит, его надо разбить на куски, которые и будут «читаться» . Затем нужно восстановить единую последовательность нуклеотидов из сравнения отдельных прочтенных отрезков текста. Восстановление основано на сравнении определенных последовательностей и выявлении в них перекрывающихся (идентичных) участков текста. Длина участка перекрывания должна превышать длину последовательности, которая может встретиться в данном геноме по причинам случайного характера. Например, в геноме человека 3 х109 п. н. случайно может встретится последовательность длиной 15 нуклеотидов – поскольку в каждой позиции может находится один из четырех нуклеотидов, то вероятность того, что заданные нуклеотиды окажутся в 15 позициях подряд 415 =230 что примерно равно 109. То есть в отрезке длиной 109 позиций заданная 15 -нуклеотидная последовательность может встретиться 1 раз по причинам случайного характера. 3
 • • • Но дело в том, что в ДНК нуклеотиды расположены не случайно и это является проблемой для восстановления последовательности из перекрывания отрезков. Если две последовательности из 1000 нуклеотидов перекрываются на 20 нуклеотидов или сто – это еще ничего не значит, так как весь этот фрагмент из 1000 нуклеотидов может быть несколько раз повторен в геноме. Поэтому нужно было сначала расставить вдоль генома фрагменты, а уже потом выявлять их перекрывание на основе сиквенса. Таков был путь мирового сообщества при секвенировании генома человека. (секвенированием в русскоязычной литературе называют процесс определения последовательности нуклеотидов. Этот термин также является калькой с английского названия). Как это можно было сделать? Нужно было поставить какие-нибудь «буйки» в геноме человека, какой участок стоит за каким. Последовательность таких участков и составляет карту генома. Первой такой картой стала карта генетическая. Она показана на рисунке слева. 4
• • • Но дело в том, что в ДНК нуклеотиды расположены не случайно и это является проблемой для восстановления последовательности из перекрывания отрезков. Если две последовательности из 1000 нуклеотидов перекрываются на 20 нуклеотидов или сто – это еще ничего не значит, так как весь этот фрагмент из 1000 нуклеотидов может быть несколько раз повторен в геноме. Поэтому нужно было сначала расставить вдоль генома фрагменты, а уже потом выявлять их перекрывание на основе сиквенса. Таков был путь мирового сообщества при секвенировании генома человека. (секвенированием в русскоязычной литературе называют процесс определения последовательности нуклеотидов. Этот термин также является калькой с английского названия). Как это можно было сделать? Нужно было поставить какие-нибудь «буйки» в геноме человека, какой участок стоит за каким. Последовательность таких участков и составляет карту генома. Первой такой картой стала карта генетическая. Она показана на рисунке слева. 4
 Рядом показана окрашенная хромосома, на которой видны поперечные полоски. Поперечная окрашенность индивидуальна для каждой хромосомы, каждая полоска имеет собственный номер, который представляет собой "адрес" данного участка на хромосоме. В каждом таком участке миллионы пар нуклеотидов, последовательность которых должна быть определена. Получены полиморфные маркеры, то есть найдены такие участки хромосомы, которые у разных людей (или на разных хромосомах одного человека) содержат неидентичные последовательности нуклеотидов. Заметим, что для генетической карты с интервалом в 10% рекомбинации нужно 300 равноудаленных маркеров, чтобы отличить одну хромосому от другой в данном локусе. 5
Рядом показана окрашенная хромосома, на которой видны поперечные полоски. Поперечная окрашенность индивидуальна для каждой хромосомы, каждая полоска имеет собственный номер, который представляет собой "адрес" данного участка на хромосоме. В каждом таком участке миллионы пар нуклеотидов, последовательность которых должна быть определена. Получены полиморфные маркеры, то есть найдены такие участки хромосомы, которые у разных людей (или на разных хромосомах одного человека) содержат неидентичные последовательности нуклеотидов. Заметим, что для генетической карты с интервалом в 10% рекомбинации нужно 300 равноудаленных маркеров, чтобы отличить одну хромосому от другой в данном локусе. 5
 • В основе детекции ДНК маркеров лежит метод амплификации (размножения) фрагментов ДНК in vitro с точностью до нуклеотида методом полимеразной цепной реакции (ПЦР). Методом ПЦР можно синтезировать фрагмент ДНК in vitro (в пробирке) и получить его как химически чистое вещество. Для синтеза используются короткие синтетические отрезки ДНК, называемые праймерами (затравка для синтеза). С 3’-конца праймера начинается синтез фрагмента ДНК по матричной нити, на которую он отжигается (прилипает при комплементарном взаимодействии между нуклеотидами праймера и матрицы). За один цикл достройки ДНК из двух нитей ДНК получили 4. В следующем цикле из 4 нитей получится уже 8 и т. д. Каждый цикл занимает несколько минут. За 30 циклов ПЦР целевой фрагмент размножится в 1 миллиард раз, что позволяет наблюдать фрагмент (после окраски). Время проведения каждого этапа ПЦР в будущем сократится на 2 -3 порядка, таким образом, что каждый цикл будет проводиться за секунды. 6
• В основе детекции ДНК маркеров лежит метод амплификации (размножения) фрагментов ДНК in vitro с точностью до нуклеотида методом полимеразной цепной реакции (ПЦР). Методом ПЦР можно синтезировать фрагмент ДНК in vitro (в пробирке) и получить его как химически чистое вещество. Для синтеза используются короткие синтетические отрезки ДНК, называемые праймерами (затравка для синтеза). С 3’-конца праймера начинается синтез фрагмента ДНК по матричной нити, на которую он отжигается (прилипает при комплементарном взаимодействии между нуклеотидами праймера и матрицы). За один цикл достройки ДНК из двух нитей ДНК получили 4. В следующем цикле из 4 нитей получится уже 8 и т. д. Каждый цикл занимает несколько минут. За 30 циклов ПЦР целевой фрагмент размножится в 1 миллиард раз, что позволяет наблюдать фрагмент (после окраски). Время проведения каждого этапа ПЦР в будущем сократится на 2 -3 порядка, таким образом, что каждый цикл будет проводиться за секунды. 6
 • Для различения папиной и маминой хромосом использовали так называемые STR-маркеры (Short Tandem Repeat), состоящие из одинаковых звеньев, чаще всего звено состояло из пары нуклеотидов ЦА. То есть нашли места в геноме, где повторялись эти вкрапленные звенья. Допустим в папиной хромосоме в фрагменте из 100 пар нуклеотидов была вставка из 20 звеньев, а в таком же месте маминой хромосомы было вставлено 22 звена. Этот фрагмент ДНК размножили in vitro, с точностью до нуклеотида методом полимеразной цепной реакции (ПЦР). Длина этих фрагментов будет у папы 100+20 х2=140, а у мамы – 100+22 х2=144. При фракционировании образованных фрагментов в геле под действием постоянного тока (электрофорез) мы можем провести разделение фрагментов по размеру. Чем тяжелее фрагмент, тем меньше его электрофоретическая подвижность и тем ближе к старту он будет находиться. Если у родителей ребенка длины фрагментов составляли (как указано в примере выше) 140 и 144 п. н. , то и у ребенка будут эти полоски присутствовать. 7
• Для различения папиной и маминой хромосом использовали так называемые STR-маркеры (Short Tandem Repeat), состоящие из одинаковых звеньев, чаще всего звено состояло из пары нуклеотидов ЦА. То есть нашли места в геноме, где повторялись эти вкрапленные звенья. Допустим в папиной хромосоме в фрагменте из 100 пар нуклеотидов была вставка из 20 звеньев, а в таком же месте маминой хромосомы было вставлено 22 звена. Этот фрагмент ДНК размножили in vitro, с точностью до нуклеотида методом полимеразной цепной реакции (ПЦР). Длина этих фрагментов будет у папы 100+20 х2=140, а у мамы – 100+22 х2=144. При фракционировании образованных фрагментов в геле под действием постоянного тока (электрофорез) мы можем провести разделение фрагментов по размеру. Чем тяжелее фрагмент, тем меньше его электрофоретическая подвижность и тем ближе к старту он будет находиться. Если у родителей ребенка длины фрагментов составляли (как указано в примере выше) 140 и 144 п. н. , то и у ребенка будут эти полоски присутствовать. 7
 • Описанный подход применяется не только в фундаментальных исследованиях , но и в практике идентификации личности при судебномедицинской экспертизе. Допустим данный локус в хромосоме может находиться в одном из 10 альтернативных состояний. (Эти состояния, аллели, различимы по их электрофоретической подвижности). Эти состояния различают 10 хромосом или людей с такими хромосомами. Если мы возьмем в анализ еще один локус (на другой хромосоме) с такими же характеристиками, то по этому локусу мы тоже различим 10 хромосом или людей. А по сочетанию состояний в этих двух локусах различимы 10 х10=102 хромосом. Пять таких локусов позволят различить 105 хромосом. А поскольку хромосом у каждого из нас по паре, то сочетания аллелей этих пяти локусов дают 105 х105 = 1010 вариантов. Это число вариантов больше, чем число людей на земле. На практике при идентификации используют набор аллелей из 13 локусов, хотя и пяти как мы видим, может быть волне достаточно. • Генетическая карта была первой картой генома человека, на основе которой строилась дальнейшая работа по картированию. Эту карту соотнесли с физической картой, показывающей порядок следования клонированных фрагментов ДНК вдоль генома (см. рисунок 1 справа). 8
• Описанный подход применяется не только в фундаментальных исследованиях , но и в практике идентификации личности при судебномедицинской экспертизе. Допустим данный локус в хромосоме может находиться в одном из 10 альтернативных состояний. (Эти состояния, аллели, различимы по их электрофоретической подвижности). Эти состояния различают 10 хромосом или людей с такими хромосомами. Если мы возьмем в анализ еще один локус (на другой хромосоме) с такими же характеристиками, то по этому локусу мы тоже различим 10 хромосом или людей. А по сочетанию состояний в этих двух локусах различимы 10 х10=102 хромосом. Пять таких локусов позволят различить 105 хромосом. А поскольку хромосом у каждого из нас по паре, то сочетания аллелей этих пяти локусов дают 105 х105 = 1010 вариантов. Это число вариантов больше, чем число людей на земле. На практике при идентификации используют набор аллелей из 13 локусов, хотя и пяти как мы видим, может быть волне достаточно. • Генетическая карта была первой картой генома человека, на основе которой строилась дальнейшая работа по картированию. Эту карту соотнесли с физической картой, показывающей порядок следования клонированных фрагментов ДНК вдоль генома (см. рисунок 1 справа). 8
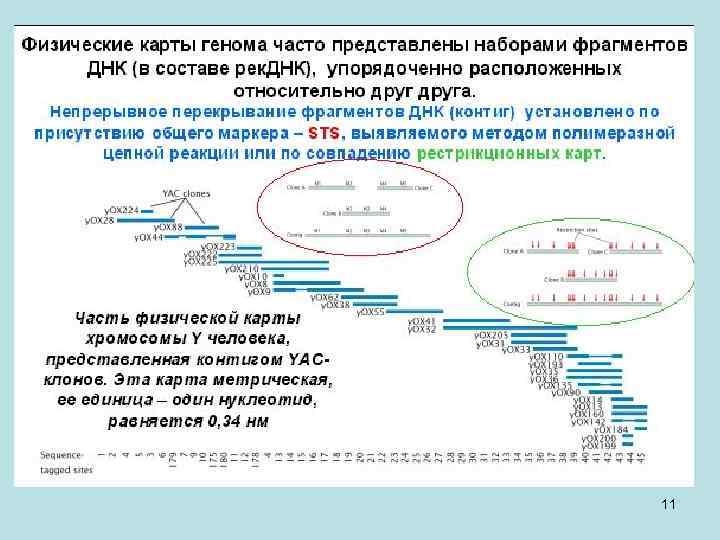
 • Физические карты генома часто представлены наборами фрагментов ДНК, клонированные в векторных молекулах (рекомбинантных ДНК), упорядоченно расположенных относительно друга. Такой набор непрерывно перекрывающихся фрагментов ДНК называется контиг. Для того чтобы выявить перекрывание клонированных фрагментов ДНК и понадобилась ранее установленная карта генетических маркеров. Перекрывание устанавливалось между «большими» молекулами ДНК, содержащими примерно 106 пар нуклеотидов, которые были клонированы в искусственных хромосомах дрожжей (YAC-клоны, сокращение от Yeast Artificial Chromosome). Искусственные, потому что у них удалили основную часть собственно дрожжевой ДНК и вставили человеческие фрагменты ДНК. Такие конструкции способны реплицироваться в клетках дрожжей. Размер хромосом дрожжей как раз примерно 1 -2 миллиона пар нуклеотидов. • Как устанавливали перекрывание клонированных фрагментов ДНК? У нас есть YAC-клон № 1 с протяженным фрагментом клонированной ДНК, а в нем, предположим, обнаружен и маркер А и маркер В, для которых из генетических данных известно, что они соседние на карте. В YAC-клоне № 2 уже нет маркера А, а есть маркеры В и С, причем также известно из генетической карты что В и С – соседи. В клоне № 3 есть маркеры С и D. Сопоставление данных по присутствию генетических маркеров А, В, С и D в YAC-клонах показывает что они перекрываются в последовательности YAC № 1, № 2, № 3. 9
• Физические карты генома часто представлены наборами фрагментов ДНК, клонированные в векторных молекулах (рекомбинантных ДНК), упорядоченно расположенных относительно друга. Такой набор непрерывно перекрывающихся фрагментов ДНК называется контиг. Для того чтобы выявить перекрывание клонированных фрагментов ДНК и понадобилась ранее установленная карта генетических маркеров. Перекрывание устанавливалось между «большими» молекулами ДНК, содержащими примерно 106 пар нуклеотидов, которые были клонированы в искусственных хромосомах дрожжей (YAC-клоны, сокращение от Yeast Artificial Chromosome). Искусственные, потому что у них удалили основную часть собственно дрожжевой ДНК и вставили человеческие фрагменты ДНК. Такие конструкции способны реплицироваться в клетках дрожжей. Размер хромосом дрожжей как раз примерно 1 -2 миллиона пар нуклеотидов. • Как устанавливали перекрывание клонированных фрагментов ДНК? У нас есть YAC-клон № 1 с протяженным фрагментом клонированной ДНК, а в нем, предположим, обнаружен и маркер А и маркер В, для которых из генетических данных известно, что они соседние на карте. В YAC-клоне № 2 уже нет маркера А, а есть маркеры В и С, причем также известно из генетической карты что В и С – соседи. В клоне № 3 есть маркеры С и D. Сопоставление данных по присутствию генетических маркеров А, В, С и D в YAC-клонах показывает что они перекрываются в последовательности YAC № 1, № 2, № 3. 9
 • Вставки ДНК из 3000 YAC-клонов примерно равны по длине геному человека. В анализ на перекрывание YAC-колонов взяли 30000 клонов, с тем чтобы каждая точка генома перекрывалась несколькими клонами. Вначале неизвестно было, как они расположены, но в среднем каждая точка генома перекрывалась 10 раз. Было использовано порядка 3000 STR-маркеров, и посмотрели, эти как маркеры и клоны друг с другом перекрываются. В качестве метода, выявляющего присутствие генетического маркера в составе YAC-клонов, использовался ПЦР. На заключительном этапе составления физической карты генома человека в этих 30 000 YAC-клонов, выявлено присутствие примерно 30000 маркеров. Это один маркер на 100 000 пар нуклеотидов. Расстояние между концами YAC-клонов также составило 100 000 п. н. (при длине клона 1 млн. п. н. ). Картирование проводили на роботизированных машинах, которые проводили приблизительно по 300 000 ПЦР-реакций в день. Позволило расставить в контиг все YAC клоны. Предполагалось, что они будут непосредственно секвенироваться. Однако в дальнейшем была использована друга схема секвенирования клонов. Картированные YAC-клоны часто использовали для поиска генов, находящихся во вставке YAC, а к сиквенсу этот этап не привел. 10
• Вставки ДНК из 3000 YAC-клонов примерно равны по длине геному человека. В анализ на перекрывание YAC-колонов взяли 30000 клонов, с тем чтобы каждая точка генома перекрывалась несколькими клонами. Вначале неизвестно было, как они расположены, но в среднем каждая точка генома перекрывалась 10 раз. Было использовано порядка 3000 STR-маркеров, и посмотрели, эти как маркеры и клоны друг с другом перекрываются. В качестве метода, выявляющего присутствие генетического маркера в составе YAC-клонов, использовался ПЦР. На заключительном этапе составления физической карты генома человека в этих 30 000 YAC-клонов, выявлено присутствие примерно 30000 маркеров. Это один маркер на 100 000 пар нуклеотидов. Расстояние между концами YAC-клонов также составило 100 000 п. н. (при длине клона 1 млн. п. н. ). Картирование проводили на роботизированных машинах, которые проводили приблизительно по 300 000 ПЦР-реакций в день. Позволило расставить в контиг все YAC клоны. Предполагалось, что они будут непосредственно секвенироваться. Однако в дальнейшем была использована друга схема секвенирования клонов. Картированные YAC-клоны часто использовали для поиска генов, находящихся во вставке YAC, а к сиквенсу этот этап не привел. 10
 11
11
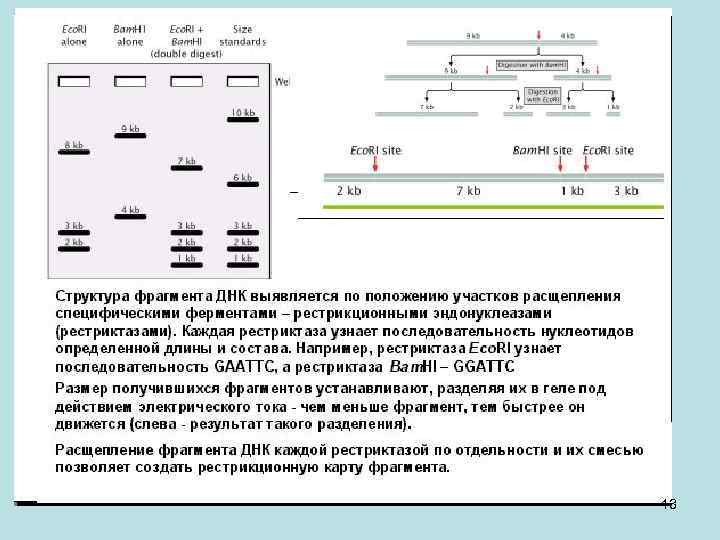
 • Перекрывание можно также посмотреть по расположению специфических рестрикционных сайтов. Рассмотрим этот способ подробнее. Структура фрагмента ДНК выявляется по положению участков расщепления специфическими ферментами – рестрикционными эндонуклеазами (рестриктазами). Каждая рестриктаза узнает последовательность нуклеотидов определенной длины и состава. Например, рестриктаза Eco. RI узнает GAATTC и никакую другую (расщеплять ДНК она будет в среднем один раз на 46=4096 нуклеотидов), Bam. HI узнает GGATTC. Предположим, что у нас есть клонированный фрагмент ДНК, длиной 13000 нуклеотидов, и мы расщепили его рестриктазой Bam. HI, получив два фрагмента по 9 и 4 тысячи нуклеотидов. Затем если мы расщепим Eco. RI, получим фрагменты по 8, 3 и 2 kb. Когда мы посмотрим двойное расщепление, получим фрагменты размерами 7, 3, 2, 1 kb. Размеры известны, потому что рядом есть дорожка, в которой идет фракционирование молекул стандартного размера, что позволяет создать калибровочную кривую. Если мы проведем второе расщепление, то увидим, что фрагмент в 9 kb расщепился на фрагменты по 7 и 2 kb. Эта специфическая последовательность сайтов и специфическое расстояние между ними является портретом молекулы (см. рис. ниже). По этим портретам мы можем сопоставлять молекулы друг с другом, независимо от того, что они кодируют, и что в них находится. Это очень типичная процедура. Расщепление фрагмента ДНК каждой рестриктазой по отдельности и их смесью позволяет создать рестрикционную карту фрагмента. 12
• Перекрывание можно также посмотреть по расположению специфических рестрикционных сайтов. Рассмотрим этот способ подробнее. Структура фрагмента ДНК выявляется по положению участков расщепления специфическими ферментами – рестрикционными эндонуклеазами (рестриктазами). Каждая рестриктаза узнает последовательность нуклеотидов определенной длины и состава. Например, рестриктаза Eco. RI узнает GAATTC и никакую другую (расщеплять ДНК она будет в среднем один раз на 46=4096 нуклеотидов), Bam. HI узнает GGATTC. Предположим, что у нас есть клонированный фрагмент ДНК, длиной 13000 нуклеотидов, и мы расщепили его рестриктазой Bam. HI, получив два фрагмента по 9 и 4 тысячи нуклеотидов. Затем если мы расщепим Eco. RI, получим фрагменты по 8, 3 и 2 kb. Когда мы посмотрим двойное расщепление, получим фрагменты размерами 7, 3, 2, 1 kb. Размеры известны, потому что рядом есть дорожка, в которой идет фракционирование молекул стандартного размера, что позволяет создать калибровочную кривую. Если мы проведем второе расщепление, то увидим, что фрагмент в 9 kb расщепился на фрагменты по 7 и 2 kb. Эта специфическая последовательность сайтов и специфическое расстояние между ними является портретом молекулы (см. рис. ниже). По этим портретам мы можем сопоставлять молекулы друг с другом, независимо от того, что они кодируют, и что в них находится. Это очень типичная процедура. Расщепление фрагмента ДНК каждой рестриктазой по отдельности и их смесью позволяет создать рестрикционную карту фрагмента. 12
 13
13
 14
14
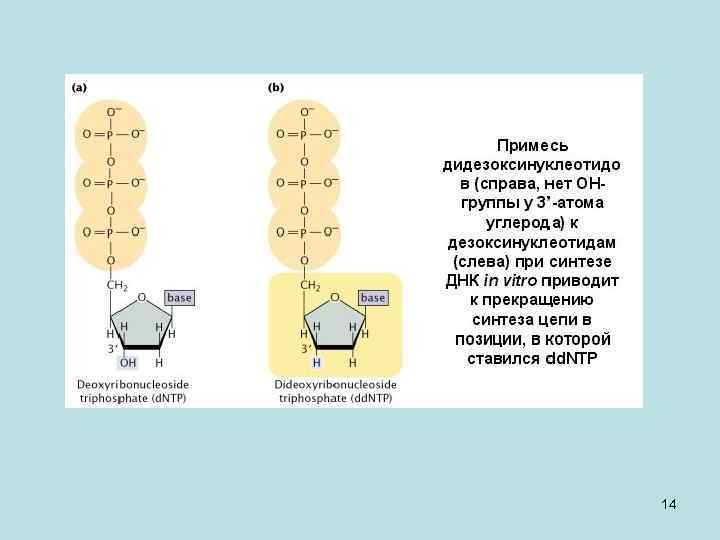
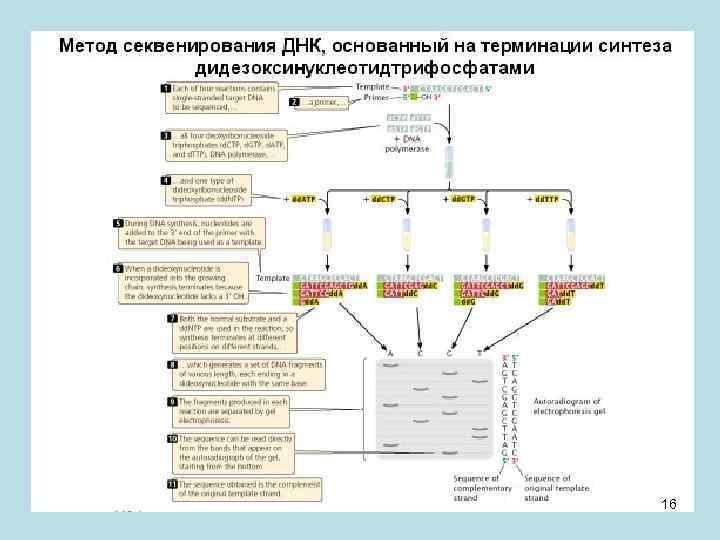
 • Итак, мы расставили молекулы методом генетического и физического картирования. Вернемся к методу секвенирования. Использовалась примесь дидезоксинуклеотидов - dd. NTP (на рисунке – справа; у них нет OH-группы у 3’-атома углерода), которая добавлялась к обычным дезоксинуклеотидам (на рисунке слева). И при синтезе ДНК in vitro это приводило к прекращению синтеза цепи в позиции, в которой вставился dd. NTP. Через позицию 3’ идет присоединение нуклеотида к строящейся молекуле ДНК. Но если на 3`- конце не будет гидроксильной группы, а водород, то синтез дальше не пойдет – он будет терминирован. • Это используется следующим образом. У нас есть матрица (нить ДНК), которую надо секвенировать. Если идет синтез, и в первой позиции матрицы стоит А (см. рис. ниже), то может встроиться обычный Т и синтез пойдет дальше, а может встроиться dd. ТTP и синтез дальше не пойдет. Произойдет обрыв цепи, а полученный синтезированный огрызок займет при фракционировании определенную позицию согласно своему размеру. Следующий обрыв будет соответствовать второй букве секвенируемой нити, и также займет свою позицию согласно длине при фракционировании на электрофорезе и т. д. И так по каждому нуклеотиду. Так мы восстановим последовательность нуклеотидов в секвенируемой нити ДНК. Этот метод предложил Фрэд Сэнгер, за что получил свою вторую Нобелевскую премию. 15
• Итак, мы расставили молекулы методом генетического и физического картирования. Вернемся к методу секвенирования. Использовалась примесь дидезоксинуклеотидов - dd. NTP (на рисунке – справа; у них нет OH-группы у 3’-атома углерода), которая добавлялась к обычным дезоксинуклеотидам (на рисунке слева). И при синтезе ДНК in vitro это приводило к прекращению синтеза цепи в позиции, в которой вставился dd. NTP. Через позицию 3’ идет присоединение нуклеотида к строящейся молекуле ДНК. Но если на 3`- конце не будет гидроксильной группы, а водород, то синтез дальше не пойдет – он будет терминирован. • Это используется следующим образом. У нас есть матрица (нить ДНК), которую надо секвенировать. Если идет синтез, и в первой позиции матрицы стоит А (см. рис. ниже), то может встроиться обычный Т и синтез пойдет дальше, а может встроиться dd. ТTP и синтез дальше не пойдет. Произойдет обрыв цепи, а полученный синтезированный огрызок займет при фракционировании определенную позицию согласно своему размеру. Следующий обрыв будет соответствовать второй букве секвенируемой нити, и также займет свою позицию согласно длине при фракционировании на электрофорезе и т. д. И так по каждому нуклеотиду. Так мы восстановим последовательность нуклеотидов в секвенируемой нити ДНК. Этот метод предложил Фрэд Сэнгер, за что получил свою вторую Нобелевскую премию. 15
 16
16
 17
17
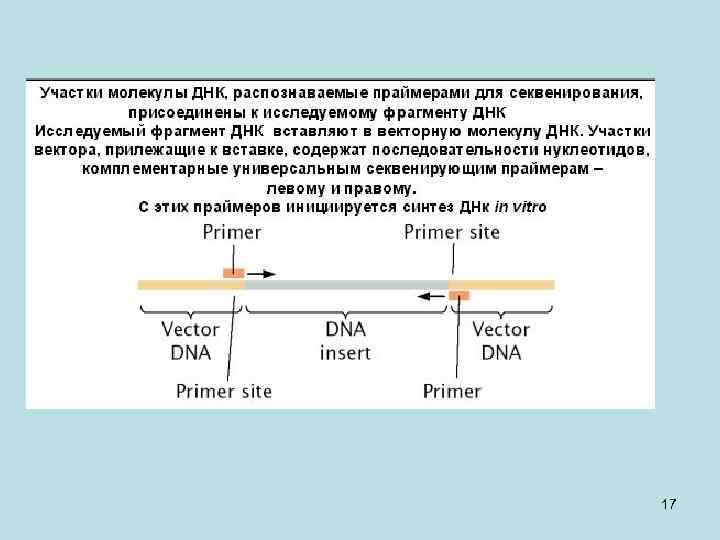
 • Рассмотрим определение последовательности нуклеотидов в клонированном фрагменте ДНК. Клонированный фрагмент находится в так называемой векторной молекуле ДНК – молекуле, которая позволяет ввести его в клетку (обычно это клетка бактериальная, но иногда используются и дрожжевые клетки). Все работы по секвенированию генома человека прошли при участии бактериальных векторных молекул. Участок вектора, прилежащий к вставке, содержит последовательность нуклеотидов, комплементарную универсальному секвенирующему праймеру. С этого праймера инициируется синтез ДНК in vitro, который с первого нуклеотида будет идти по матрице клонированного фрагмента ДНК человека. Универсальных праймеров используется два, один к последовательности вектора прилежащей к одному концу вставки, другой праймер к последовательности вектора прилежащей к другому концу вставки. С одного из праймеров клонированный фрагмент секвенируется с одной стороны, а с другого праймера – с другой стороны. 18
• Рассмотрим определение последовательности нуклеотидов в клонированном фрагменте ДНК. Клонированный фрагмент находится в так называемой векторной молекуле ДНК – молекуле, которая позволяет ввести его в клетку (обычно это клетка бактериальная, но иногда используются и дрожжевые клетки). Все работы по секвенированию генома человека прошли при участии бактериальных векторных молекул. Участок вектора, прилежащий к вставке, содержит последовательность нуклеотидов, комплементарную универсальному секвенирующему праймеру. С этого праймера инициируется синтез ДНК in vitro, который с первого нуклеотида будет идти по матрице клонированного фрагмента ДНК человека. Универсальных праймеров используется два, один к последовательности вектора прилежащей к одному концу вставки, другой праймер к последовательности вектора прилежащей к другому концу вставки. С одного из праймеров клонированный фрагмент секвенируется с одной стороны, а с другого праймера – с другой стороны. 18
 • Вектор у нас один и тот же, а вставок – миллионы, но все они секвенировались с одной и той же пары праймеров. Основная часть генома была секвенирована при клонировании фрагментов в 2 тысячи пар нуклеотидов, потому что тысяча читалась с одной стороны и тысяча – с другой. Каждая точка генома человека была просеквенирована несколько десятков раз в составе разных клонированных молекул ДНК. То есть расстояние в геноме между концами клонированных и секвенированных фрагментов ДНК составляло меньше 200 пар нуклеотидов. От каждой точки старта было прочитано около 1000 нуклеотидов. Из всего этого набора «текстов» воспроизводилась структура генома человека. Но собрать эти 1000 -буквенные сиквенсы в контиги длинной в мииллионы букв удалось лишь на основе того, что большая часть фрагментов была предварительно картирована относительно хромосом человека. Без картирования сиквенс мог попасть в повторяющийся участок генома, а продолжение сиквенса из такого участка имеет столько вариантов продолжений, сколько раз повтор присутствует в геноме человека (некоторые повторы – миллион раз). Поэтому сначала устанавливали последовательность расположения клонированных фрагментов в геноме. Это было сделано для фрагментов размером около 200 тыс пар нуклеотидов, а уже затем их секвенировали. • Процесс секвенирования по методу Сенгера может быть автоматизирован. Механизм представлен на следующем слайде. 19
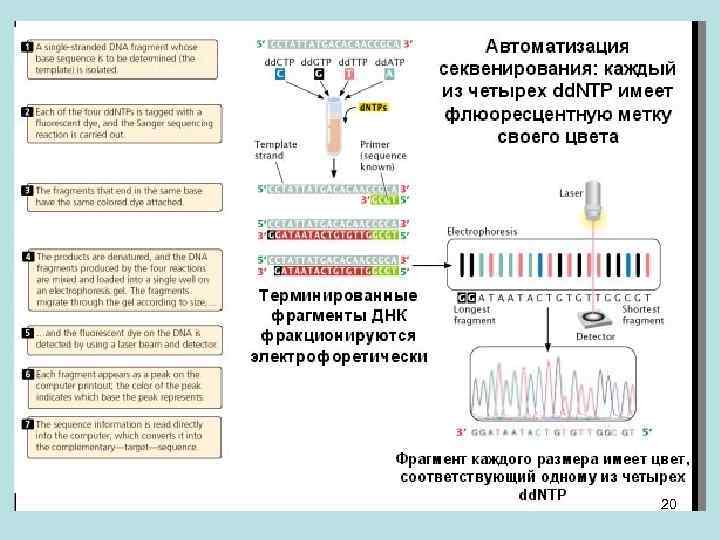
• Вектор у нас один и тот же, а вставок – миллионы, но все они секвенировались с одной и той же пары праймеров. Основная часть генома была секвенирована при клонировании фрагментов в 2 тысячи пар нуклеотидов, потому что тысяча читалась с одной стороны и тысяча – с другой. Каждая точка генома человека была просеквенирована несколько десятков раз в составе разных клонированных молекул ДНК. То есть расстояние в геноме между концами клонированных и секвенированных фрагментов ДНК составляло меньше 200 пар нуклеотидов. От каждой точки старта было прочитано около 1000 нуклеотидов. Из всего этого набора «текстов» воспроизводилась структура генома человека. Но собрать эти 1000 -буквенные сиквенсы в контиги длинной в мииллионы букв удалось лишь на основе того, что большая часть фрагментов была предварительно картирована относительно хромосом человека. Без картирования сиквенс мог попасть в повторяющийся участок генома, а продолжение сиквенса из такого участка имеет столько вариантов продолжений, сколько раз повтор присутствует в геноме человека (некоторые повторы – миллион раз). Поэтому сначала устанавливали последовательность расположения клонированных фрагментов в геноме. Это было сделано для фрагментов размером около 200 тыс пар нуклеотидов, а уже затем их секвенировали. • Процесс секвенирования по методу Сенгера может быть автоматизирован. Механизм представлен на следующем слайде. 19
 20
20
 • На слайде виден праймер, синтез с которого идет влево. У нас есть дидезоксинуклеотидфосфаты T, A, C и G. Каждый из них занимает свою позицию во фрагменте синтезируемом по исследуемой матричной нити. На предыдущем слайде каждой букве соответствовала отдельная дорожка геля, их всего четыре. Если каждую из букв терминирующих синтез пометить в свой цвет, то все терминаторы можно объединить в одной пробирке и фракционировать продукты в одной дорожке. Обрыв синтеза в позиции данной буквы даст фрагмент со своим положением в геле после фракционирования. Каждое положение обрыва будет характеризоваться цветом той- буквы терминатора, на которой произошел обрыв. В ходе фракционирования терминированных фрагментов лазер будет фиксировать на детекторе последовательные пики - какая прошла полоса по счету, и какого она цвета. Далее эта последовательность пиков дешифруется в последовательность нуклеотидов в молекуле ДНК. Точность сиквенса (установления того, какая именно буква терминировала синтез в данной позиции) определяется соотношением высот пиков соответствующих разным буквам в одной и той же позиции секвенируемого фрагмента. Между двумя пиками разных цветов в одной позиции было заданное дискриминирующее значение. Техника отрабатывалась так, что буква считалась достоверно установленной для данной позиции, если основной пик в этой позиции был выше других в заданное количество раз. 21
• На слайде виден праймер, синтез с которого идет влево. У нас есть дидезоксинуклеотидфосфаты T, A, C и G. Каждый из них занимает свою позицию во фрагменте синтезируемом по исследуемой матричной нити. На предыдущем слайде каждой букве соответствовала отдельная дорожка геля, их всего четыре. Если каждую из букв терминирующих синтез пометить в свой цвет, то все терминаторы можно объединить в одной пробирке и фракционировать продукты в одной дорожке. Обрыв синтеза в позиции данной буквы даст фрагмент со своим положением в геле после фракционирования. Каждое положение обрыва будет характеризоваться цветом той- буквы терминатора, на которой произошел обрыв. В ходе фракционирования терминированных фрагментов лазер будет фиксировать на детекторе последовательные пики - какая прошла полоса по счету, и какого она цвета. Далее эта последовательность пиков дешифруется в последовательность нуклеотидов в молекуле ДНК. Точность сиквенса (установления того, какая именно буква терминировала синтез в данной позиции) определяется соотношением высот пиков соответствующих разным буквам в одной и той же позиции секвенируемого фрагмента. Между двумя пиками разных цветов в одной позиции было заданное дискриминирующее значение. Техника отрабатывалась так, что буква считалась достоверно установленной для данной позиции, если основной пик в этой позиции был выше других в заданное количество раз. 21
 22
22
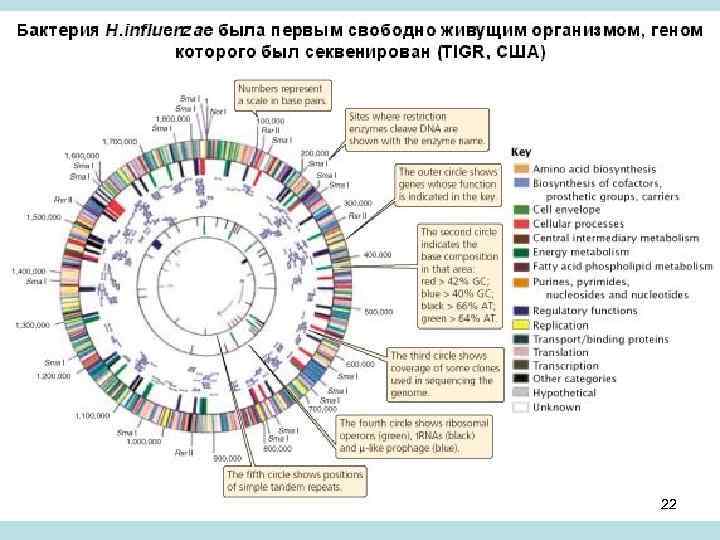
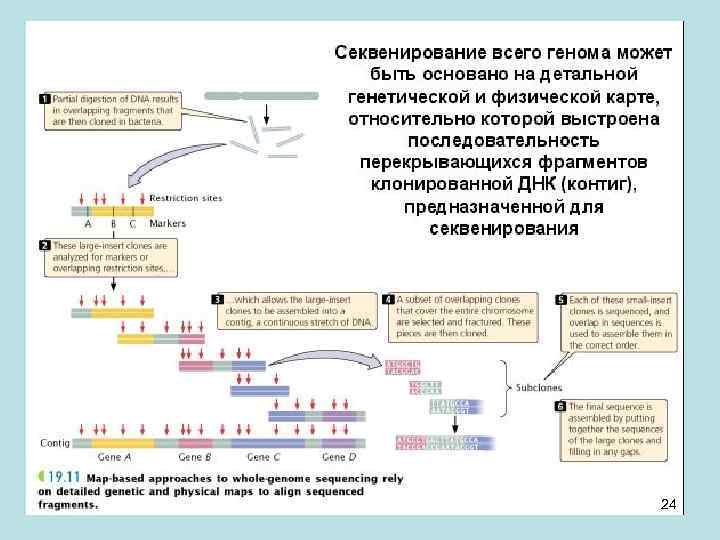
 • Бактерия H. influenzae была первым свободно живущим организмом, геном которого был полностью секвенирован. Поскольку геном бактерии маленький, около тысячи нуклеотидов, и повторов нем мало (да и короткие они), то предварительное картирование клонированных фрагментов ДНК не понадобилось – эти фрагменты сразу сиквенировались. • Такая работа была проведена в институте генетических исследований ТIGR под началом Крега Вентера. Вентер затем организовал фирму Селера, секвенировавшую геном человека, где он применил ту же схему секвенирования что и для бактерии. Причем деньги он взял у частных фирм, так как государство не верило, что у него что-нибудь получится. • Мировое сообщество предварительно использовало генетическую и физическую карты, относительно которой была выстроена последовательность перекрывающихся фрагментов клонированной ДНК (контиг), предназначенной для секвенирования. То есть сиквенс генома человека был собран из фрагментов правило благодаря использованию упорядоченного набора клонов и установлению последовательности нуклеотидов картированных клонов. 23
• Бактерия H. influenzae была первым свободно живущим организмом, геном которого был полностью секвенирован. Поскольку геном бактерии маленький, около тысячи нуклеотидов, и повторов нем мало (да и короткие они), то предварительное картирование клонированных фрагментов ДНК не понадобилось – эти фрагменты сразу сиквенировались. • Такая работа была проведена в институте генетических исследований ТIGR под началом Крега Вентера. Вентер затем организовал фирму Селера, секвенировавшую геном человека, где он применил ту же схему секвенирования что и для бактерии. Причем деньги он взял у частных фирм, так как государство не верило, что у него что-нибудь получится. • Мировое сообщество предварительно использовало генетическую и физическую карты, относительно которой была выстроена последовательность перекрывающихся фрагментов клонированной ДНК (контиг), предназначенной для секвенирования. То есть сиквенс генома человека был собран из фрагментов правило благодаря использованию упорядоченного набора клонов и установлению последовательности нуклеотидов картированных клонов. 23
 24
24
 25
25
 • Вентер же, в отличие от мирового сообщества, использовал случайный набор клонов и попытался восстановить полную последовательность нуклеотидов прямо из сравнения сиквенсов всей кучи фрагментов. На бактерии у него это удалось, но на человеке это сработало лишь потому, что он использовал публично доступные данные от мирового сообщества о том, какие молекулы где расположены в геноме человека. • Вентер опубликовал свою работу на месяц раньше, чем мировое сообщество, потому что он ничего не картировал, а использовал секвенирование совсем коротких рекомбинантных молекул. Общую длина секвенированных фрагментов ДНК была у Вентера в пять раз больше, чем сделало все мировое сообщество. Используя данные мирового сообщества о картированных фрагментах, Вентер смог восстановить в единую последовательность нуклеотидов все то, что он насеквенировал. Если бы данных мирового сообщества не было бы, то вся его работа была представлена короткими отрезками, которые бы разветвлялись, из-за того, что в геноме находятся повторы. • В результате проделанной работы вышло две статьи: статья Вентера в журнале Science и статья Лэндера – лидера мирового сообщества - в журнале Nature. 26
• Вентер же, в отличие от мирового сообщества, использовал случайный набор клонов и попытался восстановить полную последовательность нуклеотидов прямо из сравнения сиквенсов всей кучи фрагментов. На бактерии у него это удалось, но на человеке это сработало лишь потому, что он использовал публично доступные данные от мирового сообщества о том, какие молекулы где расположены в геноме человека. • Вентер опубликовал свою работу на месяц раньше, чем мировое сообщество, потому что он ничего не картировал, а использовал секвенирование совсем коротких рекомбинантных молекул. Общую длина секвенированных фрагментов ДНК была у Вентера в пять раз больше, чем сделало все мировое сообщество. Используя данные мирового сообщества о картированных фрагментах, Вентер смог восстановить в единую последовательность нуклеотидов все то, что он насеквенировал. Если бы данных мирового сообщества не было бы, то вся его работа была представлена короткими отрезками, которые бы разветвлялись, из-за того, что в геноме находятся повторы. • В результате проделанной работы вышло две статьи: статья Вентера в журнале Science и статья Лэндера – лидера мирового сообщества - в журнале Nature. 26
 • Проект генома человека начат в 1990 г. Первая (черновая) версия последовательности нуклеотидов была закончена в 2000 г. Конечная версия, которая больше не будет совершенствоваться (названная Build 35) - закончена в 2004 г. 27
• Проект генома человека начат в 1990 г. Первая (черновая) версия последовательности нуклеотидов была закончена в 2000 г. Конечная версия, которая больше не будет совершенствоваться (названная Build 35) - закончена в 2004 г. 27
 • Последняя версия последовательности содержит 2, 85 миллиардов пар нуклеотидов с 341 брешью, то есть в этих местах по каким-то причинам секвенировать геномную ДНК не удалось. Сиквенс покрывает около 99% той части генома человека, которая представлены в некомпактизированной форме – эухроматине. Точность сиквенса в конечной версии – 1 ошибка на 100 тысяч позиций подряд. Еще точнее секвенировать весь геном уже никто не будет. Напомню, что папин геном отличается у вас от маминого генома примерно в 1 позиции на тысячу. • Предсказанное число генов у человека теперь 2025 тысяч, что немного меньше, чем предсказывалось раньше. 28
• Последняя версия последовательности содержит 2, 85 миллиардов пар нуклеотидов с 341 брешью, то есть в этих местах по каким-то причинам секвенировать геномную ДНК не удалось. Сиквенс покрывает около 99% той части генома человека, которая представлены в некомпактизированной форме – эухроматине. Точность сиквенса в конечной версии – 1 ошибка на 100 тысяч позиций подряд. Еще точнее секвенировать весь геном уже никто не будет. Напомню, что папин геном отличается у вас от маминого генома примерно в 1 позиции на тысячу. • Предсказанное число генов у человека теперь 2025 тысяч, что немного меньше, чем предсказывалось раньше. 28
 • Кроме данных о последовательности нуклеотидов геномной ДНК человека (референтная последовательность) созданы также базы данных: • 1) о последовательности нуклеотидов транскрибируемых участков ДНК (EST database, EST = Expressed Sequence Tags), которая характеризует не геномную ДНК, а то, что транскрибировалось с ДНК. • 2) о положении и содержании отличий (полиморфизмов, то есть нуклеотидных замен) других известных последовательностей ДНК человека от референтной последовательности (SNP database, SNP = Single Nucleotide Polymorphism) 29
• Кроме данных о последовательности нуклеотидов геномной ДНК человека (референтная последовательность) созданы также базы данных: • 1) о последовательности нуклеотидов транскрибируемых участков ДНК (EST database, EST = Expressed Sequence Tags), которая характеризует не геномную ДНК, а то, что транскрибировалось с ДНК. • 2) о положении и содержании отличий (полиморфизмов, то есть нуклеотидных замен) других известных последовательностей ДНК человека от референтной последовательности (SNP database, SNP = Single Nucleotide Polymorphism) 29
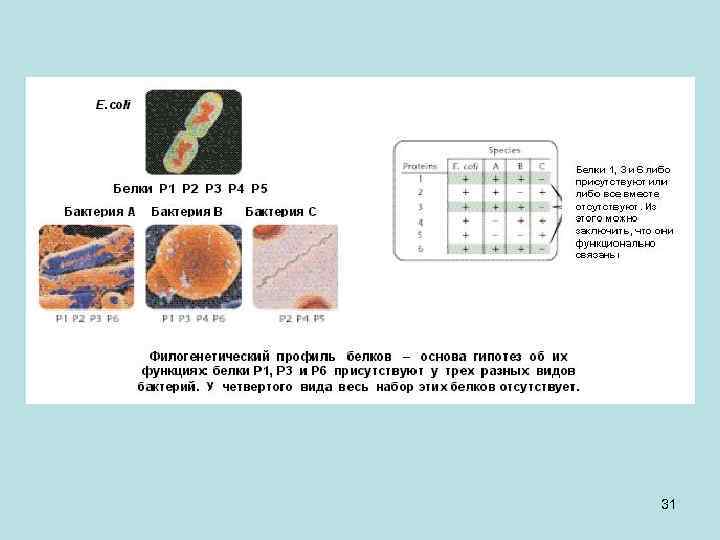
 • Геномика – недавно возникшее направление науки, объектом изучения которой являются геномы всех организмов, не только человека. Одно из направлений геномики - воссоздание суммарной карты метаболических путей живого, состоящей из частных метаболических карт, характерных для каждого организма. • Выявление в разных геномах определенных наборов генов метаболических функций позволяет предположить функциональную связь генов этого набора в едином участке метаболической цепи. В частности, один из подходов такой. Исследуют ряд видов (рисунок ниже), к примеру, бактерий. У первых трех видов есть гены для белков 1, 3 и 6. Остальные белки у некоторых есть, а у некоторых нет. Этот набор генов (1, 3 и 6) отсутствует у четвертого вида. Такого рода присутствие-отсутствие цельного набора генов позволяет сделать предположение о том, что кодируемые ими белки каким-то образом связаны в метаболическом цикле. Гены такого набора необязательно располагаются рядом в геноме. 30
• Геномика – недавно возникшее направление науки, объектом изучения которой являются геномы всех организмов, не только человека. Одно из направлений геномики - воссоздание суммарной карты метаболических путей живого, состоящей из частных метаболических карт, характерных для каждого организма. • Выявление в разных геномах определенных наборов генов метаболических функций позволяет предположить функциональную связь генов этого набора в едином участке метаболической цепи. В частности, один из подходов такой. Исследуют ряд видов (рисунок ниже), к примеру, бактерий. У первых трех видов есть гены для белков 1, 3 и 6. Остальные белки у некоторых есть, а у некоторых нет. Этот набор генов (1, 3 и 6) отсутствует у четвертого вида. Такого рода присутствие-отсутствие цельного набора генов позволяет сделать предположение о том, что кодируемые ими белки каким-то образом связаны в метаболическом цикле. Гены такого набора необязательно располагаются рядом в геноме. 30
 31
31
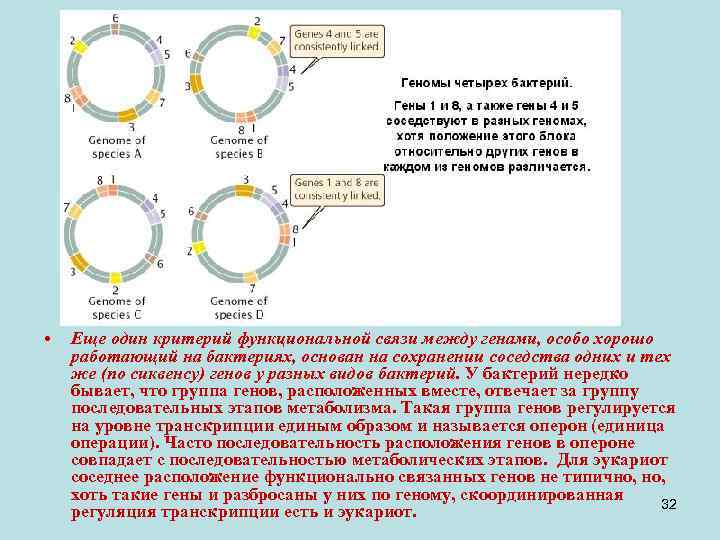 • Еще один критерий функциональной связи между генами, особо хорошо работающий на бактериях, основан на сохранении соседства одних и тех же (по сиквенсу) генов у разных видов бактерий. У бактерий нередко бывает, что группа генов, расположенных вместе, отвечает за группу последовательных этапов метаболизма. Такая группа генов регулируется на уровне транскрипции единым образом и называется оперон (единица операции). Часто последовательность расположения генов в опероне совпадает с последовательностью метаболических этапов. Для эукариот соседнее расположение функционально связанных генов не типично, хоть такие гены и разбросаны у них по геному, скоординированная 32 регуляция транскрипции есть и эукариот.
• Еще один критерий функциональной связи между генами, особо хорошо работающий на бактериях, основан на сохранении соседства одних и тех же (по сиквенсу) генов у разных видов бактерий. У бактерий нередко бывает, что группа генов, расположенных вместе, отвечает за группу последовательных этапов метаболизма. Такая группа генов регулируется на уровне транскрипции единым образом и называется оперон (единица операции). Часто последовательность расположения генов в опероне совпадает с последовательностью метаболических этапов. Для эукариот соседнее расположение функционально связанных генов не типично, хоть такие гены и разбросаны у них по геному, скоординированная 32 регуляция транскрипции есть и эукариот.
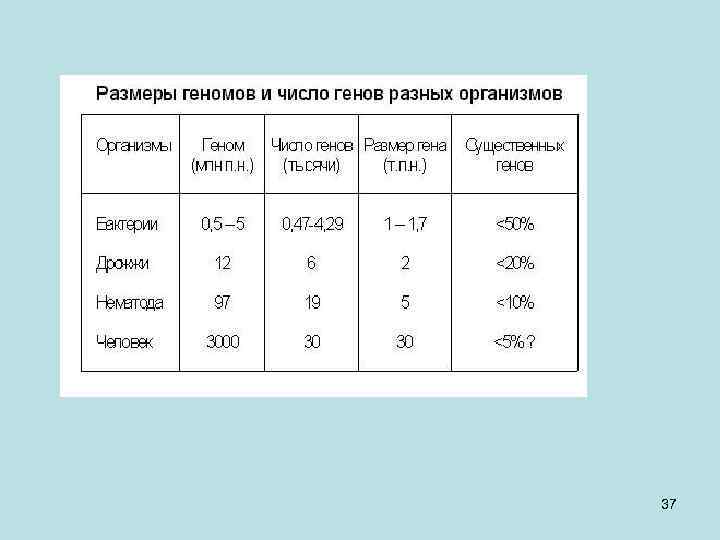
 • На данный момент просеквенировано несколько сотен геномов бактерий и геномы нескольких эукариот. Теперь мы знаем, что - у бактерий размеры генома не бывают меньше 0, 5 миллионов пар нуклеотидов, - а максимальный размер генома около 10 миллионов п. н. , - у дрожжей (эукариотический организм)– порядка 12 миллионов, - у червя нематоды – 97 млн. , - а у человека – 3 миллиарда пар нуклеотидов. - А число генов у про- и эукариот различается уже в меньшее число раз. • Минимальное количество генов у бактерии микоплазмы – 470 штук, - у дрожжей – 6000, - у нематоды – 19000, - а у человека около 20000, то есть от нематоды и мухи по количеству генов мы не сильно отличаемся. • Количество хромосомной ДНК, приходящейся на один ген - у бактерий -1000 п. н. то есть гены упакованы очень плотно; - у дрожжей – 2000 п. н. , и кое-где гены разделены некоторым пространством; - у нематоды – 5000 п. н. на ген и появляются пространства внутри генов – интроны; у человека – 30000 п. н. - У нас в геноме большие межгенные пространства и большие пространства внутри генов, которые не переходят в зрелую РНК. 33
• На данный момент просеквенировано несколько сотен геномов бактерий и геномы нескольких эукариот. Теперь мы знаем, что - у бактерий размеры генома не бывают меньше 0, 5 миллионов пар нуклеотидов, - а максимальный размер генома около 10 миллионов п. н. , - у дрожжей (эукариотический организм)– порядка 12 миллионов, - у червя нематоды – 97 млн. , - а у человека – 3 миллиарда пар нуклеотидов. - А число генов у про- и эукариот различается уже в меньшее число раз. • Минимальное количество генов у бактерии микоплазмы – 470 штук, - у дрожжей – 6000, - у нематоды – 19000, - а у человека около 20000, то есть от нематоды и мухи по количеству генов мы не сильно отличаемся. • Количество хромосомной ДНК, приходящейся на один ген - у бактерий -1000 п. н. то есть гены упакованы очень плотно; - у дрожжей – 2000 п. н. , и кое-где гены разделены некоторым пространством; - у нематоды – 5000 п. н. на ген и появляются пространства внутри генов – интроны; у человека – 30000 п. н. - У нас в геноме большие межгенные пространства и большие пространства внутри генов, которые не переходят в зрелую РНК. 33
 • Заметим, все эти организмы по размерам зрелых транскриптов не сильно отличаются. В зрелой РНК белок-кодирующий участок занимает обычно основную часть последовательности. Часть генов кодируют РНК, с которой белок вообще не синтезируется. Перед белок-кодирующей последовательностью в зрелой м. РНК расположены участки регуляции трансляции, а после белок кодирующей последовательности – участки определяющие стабильность (время жизни РНК). У прокариот последовательности перед и после белок-кодирующей части гораздо короче, чем у эукариот. Так что по размерам РНК все организмы ближе, чем по размерам генов, а по размерам белков – еще ближе. 34
• Заметим, все эти организмы по размерам зрелых транскриптов не сильно отличаются. В зрелой РНК белок-кодирующий участок занимает обычно основную часть последовательности. Часть генов кодируют РНК, с которой белок вообще не синтезируется. Перед белок-кодирующей последовательностью в зрелой м. РНК расположены участки регуляции трансляции, а после белок кодирующей последовательности – участки определяющие стабильность (время жизни РНК). У прокариот последовательности перед и после белок-кодирующей части гораздо короче, чем у эукариот. Так что по размерам РНК все организмы ближе, чем по размерам генов, а по размерам белков – еще ближе. 34
 • Экспериментально проводили «выключение» каждого гена у многих бактерий, и смотрели, выживут они в данных условиях или нет. Оказалось, что у бактерий можно «выключить» (поочередно) около 50% генов, и они все равно будут жить. У дрожжей можно выключить 80% генов и они все равно будут жить. • Как это было экспериментально показано? В геном клетки вставляют репортерный фрагмент ДНК, который позволяет замерить скорость транскрипции и трансляции в точке вставки фрагмента. Известно поэтому, что и траснкрипция и трансляция репортерного гена через данную точку в данных условиях происходит с регуляторных элементов гена, разорванного вставкой репортера, хотя разорванный ген сам не функционален. Таким образом 80% генов дрожжей по одному «убивали» и видели, что клетка дрожжей все равно живет. 35
• Экспериментально проводили «выключение» каждого гена у многих бактерий, и смотрели, выживут они в данных условиях или нет. Оказалось, что у бактерий можно «выключить» (поочередно) около 50% генов, и они все равно будут жить. У дрожжей можно выключить 80% генов и они все равно будут жить. • Как это было экспериментально показано? В геном клетки вставляют репортерный фрагмент ДНК, который позволяет замерить скорость транскрипции и трансляции в точке вставки фрагмента. Известно поэтому, что и траснкрипция и трансляция репортерного гена через данную точку в данных условиях происходит с регуляторных элементов гена, разорванного вставкой репортера, хотя разорванный ген сам не функционален. Таким образом 80% генов дрожжей по одному «убивали» и видели, что клетка дрожжей все равно живет. 35
 • У нематоды на 20 000 генов получено несколько десятков тысяч мутаций, которые, по-видимому, поражают около 2 000 генов (так называемых групп комплементации). Это около 10% всех генов нематоды. То есть если «выключить» около 90% генов, клетка будет продолжать жить. • У человека из 20 000 генов только в 1700 (меньше 10%) известны мутации, которые связаны с болезнями, наследуемыми по Менделю как моногенный признак. 36
• У нематоды на 20 000 генов получено несколько десятков тысяч мутаций, которые, по-видимому, поражают около 2 000 генов (так называемых групп комплементации). Это около 10% всех генов нематоды. То есть если «выключить» около 90% генов, клетка будет продолжать жить. • У человека из 20 000 генов только в 1700 (меньше 10%) известны мутации, которые связаны с болезнями, наследуемыми по Менделю как моногенный признак. 36
 37
37
 • В связи с этим понятно, что количество генов, мутации в которых будут приводить заболеваниям человека (по крайней мере, к летальным), скорее всего, не увеличится значительно, по сравнению с тем, что уже известно к настоящему времени. Сейчас в интернет доступна база данных OMIM (Online Mendelian Inheritance in Man) по генам, мутации которых приводят к заболеваниям и проявляются как менделирующие признаки. • В геноме не все его участки транскрибируется. В связи с этим встал вопрос экспериментального определения, где и сколько в геноме генов. Под одним геном понимается участок ДНК, который соответствует единому транскрипту, образованному с этого участка. При транскрипции участка ДНК получается так называемыя пре-м. РНК, которая содержит и экзоны (участки, переходящие затем в зрелую м. РНК), и интроны (вставочные последовательности, которые удаляются из м. РНК). Интроны удаляются из пре-м. РНК в результате процесса, называемого сплайсингом. Остающиеся в результате участки пре-м. РНК, называемые экзонами, соединяются в единую нить. Она называется зрелой м. РНК. ( Некоторые из РНК не кодируют белок. Называть такие РНК матричными, т. е. м. РНК терминологически не верно, хотя они соответствуют генам и имеют свои функции. ) 38
• В связи с этим понятно, что количество генов, мутации в которых будут приводить заболеваниям человека (по крайней мере, к летальным), скорее всего, не увеличится значительно, по сравнению с тем, что уже известно к настоящему времени. Сейчас в интернет доступна база данных OMIM (Online Mendelian Inheritance in Man) по генам, мутации которых приводят к заболеваниям и проявляются как менделирующие признаки. • В геноме не все его участки транскрибируется. В связи с этим встал вопрос экспериментального определения, где и сколько в геноме генов. Под одним геном понимается участок ДНК, который соответствует единому транскрипту, образованному с этого участка. При транскрипции участка ДНК получается так называемыя пре-м. РНК, которая содержит и экзоны (участки, переходящие затем в зрелую м. РНК), и интроны (вставочные последовательности, которые удаляются из м. РНК). Интроны удаляются из пре-м. РНК в результате процесса, называемого сплайсингом. Остающиеся в результате участки пре-м. РНК, называемые экзонами, соединяются в единую нить. Она называется зрелой м. РНК. ( Некоторые из РНК не кодируют белок. Называть такие РНК матричными, т. е. м. РНК терминологически не верно, хотя они соответствуют генам и имеют свои функции. ) 38
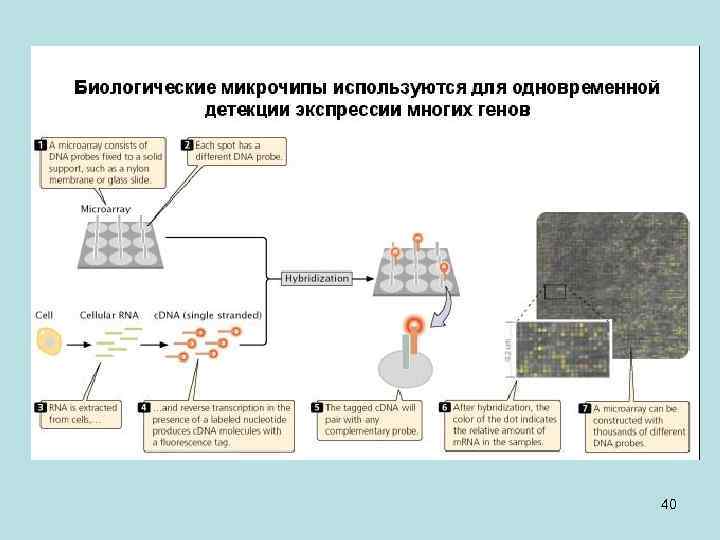
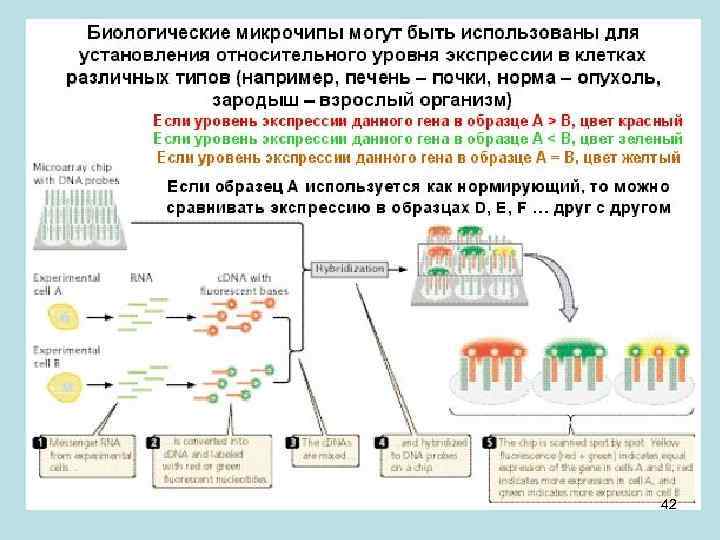
 • Зрелая м. РНК используется как материал для экспериментального исследования наличия гена в геноме, его положения и интрон-экзонной структуры. Инструментом для такого исследования являются биологические микрочипы. • Первый патент на микрочипы принадлежит коллективу под руководством Андрея Дарьевича Мирзабекова, который был директором Института молекулярной биологии РАН и заведующий одной из кафедр ФМБФ МФТИ. Он предложил иммобилизовать синтетические фрагменты ДНК на твердые матрицы, и проводить гибридизацию этой матрицы с исследуемым образцом нуклеиновой кислоты – ДНК или РНК. • Как исследовать, действительно ли ген существует, то есть транскрибируется ли данный участок ДНК? Для этого ген представляют в чипе частью его последовательности – олигонуклеотидом, который иммобилизован в микроплощадке с определенными координатами на этой матрице. Этот олигонуклеотид соответствует части экзона, предсказанного компьютером на основе сиквенса геномной ДНК. Чтобы выяснить, действительно геном в данном участке транскрибируется, берется клетка и из нее выделяется суммарная РНК. Из всех этих молекул РНК получают ДНК-копии, которые флуоресцентно метят и проводят гибридизацию с иммобилизованными на микрочипе олигонуклеотидами. Если в данных условиях какие-то площадки с олигонуклеотидами «молчат» (они показаны черным), то это значит, что участок геномной последовательности, комплементарной этому олигонуклеотиду, не транскрибируется. Если же площадка матрицы «светится» , значит олигонуклеотиды в этой площадке прогибридизовались с флуоресцентно меченым продуктом, то есть соответствующий участок генома транскрибировался и действительно 39 является частью какого-то гена.
• Зрелая м. РНК используется как материал для экспериментального исследования наличия гена в геноме, его положения и интрон-экзонной структуры. Инструментом для такого исследования являются биологические микрочипы. • Первый патент на микрочипы принадлежит коллективу под руководством Андрея Дарьевича Мирзабекова, который был директором Института молекулярной биологии РАН и заведующий одной из кафедр ФМБФ МФТИ. Он предложил иммобилизовать синтетические фрагменты ДНК на твердые матрицы, и проводить гибридизацию этой матрицы с исследуемым образцом нуклеиновой кислоты – ДНК или РНК. • Как исследовать, действительно ли ген существует, то есть транскрибируется ли данный участок ДНК? Для этого ген представляют в чипе частью его последовательности – олигонуклеотидом, который иммобилизован в микроплощадке с определенными координатами на этой матрице. Этот олигонуклеотид соответствует части экзона, предсказанного компьютером на основе сиквенса геномной ДНК. Чтобы выяснить, действительно геном в данном участке транскрибируется, берется клетка и из нее выделяется суммарная РНК. Из всех этих молекул РНК получают ДНК-копии, которые флуоресцентно метят и проводят гибридизацию с иммобилизованными на микрочипе олигонуклеотидами. Если в данных условиях какие-то площадки с олигонуклеотидами «молчат» (они показаны черным), то это значит, что участок геномной последовательности, комплементарной этому олигонуклеотиду, не транскрибируется. Если же площадка матрицы «светится» , значит олигонуклеотиды в этой площадке прогибридизовались с флуоресцентно меченым продуктом, то есть соответствующий участок генома транскрибировался и действительно 39 является частью какого-то гена.
 40
40
 • В реальном эксперименте все участки на матрице в той или иной мере «светятся» . Поэтому без сравнения с некоторым стандартом, нельзя сказать с чем связано появление сигнала в данной площадке чипа. Чтобы определить, является ли полученный результат ошибкой эксперимента или нет, проводится сравнение двух объектов. Для этого берутся некие клетки А, из них получают РНК, и их флуоресцентно метят (на слайде - красным). То же проводят и с клетками В, но метят РНК другим цветом (зеленым). Затем проводят гибридизацию чипа со смесью этих двух препаратов РНК. Если сигнал в данной площадке на чипе получается красным, значит в клетках А транскрипция данного гена сильнее, чем в клетках В. Если сигнал зеленый, то транскрипция сильнее в клетках В. Если красного и зеленого поровну, то получится желтый цвет. Таким образом, возникает возможность сравнивать уровень траснкрипции данного гена в разных клетках - B, C, D и т. д. , нормируя его на уровень транскрипции этого гена в клетках А. При этом сравнивают транскрипцию гена в разных тканях, в них гены экспрессируются поразному. Можно сравнивать опухоль и норму, тогда выявляют те гены, которые специфически более сильно транскрибируются в опухоли или в норме. Можно посмотреть разные стадии развития, как работают гены в зародышевом развитии и во взрослом состоянии. Таким образом, гибридизация на микрочипах позволяет узнать, какие гены в геноме в данных условиях транскрибируются, а именно этим он и проявляет свою жизнь. 41
• В реальном эксперименте все участки на матрице в той или иной мере «светятся» . Поэтому без сравнения с некоторым стандартом, нельзя сказать с чем связано появление сигнала в данной площадке чипа. Чтобы определить, является ли полученный результат ошибкой эксперимента или нет, проводится сравнение двух объектов. Для этого берутся некие клетки А, из них получают РНК, и их флуоресцентно метят (на слайде - красным). То же проводят и с клетками В, но метят РНК другим цветом (зеленым). Затем проводят гибридизацию чипа со смесью этих двух препаратов РНК. Если сигнал в данной площадке на чипе получается красным, значит в клетках А транскрипция данного гена сильнее, чем в клетках В. Если сигнал зеленый, то транскрипция сильнее в клетках В. Если красного и зеленого поровну, то получится желтый цвет. Таким образом, возникает возможность сравнивать уровень траснкрипции данного гена в разных клетках - B, C, D и т. д. , нормируя его на уровень транскрипции этого гена в клетках А. При этом сравнивают транскрипцию гена в разных тканях, в них гены экспрессируются поразному. Можно сравнивать опухоль и норму, тогда выявляют те гены, которые специфически более сильно транскрибируются в опухоли или в норме. Можно посмотреть разные стадии развития, как работают гены в зародышевом развитии и во взрослом состоянии. Таким образом, гибридизация на микрочипах позволяет узнать, какие гены в геноме в данных условиях транскрибируются, а именно этим он и проявляет свою жизнь. 41
 42
42
 • Гибридизация на микрочипах позволяет проверить компьютерное предсказание о том, что данный фрагмент генома – экзон, (участок, остающийся в зрелой м. РНК) и он действительно транскрибируется. Каждый ген не обязан экспрессироваться во всех тканях и в каждых данных условиях. Поэтому нужно исследовать много условий и тканей, чтобы выявить все участки генома, соответствующие экзонам. На слайде каждая гибридизация на данном чипе соответствует какому-то одному типу ткани или условиям ее функционирования. Красным указано количество экзонов в каждой из хромосом, существование которых экспериментально подтверждено. На каждом чипе 1 090 408 площадок с пробами-олигонуклеотидами, соответствующими каждому из 442 785 экзонов человека, предсказанных компьютером. Олигонуклеотиды в площадках соответствуют как транскрибируемой нити ДНК, так комплементарной нити. В геноме человека транскрипция комплементарных нитей ДНК, характерна для небольшой части генов. Такие гены перекрываются и, возможно, взаимно регулируются на уровне транскрипции. У бактерий перекрывание генов гораздо более частое явление, чем у эукариот. 43
• Гибридизация на микрочипах позволяет проверить компьютерное предсказание о том, что данный фрагмент генома – экзон, (участок, остающийся в зрелой м. РНК) и он действительно транскрибируется. Каждый ген не обязан экспрессироваться во всех тканях и в каждых данных условиях. Поэтому нужно исследовать много условий и тканей, чтобы выявить все участки генома, соответствующие экзонам. На слайде каждая гибридизация на данном чипе соответствует какому-то одному типу ткани или условиям ее функционирования. Красным указано количество экзонов в каждой из хромосом, существование которых экспериментально подтверждено. На каждом чипе 1 090 408 площадок с пробами-олигонуклеотидами, соответствующими каждому из 442 785 экзонов человека, предсказанных компьютером. Олигонуклеотиды в площадках соответствуют как транскрибируемой нити ДНК, так комплементарной нити. В геноме человека транскрипция комплементарных нитей ДНК, характерна для небольшой части генов. Такие гены перекрываются и, возможно, взаимно регулируются на уровне транскрипции. У бактерий перекрывание генов гораздо более частое явление, чем у эукариот. 43
 44
44
 • Микрочипы могут быть использованы для исследования изменений уровня транскрипции генов, связанной с возникновением или прогрессией заболевания, (например, опухолевого или инфекционного). Предполагается, что каждая болезнь, характеризуется своим штрихкодом - изменением уровня транскрипции набора генов характерного именно для данной болезни. Этот анализ является очень важным для усовершенствования функциональной диагностики в медицине. 45
• Микрочипы могут быть использованы для исследования изменений уровня транскрипции генов, связанной с возникновением или прогрессией заболевания, (например, опухолевого или инфекционного). Предполагается, что каждая болезнь, характеризуется своим штрихкодом - изменением уровня транскрипции набора генов характерного именно для данной болезни. Этот анализ является очень важным для усовершенствования функциональной диагностики в медицине. 45
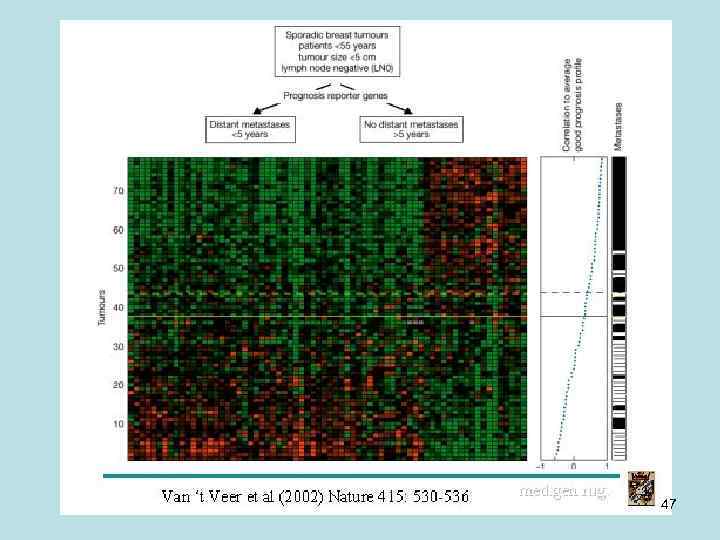
 • Провели такой опыт. Взяли образцы РНК из опухолей у двух групп больных. В одной группе метастазы были, а в другой – нет. Метастазы – это возникновение новых очагов опухоли в организме, пространственно отделенных от исходного очага. На данном чипе довольно резко проходит граница между группами зеленых и красных площадок. То есть видны гены, изменение уровня экспрессии которых характерно для стадии метастазирования опухоли, что можно использовать для диагностики этой стадии. Пока этот метод диагностики недоработан. Предполагается, что в будущем по штрих-коду изменения экспрессии в определенном наборе генов можно будет диагностировать конкретные заболевания и стадии их развития, а следовательно и знать, как лечить. 46
• Провели такой опыт. Взяли образцы РНК из опухолей у двух групп больных. В одной группе метастазы были, а в другой – нет. Метастазы – это возникновение новых очагов опухоли в организме, пространственно отделенных от исходного очага. На данном чипе довольно резко проходит граница между группами зеленых и красных площадок. То есть видны гены, изменение уровня экспрессии которых характерно для стадии метастазирования опухоли, что можно использовать для диагностики этой стадии. Пока этот метод диагностики недоработан. Предполагается, что в будущем по штрих-коду изменения экспрессии в определенном наборе генов можно будет диагностировать конкретные заболевания и стадии их развития, а следовательно и знать, как лечить. 46
 47
47
 • Сделаем небольшое отступление. Генетические карты были построены для многих видов. На видах с подробными генетическими картами проводится экспериментальный поиск мутаций связанных с регистрируемыми морфологическими изменениями. На слайде показана схема такой работы на рыбах. Вначале проводят мутагенез. После этого получают гибриды первого поколения. Их используют для возвратных скрещиваний с мутагенизированными родителями. Если оказывается, что какой-то признак выявляется, то смотрят, с какими генетическими маркерами он сонаследуется. Таким образом исследуется, какие гены повреждены мутациями, выявляемыми фенотипически. 48
• Сделаем небольшое отступление. Генетические карты были построены для многих видов. На видах с подробными генетическими картами проводится экспериментальный поиск мутаций связанных с регистрируемыми морфологическими изменениями. На слайде показана схема такой работы на рыбах. Вначале проводят мутагенез. После этого получают гибриды первого поколения. Их используют для возвратных скрещиваний с мутагенизированными родителями. Если оказывается, что какой-то признак выявляется, то смотрят, с какими генетическими маркерами он сонаследуется. Таким образом исследуется, какие гены повреждены мутациями, выявляемыми фенотипически. 48
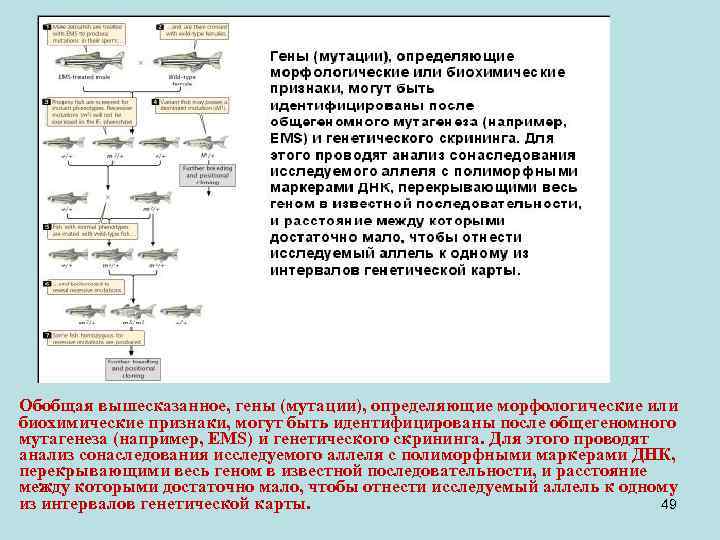 Обобщая вышесказанное, гены (мутации), определяющие морфологические или биохимические признаки, могут быть идентифицированы после общегеномного мутагенеза (например, EMS) и генетического скрининга. Для этого проводят анализ сонаследования исследуемого аллеля с полиморфными маркерами ДНК, перекрывающими весь геном в известной последовательности, и расстояние между которыми достаточно мало, чтобы отнести исследуемый аллель к одному из интервалов генетической карты. 49
Обобщая вышесказанное, гены (мутации), определяющие морфологические или биохимические признаки, могут быть идентифицированы после общегеномного мутагенеза (например, EMS) и генетического скрининга. Для этого проводят анализ сонаследования исследуемого аллеля с полиморфными маркерами ДНК, перекрывающими весь геном в известной последовательности, и расстояние между которыми достаточно мало, чтобы отнести исследуемый аллель к одному из интервалов генетической карты. 49
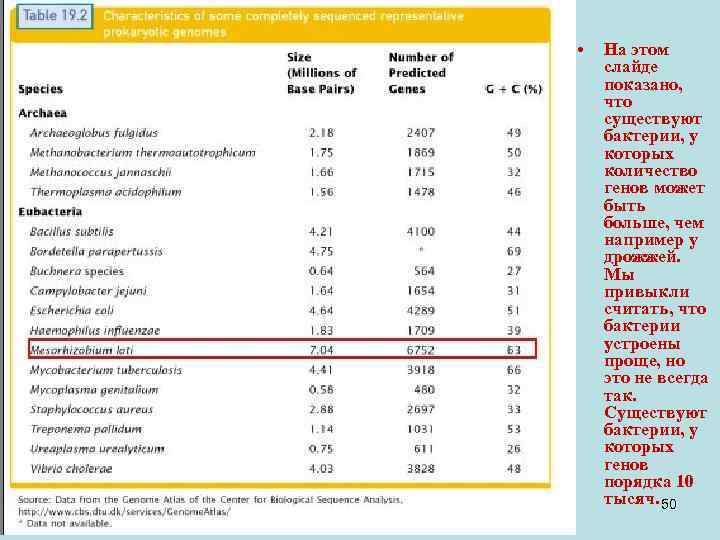 • На этом слайде показано, что существуют бактерии, у которых количество генов может быть больше, чем например у дрожжей. Мы привыкли считать, что бактерии устроены проще, но это не всегда так. Существуют бактерии, у которых генов порядка 10 тысяч. 50
• На этом слайде показано, что существуют бактерии, у которых количество генов может быть больше, чем например у дрожжей. Мы привыкли считать, что бактерии устроены проще, но это не всегда так. Существуют бактерии, у которых генов порядка 10 тысяч. 50
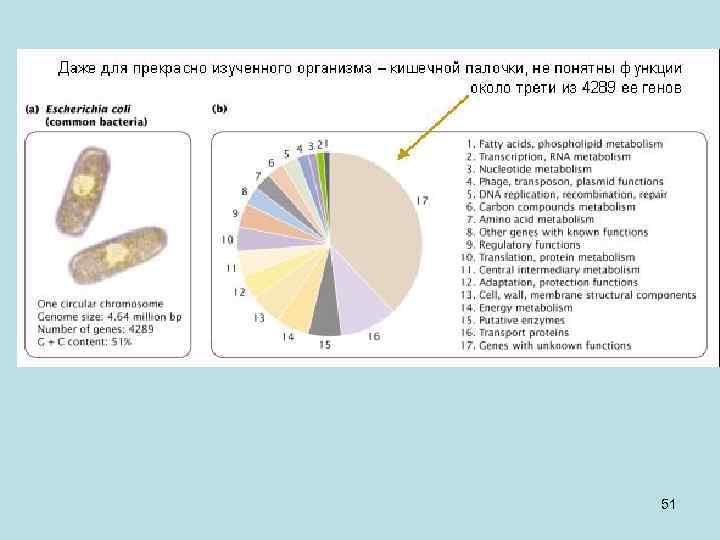 51
51
 На этом слайде обращает внимание, что хотя число генов разнится у разных видов, число так называемых белковых доменов (структурные единицы в белке, отвечающие за единичную функцию) отличаются в пределах разных царств живого (прокариоты и эукариоты) до полутора раз, не более. Конечно комбинации этих доменов разные, но сами домены похожи, то есть они кодируются сходными по последовательности нуклеотидов участками генома и эти сходные участки имеют общее происхождение в эволюции. Обратно заявление будет не верно. Если функции белков сходны, это не означает, что их структура будет одинакова. Одна и та же функция, например, один и тот же каталитический процесс, может выполняться разными, не родственными по происхождению белками. Один и тот же процесс может катализироваться даже и белком 52 и РНК (рибозим), у которых нет ничего общего в происхождении.
На этом слайде обращает внимание, что хотя число генов разнится у разных видов, число так называемых белковых доменов (структурные единицы в белке, отвечающие за единичную функцию) отличаются в пределах разных царств живого (прокариоты и эукариоты) до полутора раз, не более. Конечно комбинации этих доменов разные, но сами домены похожи, то есть они кодируются сходными по последовательности нуклеотидов участками генома и эти сходные участки имеют общее происхождение в эволюции. Обратно заявление будет не верно. Если функции белков сходны, это не означает, что их структура будет одинакова. Одна и та же функция, например, один и тот же каталитический процесс, может выполняться разными, не родственными по происхождению белками. Один и тот же процесс может катализироваться даже и белком 52 и РНК (рибозим), у которых нет ничего общего в происхождении.
 • На данном слайде показаны средние значения характеристик различных элементов генов человека. Средний размер экзона - 145 нуклеотидов, интрона – 3365 и т. д. В общей сложности получается, что белоккодирующая часть гена невелика по сравнению с белок-некодирующей частью, поэтому, когда происходят какие-нибудь мутации, велика вероятность, что промутирует белок-некодирующая часть. Такие мутации или вообще не скажутся на структуре белка, или приведут к изменению его количества, но не структуры (изменения регуляторных участков инициации транскрипции или стабильности РНК), или приведут к драматическим изменениям структуры РНК (мутации в мишенях для сплайсинга). 53
• На данном слайде показаны средние значения характеристик различных элементов генов человека. Средний размер экзона - 145 нуклеотидов, интрона – 3365 и т. д. В общей сложности получается, что белоккодирующая часть гена невелика по сравнению с белок-некодирующей частью, поэтому, когда происходят какие-нибудь мутации, велика вероятность, что промутирует белок-некодирующая часть. Такие мутации или вообще не скажутся на структуре белка, или приведут к изменению его количества, но не структуры (изменения регуляторных участков инициации транскрипции или стабильности РНК), или приведут к драматическим изменениям структуры РНК (мутации в мишенях для сплайсинга). 53
 Распределение генов человека по размеру Размер, тыс. пар нуклеотидов <10 10 -25 26 -50 51 -100 101 -500 >500 % общего числа 23, 3 35, 6 20, 2 13, 0 6, 7 1, 2 54
Распределение генов человека по размеру Размер, тыс. пар нуклеотидов <10 10 -25 26 -50 51 -100 101 -500 >500 % общего числа 23, 3 35, 6 20, 2 13, 0 6, 7 1, 2 54
 • Общая структура генома такова ( размер генома человека 3200 Mb) • Гены занимают всего 1200 Мb. Основная часть этого пространства приходится на псевдогены (нефункциональные гены, инактивированные мутациями), различные фрагменты генов и интроны. • На экзоны функциональных генов (суммарная длина зрелых РНК) приходится 48 Мb. Здесь есть некоторое лукавство, так как на одну пре-м. РНК в среднем приходится 1, 4 зрелых РНК. А из одной зрелой м. РНК в некоторых случаях может получиться до тысячи белков. • Межгенная ДНК занимает 2000 Мb, она представлена главным образом короткими рассеянными по всему геному повторяющимися последовательностями, которые занимают 1400 Мb. Один из таких повторов – Alu-повтор, длиной около 300 п. н. , повторен в геноме миллион раз. Другой примечательный тип рассеянных повторов – длинные концевые повторы (LTR, long terminal repeat). Эти элементы являются молекулярными свидетельствами перескока фрагмента ДНК внутри генома. Общая протяженность таких участков на молекуле ДНК– 250 Мb. 55
• Общая структура генома такова ( размер генома человека 3200 Mb) • Гены занимают всего 1200 Мb. Основная часть этого пространства приходится на псевдогены (нефункциональные гены, инактивированные мутациями), различные фрагменты генов и интроны. • На экзоны функциональных генов (суммарная длина зрелых РНК) приходится 48 Мb. Здесь есть некоторое лукавство, так как на одну пре-м. РНК в среднем приходится 1, 4 зрелых РНК. А из одной зрелой м. РНК в некоторых случаях может получиться до тысячи белков. • Межгенная ДНК занимает 2000 Мb, она представлена главным образом короткими рассеянными по всему геному повторяющимися последовательностями, которые занимают 1400 Мb. Один из таких повторов – Alu-повтор, длиной около 300 п. н. , повторен в геноме миллион раз. Другой примечательный тип рассеянных повторов – длинные концевые повторы (LTR, long terminal repeat). Эти элементы являются молекулярными свидетельствами перескока фрагмента ДНК внутри генома. Общая протяженность таких участков на молекуле ДНК– 250 Мb. 55
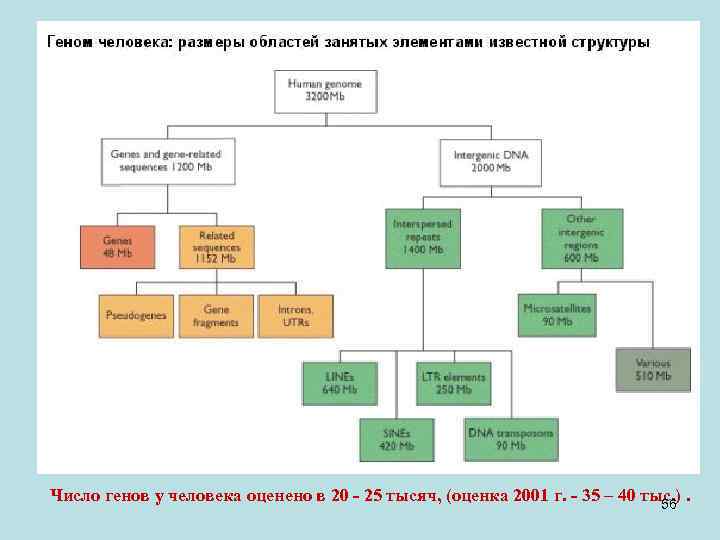 Число генов у человека оценено в 20 - 25 тысяч, (оценка 2001 г. - 35 – 40 тыс. ). 56
Число генов у человека оценено в 20 - 25 тысяч, (оценка 2001 г. - 35 – 40 тыс. ). 56
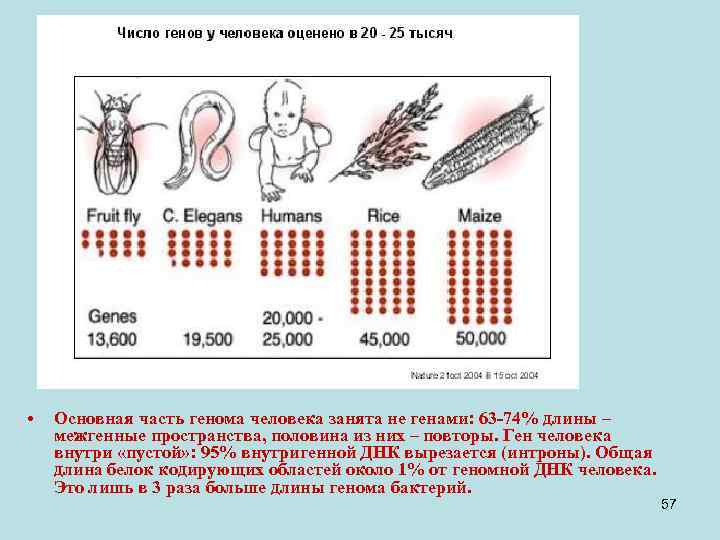 • Основная часть генома человека занята не генами: 63 -74% длины – межгенные пространства, половина из них – повторы. Ген человека внутри «пустой» : 95% внутригенной ДНК вырезается (интроны). Общая длина белок кодирующих областей около 1% от геномной ДНК человека. Это лишь в 3 раза больше длины генома бактерий. 57
• Основная часть генома человека занята не генами: 63 -74% длины – межгенные пространства, половина из них – повторы. Ген человека внутри «пустой» : 95% внутригенной ДНК вырезается (интроны). Общая длина белок кодирующих областей около 1% от геномной ДНК человека. Это лишь в 3 раза больше длины генома бактерий. 57
 • Примечание: • От 26383 до 39114 генов человека были предсказаны компьютером (в 2001 г. ), но лишь менее 7000 были подтверждены на человеке. И более, чем для 80% генов, хоть в чем-то была пересмотрена структура в период с 2001 по 2003 г и продолжает уточняться на микрочипах. • Сейчас предсказанное число генов у человека 20 -25 тысяч и существование около 19 000 из них экспериментально подтверждено – с них образуются транскрипты. • Имеющееся на данный момент определение гена (ген – это фрагмент геномной ДНК с котранскрибируемыми субфрагментами) - не полное. Например, возможна транскрипция с двух цепей. Плохо выявляются короткие гены и белок-некодирующие гены. Их, по крайней мере, под тысячу, но точное число не известно. Такие гены – тоже гены, хоть белок они и не кодируют. Они - гены, потому что с них образуется РНК. Причем РНК некоторых белк-некодирующих генов состоит из нескольких экзонов. То есть, клетке эти РНК зачем-то нужны, но мы пока не понимаем, зачем. 58
• Примечание: • От 26383 до 39114 генов человека были предсказаны компьютером (в 2001 г. ), но лишь менее 7000 были подтверждены на человеке. И более, чем для 80% генов, хоть в чем-то была пересмотрена структура в период с 2001 по 2003 г и продолжает уточняться на микрочипах. • Сейчас предсказанное число генов у человека 20 -25 тысяч и существование около 19 000 из них экспериментально подтверждено – с них образуются транскрипты. • Имеющееся на данный момент определение гена (ген – это фрагмент геномной ДНК с котранскрибируемыми субфрагментами) - не полное. Например, возможна транскрипция с двух цепей. Плохо выявляются короткие гены и белок-некодирующие гены. Их, по крайней мере, под тысячу, но точное число не известно. Такие гены – тоже гены, хоть белок они и не кодируют. Они - гены, потому что с них образуется РНК. Причем РНК некоторых белк-некодирующих генов состоит из нескольких экзонов. То есть, клетке эти РНК зачем-то нужны, но мы пока не понимаем, зачем. 58
 59
59
 Альтернативный сплайсинг, биологическая роль и механизмы 60
Альтернативный сплайсинг, биологическая роль и механизмы 60
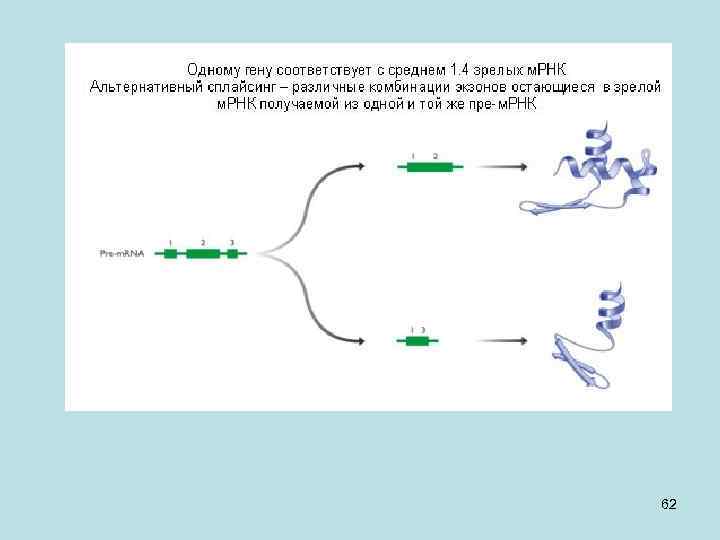
 • Предположим, образовался транскрипт зрелой м. РНК, и он может содержать экзоны 1, 2, 3. Это вовсе не означает, что он обязательно будет содержать их все. У нас может появиться РНК, которая будет содержать экзоны 1 и 2 или экзоны 1 и 3, и в результате с них будут образовываться разные белки. Такой способ процессинга (обработки) генетической информации называется альтернативный У человека есть ген slo. Он «работает» во внутреннем ухе, в частности, этот белок присутствует в ворсинках, которые отвечают за распознавание высоты звука. Он состоит из 35 экзонов (на рисунке - прямоугольники), 8 из которых (синие) могут или присутствовать, или отсутствовать в зрелой м. РНК. Возможны 8! = 40 320 вариантов сплайсинга, но только около 500 из них обнаружены. Других, может быть, и нет, то есть природа не должна, вообще говоря, реализовывать все возможные варианты. 61
• Предположим, образовался транскрипт зрелой м. РНК, и он может содержать экзоны 1, 2, 3. Это вовсе не означает, что он обязательно будет содержать их все. У нас может появиться РНК, которая будет содержать экзоны 1 и 2 или экзоны 1 и 3, и в результате с них будут образовываться разные белки. Такой способ процессинга (обработки) генетической информации называется альтернативный У человека есть ген slo. Он «работает» во внутреннем ухе, в частности, этот белок присутствует в ворсинках, которые отвечают за распознавание высоты звука. Он состоит из 35 экзонов (на рисунке - прямоугольники), 8 из которых (синие) могут или присутствовать, или отсутствовать в зрелой м. РНК. Возможны 8! = 40 320 вариантов сплайсинга, но только около 500 из них обнаружены. Других, может быть, и нет, то есть природа не должна, вообще говоря, реализовывать все возможные варианты. 61
 62
62
 • Биологическая роль множественного сплайсинга заключается в следующем. Разные типы волосяных клеток внутреннего уха реагируют на звуки разных частот от 20 до 20 000 герц. Различия клеток в восприятии частоты частично определяются свойствами альтернативных сплайс-форм белка Slo. Как определяется выбор между вариантами сплайсинга неизвестно. Известны случаи, когда с одного локуса образуются тысячи разных белков. К ним, в частности, относятся белки, которые образуются на поверхности нервных клеток. Таким образом, они, видимо, как-то участвуют в распознавании друга, и в формировании нейронных сетей. В этом случае происходит выбрасывание не только экзонов или интронов, но и может реализовываться и альтернативный участок инициации транскрипции. Такие случаи известны, в частности, для человека, когда у разных генов есть несколько разных промоторов, каждый из которых дает свою РНК, в которой, в зависимости от того, где он начался, будет дополнительный экзон, связанной с различной длиной транскрипта на 5’-конце. 63
• Биологическая роль множественного сплайсинга заключается в следующем. Разные типы волосяных клеток внутреннего уха реагируют на звуки разных частот от 20 до 20 000 герц. Различия клеток в восприятии частоты частично определяются свойствами альтернативных сплайс-форм белка Slo. Как определяется выбор между вариантами сплайсинга неизвестно. Известны случаи, когда с одного локуса образуются тысячи разных белков. К ним, в частности, относятся белки, которые образуются на поверхности нервных клеток. Таким образом, они, видимо, как-то участвуют в распознавании друга, и в формировании нейронных сетей. В этом случае происходит выбрасывание не только экзонов или интронов, но и может реализовываться и альтернативный участок инициации транскрипции. Такие случаи известны, в частности, для человека, когда у разных генов есть несколько разных промоторов, каждый из которых дает свою РНК, в которой, в зависимости от того, где он начался, будет дополнительный экзон, связанной с различной длиной транскрипта на 5’-конце. 63
 64
64
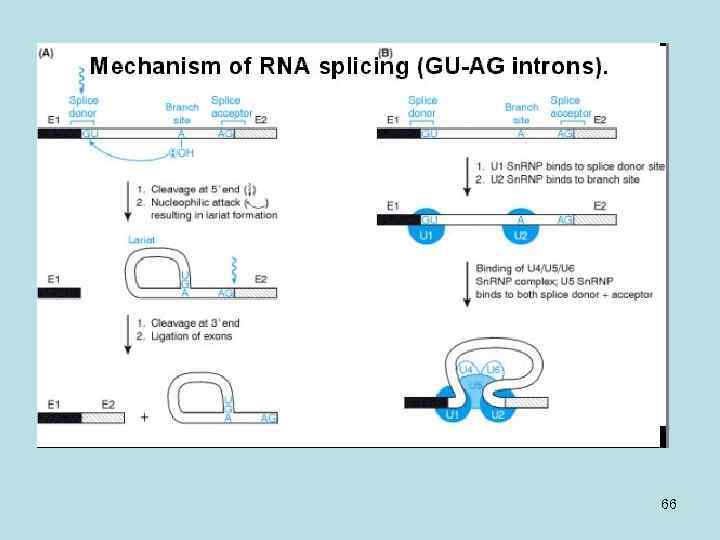
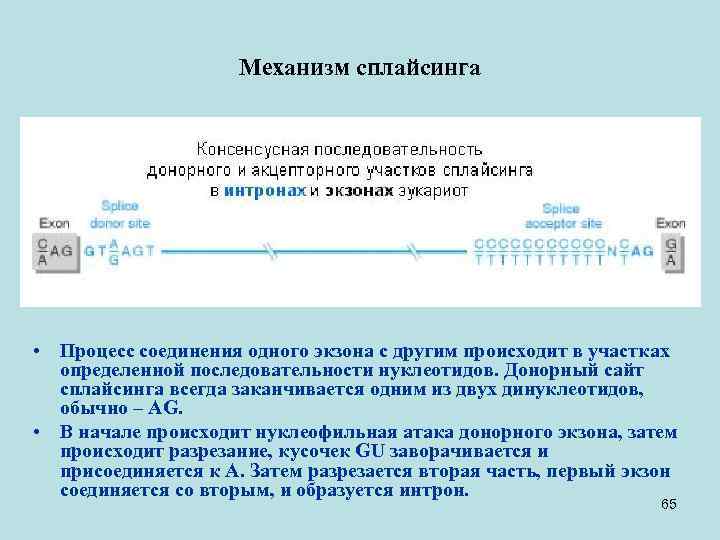 Механизм сплайсинга • Процесс соединения одного экзона с другим происходит в участках определенной последовательности нуклеотидов. Донорный сайт сплайсинга всегда заканчивается одним из двух динуклеотидов, обычно – AG. • В начале происходит нуклеофильная атака донорного экзона, затем происходит разрезание, кусочек GU заворачивается и присоединяется к А. Затем разрезается вторая часть, первый экзон соединяется со вторым, и образуется интрон. 65
Механизм сплайсинга • Процесс соединения одного экзона с другим происходит в участках определенной последовательности нуклеотидов. Донорный сайт сплайсинга всегда заканчивается одним из двух динуклеотидов, обычно – AG. • В начале происходит нуклеофильная атака донорного экзона, затем происходит разрезание, кусочек GU заворачивается и присоединяется к А. Затем разрезается вторая часть, первый экзон соединяется со вторым, и образуется интрон. 65
 66
66
 • Если посмотреть, какую долю гена составляют экзоны, то самый большой известный транскрипт (у гена миодистрофина) имеет длину около 2, 5 миллионов нуклеотидов. У него в зрелую часть РНК переходит 14 тыс нуклеотидов (0, 6%), а остальные 99, 4% от первичного транскрипта выкидывается (интроны). • С ростом размеров гена в хромосоме его белок-кодирующая часть увеличивается незначительно, а количество интронов в гене растет. С ростом числа интронов растет число сайтов сплайсинга и вероятность их повреждения. Поэтому для генов с большим числом интронов потеря функции при мутации может быть связана не с белок- кодирующей частью ДНК, а с регуляторными элементами сплайсинга. • Секвенирование генома человека показало, что некоторые экзоны многократно повторены в геноме. Это могут повторы экзонов в составе одного гена, или присутствие одного и того же экзона в составе нескольких разных генов. Получается, что экзоны, основные элементы структуры РНК, то есть белок-кодирующие элементы, в процессе эволюции могут каким-то образом размножаться в геноме и «перетасовываться» между разными генами. Такое явление получило название exon shuffling – перетасовка экзонов. Ниже показаны разные белки, в которых содержатся одинаковые экзоны. Таким образом, оказывается, что эволюция – это нередко именно блоковые изменения генома, а не точечные изменения. 67
• Если посмотреть, какую долю гена составляют экзоны, то самый большой известный транскрипт (у гена миодистрофина) имеет длину около 2, 5 миллионов нуклеотидов. У него в зрелую часть РНК переходит 14 тыс нуклеотидов (0, 6%), а остальные 99, 4% от первичного транскрипта выкидывается (интроны). • С ростом размеров гена в хромосоме его белок-кодирующая часть увеличивается незначительно, а количество интронов в гене растет. С ростом числа интронов растет число сайтов сплайсинга и вероятность их повреждения. Поэтому для генов с большим числом интронов потеря функции при мутации может быть связана не с белок- кодирующей частью ДНК, а с регуляторными элементами сплайсинга. • Секвенирование генома человека показало, что некоторые экзоны многократно повторены в геноме. Это могут повторы экзонов в составе одного гена, или присутствие одного и того же экзона в составе нескольких разных генов. Получается, что экзоны, основные элементы структуры РНК, то есть белок-кодирующие элементы, в процессе эволюции могут каким-то образом размножаться в геноме и «перетасовываться» между разными генами. Такое явление получило название exon shuffling – перетасовка экзонов. Ниже показаны разные белки, в которых содержатся одинаковые экзоны. Таким образом, оказывается, что эволюция – это нередко именно блоковые изменения генома, а не точечные изменения. 67
 68
68
 69
69
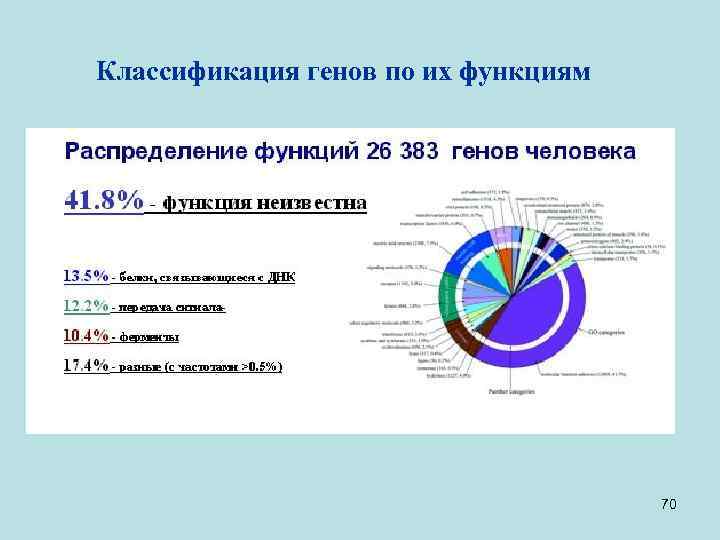 Классификация генов по их функциям 70
Классификация генов по их функциям 70
 • На 2001 год для более 40% генов человека не было никаких предположений относительно выполняемых функций. А для остальных раскладка была достаточно условной. Принадлежность белка к одному функциональному классу не исключает его принадлежности также и к другому классу. Например, то что белок связывается с ДНК, не означает, что он не может быть еще и ферментом и т. д. Это - характеристика, которая была дана гену по той его части, которая связана с охарактеризованной функцией, но, вообще говоря, такая функция у белка может быть и не одна. • Больше всего генов отвечают за экспрессию, репликацию и поддержание функций генома; около 20% - за передачу сигналов между клетками, около 17% - за то, чтобы клетка сама по себе была здорова, и для других функции не классифицированы. • Оказывается, что у человека, по сравнению с дрожжами, бактериями и т. д. , в геноме имеется больше генов регуляторов транскрипции. То есть, транскрипционные регуляторы сильно размножились в эволюционной линии млекопитающих, в частности, человека. Предполагается что разнообразие регуляторов транскрипции обеспечивает большую тонкость реакции генома на сигналы внешней среды. То есть у млекопитающих больше число ансамблей координировано транскрибируемых генов, чем в других группах. 71
• На 2001 год для более 40% генов человека не было никаких предположений относительно выполняемых функций. А для остальных раскладка была достаточно условной. Принадлежность белка к одному функциональному классу не исключает его принадлежности также и к другому классу. Например, то что белок связывается с ДНК, не означает, что он не может быть еще и ферментом и т. д. Это - характеристика, которая была дана гену по той его части, которая связана с охарактеризованной функцией, но, вообще говоря, такая функция у белка может быть и не одна. • Больше всего генов отвечают за экспрессию, репликацию и поддержание функций генома; около 20% - за передачу сигналов между клетками, около 17% - за то, чтобы клетка сама по себе была здорова, и для других функции не классифицированы. • Оказывается, что у человека, по сравнению с дрожжами, бактериями и т. д. , в геноме имеется больше генов регуляторов транскрипции. То есть, транскрипционные регуляторы сильно размножились в эволюционной линии млекопитающих, в частности, человека. Предполагается что разнообразие регуляторов транскрипции обеспечивает большую тонкость реакции генома на сигналы внешней среды. То есть у млекопитающих больше число ансамблей координировано транскрибируемых генов, чем в других группах. 71
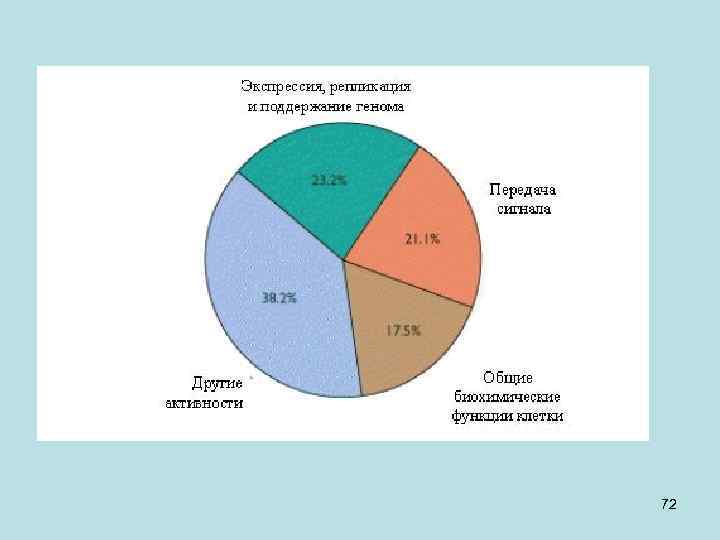 72
72
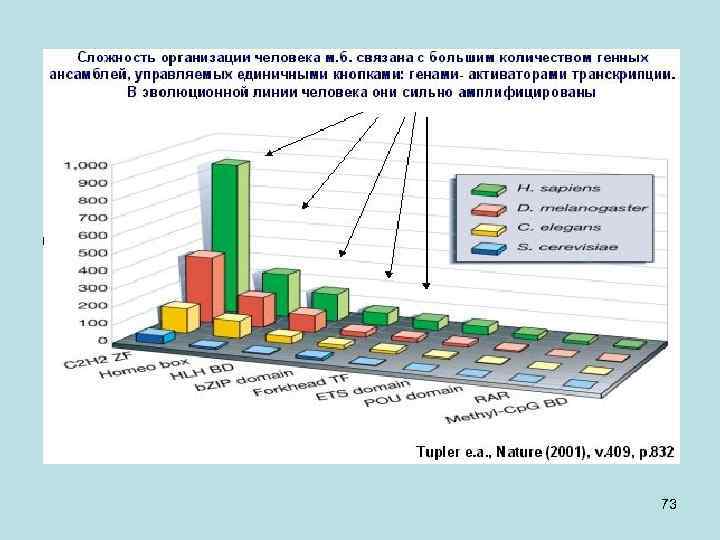 73
73
 • Ниже показано, как выглядит кусок генома человека (≈50 000 п. н. ). Около половины длины этого фрагмента ДНК занимают элементы, структура и функция которых понятна. Среди этих элементов есть гены (экзоны и интроны) и псевдогены - есть гены функциональные, а есть их нефункциональные копии. Они, обычно, не содержат интронов (считается, что после транскрипции и преобразовании зрелой РНК возможен процесс встраивания ее обратно в геном в виде ДНК-копии; тогда это будет ген, содержащий лишний «хвост» и не содержащий интронов). А также короткие (SINE) и длинные (LINE) диспергированные повторы, длинные концевые повторы (LTR) – следы, оставшиеся после транспозиции, транспозоны, микросателлиты. 74
• Ниже показано, как выглядит кусок генома человека (≈50 000 п. н. ). Около половины длины этого фрагмента ДНК занимают элементы, структура и функция которых понятна. Среди этих элементов есть гены (экзоны и интроны) и псевдогены - есть гены функциональные, а есть их нефункциональные копии. Они, обычно, не содержат интронов (считается, что после транскрипции и преобразовании зрелой РНК возможен процесс встраивания ее обратно в геном в виде ДНК-копии; тогда это будет ген, содержащий лишний «хвост» и не содержащий интронов). А также короткие (SINE) и длинные (LINE) диспергированные повторы, длинные концевые повторы (LTR) – следы, оставшиеся после транспозиции, транспозоны, микросателлиты. 74
 75
75
 • К 2001 году в геноме человека было выявлено 1112 “генов болезней” (то есть таких, мутации в которых ведут к заболеванию) и еще есть 94 “составных” гена, образующихся при опухолевых перестройках генома. Пока, в основном, раскрыты по механизму те заболевания, которые затрагивают белок-кодирующую часть гена. Возможно, не меньшее количество мутаций, вызывающих болезни, будет найдено и в участках регуляции транскрипции, сплайсинга и стабильности РНК. 76
• К 2001 году в геноме человека было выявлено 1112 “генов болезней” (то есть таких, мутации в которых ведут к заболеванию) и еще есть 94 “составных” гена, образующихся при опухолевых перестройках генома. Пока, в основном, раскрыты по механизму те заболевания, которые затрагивают белок-кодирующую часть гена. Возможно, не меньшее количество мутаций, вызывающих болезни, будет найдено и в участках регуляции транскрипции, сплайсинга и стабильности РНК. 76
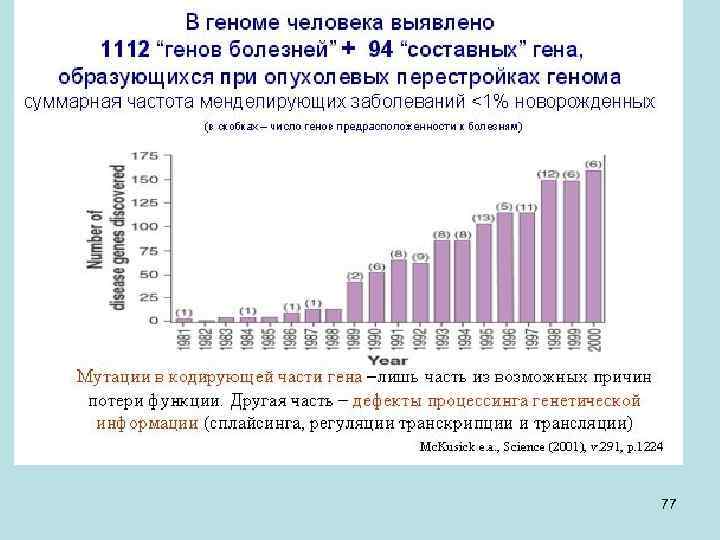 77
77
 • По представлениям на март 2005 года, у человека 24000 белоккодирующих генов, из них 1700 генов ассоциированы с заболеваниями. Обнаружено 44, 500 мутаций в этих 1700 генах (в среднем 26 на ген), связанных к заболеваниям. А для остальных 10 000 известных мутаций подобная связь не выявлена. • 20% смертей в США происходит из-за того, что прием лекарства осуществлялся либо не того, либо не так. Но это связано не с некомпетентностью врачей, а с тем, что мы все генетически разные. У болезней много мишеней и если бить не по той мишени, то лекарство точно не будет полезным, а потому может быть и вредным. У человека может быть специфическая реакция на данное лекарство (слишком низкая или слишком высокая скорость метаболизма). А в нашей стране ведущая пока причина смертей взрослого населения – пьянство. Эта первопричина просто скрыта за определением «травматизм» (производственный, бытовой, дорожный и т. д. ), который и указывают как причину смерти. Выявлена корреляция потребления алкоголя в нашей стране и продолжительности жизни: когда, снижается потребление алкоголя, продолжительность жизни идет вверх, и наоборот. 78
• По представлениям на март 2005 года, у человека 24000 белоккодирующих генов, из них 1700 генов ассоциированы с заболеваниями. Обнаружено 44, 500 мутаций в этих 1700 генах (в среднем 26 на ген), связанных к заболеваниям. А для остальных 10 000 известных мутаций подобная связь не выявлена. • 20% смертей в США происходит из-за того, что прием лекарства осуществлялся либо не того, либо не так. Но это связано не с некомпетентностью врачей, а с тем, что мы все генетически разные. У болезней много мишеней и если бить не по той мишени, то лекарство точно не будет полезным, а потому может быть и вредным. У человека может быть специфическая реакция на данное лекарство (слишком низкая или слишком высокая скорость метаболизма). А в нашей стране ведущая пока причина смертей взрослого населения – пьянство. Эта первопричина просто скрыта за определением «травматизм» (производственный, бытовой, дорожный и т. д. ), который и указывают как причину смерти. Выявлена корреляция потребления алкоголя в нашей стране и продолжительности жизни: когда, снижается потребление алкоголя, продолжительность жизни идет вверх, и наоборот. 78
 • Если два белка характеризуются сходной последовательностью аминокислотных (выше критической длины, до которой совпадения могут быть остатков чисто случайными), то у них есть общая предковая последовательность, и соответствующий предковый ген. Количество таких предковых структур у белков весьма ограничено. • К примеру, был один ген в геноме, а потом их стало два (дупликация). Со временем мутации изменили эти гены каждый по-своему. А потом этот вид дал начало двум новым видам (см. рис. ниже). Все эти гены являются «родственниками» (гомологами), но по-разному называются. Гомологичные гены, которые мы рассматриваем в составе разных видов, называются ортологи, а гомологичные гены в одном геноме называют паралоги. 79
• Если два белка характеризуются сходной последовательностью аминокислотных (выше критической длины, до которой совпадения могут быть остатков чисто случайными), то у них есть общая предковая последовательность, и соответствующий предковый ген. Количество таких предковых структур у белков весьма ограничено. • К примеру, был один ген в геноме, а потом их стало два (дупликация). Со временем мутации изменили эти гены каждый по-своему. А потом этот вид дал начало двум новым видам (см. рис. ниже). Все эти гены являются «родственниками» (гомологами), но по-разному называются. Гомологичные гены, которые мы рассматриваем в составе разных видов, называются ортологи, а гомологичные гены в одном геноме называют паралоги. 79
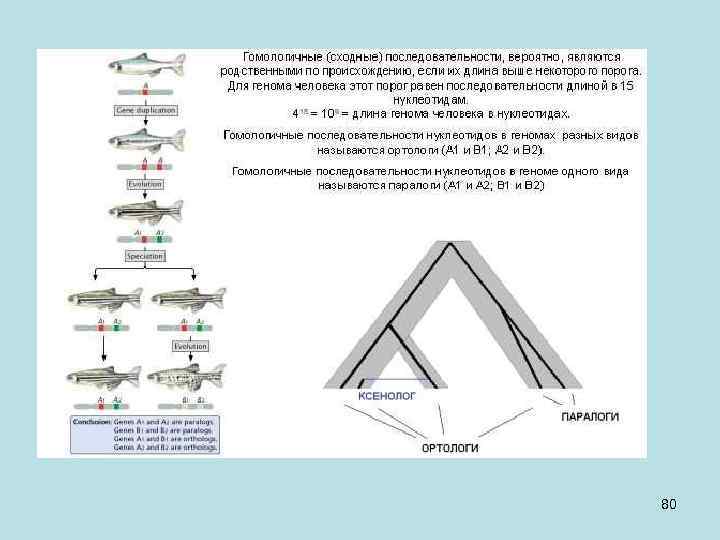 80
80
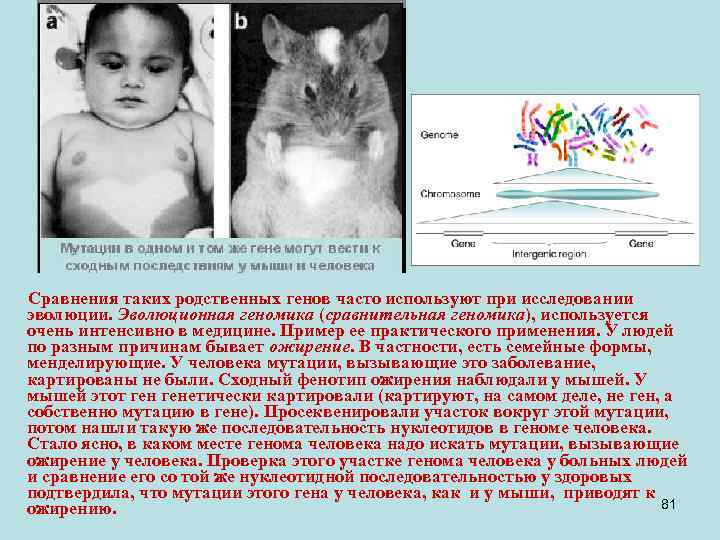 Сравнения таких родственных генов часто используют при исследовании эволюции. Эволюционная геномика (сравнительная геномика), используется очень интенсивно в медицине. Пример ее практического применения. У людей по разным причинам бывает ожирение. В частности, есть семейные формы, менделирующие. У человека мутации, вызывающие это заболевание, картированы не были. Сходный фенотип ожирения наблюдали у мышей. У мышей этот генетически картировали (картируют, на самом деле, не ген, а собственно мутацию в гене). Просеквенировали участок вокруг этой мутации, потом нашли такую же последовательность нуклеотидов в геноме человека. Стало ясно, в каком месте генома человека надо искать мутации, вызывающие ожирение у человека. Проверка этого участке генома человека у больных людей и сравнение его со той же нуклеотидной последовательностью у здоровых подтвердила, что мутации этого гена у человека, как и у мыши, приводят к 81 ожирению.
Сравнения таких родственных генов часто используют при исследовании эволюции. Эволюционная геномика (сравнительная геномика), используется очень интенсивно в медицине. Пример ее практического применения. У людей по разным причинам бывает ожирение. В частности, есть семейные формы, менделирующие. У человека мутации, вызывающие это заболевание, картированы не были. Сходный фенотип ожирения наблюдали у мышей. У мышей этот генетически картировали (картируют, на самом деле, не ген, а собственно мутацию в гене). Просеквенировали участок вокруг этой мутации, потом нашли такую же последовательность нуклеотидов в геноме человека. Стало ясно, в каком месте генома человека надо искать мутации, вызывающие ожирение у человека. Проверка этого участке генома человека у больных людей и сравнение его со той же нуклеотидной последовательностью у здоровых подтвердила, что мутации этого гена у человека, как и у мыши, приводят к 81 ожирению.
 • Данные по количеству генов, вовлеченных в развитие и функционирование некоторых органов и тканей человека 82
• Данные по количеству генов, вовлеченных в развитие и функционирование некоторых органов и тканей человека 82
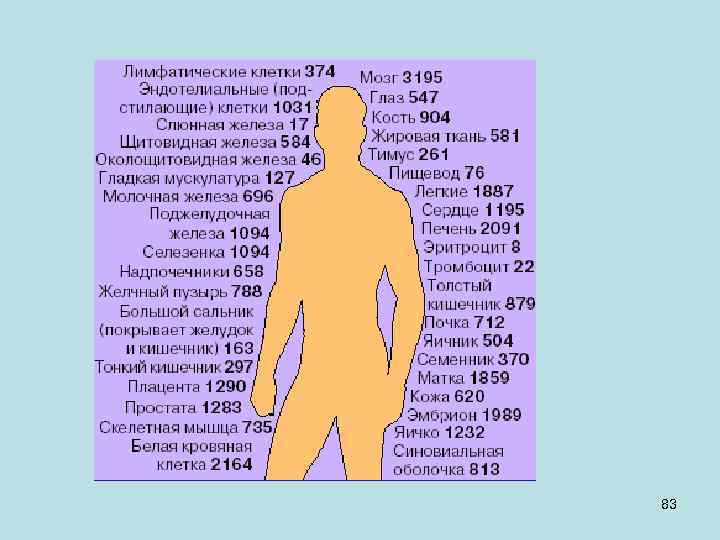 83
83
 • Схематическое изображение человеческого генома 84
• Схематическое изображение человеческого генома 84
 • Геном человека, изображенный в виде функциональной сети 85
• Геном человека, изображенный в виде функциональной сети 85
 86
86
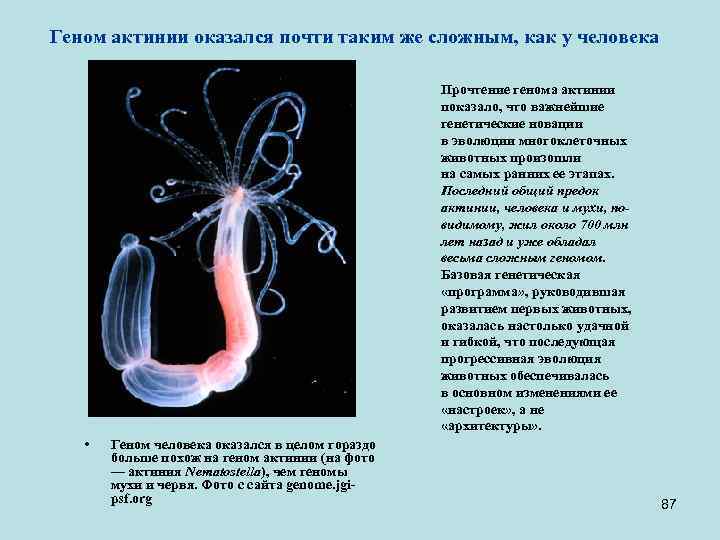 Геном актинии оказался почти таким же сложным, как у человека Прочтение генома актинии показало, что важнейшие генетические новации в эволюции многоклеточных животных произошли на самых ранних ее этапах. Последний общий предок актинии, человека и мухи, повидимому, жил около 700 млн лет назад и уже обладал весьма сложным геномом. Базовая генетическая «программа» , руководившая развитием первых животных, оказалась настолько удачной и гибкой, что последующая прогрессивная эволюция животных обеспечивалась в основном изменениями ее «настроек» , а не «архитектуры» . • Геном человека оказался в целом гораздо больше похож на геном актинии (на фото — актиния Nematostella), чем геномы мухи и червя. Фото с сайта genome. jgipsf. org 87
Геном актинии оказался почти таким же сложным, как у человека Прочтение генома актинии показало, что важнейшие генетические новации в эволюции многоклеточных животных произошли на самых ранних ее этапах. Последний общий предок актинии, человека и мухи, повидимому, жил около 700 млн лет назад и уже обладал весьма сложным геномом. Базовая генетическая «программа» , руководившая развитием первых животных, оказалась настолько удачной и гибкой, что последующая прогрессивная эволюция животных обеспечивалась в основном изменениями ее «настроек» , а не «архитектуры» . • Геном человека оказался в целом гораздо больше похож на геном актинии (на фото — актиния Nematostella), чем геномы мухи и червя. Фото с сайта genome. jgipsf. org 87
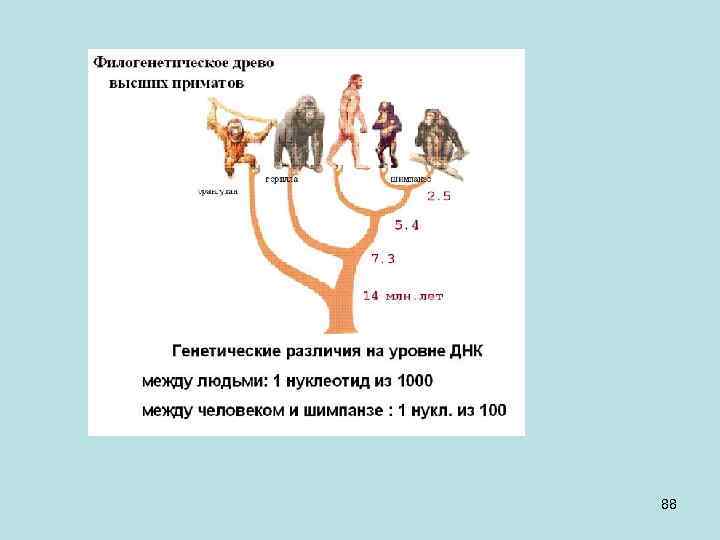 88
88
 89
89
 • Геномом называется полный состав ДНК клетки. • Геномика - это молодая интенсивно развивающаяся отрасль генетики, изучающая принципы построения геномов и их структурнофункциональную организацию. • Структурная геномика изучает нуклеотидные последовательности ДНК, в том числе строение и локализацию генов. Одной из задач структурной геномики является построение генетических карт организмов. • Функциональная геномика решает задачи идентификации функций отдельных участков генома и механизмы их взаимодействий в клеточном ансамбле. • Современные представления о геноме человека базируются на нескольких открытиях молекулярной биологии 70 -х годов ХХ века, основными из которых являются открытие полимеразной цепной реакции (ПЦР), позволяющей получать достаточное количество ДНК для анализа, и разработка методов секвенирования, которые позволяют расшифровывать точную последовательность нуклеотидов в цепях ДНК. 90
• Геномом называется полный состав ДНК клетки. • Геномика - это молодая интенсивно развивающаяся отрасль генетики, изучающая принципы построения геномов и их структурнофункциональную организацию. • Структурная геномика изучает нуклеотидные последовательности ДНК, в том числе строение и локализацию генов. Одной из задач структурной геномики является построение генетических карт организмов. • Функциональная геномика решает задачи идентификации функций отдельных участков генома и механизмы их взаимодействий в клеточном ансамбле. • Современные представления о геноме человека базируются на нескольких открытиях молекулярной биологии 70 -х годов ХХ века, основными из которых являются открытие полимеразной цепной реакции (ПЦР), позволяющей получать достаточное количество ДНК для анализа, и разработка методов секвенирования, которые позволяют расшифровывать точную последовательность нуклеотидов в цепях ДНК. 90
 • В конце 80 -х годов ХХ столетия началось осуществление международного проекта "Геном человека", основной задачей которого было секвенирование генома человека. Полное секвенирование генома человека было завершено в 2000 году. • Секвенирование генома человека привело к открытию огромного количества однонуклеотидных полиморфизмов (ОНП) - генетических вариантов последовательностей нуклеотидов одного и того же участка ДНК у разных людей. Распределенные по всему геному ОНП используются в качестве генетических маркеров. • По расчетам генетиков люди оказываются идентичными по нуклеотидным последовательностям на 99, 9%. Таким образом, генетическая вариативность людей возникает за счет различий лишь в 0, 1% генома. • Данные секвенирования показали, что в геноме человека чуть более 30000* генов. Большинство генов имеют размеры до 50000 пар нуклеотидов. Число синтезируемых белковых продуктов превышает число генов в 1, 5 -2 раза. Это является результатом альтернативного сплайсинга. 91
• В конце 80 -х годов ХХ столетия началось осуществление международного проекта "Геном человека", основной задачей которого было секвенирование генома человека. Полное секвенирование генома человека было завершено в 2000 году. • Секвенирование генома человека привело к открытию огромного количества однонуклеотидных полиморфизмов (ОНП) - генетических вариантов последовательностей нуклеотидов одного и того же участка ДНК у разных людей. Распределенные по всему геному ОНП используются в качестве генетических маркеров. • По расчетам генетиков люди оказываются идентичными по нуклеотидным последовательностям на 99, 9%. Таким образом, генетическая вариативность людей возникает за счет различий лишь в 0, 1% генома. • Данные секвенирования показали, что в геноме человека чуть более 30000* генов. Большинство генов имеют размеры до 50000 пар нуклеотидов. Число синтезируемых белковых продуктов превышает число генов в 1, 5 -2 раза. Это является результатом альтернативного сплайсинга. 91
 • В конце 80 -х годов ХХ столетия началось осуществление международного проекта "Геном человека", основной задачей которого было секвенирование генома человека. Полное секвенирование генома человека было завершено в 2000 году. 92
• В конце 80 -х годов ХХ столетия началось осуществление международного проекта "Геном человека", основной задачей которого было секвенирование генома человека. Полное секвенирование генома человека было завершено в 2000 году. 92
 Задачи и сроки проекта «Геном человека» 93
Задачи и сроки проекта «Геном человека» 93
 • Цель этого проекта заключалась в выяснении последовательности оснований во всех молекулах ДНК в клетках человека. Одновременно должна быть установлена локализация всех генов, что помогло бы выяснить причину многих наследственных заболеваний и этим открыть пути к их лечению. Что бы последовательно приближаться к решению проблемы картирование генов человека, было сформулировано пять основных целей: • • • 1) Завершить составление детальной генетической карты, на которой были бы помечены гены, отстоящие друг от друга на расстоянии не превышающем в среднем 2 млн. оснований (1 млн. оснований принято называть мегобазой); 2) составить физические карты каждой хромосомы (разрешение 0. 1 Мб); 3) получить карту всего генома в виде охарактеризованных клонов (5 тыс. оснований в клоне или 5 Кб); 4) завершить к 2004 году полное секвенирование ДНК (разрешение одного основание); 5) нанести на полностью завершенную секвенсовую карту все гены человека (к 2005 году). 94
• Цель этого проекта заключалась в выяснении последовательности оснований во всех молекулах ДНК в клетках человека. Одновременно должна быть установлена локализация всех генов, что помогло бы выяснить причину многих наследственных заболеваний и этим открыть пути к их лечению. Что бы последовательно приближаться к решению проблемы картирование генов человека, было сформулировано пять основных целей: • • • 1) Завершить составление детальной генетической карты, на которой были бы помечены гены, отстоящие друг от друга на расстоянии не превышающем в среднем 2 млн. оснований (1 млн. оснований принято называть мегобазой); 2) составить физические карты каждой хромосомы (разрешение 0. 1 Мб); 3) получить карту всего генома в виде охарактеризованных клонов (5 тыс. оснований в клоне или 5 Кб); 4) завершить к 2004 году полное секвенирование ДНК (разрешение одного основание); 5) нанести на полностью завершенную секвенсовую карту все гены человека (к 2005 году). 94
 • • • Ожидалось, что, когда все указанные цели будут постигнуты, исследователи определят все функции генов и разработают методы биологического и медицинского применения полученных данных. Рассмотрев темпы ускорения работы в рамках проекта «Геном человека» , руководители этого проекта объявили 23 октября 1998 г. , что программа будет полностью завершена гораздо раньше, чем планировалось, и сформулировали «Новые задачи проекта «Геном человека» : 1) полностью завершить в декабре 1998 года работу по секвенирование генома «Круглого червя» С. elegans (это было сделано в срок); 2) закончить предварительный анализ последовательности ДНК человека к 2001 году, а полную последовательность к 2003 году; 3) картировать к 2002 году геном плодовой мухи; 4) начать секвенирование генома мыши с использованием методов ДНК искусственных хромосом дрожжей (завершить этот проект к 2005 году). Помимо этих целей, официально включен в поддерживаемый правительством США и рядом других правительств проект, некоторые исследовательские центры объявили о задачах, которые будут решаться в основном за счет частных фондов и пожертвователей. Так, ученые калифорнийского университета (Беркли), Орегонского университета и Ракового исследовательского центра имени Фрейда Хатчинсона начали программу «Геном собаки» . Международное общество секвенирование в феврале 1996 года приняло решение о том, что любая последовательность нуклиотидов размером 1 -2 Кб должна быть обнародована (через Интернет) в течение 24 часов после ее установления. 95
• • • Ожидалось, что, когда все указанные цели будут постигнуты, исследователи определят все функции генов и разработают методы биологического и медицинского применения полученных данных. Рассмотрев темпы ускорения работы в рамках проекта «Геном человека» , руководители этого проекта объявили 23 октября 1998 г. , что программа будет полностью завершена гораздо раньше, чем планировалось, и сформулировали «Новые задачи проекта «Геном человека» : 1) полностью завершить в декабре 1998 года работу по секвенирование генома «Круглого червя» С. elegans (это было сделано в срок); 2) закончить предварительный анализ последовательности ДНК человека к 2001 году, а полную последовательность к 2003 году; 3) картировать к 2002 году геном плодовой мухи; 4) начать секвенирование генома мыши с использованием методов ДНК искусственных хромосом дрожжей (завершить этот проект к 2005 году). Помимо этих целей, официально включен в поддерживаемый правительством США и рядом других правительств проект, некоторые исследовательские центры объявили о задачах, которые будут решаться в основном за счет частных фондов и пожертвователей. Так, ученые калифорнийского университета (Беркли), Орегонского университета и Ракового исследовательского центра имени Фрейда Хатчинсона начали программу «Геном собаки» . Международное общество секвенирование в феврале 1996 года приняло решение о том, что любая последовательность нуклиотидов размером 1 -2 Кб должна быть обнародована (через Интернет) в течение 24 часов после ее установления. 95
 • • ЧТО БУДЕТ СДЕЛАННО ПОСЛЕ ЗАВЕРШЕНИЯ АНАЛИЗА ГЕНОМА ЧЕЛОВЕКА? Главная стратегическая задача будущего сформулирована следующим образом: изучить однонуклеотидные вариации ДНК в разных органах и клетках отдельных индивидуумов и выявить различия между индивидуумами. Анализ таких вариаций даст возможность не только подойти к созданию индивидуальных генных портретов людей, что в частности даст возможность лечить болезни, но и определить различия между популяциями. А также выявлять географические районы повышенного риска, что поможет давать чёткие рекомендации о необходимости очистке территории от загрязнения и выявить производства, на которых есть большая опасность поражение геномов персонала. Эта грандиозная задача рождает не одни радужные ожидания всеобщего блага, но и вполне осознанную тревогу юристов и борцов за индивидуальные права человека. Так, в частности, высказываются возражения против распространения персональной информации без решения тех, кого она касается. Один пример помогает понять эти тревоги: уже сейчас страховые компании нацелились на добывание таких сведений правдами и неправдами, они намериваются использовать данные против тех, кого они страхуют. Например, если подающий на страховку несёт потенциально болезнетворный ген, компании не хотят страховать таких людей вовсе или же пытаются заломить бешенные суммы за их страховки. Исходя из этого, . конгресс США уже принял ряд законов, направленный на строгий запрет распространения генетической информации относительно отдельных людей, юристы всего мира 96 интенсивно работают в данном направлении.
• • ЧТО БУДЕТ СДЕЛАННО ПОСЛЕ ЗАВЕРШЕНИЯ АНАЛИЗА ГЕНОМА ЧЕЛОВЕКА? Главная стратегическая задача будущего сформулирована следующим образом: изучить однонуклеотидные вариации ДНК в разных органах и клетках отдельных индивидуумов и выявить различия между индивидуумами. Анализ таких вариаций даст возможность не только подойти к созданию индивидуальных генных портретов людей, что в частности даст возможность лечить болезни, но и определить различия между популяциями. А также выявлять географические районы повышенного риска, что поможет давать чёткие рекомендации о необходимости очистке территории от загрязнения и выявить производства, на которых есть большая опасность поражение геномов персонала. Эта грандиозная задача рождает не одни радужные ожидания всеобщего блага, но и вполне осознанную тревогу юристов и борцов за индивидуальные права человека. Так, в частности, высказываются возражения против распространения персональной информации без решения тех, кого она касается. Один пример помогает понять эти тревоги: уже сейчас страховые компании нацелились на добывание таких сведений правдами и неправдами, они намериваются использовать данные против тех, кого они страхуют. Например, если подающий на страховку несёт потенциально болезнетворный ген, компании не хотят страховать таких людей вовсе или же пытаются заломить бешенные суммы за их страховки. Исходя из этого, . конгресс США уже принял ряд законов, направленный на строгий запрет распространения генетической информации относительно отдельных людей, юристы всего мира 96 интенсивно работают в данном направлении.
 • Области практического применения генной инженерии • Создание трансгенных растений • Еще 10 лет тому назад биотехнология растений заметно отставала в своем развитии, но за последние 3 года наблюдается быстрый выброс на рынок трансгенных растений с новыми полезными признаками. Трансгенные растения в США в 1996 году занимали площадь 3 млн. акров, в 1997 году площадь увеличилась до 15 млн. акров, в 1998 году – до 60 млн. акров, а в прошлом году до 80 млн. акров. Поскольку основные трансгенные формы кукурузы, сои, хлопчатника с устойчивостью к гербицидам и насекомым хорошо себя зарекомендовали, есть все основания ожидать, что площадь под генноиженерные растения в 2001 году увеличатся в 4 -5 раз. В апреле 1998 года доля в процентах трансгенных форм растений в сельском хозяйстве составило: кукуруза – 6, соя – 12, хлопчатник – 15, томаты – <1. Так как число жителей за последнее столетие увеличилось с 1. 5 до 5. 5 млрд. человек, а к 2020 году предполагается вырост до 8 млрд. , таким образом возникает огромная проблема, стоящая перед человечеством. Эта проблема заключается в огромном увеличение производства продуктов питания, несмотря на то, что за последние 40 лет производство увеличилось в 2. 5 раза, все равно этого не достаточно. И в мире в связи с этим наблюдается социальный застой, который становится все более настоятельным. 97
• Области практического применения генной инженерии • Создание трансгенных растений • Еще 10 лет тому назад биотехнология растений заметно отставала в своем развитии, но за последние 3 года наблюдается быстрый выброс на рынок трансгенных растений с новыми полезными признаками. Трансгенные растения в США в 1996 году занимали площадь 3 млн. акров, в 1997 году площадь увеличилась до 15 млн. акров, в 1998 году – до 60 млн. акров, а в прошлом году до 80 млн. акров. Поскольку основные трансгенные формы кукурузы, сои, хлопчатника с устойчивостью к гербицидам и насекомым хорошо себя зарекомендовали, есть все основания ожидать, что площадь под генноиженерные растения в 2001 году увеличатся в 4 -5 раз. В апреле 1998 года доля в процентах трансгенных форм растений в сельском хозяйстве составило: кукуруза – 6, соя – 12, хлопчатник – 15, томаты – <1. Так как число жителей за последнее столетие увеличилось с 1. 5 до 5. 5 млрд. человек, а к 2020 году предполагается вырост до 8 млрд. , таким образом возникает огромная проблема, стоящая перед человечеством. Эта проблема заключается в огромном увеличение производства продуктов питания, несмотря на то, что за последние 40 лет производство увеличилось в 2. 5 раза, все равно этого не достаточно. И в мире в связи с этим наблюдается социальный застой, который становится все более настоятельным. 97
 • Другая проблема возникла с медицинским лечением. Несмотря на огромные достижение современной медицины, производимые сегодня лекарственные препараты столь дороги, что ¾ населения земли сейчас полностью полагаются на традиционные донаучные методы лечения, прежде всего на неочищенные препараты растительного происхождения. В развитых странах лекарственные средства на 25% состоят из природных веществ, выделенных из растений. Открытия последних лет (противоопухолевые препараты: таксол, подофиллотоксин) свидетельствуют о том, что растения еще долго будут оставаться источником полезных биологически-активных веществ (БТА), и что способности растительной клетки к синтезу сложных БТА все еще значительно превосходят синтетические способности инженера-химика. Вот почему ученые взялись за проблему создания трансгенных растений. Отсчёт истории генетической инженерии растений принято вести с 1982 года, когда впервые были получены генетически трансформированные растения. Метод трансформации основывается на природной способности бактерий Agrobacterium tumefaciens генетически модифицировать растения. Реконструированные штаммы Agrobactrium, содержащие неонкогенные варианты Ti-плазмид и обладающие повышенной вирулентностью, стали основой одного из наболее популярных методов трансформации. 98
• Другая проблема возникла с медицинским лечением. Несмотря на огромные достижение современной медицины, производимые сегодня лекарственные препараты столь дороги, что ¾ населения земли сейчас полностью полагаются на традиционные донаучные методы лечения, прежде всего на неочищенные препараты растительного происхождения. В развитых странах лекарственные средства на 25% состоят из природных веществ, выделенных из растений. Открытия последних лет (противоопухолевые препараты: таксол, подофиллотоксин) свидетельствуют о том, что растения еще долго будут оставаться источником полезных биологически-активных веществ (БТА), и что способности растительной клетки к синтезу сложных БТА все еще значительно превосходят синтетические способности инженера-химика. Вот почему ученые взялись за проблему создания трансгенных растений. Отсчёт истории генетической инженерии растений принято вести с 1982 года, когда впервые были получены генетически трансформированные растения. Метод трансформации основывается на природной способности бактерий Agrobacterium tumefaciens генетически модифицировать растения. Реконструированные штаммы Agrobactrium, содержащие неонкогенные варианты Ti-плазмид и обладающие повышенной вирулентностью, стали основой одного из наболее популярных методов трансформации. 98
 • Первоначально трансформация применялась для генно-инженерных двудольных растений, однако работы последних лет свидетельствуют, что этот метод эффективен и в отношении кукурузы, риса, пшеницы. Другим широко распространённым методом трансформации, является технология, основанная на обстреле ткани микрочастицами золота (или других тяжелых металлов), покрытыми раствором ДНК. Все выращиваемые ныне коммерческие сорта получены с помощью названных выше двух методов. Современный арсенал методов трансформации, однако, довольно обширен и включает такие подходы, как введение ДНК в голые клетки (протопласты), электропорация клеток, микроинъекций ДНК в клетки, прокалывание клеток путём встряхивания их в суспензии микроигл, опосредованная вирусами инфекции и так далее. Генетические изменённые растения с устойчивостью к различным классам гербицидов в настоящее время являются наиболее успешным биотехнологическим продуктом. Дело в том, что биотехнология позволила совершить такой прыжок, так как оказалось возможным генетически изменять устойчивость растений к тем или иным гербицидам либо путем введения генов, кодирующих белки, нечувствительные к данному классу гербицидов, либо за счет введения генов, обеспечивающих ускоренный метаболизм гербицидов растений. 99
• Первоначально трансформация применялась для генно-инженерных двудольных растений, однако работы последних лет свидетельствуют, что этот метод эффективен и в отношении кукурузы, риса, пшеницы. Другим широко распространённым методом трансформации, является технология, основанная на обстреле ткани микрочастицами золота (или других тяжелых металлов), покрытыми раствором ДНК. Все выращиваемые ныне коммерческие сорта получены с помощью названных выше двух методов. Современный арсенал методов трансформации, однако, довольно обширен и включает такие подходы, как введение ДНК в голые клетки (протопласты), электропорация клеток, микроинъекций ДНК в клетки, прокалывание клеток путём встряхивания их в суспензии микроигл, опосредованная вирусами инфекции и так далее. Генетические изменённые растения с устойчивостью к различным классам гербицидов в настоящее время являются наиболее успешным биотехнологическим продуктом. Дело в том, что биотехнология позволила совершить такой прыжок, так как оказалось возможным генетически изменять устойчивость растений к тем или иным гербицидам либо путем введения генов, кодирующих белки, нечувствительные к данному классу гербицидов, либо за счет введения генов, обеспечивающих ускоренный метаболизм гербицидов растений. 99
 • К настоящему времени клонированы гены, кодирующие нечувствительные к действию гербицидов ферменты-мишени, что дало возможность получать трансгенные растения, устойчивые к таким гербицидам, как глифостат и хлорсульфуроновым, и имидазолиноновым гербицидом. Изолированы также гены, которые кодируют ферменты деградации некоторых гербицидов, что позволило получить трансгенные растения устойчивые к фосфинотрицину и далапону. В 1997 году устойчивая к Roundup соя, распространяемая компанией "As Grow", была признана в США сельскохозяйственным продуктом года. Ученые пошли далее. Так как множество растений подвержены нападению и поеданию со стороны насекомых, то ученые генной инженерии провели эксперимент с давно известной бактерией Bacillus-Thiringiensis, которая продуцирует белок, оказалось она является очень токсичной для многих видов насекомых, но в то же время безопасна для млекопитающих. , белок (дельта-эндотаксин, CRY- белок) продуцируется различными штамами Bacillus-Thiringiensis. Это прототаксин который расщепляется в кишечнике насекомых, образуя активированный токсин. Активизированный белок специфично связывается с рецепторами средней кишки насекомых, что приводит к образованию пор и лизису клеток кишечного эпителия. 100
• К настоящему времени клонированы гены, кодирующие нечувствительные к действию гербицидов ферменты-мишени, что дало возможность получать трансгенные растения, устойчивые к таким гербицидам, как глифостат и хлорсульфуроновым, и имидазолиноновым гербицидом. Изолированы также гены, которые кодируют ферменты деградации некоторых гербицидов, что позволило получить трансгенные растения устойчивые к фосфинотрицину и далапону. В 1997 году устойчивая к Roundup соя, распространяемая компанией "As Grow", была признана в США сельскохозяйственным продуктом года. Ученые пошли далее. Так как множество растений подвержены нападению и поеданию со стороны насекомых, то ученые генной инженерии провели эксперимент с давно известной бактерией Bacillus-Thiringiensis, которая продуцирует белок, оказалось она является очень токсичной для многих видов насекомых, но в то же время безопасна для млекопитающих. , белок (дельта-эндотаксин, CRY- белок) продуцируется различными штамами Bacillus-Thiringiensis. Это прототаксин который расщепляется в кишечнике насекомых, образуя активированный токсин. Активизированный белок специфично связывается с рецепторами средней кишки насекомых, что приводит к образованию пор и лизису клеток кишечного эпителия. 100
 • Взаимодействие токсинов с рецепторами строго специфично, что усложняет подбор комбинации токсин-насекомое. В природе найдено большое количество штаммов Bacillus-Thiringiensis, чьи токсины действуют только на определенные виды насекомых. Препараты Bacillus- Thiringiensis в течение десятилетий использовались для контроля насекомых на полях. Встраивание гена этого белка в геном растений дает возможность получить трансгенные растения, не поедаемые насекомые. Но этот метод потребовал большой работы со стороны генной инженерии, в плане подборов необходимых штаммов и созданию генноинженерных конструкций, которые дают наибольший эффект для конкретных классов насекомых. Кроме видоспецифичности по действию на насекомых встраивание прокариотических генов дельта-токсинов в геном растений даже под контролем сильных эукариотических промоторов не привело к высокому уровню экспрессии. Предположительно такое явление возникло в связи с тем, что эти бактериальные гены содержат значительно больше адениновых и тиминовых нуклеатидных оснований, чем растительная ДНК. Эта проблема была решена путем создания модефицированных генов, где один из природного гена вырезали и добавили те или иные фрагменты с сохранением доменов, кодирующих активные части дельта-токсинов. Так, например, с помощью таких подходов был получен картофель, устойчивый к колорадскому жуку. В настоящее время так называемый Bt – растения хлопка и кукурузы занимают основную долю в общем объеме генетически модифицированных растений этих культур, которые выращивают на полях США. 101
• Взаимодействие токсинов с рецепторами строго специфично, что усложняет подбор комбинации токсин-насекомое. В природе найдено большое количество штаммов Bacillus-Thiringiensis, чьи токсины действуют только на определенные виды насекомых. Препараты Bacillus- Thiringiensis в течение десятилетий использовались для контроля насекомых на полях. Встраивание гена этого белка в геном растений дает возможность получить трансгенные растения, не поедаемые насекомые. Но этот метод потребовал большой работы со стороны генной инженерии, в плане подборов необходимых штаммов и созданию генноинженерных конструкций, которые дают наибольший эффект для конкретных классов насекомых. Кроме видоспецифичности по действию на насекомых встраивание прокариотических генов дельта-токсинов в геном растений даже под контролем сильных эукариотических промоторов не привело к высокому уровню экспрессии. Предположительно такое явление возникло в связи с тем, что эти бактериальные гены содержат значительно больше адениновых и тиминовых нуклеатидных оснований, чем растительная ДНК. Эта проблема была решена путем создания модефицированных генов, где один из природного гена вырезали и добавили те или иные фрагменты с сохранением доменов, кодирующих активные части дельта-токсинов. Так, например, с помощью таких подходов был получен картофель, устойчивый к колорадскому жуку. В настоящее время так называемый Bt – растения хлопка и кукурузы занимают основную долю в общем объеме генетически модифицированных растений этих культур, которые выращивают на полях США. 101
 • Перспективы • Ожидается что детальное знание человеческого генома откроет новые пути к успехам в медицине и биотехнологии. Несколько компаний, например Myriad Genetics, начали предлагать простые способы проведения генетических тестов, которые могут показать предрасположенность к различным заболеваниям, включая рак груди, нарушение свертываемости крови, кистозный фибриоз, заболевания печени и многим другим. Также ожидается, что информация о геноме человека поможет поиску причин возникновения рака, болезни Альцгеймера и другим областям клинического значения и, вероятно, в будущем может привести к значительным успехам в их лечении. • Также, например, исследователь, изучающий определённую форму рака может сузить свой поиск до одного гена. Посетив базу данных человеческого генома в сети, этот исследователь может проверить что другие учёные написали об этом гене включая (потенциально) трёхменую структуру его производного белка, его функции, его эволюционную связь с другими человеческими генами или с генами в мышах или дрожжах или дрозофиле, возможные пагубные мутации, взаимосвязь с другими генами, тканями тела в которых ген активируется, заболеваниями, связанными с этим геном или другие данные. • Более того, глубокое понимание процесса заболевания на уровне молекулярной биологии может предложить новые терапевтические процедуры. Учитывая установленную огромную роль ДНК в молекулярной биологии и её центральную роль в определении фундаментальных принципов работы клеточных процессов, вероятно, что расширение знаний в данной области будет способствовать успехам медицины в различных областях клинического значения, которые без них были бы невозможны. 102
• Перспективы • Ожидается что детальное знание человеческого генома откроет новые пути к успехам в медицине и биотехнологии. Несколько компаний, например Myriad Genetics, начали предлагать простые способы проведения генетических тестов, которые могут показать предрасположенность к различным заболеваниям, включая рак груди, нарушение свертываемости крови, кистозный фибриоз, заболевания печени и многим другим. Также ожидается, что информация о геноме человека поможет поиску причин возникновения рака, болезни Альцгеймера и другим областям клинического значения и, вероятно, в будущем может привести к значительным успехам в их лечении. • Также, например, исследователь, изучающий определённую форму рака может сузить свой поиск до одного гена. Посетив базу данных человеческого генома в сети, этот исследователь может проверить что другие учёные написали об этом гене включая (потенциально) трёхменую структуру его производного белка, его функции, его эволюционную связь с другими человеческими генами или с генами в мышах или дрожжах или дрозофиле, возможные пагубные мутации, взаимосвязь с другими генами, тканями тела в которых ген активируется, заболеваниями, связанными с этим геном или другие данные. • Более того, глубокое понимание процесса заболевания на уровне молекулярной биологии может предложить новые терапевтические процедуры. Учитывая установленную огромную роль ДНК в молекулярной биологии и её центральную роль в определении фундаментальных принципов работы клеточных процессов, вероятно, что расширение знаний в данной области будет способствовать успехам медицины в различных областях клинического значения, которые без них были бы невозможны. 102
 • Анализ сходства в последовательностях ДНК различных организмов также открывает новые пути в исследовании теории эволюции. Во многих случаях вопросы эволюции теперь можно ставить в терминах молекулярной биологии. И в самом деле, многие важнейшие вехи в истории эволюции (появление рибосомы и органелл, развитие эмбриона, иммунной системы позвоночных) можно проследить на молекулярном уровне. Ожидается что этот проект прольёт свет на многие вопросы о сходстве и различиях между людьми и нашими ближайшими сородичами (приматами, а на деле и всеми млекопитающими). • Проект определения разнообразия человеческого генома (HGDP), отдельное исследование, нацеленное на картирование участков ДНК, которые различаются между этническими группами, который был, по слухам, приостановлен, но на самом деле продолжает работу и в настоящее время накапливает новые результаты. В будущем HGDP, вероятно, сможет получить новые данные в области контроля заболеваний, развития человека и антропологии. HGDP может открыть секреты уязвимости этнических групп к отдельным заболеваниям и подсказать новые стратегии для их преодоления. Он может также показать, как человеческие популяции адаптировались к этим заболеваниям. 103
• Анализ сходства в последовательностях ДНК различных организмов также открывает новые пути в исследовании теории эволюции. Во многих случаях вопросы эволюции теперь можно ставить в терминах молекулярной биологии. И в самом деле, многие важнейшие вехи в истории эволюции (появление рибосомы и органелл, развитие эмбриона, иммунной системы позвоночных) можно проследить на молекулярном уровне. Ожидается что этот проект прольёт свет на многие вопросы о сходстве и различиях между людьми и нашими ближайшими сородичами (приматами, а на деле и всеми млекопитающими). • Проект определения разнообразия человеческого генома (HGDP), отдельное исследование, нацеленное на картирование участков ДНК, которые различаются между этническими группами, который был, по слухам, приостановлен, но на самом деле продолжает работу и в настоящее время накапливает новые результаты. В будущем HGDP, вероятно, сможет получить новые данные в области контроля заболеваний, развития человека и антропологии. HGDP может открыть секреты уязвимости этнических групп к отдельным заболеваниям и подсказать новые стратегии для их преодоления. Он может также показать, как человеческие популяции адаптировались к этим заболеваниям. 103
 Понят ли геном человека? 104
Понят ли геном человека? 104
 • Ученым удалось "прочитать" последовательность нуклеотидов. А вот на расшифровку наследственного аппарата человека уйдут еще многие годы - около половины генов Homo Sapiens до сих пор остаются не раскрытыми. • Установление последовательности генов - это первый шаг в понимании генома человека. Ведь представления о функциях установленных генов всего лишь демонстрируют порядок, в котором следуют нуклеотиды в цепочке ДНК. Таким образом, первое глубокое изучение генома человека прояснило гораздо меньше загадок, чем ожидалось. Впрочем, впоследствии это позволило ученым сделать несколько громких открытий: • Значительный процент наших генов был сформирован человеческой цивилизацией. Американские ученые выяснили, что около 1800 генов (примерно 7% человеческого генома) изменились в результате естественного отбора за последние 50 тыс. лет, т. е. в процессе развития человеческой цивилизации. Примерно в той же пропорции изменились и геномы кукурузы, после того как люди ее окультурили. Главным образом изменения произошли в генах, отвечающих за белковый обмен и сопротивляемость различным заболеваниям. По мнению ученых, эти изменения можно объяснить развитием сельского хозяйства, ростом городов и увеличением плотности населения. Мутация генов, ответственных за деятельность мозга, ученые связывают с развитием культуры. 105
• Ученым удалось "прочитать" последовательность нуклеотидов. А вот на расшифровку наследственного аппарата человека уйдут еще многие годы - около половины генов Homo Sapiens до сих пор остаются не раскрытыми. • Установление последовательности генов - это первый шаг в понимании генома человека. Ведь представления о функциях установленных генов всего лишь демонстрируют порядок, в котором следуют нуклеотиды в цепочке ДНК. Таким образом, первое глубокое изучение генома человека прояснило гораздо меньше загадок, чем ожидалось. Впрочем, впоследствии это позволило ученым сделать несколько громких открытий: • Значительный процент наших генов был сформирован человеческой цивилизацией. Американские ученые выяснили, что около 1800 генов (примерно 7% человеческого генома) изменились в результате естественного отбора за последние 50 тыс. лет, т. е. в процессе развития человеческой цивилизации. Примерно в той же пропорции изменились и геномы кукурузы, после того как люди ее окультурили. Главным образом изменения произошли в генах, отвечающих за белковый обмен и сопротивляемость различным заболеваниям. По мнению ученых, эти изменения можно объяснить развитием сельского хозяйства, ростом городов и увеличением плотности населения. Мутация генов, ответственных за деятельность мозга, ученые связывают с развитием культуры. 105
 • Люди, проживающие даже в разных уголках земли, отличаются друг от друга только на 0, 1%. Тем не менее, это маленькое расхождение в ДНК обеспечивает достаточно признаков, чтобы определить географических предков индивидуума. А вот гены шимпанзе и человека, чье родство ранее считалось самым близким, совпадают только на 95%. • Человек стал человеком 3 миллиона лет назад. Именно тогда предки Homo Sapiens начали ходить вертикально после того, как "отключился" один из генов. Данный ген - Neu 5 Gc - контролирует выработку в организме сиаловой кислоты (один из сахаров). Исследователи предполагают, что мутация произошла где-то в промежутке между появлением общего предка человека и шимпанзе и возникновением уже непосредственных предшественников Homo Sapiens. В организмах животных все клетки покрыты оболочкой из сахаров. У человека этого нет. Специалисты предполагают, что это как-то связано с развитием мозга: на отрезке эволюции, когда предки современного человека отделились от предков шимпанзе, размеры головного мозга у них были примерно одинаковы. 106
• Люди, проживающие даже в разных уголках земли, отличаются друг от друга только на 0, 1%. Тем не менее, это маленькое расхождение в ДНК обеспечивает достаточно признаков, чтобы определить географических предков индивидуума. А вот гены шимпанзе и человека, чье родство ранее считалось самым близким, совпадают только на 95%. • Человек стал человеком 3 миллиона лет назад. Именно тогда предки Homo Sapiens начали ходить вертикально после того, как "отключился" один из генов. Данный ген - Neu 5 Gc - контролирует выработку в организме сиаловой кислоты (один из сахаров). Исследователи предполагают, что мутация произошла где-то в промежутке между появлением общего предка человека и шимпанзе и возникновением уже непосредственных предшественников Homo Sapiens. В организмах животных все клетки покрыты оболочкой из сахаров. У человека этого нет. Специалисты предполагают, что это как-то связано с развитием мозга: на отрезке эволюции, когда предки современного человека отделились от предков шимпанзе, размеры головного мозга у них были примерно одинаковы. 106
 • Научившись различать цвета, предки человека перестали выбирать партнеров по запаху. Развитие цветового зрения привело к тому, что приматы, обитавшие в восточном полушарии, и появившиеся затем вследствие их развития люди утратили способность распознавать феромоны. Это произошло около 23 млн. лет назад, незадолго до того, как надсемейство человекообразных обезьян, от которых со временем произошли люди, распалось на несколько обособленных групп. Когда и самцы обезьян, обитающих в восточном полушарии, около 23 млн. лет назад приобрели второй ген цветового зрения, автоматически возник новый способ полового отбора. Теперь для сигнализации зрелости и способности самок к воспроизводству стали использоваться не феромоны, а вторичные половые признаки, такие, как яркие цветные участки на коже и др. • Особенности фигуры заложены генетически. Генетическая программа организма определяет фигуру и ответственна за вес. На эту закономерность натолкнулись ученые, когда они начали исследовать жировую ткань мышей на наличие склонности к излишнему весу. Было выделено по крайней мере 12 генов, влияющих на различные места накопления жира. Еще три гена играют, по всей видимости, решающую роль в наличие склонности к излишнему весу. Вклад генов в распределение жировых масс оценивается как 50 -60 -процентный. 107
• Научившись различать цвета, предки человека перестали выбирать партнеров по запаху. Развитие цветового зрения привело к тому, что приматы, обитавшие в восточном полушарии, и появившиеся затем вследствие их развития люди утратили способность распознавать феромоны. Это произошло около 23 млн. лет назад, незадолго до того, как надсемейство человекообразных обезьян, от которых со временем произошли люди, распалось на несколько обособленных групп. Когда и самцы обезьян, обитающих в восточном полушарии, около 23 млн. лет назад приобрели второй ген цветового зрения, автоматически возник новый способ полового отбора. Теперь для сигнализации зрелости и способности самок к воспроизводству стали использоваться не феромоны, а вторичные половые признаки, такие, как яркие цветные участки на коже и др. • Особенности фигуры заложены генетически. Генетическая программа организма определяет фигуру и ответственна за вес. На эту закономерность натолкнулись ученые, когда они начали исследовать жировую ткань мышей на наличие склонности к излишнему весу. Было выделено по крайней мере 12 генов, влияющих на различные места накопления жира. Еще три гена играют, по всей видимости, решающую роль в наличие склонности к излишнему весу. Вклад генов в распределение жировых масс оценивается как 50 -60 -процентный. 107
 • Существует ген, отвечающий за пристрастие к никотину. Две группы ученых провели исследования различных форм гена CYP 2 A 6 - фермента, который содержится главным образом в печени и регулирует никотиновый метаболизм в теле человека. Ранее проведенные исследования показали, что у людей, у которых этот ген не работает, меньше риск получить никотиновую зависимость. Эксперты считают, что у таких людей никотин в течение более долгого времени выводится из организма, поэтому желание выкурить следующую сигарету появляется через более длительный промежуток времени. • Алкогольная зависимость также определяется генами. Американские ученые обнаружили ген, который является связующим звеном между алкоголизмом и чувством страха. Опыты доказали, что отсутствие копии определенного гена вызывает у мышей чувство страха и неудержимое влечение к алкоголю. Ученые предполагают, что мыши пытались подавить свой страх при помощи алкоголя, так как частое потребление спирта делало их смелее. Подобная мотивация, возможно, приводит к хроническому алкоголизму и у людей. 108
• Существует ген, отвечающий за пристрастие к никотину. Две группы ученых провели исследования различных форм гена CYP 2 A 6 - фермента, который содержится главным образом в печени и регулирует никотиновый метаболизм в теле человека. Ранее проведенные исследования показали, что у людей, у которых этот ген не работает, меньше риск получить никотиновую зависимость. Эксперты считают, что у таких людей никотин в течение более долгого времени выводится из организма, поэтому желание выкурить следующую сигарету появляется через более длительный промежуток времени. • Алкогольная зависимость также определяется генами. Американские ученые обнаружили ген, который является связующим звеном между алкоголизмом и чувством страха. Опыты доказали, что отсутствие копии определенного гена вызывает у мышей чувство страха и неудержимое влечение к алкоголю. Ученые предполагают, что мыши пытались подавить свой страх при помощи алкоголя, так как частое потребление спирта делало их смелее. Подобная мотивация, возможно, приводит к хроническому алкоголизму и у людей. 108
 109
109


