Лекция 5. Генные Мутации и болезни.ppt
- Количество слайдов: 51

ГЕННЫЕ МУТАЦИИ И БОЛЕЗНИ Основные вопросы 1. Общие положения 2. Генные мутации 2. 1. Замены пар оснований 2. 2. Мутации сдвига рамки считывания 3. Индуцированный мутагенез 3. 1. Мутагенное действие ионизирующих излучений 4. Репарация ДНК 5. Некоторые генные болезни 1

1. Общие положения Наследственная передача признаков от родителей потомкам – процесс консервативный, но эта консервативность не абсолютна. Иногда происходят ошибки, в результате которых количество ДНК или последовательность оснований в генах дочерних клеток становятся иными. Эти изменения наследственного материала называются мутациями. • В общей генетике различают мутации: генные, хромосомные, геномные, цитоплазматические. В генетике человека хромосомные и геномные мутации объединены в одну группу. • Как правило, все возникающие новые мутации вредны. Соответствующие мутациям нарушения фенотипа разделяют на следующие категории: • 1. Генные болезни (обусловлены мутациями одного гена); • 2. Хромосомные болезни; • 3. Мультифакториальные заболевания (болезни, обусловленные одновременным действием нескольких разных генов). 2

1. Генные мутации • Наследственная информация передаётся в ряду поколений благодаря процессам репликации, рекомбинации и репарации ДНК. При протекании этих процессов случаются ошибки, которые приводят к возникновению генных мутаций. Поэтому существует выражение: генные мутации происходят в результате ошибок трёх Р – репликации, репарации, рекомбинации. • Ошибки репликации и рекомбинации происходят постоянно, как правило, репарация их успевает устранять. Многие внешние факторы (мутагены) резко повышают частоту ошибок репликации и рекомбинации, так что даже вполне исправная система репарации не успевает их устранять. 3

• Репаративная система – это комплекс согласованно действующих ферментов, которые, как и все белки, закодированы в соответствующих генах. Поэтому, резко повышается частота мутаций в том случае, если один из генов ферментов системы репарации сам подвергнется мутации. Такие мутантные гены ферментов репарации называют генами-мутаторами. 4

• Генные мутации разделяют на два класса: мутации, обусловленные заменой оснований в ДНК гена и мутации, обусловленные сдвигом рамки считывания. Замены оснований составляют не более 20% спонтанных мутаций. Мутагенной активностью обладают некоторые аналоги оснований, в частности 5 -бромурацил, в котором метильная группа заменена атомом брома. 5
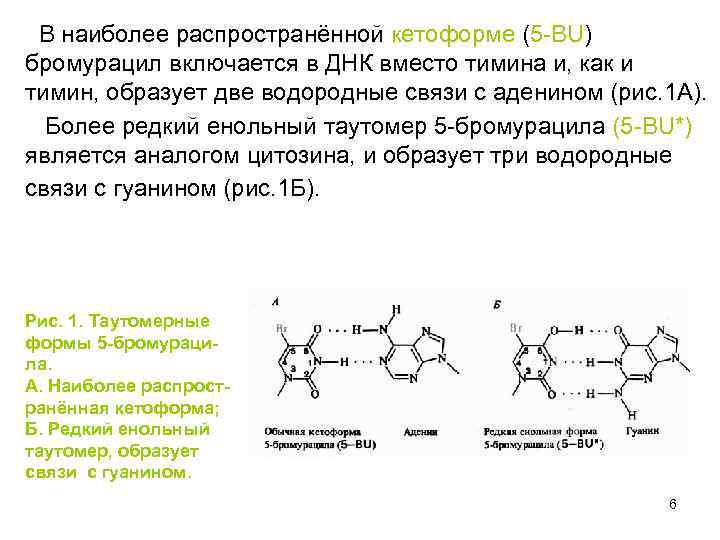
В наиболее распространённой кетоформе (5 -BU) бромурацил включается в ДНК вместо тимина и, как и тимин, образует две водородные связи с аденином (рис. 1 А). Более редкий енольный таутомер 5 -бромурацила (5 -BU*) является аналогом цитозина, и образует три водородные связи с гуанином (рис. 1 Б). Рис. 1. Таутомерные формы 5 -бромурацила. А. Наиболее распространённая кетоформа; Б. Редкий енольный таутомер, образует связи с гуанином. 6
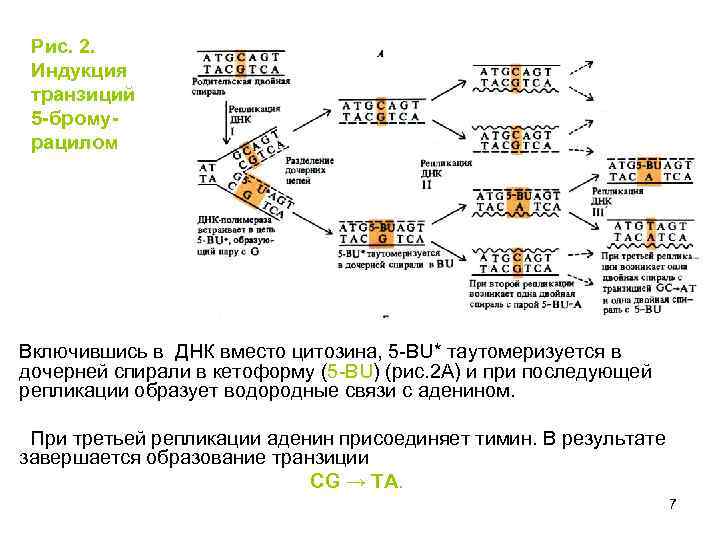
Рис. 2. Индукция транзиций 5 -бромурацилом Включившись в ДНК вместо цитозина, 5 -BU* таутомеризуется в дочерней спирали в кетоформу (5 -BU) (рис. 2 А) и при последующей репликации образует водородные связи с аденином. При третьей репликации аденин присоединяет тимин. В результате завершается образование транзиции CG → ТА. 7

Замены нуклеотидов приводят к следующим последствиям: • 1. Некоторые мутации замены пар оснований приводят к прерыванию синтеза полипептидной цепи (трансляции). Это связано с тем, что, замена основания в кодоне приводит к превращению его в один из терминирующих (nonsense) кодонов – UAG, UAA, UGA. Почти всегда nonsense – мутации приводят к резкому снижению жизнеспособности. У человека наиболее изучены β-талассемии – синтез укороченных β-цепей гемоглобина. Гетерозиготы по такой мутации страдают от анемии, гомозиготы нежизнеспособны. 2. Замена нуклеотида в триплете может привести к включению в белок другой аминокислоты (например, при серповидноклеточной анемии, рис. 3 и 4). 8
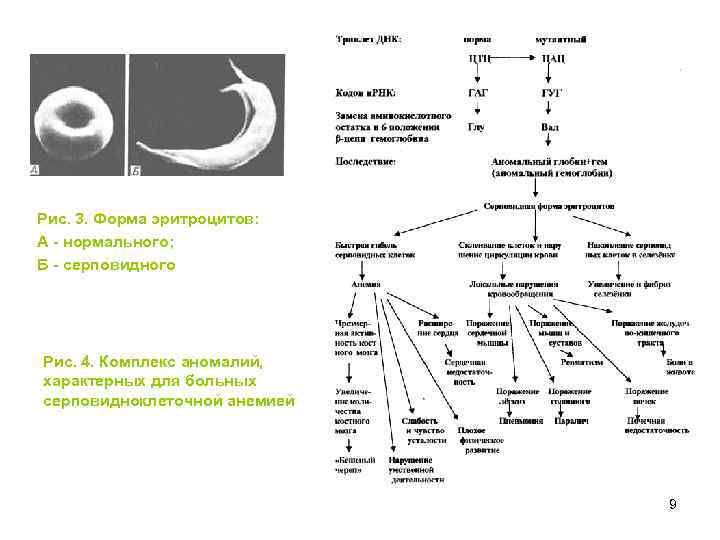
Рис. 3. Форма эритроцитов: А - нормального; Б - серповидного Рис. 4. Комплекс аномалий, характерных для больных серповидноклеточной анемией 9

2. 2. Мутации сдвига рамки считывания • Другой класс генных мутаций - мутации сдвига рамки считывания - составляют около 80% всех спонтанных мутаций. • Эти мутации вызывают более крупные нарушения в синтезируемых белках. • Большая часть обнаруженных мутаций сдвига рамки считывания обнаружена в последовательностях ДНК, состоящих из одинаковых пар оснований. Джордж Стрейзингер предложил следующую гипотезу их возникновения. 1. Фермент топоизомераза, перемещающийся по ДНК перед репликативной вилкой, вносит одноцепочечные разрывы (для устранения супервитков) (рис. 6); 2. Половины молекул ДНК, находящиеся справа и слева от точки такого разрыва, проворачиваются относительно друга, устраняя тем самым, возникшее в ДНК напряжение (рис. 7); Рис. 5. Мутации сдвига рамки считывания Рис. 6. Схема репликативной вилки 10

• 3. После поворота на 360 о (или на большее число оборотов) концы разорванной нити воссоединяются; • 4. При этом, на участках, где последовательно расположено несколько одинаковых нуклеотидов может произойти комплементарное спаривание разорванных концов молекулы, при этом образуется брешь из нескольких нуклеотидов (рис. 6). • 5. Последующее заполнение бреши путем репаративного синтеза приводит к тому, что одна из нитей ДНК (разорванная) оказывается длиннее другой на несколько нуклеотидов – т. е. возникает мутация сдвига рамки считывания. Рис. 7. Образование сдвига рамки считывания по гипотезе Д. Стрейзингера 11

3. ИНДУЦИРОВАННЫЙ МУТАГЕНЕЗ • Открытие мутационного процесса в начале XX в. дало возможность изучать причины и механизмы наследственной изменчивости, присущей всем живым организмам. Повышению эффективности этих исследований способствовали три обстоятельства: • • 1) выявление мутагенного действия рентгеновских лучей; • 2) разработка методов количественного учета вновь возникающих мутаций. 12

3. 1. Мутагенное действие ионизирующих излучений • Первая успешная попытка изменить наследственность действием радиации была предпринята Г. А. Надсоном и Г. С. Филипповым (1925). Они получили различные формы клеток у дрожжей, облученных препаратом радия. Поскольку генетика дрожжей в то время была совершенно не изучена, авторы не смогли доказать, что в основе полученных новых форм лежат мутации. • Но вскоре Г. Меллер (1927) на дрозофиле, а Л. Стадлер (1928) на ячмене и кукурузе убедительно продемонстрировали мутагенное действие рентгеновского излучения. Этому способствовала разработка надежных методов выявления сцепленных с полом летальных мутаций, а также видимых мутаций и крупных делеций. 13

4. Репарация ДНК Если бы точность репликации ДНК обеспечивалась только механизмом комплементарного спаривания основания, то ошибочное включение нуклеотидов происходило бы с частотой около 1%. В действительности, частота генных мутаций в десятки и сотни тысяч раз ниже (рис. 8). Такое снижение частоты мутаций обеспечивается работой ферментов, которые удаляют «неправильные» нуклеотиды и заменяют их правильными. Один из этих ферментов у E. Coli - ДНК-полимераза-I. В случае ошибочного встраивания нуклеотида активируется 3´→ 5´экзонуклеазная активность этого фермента. Ошибочно вставленный концевой нуклеотид вырезается, фермент перемещается назад и встраивает правильный нуклеотид. ДНК-полимераза-III E. Coli также обладает 3´→ 5´экзонуклеазной активностью и корректорскими функциями. Эукариотические ДНК-полимеразы не обладают 3´→ 5´экзонуклеазной активностью, что определяет у эукариотов более высокую частоту ошибок репликации. Но имеются другие ферменты с такой активностью. 14

Рис. 8. Частота возникновения некоторых генных мутаций у различных организмов. 15
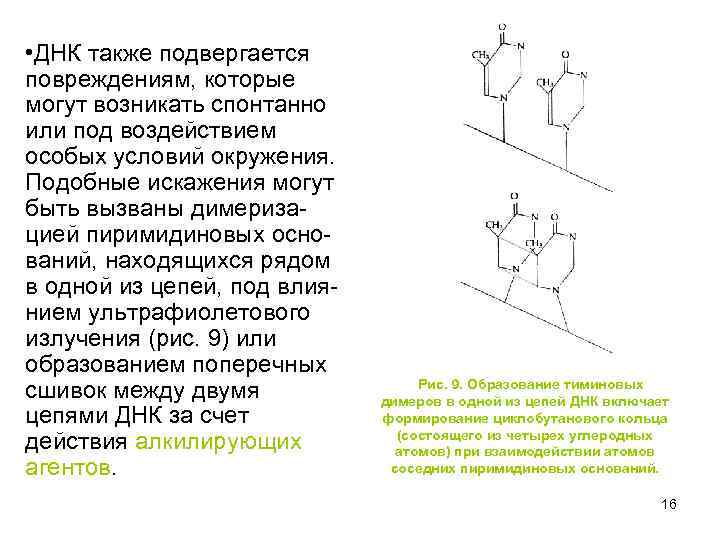
• ДНК также подвергается повреждениям, которые могут возникать спонтанно или под воздействием особых условий окружения. Подобные искажения могут быть вызваны димеризацией пиримидиновых оснований, находящихся рядом в одной из цепей, под влиянием ультрафиолетового излучения (рис. 9) или образованием поперечных сшивок между двумя цепями ДНК за счет действия алкилирующих агентов. Рис. 9. Образование тиминовых димеров в одной из цепей ДНК включает формирование циклобутанового кольца (состоящего из четырех углеродных атомов) при взаимодействии атомов соседних пиримидиновых оснований. 16

8. ПОСТРЕПЛИКАТИВНАЯ РЕПАРАЦИЯ • Несмотря на корректорские функции ДНК-полимераз все же некоторые нуклеотиды ошибочно включаются в новообразованную цепь ДНК. Это влечёт возникновение спонтанных мутаций, если ошибки не будут исправлены до начала следующего цикла репликации. Существуют пострепликационные механизмы исправления таких ошибок. Ферменты, осуществляющие это исправление называются ферментами репарации. • Были обнаружены мутации, инактивирующие эти ферменты. Эти мутации заметно повышают частоту спонтанных мутаций во всех генах организма. • Исправление ошибок в ДНК состоит из нескольких ферментативных этапов. 17
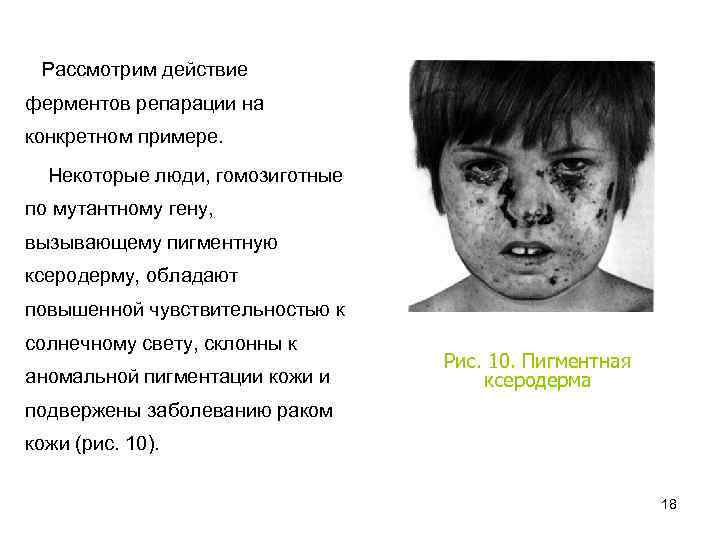
Рассмотрим действие ферментов репарации на конкретном примере. Некоторые люди, гомозиготные по мутантному гену, вызывающему пигментную ксеродерму, обладают повышенной чувствительностью к солнечному свету, склонны к аномальной пигментации кожи и Рис. 10. Пигментная ксеродерма подвержены заболеванию раком кожи (рис. 10). 18
Продолжительность жизни больных - менее 20 лет. Популяционная частота пигментной ксеродермы - 1: 250000, но носителем является каждый 250 человек. Известно 9 различных генетических форм этой болезни. Некоторые из них связаны с неспособностью клеток к вырезанию тиминовых димеров, возникающих под действием ултрафиолета (рис. 11). Гены локализованы 1 -й, 2, 9 и 19 -й хромосомах. 19
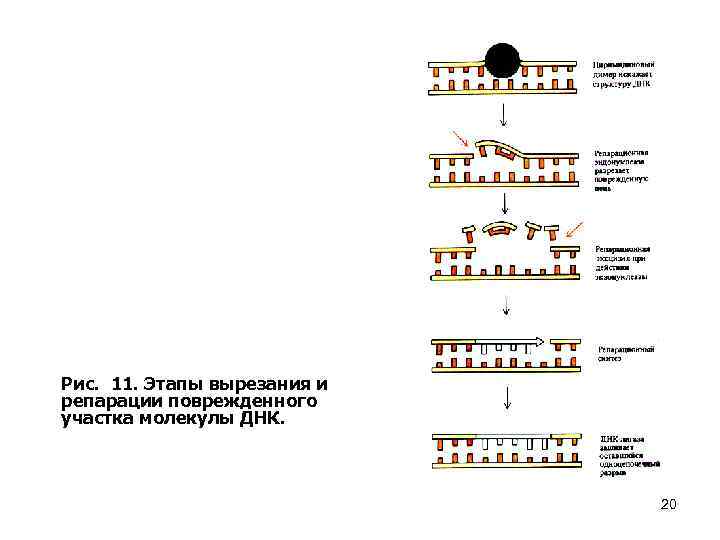
Рис. 11. Этапы вырезания и репарации поврежденного участка молекулы ДНК. 20

5. Некоторые генные болезни • Генные болезни — это заболевания, возникающие в результате повреждения ДНК на уровне гена. • Общая частота генных болезней в популяции составляет 1 -2%. Условно частоту генных болезней считают высокой, если она встречается как 1 случай на 10000 новорожденных, средней — 1 на 10 000 -40 000 и далее - низкой. • Моногенные формы наследуются в соответствии с законами Г. Менделя. По типу наследования они делятся на аутосомно-доминантные, аутосомно-рецессивные и сцепленные с Х- или Y-хромосомами. • Большинство генных патологий обусловлено мутациями в структурных генах тех или иных белков, которые ведут к изменению структуры или количества белка. 21

• Основная схема развития генных болезней включает ряд звеньев: мутантный аллель → измененный первичный продукт → цепь последующих биохимических процессов →клетки → органы → организм. • В результате мутации гена на молекулярном уровне возможны следующие варианты: • 1) синтез аномального белка; • 2) выработка избыточного количества генного продукта; • 3) отсутствие выработки первичного продукта; • 4) выработка уменьшенного количества нормального первичного продукта. 22

• Генные болезни могут влиять как на отдельные структуры клетки — лизосомы, мембраны, мито-хондрии, пероксисомы, так и на органы человека. • • Клинические проявления генных болезней, тяжесть и скорость развития зависят от особенностей всего генотипа (генов-модификаторов, дозы генов, времени действия мутантного гена, гомо- и гетерозиготности и др. ), возраста больного, условий внешней среды (питание, охлаждение, стрессы, переутомление) и других факторов. Особенностью многих генных болезней является их гетерогенность - одинаковые по фенотипу болезни могут быть обусловлены мутациями в разных генах или разными мутациями внутри одного гена. 23

• Всемирной Организацией Здравоохранения предложена следующая классификация генных болезней: • 1) болезни аминокислотного обмена (фенилкетонурия, алкаптонурия и др); • 2) наследственные нарушения обмена углеводов (галактоземия, гликогеновая болезнь и др. ); • 3) болезни, связанные с нарушением липидного обмена (Ниманна-Пика, Гоше и др. ); • 4) наследственные нарушения обмена стероидов; • 5) наследственные болезни пуринового и пиримидинового обмена (подагра, синдром Леша-Нейхана и др. ); • 6) болезни нарушения обмена соединительной ткани (болезнь Марфана, мукополисахаридозы и др. ); • 7) наследственные нарушения гема и порфирина (гемоглобинопатии и др); • 8) болезни, связанные с нарушением обмена в эритроцитах (гемолитические анемии); • 9)наследственные нарушения обмена билирубина; • 10) наследственные болезни обмена металлов (болезнь Коновалова. Вильсона и др. ) • 11) наследственные синдромы нарушения всасывания в пищеварительном тракте (муковисцидоз, непереносимость лактозы и др. ). 24

Наследственные болезни аминокислотного обмена Это — самая многочисленная группа наследственных болезней обмена веществ. Почти все они наследуются по аутосомнорецессивному типу. Причина заболеваний — недостаточность того или иного фермента, ответственного за синтез аминокислот. Болезни сопровождаются рвотой и обезвоживанием организма, летаргическим состоянием или возбуждением и судорогами. В позднем возрасте проявляется угасание умственного и физического развития. • К наследственным болезням с нарушенным аминокислотным обменом относится фенилкетонурия, альбинизм и др. 25

Фенилкетонурия (ФКУ) • Фенилкетонурия (ФКУ) впервые была описана А. Феллингом в 1934 г. • У больных нарушено превращение аминокислоты фенилаланина в тирозин из-за резкого снижения активности фермента фенилаланингидроксилазы. • В результате содержание фенилаланина в крови и моче больных значительно возрастает (рис. 12). • Далее фенилаланин превращается в фенилпировиноградную кислоту, которая является нейротропным ядом и нарушает формирование миелиновой оболочки вокруг аксонов центральной нервной системы. 26
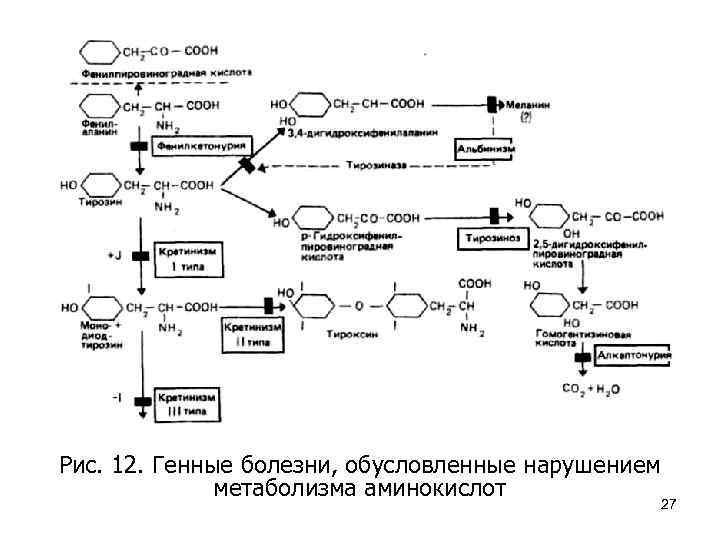
Рис. 12. Генные болезни, обусловленные нарушением метаболизма аминокислот 27

Ребенок с фенилкетонурией рождается здоровым, но в первые же недели в связи с поступлением фенилаланина в организм с молоком матери развивается повышенная возбудимость, судорожный синдром, склонность к дерматитам, моча и пот больных имеют характерный "мышиный" запах, но главными симптомами ФКУ являются судорожные припадки и олигофрения. • Большинство больных — блондины со светлой кожей и голубыми глазами, что определяется недостаточным синтезом пигмента меланина. Диагноз заболевания устанавливается на основании клинических данных и результатов биохимического анализа мочи (на фенилпировиноградную кислоту) и крови (на фенилаланин). С этой целью несколько капель крови на фильтровальной бумаге подвергают хроматографии и определяют содержание фенилаланина. Иногда используют пробу Феллинга — в 2, 5 мл свежей мочи ребенка добавляют 10 капель 5% раствора треххлористого железа и уксусной кислоты. Появление сине-зеленого окрашивания указывает на наличие заболевания. 28

• Метод лечения фенилкетонурии хорошо разработан. Он состоит в назначении диеты (овощи, фрукты, варенье, мед) и специально обработанных гидролизатов белков с низким содержанием фенилаланина. В настоящее время разработаны методы дородовой диагностики. Ранняя диагностика и профилактическое лечение предупреждают развитие болезни. • Средняя частота ФКУ в мире - 1 на 10000 новорожденных. Однако имеются значительные различия между странами: 1: 2600 в Турции, 1: 4500 в Ирландии, 1: 30000 в Швеции, 1: 119000 в Японии. Частота гетерозиготного носительства в большинстве европейских популяций составляет 1: 100. • Ген фенилгидроксилазы расположен в 12 -й хромосоме. В настоящее время возможна молекулярно-генетическая диагностика и выявление гетерозиготного носительства. Болезнь наследуется по аутосомно-рецессивному типу. Известно несколько форм фенилкетонурии, которые различаются по тяжести протекания болезни. Это связано с наличием 4 -х аллелей гена и их комбинациями. 29

• Альбинизм (глазо-кожный) описан в 1959 г. Болезнь обусловлена отсутствием синтеза фермента тирозиназы. Для нее характерна обесцвеченность кожи, волос, глаз, независимо от расы и возраста (рис. 13). • Кожа больных розово-красная, не загорает. Имеет предрасположенность к злокачественным новообразованиям. Волосы белые или желтоватые. Радужка серо-голубого цвета, но может быть и розоватая из-за отражения света от глазного дна. Больным свойственна сильная светобоязнь, их зрение снижено и не улучшается с возрастом. • Встречается с частотой 1 на 39000, наследуется по аутосомно-рецес-сивному типу. Носителем является каждый сотый человек. Ген локализован на длинном плече 11 й хромосомы. Рис. 13. Альбинос негр 30

Наследственные заболевания, связанные с нарушением обмена углеводов Углеводы входят в состав ряда биологически-активных веществ. Выполняют энергетическую и структурную функции. В результате нарушения углеводного обмена развивается гликогеновая болезнь, галактоземия и др. • Гликогеновая болезнь связана с нарушением синтеза и разложения гликогена — животного крахмала. Гликоген образуется из глюкозы. При голодании в норме он снова превращается в глюкозу и усваивается организмом. При нарушении этих процессов у человека развиваются тяжелые заболевания — различные типы гликогенозов К ним относятся болезнь Гирке, болезнь Кори и др. • Гликогеноз (I тип — болезнь Гирке). У больных в печени, почках и слизистой кишечника накапливается большое количество гликогена. Превращение его в глюкозу не происходит, т. к. отсутствует фермент глюко-6 -фосфатаза, регулирующий уровень глюкозы в крови. В результате у больного развивается гипогликемия, в печени, почках и слизистой кишечника накапливается гликоген. Болезнь Гирке наследуется по аутосомно-рецессивному типу. 31
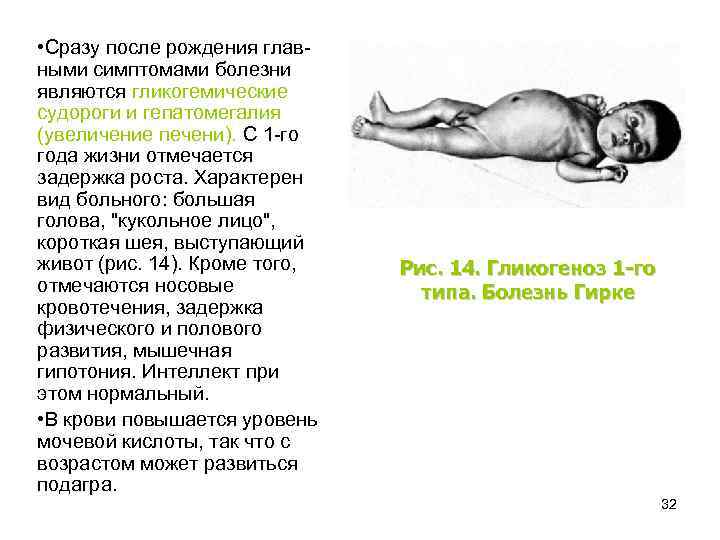
• Сразу после рождения главными симптомами болезни являются гликогемические судороги и гепатомегалия (увеличение печени). С 1 -го года жизни отмечается задержка роста. Характерен вид больного: большая голова, "кукольное лицо", короткая шея, выступающий живот (рис. 14). Кроме того, отмечаются носовые кровотечения, задержка физического и полового развития, мышечная гипотония. Интеллект при этом нормальный. • В крови повышается уровень мочевой кислоты, так что с возрастом может развиться подагра. Рис. 14. Гликогеноз 1 -го типа. Болезнь Гирке 32
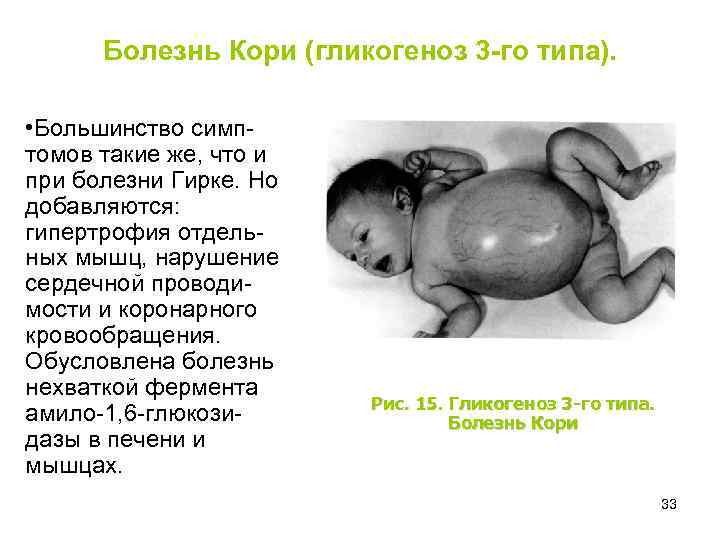
Болезнь Кори (гликогеноз 3 -го типа). • Большинство симптомов такие же, что и при болезни Гирке. Но добавляются: гипертрофия отдельных мышц, нарушение сердечной проводимости и коронарного кровообращения. Обусловлена болезнь нехваткой фермента амило-1, 6 -глюкозидазы в печени и мышцах. Рис. 15. Гликогеноз 3 -го типа. Болезнь Кори 33

• Галактоземия. При этом заболевании поражаются многие органы: печень, нервная система, глаза и др. Симптомы болезни появляются у новорожденных после приема молока. Составная часть молочного сахара лактозы - галакто-за. При гидролизе лактозы образуются глюкоза и галактоза, которая необходима для миелинизации нервных волокон. При избытке галактозы она в норме превращается в глюкозу с помощью фермента галактоза-1 -фосфат -уридил-трансферазы. При понижении активности этого фермента происходит накоп-ление галактоза-1 -фосфата, токсичного для печени, мозга, хрусталика глаза. 34

• Болезнь проявляется с первых дней жизни расстройствами пищеварения, интоксикацией (понос, рвота, обезвоживание). У больных увеличивается печень, развивается печеночная недостаточность и желтуха. Обнаруживается катаракта (помутнение хрусталика глаза), умственная отсталость. У погибших в первый год жизни детей при вскрытии обнаруживают цирроз печени. • Наиболее точные методы диагностики галактоземии — определение активности фермента галактоза-1 -фосфатуридилтрансферазы в эритроцитах, а также галактозы в крови и моче, где уровни ее увеличены. Без лечения больные погибают в первые месяцы жизни от инфекций или печёночной недостаточности. При исключении из пищи молока (источника галактозы) и раннем назначении диеты больные дети могут нормально развиваться. • Тип наследования галактоземии — аутосомно-рецессивный. Ген локализован на коротком плече 9 -й хромосомы. Болезнь встречается с частотой 1 на 16000 новорожденных. Носителем является каждый 60 -й человек. 35

Наследственные заболевания, связанные с нарушением липидного обмена • В число липидов входят холестерол (холестерин), триглицериды, эфиры холестерола, фосфолипиды, сфинголипиды и др. • Наследственные болезни обмена липидов (липидозы) подразделяются на два основных типа: • 1) внутриклеточные, при которых происходит накопление липидов в клетках различных тканей и • 2) болезни с нарушением метаболизма липопротеидов, содержащихся в крови. • К числу наиболее изученных наследственных заболеваний липидного обмена первого типа относятся болезнь Гоше, болезнь Ниманна-Пика и амавротическая идиотия (болезнь Тея-Сакса). 36

• Болезнь Гоше обусловлена дефицитом фермента β-глюкозидазы. Это приводит к накоплению в клетках ретикуло-эндотелиальной системы глюкоцереброзида. В клетках мозга, печени, лимфатических узлах обнаруживаются крупные клетки (клетки Гоше). Накопление цереброзида в клетках нервной системы приводит к их разрушению. • Выделяют детскую, ювенильную и взрослую формы болезни. • Детская проявляется в первые месяцы жизни задержкой умственного и физического развития, увеличением живота, печени и селезенки, затруднением глотания, спазмом гортани. Возможна дыхательная недостаточность, инфильтрация (уплотнение легких клетками Гоше) и судороги. Смерть наступает на первом году жизни. • Чаще встречается взрослая форма болезни Гоше. Она поражает детей различного возраста и носит хронический характер. Заболевание проявляется уже на первом году жизни. Возникают пигментация кожи (коричневые пятна), остеопороз (снижение плотности костной ткани). • Тип наследования всех трёх форм - аутосомно-рецессивный. Ген локализован в первой хромосоме. 37

• Болезнь Ниманн-Пика обусловлена снижением активности фермента сфингомиелиназы. Происходит накопление сфингомиелина в клетках печени, селезенке, мозге, ретикуло-эндотелиальной системе. Вследствие дегенерации нервных клеток нарушается деятельность нервной системы. • Выделяют 4 формы заболевания, различающихся клинически (время начала, течение и тяжесть неврологических проявлений). Однако имеются и общие для всех форм симптомы. Более половины случаев заболеваний приходятся на классическую форму (тип А). • Болезнь чаще проявляется в раннем возрасте. У ребенка увеличиваются лимфатические узлы, размеры живота, печени и селезенки; отмечаются рвота, отказ от пищи, мышечная слабость, снижение слуха и зрение. У 20 -30% детей на сетчатке глаза обнаруживается пятно вишневого цвета (симптом "вишневой косточки"). Поражение нервной системы ведет к отставанию нервно-психического развития, глухоте, слепоте. Резко снижается устойчивость к инфекционным заболеваниям. Дети погибают в раннем возрасте (до трёх лет). • Наследование болезни — аутосомно-рецессивное. Ген сфингомиелиназы картирован на хромосоме 11. • Диагностика болезни Ниманна-Пика основана на выявлении в плазме крови и спинномозговой жидкости повышенного содержания сфингомиелина. • В периферической крови выявляются большие зернистые пенистые клетки Пика. Лечение симптоматическое. 38
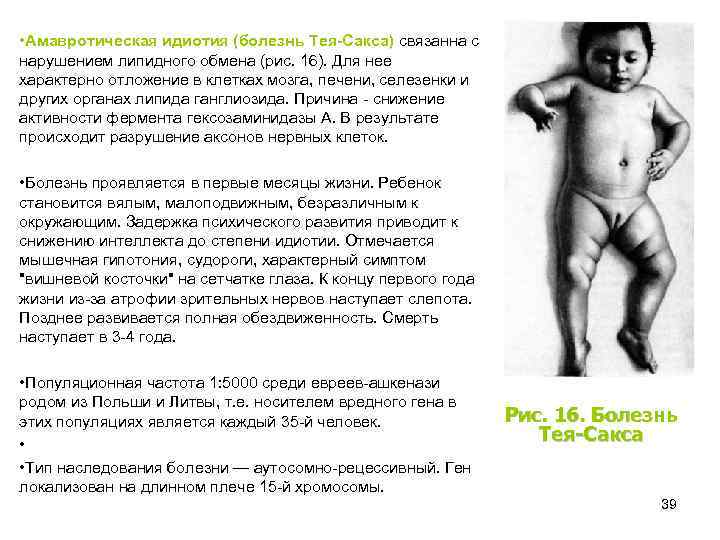
• Амавротическая идиотия (болезнь Тея-Сакса) связанна с нарушением липидного обмена (рис. 16). Для нее характерно отложение в клетках мозга, печени, селезенки и других органах липида ганглиозида. Причина - снижение активности фермента гексозаминидазы А. В результате происходит разрушение аксонов нервных клеток. • Болезнь проявляется в первые месяцы жизни. Ребенок становится вялым, малоподвижным, безразличным к окружающим. Задержка психического развития приводит к снижению интеллекта до степени идиотии. Отмечается мышечная гипотония, судороги, характерный симптом "вишневой косточки" на сетчатке глаза. К концу первого года жизни из-за атрофии зрительных нервов наступает слепота. Позднее развивается полная обездвиженность. Смерть наступает в 3 -4 года. • Популяционная частота 1: 5000 среди евреев-ашкенази родом из Польши и Литвы, т. е. носителем вредного гена в этих популяциях является каждый 35 -й человек. • • Тип наследования болезни — аутосомно-рецессивный. Ген локализован на длинном плече 15 -й хромосомы. Рис. 16. Болезнь Тея-Сакса 39

Наследственные болезни соединительной ткани • Роль соединительной ткани в организме связана с опорной, трофической и защитной функциями. Важнейшими компонентами соединительной ткани являются: • а) клеточные компоненты; • б) коллагеновые, эластические и ретикулярные волокна; • в) аморфное основное вещество. • Структура соединительной ткани задана генетически. Патология в ее системе является причиной различных наследственных заболеваний и обусловлена в той или иной степени нарушениями строения структурных белков — коллагенов. • Большинство болезней соединительной ткани связано с дефектами опорно-двигательного аппарата и кожи. К числу их относятся синдром Марфана, синдром Элерса-Данлоса, а также мукополисахаридозы. 40

Синдром Марфана ("паучьи пальцы") • Синдром Марфана ("паучьи пальцы") относится к числу наследственных болезней обмена веществ и характеризуется системным поражением соединительной ткани. Впервые синдром был описан В. Марфаном в 1886 г. • Наследуется по аутосомно-доминантному типу с высокой пенетрантностью и различной степенью экспрессивности. С этим связан значительный клинический и возрастной полиморфизм. • Причина болезни — мутация в гене, ответственном за синтез белка соединительнотканных волокон фибриллина. Блокирование его сиинтеза приводит к повышенной растяжимости соединительной ткани. 41

• Больных с синдромом Марфана (рис. 17) отличают высокий рост, длинные паукообразные пальцы (рис. 18), деформация грудной клетки (воронкообразная, килевидная, уплощенная), плоскостопие. Нередко имеют место бедренные и паховые грыжи, гипоплазия (недоразвитие) мышц, мышечная гипотония, ухудшение зрения, изменение формы и размера хрусталика, значительная миопия вплоть до отслойки сетчатки, гетеро-хромия (разное окрашивание участков радужки); подвывих хрусталика, катаракта, косоглазие. • При синдроме Марфана характерны врожденные пороки сердца, расширение аорты с развитием аневризмы. Нередко отмечаются расстройства органов дыхания, поражения желудочнокишечного тракта и мочевыводящей системы. Рис. 17. Отец и дети с синдромом Марфана Рис. 18. Кисти рук при синдроме Марфана 42

• Лечение в основном симптоматическое. Положительное действие оказывают массаж, лечебная физкультура, а в ряде случаев оперативное вмешательство. Частота синдрома Марфана в популяции равна 1: 25000. • У больных резко повышено содержание адреналина в крови, что определяет их очень высокую интеллектуальную и физическую активность. • Синдромом Марфана страдали президент США Авраам Линкольн, великий итальянский скрипач и композитор Николо Паганини, писатель Андерсен, президент Франции де Голль Выдающиеся личности, болевшие синдромом Марфана 43

• Мукополисахаридозы - группа наследственных заболеваний соединительной ткани. Нарушено расщепление углеводной части молекул кислых мукополисахаридов, входящих в состав клеток соединительной ткани. Причина - недостаточность лизосомальных ферментов. В результате патологические продукты обмена откладываются в соединительной ткани, в печени, селезенке, роговице и в клетках центральной нервной системы. • Раньше заболевание было известно под названием "гаргоилизм", поскольку пробанды напоминали фигуры, украшавшие собор Парижской Богоматери (рис. 19, 20). • Поражаются опорно-двигательный аппарат, внутренние органы, глаза, нервная система. Рис. 19. Мукополисахаридоз, тип 1 44

• Клинические признаки: замедление роста, короткая шея и туловище, деформация костей, снижение интеллекта, грубые черты лица с крупными губами и языком, пупочные и паховые грыжи, пороки сердца, нарушение психического развития с отставанием от нормы. • Тип наследования М. 1 — аутосомнорецессивный. Ген картирован на коротком плече 4 -й хромосомы. • Известно 8 типов мукополисахаридозов в зависимости от снижения активности разных ферментов и особенностей кли-нических признаков. Для определения типа заболевания исследуются биохимические показатели кислых гликозаминоглюканов в крови и моче больных. • Лечение: диетотерапия, физиопроцедуры (электрофорез, магнитотерапия, массаж, лечебная физкультура и др. ), гормональные и сердечно-сосудистые средства. Рис. 20. Мукополисахаридоз, тип 6. Слева - 2 года; справа - она же в возрасте 18 лет. 45

Наследственные нарушения обмена в эритроцитах • К этой группе относятся болезни, связанные чаще всего с укорочением срока жизни эритроцитов, а также со снижением уровня гемоглобина в крови. Гемоглобин — основной белок эритроцитов. • Изучение гемоглобина у человека началось с открытия наследственного заболевания — серповидноклеточной анемии. Было показано, что молекулярная структура серповидноклеточного гемоглобина отличается от нормального. • Известно более 400 вариантов гемоглобина и расшифрована их полная аминокислотная последовательность. • Молекула человеческого гемоглобина состоит из 4 -х полипептидных цепей (α, β, γ, δ). • Большинство разновидностей гемоглобина человека имеет идентичные αцепи и различаются по остальным цепям. К каждой цепи глобина в специфическом участке присоединяется молекула небелковой природы — гемогруппа, или гем. • Четыре глобиновых цепи вместе с гемами образуют функциональную молекулу гемоглобина, которая переносит кислород из легких в ткани. • Молекула глобина состоит из 141 — 146 аминокислотных остатков, расположенных в строго определенном порядке. 46

• Все нормальные гемоглобины человека имеют идентичную трехмерную структуру, оптимальную для переноса кислорода. • Аминокислотная последовательность каждой глобиновой цепи кодируется своим геном, равно как и синтез небелковой гемогруппы. • Гены глобинов у человека образуют мультигенное семейство и расположены на хромосомах двух кластеров (Кластеры — группа генов, расположенных в определенных локусах, объединенных общими функциями. ) — α-кластер занимает 25000 пар нуклеотидов в коротком плече 16 -й хромосмы. Семейство у-β-δ-генов расположено в коротком плече 11 -й хромосомы (60 000 п. н. ). • Варианты гемоглобинов возникают в результате мутаций в конкретном глобиновом гене. Эти варианты (чаще всего) отличаются одной аминокислотой в глобиновой цепи. Описано более 350 таких единичных замен. Замены аминокислот влияют на сродство молекулы гемоглобина кислорода. • Нарушение же его функций ведет к возникновению заболеваний. К другим типам мутаций, изменяющим гемоглобин, относятся: делеции, дупликации, мутации сдвига рамки считывания, мутации, нарушающие процессинг РНК и др. 47

• В результате мутаций в эритроцитах и гемоглобине возникают наследственные болезни человека — гемолитические анемии и гемоглобинопатии. • Гемолитические анемии включают заболевания, обсусловленные снижением уровня гемоглобина и укорочением срока жизни эритроцитов. • Кроме того, причиной болезни могут быть: • Нарушение мембраны эритроцитов. • Нарушение активности ферментов эритроцитов (ферментов, гликолиза пентозофосфатного цикла и др. ). • Нарушение структуры или синтеза гемоглобина. • Рассмотрим кратко наиболее распространенную форму наследственной гемолитической анемии у человека. • Наследственный микросфероцитоз — гемолитическая анемия Минковского-Шоффара. Обусловлена генетическими аномалиями эритроцитов (недостаточность липидов их оболочки). В результате повышения проницаемости мембраны в клетку проникают ионы натрия и теряется АТФ. Эритроциты принимают сферическую форму. Измененные эритроциты разрушаются в селезенке с образованием токсического белка — билирубина. • Развиваются желтуха, анемия, спленомегалия (и разрыв селезенки), изменения скелета. 48

• Болезнь может протекать в двух формах — хронической и острой, при которой усиливается гемолиз, обусловливающий анемию. • У детей в первые месяцы жизни часто возникает "ядерная желтуха". Причина — поражение ядер головного мозга за счет высокого содержания билирубина. В более старшем возрасте высокий уровень билирубина приводит к образованию камней и развитию желчекаменной болезни. • Для больных характерно увеличение селезенки и печени, деформация скелета; башенный череп, готическое небо, нарушенное расположение зубов. • Для диагностики заболевания исследуют кровь. Характерными признаками являются обнаружение микросфероцитов, снижение осмотической стойкости эритроцитов и др. • Тип наследования — аутосомно-доминантный с неполной пенетрантностью. Ген картирован на коротком плече 8 -й хромосомы. 49

Гемоглобинопатии • Гемоглобинопатии связаны с нарушением синтеза гемоглобина. Выделяют количественные (структурные) и качественные их формы. Первые характеризуются изменением первичной структуры белков гемоглобина, что может приводить к нарушению его стабильности и функции. При качественных формах структура гемоглобина остается нормальной, снижена лишь скорость синтеза глобиновых цепей. • Талассемии. Данная патология обусловлена снижением скорости синтеза полипептидных цепей нормального гемоглобина А. Впервые болезнь описана в 1925 г. Ее название происходит от греческого "Таласса" — Средиземное море. Полагают, что большинство носителей гена талассемии происходят из средиземноморского региона. • Талассемия встречается в гомо- и гетерозиготных формах. По клинической картине принято различать большую, промежуточную, малую и минимальную формы. Остановимся на одной из них. 50

• Гомозиготная (большая) талассемия, она же — анемия Кули вызывается резким снижением образования гемоглобина Hb. A и увеличением количества гемоглобина F. • Клинически болезнь проявляется к концу первого года жизни ребенка. Для нее характерны монголоидность лица, башенный тип черепа, отставание физического развития. При данной патологии в крови больного обнаруживаются мишеневидные эритроциты с низким содержанием гемоглобина, укороченной продолжительностью жизни и повышенной осмотической стойкостью. У больных отмечается увеличение селезенки и, реже, печени. • По тяжести заболевания выделяют несколько форм талассемии. Тяжелая талассемия заканчивается быстрой гибелью в первые месяцы жизни ребенка. При хронической — больные дети доживают до 5 -8 лет, а при легких формах больные доживают до взрослого возраста. 51
Лекция 5. Генные Мутации и болезни.ppt