лекция 24.04.pptфинал.ppt
- Количество слайдов: 66

Генная терапия сердечно-сосудистых заболеваний Е. В. Парфенова ФГУ РКНПК Росмедтехнологий

ГЕННАЯ ТЕРАПИЯ – лечение болезней путем введения ДНК или РНК специфических генов в клетки организма (2000 -е годы) Стратегии генной терапии Цель 1. Усиление продукции терапевтического белка 2. Подавление продукции патогенного белка Примеры Механизм Экспрессия гена с помощью вектора (плазмиды, вирусы) Ишемические заболевания (гены факторов роста – увеличение количества сосудов); онкозабол. (р53). Подавление экспрессии гена, с помощью антисмысловых олигонуклеотидов, коротких интерферирующих РНК, ДНК рибозимов. Рестенозы, опухоли, инфекции (Подавление пролиферации, миграц ии, адгезии)
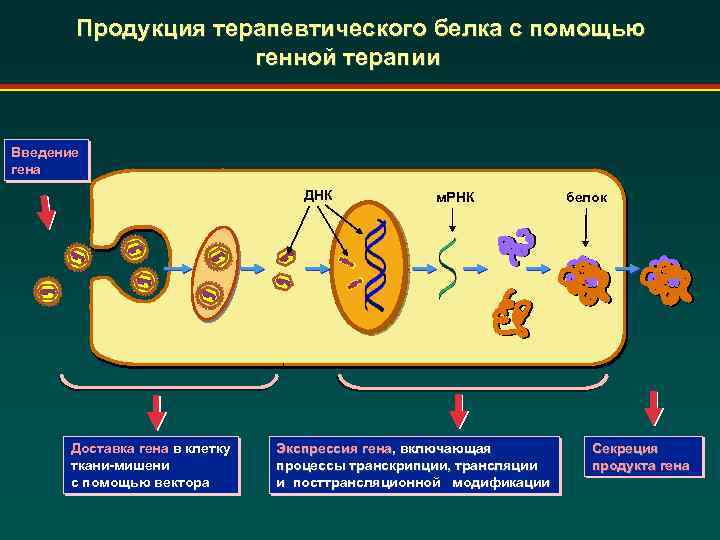
Продукция терапевтического белка с помощью генной терапии Введение гена ДНК Доставка гена в клетку ткани-мишени с помощью вектора м. РНК Экспрессия гена, включающая процессы транскрипции, трансляции и посттрансляционной модификации белок Секреция продукта гена

Прямая и непрямая генная терапия Прямое введение гена в ткань / орган Введение генетически трансформированных клеток

Что необходимо, для эффективного переноса ДНК в клетки эукариот? §Специфическое связывание с белками наружных клеточных мембран. §Эндоцитоз – попадание в цитоплазму в составе эндосом. §Избежать разрушения лизосомальными ферментами. §Быстрый выход из эндосом. §Избежать разрушения эндогенными нуклеазами. §Попасть в ядро. §Интегрироваться в геном или сохраняться как можно более длительно в эписомальном состоянии.

Терапевтическая генетическая конструкция Полноразмерная последовательность кодирующей ДНК определенного гена, или коротких РНК, встроенная в экспрессионный вектор, где она находится под действием сильного промотора.

Векторные системы для генной терапии Вектор Эффективность трансдукции Иммунный ответ на вектор Плазмида (ДНК)/ низкая носитель нет Ретровирусы (РНК) низкая нет Лентивирусы высокая нет Клетки- Интеграция «Вместимость» мишени в геном Все (Лучше делящиеся) Только делящиеся Все клетки нет есть Четко не ограничена 5000 - 7000 п. о. 5000 – 7000 п. о. (РНК) Аденовирусы (ДНК) Аденоассоциированные Вирусы (ДНК) Вирус простого герпеса HSV (ДНК) Очень высокая есть Все клетки нет 7000 -30000 п. о. Не ясна слабый Не все клетки есть До 5000 п. о. нет Клетки НС нет Более 30 000 п. о. высокая

Идеальный вектор для генной терапии • • • Эффективная 100% трансфекция клеток-мишеней как ex vivo, так и in vivo. Обеспечение адресной доставки в клетки-мишени Высокая пакующая способность (включение генетической конструкции от 1000 до 1 млн. п. о. ). Интеграция в геном или при отсутствии интеграции обеспечение длительной, регулируемой экспрессии. Отсутствие опасности онкогенных модификаций или иных нежелательных побочных эффектов.

Цели генной терапии в кардиологии и ангиологии - Терапевтический ангиогенез - Предотвращение рестенозов и стенозов венозных шунтов - Защита миокарда от ишемического повреждения - Предотвращение тромбозов - Лечение рефрактерной гипертонии - Лечение сердечной недостаточности - Лечение гиперлипидемий - Лечение аритмий – биологические водители ритма

Терапевтический ангиогенез – лечебная тактика, направленная на стимуляцию роста и ремоделирования сосудов в ишемизированных тканях с помощью введения ангиогенных факторов, их генов или прогениторных клеток.

ФОРМИРОВАНИЕ НОВЫХ СОСУДОВ АНГИОГЕНЕЗ § Отрастание новых капилляров от посткапиллярной венулы § Индуцируется ишемией § Ремоделирование Образование новых сосудов или ремоделирование сосудов с участием прогениторных клеток § Индуцируется ишемией или повреждением § Функциональный эффект неизвестен § Индуцируется локальным изменением напряжения сдвига и моноцатарной инфильтрацией § Увеличивает кровоток в раза § предсуществующих сосудов через HIF 2 -3 ВАСКУЛОГЕНЕЗ АРТЕРИОГЕНЕЗ § Увеличение кровотока в 20 -30 раз.
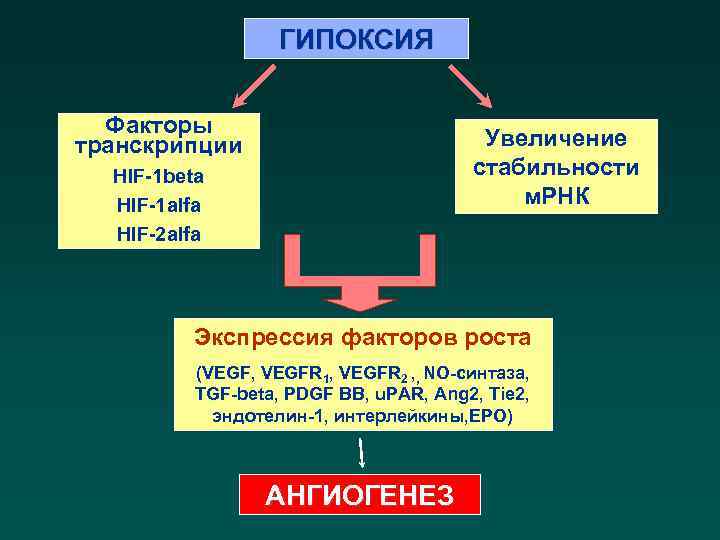
ГИПОКСИЯ Факторы транскрипции Увеличение стабильности м. РНК HIF-1 beta HIF-1 alfa HIF-2 alfa Экспрессия факторов роста (VEGF, VEGFR 1, VEGFR 2 , , NO-синтаза, TGF-beta, PDGF BB, u. PAR, Ang 2, Tie 2, эндотелин-1, интерлейкины, ЕРО) АНГИОГЕНЕЗ
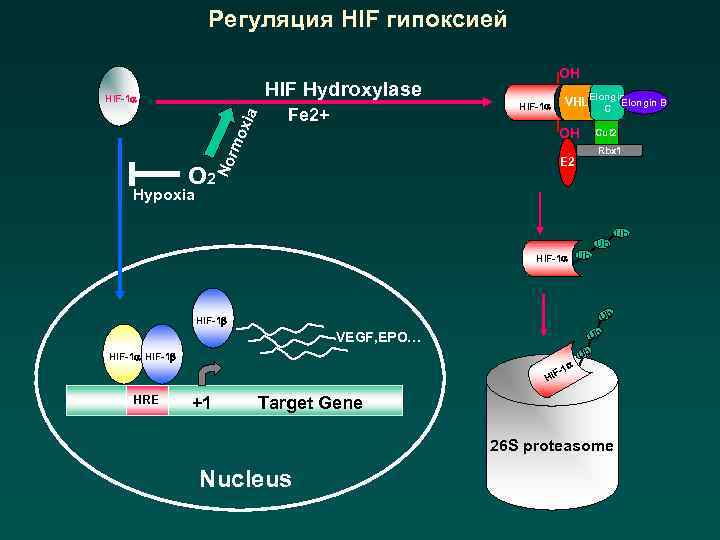
Регуляция HIF гипоксией OH HIF Hydroxylase VHL HIF-1 Fe 2+ Elongin B C OH Cul 2 Rbx 1 E 2 No rm oxi a HIF-1 O 2 Hypoxia Ub HIF-1 Ub Ub HIF-1 Ub VEGF, EPO… HIF-1 -1 Ub HIF HRE +1 Target Gene 26 S proteasome Nucleus Ub

Артериогенез Кровоток Shear stress -моноциты -ФР Миграция и Пролиферация ГМК, ремодел. матрикса

Механические ангиогенные стимулы Кровоток + Растяжение + + Shear stress + ICAM - 1, Р-селектин адгезия моноцитов VEGF ЭК b. FGF Артериогенез

Основные ангиогенные факторы • VEGFs – факторы роста эндотелия сосудов (VEGF A 165, 121) • FGFs - факторы роста фибробластов (FGF-1, 2, 4) • PDGF - тромбоцитарный фактор роста • TGF - трансформирующий фактор роста • HGF - фактор роста гепатоцитов • TNF - фактор некроза опухолей • EGF - эпидермальный фактор роста • IGF-1 - инсулиноподобный фактор роста 1 • Ang 1, Ang 2 – ангиопоэтины • НIF-1 -фактор, индуцируемый гипоксией

Основные естественные ингибиторы ангиогенеза • 4 -й Фактор тромбоцитов • Тромбоспондины 1, 2 • Тканевой ингибитор матриксных металлопротеаз • Интерферон • Ангиостатин • Эндостатин

Ангиогенез запускается при нарушении баланса между его активаторами и ингибиторами
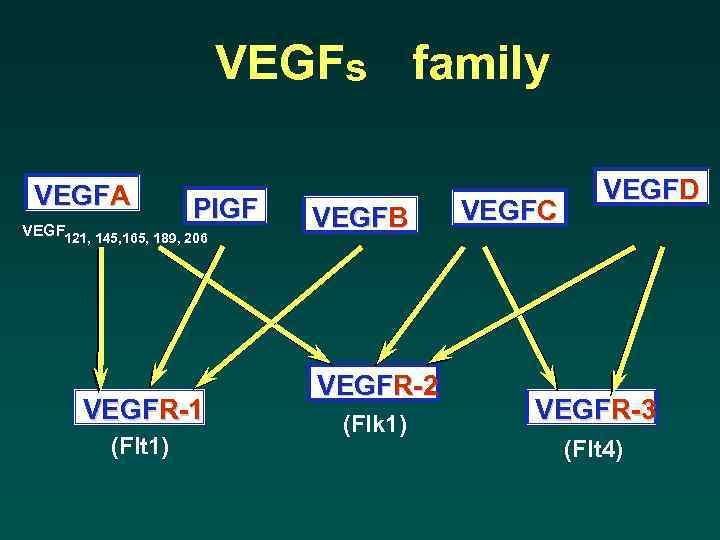
VEGFs family VEGFA PIGF VEGF 121, 145, 165, 189, 206 VEGFR-1 (Flt 1) VEGFB VEGFR-2 (Flk 1) VEGFC VEGFD VEGFR-3 (Flt 4)

Внутриклеточный сигналинг, запускаемый VEGF

Механизмы влияния VEGF на ангиогенез VEGF Пролиферация и миграция ЭК Вазодилятация (NO) Экспрессия протеаз ЭК Повышение сосудистой проницаемости Выход из костного мозга предшественников ЭК Миграция моноцитов Нейропротективное действие

Механизмы влияния FGF на ангиоартериогенез FGFs* Активация пролиферации миграции ГМК, ЭК, фибробластов. Протективное действие на кардиомиоциты Миграция моноцитов * - FGF-1, FGF-2, FGF-4 Вазодилятация (NO)

АНГИОПОЭТИНЫ ANG 1 ANG 2 + - Уменьшение сосудистой проницаемости - Стабилизация сосуда + Tie 2 Сигнал к дестабилизации сосудов -VEGF + VEGF -Рост и ремоделирование сосудов регрессия сосудов рост и ветвление

Формирование стабильного сосуда ПЭК Регрессия, апоптоз Появление отростка ПЭК Ang-2 u. PA PDGF Стабилизация Ang-1 VEGFs FGFs MMPs TGF- Ang-2 Дестабилизация Ремоделирование Зрелый сосуд Адаптировано из Curr Contr Trials in Cardiovasc Med, 2001, 2(6): 278

Гены ангиогенных факторов Рекомбинантные факторы роста Терапевтический ангиогенез Стволовые/ прогениторные клетки Клетки + гены Генетически трансформированные клетки

Генная терапия versus терапия рекомбинантными белками Характеристики Генная терапия Терапия рекомбинантными белками Длительность действия ангиогенных факторов Длительное благодаря постоянной продукции белка Короткий период полужизни белков. Необходимость повторных введений или системы медленного высвобождения белков Возможность повторного введения Возможна инактивация или иммунный ответ при использовании аденовируса Очень низкий риск воспалительной реакции или иммунной инактивации Введение чужеродного генетического материала/ вирусного вектора Да Нет Попадание ангиогенного фактора в циркуляцию Длительное , но очень низкий уровень Короткое, но очень высокий уровень
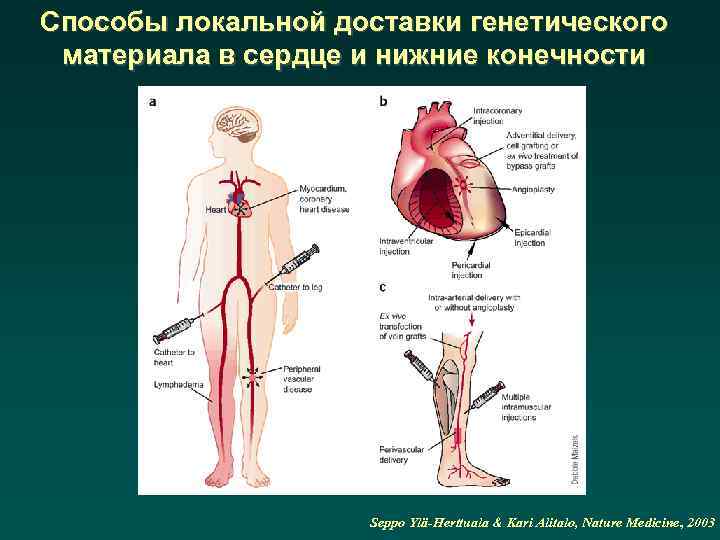
Способы локальной доставки генетического материала в сердце и нижние конечности Seppo Ylä-Herttuala & Kari Alitalo, Nature Medicine, 2003

Cпособы доставки терапевтических генов или белков в сердце Способ Задержка в сердце Системная диссеминация ВВ инъекции-инфузии 0, 5% Очень высокая В левое предсердие 1, 3% Очень высокая Внутри коронарное (белки) 5% Очень высокая Внутрикоронарное (аденовирусы) 95% Перикардиальное Внутримиокардиально (белки) Внутримиокардиально (плазмиды, аденовирусы ) 19% Низкая Высокая 60 -70% Умеренная 90% Низкая

Применение ph. VEGF 165 для лечения критической ишемии нижних конечностей До лечения Через 1 месяц Через 3 месяца До лечения Через 2 месяца J. M. Isner, Сirculation, 1996 Baumgatner I. , et al. , Circulation, 1998

Больные ИБС для терапевтического ангиогенеза – 1. Неоптимальные кандидаты на АКШ и эндоваскулярную реваскуляризацию 2. Рефрактерная стенокардия 3. Неполная реваскуляризация - 10 -15% от всех процедур (плохой прогноз длительной выживаемости).

AGENT: Увеличение времени нагрузки на тредмиле после внутрикоронарного введения Ad 5 FGF-4 (1010 вч) l 79 б-х со стенокардией 2 - 4 класса неоптимальных для реваскуляризации l 3 дозы Ad 5 FGF-4 (3, 2 х108 – 3, 2 х1010 вч) vs плацебо Increase in ETT time, min p=0. 049 2 p=0. 046 Ad 5 FGF-4 (n=22) Placebo (n=19) 1 0 baseline Week 4 Week 12 Grines et al. , JACC 2003, 42: 1339

Улучшение перфузии миокарда после генной терапии

AGENT 2: Уменьшение обратимого дефекта перфузии ЛЖ после внутрикоронарного введения Ad. FGF-4 Абсолютное уменьшение ОДП l 52 б-х со стенокардией 3 -4 класса неоптимальных для реваскуляризации: 35 - на Ad. FGF-4, 17 - на плацебо % p < 0. 001 4 2 0 p = 0. 14 (Δ Ad 5 FGF-4 vs Δ плацебо) - 21% p = 0. 32 p < 0. 05 (при исключении 1 б-го на плацебо) - 8% Ad 5 FGF-4, 1010 вч n = 35 плацебо n = 17 Grines et al. , Circulation 2002, 105: 1291 -7

EUROINJECT- trial ( VEGF-A 165 ) l 80 б-х рандомизированы - плазмида VEGF-A 165 vs плазмида l трансэндокардиальные инъекции (NOGA) в область обратимого дефекта перфузии в ЛЖ Первичная конечная точка : изменение дефекта перфузии (3 мес) % больных 75 p=0, 02 50 - увеличение - без изменений 25 - уменьшение 0 плацебо VEGF-A 165 p = НД Kastrup et al. , JACC 2005, 45: 982

Injection Catheters Universal Guide Catheter Helical Injection Catheter

EUROINJECT- trial ( VEGF-A 165 ) Увеличение локального линейного укорочения ЛЖ в области введения VEGF-A 165 % p=0, 04 12 - исходно 8 исходно - через 3 месяца 4 0 плацебо VEGF-A 165 через 3 месяца Карта локального линейного укорочения ЛЖ (NOGA) Kastrup et al. , JACC 2005, 45: 982

Рандомизированные двойные-слепые исследованния по терапевтическому ангиогенезу с генами факторов роста Trial Больные EUROINJECT One Trial ИБС n =80 Фактор VEGF 165 плазмида В/М инъекции Конечная точка Улучшение перфузии (3 мес. ) Время нагрузки, Улуч. перфузии Результат § отрицательный § частично AGENT Trials ИБС n =464 FGF-4 аденовирус REVASC Trial ИБС n =67 VEGF 121 аденовирус KAT Trial ИБС n =103 VEGF 165 плазмида/ RAVE Trial КИНК n =105 VEGF 121 аденовирус В/М инъекции Время ходьбы (3 мес. ) § отрицательный VEGF PVD Trial КИНК n =54 VEGF 165 плазмида/ Увеличение коллатералей (3 мес. ) § положительный В/К введение В/М инъекции аденовирус, В/К введ. аденовирус В/М инъекции Время нагрузки (6 мес. ) положительный (только по времени нагрузки) §положительный Улучшение перфузии § частично (6 мес. ) положительный (только аденовирус ) Адаптировано из Yla-Herttuala et al. , TCM 2004, 14: 295 -300
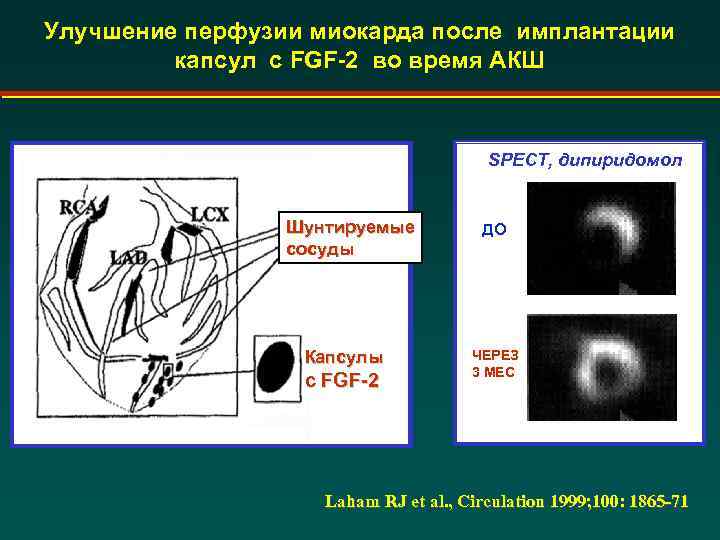
Улучшение перфузии миокарда после имплантации капсул с FGF-2 во время АКШ SPECT, дипиридомол Шунтируемые сосуды Капсулы c FGF-2 ДО ЧЕРЕЗ 3 МЕС Laham RJ et al. , Circulation 1999; 100: 1865 -71

Проблемы ангиогенной терапии и возможные пути их решения Проблемы Нет достаточных доказательств эффективности, особенно длительной Не доказана длительная безопасность Перспективы Длительные контролируемые исследования аденовирусы с низкой иммуногенностью Нет клинических методик объективной оценки ангиогенеза аутологичные клетки для переноса генов недостаточно данных об эндогенных ФА новые факторы ангиогенеза (HGF, ангиопоэтин-1, NO-синтаза и др. ) Низкая эффективность трансфекции у человека аденоассоциированные вирусы Кратковременная экспрессия ангиогенного фактора тканеспецифические промоторы/ регулируемые помоторы Формирование «незрелых» сосудов при введении VEGF оптимальные сочетания генов ФА

Injury induced vessel remodeling (angioplasty) before PTCA after PTCA Lumen area 3 -6 months Neointima after PTCA Out-ward remodeling No restenosis In-ward remodeling Restenosis

Changes in vessel structure two weeks after balloon injury to the rat carotid artery Uninjured artery Injured artery

Генная терапия рестенозов и стенозов венозных шунтов Подавление пролиферации и миграции клеток неоинтимы (si. RNA на регуляторы клеточного цикла, TIMP-1) Стимуляция реэндотелизации (VEGF, ec. SOD, e. NOS, простациклин синтаза в ААV-векторе) Ex vivo трансдукция шунта перед имплантацией (e. NOS - NO вазодилятация, антитромботический эффект, подавление пролиферации и миграции ГМК) (si RNA- для эффективности д. б. доставлена в большое количество клеток)

Внутрисосудистый стент

THE HYDROGEL CATHETER JACC, 1994, 23, 1570 -1577
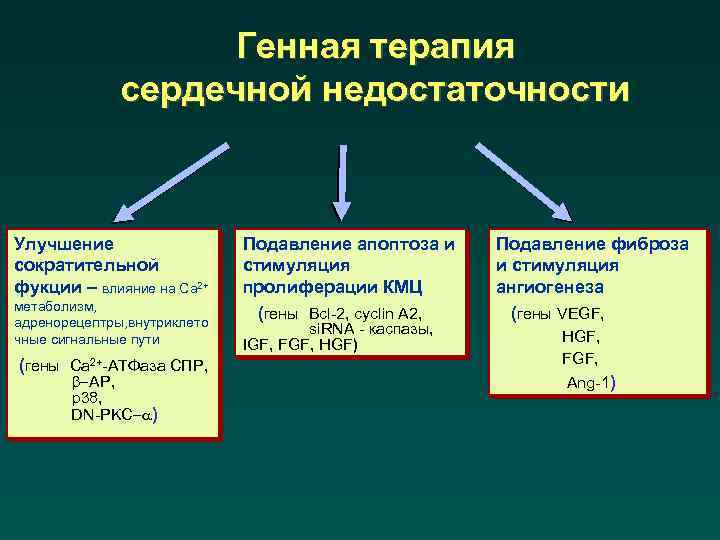
Генная терапия сердечной недостаточности Улучшение сократительной фукции – влияние на Са 2+ метаболизм, адренорецептры, внутриклето чные сигнальные пути (гены Са 2+-АТФаза СПР, b-АР, р38, DN-PKC-a) Подавление апоптоза и стимуляция пролиферации КМЦ (гены Bcl-2, cyclin A 2, si. RNA - каспазы, IGF, FGF, HGF) Подавление фиброза и стимуляция ангиогенеза (гены VEGF, HGF, FGF, Ang-1)

Антитромботическая генная терапия § t. PA § Тромбомодулин § Циклооксигеназа-1 § Ингибитор тканевого фактора § Предсердный натрийуретический пептид (C-тип) § e. NOS

Генная терапия артериальной гипертонии Подавление экспрессии генов, ответственных за повышение АД (ми. РНК ) § Ангиотензиноген § АПФ § АТII-рецепторы 1 § -адренорецепторы Гиперэкспрессия генов, индуцирующих вазодилятацию § Калликреин § Адреномедуллин § ПНФ § e. NOS § Только векторы, обеспечивающие длительную экспрессию могут использоваться для генной терапии АГ и других факторов риска ССЗ

Генная терапия для защиты миокарда от ишемического повреждения – - prophylactic cardioprotection) 1. Ишемическое прекондиционирование – эндогенный защитный механизм, активирующийся умеренным ишемическим стрессом и повышающий способность сердца преодолевать более тяжелый ишемический стресс (вакцинация против ишемии). Murry CE, Jennings RB, Raimer KA Preconditionong with ischemia: a delay of lethal cell injury in ischemic myicardium. Circulation 1986, 74: 1124 -1136. (более 3000 цитирований к 2007 году) В 2006 году более 500 статей по ИП в ведущих журналах.


Ишемическое прекондиционирование - мощный кардиопротективный феномен – уменьшение размера инфаркта до 80 -90% высокая воспроизводимость трудно использовать в клинике Механизм позднего ишемического прекондиционирования - - генетическое репрограммирование сердца так, что оно приобретает защитный фенотип, обусловленный повышением экспрессии кардиопротективных генов


Профилактическая кардиопротекция: Почему именно генная терапия? l Основной случай для профилактической кардиопротекции – острый инфаркт миокарда l Обычно терапия начинается с реперфузии и на стадии реперфузии через несколько часов после начала болевого синдрома, поэтому ее эффективность в плане уменьшения размера инфаркта ограничена l Профилактическое лечение для защиты от ишемического повреждения невозможно l Поэтому решением проблемы может быть длительная индукция в сердце экспрессионного профиля, характерного для ПИП, с помощью генно -терапевтических подходов.




Генная терапия сердечно-сосудистых заболеваний имеет колоссальный потенциал, но пока не реализованный вследствие отсутствия адекватной системы доставки терапевтических генов в клетки сердца и сосудов

Гипотеза – длительная экспрессия в сердце белков, которые опосредуют антиишемический эффект позднего ишемического прекондиционирования должна защищать сердце при возникновении тяжелой ишемии и в течение всего периода ишемического/реперфузионного повреждения
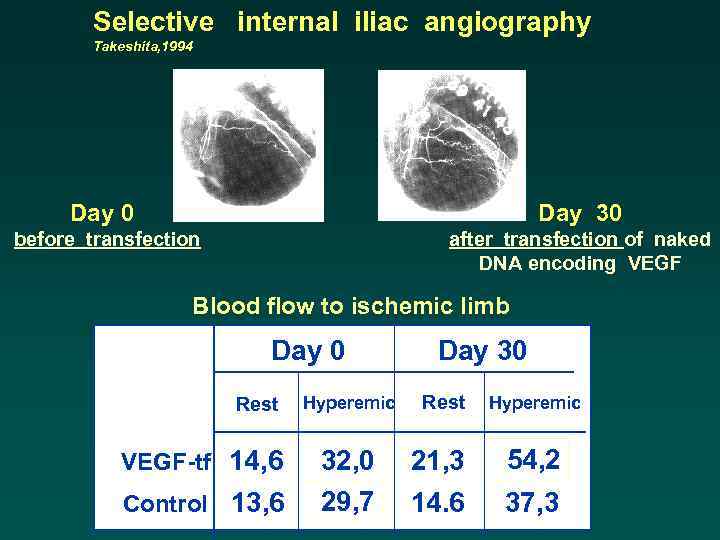
Selective internal iliac angiography Takeshita, 1994 Day 0 Day 30 before transfection after transfection of naked DNA encoding VEGF Blood flow to ischemic limb Day 0 Rest VEGF-tf 14, 6 Control 13, 6 Hyperemic 32, 0 29, 7 Day 30 Rest 21, 3 14. 6 Hyperemic 54, 2 37, 3

NO и CO формируют функциональный кардиопротективный модуль: • • • Увеличение NO ведет к увеличению CO через «up-regulation» HO-1; В то же время увеличение CO ведет к увеличению NO через «up-regulation» ec. SOD и уменьшение инактивации NO. Таким образом эффекты NO и CO невозможно разделить.


M. tibialis anterior свиньи, кролика и мыши

Внутрисосудистый стент Seppo Ylä-Herttuala & Kari Alitalo, Nature Medicine, 2003

Улучшение перфузии и региональной сократимости миокарда после генной терапии p. VEGF-165


Механизм позднего ишемического прекондиционирования - - генетическое репрограммирование сердца так, что оно приобретает защитный фенотип, обусловленный повышением экспрессии кардиопротективных генов

Векторные системы Не вирусные Вирусные ДНК в составе бактериальных плазмид/ «голая» ДНК или ДНК + носитель ДНК в составе вирусных частиц, дефектных по репликации Трансфекция Трансдукция
лекция 24.04.pptфинал.ppt