лекция 11 генная терапия МедФ 29 08 11.ppt
- Количество слайдов: 49
 Генная Терапия Лекция 11
Генная Терапия Лекция 11
 Что такое Генная Терапия? Лечение с помощью генов или лечение самих генов Ген Вектор доставки ( носитель) Генная терапия ориентирована на борьбу с причиной заболевания Генная терапия – лечение с помощью генов, лечение самих генов, лечение путем воздействия на процессы реализации генетической информации: транскрипцию, посттранскрипционные модификаций РНК и трансляцию с целью получения
Что такое Генная Терапия? Лечение с помощью генов или лечение самих генов Ген Вектор доставки ( носитель) Генная терапия ориентирована на борьбу с причиной заболевания Генная терапия – лечение с помощью генов, лечение самих генов, лечение путем воздействия на процессы реализации генетической информации: транскрипцию, посттранскрипционные модификаций РНК и трансляцию с целью получения
 Основные этапы становления генной терапии. Этап- 1 1970 -1990 заложены основы генной терапии 1976 - дефицит аргиназы - вирус папилломы Шоупа (Rogers, 1976) 1980 - талассемия -бета Hb- ген (Klein 1980) 1990 - меланома - Rv vector ex vivo (клеточное маркирование) (Rosenberg 1990)
Основные этапы становления генной терапии. Этап- 1 1970 -1990 заложены основы генной терапии 1976 - дефицит аргиназы - вирус папилломы Шоупа (Rogers, 1976) 1980 - талассемия -бета Hb- ген (Klein 1980) 1990 - меланома - Rv vector ex vivo (клеточное маркирование) (Rosenberg 1990)
 Основные этапы становления генной терапии Этап -2 2 -й этап 1990 -2003. Первые успехи клинических испытаний и трагические инциденты в ходе клинических испытаний. 1990 - дефицит аденозин-дезаминазы -ex vivo, лимфоциты (Blaese, 1990) 14 сентября 1990 года 4 -летней Ашанти Де Силва, страдающей наследственным иммунодефицитом, были пересажены ее собственные Т-лимфоциты, предварительно трансформированные ex vivo геном аденозиндезаминазы. 1992 - семейная гиперхолестеринемия (Grossman 1994) 1991 - муковисцидоз, ген CFTR (Сrystal et al. , 1991) 1993 - глиобластома (интерлейкин) (Sobol 1996) 1999 - Терри Гельсингер - первая смерть вследствие ГТ На 2 -й день после печеночной инфузии аденовирусной конструкции у больного с наследственным дефицитом печеночного фермента орнитинтранскарбамилазы признаки анафилактического шок Смерть на 4 -й день явилась следствием введения генетической конструкции. 2002 - 6 случаев лейкемии при ГТ иммунодефицита ( rv-vector, LMO 2) X-linked SCID - врожденный иммунодефицит*, характеризующийся отсутствием В и Т-лимфоцитов и приводящий к смертельному исходу в первые годы жизни. Ретровирусный вектор интегрировал в проксимальную часть протоонкогена LMO-2 и Активировал пролиферативную активность Т-лимфоцитов. Через 30 месяцев развилась Т-клеточная лейкемия.
Основные этапы становления генной терапии Этап -2 2 -й этап 1990 -2003. Первые успехи клинических испытаний и трагические инциденты в ходе клинических испытаний. 1990 - дефицит аденозин-дезаминазы -ex vivo, лимфоциты (Blaese, 1990) 14 сентября 1990 года 4 -летней Ашанти Де Силва, страдающей наследственным иммунодефицитом, были пересажены ее собственные Т-лимфоциты, предварительно трансформированные ex vivo геном аденозиндезаминазы. 1992 - семейная гиперхолестеринемия (Grossman 1994) 1991 - муковисцидоз, ген CFTR (Сrystal et al. , 1991) 1993 - глиобластома (интерлейкин) (Sobol 1996) 1999 - Терри Гельсингер - первая смерть вследствие ГТ На 2 -й день после печеночной инфузии аденовирусной конструкции у больного с наследственным дефицитом печеночного фермента орнитинтранскарбамилазы признаки анафилактического шок Смерть на 4 -й день явилась следствием введения генетической конструкции. 2002 - 6 случаев лейкемии при ГТ иммунодефицита ( rv-vector, LMO 2) X-linked SCID - врожденный иммунодефицит*, характеризующийся отсутствием В и Т-лимфоцитов и приводящий к смертельному исходу в первые годы жизни. Ретровирусный вектор интегрировал в проксимальную часть протоонкогена LMO-2 и Активировал пролиферативную активность Т-лимфоцитов. Через 30 месяцев развилась Т-клеточная лейкемия.
 Основные этапы становления генной терапии Этап-3 3 -й этап 2003 по наст. время Масштабный переход наиболее удачных лабораторных разработок к стадии клинических испытаний 2003 - первое “ генное лекарство “ Gendicine™ 2006 - разрешение FDA на проведение генной терапии плода
Основные этапы становления генной терапии Этап-3 3 -й этап 2003 по наст. время Масштабный переход наиболее удачных лабораторных разработок к стадии клинических испытаний 2003 - первое “ генное лекарство “ Gendicine™ 2006 - разрешение FDA на проведение генной терапии плода
 Предпосылки для работ по ГТ • Информация о первичном биохимическом дефекте • Выбор стратегии Генной Терапии (мутация, генная сеть) • Наличие необходимого гена (генов), к. ДНК • Генно-инженерная кухня (плазмиды, промоторы , маркерные и терапевтические гены) • Выбор вектора и способов доставки • Эффективная система детекции экспрессии трансгена • Адекватная оценка терапевтического эффекта Этапность тестирования в ГТ • Опыты in vitro (культуры клеток) • Опыты in vivo (биологические модели - мыши) • Опыты in vivo (биологические модели - собаки, свиньи, приматы) Клинические испытания 1 -2 -3 фазы
Предпосылки для работ по ГТ • Информация о первичном биохимическом дефекте • Выбор стратегии Генной Терапии (мутация, генная сеть) • Наличие необходимого гена (генов), к. ДНК • Генно-инженерная кухня (плазмиды, промоторы , маркерные и терапевтические гены) • Выбор вектора и способов доставки • Эффективная система детекции экспрессии трансгена • Адекватная оценка терапевтического эффекта Этапность тестирования в ГТ • Опыты in vitro (культуры клеток) • Опыты in vivo (биологические модели - мыши) • Опыты in vivo (биологические модели - собаки, свиньи, приматы) Клинические испытания 1 -2 -3 фазы
 Фазы клинических испытаний. 1 фаза. Анализ безопасности введения генетических конструкций на отдельных пациентах. 2 фаза. Увеличение числа пациентов и оценка терапевтического эффекта введенных генных конструкций. 3 фаза. Дальнейшее увеличение числа пациентов. Проведение испытаний в нескольких независимых клиниках. Оценка терапевтического эффекта, оптимизация доз вводимых генных конструкций. Подготовка протоколов к утверждению.
Фазы клинических испытаний. 1 фаза. Анализ безопасности введения генетических конструкций на отдельных пациентах. 2 фаза. Увеличение числа пациентов и оценка терапевтического эффекта введенных генных конструкций. 3 фаза. Дальнейшее увеличение числа пациентов. Проведение испытаний в нескольких независимых клиниках. Оценка терапевтического эффекта, оптимизация доз вводимых генных конструкций. Подготовка протоколов к утверждению.
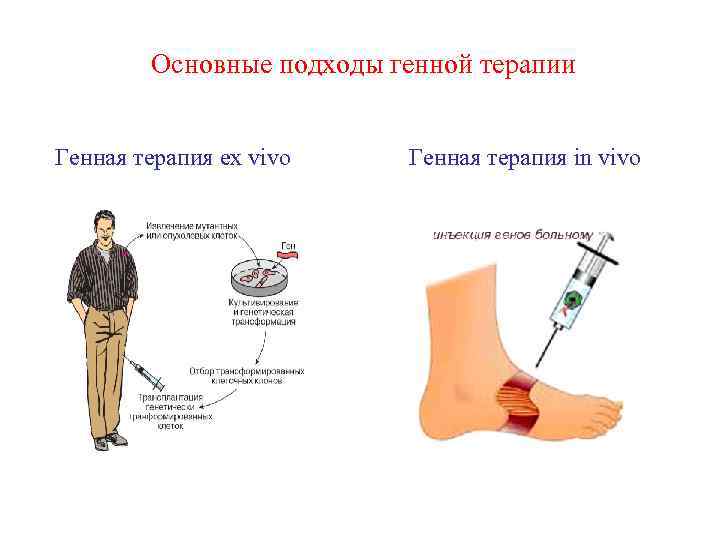 Основные подходы генной терапии Генная терапия ex vivo Генная терапия in vivo
Основные подходы генной терапии Генная терапия ex vivo Генная терапия in vivo
 • • ПРЕИМУЩЕСТВА ГЕННОЙ ТЕРАПИИ (ГТ) ПЛОДА Фетальная ГТ позволяет: Начать лечение в досимптоматическую фазу заболевания Избежать иммунного ответа при введении генных конструкций на 12 -20 неделях беременности Достичь более высокой (терапевтической) концентрации трансгена - клетки С большей эффективностью трансфецировать стволовые клетки
• • ПРЕИМУЩЕСТВА ГЕННОЙ ТЕРАПИИ (ГТ) ПЛОДА Фетальная ГТ позволяет: Начать лечение в досимптоматическую фазу заболевания Избежать иммунного ответа при введении генных конструкций на 12 -20 неделях беременности Достичь более высокой (терапевтической) концентрации трансгена - клетки С большей эффективностью трансфецировать стволовые клетки
 Одна из ключевых проблем генной терапии – эффективная доставка генетической конструкции в клетки пациента "организм человека затратил много тысяч лет, чтоб защитить себя от нападения факторов внешней среды, в т. ч. от чужеродной ДНК, пытавшейся проникнуть в его геном" Фрэнч Андерсона
Одна из ключевых проблем генной терапии – эффективная доставка генетической конструкции в клетки пациента "организм человека затратил много тысяч лет, чтоб защитить себя от нападения факторов внешней среды, в т. ч. от чужеродной ДНК, пытавшейся проникнуть в его геном" Фрэнч Андерсона
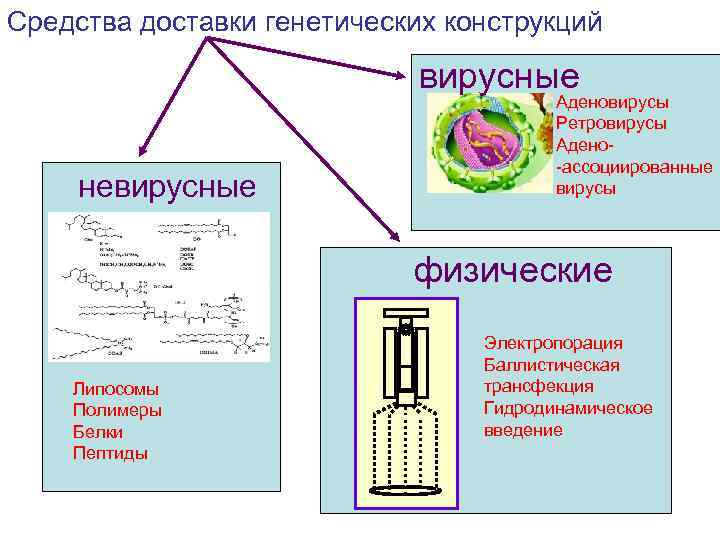 Средства доставки генетических конструкций вирусные невирусные Аденовирусы Ретровирусы Адено-ассоциированные вирусы физические Липосомы Полимеры Белки Пептиды Электропорация Баллистическая трансфекция Гидродинамическое введение
Средства доставки генетических конструкций вирусные невирусные Аденовирусы Ретровирусы Адено-ассоциированные вирусы физические Липосомы Полимеры Белки Пептиды Электропорация Баллистическая трансфекция Гидродинамическое введение
 Вирусные векторы Ретровирусы Адено-ассоциированные вирусы - обеспечивают продолжительную Экспрессию чужеродной ДНК (интеграция в ДНК делящихся и неделящихся клеток ) - Успешная трансфекция - высокая способность к пролиферирующих и трансфекции ex vivo непролиферирующих клеток - сравнительно невысокий НО: - возможность уровень иммуногенности - высокая эффективность инсерционного - длительная экспрессия трансфекции in vivo и ex vivo мутагенеза трансгена за счет его - ограниченный интеграции в геном клетки размер НО: выраженный иммунный хозяина клонированного ответ при повторных введениях НО: - инфицируют только фрагмента ДНК конструкций делящиеся клетки (4 - 5 т. п. н. ) - возможность инсерционного мутагенеза - ограниченный размер клонированного фрагмента (8 т. п. н)
Вирусные векторы Ретровирусы Адено-ассоциированные вирусы - обеспечивают продолжительную Экспрессию чужеродной ДНК (интеграция в ДНК делящихся и неделящихся клеток ) - Успешная трансфекция - высокая способность к пролиферирующих и трансфекции ex vivo непролиферирующих клеток - сравнительно невысокий НО: - возможность уровень иммуногенности - высокая эффективность инсерционного - длительная экспрессия трансфекции in vivo и ex vivo мутагенеза трансгена за счет его - ограниченный интеграции в геном клетки размер НО: выраженный иммунный хозяина клонированного ответ при повторных введениях НО: - инфицируют только фрагмента ДНК конструкций делящиеся клетки (4 - 5 т. п. н. ) - возможность инсерционного мутагенеза - ограниченный размер клонированного фрагмента (8 т. п. н)
 Физические способы доставки генетических конструкций Доставка генных конструкций методом электропорации • разрез кожи • инъекция генетической конструкции в мышцу • наложение электродов и проведение электропорации Эффективность трансфекции зависит от дозы плазмидной ДНК, силы тока и числа импульсов. Экспрессия маркерного гена lac. Z в ядрах мышечных волокон
Физические способы доставки генетических конструкций Доставка генных конструкций методом электропорации • разрез кожи • инъекция генетической конструкции в мышцу • наложение электродов и проведение электропорации Эффективность трансфекции зависит от дозы плазмидной ДНК, силы тока и числа импульсов. Экспрессия маркерного гена lac. Z в ядрах мышечных волокон
 Экспрессия гена lac. Z в мышцах мышей после электропорации p. CMV-Lac. Znls; электрические импульсы: 2 m. A; 20 V; 1 k. Hz Криостатные срезы 7 дней x 20 14 дней x 60
Экспрессия гена lac. Z в мышцах мышей после электропорации p. CMV-Lac. Znls; электрические импульсы: 2 m. A; 20 V; 1 k. Hz Криостатные срезы 7 дней x 20 14 дней x 60
 Преимущества невирусных способов доставки генных конструкций - легко синтезируются - отсутствуют ограничения на размер доставляемого вектора экспрессии. - невирусные носители трансфецируют клетки, находящиеся на любой фазе клеточного цикла - в большинстве случаев носители не вызывают специфического иммунного ответа - безопасны в применении in vivo по сравнению с вирусными векторами.
Преимущества невирусных способов доставки генных конструкций - легко синтезируются - отсутствуют ограничения на размер доставляемого вектора экспрессии. - невирусные носители трансфецируют клетки, находящиеся на любой фазе клеточного цикла - в большинстве случаев носители не вызывают специфического иммунного ответа - безопасны в применении in vivo по сравнению с вирусными векторами.
 Болезни - кандидаты для генной терапии
Болезни - кандидаты для генной терапии
 Способы доставки генных конструкций в клинических испытаниях
Способы доставки генных конструкций в клинических испытаниях
 Число протоколов по генной терапии в мире на разных фазах клинических испытаний в 2001 и в 2009 гг. Общее число протоколов клинических испытаний по генной терапии в мире увеличилось с 425 в 2001 г до 1537 в 2009 г.
Число протоколов по генной терапии в мире на разных фазах клинических испытаний в 2001 и в 2009 гг. Общее число протоколов клинических испытаний по генной терапии в мире увеличилось с 425 в 2001 г до 1537 в 2009 г.
 Число клинических испытаний по генной терапии в разных странах
Число клинических испытаний по генной терапии в разных странах
 Много ли Генной Терапии в Мире ? • Всего около 2 000 лабораторий. • Число публикаций по ГТ в 2008 г. в 3 раза больше, чем за 5 предшествующих лет. • Национальный Институт Здоровья (США) выделил на ГТ в 2004 г. 427, 7 млн. $$. • В 2009 г. >1 500 официальных проектов по генной терапии. • Разрешение FDA на генную терапию плода - февраль 2006 г. в России? • 10 лабораторий - 3 клинических испытания (1 зарегистрировано). - боковой асмиотрофический склероз –Ин-т неврологии Москва - облитерирующий эндартерит, инфаркт – Н. П. Бочков, Е. Д. Свердлов - опухоли – Ин-т онкологии ((СПб), Ин-т биологии гена РАН (Москва) - СМА – фармакогенетический вариант, вальпроевая к-та ИАГ им. Отта РАМН
Много ли Генной Терапии в Мире ? • Всего около 2 000 лабораторий. • Число публикаций по ГТ в 2008 г. в 3 раза больше, чем за 5 предшествующих лет. • Национальный Институт Здоровья (США) выделил на ГТ в 2004 г. 427, 7 млн. $$. • В 2009 г. >1 500 официальных проектов по генной терапии. • Разрешение FDA на генную терапию плода - февраль 2006 г. в России? • 10 лабораторий - 3 клинических испытания (1 зарегистрировано). - боковой асмиотрофический склероз –Ин-т неврологии Москва - облитерирующий эндартерит, инфаркт – Н. П. Бочков, Е. Д. Свердлов - опухоли – Ин-т онкологии ((СПб), Ин-т биологии гена РАН (Москва) - СМА – фармакогенетический вариант, вальпроевая к-та ИАГ им. Отта РАМН
 Генная терапия нервно-мышечных заболеваний
Генная терапия нервно-мышечных заболеваний
 Актуальность проблемы лечения нервно-мышечных заболеваний Нервно-мышечные болезни затрагивают более чем 300 000 человек в Европе и еще приблизительно 2. 2 миллиона пациентов во всем мире. Финансовый аспект. Стоимость комплексной диагностики и лечения нервно-мышечных заболеваний очень высока. Амбулаторная стоимость лечебных и реабилитационных мероприятий одного обездвиженного пациента с ДМД считается самой высокой среди всех болезней и оценивается в сумму между $400 -500 000 в год. Наследственные нервно-мышечные заболевания Наиболее распространенным наследственным нервно-мышечным заболеванием человека являются мышечная дистрофия Дюшенна и спинальная мышечная атрофия (СМА). Их частота составляет около 1: 3000 новорожденных.
Актуальность проблемы лечения нервно-мышечных заболеваний Нервно-мышечные болезни затрагивают более чем 300 000 человек в Европе и еще приблизительно 2. 2 миллиона пациентов во всем мире. Финансовый аспект. Стоимость комплексной диагностики и лечения нервно-мышечных заболеваний очень высока. Амбулаторная стоимость лечебных и реабилитационных мероприятий одного обездвиженного пациента с ДМД считается самой высокой среди всех болезней и оценивается в сумму между $400 -500 000 в год. Наследственные нервно-мышечные заболевания Наиболее распространенным наследственным нервно-мышечным заболеванием человека являются мышечная дистрофия Дюшенна и спинальная мышечная атрофия (СМА). Их частота составляет около 1: 3000 новорожденных.
 Миодистрофия Дюшенна Наиболее частое сцепленное с полом наследственное заболевание человека Мутации в гене дистрофина являются первичным дефектом, обуславливающим нарушение целостности мембраны мышечных волокон. Мышечные клетки теряют способность поддерживать гомеостаз , дегенерируют и постепенно замещаются соединительной тканью, вызывая прогрессирующую мышечную слабость. Проблемы терапии миодистрофии Дюшенна • Системность патологических процессов • Затруднения в доставке генов или других активных агентов процессами соединительно- тканного замещения • Большой размер гена и к. ДНК • Высокая частота спонтанных мутаций ( до 30 процентов ) Наиболее перспективный подход к лечению МДД – генная терапия
Миодистрофия Дюшенна Наиболее частое сцепленное с полом наследственное заболевание человека Мутации в гене дистрофина являются первичным дефектом, обуславливающим нарушение целостности мембраны мышечных волокон. Мышечные клетки теряют способность поддерживать гомеостаз , дегенерируют и постепенно замещаются соединительной тканью, вызывая прогрессирующую мышечную слабость. Проблемы терапии миодистрофии Дюшенна • Системность патологических процессов • Затруднения в доставке генов или других активных агентов процессами соединительно- тканного замещения • Большой размер гена и к. ДНК • Высокая частота спонтанных мутаций ( до 30 процентов ) Наиболее перспективный подход к лечению МДД – генная терапия
 Начало исследований в области генной терапии наследственных нервно – мышечных болезней – 1992 г (Stratford-Pirrecaudet et al Widespread long-term gene transfer to mouse skeletal muscles and heart / J. Clin. Invest. – 1992 Итог первых 10 лет исследований – разработка и успешная апробация на животных моделях 3 -х подходов к лечению МДД и других нервномышечных заболеваний. Заместительная терапия коррекция дефекта путем введения нормальных копий к. ДНК гена Коррекционная терапия коррекция мутаций на уровне гена или РНК- транскрипта Компенсационная терапия активация генов препятствующих развитию патологических процессов Все вышеперечисленные стратегии лечения используются в настоящее время в клинических испытаниях по лечению наследственных НМЗ
Начало исследований в области генной терапии наследственных нервно – мышечных болезней – 1992 г (Stratford-Pirrecaudet et al Widespread long-term gene transfer to mouse skeletal muscles and heart / J. Clin. Invest. – 1992 Итог первых 10 лет исследований – разработка и успешная апробация на животных моделях 3 -х подходов к лечению МДД и других нервномышечных заболеваний. Заместительная терапия коррекция дефекта путем введения нормальных копий к. ДНК гена Коррекционная терапия коррекция мутаций на уровне гена или РНК- транскрипта Компенсационная терапия активация генов препятствующих развитию патологических процессов Все вышеперечисленные стратегии лечения используются в настоящее время в клинических испытаниях по лечению наследственных НМЗ
 Заместительная терапия с использованием плазмидных векторов доставки Франция 2003 год Компания Transgene и Французская ассоциация нервно-мышечных заболеваний (AFM) начали I фазу клинических испытаний по генной терапии МДД c использованием плазмидных конструкций. Dystrophin m. RNA Dystrophin 3 недели после введения плазмиды : • у 6 из 9 пациентов была обнаружена экспрессия дистрофина (5 -10 % ДПМВ) Настоящее время: Компания Transgene приступила к фазе I-II клинических испытаний генотерапии МДД с доставкой плазмидной ДНК методом Pathway IV TM. Заместительная терапия с использованием вирусных векторов доставки 2006 год В США запущен первый клинический протокол по доставке гена дистрофина в составе аденоассоциированных вирусов. 9 пациентов в возрасте более 10 лет Клинические испытания должны были быть закончены в декабре 2008 года
Заместительная терапия с использованием плазмидных векторов доставки Франция 2003 год Компания Transgene и Французская ассоциация нервно-мышечных заболеваний (AFM) начали I фазу клинических испытаний по генной терапии МДД c использованием плазмидных конструкций. Dystrophin m. RNA Dystrophin 3 недели после введения плазмиды : • у 6 из 9 пациентов была обнаружена экспрессия дистрофина (5 -10 % ДПМВ) Настоящее время: Компания Transgene приступила к фазе I-II клинических испытаний генотерапии МДД с доставкой плазмидной ДНК методом Pathway IV TM. Заместительная терапия с использованием вирусных векторов доставки 2006 год В США запущен первый клинический протокол по доставке гена дистрофина в составе аденоассоциированных вирусов. 9 пациентов в возрасте более 10 лет Клинические испытания должны были быть закончены в декабре 2008 года
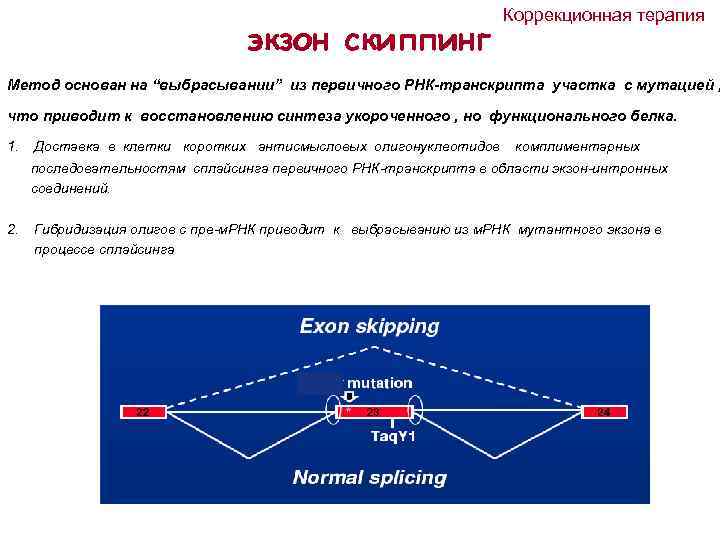 экзон скиппинг Коррекционная терапия Метод основан на “выбрасывании” из первичного РНК-транскрипта участка с мутацией , что приводит к восстановлению синтеза укороченного , но функционального белка. 1. Доставка в клетки коротких антисмысловых олигонуклеотидов комплиментарных последовательностям сплайсинга первичного РНК-транскрипта в области экзон-интронных соединений. 2. Гибридизация олигов с пре-м. РНК приводит к выбрасыванию из м. РНК мутантного экзона в процессе сплайсинга
экзон скиппинг Коррекционная терапия Метод основан на “выбрасывании” из первичного РНК-транскрипта участка с мутацией , что приводит к восстановлению синтеза укороченного , но функционального белка. 1. Доставка в клетки коротких антисмысловых олигонуклеотидов комплиментарных последовательностям сплайсинга первичного РНК-транскрипта в области экзон-интронных соединений. 2. Гибридизация олигов с пре-м. РНК приводит к выбрасыванию из м. РНК мутантного экзона в процессе сплайсинга
 Результаты предклинических испытаний : высокая эффективность метода !!!!!!! После семи инъекций олигонуклеотидов во всех мышцах скелетной мускулатуры в диафрагме мышей mdx регистрировалось более 70% клеток с экспрессией дистрофина. Клинические испытания по лечению МДД с использованием антисенс олигонуклеотидов 2006 -2007 год Нидерланды ; 2007 год Великобритания 1 -я фаза клинических испытаний по лечению МДД с использованием антисенс олигонуклеотидов. 4 и 9 пациентов в возрасте 10 -14 лет. Изучение безопасности введения и эффективности удаления экзона 51 после в/м введения АСО. Для всех пациентов показано возобновление синтеза дистрофина в пораженных мышцах 2009 год Только данная система олигонуклеотидов адаптированная для удаления несущего мутации экзона 51 может помочь в лечении около 17 % пациентов с МДД !!! Всего данный метод может быть использован для лечения до 85% пациентов с МДД !!! Ведется подготовка клинических испытаний с использованием экзон скиппинга по лечению миотонической дистрофии, спинной мускульной атрофии, и болезни Хантингтона,
Результаты предклинических испытаний : высокая эффективность метода !!!!!!! После семи инъекций олигонуклеотидов во всех мышцах скелетной мускулатуры в диафрагме мышей mdx регистрировалось более 70% клеток с экспрессией дистрофина. Клинические испытания по лечению МДД с использованием антисенс олигонуклеотидов 2006 -2007 год Нидерланды ; 2007 год Великобритания 1 -я фаза клинических испытаний по лечению МДД с использованием антисенс олигонуклеотидов. 4 и 9 пациентов в возрасте 10 -14 лет. Изучение безопасности введения и эффективности удаления экзона 51 после в/м введения АСО. Для всех пациентов показано возобновление синтеза дистрофина в пораженных мышцах 2009 год Только данная система олигонуклеотидов адаптированная для удаления несущего мутации экзона 51 может помочь в лечении около 17 % пациентов с МДД !!! Всего данный метод может быть использован для лечения до 85% пациентов с МДД !!! Ведется подготовка клинических испытаний с использованием экзон скиппинга по лечению миотонической дистрофии, спинной мускульной атрофии, и болезни Хантингтона,
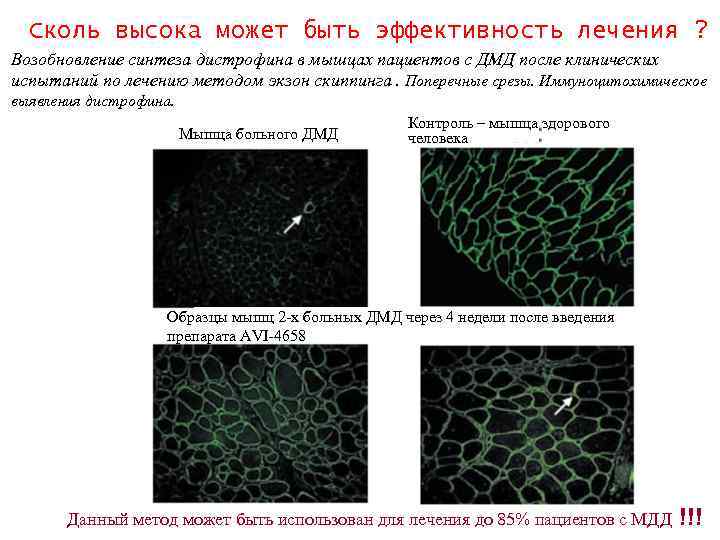 Сколь высока может быть эффективность лечения ? Возобновление синтеза дистрофина в мышцах пациентов с ДМД после клинических испытаний по лечению методом экзон скиппинга. Поперечные срезы. Иммуноцитохимическое выявления дистрофина. Мышца больного ДМД Контроль – мышца здорового человека Образцы мышц 2 -х больных ДМД через 4 недели после введения препарата AVI-4658 Данный метод может быть использован для лечения до 85% пациентов с МДД !!!
Сколь высока может быть эффективность лечения ? Возобновление синтеза дистрофина в мышцах пациентов с ДМД после клинических испытаний по лечению методом экзон скиппинга. Поперечные срезы. Иммуноцитохимическое выявления дистрофина. Мышца больного ДМД Контроль – мышца здорового человека Образцы мышц 2 -х больных ДМД через 4 недели после введения препарата AVI-4658 Данный метод может быть использован для лечения до 85% пациентов с МДД !!!
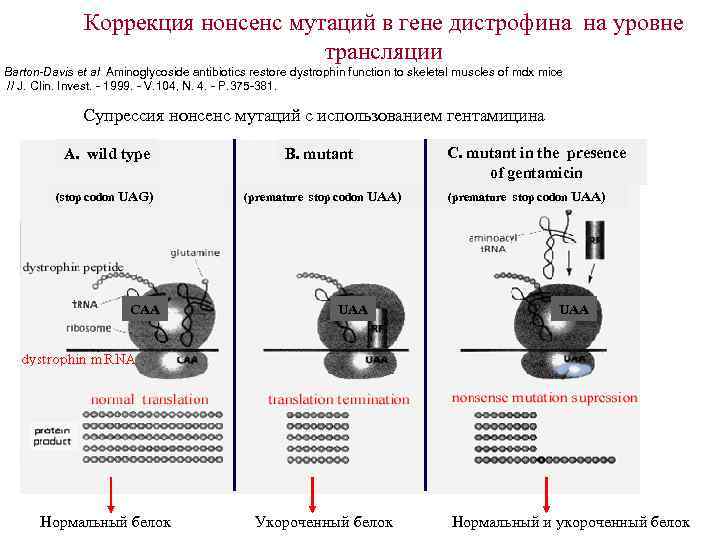 Коррекция нонсенс мутаций в гене дистрофина на уровне трансляции Barton-Davis et al Aminoglycoside antibiotics restore dystrophin function to skeletal muscles of mdx mice // J. Clin. Invest. - 1999. - V. 104, N. 4. - P. 375 -381. Супрессия нонсенс мутаций с использованием гентамицина A. wild type (stop codon UAG) CAA Нормальный белок B. mutant (premature stop codon UAA) UAA Укороченный белок C. mutant in the presence of gentamicin (premature stop codon UAA) UAA Нормальный и укороченный белок
Коррекция нонсенс мутаций в гене дистрофина на уровне трансляции Barton-Davis et al Aminoglycoside antibiotics restore dystrophin function to skeletal muscles of mdx mice // J. Clin. Invest. - 1999. - V. 104, N. 4. - P. 375 -381. Супрессия нонсенс мутаций с использованием гентамицина A. wild type (stop codon UAG) CAA Нормальный белок B. mutant (premature stop codon UAA) UAA Укороченный белок C. mutant in the presence of gentamicin (premature stop codon UAA) UAA Нормальный и укороченный белок
 Коррекция нонсенс мутаций на уровне трансляции. Компания PTC Therapeutics Скрининг 590 000 кандидатных соединений 4 из которых обладали выраженным эффектом. Наибольшая эффективность - PTC 124 2006 -2007 г. Фаза 2 клинических испытаний по супрессии нонсенс мутаций с использованием препарата PTC 124. Дизайн: 26 пациентов в возрасте 9 и 10 лет Прием различных доз PTC 124 перорально 28 дней дважды в день Результаты исследований (2007 г ) : Уровень маркерных белков поврежденных мышечных волокон, в результате терапии PTC 124 значительно снижался. • У некоторых пациентов было отмечено улучшение функционального состояния мышц. • У всех пациентов показано дозо- зависимое увеличение синтеза дистрофина. • Отмечена хорошая переносимость препарата и отсутствие побочных эффектов.
Коррекция нонсенс мутаций на уровне трансляции. Компания PTC Therapeutics Скрининг 590 000 кандидатных соединений 4 из которых обладали выраженным эффектом. Наибольшая эффективность - PTC 124 2006 -2007 г. Фаза 2 клинических испытаний по супрессии нонсенс мутаций с использованием препарата PTC 124. Дизайн: 26 пациентов в возрасте 9 и 10 лет Прием различных доз PTC 124 перорально 28 дней дважды в день Результаты исследований (2007 г ) : Уровень маркерных белков поврежденных мышечных волокон, в результате терапии PTC 124 значительно снижался. • У некоторых пациентов было отмечено улучшение функционального состояния мышц. • У всех пациентов показано дозо- зависимое увеличение синтеза дистрофина. • Отмечена хорошая переносимость препарата и отсутствие побочных эффектов.
 Ближайшие перспективы PTC 124 Февраль 2009 Старт испытаний препарата PTC 124 фазы 2 b Для участия отобраны 165 пациентов с МДД В испытания вовлечены 14 стран ЕС, США, Канада 2010 г - возможно привлечение пациентов РФ
Ближайшие перспективы PTC 124 Февраль 2009 Старт испытаний препарата PTC 124 фазы 2 b Для участия отобраны 165 пациентов с МДД В испытания вовлечены 14 стран ЕС, США, Канада 2010 г - возможно привлечение пациентов РФ
 Компенсационная терапия МДД Активация гомологов дистрофина или других генов препятствующих развитию патологических изменений мышечных клеток
Компенсационная терапия МДД Активация гомологов дистрофина или других генов препятствующих развитию патологических изменений мышечных клеток
 Миостатин – член семейства трансфоримирующих факторов роста β, угнетающих ( негативно регулирующий) рост скелетной мускулатуры. Мышь дикого типа ( wild type) и мышь с “выключенным “ миостатиновым геном (Mstn -/-) Замедление развития патологических процессов в мышцах мышей Mdx с “ выключенным “ геном миостатина mdx / Mstn -/- wt
Миостатин – член семейства трансфоримирующих факторов роста β, угнетающих ( негативно регулирующий) рост скелетной мускулатуры. Мышь дикого типа ( wild type) и мышь с “выключенным “ миостатиновым геном (Mstn -/-) Замедление развития патологических процессов в мышцах мышей Mdx с “ выключенным “ геном миостатина mdx / Mstn -/- wt
 Чем или как можно “выключить” Миостатин у больных миопатиями ?
Чем или как можно “выключить” Миостатин у больных миопатиями ?
 Nature Medicine - 12, 1147 - 1150 (2006) 8 институтов Италии и США 18 авторов Резюме: Показано, что внутрибрюшинные инъекции антибиотика Трихостатина А, мышам с мутациями а генах дистрофина или альфа саркогликана подавляют экспрессию миостатина. Результатом явилось восстановление мышечной массы, и предотвращение развития патологических процессов характерных для мышечных дистрофий.
Nature Medicine - 12, 1147 - 1150 (2006) 8 институтов Италии и США 18 авторов Резюме: Показано, что внутрибрюшинные инъекции антибиотика Трихостатина А, мышам с мутациями а генах дистрофина или альфа саркогликана подавляют экспрессию миостатина. Результатом явилось восстановление мышечной массы, и предотвращение развития патологических процессов характерных для мышечных дистрофий.
 Результаты 3 -х месячных исследований влияния трихостатина- А на развитие патологических изменений и физиологические характеристики мышц у мышей mdx Морфологические улучшения • Отмечается прогрессивное увеличение размера миофибрилл во всех группах мышц. • Предотвращается развитие соединительно тканного замещения и воспалительной инфильтрации в мышцах Физиологические улучшения • По результатам тестов было показано восстановление сила мышц всего тела практически до норм уровня.
Результаты 3 -х месячных исследований влияния трихостатина- А на развитие патологических изменений и физиологические характеристики мышц у мышей mdx Морфологические улучшения • Отмечается прогрессивное увеличение размера миофибрилл во всех группах мышц. • Предотвращается развитие соединительно тканного замещения и воспалительной инфильтрации в мышцах Физиологические улучшения • По результатам тестов было показано восстановление сила мышц всего тела практически до норм уровня.
 Спинальная мышечная атрофия - одно из наиболее частых наследственных нейромышечных заболеваний. Заболевание обусловлено гибелью моторных нейронов передних рогов спинного мозга. тип I - острая форма ( болезнь Верднига-Гоффмана) проявляется в первые шесть месяцев жизни и приводит к летальному исходу к двум годам. тип II - средняя (промежуточная) форма (болезнь Дубовича) с летальным исходом после 2 -х лет. тип III - хроническая форма (болезнь Кугельберга-Веландер) Время манифестации заболевания колеблется от 2 х до 17 лет.
Спинальная мышечная атрофия - одно из наиболее частых наследственных нейромышечных заболеваний. Заболевание обусловлено гибелью моторных нейронов передних рогов спинного мозга. тип I - острая форма ( болезнь Верднига-Гоффмана) проявляется в первые шесть месяцев жизни и приводит к летальному исходу к двум годам. тип II - средняя (промежуточная) форма (болезнь Дубовича) с летальным исходом после 2 -х лет. тип III - хроническая форма (болезнь Кугельберга-Веландер) Время манифестации заболевания колеблется от 2 х до 17 лет.
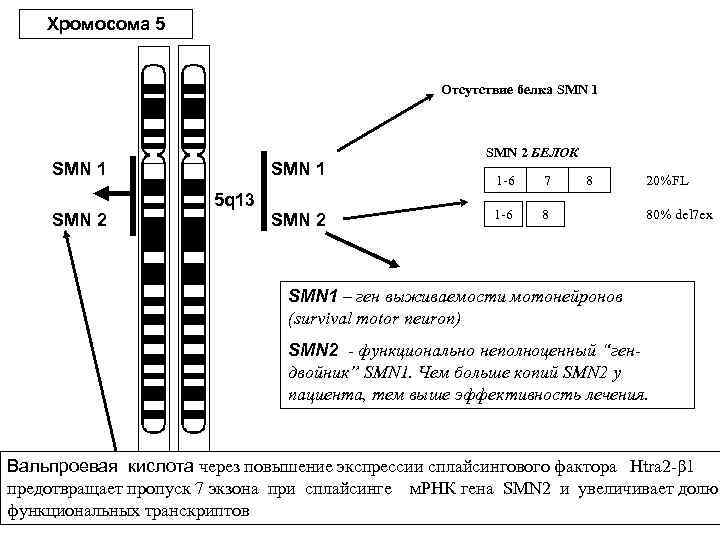 Хромосома 5 Отсутствие белка SMN 1 SMN 2 SMN 1 5 q 13 SMN 2 БЕЛОК 1 -6 7 1 -6 8 8 20%FL 80% del 7 ex SMN 1 – ген выживаемости мотонейронов (survival motor neuron) SMN 2 - функционально неполноценный “гендвойник” SMN 1. Чем больше копий SMN 2 у пациента, тем выше эффективность лечения. Вальпроевая кислота через повышение экспрессии сплайсингового фактора Htra 2 -β 1 предотвращает пропуск 7 экзона при сплайсинге м. РНК гена SMN 2 и увеличивает долю функциональных транскриптов
Хромосома 5 Отсутствие белка SMN 1 SMN 2 SMN 1 5 q 13 SMN 2 БЕЛОК 1 -6 7 1 -6 8 8 20%FL 80% del 7 ex SMN 1 – ген выживаемости мотонейронов (survival motor neuron) SMN 2 - функционально неполноценный “гендвойник” SMN 1. Чем больше копий SMN 2 у пациента, тем выше эффективность лечения. Вальпроевая кислота через повышение экспрессии сплайсингового фактора Htra 2 -β 1 предотвращает пропуск 7 экзона при сплайсинге м. РНК гена SMN 2 и увеличивает долю функциональных транскриптов
 Первая публикация российских авторов: ПЕРВЫЙ ОПЫТ ЛЕЧЕНИЯ БОЛЬНЫХ СПИНАЛЬНОЙ МЫШЕЧНОЙ АТРОФИЕЙ ПРЕПАРАТОМ ВАЛЬПРОЕВОЙ КИСЛОТЫ В. С. Баранов, В. Г. Вахарловский, В. Н. Команцев, О. С. Глотов, А. В. Киселев МЕД. ГЕНЕТИКА 2005 Т. 4, С. 119 -122. Некоторые итоги лечения 11 больных СМА тип 2. Период наблюдения – 6 мес. - 3, 3 года 2 больных, 9 и 15 лет. Конвулекса в течение 6 мес. Положительной динамики не выявлено. 9 больных, 2, 2 до 11 лет. Конвулекс от 6 мес. до 3, 3 лет. На фоне лечения отмечены положительные изменения двигательной активности и электронейромиографических показателей мышц разной степени выраженности. У 2 -х пациентов отмечен выраженный положительный эффект : больные обрели способность к самостоятельной ходьбе. Первые результаты лечения отмечаются в среднем через 5 -6 мес. Выводы: Существует индивидуальная восприимчивость к лечению ВК у пациентов со СМА. Для оценки эффективности лечения необходим мониторинг уровня полноразмерной м. РНК SMN 2 , в сочетании с функциональными тестами.
Первая публикация российских авторов: ПЕРВЫЙ ОПЫТ ЛЕЧЕНИЯ БОЛЬНЫХ СПИНАЛЬНОЙ МЫШЕЧНОЙ АТРОФИЕЙ ПРЕПАРАТОМ ВАЛЬПРОЕВОЙ КИСЛОТЫ В. С. Баранов, В. Г. Вахарловский, В. Н. Команцев, О. С. Глотов, А. В. Киселев МЕД. ГЕНЕТИКА 2005 Т. 4, С. 119 -122. Некоторые итоги лечения 11 больных СМА тип 2. Период наблюдения – 6 мес. - 3, 3 года 2 больных, 9 и 15 лет. Конвулекса в течение 6 мес. Положительной динамики не выявлено. 9 больных, 2, 2 до 11 лет. Конвулекс от 6 мес. до 3, 3 лет. На фоне лечения отмечены положительные изменения двигательной активности и электронейромиографических показателей мышц разной степени выраженности. У 2 -х пациентов отмечен выраженный положительный эффект : больные обрели способность к самостоятельной ходьбе. Первые результаты лечения отмечаются в среднем через 5 -6 мес. Выводы: Существует индивидуальная восприимчивость к лечению ВК у пациентов со СМА. Для оценки эффективности лечения необходим мониторинг уровня полноразмерной м. РНК SMN 2 , в сочетании с функциональными тестами.
 Сравнительная динамика сократительной способности мышцы бедра больной Г. К. , 11 лет в условных (пороговых) единицах (усл. ед. ) амплитуды электрической активности в период процедур массажа и приема вальпроевой кислоты двуглавая Квадраты - m. biceps femoris sin. ; кружки – m. biceps femoris dextr. ; кривая – усредненные показатели для m. biceps femoris sin; четырехглавая Квадраты - m. rectus femoris sin. ; кружки – m. rectus femoris dextr. ; кривые – усредненные показатели; 1 - начало массажа; 2 - конец массажа; 3 - начало приема ВК по 600 мг/день; 4 начало приема ВК по 800 мг/день. По оси абсцисс – дни наблюдения за больной, по оси ординат – уровень электрической активности мышц в усл. ед.
Сравнительная динамика сократительной способности мышцы бедра больной Г. К. , 11 лет в условных (пороговых) единицах (усл. ед. ) амплитуды электрической активности в период процедур массажа и приема вальпроевой кислоты двуглавая Квадраты - m. biceps femoris sin. ; кружки – m. biceps femoris dextr. ; кривая – усредненные показатели для m. biceps femoris sin; четырехглавая Квадраты - m. rectus femoris sin. ; кружки – m. rectus femoris dextr. ; кривые – усредненные показатели; 1 - начало массажа; 2 - конец массажа; 3 - начало приема ВК по 600 мг/день; 4 начало приема ВК по 800 мг/день. По оси абсцисс – дни наблюдения за больной, по оси ординат – уровень электрической активности мышц в усл. ед.
 Пилотные клинические испытания лечения СМА с помощью ВК (Brichta Wirth et al. , 2006). 2006 год Кельн, Германия 1. 2. 2. 3. 4. У из 7 из 20 пациентов лечение ВК привело к увеличению уровня полноразмерной м. РНК. Улучшение клинических симптомов СМА наблюдали у 50% пациентов через 5 -6 мес. после начала лечения.
Пилотные клинические испытания лечения СМА с помощью ВК (Brichta Wirth et al. , 2006). 2006 год Кельн, Германия 1. 2. 2. 3. 4. У из 7 из 20 пациентов лечение ВК привело к увеличению уровня полноразмерной м. РНК. Улучшение клинических симптомов СМА наблюдали у 50% пациентов через 5 -6 мес. после начала лечения.
 Ангиогенная активность плазмиды с геном VEGF-1 испытании на модели ишемии конечности в эксперименте (крысы) среднее количество капилляров в одном поле зрения мышечной ткани Среднее кол-во капилляров 35 30 Капилляры 34, 98 p < 0, 01 25 19, 73 20 15 10 CELO Ang (опыт) PBS (контроль) Птичий вирус, несущий ген ангиогенина Окраска азокармином по Гейденгайну. х 280. Н. П. БОЧКОВ, Е. Д. СВЕРДЛОВ
Ангиогенная активность плазмиды с геном VEGF-1 испытании на модели ишемии конечности в эксперименте (крысы) среднее количество капилляров в одном поле зрения мышечной ткани Среднее кол-во капилляров 35 30 Капилляры 34, 98 p < 0, 01 25 19, 73 20 15 10 CELO Ang (опыт) PBS (контроль) Птичий вирус, несущий ген ангиогенина Окраска азокармином по Гейденгайну. х 280. Н. П. БОЧКОВ, Е. Д. СВЕРДЛОВ
 Реакция гиперчувствительности замедленного типа в ответ на введение вакцины, модифицированной геном tag 7*. Иммуногистохимическое исследование биопсии мест введения (выявляются: CD 1 a, CD 3, CD 4, CD 8, CD 14, CD 83) В. М. МОИСЕЕНКО Г. П. ГЕОРГИЕВ CD 3+ “Bystander” effect CD 8+ Больной П. , 53 г. * - ген цитокина, участвующего во врожденном иммунитете
Реакция гиперчувствительности замедленного типа в ответ на введение вакцины, модифицированной геном tag 7*. Иммуногистохимическое исследование биопсии мест введения (выявляются: CD 1 a, CD 3, CD 4, CD 8, CD 14, CD 83) В. М. МОИСЕЕНКО Г. П. ГЕОРГИЕВ CD 3+ “Bystander” effect CD 8+ Больной П. , 53 г. * - ген цитокина, участвующего во врожденном иммунитете
 Генная терапия мультифакториальных болезней Всего более 100 проектов на Фазе 2 испытаний • Ишемия сердечной мышцы-VEGF, b. FGF 4 • Инфаркт миокарда ( VEGF, b. FGF 4, CTFs (Cardiac Тranscription Factors) • Атеросклероз (Apo. E, Apo. A 1) • Нейродегенеративные заболевания (GDNF, BDNF, MNTF, GABA, CNTF, SOD 2, CP 2, BCLk, β-sinuclein) • Ревматизм, аллергические заболевания (блок TNFα, IL 12) • Онкологические заболевания: гены самоубийцы - CD (Cytosine Deaminase) гены лекарственной устойчивости (DHFR, MDR 1, MGMT) гены высокой иммунной реактивности (IL 2, Interferon γ) блок онкогенов (si. RNA, antisence RNA) блок васкуляризации опухоли (ангиотензин, эндотоксин) • Диабет тип I (Pdx-1, IGF) • Трофические язвы (VEGF, HGF, PGIS, FOX 2 c)
Генная терапия мультифакториальных болезней Всего более 100 проектов на Фазе 2 испытаний • Ишемия сердечной мышцы-VEGF, b. FGF 4 • Инфаркт миокарда ( VEGF, b. FGF 4, CTFs (Cardiac Тranscription Factors) • Атеросклероз (Apo. E, Apo. A 1) • Нейродегенеративные заболевания (GDNF, BDNF, MNTF, GABA, CNTF, SOD 2, CP 2, BCLk, β-sinuclein) • Ревматизм, аллергические заболевания (блок TNFα, IL 12) • Онкологические заболевания: гены самоубийцы - CD (Cytosine Deaminase) гены лекарственной устойчивости (DHFR, MDR 1, MGMT) гены высокой иммунной реактивности (IL 2, Interferon γ) блок онкогенов (si. RNA, antisence RNA) блок васкуляризации опухоли (ангиотензин, эндотоксин) • Диабет тип I (Pdx-1, IGF) • Трофические язвы (VEGF, HGF, PGIS, FOX 2 c)
 Имеющиеся на фармацевтическом рынке или близкие к широкому внедрению “ генные лекарства “ Разрешен к применению 16 Октября 2003 State Food and Drug Administration of China Gendicine™ (компания Si. Biono Genetechnologies) – рекомбинантный аденовирус с геном супрессором опухолей p 53 для комбинированого с радиотерапией лечения больных злокачественными новообразованиями головы и шеи В КНР лечение с использованием Gendicine™ прошли несколько тысяч пациентов Эффективность данного препарата ставится под сомнение некоторыми экспертами. Аналог : Advexin™ (INGN 201; Introgen; Austin, TX, USA)
Имеющиеся на фармацевтическом рынке или близкие к широкому внедрению “ генные лекарства “ Разрешен к применению 16 Октября 2003 State Food and Drug Administration of China Gendicine™ (компания Si. Biono Genetechnologies) – рекомбинантный аденовирус с геном супрессором опухолей p 53 для комбинированого с радиотерапией лечения больных злокачественными новообразованиями головы и шеи В КНР лечение с использованием Gendicine™ прошли несколько тысяч пациентов Эффективность данного препарата ставится под сомнение некоторыми экспертами. Аналог : Advexin™ (INGN 201; Introgen; Austin, TX, USA)
 2006 год – препарат Oncorine™ (Chinese Shanghai Sunway Biotech ) рекомбинантный аденовирус с геном супрессором опухолей p 53 для лечения больных злокачественными новообразованиями головы и шеи, глиом, рака легких , рака яичников Для некоторых онкологических заболеваний после лечения с использованием Oncorine™ в комбинации с химеотерапией по результатам оценки с использованием критериев ВОЗ регрессия опухолей происходила в 75. 6 % Аналогичный препарат Onyx-015 проходит испытания компании Onyx Pharmaceutical’s 2009 год препарат Cerepro® (Ark Therapeutics Финляндия Великобритания) рекомбинантный аденовирус с геном тимидинкиназы для лечения глиом. Препарат вводится в ткани мозга. Ганцикловир вводится внутривенно. Синтезируемая в клетках мозга тимидинкиназа превращает ганцикловир в вещество специфически убивающее делящиеся раковые клетки. Использование препарата разрешено Финскими и Французскими Надзорными Медицинскими инстанциями.
2006 год – препарат Oncorine™ (Chinese Shanghai Sunway Biotech ) рекомбинантный аденовирус с геном супрессором опухолей p 53 для лечения больных злокачественными новообразованиями головы и шеи, глиом, рака легких , рака яичников Для некоторых онкологических заболеваний после лечения с использованием Oncorine™ в комбинации с химеотерапией по результатам оценки с использованием критериев ВОЗ регрессия опухолей происходила в 75. 6 % Аналогичный препарат Onyx-015 проходит испытания компании Onyx Pharmaceutical’s 2009 год препарат Cerepro® (Ark Therapeutics Финляндия Великобритания) рекомбинантный аденовирус с геном тимидинкиназы для лечения глиом. Препарат вводится в ткани мозга. Ганцикловир вводится внутривенно. Синтезируемая в клетках мозга тимидинкиназа превращает ганцикловир в вещество специфически убивающее делящиеся раковые клетки. Использование препарата разрешено Финскими и Французскими Надзорными Медицинскими инстанциями.
 Клинические испытания по генной терапии на фазе 3 клинических Испытаний. Март 2009 года 52 проекта на стадии : 37 онкология 7 сердечно-сосудистые заболевания 6 инфекционные заболевания 2 генная вакцинация
Клинические испытания по генной терапии на фазе 3 клинических Испытаний. Март 2009 года 52 проекта на стадии : 37 онкология 7 сердечно-сосудистые заболевания 6 инфекционные заболевания 2 генная вакцинация
 Проблемы современной генной терапии • • Безопасность Эффективность доставки Попадание в клетки (ткани) мишени Соответствующий уровень и время экспрессии . ppt
Проблемы современной генной терапии • • Безопасность Эффективность доставки Попадание в клетки (ткани) мишени Соответствующий уровень и время экспрессии . ppt
 ВЫВОДЫ 1. ГТ выходит из застоя и вступает в фазу бурного развития. 2. Число официальных протоколов клинических испытаний превысило 1000 и включает все виды заболеваний. 3. Наиболее существенный прогресс в ГТ нервно-мышечных заболеваний отмечен для МДД, СМА, МД, МА и др. 4. Исследования и клинические испытания по ГТ требуют слаженной работы многочисленных научных лабораторий и клинических центров. 5. ГТ строго специфична для каждого заболевания и сугубо индивидуальна для каждого больного (конструкция, доза, способ доставки и пр. ). 6. Если не произойдет чуда, в которое мы давно и упорно верим, Россия навсегда потеряет для себя этот вид медицины.
ВЫВОДЫ 1. ГТ выходит из застоя и вступает в фазу бурного развития. 2. Число официальных протоколов клинических испытаний превысило 1000 и включает все виды заболеваний. 3. Наиболее существенный прогресс в ГТ нервно-мышечных заболеваний отмечен для МДД, СМА, МД, МА и др. 4. Исследования и клинические испытания по ГТ требуют слаженной работы многочисленных научных лабораторий и клинических центров. 5. ГТ строго специфична для каждого заболевания и сугубо индивидуальна для каждого больного (конструкция, доза, способ доставки и пр. ). 6. Если не произойдет чуда, в которое мы давно и упорно верим, Россия навсегда потеряет для себя этот вид медицины.


