генная инженерия.ppt
- Количество слайдов: 43
 Генная инженерия
Генная инженерия
 • Генетическая инженерия - конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК), или иначе - создание искусственных генетических программ (Баев А. А. ). • Генетическая инженерия - система экспериментальных приемов, позволяющих конструировать лабораторным путем (в пробирке) искусственные генетические структуры в виде рекомбинантных или гибридных молекул ДНК (Пирузян Э. С. ). • Генетическая инженерия - получение новых комбинаций генетического материала путем проводимых вне клетки манипуляций с молекулами нуклеиновых кислот и переноса созданных конструкций генов в живой организм, в результате которого достигается их включение и активность в этом организме и у его потомства.
• Генетическая инженерия - конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК), или иначе - создание искусственных генетических программ (Баев А. А. ). • Генетическая инженерия - система экспериментальных приемов, позволяющих конструировать лабораторным путем (в пробирке) искусственные генетические структуры в виде рекомбинантных или гибридных молекул ДНК (Пирузян Э. С. ). • Генетическая инженерия - получение новых комбинаций генетического материала путем проводимых вне клетки манипуляций с молекулами нуклеиновых кислот и переноса созданных конструкций генов в живой организм, в результате которого достигается их включение и активность в этом организме и у его потомства.
 Возможности генной инженерии 1. Крупномасштабное производство белка. 100 г инсулина = поджелудочная железа 4 000 коров или свиней = 500 л культуральной жидкости (Кишечная палочка). Трупный материал 1 человека = 4 -6 мг соматотропина на 1 ребенка 10 мг/кг * 3 раза в неделю 2. Получение высокоспецифичных ДНК-зондов. 3. Генная терапия человека. 4. Получение трансгенных организмов. 5. Проведение молекулярно-генетических исслеований.
Возможности генной инженерии 1. Крупномасштабное производство белка. 100 г инсулина = поджелудочная железа 4 000 коров или свиней = 500 л культуральной жидкости (Кишечная палочка). Трупный материал 1 человека = 4 -6 мг соматотропина на 1 ребенка 10 мг/кг * 3 раза в неделю 2. Получение высокоспецифичных ДНК-зондов. 3. Генная терапия человека. 4. Получение трансгенных организмов. 5. Проведение молекулярно-генетических исслеований.
 История генной инженерии 1869 – Мишер Ф. – наличие нуклеиновых кислот. 1944 — Эвери, Мак-Леод и Маккарти показали, что «вещество наследственности» — это ДНК. 1953 — Джеймс Уотсон и Фрэнсис Крик определили структуру молекулы ДНК — двойную спираль. 1961 -1966 — расшифрован генетический код и выделены лигазы и рестриктазы – Ниренберг М. , Очоа С. , Корана Х. -Т. 1970 — выделена первая рестриктаза. 1972 -1973 — Гобинда Корана синтезировал полноразмерный ген; П. Берг, Герберт Бойер и Стэнли Коэн предложили стратегию создания рекомбинантных ДНК. 1976 -1977 — разработаны методы определения нуклеотидных последовательностей (секвенирования) любых ДНК. 1978 — фирма Genentech выпустила рекомбинантный инсулин, производимый человеческим геном, введенным в бактериальную клетку.
История генной инженерии 1869 – Мишер Ф. – наличие нуклеиновых кислот. 1944 — Эвери, Мак-Леод и Маккарти показали, что «вещество наследственности» — это ДНК. 1953 — Джеймс Уотсон и Фрэнсис Крик определили структуру молекулы ДНК — двойную спираль. 1961 -1966 — расшифрован генетический код и выделены лигазы и рестриктазы – Ниренберг М. , Очоа С. , Корана Х. -Т. 1970 — выделена первая рестриктаза. 1972 -1973 — Гобинда Корана синтезировал полноразмерный ген; П. Берг, Герберт Бойер и Стэнли Коэн предложили стратегию создания рекомбинантных ДНК. 1976 -1977 — разработаны методы определения нуклеотидных последовательностей (секвенирования) любых ДНК. 1978 — фирма Genentech выпустила рекомбинантный инсулин, производимый человеческим геном, введенным в бактериальную клетку.
 1980 — Верховный суд США вынес вердикт о законности патентования трансгенных микроорганизмов. 1982 — в США впервые поданы заявки на проведение полевых испытаний трансгенных организмов; в Европе разрешена первая вакцина для животных, полученная методами генной инженерии. 1983 — для трансформации растений применены гибридные Ti-плазмиды; компания Monsanto начала создание трансгенных растений. 1985 -1988 — разработан метод полимеразной цепной реакции (ПЦР). 1990 — в США утвержден план испытаний генной терапии с использованием человеческих клеток; официально начаты работы над всемирным проектом «Геном человека» (завершен в 2000 году). 1994 — получено первое разрешение на возделывание трансгенного растения (помидора сорта Flavr. Savr). 1996 — началось массовое выращивание трансгенных растений. 1998 — Европейский Союз ввел мораторий на регистрацию новых ГМкультур, действовавший до 2002 года. 2000 — принят Картахенский протокол по биобезопасности (вступил в силу в 2003 году), установивший наиболее общие международные нормы обращения с трансгенными организмами
1980 — Верховный суд США вынес вердикт о законности патентования трансгенных микроорганизмов. 1982 — в США впервые поданы заявки на проведение полевых испытаний трансгенных организмов; в Европе разрешена первая вакцина для животных, полученная методами генной инженерии. 1983 — для трансформации растений применены гибридные Ti-плазмиды; компания Monsanto начала создание трансгенных растений. 1985 -1988 — разработан метод полимеразной цепной реакции (ПЦР). 1990 — в США утвержден план испытаний генной терапии с использованием человеческих клеток; официально начаты работы над всемирным проектом «Геном человека» (завершен в 2000 году). 1994 — получено первое разрешение на возделывание трансгенного растения (помидора сорта Flavr. Savr). 1996 — началось массовое выращивание трансгенных растений. 1998 — Европейский Союз ввел мораторий на регистрацию новых ГМкультур, действовавший до 2002 года. 2000 — принят Картахенский протокол по биобезопасности (вступил в силу в 2003 году), установивший наиболее общие международные нормы обращения с трансгенными организмами
 Этапы развития • Первый этап связан с доказательством принципиальной возможности получения рекомбинантных молекул ДНК in vitro. Эти работы касаются получения гибридов между различными плазмидами. Была доказана возможность создания рекомбинантных молекул с использованием исходных молекул ДНК из различных видов и штаммов бактерий, их жизнеспособность, стабильность и функционирование. • Второй этап связан с началом работ по получению рекомбинантных молекул ДНК между хромосомными генами прокариот и различными плазмидами, доказательством их стабильности и жизнеспособности. • Третий этап - начало работ по включению в векторные молекулы ДНК (ДНК, используемые для переноса генов и способные встраиваться в генетический аппарат клетки-рецепиента) генов эукариот, главным образом, животных.
Этапы развития • Первый этап связан с доказательством принципиальной возможности получения рекомбинантных молекул ДНК in vitro. Эти работы касаются получения гибридов между различными плазмидами. Была доказана возможность создания рекомбинантных молекул с использованием исходных молекул ДНК из различных видов и штаммов бактерий, их жизнеспособность, стабильность и функционирование. • Второй этап связан с началом работ по получению рекомбинантных молекул ДНК между хромосомными генами прокариот и различными плазмидами, доказательством их стабильности и жизнеспособности. • Третий этап - начало работ по включению в векторные молекулы ДНК (ДНК, используемые для переноса генов и способные встраиваться в генетический аппарат клетки-рецепиента) генов эукариот, главным образом, животных.
 Основные этапы решения генноинженерной задачи 1. Получение изолированного гена. 2. Введение гена в вектор для переноса в организм. 3. Перенос вектора с геном в модифицируемый организм. 4. Преобразование клеток организма. 5. Отбор генетически модифицированных организмов (ГМО) и устранение тех, которые не были успешно модифицированы.
Основные этапы решения генноинженерной задачи 1. Получение изолированного гена. 2. Введение гена в вектор для переноса в организм. 3. Перенос вектора с геном в модифицируемый организм. 4. Преобразование клеток организма. 5. Отбор генетически модифицированных организмов (ГМО) и устранение тех, которые не были успешно модифицированы.
 Технология получения рекомбинантной ДНК • специфическое расщепление ДНК рестрицирующими нуклеазами, ускоряющее выделение и манипуляции с отдельными генами; • секвенирование всех нуклеотидов очищенном фрагменте ДНК, что позволяет определить границы гена и аминокислотную последовательность, кодируемую им; • конструирование рекомбинантной ДНК; • гибридизация нуклеиновых кислот, позволяющая выявлять специфические последовательности РНК или ДНК с большей точностью и чувствительностью, основанную на их способности связывать комплементарные последовательности нуклеиновых кислот; • клонирование ДНК: амплификация in vitro с помощью цепной полимеразной реакции или введение фрагмента ДНК в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий; • введение рекомбинантной ДНК в клетки или организмы.
Технология получения рекомбинантной ДНК • специфическое расщепление ДНК рестрицирующими нуклеазами, ускоряющее выделение и манипуляции с отдельными генами; • секвенирование всех нуклеотидов очищенном фрагменте ДНК, что позволяет определить границы гена и аминокислотную последовательность, кодируемую им; • конструирование рекомбинантной ДНК; • гибридизация нуклеиновых кислот, позволяющая выявлять специфические последовательности РНК или ДНК с большей точностью и чувствительностью, основанную на их способности связывать комплементарные последовательности нуклеиновых кислот; • клонирование ДНК: амплификация in vitro с помощью цепной полимеразной реакции или введение фрагмента ДНК в бактериальную клетку, которая после такой трансформации воспроизводит этот фрагмент в миллионах копий; • введение рекомбинантной ДНК в клетки или организмы.
 Ферменты, применяемые при конструировании рекомбинантных ДНК - ферменты, с помощью которых получают фрагменты ДНК (рестриктазы); - ферменты, синтезирующие ДНК на матрице ДНК (полимеразы) или РНК (обратные транскриптазы); - ферменты, соединяющие фрагменты ДНК (лигазы); - ферменты, позволяющие осуществить изменение структуры концов фрагментов ДНК.
Ферменты, применяемые при конструировании рекомбинантных ДНК - ферменты, с помощью которых получают фрагменты ДНК (рестриктазы); - ферменты, синтезирующие ДНК на матрице ДНК (полимеразы) или РНК (обратные транскриптазы); - ферменты, соединяющие фрагменты ДНК (лигазы); - ферменты, позволяющие осуществить изменение структуры концов фрагментов ДНК.
 Полимеразы Впервые ДНК-полимераза была выделена Корнбергом с сотрудниками в 1958 году из E. coli. Обратная транскриптаза используется для транскрипции м-РНК в комплементарную цепь ДНК. В 1970 г. Темин с Мизутани, а также независимо от них Балтимор открыли фермент в препарате внеклеточных вирионов вируса саркомы Рауса. Данная РНК-зависимая ДНК-полимераза получила название обратная транскриптаза, или ревертаза. Используют для транскрипции матричной РНК в комплементарную ДНК (к. ДНК).
Полимеразы Впервые ДНК-полимераза была выделена Корнбергом с сотрудниками в 1958 году из E. coli. Обратная транскриптаза используется для транскрипции м-РНК в комплементарную цепь ДНК. В 1970 г. Темин с Мизутани, а также независимо от них Балтимор открыли фермент в препарате внеклеточных вирионов вируса саркомы Рауса. Данная РНК-зависимая ДНК-полимераза получила название обратная транскриптаза, или ревертаза. Используют для транскрипции матричной РНК в комплементарную ДНК (к. ДНК).
 Лигазы
Лигазы
 Лигазы В 1961 г. Мезельсон и Вейгл на примере фага показали, что рекомбинация включает разрыв и последующее воссоединение молекул ДНК. В 1967 году такой фермент был найден и получил название ДНК-лигаза. Он катализирует синтез фосфодиэфирной связи в 2 -х цепочечной молекуле нуклеиновой кислоты. ДНК-лигазы абсолютно необходимы в процессах репарации ДНК, в процессах репликации - при удвоении цепи ДНК. В генной инженерии используются 2 типа ДНК-лигаз, отличающихся по потребностям в кофакторах и способу действия. ДНК-лигаза E. coli в качестве кофактора использует дифосфопиридиннуклеотид, а лигаза фага Т 4 - АТФ в присутствии Mg 2+. Терминальная трансфераза, поли-А - полимераза Терминальная трансфераза (концевая дезоксинуклеотидилтрансфераза) была обнаружена Боллумом в 1962 году в тимусе теленка. Субстратом терминальной трансферазы при использовании в качестве кофактора ионов Mg 2+ является одноцепочечная ДНК с З'-ОН концом или двухцепочечная ДНК с выступающим одноцепочечным З'-ОН концом. Именно с помощью концевой дезоксинуклеотидилтрансферазы в 1972 г. был выполнен первый эксперимент по рекомбинации молекул ДНК in vitro.
Лигазы В 1961 г. Мезельсон и Вейгл на примере фага показали, что рекомбинация включает разрыв и последующее воссоединение молекул ДНК. В 1967 году такой фермент был найден и получил название ДНК-лигаза. Он катализирует синтез фосфодиэфирной связи в 2 -х цепочечной молекуле нуклеиновой кислоты. ДНК-лигазы абсолютно необходимы в процессах репарации ДНК, в процессах репликации - при удвоении цепи ДНК. В генной инженерии используются 2 типа ДНК-лигаз, отличающихся по потребностям в кофакторах и способу действия. ДНК-лигаза E. coli в качестве кофактора использует дифосфопиридиннуклеотид, а лигаза фага Т 4 - АТФ в присутствии Mg 2+. Терминальная трансфераза, поли-А - полимераза Терминальная трансфераза (концевая дезоксинуклеотидилтрансфераза) была обнаружена Боллумом в 1962 году в тимусе теленка. Субстратом терминальной трансферазы при использовании в качестве кофактора ионов Mg 2+ является одноцепочечная ДНК с З'-ОН концом или двухцепочечная ДНК с выступающим одноцепочечным З'-ОН концом. Именно с помощью концевой дезоксинуклеотидилтрансферазы в 1972 г. был выполнен первый эксперимент по рекомбинации молекул ДНК in vitro.
 Рестриктазы (эндонуклеазы рестрикции) - это ферменты, узнающие и атакующие определенные последовательности нуклеотидов в молекуле ДНК (сайты рестрикции). Рестриктаза, которая расщепляла неметилированную ДНК, была выделена в 1968 г. Мезельсоном и Юанем. В 1970 г. Смит и Вилькокс выделили из Haemophilus influenzae первую рестриктазу, которая расщепляла строго определенную последовательность ДНК (Hind III). В настоящее время выделено более 500 рестриктаз класса 2, однако среди ферментов, выделенных из различных микроорганизмов, встречаются такие, которые узнают на ДНК одни и те же последовательности. Такие пары или группы называют изошизомерами. В 1973 году Смит и Натанс предложили номенклатуру рестриктаз. За открытие рестриктаз Вернер Арбер, Даниел Натанс и Хамилтон Смит были удостоены Нобелевской премии в 1978 г. Рестриктазы по-разному расщепляют ДНК. Одни вносят разрывы по оси симметрии узнаваемой последовательности (Hpa I, Ssp I), образуются так называемые "тупые" концы Другие - со сдвигом, со "ступенькой" (Pst I), с образованием "липких « концов.
Рестриктазы (эндонуклеазы рестрикции) - это ферменты, узнающие и атакующие определенные последовательности нуклеотидов в молекуле ДНК (сайты рестрикции). Рестриктаза, которая расщепляла неметилированную ДНК, была выделена в 1968 г. Мезельсоном и Юанем. В 1970 г. Смит и Вилькокс выделили из Haemophilus influenzae первую рестриктазу, которая расщепляла строго определенную последовательность ДНК (Hind III). В настоящее время выделено более 500 рестриктаз класса 2, однако среди ферментов, выделенных из различных микроорганизмов, встречаются такие, которые узнают на ДНК одни и те же последовательности. Такие пары или группы называют изошизомерами. В 1973 году Смит и Натанс предложили номенклатуру рестриктаз. За открытие рестриктаз Вернер Арбер, Даниел Натанс и Хамилтон Смит были удостоены Нобелевской премии в 1978 г. Рестриктазы по-разному расщепляют ДНК. Одни вносят разрывы по оси симметрии узнаваемой последовательности (Hpa I, Ssp I), образуются так называемые "тупые" концы Другие - со сдвигом, со "ступенькой" (Pst I), с образованием "липких « концов.



 Номенклатура и характеристика рестриктаз 1. Аббревиатура названия каждого фермента является производной от бинарного названия микроорганизма, содержащего данную метилазно -рестриктазную систему. Streptomyces albus - Sal, Escherichia coli – Eco 2. В случае необходимости добавляют обозначение серотипа или штамма, например, Есо B. 3. Различные системы рестрикции - модификации, кодируемые одной бактериальной клеткой, обозначают римскими цифрами: Hind II, Hind III (Haemophilus influenzae). 4. Рестриктазы обозначают буквой R (R Hind III), метилазы - М (М Hind III). Робертс в 1978 году внес дополнения в систему рациональных обозначений ферментов: если сокращенное название совпадает для нескольких ферментов, то 2 первые буквы аббревиатуры остаются неизменными, а третья берется из последующих букв видового названия: Haemophilus parainfluenzae - Hpa I, Haemophilus parahaemolyticus - Hph I.
Номенклатура и характеристика рестриктаз 1. Аббревиатура названия каждого фермента является производной от бинарного названия микроорганизма, содержащего данную метилазно -рестриктазную систему. Streptomyces albus - Sal, Escherichia coli – Eco 2. В случае необходимости добавляют обозначение серотипа или штамма, например, Есо B. 3. Различные системы рестрикции - модификации, кодируемые одной бактериальной клеткой, обозначают римскими цифрами: Hind II, Hind III (Haemophilus influenzae). 4. Рестриктазы обозначают буквой R (R Hind III), метилазы - М (М Hind III). Робертс в 1978 году внес дополнения в систему рациональных обозначений ферментов: если сокращенное название совпадает для нескольких ферментов, то 2 первые буквы аббревиатуры остаются неизменными, а третья берется из последующих букв видового названия: Haemophilus parainfluenzae - Hpa I, Haemophilus parahaemolyticus - Hph I.
 Механизм действия рестриктаз, системы метилирования ДНК • В качестве мишеней (мест узнавания) часто выступают палиндромы из 4 -6 пар оснований - сайты рестрикции. Точки узнавания рестриктазами симметричны. Сайт-мишень может быть полностью метилирован (обе цепи модифицированы), полуметилирован (только одна цепь метилирована) или неметилирован. • Полностью метилированный сайт не подвержен ни рестрикции, ни модификации. • Полуметилированный сайт не узнается ферментом рестрикции, но может быть превращен с помощью метилазы в полностью метилированный. • Неметилированный сайт-мишень представляет собой субстрат либо для рестрикции, либо для модификации in vitro.
Механизм действия рестриктаз, системы метилирования ДНК • В качестве мишеней (мест узнавания) часто выступают палиндромы из 4 -6 пар оснований - сайты рестрикции. Точки узнавания рестриктазами симметричны. Сайт-мишень может быть полностью метилирован (обе цепи модифицированы), полуметилирован (только одна цепь метилирована) или неметилирован. • Полностью метилированный сайт не подвержен ни рестрикции, ни модификации. • Полуметилированный сайт не узнается ферментом рестрикции, но может быть превращен с помощью метилазы в полностью метилированный. • Неметилированный сайт-мишень представляет собой субстрат либо для рестрикции, либо для модификации in vitro.
 Сайт рестрикции
Сайт рестрикции
 Построение карт рестрикции • Сравнение размеров фрагментов ДНК, полученных после обработки определенного участка генома набором рестрицирующих нуклеаз позволяет построить рестрикционную карту, на которой указано положение каждого сайта рестрикции относительно других участков. • Молекулу ДНК длиной 5000 пар нуклеотидов (п. н. ). обрабатывают отдельно рестриктазами А и В. • Фрагменты разделяют электрофорезом. • Фермент А разрезал ДНК на 4 фрагмента размером 2100, 1400, 1000 и 500 п. н. • Обработка рестриктазой В дала 3 фрагмента: 2500, 1300 и 1200 п. н. • Для определения расположения сайтов рестрикции этих ферментов на следующем этапе применяют процедуру двойного расщепления – обрабатывают ДНК двумя эндонуклеазами. • Обработка изучаемого фрагмента одновременно двумя рестриктазами дала 6 фрагментов: 1900, 1000, 800, 600, 500, 200 п. н.
Построение карт рестрикции • Сравнение размеров фрагментов ДНК, полученных после обработки определенного участка генома набором рестрицирующих нуклеаз позволяет построить рестрикционную карту, на которой указано положение каждого сайта рестрикции относительно других участков. • Молекулу ДНК длиной 5000 пар нуклеотидов (п. н. ). обрабатывают отдельно рестриктазами А и В. • Фрагменты разделяют электрофорезом. • Фермент А разрезал ДНК на 4 фрагмента размером 2100, 1400, 1000 и 500 п. н. • Обработка рестриктазой В дала 3 фрагмента: 2500, 1300 и 1200 п. н. • Для определения расположения сайтов рестрикции этих ферментов на следующем этапе применяют процедуру двойного расщепления – обрабатывают ДНК двумя эндонуклеазами. • Обработка изучаемого фрагмента одновременно двумя рестриктазами дала 6 фрагментов: 1900, 1000, 800, 600, 500, 200 п. н.

 Анализ фрагментов рестрикции и карта фрагмента ДНК
Анализ фрагментов рестрикции и карта фрагмента ДНК
 Конструирование рекомбинантных ДНК 1. Сшивка по одноименным "липким" концам (рестриктазно лигазный метод) Впервые этим способом гибридная ДНК была получена С. Коэном с сотрудниками в 1973 году. Спаривание оснований происходит только между комплементарными последовательностями, поэтому ААТТ-концы, образуемые Eco RI, не будут спариваться, например, с АГЦТ-концами, образуемыми Hind III. Но любые два фрагмента, образовавшиеся под действием одной и той же рестриктазы, могут слипаться за счет образования водородных связей между однонитевыми участками комплементарных нуклеотидов. После спаривания полной целостности двойной спирали не восстановится, изза двух разрывов в фосфодиэфирном остове. Для лигирования нитей используют фермент ДНК-лигазу.
Конструирование рекомбинантных ДНК 1. Сшивка по одноименным "липким" концам (рестриктазно лигазный метод) Впервые этим способом гибридная ДНК была получена С. Коэном с сотрудниками в 1973 году. Спаривание оснований происходит только между комплементарными последовательностями, поэтому ААТТ-концы, образуемые Eco RI, не будут спариваться, например, с АГЦТ-концами, образуемыми Hind III. Но любые два фрагмента, образовавшиеся под действием одной и той же рестриктазы, могут слипаться за счет образования водородных связей между однонитевыми участками комплементарных нуклеотидов. После спаривания полной целостности двойной спирали не восстановится, изза двух разрывов в фосфодиэфирном остове. Для лигирования нитей используют фермент ДНК-лигазу.

 Сшивка по "тупым" концам (коннекторный метод) • Тупые концы также могут быть соединены за счет действия ДНКлигазы, если и лигаза, и тупые концы присутствуют в реакционной смеси в высоких концентрациях. • Впервые такие эксперименты были выполнены в 1972 году Полем Бергом в Стенфордском университете, США. • Липкие концы ферментативным путем присоединяют к молекулам ДНК с тупыми концами. Для этого используют фермент - концевую трансферазу из тимуса теленка, которая присоединяет нуклеотиды к 3 -концам цепей ДНК. • Для ковалентного соединения двух фрагментов используется ДНКлигаза. Эти процедуры составляют основу для второго общего метода получения рекомбинантных молекул ДНК. • При клонировании ДНК-копий матричных РНК, которые доступны в ограниченных количествах, используют коннекторный метод.
Сшивка по "тупым" концам (коннекторный метод) • Тупые концы также могут быть соединены за счет действия ДНКлигазы, если и лигаза, и тупые концы присутствуют в реакционной смеси в высоких концентрациях. • Впервые такие эксперименты были выполнены в 1972 году Полем Бергом в Стенфордском университете, США. • Липкие концы ферментативным путем присоединяют к молекулам ДНК с тупыми концами. Для этого используют фермент - концевую трансферазу из тимуса теленка, которая присоединяет нуклеотиды к 3 -концам цепей ДНК. • Для ковалентного соединения двух фрагментов используется ДНКлигаза. Эти процедуры составляют основу для второго общего метода получения рекомбинантных молекул ДНК. • При клонировании ДНК-копий матричных РНК, которые доступны в ограниченных количествах, используют коннекторный метод.

 Сшивка фрагментов с разноименными липкими концами • Линкеры - это химически синтезированные олигонуклеотиды, представляющие собой сайты рестрикции или их комбинацию. • Впервые эту идею предложил Шеллер с сотрудниками в 1977 году. • Существуют большие наборы таких генных "переходников". • При использовании линкеров должна учитываться необходимость соблюдения правил экспрессии генетической информации. Часто в середину линкера помещают регуляторный генетический элемент (промотор или участок, связанный с рибосомой). • При необходимости липкие концы можно превратить в тупые. Это достигается либо отщеплением липких концов с помощью фермента - эндонуклеазы S 1, которая разрушает только одноцепочечную ДНК, либо липкие концы "застраивают", то есть с помощью ДНК-полимеразы I на однонитевых липких концах синтезируют вторую нить.
Сшивка фрагментов с разноименными липкими концами • Линкеры - это химически синтезированные олигонуклеотиды, представляющие собой сайты рестрикции или их комбинацию. • Впервые эту идею предложил Шеллер с сотрудниками в 1977 году. • Существуют большие наборы таких генных "переходников". • При использовании линкеров должна учитываться необходимость соблюдения правил экспрессии генетической информации. Часто в середину линкера помещают регуляторный генетический элемент (промотор или участок, связанный с рибосомой). • При необходимости липкие концы можно превратить в тупые. Это достигается либо отщеплением липких концов с помощью фермента - эндонуклеазы S 1, которая разрушает только одноцепочечную ДНК, либо липкие концы "застраивают", то есть с помощью ДНК-полимеразы I на однонитевых липких концах синтезируют вторую нить.
 Определение нуклеотидной последовательности (секвенирование) ДНК • Секвенирование позволяет быстро определять полную нуклеотидную последовательность сегмента длиной 100 - 500 нуклеотидных пар, образующегося при расщеплении ДНК рестрикционными эндонуклеазами.
Определение нуклеотидной последовательности (секвенирование) ДНК • Секвенирование позволяет быстро определять полную нуклеотидную последовательность сегмента длиной 100 - 500 нуклеотидных пар, образующегося при расщеплении ДНК рестрикционными эндонуклеазами.
 Метод Маскама и Гилберта (химический) • Метод основан на химической деградации ДНК. • Предложен в 1976 году Максамом и Гилбертом. • Суть метода: один из концов фрагмента ДНК метят с помощью изотопа фосфора 32 Р или вводят флюоресцирующую метку (ее можно «цеплять» и к нуклеотидам, причем для каждого типа нуклеотидов подбирать различную окраску). Препарат меченой ДНК делят на четыре порции и каждую из них обрабатывают реагентом, специфически разрушающим одно или два из четырех оснований, причем условия реакции подбирают таким образом, чтобы на каждую молекулу ДНК приходилось лишь несколько повреждений. Разрушение идет в 2 этапа. На первом этапе происходит модификация азотистого основания и последующее выщепление его. На втором этапе производят гидролиз ДНК в местах выщепления оснований.
Метод Маскама и Гилберта (химический) • Метод основан на химической деградации ДНК. • Предложен в 1976 году Максамом и Гилбертом. • Суть метода: один из концов фрагмента ДНК метят с помощью изотопа фосфора 32 Р или вводят флюоресцирующую метку (ее можно «цеплять» и к нуклеотидам, причем для каждого типа нуклеотидов подбирать различную окраску). Препарат меченой ДНК делят на четыре порции и каждую из них обрабатывают реагентом, специфически разрушающим одно или два из четырех оснований, причем условия реакции подбирают таким образом, чтобы на каждую молекулу ДНК приходилось лишь несколько повреждений. Разрушение идет в 2 этапа. На первом этапе происходит модификация азотистого основания и последующее выщепление его. На втором этапе производят гидролиз ДНК в местах выщепления оснований.
 Метод Сэнгера (ферментативный) • Фредерик Сэнге — английский биохимик и корифей молекулярной биологии, дважды лауреат Нобелевской премии по химии: за определение аминокислотной последовательности инсулина (1955 г. ) и за разработку метода секвенирования ДНК (1980 г. ). • Метод основан на ферментативном подходе.
Метод Сэнгера (ферментативный) • Фредерик Сэнге — английский биохимик и корифей молекулярной биологии, дважды лауреат Нобелевской премии по химии: за определение аминокислотной последовательности инсулина (1955 г. ) и за разработку метода секвенирования ДНК (1980 г. ). • Метод основан на ферментативном подходе.


 Гибридизация как высокочувствительный метод выявления специфических последовательностей нуклеотидов
Гибридизация как высокочувствительный метод выявления специфических последовательностей нуклеотидов

 Трансформация – методы переноса ДНК в клетку • Прямой перенос - Электропорация (4, 5 мс, 2, 5 к. В, 200 Ом) - Биобалистика - Трансфекция с помощью липосом, микрочастиц, катионных полимеров - Использование мини-клеток • Перенос с помощью вектора
Трансформация – методы переноса ДНК в клетку • Прямой перенос - Электропорация (4, 5 мс, 2, 5 к. В, 200 Ом) - Биобалистика - Трансфекция с помощью липосом, микрочастиц, катионных полимеров - Использование мини-клеток • Перенос с помощью вектора
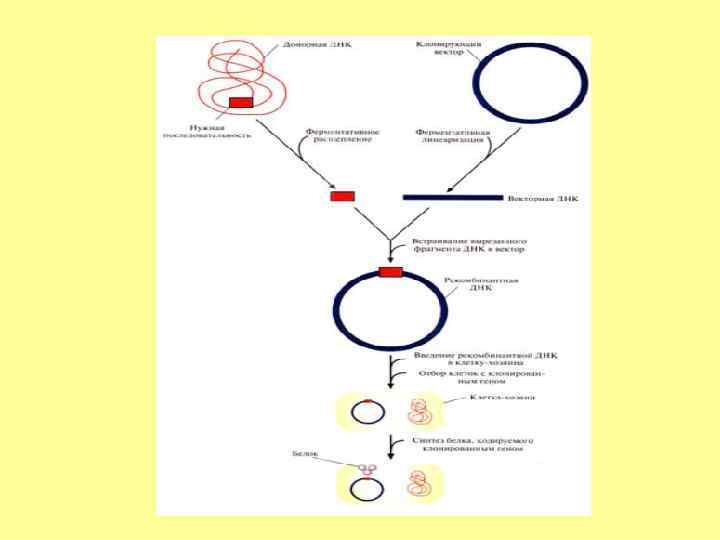
 Вектор • Вектор – молекула ДНК или РНК, состоящая из двух компонентов: векторной части (носителя) и клонируемого чужеродного гена. Задача вектора – донести выбранную ДНК в клетку-рецепиент, встроить ее в геном, позволить идентификацию трансформированных клеток, обеспечить стабильную экспрессию введенного гена. Виды: Плазмиды (для фрагментов до 10 000 п. н. ) Вирусы Космиды (для фрагментов до 40 000 п. н. ) Фазмиды Бактериальная искусственная хромосома (для фрагментов более 100 000 п. н. ) Вироиды ДНК хлоропластов и митохондрий Транспозоны
Вектор • Вектор – молекула ДНК или РНК, состоящая из двух компонентов: векторной части (носителя) и клонируемого чужеродного гена. Задача вектора – донести выбранную ДНК в клетку-рецепиент, встроить ее в геном, позволить идентификацию трансформированных клеток, обеспечить стабильную экспрессию введенного гена. Виды: Плазмиды (для фрагментов до 10 000 п. н. ) Вирусы Космиды (для фрагментов до 40 000 п. н. ) Фазмиды Бактериальная искусственная хромосома (для фрагментов более 100 000 п. н. ) Вироиды ДНК хлоропластов и митохондрий Транспозоны
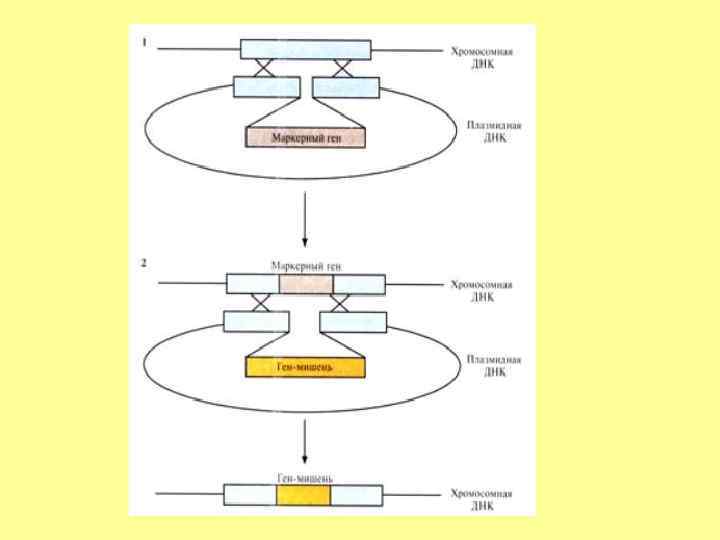
 Маркерные гены • Селективные гены, отвечающие за устойчивость к антибиотикам (канамицину, тетрациклину, неомицину и др. ), гербицидам (у растений). Основной принцип работы– способность трансформированных клеток расти на селективной питательной среде, с добавкой определенных веществ, ингибирующих рост и деление нетрансформированных, нормальных клеток. • Репортерные гены, кодирующие нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано. Чаще всего в качестве репортерных используются гены βглюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетилтрансферазы (CAT).
Маркерные гены • Селективные гены, отвечающие за устойчивость к антибиотикам (канамицину, тетрациклину, неомицину и др. ), гербицидам (у растений). Основной принцип работы– способность трансформированных клеток расти на селективной питательной среде, с добавкой определенных веществ, ингибирующих рост и деление нетрансформированных, нормальных клеток. • Репортерные гены, кодирующие нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано. Чаще всего в качестве репортерных используются гены βглюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетилтрансферазы (CAT).
 Микроинъекции
Микроинъекции
 Электропорация Липосомы
Электропорация Липосомы
 Биобалистика
Биобалистика



