MG_13.ppt
- Количество слайдов: 22

Генетична трансформація бактерій

q Генетична трансформація - це виникнення стабільних генетичних змін у бактерій унаслідок поглинання екзогенної ДНК (чистої, не зв’язаної з клітинами або білками) § За природних умов багато видів бактерій здатні поглинати екзогенну ДНК. Трансформація є одним з головних чинників горизонтального перенесення генів § Поглинатися може будь-яка ДНК, як клітин свого, так і інших видів, однак є види бактерій для яких властиве видоспецифічне поглинання ДНК § Механізм трансформації найкраще вивчений у Streptrococcus pneumoniae, Bacillus subtilis, Haemophilus influenzae, Neisseria gonorrhoeae § Генетична трансформація – найголовніший метод перенесення ДНК у генно-інженерних експериментах q Ефективність трансформації оцінюється за кількістю клітин трансформантів на 1 мкг використаної ДНК
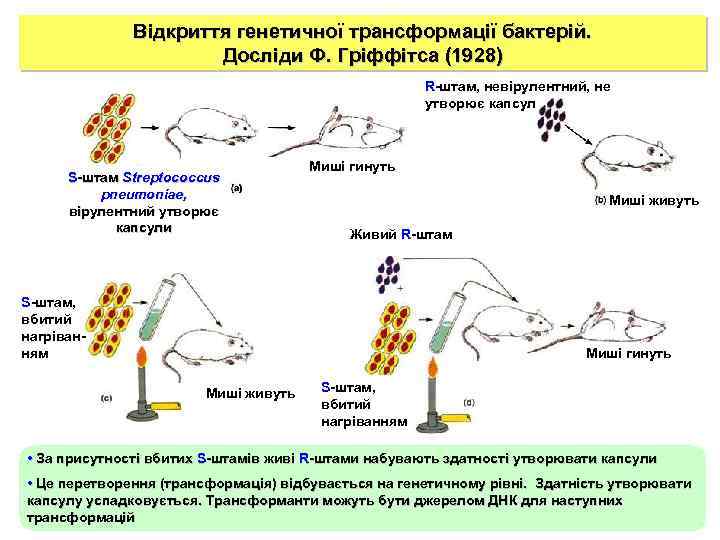
Відкриття генетичної трансформації бактерій. Досліди Ф. Гріффітса (1928) R-штам, невірулентний, не утворює капсул S-штам Streptoсoccus pneumoniae, вірулентний утворює капсули Миші гинуть Миші живуть Живий R-штам S-штам, вбитий нагріванням Миші гинуть Миші живуть S-штам, вбитий нагріванням • За присутності вбитих S-штамів живі R-штами набувають здатності утворювати капсули • Це перетворення (трансформація) відбувається на генетичному рівні. Здатність утворювати капсулу успадковується. Трансформанти можуть бути джерелом ДНК для наступних трансформацій
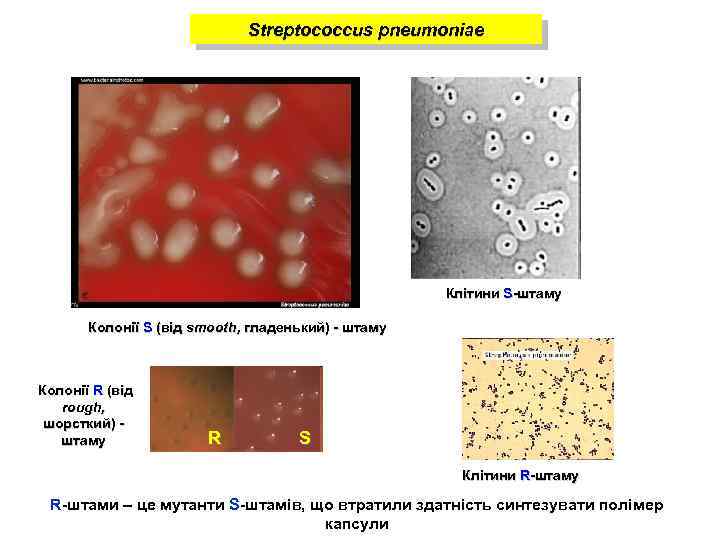
Streptococcus pneumoniae Клітини S-штаму Колонії S (від smooth, гладенький) - штаму Колонії R (від rough, шорсткий) штаму R S Клітини R-штаму R-штами – це мутанти S-штамів, що втратили здатність синтезувати полімер капсули
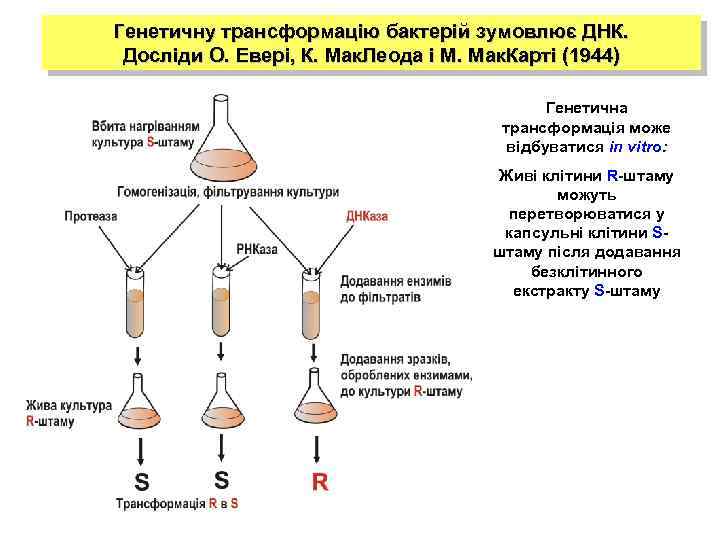
Генетичну трансформацію бактерій зумовлює ДНК. Досліди О. Евері, К. Мак. Леода і М. Мак. Карті (1944) Генетична трансформація може відбуватися in vitro: Живі клітини R-штаму можуть перетворюватися у капсульні клітини Sштаму після додавання безклітинного екстракту S-штаму
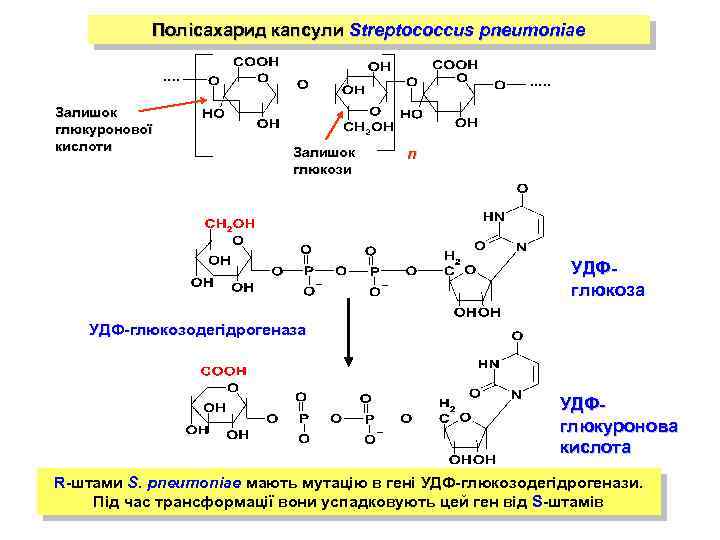
Полісахарид капсули Streptococcus pneumoniae Залишок глюкуронової кислоти Залишок глюкози n УДФглюкоза УДФ-глюкозодегідрогеназа УДФглюкуронова кислота R-штами S. pneumoniae мають мутацію в гені УДФ-глюкозодегідрогенази. Під час трансформації вони успадковують цей ген від S-штамів

§ У кінці 40 -х, на початку 50 -х років ХХ століття Р. Хочкіс опрацював методи отримання високоочищених препаратів ДНК § Він довів, що за допомогою трансформації можуть переноситися гени, що визначають стійкість пневмококів до антибіотиків пеніциліну і стрептоміцину § Результати його досліджень створили можливість кількісного аналізу трансформації Трансформанти Донор Реципієнт Pen. R Роллін Хочкіс (1911 – 2004) S Pen. S R R Pen. S S Pen. R S • Роль ДНК не “фізіологічна”, а “інформаційна” (генетична). Її роль - не безпосередній вплив на синтез капсули, а перенесення генетичної інформації про ознаки бактерій, у тому числі про синтез капсули • Гени, що контролюють утворення капсули і стійкість до пеніциліну переносяться у різних молекулах ДНК, бо трансформації, що приводить до появи штамів, що мають обидві ознаки донора, проходять як дві незалежні події • У дослідах з трансформації можна аналізувати зчепленість маркерів. Наприклад маркери стійкості до стрептоміцину (Str. R) і здатності засвоювати манітол (Man+) переносилися з частотою у ~ 15 разів вищою, ніж це очікувалося, як що б вони переносилися у результаті двох незалежних (послідовних чи одночасних) актів трансформації
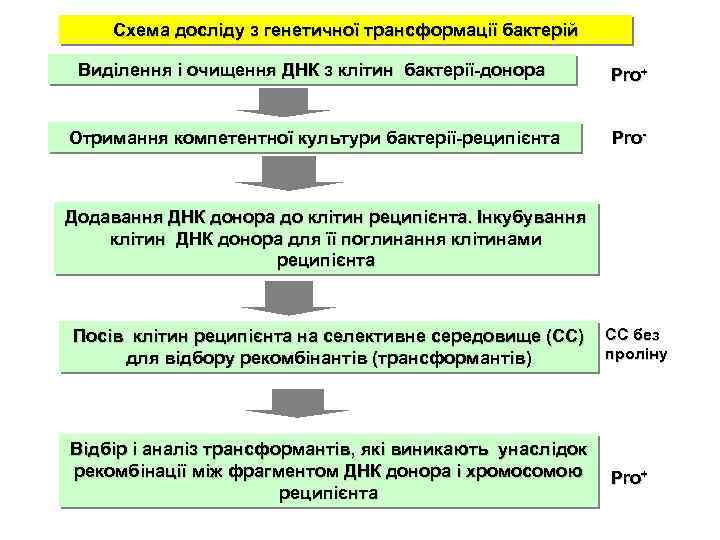
Схема досліду з генетичної трансформації бактерій Виділення і очищення ДНК з клітин бактерії-донора Pro+ Отримання компетентної культури бактерії-реципієнта Pro- Додавання ДНК донора до клітин реципієнта. Інкубування клітин ДНК донора для її поглинання клітинами реципієнта Посів клітин реципієнта на селективне середовище (СС) для відбору рекомбінантів (трансформантів) Відбір і аналіз трансформантів, які виникають унаслідок рекомбінації між фрагментом ДНК донора і хромосомою реципієнта CC без проліну Pro+

Етапи генетичної трансформації бактерій q Зв’язування клітинами двониткової ДНК § Подвійну ДНК можуть зв’язувати і компетентні і некомпетентні клітини § Однак компетентні клітини зв’язують її так, що вона не може бути звільнена від клітин простим відмиванням § З клітинами може зв’язуватися будь-яка ДНК § Мінімальний розмір ДНК, яка може бути зв’язана ~ 500 п. н. § Певні білки клітинної поверхні виконують роль рецепторів ДНК (у B. subtilis – Com. EA) q Розщеплення зв’язаної двониткової ДНК на фрагменти § Двониткові розриви в ДНК вносить ендонуклеаза (Nuc. A у B. subtilis) § Утворені фрагменти мають розміри ~ 6 т. п. н у S. pneumoniae і 13, 5 – 18 т. п. н у B. subtilis q Руйнування одного з двох ланцюгів ДНК. Перенесення одного ланцюга через цитоплазматичну мембрану у цитоплазму реципієнтної клітини q Гомологічна рекомбінація між перенесеною ДНК донора і ДНК клітини-реципієнта
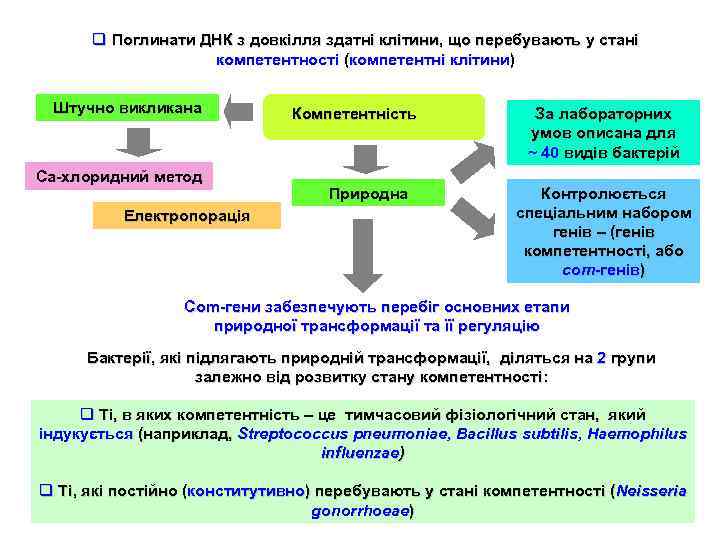
q Поглинати ДНК з довкілля здатні клітини, що перебувають у стані компетентності (компетентні клітини) Штучно викликана Ca-хлоридний метод Електропорація Компетентність Природна За лабораторних умов описана для ~ 40 видів бактерій Контролюється спеціальним набором генів – (генів компетентності, або com-генів) Com-гени забезпечують перебіг основних етапи природної трансформації та її регуляцію Бактерії, які підлягають природній трансформації, діляться на 2 групи залежно від розвитку стану компетентності: q Ті, в яких компетентність – це тимчасовий фізіологічний стан, який індукується (наприклад, Streptococcus pneumoniae, Bacillus subtilis, Нaemophilus influenzae) q Ті, які постійно (конститутивно) перебувають у стані компетентності (Neisseria gonorrhoeae)
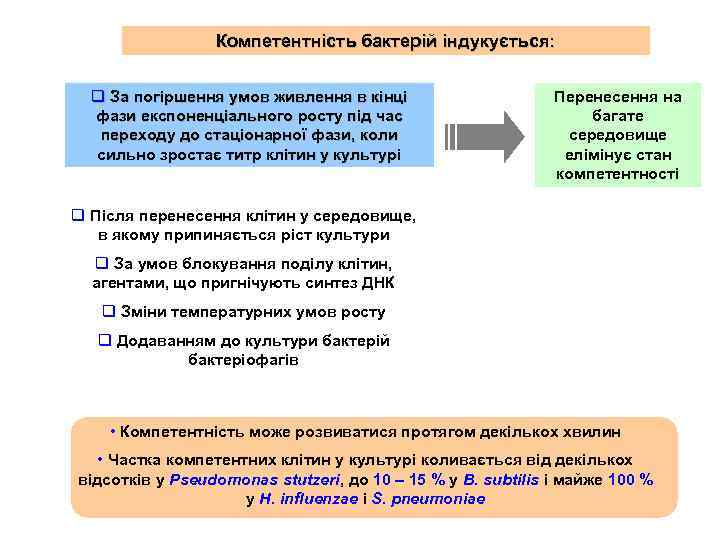
Компетентність бактерій індукується: q За погіршення умов живлення в кінці фази експоненціального росту під час переходу до стаціонарної фази, коли сильно зростає титр клітин у культурі Перенесення на багате середовище елімінує стан компетентності q Після перенесення клітин у середовище, в якому припиняється ріст культури q За умов блокування поділу клітин, агентами, що пригнічують синтез ДНК q Зміни температурних умов росту q Додаванням до культури бактерій бактеріофагів • Компетентність може розвиватися протягом декількох хвилин • Частка компетентних клітин у культурі коливається від декількох відсотків у Pseudomonas stutzeri, до 10 – 15 % у B. subtilis і майже 100 % у H. influenzae і S. pneumoniae
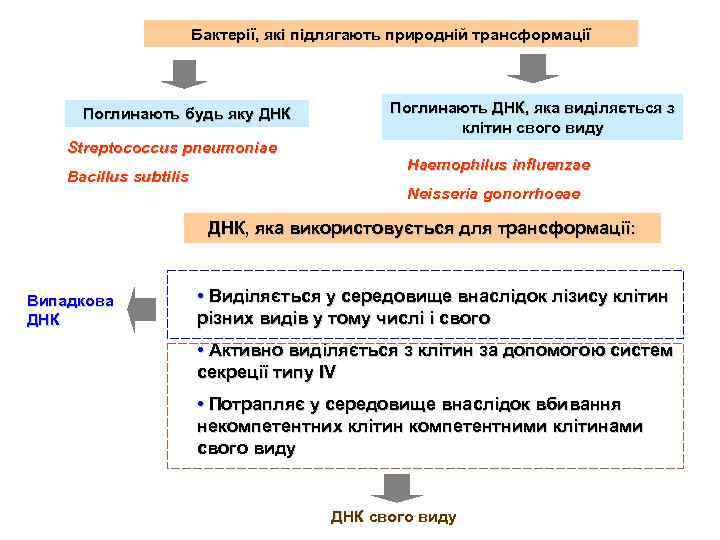
Бактерії, які підлягають природній трансформації Поглинають будь яку ДНК Streptococcus pneumoniae Bacillus subtilis Поглинають ДНК, яка виділяється з клітин свого виду Haemophilus influenzae Neisseria gonorrhoeae ДНК, яка використовується для трансформації: Випадкова ДНК • Виділяється у середовище внаслідок лізису клітин різних видів у тому числі і свого • Активно виділяється з клітин за допомогою систем секреції типу IV • Потрапляє у середовище внаслідок вбивання некомпетентних клітин компетентними клітинами свого виду ДНК свого виду
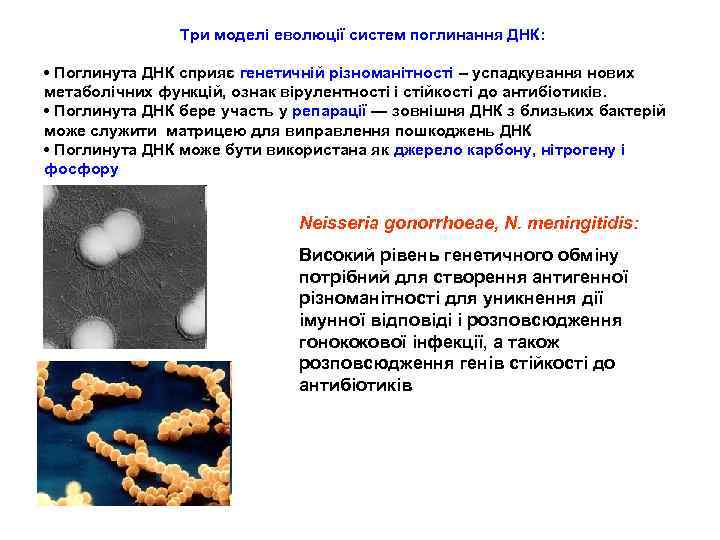
Tри моделі eволюції систем поглинання ДНК: • Поглинута ДНК сприяє генетичній різноманітності – успадкування нових метаболічних функцій, ознак вірулентності і стійкості до антибіотиків. • Поглинута ДНК бере участь у репарації — зовнішня ДНК з близьких бактерій може служити матрицею для виправлення пошкоджень ДНК • Поглинута ДНК може бути використана як джерело карбону, нітрогену і фосфору Neisseria gonorrhoeae, N. meningitidis: Високий рівень генетичного обміну потрібний для створення антигенної різноманітності для уникнення дії імунної відповіді і розповсюдження гонококової інфекції, а також розповсюдження генів стійкості до антибіотиків
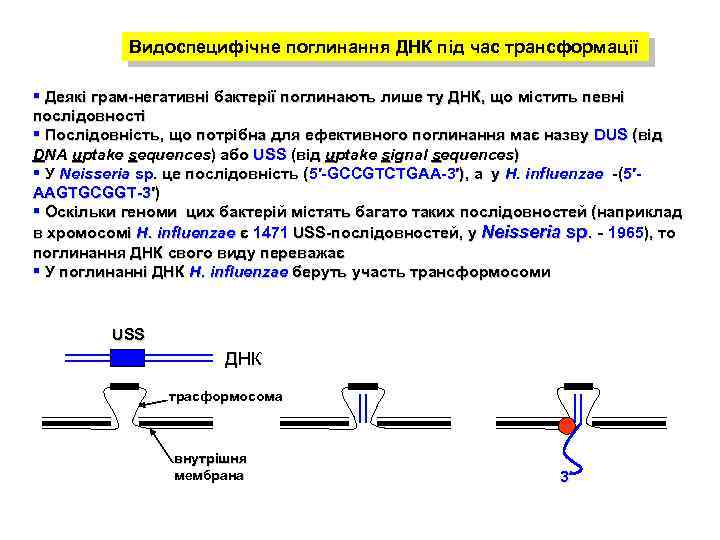
Видоспецифічне поглинання ДНК під час трансформації § Деякі грам-негативні бактерії поглинають лише ту ДНК, що містить певні послідовності § Послідовність, що потрібна для ефективного поглинання має назву DUS (від DNA uptake sequences) або USS (від uptake signal sequences) § У Neisseria sp. це послідовність (5′-GCCGTCTGAA-3′), а у H. influenzae -(5′AAGTGCGGT-3′) § Оскільки геноми цих бактерій містять багато таких послідовностей (наприклад в хромосомі H. influenzae є 1471 USS-послідовностей, у Neisseria sp. - 1965), то поглинання ДНК свого виду переважає § У поглинанні ДНК H. influenzae беруть участь трансформосоми USS ДНК трасформосома внутрішня мембрана 3’
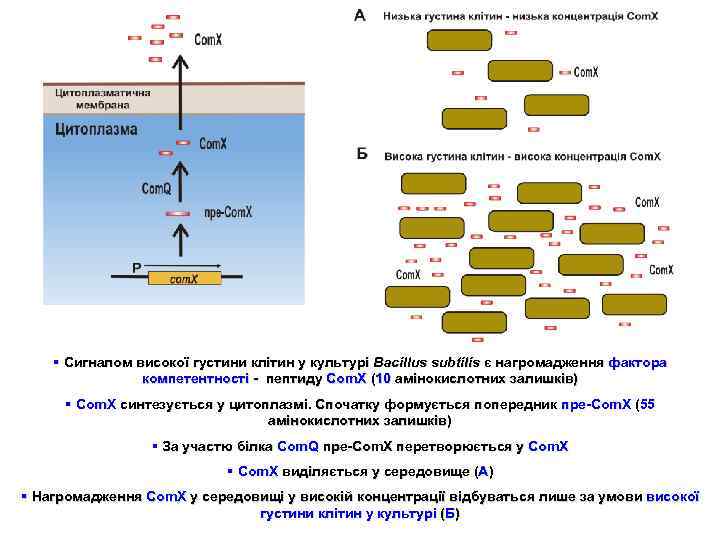
§ Сигналом високої густини клітин у культурі Bacillus subtilis є нагромадження фактора компетентності - пептиду Com. X (10 амінокислотних залишків) § Com. X синтезується у цитоплазмі. Спочатку формується попередник пре-Com. X (55 амінокислотних залишків) § За участю білка Сom. Q пре-Com. X перетворюється у Com. X § Соm. X виділяється у середовище (А) § Нагромадження Com. X у середовищі у високій концентрації відбуваться лише за умови високої густини клітин у культурі (Б)
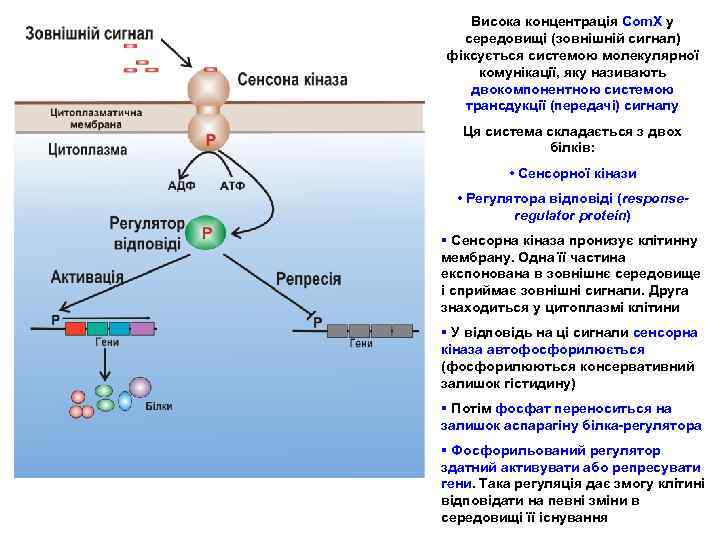
Висока концентрація Com. X у середовищі (зовнішній сигнал) фіксується системою молекулярної комунікації, яку називають двокомпонентною системою трансдукції (передачі) сигналу Ця система складається з двох білків: • Сенсорної кінази • Регулятора відповіді (responseregulator protein) § Cенсорна кіназа пронизує клітинну мембрану. Одна її частина експонована в зовнішнє середовище і сприймає зовнішні сигнали. Друга знаходиться у цитоплазмі клітини § У відповідь на ці сигнали сенсорна кіназа автофосфорилюється (фосфорилюються консервативний залишок гістидину) § Потім фосфат переноситься на залишок аспарагіну білка-регулятора § Фосфорильований регулятор здатний активувати або репресувати гени. Така регуляція дає змогу клітині відповідати на певні зміни в середовищі її існування
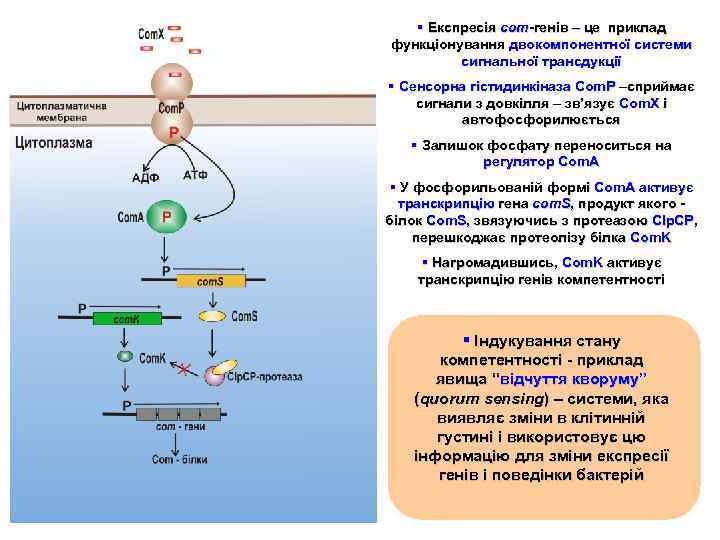
§ Експресія com-генів – це приклад функціонування двокомпонентної системи сигнальної трансдукції § Сенсорна гістидинкіназа Сom. P –сприймає сигнали з довкілля – зв’язує Com. X і автофосфорилюється § Залишок фосфату переноситься на регулятор Com. A § У фосфорильованій формі Com. A активує транскрипцію гена com. S, продукт якого білок Com. S, звязуючись з протеазою Clp. CP, перешкоджає протеолізу білка Com. K § Нагромадившись, Com. K активує транскрипцію генів компетентності § Індукування стану компетентності - приклад явища “відчуття кворуму” (quorum sensing) – cистеми, яка виявляє зміни в клітинній густині і використовує цю інформацію для зміни експресії генів і поведінки бактерій
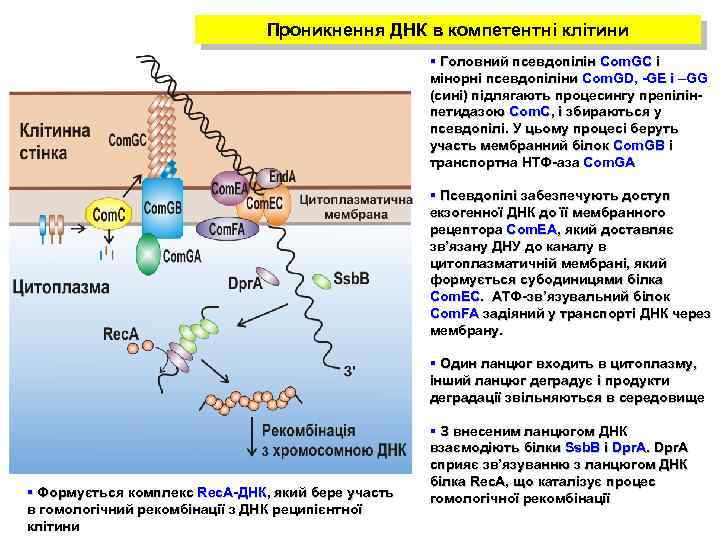
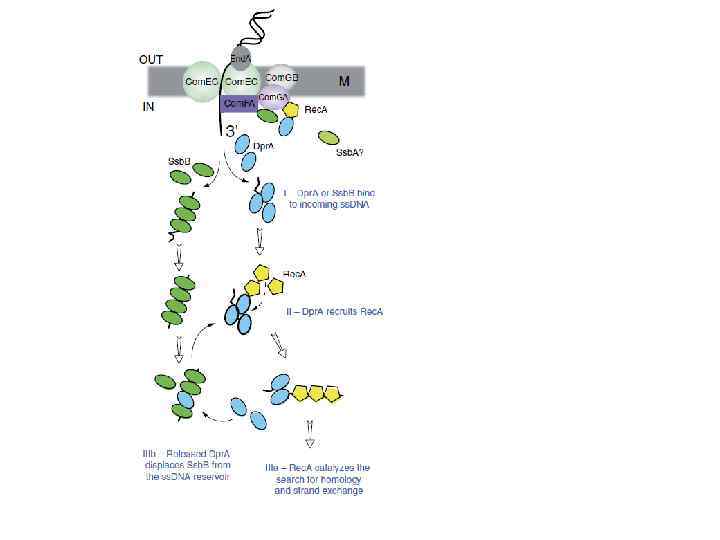
Проникнення ДНК в компетентні клітини § Головний псевдопілін Com. GC і мінорні псевдопіліни Com. GD, -GE і –GG (сині) підлягають процесингу препілінпетидазою Com. C, і збираються у псевдопілі. У цьому процесі беруть участь мембранний білок Com. GB і транспортна НТФ-аза Com. GA § Псевдопілі забезпечують доступ екзогенної ДНК до її мембранного рецептора Com. EA, який доставляє зв’язану ДНУ до каналу в цитоплазматичній мембрані, який формується субодиницями білка Com. EC. ATФ-зв’язувальний білок Com. FA задіяний у транспорті ДНК через мембрану. § Один ланцюг входить в цитоплазму, інший ланцюг деградує і продукти деградації звільняються в середовище § Формується комплекс Rec. A-ДНК, який бере участь в гомологічний рекомбінації з ДНК реципієнтної клітини § З внесеним ланцюгом ДНК взаємодіють білки Ssb. B і Dpr. A cприяє зв’язуванню з ланцюгом ДНК білка Rec. A, що каталізує процес гомологічної рекомбінації
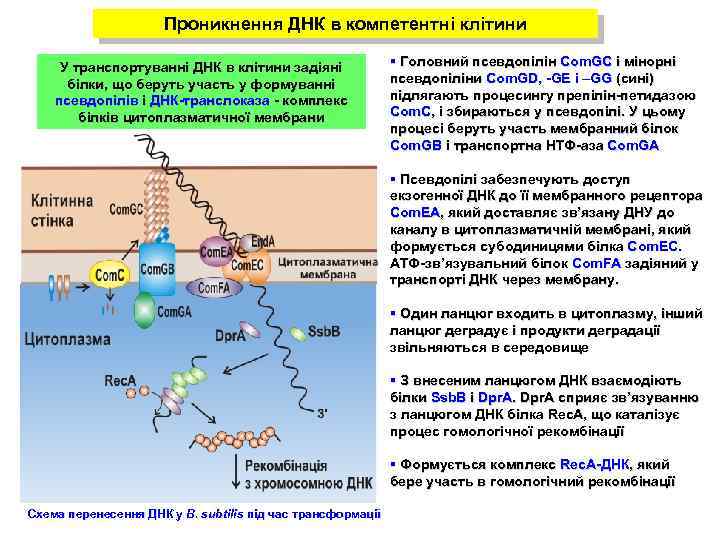
Проникнення ДНК в компетентні клітини У транспортуванні ДНК в клітини задіяні білки, що беруть участь у формуванні псевдопілів і ДНК-транслоказа - комплекс білків цитоплазматичної мембрани § Головний псевдопілін Com. GC і мінорні псевдопіліни Com. GD, -GE і –GG (сині) підлягають процесингу препілін-петидазою Com. C, і збираються у псевдопілі. У цьому процесі беруть участь мембранний білок Com. GB і транспортна НТФ-аза Com. GA § Псевдопілі забезпечують доступ екзогенної ДНК до її мембранного рецептора Com. EA, який доставляє зв’язану ДНУ до каналу в цитоплазматичній мембрані, який формується субодиницями білка Com. EC. ATФ-зв’язувальний білок Com. FA задіяний у транспорті ДНК через мембрану. § Один ланцюг входить в цитоплазму, інший ланцюг деградує і продукти деградації звільняються в середовище § З внесеним ланцюгом ДНК взаємодіють білки Ssb. B і Dpr. A cприяє зв’язуванню з ланцюгом ДНК білка Rec. A, що каталізує процес гомологічної рекомбінації § Формується комплекс Rec. A-ДНК, який бере участь в гомологічний рекомбінації Схема перенесення ДНК у B. subtilis під час трансформації
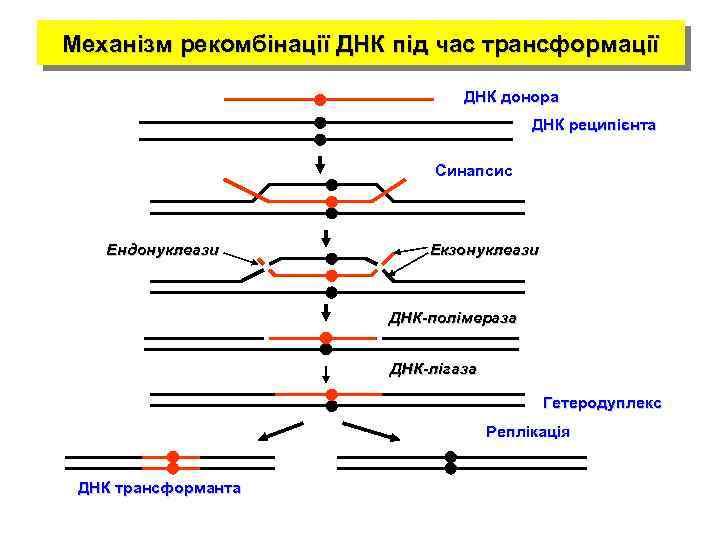
Механізм рекомбінації ДНК під час трансформації ДНК донора ДНК реципієнта Синапсис Ендонуклеази Екзонуклеази ДНК-полімераза ДНК-лігаза Гетеродуплекс Реплікація ДНК трансформанта
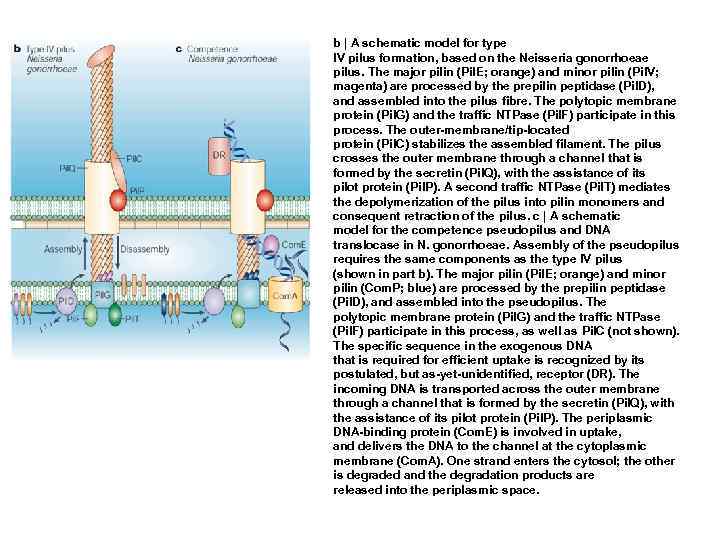
b | A schematic model for type IV pilus formation, based on the Neisseria gonorrhoeae pilus. The major pilin (Pil. E; orange) and minor pilin (Pil. V; magenta) are processed by the prepilin peptidase (Pil. D), and assembled into the pilus fibre. The polytopic membrane protein (Pil. G) and the traffic NTPase (Pil. F) participate in this process. The outer-membrane/tip-located protein (Pil. C) stabilizes the assembled filament. The pilus crosses the outer membrane through a channel that is formed by the secretin (Pil. Q), with the assistance of its pilot protein (Pil. P). A second traffic NTPase (Pil. T) mediates the depolymerization of the pilus into pilin monomers and consequent retraction of the pilus. c | A schematic model for the competence pseudopilus and DNA translocase in N. gonorrhoeae. Assembly of the pseudopilus requires the same components as the type IV pilus (shown in part b). The major pilin (Pil. E; orange) and minor pilin (Com. P; blue) are processed by the prepilin peptidase (Pil. D), and assembled into the pseudopilus. The polytopic membrane protein (Pil. G) and the traffic NTPase (Pil. F) participate in this process, as well as Pil. C (not shown). The specific sequence in the exogenous DNA that is required for efficient uptake is recognized by its postulated, but as-yet-unidentified, receptor (DR). The incoming DNA is transported across the outer membrane through a channel that is formed by the secretin (Pil. Q), with the assistance of its pilot protein (Pil. P). The periplasmic DNA-binding protein (Com. E) is involved in uptake, and delivers the DNA to the channel at the cytoplasmic membrane (Com. A). One strand enters the cytosol; the other is degraded and the degradation products are released into the periplasmic space.
MG_13.ppt