БТ6 ТГ тварини.ppt
- Количество слайдов: 25
 Генетична інженерія тварин
Генетична інженерія тварин
 Схема отримання трасгенних мишей за допомогою мікроін’єкцій ДНК в яйцеклітини 1. Конструювання рек ДНК 2. Ін’єкції лінійної ДНК за допомогою мікропіпетки в чоловічий пронуклеус заплідненої яйцеклітини 3. Перенесення ембріона в організм псевдовагітної самки 4. Розвиток ембріона до народження 5. Аналіз чи нащадки є трансгенними (Саузерн- гібридизація, ПЛР) 6. Зазвичай у 70% трансгени є в усіх клітинах організму, у 30% трансген міститься в частині соматичних клітин, тобто вони є мозаїками 1. 2. 3. 5. 4.
Схема отримання трасгенних мишей за допомогою мікроін’єкцій ДНК в яйцеклітини 1. Конструювання рек ДНК 2. Ін’єкції лінійної ДНК за допомогою мікропіпетки в чоловічий пронуклеус заплідненої яйцеклітини 3. Перенесення ембріона в організм псевдовагітної самки 4. Розвиток ембріона до народження 5. Аналіз чи нащадки є трансгенними (Саузерн- гібридизація, ПЛР) 6. Зазвичай у 70% трансгени є в усіх клітинах організму, у 30% трансген міститься в частині соматичних клітин, тобто вони є мозаїками 1. 2. 3. 5. 4.
 Сумарна ефективність трансгенозу після мікроін’єкцій
Сумарна ефективність трансгенозу після мікроін’єкцій
 Отримання трансгенних мишей з геном гормона росту щурів Р. Пальмітер Трансгенна миша з геном гормону росту щура q Сконструйовано плазміду, в якій регуляторна ділянка гена металотеонеїну І злита зі структурною частиною гена гормона росту щура q Металотеонеїн зв’язує іони багатьох металів і особливо Zn 2+. Промотор його гена активується за присутності Zn 2+ та експресується в клітинах печінки q По 600 копій фрагмента плазміди з гормоном росту щура перенесено у чоловічі пронуклеуси 170 запліднених яйцеклітин, які імплантовано в організм самок мишей q Отримано 7 нащадків, які несли у своємі геномі злитий ген q 6 з 7 мали більші розміри тіла, ніж звичайні миші, в клітинах їхньої печінки виявлено підвищений вміст м. РНК злитого гена, а в крові – високий рівень гормону росту q Гормон росту в таких тварин продукувався клітинами печінки, а не гіпофіза
Отримання трансгенних мишей з геном гормона росту щурів Р. Пальмітер Трансгенна миша з геном гормону росту щура q Сконструйовано плазміду, в якій регуляторна ділянка гена металотеонеїну І злита зі структурною частиною гена гормона росту щура q Металотеонеїн зв’язує іони багатьох металів і особливо Zn 2+. Промотор його гена активується за присутності Zn 2+ та експресується в клітинах печінки q По 600 копій фрагмента плазміди з гормоном росту щура перенесено у чоловічі пронуклеуси 170 запліднених яйцеклітин, які імплантовано в організм самок мишей q Отримано 7 нащадків, які несли у своємі геномі злитий ген q 6 з 7 мали більші розміри тіла, ніж звичайні миші, в клітинах їхньої печінки виявлено підвищений вміст м. РНК злитого гена, а в крові – високий рівень гормону росту q Гормон росту в таких тварин продукувався клітинами печінки, а не гіпофіза
 Введення трансгенів в плюрипотентні ембріональні стовбурові клітини q Клітини виділяють з бластоцисти. Трансформують їх in vitro q Відбирають трансформовані клітини за функцією маркерних генів q Трансформовані клітини переносять у бластоцисти q Інший метод – інкубація ембріональних клітин in vitro у присутності фібробластів, які продукують рекомбінантні вірусні частинки q Вірусні частинки переносять трансген в клітини ембріонів q Потім заражені вірусним вектором ембріони переносять в організм псевдовагітної самки
Введення трансгенів в плюрипотентні ембріональні стовбурові клітини q Клітини виділяють з бластоцисти. Трансформують їх in vitro q Відбирають трансформовані клітини за функцією маркерних генів q Трансформовані клітини переносять у бластоцисти q Інший метод – інкубація ембріональних клітин in vitro у присутності фібробластів, які продукують рекомбінантні вірусні частинки q Вірусні частинки переносять трансген в клітини ембріонів q Потім заражені вірусним вектором ембріони переносять в організм псевдовагітної самки
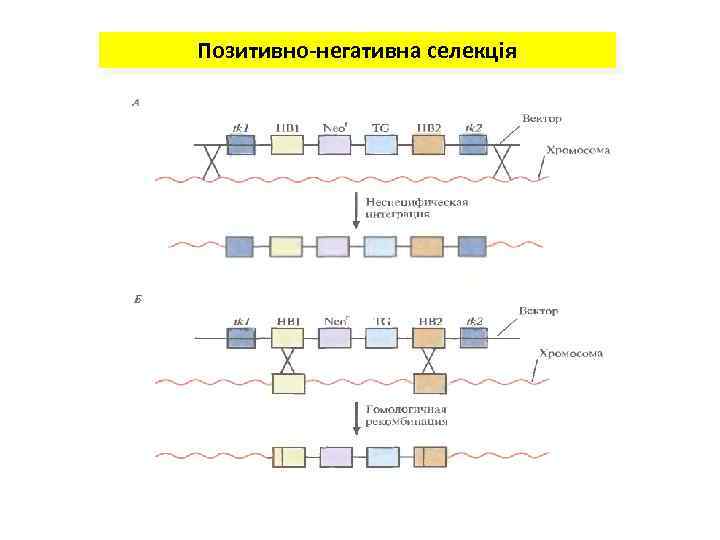 Позитивно-негативна селекція
Позитивно-негативна селекція
 Отримання нокаутних тварин Ген Х Клонування у вектор копії гена Х з інсерцією гена neo. R Х: : neo. R ТК+ Трансформація клітин рекомбінантною ДНК ТК+ Заміщення за рахунок подвійного кросинговеру нормального гена в хромосомі на його мутантний алель, селекція мутантних клітин Отримання трансгенних тварин за схемами, наведеними на попередніх слайдах
Отримання нокаутних тварин Ген Х Клонування у вектор копії гена Х з інсерцією гена neo. R Х: : neo. R ТК+ Трансформація клітин рекомбінантною ДНК ТК+ Заміщення за рахунок подвійного кросинговеру нормального гена в хромосомі на його мутантний алель, селекція мутантних клітин Отримання трансгенних тварин за схемами, наведеними на попередніх слайдах
 Використання трансгенних тварин 1. Трансгенні тварини – моделі для вивчення: q Генетики тварин, зокрема, онтогенетики q Можливих змін фізіологічного статусу у лабораторних та сільськогосподарських тварин внаслідок впливу трансгенів q Захворювань людини (з цією метою найчастіше використовують тварин з нокаутами певних генів) (хв. Альцгеймера, артриту, м’язевих дистрофій, онкологічних захворювань, гіпертонії, діабету, серцево-судинних захворювань) 2. Трансгенні ссавці, в молоці яких нагромаджуються білки, що мають терапевтичне значення (інтерферон, імуноглобуліни, фактори VIII, ІХ, фібриноген, лактоферин тощо). У цьому випадку гени клонують з використанням регуляторних послідовностей генів казеїнів, β – лактоглобулінів, α-лактальбумінів – білків, які секретуються в епітеліальних клітинах молочної залози. 3. Трансгенні тварини як джерело органів для пересадки.
Використання трансгенних тварин 1. Трансгенні тварини – моделі для вивчення: q Генетики тварин, зокрема, онтогенетики q Можливих змін фізіологічного статусу у лабораторних та сільськогосподарських тварин внаслідок впливу трансгенів q Захворювань людини (з цією метою найчастіше використовують тварин з нокаутами певних генів) (хв. Альцгеймера, артриту, м’язевих дистрофій, онкологічних захворювань, гіпертонії, діабету, серцево-судинних захворювань) 2. Трансгенні ссавці, в молоці яких нагромаджуються білки, що мають терапевтичне значення (інтерферон, імуноглобуліни, фактори VIII, ІХ, фібриноген, лактоферин тощо). У цьому випадку гени клонують з використанням регуляторних послідовностей генів казеїнів, β – лактоглобулінів, α-лактальбумінів – білків, які секретуються в епітеліальних клітинах молочної залози. 3. Трансгенні тварини як джерело органів для пересадки.
 • • • Трансгенні тварини як біореактори Трансгенні миші: інтерферон, фактор звертання крові ІХ, сиворотковий альбумін, ІЛ-2. Трансгенні кролі: ІЛ-2, тканинний активатор плазміногену. Трансгенні вівці та кози: казеїн, фактор звертання крові ІХ, α-та β- лактальбуміни, тканинний активатор плазміногену. Трансгенна ВРХ: казеїн (αs 1, αs 2, β, κ), α- та βлактальбуміни, лізоцим, імуноглобуліни, фібриноген, інсулін).
• • • Трансгенні тварини як біореактори Трансгенні миші: інтерферон, фактор звертання крові ІХ, сиворотковий альбумін, ІЛ-2. Трансгенні кролі: ІЛ-2, тканинний активатор плазміногену. Трансгенні вівці та кози: казеїн, фактор звертання крові ІХ, α-та β- лактальбуміни, тканинний активатор плазміногену. Трансгенна ВРХ: казеїн (αs 1, αs 2, β, κ), α- та βлактальбуміни, лізоцим, імуноглобуліни, фібриноген, інсулін).
 • Світова потреба у факторі звертання крові ІХ ~ 85 кг, у факторі VIII ~ 7 кг на рік. В 1 мл молока є приблизно 1 мг білку. 1 корова дає щорічно ~6 тис. л. молока, з якого можна отримати ~ 6 кг білка. Всю потребу у факторі VIII може забезпечити 1 -2 корови, а у факторі IХ – 15 -20 трансгенних корів. • Під Москвою є стадо трансгенних овець, які продукують хімозин, що є необхідним для виробництва твердих сирів. Від 1 вівці за період однієї лактації можна отримати 30 г ферменту, якого вистачає, щоб отримати 30 т сиру. • Отримано безлактозне молоко. • У 2005 р. отримали трансгенну мавпу. • Сьогодні у світі налагоджено виробництво більше 150 генно-інженерних лікарських субстанцій.
• Світова потреба у факторі звертання крові ІХ ~ 85 кг, у факторі VIII ~ 7 кг на рік. В 1 мл молока є приблизно 1 мг білку. 1 корова дає щорічно ~6 тис. л. молока, з якого можна отримати ~ 6 кг білка. Всю потребу у факторі VIII може забезпечити 1 -2 корови, а у факторі IХ – 15 -20 трансгенних корів. • Під Москвою є стадо трансгенних овець, які продукують хімозин, що є необхідним для виробництва твердих сирів. Від 1 вівці за період однієї лактації можна отримати 30 г ферменту, якого вистачає, щоб отримати 30 т сиру. • Отримано безлактозне молоко. • У 2005 р. отримали трансгенну мавпу. • Сьогодні у світі налагоджено виробництво більше 150 генно-інженерних лікарських субстанцій.
 Приклад використання реконструкції клітин для клонування хребетної тварини q Провели енуклеацію яйцеклітин вівці породи Шотландська чорноморда q “Половинки” яйця злили з клітинами молочної залози вівці породи Фінндорсет, яка знаходилася в останньому триместрі вагітності q Донорне ядро та реципієнтна цитоплазма повинні бути на однакових стадіях клітинного циклу – G 0 q Злиті клітини поміщали на поживне середовище і стимулювали до розвитку електричним струмом. q Через 6 діб культивування ембріони , які розвинулися до стадії морули або бластоцисти, переносили в матку сурогатної матері, де вони розвивалися до народження. Із 277 реконструйованих яйцеклітин отримано 1 живе ягня (Доллі) q В інших експериментах донорними були також клітини з внутрішньої клітинної маси бластоцисти, які культивували in vitro
Приклад використання реконструкції клітин для клонування хребетної тварини q Провели енуклеацію яйцеклітин вівці породи Шотландська чорноморда q “Половинки” яйця злили з клітинами молочної залози вівці породи Фінндорсет, яка знаходилася в останньому триместрі вагітності q Донорне ядро та реципієнтна цитоплазма повинні бути на однакових стадіях клітинного циклу – G 0 q Злиті клітини поміщали на поживне середовище і стимулювали до розвитку електричним струмом. q Через 6 діб культивування ембріони , які розвинулися до стадії морули або бластоцисти, переносили в матку сурогатної матері, де вони розвивалися до народження. Із 277 реконструйованих яйцеклітин отримано 1 живе ягня (Доллі) q В інших експериментах донорними були також клітини з внутрішньої клітинної маси бластоцисти, які культивували in vitro
 Я. Вільмут з Рослінського інституту в Шотландії, в лабораторії якого у 1997 році клоновано вівцю Вівця Доллі та її сурогатна мати
Я. Вільмут з Рослінського інституту в Шотландії, в лабораторії якого у 1997 році клоновано вівцю Вівця Доллі та її сурогатна мати
 Клонування людини. Клонування - (англ. Cloning від др. -грец. κλών — «гілочка, пагін» ) — в самому загальному значенні — точне відтворення якогось об’єкту N-ну кількість разів. Об’’єкти, отриманні в результаті клонування, називаються клоном, причому як кожний окремо, так і весь ряд. Типи клонування людини Репродуктивне клонування людини передбачає, що індивід, який народився у результаті клонування повинен отримати ім'я, громадянські права, освіту, виховання, тобто все те, що отримують інші повнозначні громадяни держави. Репродуктивне клонування людей зустрілося із великою кількістю етичних, релігійних, юридичних проблем, що на сьогоднішній день не мають конкретного вирішення. В більшості країн світу репродуктивне клонування заборонено законом. Терапевтичне клонування людини передбачає, що розвиток ембріона закінчується через 14 днів, використовується для отримання стовбурних клітин з ембріону. Законодавці багатьох країн бояться, що легалізація терапевтичного клонування може призвести до переходу його у репродуктивне. Проте у деяких державах (США, Великобританія) воно є дозволеним.
Клонування людини. Клонування - (англ. Cloning від др. -грец. κλών — «гілочка, пагін» ) — в самому загальному значенні — точне відтворення якогось об’єкту N-ну кількість разів. Об’’єкти, отриманні в результаті клонування, називаються клоном, причому як кожний окремо, так і весь ряд. Типи клонування людини Репродуктивне клонування людини передбачає, що індивід, який народився у результаті клонування повинен отримати ім'я, громадянські права, освіту, виховання, тобто все те, що отримують інші повнозначні громадяни держави. Репродуктивне клонування людей зустрілося із великою кількістю етичних, релігійних, юридичних проблем, що на сьогоднішній день не мають конкретного вирішення. В більшості країн світу репродуктивне клонування заборонено законом. Терапевтичне клонування людини передбачає, що розвиток ембріона закінчується через 14 днів, використовується для отримання стовбурних клітин з ембріону. Законодавці багатьох країн бояться, що легалізація терапевтичного клонування може призвести до переходу його у репродуктивне. Проте у деяких державах (США, Великобританія) воно є дозволеним.
 Терапевтичне клонування людини передбачає, що розвиток ембріона закінчується через 14 днів, використовується для отримання стовбурних клітин з ембріону. Законодавці багатьох країн бояться, що легалізація терапевтичного клонування може призвести до переходу його у репродуктивне. Проте у деяких державах воно є дозволеним.
Терапевтичне клонування людини передбачає, що розвиток ембріона закінчується через 14 днів, використовується для отримання стовбурних клітин з ембріону. Законодавці багатьох країн бояться, що легалізація терапевтичного клонування може призвести до переходу його у репродуктивне. Проте у деяких державах воно є дозволеним.
 З А К О Н У К Р А Ї Н И • Про ( заборону Відомості Верховної репродуктивного Ради України клонування (ВВР), 2005, N людини 5, ст. 111 ) Цей Закон вводить заборону репродуктивного клонування людини в Україні виходячи з принципів поваги до людини, визнання цінності особистості, необхідності захисту прав і свобод людини та враховуючи недостатню дослідженість біологічних та соціальних наслідків клонування людини.
З А К О Н У К Р А Ї Н И • Про ( заборону Відомості Верховної репродуктивного Ради України клонування (ВВР), 2005, N людини 5, ст. 111 ) Цей Закон вводить заборону репродуктивного клонування людини в Україні виходячи з принципів поваги до людини, визнання цінності особистості, необхідності захисту прав і свобод людини та враховуючи недостатню дослідженість біологічних та соціальних наслідків клонування людини.
 • . • У 2000 р. шляхом відбору ембріонів народилася дитина, яка стала донором стовбурових клітин для своє сестри. • У 2001 р. народилася перша дитина – цитодуктант.
• . • У 2000 р. шляхом відбору ембріонів народилася дитина, яка стала донором стовбурових клітин для своє сестри. • У 2001 р. народилася перша дитина – цитодуктант.
 Генна терапія – сукупність генно-інженерних і медичних методів, скерованих на внесення змін в генетичний апарат соматичних клітин людини з метою лікування захворювань. За допомогою генної терапії можна виправляти: q Мутації у лініях зародкових клітин q Соматичні мутацій q Зміни, зумовлені появою чужорідного генетичного матеріалу, наприклад, внаслідок інфекції.
Генна терапія – сукупність генно-інженерних і медичних методів, скерованих на внесення змін в генетичний апарат соматичних клітин людини з метою лікування захворювань. За допомогою генної терапії можна виправляти: q Мутації у лініях зародкових клітин q Соматичні мутацій q Зміни, зумовлені появою чужорідного генетичного матеріалу, наприклад, внаслідок інфекції.
 Генна терапія in vivo Використовують векторні системи, здатні переносити гени у певні типи клітин (тканин). Генетична трансформація відбувається в організмі хворого Ліпосоми з ДНК Ін’єкція в тканини Рекомбінантний вірус Системна інфузія Рекомбінантна плазміда
Генна терапія in vivo Використовують векторні системи, здатні переносити гени у певні типи клітин (тканин). Генетична трансформація відбувається в організмі хворого Ліпосоми з ДНК Ін’єкція в тканини Рекомбінантний вірус Системна інфузія Рекомбінантна плазміда
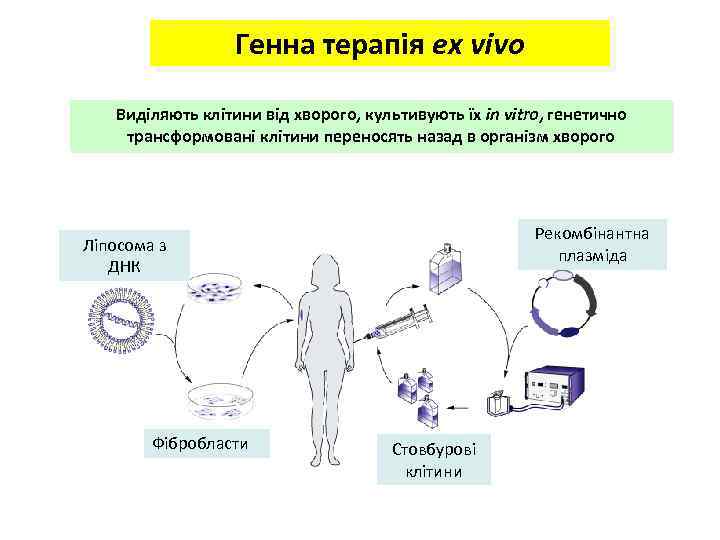 Генна терапія ex vivo Виділяють клітини від хворого, культивують їх in vitro, генетично трансформовані клітини переносять назад в організм хворого Рекомбінантна плазміда Ліпосома з ДНК Фібробласти Стовбурові клітини
Генна терапія ex vivo Виділяють клітини від хворого, культивують їх in vitro, генетично трансформовані клітини переносять назад в організм хворого Рекомбінантна плазміда Ліпосома з ДНК Фібробласти Стовбурові клітини
 Захворювання, для яких розроблені технології генної терапії Захворювання Клітини - мішені Ген, який переносять Гемофілія А, гемофілія В Клітини печінки, м’язів, фібробласти, клітини кісткового мозку Гени факторів VIII та IX Родинна гіперхолестеролемія Клітини печінки Ген рецептора ліпопротеїнів низької густини Комбінований імунодефіцит Клітини кісткового мозку, Т Ген аденозиндезамінази -клітини (ADA) Гемоглобінопатії Клітини-попередники еритроцитів α- та β-глобінів Муковісцидоз Клітини епітелію легень та носової порожнини Ген CFTR Хвороба Гоше Клітини кісткового мозку, макрофаги Ген глікоцереброзидази Рак Пухлинні клітини Ген р53, Rb, інтерлейкінів, апоптозу, інгібіторів росту
Захворювання, для яких розроблені технології генної терапії Захворювання Клітини - мішені Ген, який переносять Гемофілія А, гемофілія В Клітини печінки, м’язів, фібробласти, клітини кісткового мозку Гени факторів VIII та IX Родинна гіперхолестеролемія Клітини печінки Ген рецептора ліпопротеїнів низької густини Комбінований імунодефіцит Клітини кісткового мозку, Т Ген аденозиндезамінази -клітини (ADA) Гемоглобінопатії Клітини-попередники еритроцитів α- та β-глобінів Муковісцидоз Клітини епітелію легень та носової порожнини Ген CFTR Хвороба Гоше Клітини кісткового мозку, макрофаги Ген глікоцереброзидази Рак Пухлинні клітини Ген р53, Rb, інтерлейкінів, апоптозу, інгібіторів росту
 Генна терапія дефіциту аденозин дезамінази (ADA), ex vivo Початкові етапи катаболізму пуринових нуклеотидів АМФ Н 2 О 5’-нуклеотидаза Аденозиндезаміназа Рі Н 2 О Інозин + аміак NH 3 q. Дефіцит ADA (спадкове моногенне рецесивне захворювання, 1/25000 новонароджених) зумовлює нагромадження 2 -дезоксиаденозину, який руйнують Т-клітини, та спричиняє сильний комбінований імунодефіцит q. Ген ADA міститься в 20 хромосомі людини q Хворі діти народжуються у гетерозиготних батьків, в яких знижена активність ADA; відразу після народження таких дітей поміщають в стерильні умови, оскільки вони чутливі до будьякої інфекції q ADA-недостатність вже лікують за допомогою пересадки кісткового мозку
Генна терапія дефіциту аденозин дезамінази (ADA), ex vivo Початкові етапи катаболізму пуринових нуклеотидів АМФ Н 2 О 5’-нуклеотидаза Аденозиндезаміназа Рі Н 2 О Інозин + аміак NH 3 q. Дефіцит ADA (спадкове моногенне рецесивне захворювання, 1/25000 новонароджених) зумовлює нагромадження 2 -дезоксиаденозину, який руйнують Т-клітини, та спричиняє сильний комбінований імунодефіцит q. Ген ADA міститься в 20 хромосомі людини q Хворі діти народжуються у гетерозиготних батьків, в яких знижена активність ADA; відразу після народження таких дітей поміщають в стерильні умови, оскільки вони чутливі до будьякої інфекції q ADA-недостатність вже лікують за допомогою пересадки кісткового мозку
 Схема ex vivo генної терапії дефіциту ADA Виділення від пацієнта мононуклеарних клітин Вирощування клітин у культурі за умов, які сприяють розмноженню Т-клітин Трансфекція Т-клітин in vitro ретровірусним вектором, який містить нормальний ген ADA (ADA+) і ген neo як маркер Повторні уведення Т-лімфоцитів в організм пацієнта (7 разів впродовж 10 місяців) Підвищення активності ADA та помітне покращення стану пацієнтів q Час життя зрілих Тлімфоцитів невеликий і вони поступово заміщаються новими ADA- - клітинами q Тому потрібні повторні уведення ADA+ - клітин, або уведення стовбурових клітин крові з нормальним геном ADA
Схема ex vivo генної терапії дефіциту ADA Виділення від пацієнта мононуклеарних клітин Вирощування клітин у культурі за умов, які сприяють розмноженню Т-клітин Трансфекція Т-клітин in vitro ретровірусним вектором, який містить нормальний ген ADA (ADA+) і ген neo як маркер Повторні уведення Т-лімфоцитів в організм пацієнта (7 разів впродовж 10 місяців) Підвищення активності ADA та помітне покращення стану пацієнтів q Час життя зрілих Тлімфоцитів невеликий і вони поступово заміщаються новими ADA- - клітинами q Тому потрібні повторні уведення ADA+ - клітин, або уведення стовбурових клітин крові з нормальним геном ADA
 Приклади генної терапії in vivo q Гемофілія В зумовлена недостатністю фактора IX, який виділяють у кров клітини печінки q Рекомбінантні молекули з к. ДНК гена фактора ІХ, сконструйовану на основі аденовірусного вектора, уводять в печінку через ворітну вену q Аденовіруси здатні інфікувати гепатоцити (немає потреби проводити гепатектомію) q Спостерігається зростання концентрації фактора ІХ в крові та нормальне зсідання крові
Приклади генної терапії in vivo q Гемофілія В зумовлена недостатністю фактора IX, який виділяють у кров клітини печінки q Рекомбінантні молекули з к. ДНК гена фактора ІХ, сконструйовану на основі аденовірусного вектора, уводять в печінку через ворітну вену q Аденовіруси здатні інфікувати гепатоцити (немає потреби проводити гепатектомію) q Спостерігається зростання концентрації фактора ІХ в крові та нормальне зсідання крові
 Приклади генної терапії in vivo • М’язева дистрофія Дюшена зумовлена мутаціями гена дисторофіну. Для нормального функіонування м’язів принаймні 10% міобластів повинні нести нормальний ген дистрофіну • Аденовруси здатні інфікувати міобласти • В аденовірусний вектор клонують вкорочений, але функціональний ген дистрофіну- мініген (повний ген занадто великий для такого вектора) та уводять його у міобласти • Від 5 до 50% таких міобластів експресували мінідистрофін
Приклади генної терапії in vivo • М’язева дистрофія Дюшена зумовлена мутаціями гена дисторофіну. Для нормального функіонування м’язів принаймні 10% міобластів повинні нести нормальний ген дистрофіну • Аденовруси здатні інфікувати міобласти • В аденовірусний вектор клонують вкорочений, але функціональний ген дистрофіну- мініген (повний ген занадто великий для такого вектора) та уводять його у міобласти • Від 5 до 50% таких міобластів експресували мінідистрофін



