трансген123789.pptx
- Количество слайдов: 12

 Генетически модифицированные организмы (ГМО): трансгенные культуры и технологии рекомбинантной ДНК q
Генетически модифицированные организмы (ГМО): трансгенные культуры и технологии рекомбинантной ДНК q
 * Текущее использование генетически модифицированных организмов Сельскохозяйственные растения являются одним из наиболее часто цитируемых примеров генетически модифицированных организмов (ГМО). Некоторые преимущества генной инженерии в сельском хозяйстве увеличилась урожайность, сократить расходы на продукты питания или наркотиков производства, снижение потребности в пестицидах, повышение состав питательных веществ и качество продуктов питания, устойчивость к вредителям и болезни , повышения продовольственной безопасности и медицинские льготы для растущего мирового населения , Достижения были также внесены в развитии культуры, которые созревают быстрее и терпеть алюминий, бор, соль, засуха, мороз, и других экологических стрессоров, что позволяет растениям расти в условиях, когда они не могут иначе процветать (Таблица 1; Takeda и Мацуока, 2008) , Другие области применения включают производство непротеиновой (биопластика) или непромышленных (декоративных растений) продукции. Количество животных также генной инженерии, чтобы увеличить выход и снизить восприимчивость к болезни. Например, лосось были разработаны расти больше (рис 1) и созревает быстрее (Таблица 1), и скот были расширены, чтобы проявлять стойкость к коровьего бешенства (Соединенные Штаты департамента энергетики, 2007).
* Текущее использование генетически модифицированных организмов Сельскохозяйственные растения являются одним из наиболее часто цитируемых примеров генетически модифицированных организмов (ГМО). Некоторые преимущества генной инженерии в сельском хозяйстве увеличилась урожайность, сократить расходы на продукты питания или наркотиков производства, снижение потребности в пестицидах, повышение состав питательных веществ и качество продуктов питания, устойчивость к вредителям и болезни , повышения продовольственной безопасности и медицинские льготы для растущего мирового населения , Достижения были также внесены в развитии культуры, которые созревают быстрее и терпеть алюминий, бор, соль, засуха, мороз, и других экологических стрессоров, что позволяет растениям расти в условиях, когда они не могут иначе процветать (Таблица 1; Takeda и Мацуока, 2008) , Другие области применения включают производство непротеиновой (биопластика) или непромышленных (декоративных растений) продукции. Количество животных также генной инженерии, чтобы увеличить выход и снизить восприимчивость к болезни. Например, лосось были разработаны расти больше (рис 1) и созревает быстрее (Таблица 1), и скот были расширены, чтобы проявлять стойкость к коровьего бешенства (Соединенные Штаты департамента энергетики, 2007).
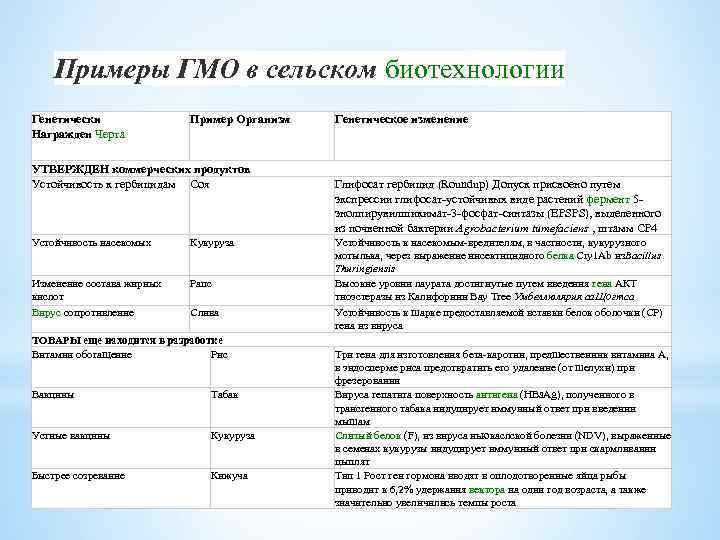 Примеры ГМО в сельском биотехнологии Генетически Награжден Черта Пример Организм УТВЕРЖДЕН коммерческих продуктов Устойчивость к гербицидам Соя Устойчивость насекомых Кукуруза Изменение состава жирных кислот Вирус сопротивление Рапс Слива ТОВАРЫ еще находится в разработке Витамин обогащение Рис Вакцины Табак Устные вакцины Кукуруза Быстрее созревание Кижуча Генетическое изменение Глифосат гербицид (Roundup) Допуск присвоено путем экспрессии глифосат-устойчивых виде растений фермент 5 энолпирувилшикимат-3 -фосфат-синтазы (EPSPS), выделенного из почвенной бактерии Agrobacterium tumefaciens , штамм CP 4 Устойчивость к насекомым-вредителям, в частности, кукурузного мотылька, через выражение инсектицидного белка Cry 1 Ab из. Bacillus Thuringiensis Высокие уровни лаурата достигнутые путем введения гена АКТ тиоэстеразы из Калифорнии Bay Tree Умбеллюлярия са. Щогтса Устойчивость к шарке предоставляемой вставки белок оболочки (CP) гена из вируса Три гена для изготовления бета-каротин, предшественник витамина А, в эндосперме риса предотвратить его удаление (от шелухи) при фрезеровании Вируса гепатита поверхность антигена (HBs. Ag), полученного в трансгенного табака индуцирует иммунный ответ при введении мышам Слитый белок (F), из вируса ньюкаслской болезни (NDV), выраженные в семенах кукурузы индуцирует иммунный ответ при скармливании цыплят Тип 1 Рост ген гормона вводят в оплодотворенные яйца рыбы приводит к 6, 2% удержания вектора на один год возраста, а также значительно увеличились темпы роста
Примеры ГМО в сельском биотехнологии Генетически Награжден Черта Пример Организм УТВЕРЖДЕН коммерческих продуктов Устойчивость к гербицидам Соя Устойчивость насекомых Кукуруза Изменение состава жирных кислот Вирус сопротивление Рапс Слива ТОВАРЫ еще находится в разработке Витамин обогащение Рис Вакцины Табак Устные вакцины Кукуруза Быстрее созревание Кижуча Генетическое изменение Глифосат гербицид (Roundup) Допуск присвоено путем экспрессии глифосат-устойчивых виде растений фермент 5 энолпирувилшикимат-3 -фосфат-синтазы (EPSPS), выделенного из почвенной бактерии Agrobacterium tumefaciens , штамм CP 4 Устойчивость к насекомым-вредителям, в частности, кукурузного мотылька, через выражение инсектицидного белка Cry 1 Ab из. Bacillus Thuringiensis Высокие уровни лаурата достигнутые путем введения гена АКТ тиоэстеразы из Калифорнии Bay Tree Умбеллюлярия са. Щогтса Устойчивость к шарке предоставляемой вставки белок оболочки (CP) гена из вируса Три гена для изготовления бета-каротин, предшественник витамина А, в эндосперме риса предотвратить его удаление (от шелухи) при фрезеровании Вируса гепатита поверхность антигена (HBs. Ag), полученного в трансгенного табака индуцирует иммунный ответ при введении мышам Слитый белок (F), из вируса ньюкаслской болезни (NDV), выраженные в семенах кукурузы индуцирует иммунный ответ при скармливании цыплят Тип 1 Рост ген гормона вводят в оплодотворенные яйца рыбы приводит к 6, 2% удержания вектора на один год возраста, а также значительно увеличились темпы роста
 История Международных правил ГМО исследований и развития * В 1971 году первые дебаты по опасности для человека воздействия ГИО началось, когда общий кишечного микроорганизма, E. палочка , был инфицирован ДНК из вируса опухоли индуцирующего (Devos др. , 2007). Первоначально, вопросы безопасности были озабоченность физическим лицам, работающим в лабораториях с ГМО, а также жителей близлежащих районов. Тем не менее, позже дискуссия возникла в связи с опасениями, что рекомбинантные организмы могут быть использованы в качестве оружия. Растет дебаты, первоначально ограничивается ученых, в конце концов распространилась на публике, а в 1974 году Национальный институт здоровья (NIH) установилрекомбинантной ДНК Консультативный комитет приступить к решению некоторых из этих проблем. * В 1980 году, когда преднамеренное высвобождение ГМО в окружающую среду начали происходить, США было очень мало правил на месте. Соблюдение принципов, предусмотренных NIH было добровольным для промышленности. Также в 1980 -использование трансгенных растений становится ценной инициативой для производства новых лекарственных и отдельных предприятий, учреждений и целые страны начинают рассматривать биотехнологии, как прибыльное средство зарабатывания денег (Дево и др. , 2007) , Во всем мире коммерциализация биотехнологических продуктов вызвала новую дискуссию по поводу патентоспособности живых организмов, неблагоприятные последствия воздействия рекомбинантных белков, конфиденциальность вопросы, мораль и авторитет ученых, роль правительства в регулировании науки, и другие вопросы. В США, Конгресса Офис инициатив по оценке технологий были разработаны, и они в конечном итоге были приняты во всем мире в качестве топ-вниз подход консультирования политиков по прогнозированию социальных последствий ГМО. * Затем, в 1986 году, публикация Организации экономического сотрудничества и развития (ОЭСР), называется "Соображения рекомбинантный безопасности ДНК", стал первым межгосударственным документом для решения вопросов, связанных с использованием ГМО. Этот документ рекомендуется, что оценка риска осуществляется на индивидуальной основе случае. С тех пор, от случая к случаю подход к оценке риска для генетически модифицированных продуктов была широко принята; Однако, как правило, США принято подход продукта, основанного на оценке, в то время как Европейский подход более процесс, основанный (Devos др. , 2007). Хотя в прошлом, тщательное регулирование не хватало во многих странах, правительства во всем мире в настоящее время удовлетворить требования общественности и реализации более строгих требований к испытаниям и маркировке генетически модифицированных сельскохозяйственных культур.
История Международных правил ГМО исследований и развития * В 1971 году первые дебаты по опасности для человека воздействия ГИО началось, когда общий кишечного микроорганизма, E. палочка , был инфицирован ДНК из вируса опухоли индуцирующего (Devos др. , 2007). Первоначально, вопросы безопасности были озабоченность физическим лицам, работающим в лабораториях с ГМО, а также жителей близлежащих районов. Тем не менее, позже дискуссия возникла в связи с опасениями, что рекомбинантные организмы могут быть использованы в качестве оружия. Растет дебаты, первоначально ограничивается ученых, в конце концов распространилась на публике, а в 1974 году Национальный институт здоровья (NIH) установилрекомбинантной ДНК Консультативный комитет приступить к решению некоторых из этих проблем. * В 1980 году, когда преднамеренное высвобождение ГМО в окружающую среду начали происходить, США было очень мало правил на месте. Соблюдение принципов, предусмотренных NIH было добровольным для промышленности. Также в 1980 -использование трансгенных растений становится ценной инициативой для производства новых лекарственных и отдельных предприятий, учреждений и целые страны начинают рассматривать биотехнологии, как прибыльное средство зарабатывания денег (Дево и др. , 2007) , Во всем мире коммерциализация биотехнологических продуктов вызвала новую дискуссию по поводу патентоспособности живых организмов, неблагоприятные последствия воздействия рекомбинантных белков, конфиденциальность вопросы, мораль и авторитет ученых, роль правительства в регулировании науки, и другие вопросы. В США, Конгресса Офис инициатив по оценке технологий были разработаны, и они в конечном итоге были приняты во всем мире в качестве топ-вниз подход консультирования политиков по прогнозированию социальных последствий ГМО. * Затем, в 1986 году, публикация Организации экономического сотрудничества и развития (ОЭСР), называется "Соображения рекомбинантный безопасности ДНК", стал первым межгосударственным документом для решения вопросов, связанных с использованием ГМО. Этот документ рекомендуется, что оценка риска осуществляется на индивидуальной основе случае. С тех пор, от случая к случаю подход к оценке риска для генетически модифицированных продуктов была широко принята; Однако, как правило, США принято подход продукта, основанного на оценке, в то время как Европейский подход более процесс, основанный (Devos др. , 2007). Хотя в прошлом, тщательное регулирование не хватало во многих странах, правительства во всем мире в настоящее время удовлетворить требования общественности и реализации более строгих требований к испытаниям и маркировке генетически модифицированных сельскохозяйственных культур.
![Трансгенное животное (transgenic animal) [лат. trans(ferre) — переносить и греч. gen(os) — род, происхождение] Трансгенное животное (transgenic animal) [лат. trans(ferre) — переносить и греч. gen(os) — род, происхождение]](https://present5.com/presentation/180748270_386484132/image-6.jpg) Трансгенное животное (transgenic animal) [лат. trans(ferre) — переносить и греч. gen(os) — род, происхождение] — генетически модифицированное животное, которое содержит в своем геноме трансген (см. Трансген). Т. ж. получают с помощью трансгеноза (см. Трансгеноз, трансгенез). В настоящее время созданы Т. ж. , обладающие рядом заданных полезных свойств и признаков (напр. , с повышенной устойчивостью к патогенным грибам, бактериям, вирусам; с улучшенным качеством шерсти, мяса, молока и др. ), а также организмы, которые являются продуцентами широкого спектра биологически активных веществ (гормонов, цитокинов, факторов роста, ферментов, субъединичных вакцин), имеющих применение в медицине. Высказываются опасения, связанные с неконтролируемым выпуском Т. ж. в окружающую среду и вредностью Т. ж. , используемых как продукты питания, которые не нашли пока своего научного подтверждения. Ф. Раддлом в 1981 г.
Трансгенное животное (transgenic animal) [лат. trans(ferre) — переносить и греч. gen(os) — род, происхождение] — генетически модифицированное животное, которое содержит в своем геноме трансген (см. Трансген). Т. ж. получают с помощью трансгеноза (см. Трансгеноз, трансгенез). В настоящее время созданы Т. ж. , обладающие рядом заданных полезных свойств и признаков (напр. , с повышенной устойчивостью к патогенным грибам, бактериям, вирусам; с улучшенным качеством шерсти, мяса, молока и др. ), а также организмы, которые являются продуцентами широкого спектра биологически активных веществ (гормонов, цитокинов, факторов роста, ферментов, субъединичных вакцин), имеющих применение в медицине. Высказываются опасения, связанные с неконтролируемым выпуском Т. ж. в окружающую среду и вредностью Т. ж. , используемых как продукты питания, которые не нашли пока своего научного подтверждения. Ф. Раддлом в 1981 г.
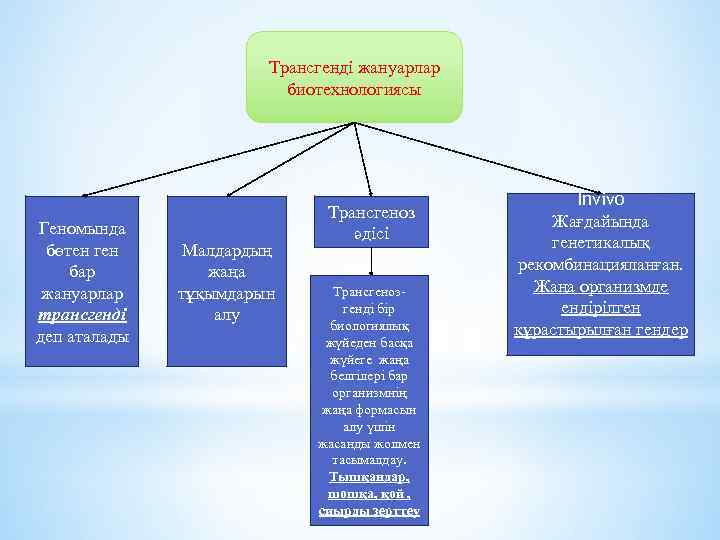 Трансгенді жануарлар биотехнологиясы Геномында бөтен ген бар жануарлар трансгенді деп аталады Малдардың жаңа тұқымдарын алу Трансгеноз әдісі Трансгеноз- генді бір биологиялық жүйеден басқа жүйеге жаңа белгілері бар организмнің жаңа формасын алу үшін жасанды жолмен тасымалдау. Тышқандар, шошқа, қой , сиырды зерттеу Invivo Жағдайында генетикалық рекомбинацияланған. Жаңа организмде ендірілген құрастырылған гендер
Трансгенді жануарлар биотехнологиясы Геномында бөтен ген бар жануарлар трансгенді деп аталады Малдардың жаңа тұқымдарын алу Трансгеноз әдісі Трансгеноз- генді бір биологиялық жүйеден басқа жүйеге жаңа белгілері бар организмнің жаңа формасын алу үшін жасанды жолмен тасымалдау. Тышқандар, шошқа, қой , сиырды зерттеу Invivo Жағдайында генетикалық рекомбинацияланған. Жаңа организмде ендірілген құрастырылған гендер
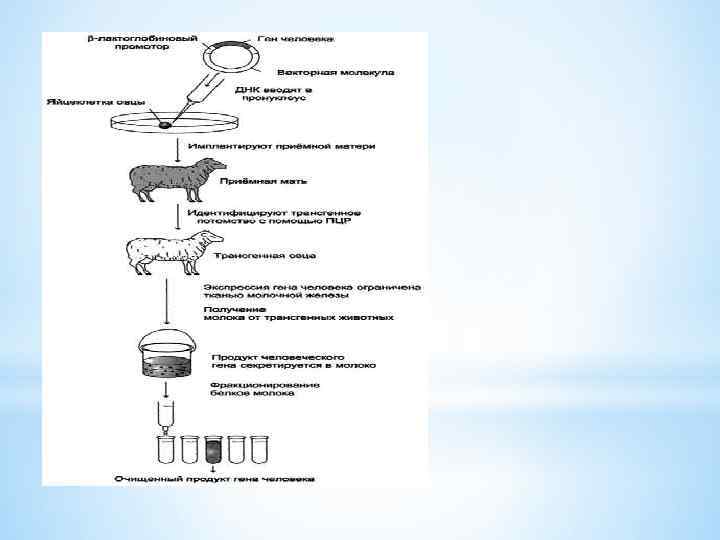
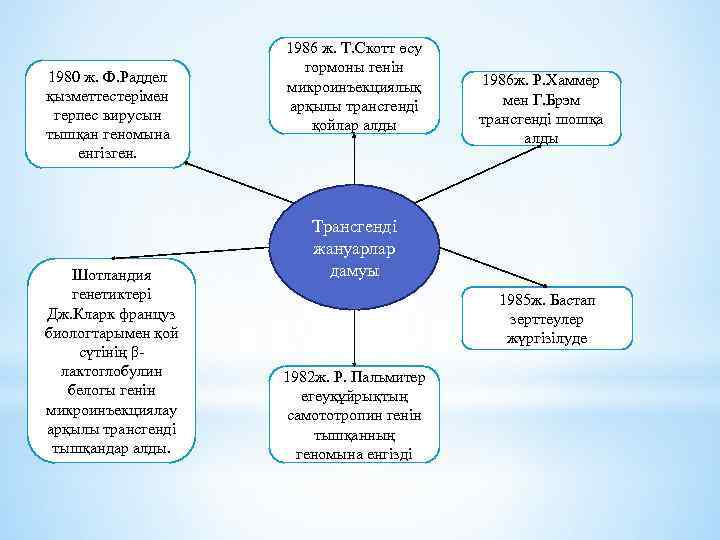 1980 ж. Ф. Раддел қызметтестерімен герпес вирусын тышқан геномына енгізген. Шотландия генетиктері Дж. Кларк француз биологтарымен қой сүтінің βлактоглобулин белогы генін микроинъекциялау арқылы трансгенді тышқандар алды. 1986 ж. Т. Скотт өсу гормоны генін микроинъекциялық арқылы трансгенді қойлар алды 1986 ж. Р. Хаммер мен Г. Брэм трансгенді шошқа алды Трансгенді жануарлар дамуы 1985 ж. Бастап зерттеулер жүргізілуде 1982 ж. Р. Пальмитер егеуқұйрықтың самототропин генін тышқанның геномына енгізді
1980 ж. Ф. Раддел қызметтестерімен герпес вирусын тышқан геномына енгізген. Шотландия генетиктері Дж. Кларк француз биологтарымен қой сүтінің βлактоглобулин белогы генін микроинъекциялау арқылы трансгенді тышқандар алды. 1986 ж. Т. Скотт өсу гормоны генін микроинъекциялық арқылы трансгенді қойлар алды 1986 ж. Р. Хаммер мен Г. Брэм трансгенді шошқа алды Трансгенді жануарлар дамуы 1985 ж. Бастап зерттеулер жүргізілуде 1982 ж. Р. Пальмитер егеуқұйрықтың самототропин генін тышқанның геномына енгізді
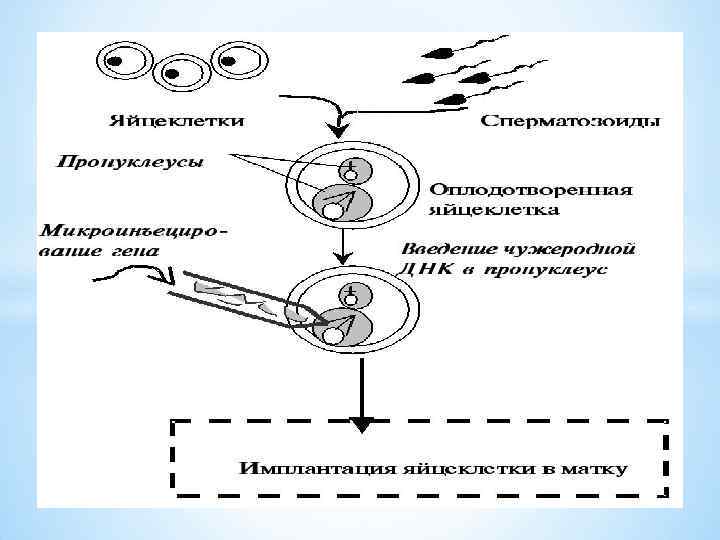
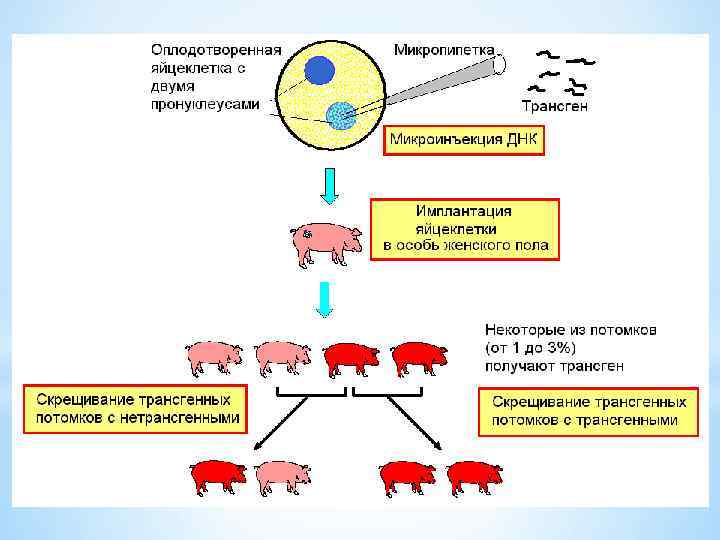
 Жалпы трансгенді малдарды алу бірінің артынан бірі өтетін мынадай кезеңдерден тұрады: 1) Рекомбинантты ДНҚ молекуласын құрастыру және оның клонын алу; 2) Трансгенозаға жарамды зиготалар алу және олардың пронуклеустерін айқындау; 3) Рекомбинантты ДНҚ көшірмелерінің белгілі мөлшерін зиготалар пронуклеустеріне (мүмкіншілігінше аталық) микротүтікше арқылы енгізу; 4) Зиготаларды гормондық дайындықтан өткен аналықтардың жыныс жолдарына тасымалдау; 5) Туылған малдардың генотипі және фенотипі бойынша бағалап, трансгенді екендігін анықтау: бөтен геннің клетка ДНҚ-сымен байланысуын, рекомбинантты ДНҚ-ның экспрессиясын, ген өнімінің синтезделуін анықтау; 6) Трансгенді малдардың жаңа қасиетінің ұрпаққа тұқым қуалауын бақылау.
Жалпы трансгенді малдарды алу бірінің артынан бірі өтетін мынадай кезеңдерден тұрады: 1) Рекомбинантты ДНҚ молекуласын құрастыру және оның клонын алу; 2) Трансгенозаға жарамды зиготалар алу және олардың пронуклеустерін айқындау; 3) Рекомбинантты ДНҚ көшірмелерінің белгілі мөлшерін зиготалар пронуклеустеріне (мүмкіншілігінше аталық) микротүтікше арқылы енгізу; 4) Зиготаларды гормондық дайындықтан өткен аналықтардың жыныс жолдарына тасымалдау; 5) Туылған малдардың генотипі және фенотипі бойынша бағалап, трансгенді екендігін анықтау: бөтен геннің клетка ДНҚ-сымен байланысуын, рекомбинантты ДНҚ-ның экспрессиясын, ген өнімінің синтезделуін анықтау; 6) Трансгенді малдардың жаңа қасиетінің ұрпаққа тұқым қуалауын бақылау.


