3в. Генетическая трансформации растений.pptx
- Количество слайдов: 83
 Генетическая трансформации растений: история, молекулярные механизмы, методы и практика Профессор, д. б. н. , А. К. Гапоненко, Главный научный сотрудник Института Биологии Развития им. Н. К. Кольцова РАН
Генетическая трансформации растений: история, молекулярные механизмы, методы и практика Профессор, д. б. н. , А. К. Гапоненко, Главный научный сотрудник Института Биологии Развития им. Н. К. Кольцова РАН
 ЭРА ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ РАСТЕНИЙ НАЧАЛАСЬ 18 ЯНВАРЯ 1983 ГОДА НА СИМПОЗИУМЕ В МАЙАМИ, США (MIAMI WINTER SYMPOSIUM) During one session, Jeff Schell, Rob Horsch from Monsanto, and I all gave talks about Agrobacterium and its adaptation as a gene vector for plants. All three of us reported success with chimeric kanamycin resistance genes as a selectable marker for plant cells. I described initial success in transforming tobacco cells with binary vectors (which we called Mini. Ti at that time). In addition, I described our tobacco plants engineered with a disarmed Ti plasmid, and Southern blots proving that they passed their T-DNA insert to progeny intact. It was clear from the progress in all three groups that crop improvement by genetic engineering would become a reality. Mary-Dell Chilton Bevan MW, Flavell RB, Chilton, M-D. , (1983) Nature 304: 184– 187 Fraley RT, Rogers SG, Horsch RB, Sanders PR, Flick JS, Adams SP, Bittner ML, Brand LA, Fink CL, Fry JS, Galluppi GR, Goldberg SB, Hoffmann NL, Woo SC. , (1983) Proc Natl Acad Sci USA 80: 4803– 4807 Herrera-Estrella L, De Block M, Messens E, Hernalsteens J-P, Van Montagu M, Schell J. , (1983) EMBO J 2: 987– 995 Plant Physiology, January 2001, Vol. 125, pp. 9– 14, www. plantphysiol. org © 2001 American Society of Plant Physiologists Д. б. н. , А. К. Гапоненко 2
ЭРА ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ РАСТЕНИЙ НАЧАЛАСЬ 18 ЯНВАРЯ 1983 ГОДА НА СИМПОЗИУМЕ В МАЙАМИ, США (MIAMI WINTER SYMPOSIUM) During one session, Jeff Schell, Rob Horsch from Monsanto, and I all gave talks about Agrobacterium and its adaptation as a gene vector for plants. All three of us reported success with chimeric kanamycin resistance genes as a selectable marker for plant cells. I described initial success in transforming tobacco cells with binary vectors (which we called Mini. Ti at that time). In addition, I described our tobacco plants engineered with a disarmed Ti plasmid, and Southern blots proving that they passed their T-DNA insert to progeny intact. It was clear from the progress in all three groups that crop improvement by genetic engineering would become a reality. Mary-Dell Chilton Bevan MW, Flavell RB, Chilton, M-D. , (1983) Nature 304: 184– 187 Fraley RT, Rogers SG, Horsch RB, Sanders PR, Flick JS, Adams SP, Bittner ML, Brand LA, Fink CL, Fry JS, Galluppi GR, Goldberg SB, Hoffmann NL, Woo SC. , (1983) Proc Natl Acad Sci USA 80: 4803– 4807 Herrera-Estrella L, De Block M, Messens E, Hernalsteens J-P, Van Montagu M, Schell J. , (1983) EMBO J 2: 987– 995 Plant Physiology, January 2001, Vol. 125, pp. 9– 14, www. plantphysiol. org © 2001 American Society of Plant Physiologists Д. б. н. , А. К. Гапоненко 2
 Основатели генетической инженерии растений: растений Мари Дел-Хильтон, 2005: «В конце-концов трансформирующая бактерия, какое бы ни имя ей не было, всего лишь маленький кусочек технологии необходимой для создания трансгенного растений» . Марк ван Монтегю Решение Шелла изучать как Agrobacterium tumefaciens, Gram-negative почвенная бактерия вызывает опухоли у растений, явилась ключом к тому прогрессу, который мы достигли за последние 30 лет Джеф Шелл, Первая его статья, написанная в соавторстве с Марком ван Монтегю, о ДНК Agrobacterium опубликована в 1972 и посвящена фагам Agrobacterium. Тимоти Холл Dr. Timothy C. Hall Distinguished Professor of Biology Director, Institute of Developmental and Molecular Biology Texas A&M University Д. б. н. , А. К. Гапоненко 3
Основатели генетической инженерии растений: растений Мари Дел-Хильтон, 2005: «В конце-концов трансформирующая бактерия, какое бы ни имя ей не было, всего лишь маленький кусочек технологии необходимой для создания трансгенного растений» . Марк ван Монтегю Решение Шелла изучать как Agrobacterium tumefaciens, Gram-negative почвенная бактерия вызывает опухоли у растений, явилась ключом к тому прогрессу, который мы достигли за последние 30 лет Джеф Шелл, Первая его статья, написанная в соавторстве с Марком ван Монтегю, о ДНК Agrobacterium опубликована в 1972 и посвящена фагам Agrobacterium. Тимоти Холл Dr. Timothy C. Hall Distinguished Professor of Biology Director, Institute of Developmental and Molecular Biology Texas A&M University Д. б. н. , А. К. Гапоненко 3
 Agrobacterium tumefaciens - бактерия и «корончатые галлы» - болезнь которую она вызывает Цитируется по Проф. Vitaly Citovsky Проф. А. К. Гапоненко 4
Agrobacterium tumefaciens - бактерия и «корончатые галлы» - болезнь которую она вызывает Цитируется по Проф. Vitaly Citovsky Проф. А. К. Гапоненко 4
 Генная инженерия в природе. Заболевание «корончатых галл» растений известно с времен Аристотеля. В 1907 году Е. Смит и К. Таудсен показали, что это заболевание вызывает почвенная бактерия Agrobacterium tumefaciens Проф. А. К. Гапоненко 5
Генная инженерия в природе. Заболевание «корончатых галл» растений известно с времен Аристотеля. В 1907 году Е. Смит и К. Таудсен показали, что это заболевание вызывает почвенная бактерия Agrobacterium tumefaciens Проф. А. К. Гапоненко 5
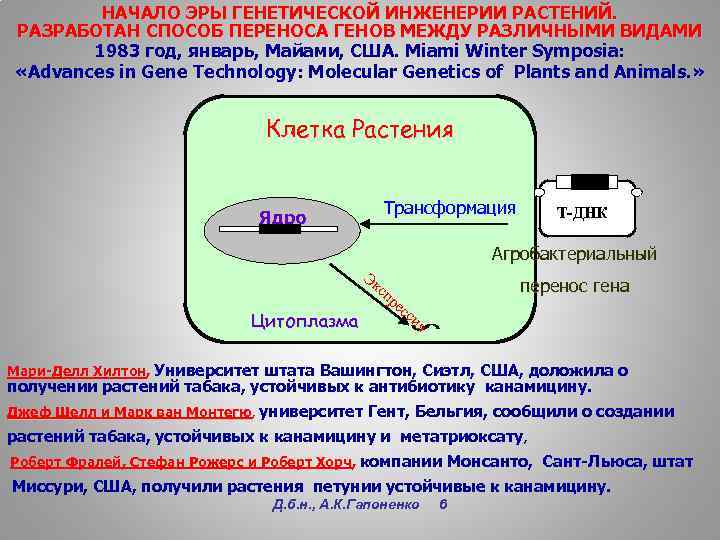 НАЧАЛО ЭРЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ РАСТЕНИЙ. РАЗРАБОТАН СПОСОБ ПЕРЕНОСА ГЕНОВ МЕЖДУ РАЗЛИЧНЫМИ ВИДАМИ 1983 год, январь, Майами, США. Miami Winter Symposia: «Advances in Gene Technology: Molecular Genetics of Plants and Animals. » Клетка Растения Ядро Трансформация Т-ДНК Агробактериальный Эк сп Цитоплазма перенос гена ре сс ия Мари-Делл Хилтон, Университет штата Вашингтон, Сиэтл, США, доложила о получении растений табака, устойчивых к антибиотику канамицину. Джеф Шелл и Марк ван Монтегю, университет Гент, Бельгия, сообщили о создании растений табака, устойчивых к канамицину и метатриоксату , Роберт Фралей, Стефан Рожерс и Роберт Хорч, компании Монсанто, Сант-Льюса, штат Хорч Миссури, США, получили растения петунии устойчивые к канамицину. Д. б. н. , А. К. Гапоненко 6
НАЧАЛО ЭРЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ РАСТЕНИЙ. РАЗРАБОТАН СПОСОБ ПЕРЕНОСА ГЕНОВ МЕЖДУ РАЗЛИЧНЫМИ ВИДАМИ 1983 год, январь, Майами, США. Miami Winter Symposia: «Advances in Gene Technology: Molecular Genetics of Plants and Animals. » Клетка Растения Ядро Трансформация Т-ДНК Агробактериальный Эк сп Цитоплазма перенос гена ре сс ия Мари-Делл Хилтон, Университет штата Вашингтон, Сиэтл, США, доложила о получении растений табака, устойчивых к антибиотику канамицину. Джеф Шелл и Марк ван Монтегю, университет Гент, Бельгия, сообщили о создании растений табака, устойчивых к канамицину и метатриоксату , Роберт Фралей, Стефан Рожерс и Роберт Хорч, компании Монсанто, Сант-Льюса, штат Хорч Миссури, США, получили растения петунии устойчивые к канамицину. Д. б. н. , А. К. Гапоненко 6
 Photograph of collaborators in the “brute force” experiments that first demonstrated the presence of T-DNA in crown gall tumor DNA. Left to right: Don Merlo, Martin Drummond, Gene Nester, Daniela Sciaky, Mary-Dell Chilton (author of this article), Alice Mon. . . Chilton M. Plantphysiol 2001; 125: 9 -14 © 2001 by American Society of Plant Biologists
Photograph of collaborators in the “brute force” experiments that first demonstrated the presence of T-DNA in crown gall tumor DNA. Left to right: Don Merlo, Martin Drummond, Gene Nester, Daniela Sciaky, Mary-Dell Chilton (author of this article), Alice Mon. . . Chilton M. Plantphysiol 2001; 125: 9 -14 © 2001 by American Society of Plant Biologists
 Общая схема «генетической колонизации» (Shell et al. , 1983) Agrobacterium tumefaciens растения и образование опухоли. Проф. А. К. Гапоненко 8
Общая схема «генетической колонизации» (Shell et al. , 1983) Agrobacterium tumefaciens растения и образование опухоли. Проф. А. К. Гапоненко 8
 Photograph of research group in Ghent, Belgium, 1984. Chilton M. Plantphysiol 2001; 125: 9 -14 © 2001 by American Society of Plant Biologists
Photograph of research group in Ghent, Belgium, 1984. Chilton M. Plantphysiol 2001; 125: 9 -14 © 2001 by American Society of Plant Biologists
 Геном природного генетического инженера Agrobacterium tumefaciens C 58 Science. 2001 Dec 14; 294(5550): 2266. . Wood DW, Setubal JC, Kaul R, Monks DE, Kitajima JP, Okura VK, Zhou Y, Chen L, Wood GE, Almeida NF Jr, Woo L, Chen Y, Paulsen IT, Eisen JA, Karp PD, Bovee D Sr, Chapman P, Clendenning J, Deatherage G, Gillet W, Grant C, Kutyavin T, Levy R, Li MJ, Mc. Clelland E, Palmieri A, Raymond C, Rouse G, Saenphimmachak C, Wu Z, Romero P, Gordon D, Zhang S, Yoo H, Tao Y, Biddle P, Jung M, Krespan W, Perry M, Gordon-Kamm B, Liao L, Kim S, Hendrick C, Zhao ZY, Dolan M, Chumley F, Tingey SV, Tomb JF, Gordon MP, Olson MV, Nester EW. Department of Microbiology, University of Washington, 1959 NE Pacific Street, Box 357242, Seattle, WA 98195, USA. Геном патогенной для растений Agrobacterium tumefaciens C 58 содержит 5. 67 -мил. пар нуклеотидов и состоит из: кольцевой хромосомы, линейной хромосомы и двух плазмид. Экстенсивная ортология и нуклеотидная колинеарность между геномами A. tumefaciens и растительным симбионтом Sinorhizobium meliloti предполагает их недавнюю эволюционную дивергенцию. Их сходства включают метаболические, транспортные и регуляторные системы, которые помогают выжить в высоко конкурентной ризосфере; различия очевидны в структуре их геномов и полноте вирулентных генов. Наличие доступной ДНКвой последовательности A. tumefaciens способствует исследованиям молекулярных механизмов патогенеза и эволюционной дивергенции между патогенным и синергическим образом жизни. Проф. А. К. Гапоненко 10
Геном природного генетического инженера Agrobacterium tumefaciens C 58 Science. 2001 Dec 14; 294(5550): 2266. . Wood DW, Setubal JC, Kaul R, Monks DE, Kitajima JP, Okura VK, Zhou Y, Chen L, Wood GE, Almeida NF Jr, Woo L, Chen Y, Paulsen IT, Eisen JA, Karp PD, Bovee D Sr, Chapman P, Clendenning J, Deatherage G, Gillet W, Grant C, Kutyavin T, Levy R, Li MJ, Mc. Clelland E, Palmieri A, Raymond C, Rouse G, Saenphimmachak C, Wu Z, Romero P, Gordon D, Zhang S, Yoo H, Tao Y, Biddle P, Jung M, Krespan W, Perry M, Gordon-Kamm B, Liao L, Kim S, Hendrick C, Zhao ZY, Dolan M, Chumley F, Tingey SV, Tomb JF, Gordon MP, Olson MV, Nester EW. Department of Microbiology, University of Washington, 1959 NE Pacific Street, Box 357242, Seattle, WA 98195, USA. Геном патогенной для растений Agrobacterium tumefaciens C 58 содержит 5. 67 -мил. пар нуклеотидов и состоит из: кольцевой хромосомы, линейной хромосомы и двух плазмид. Экстенсивная ортология и нуклеотидная колинеарность между геномами A. tumefaciens и растительным симбионтом Sinorhizobium meliloti предполагает их недавнюю эволюционную дивергенцию. Их сходства включают метаболические, транспортные и регуляторные системы, которые помогают выжить в высоко конкурентной ризосфере; различия очевидны в структуре их геномов и полноте вирулентных генов. Наличие доступной ДНКвой последовательности A. tumefaciens способствует исследованиям молекулярных механизмов патогенеза и эволюционной дивергенции между патогенным и синергическим образом жизни. Проф. А. К. Гапоненко 10
 Схема строения Agrobacterium tumefaciens и генетическая карта Ti плазмиды (Tumor inducing) – вызывающая опухоли. • • T-DNA (transferred DNA) – ДНК плазмиды, переносимая в ядро клетки растения Л и П – левая и правая границы Т-области (right и left borders, RB и LB) с прямыми повторами длиной 25 пн Область, содержащая vir-гены, контролирует синтез и перенос Т-ДНК в растении Область оri – точка начала репликации
Схема строения Agrobacterium tumefaciens и генетическая карта Ti плазмиды (Tumor inducing) – вызывающая опухоли. • • T-DNA (transferred DNA) – ДНК плазмиды, переносимая в ядро клетки растения Л и П – левая и правая границы Т-области (right и left borders, RB и LB) с прямыми повторами длиной 25 пн Область, содержащая vir-гены, контролирует синтез и перенос Т-ДНК в растении Область оri – точка начала репликации
 Photograph of Ivo Zaenen, who discovered the Ti plasmid of Agrobacterium. Chilton M. Plantphysiol 2001; 125: 9 -14 © 2001 by American Society of Plant Biologists
Photograph of Ivo Zaenen, who discovered the Ti plasmid of Agrobacterium. Chilton M. Plantphysiol 2001; 125: 9 -14 © 2001 by American Society of Plant Biologists
 Общая схема генетической карты Ti плазмиды (Tumor inducing) – вызывающей опухоли. T- DNA, – transferred – переносимая ДНК Размеры Т-ДНК Ti и Ri плазмид варьируют от 10 до 30 kbp Проф. А. К. Гапоненко 13
Общая схема генетической карты Ti плазмиды (Tumor inducing) – вызывающей опухоли. T- DNA, – transferred – переносимая ДНК Размеры Т-ДНК Ti и Ri плазмид варьируют от 10 до 30 kbp Проф. А. К. Гапоненко 13
 Схема генетической карты Ti плазмиды Схема типичной Ti плазмиды октопинового типа Размеры Ti плазмид варьируют от 200 до 800 kbp (A) T-ДНК разделена на три района: TL (T-DNA левый ), TC (T-DNA центр), и TR (T-DNA правый). черными кружками обозначены повторяющиеся последовательности границ T-DNA. Белый кружок обозначает ori. V, сайт инициации вегетативной репликации Ti плазмиды. (B) Транскрипты, кодируемые T-ДНК и направление транскрипции показаны стрелками. Обозначена локализация генов, вовлеченных в синтезы ауксинов (auxin), синтеза цитокининов (cyt); синтеза опинов: октопина (ocs), маннопина (mas) и агропина (ags). Схема T-ДНК типичной Ti плазмиды октопинового типа Размеры Т-ДНК Ti и Ri S. Gelvin, Agrobacterium -Mediated Plant Transformation: the Biology Плазмид, от 10 до 30 kbp behind the “Gene-Jockeying” Tool Проф. А. К. Гапоненко MICR. AND MOL. BIOL. Y REVIEWS, 2003, p. 16– 37 Vol. 67, No. 1 14
Схема генетической карты Ti плазмиды Схема типичной Ti плазмиды октопинового типа Размеры Ti плазмид варьируют от 200 до 800 kbp (A) T-ДНК разделена на три района: TL (T-DNA левый ), TC (T-DNA центр), и TR (T-DNA правый). черными кружками обозначены повторяющиеся последовательности границ T-DNA. Белый кружок обозначает ori. V, сайт инициации вегетативной репликации Ti плазмиды. (B) Транскрипты, кодируемые T-ДНК и направление транскрипции показаны стрелками. Обозначена локализация генов, вовлеченных в синтезы ауксинов (auxin), синтеза цитокининов (cyt); синтеза опинов: октопина (ocs), маннопина (mas) и агропина (ags). Схема T-ДНК типичной Ti плазмиды октопинового типа Размеры Т-ДНК Ti и Ri S. Gelvin, Agrobacterium -Mediated Plant Transformation: the Biology Плазмид, от 10 до 30 kbp behind the “Gene-Jockeying” Tool Проф. А. К. Гапоненко MICR. AND MOL. BIOL. Y REVIEWS, 2003, p. 16– 37 Vol. 67, No. 1 14
 В процессе генетической трансформации растительной клетки можно выделить десять главных событий: 1. Процесс начинается с распознания агробактерией специфических рецепторов клетки хозяина и прикрепления бактерии к клетке хозяина (растения-реципиента), посредством белков, кодируемых хромосомой агробактерии; 2. Опознавание специфических сигналов растительной клетки двух компонентной системой агробактерии (Vir. A–Vir. G) сигнально – трансдукцион ного механизма; 3. Далее следует Vir. G-mediated сигнальная трансдукция и активация вирулентных (vir) генов в vir области агробактерии; 4. Образование мобильной копии T-DNA, the T-strand; 5. Доставка Vir. D 2–DNA комплекса (незрелый T-комплекс), вместе с несколькими другими Vir белками, в цитоплазму клетки растения реципиента; 6. После ассоциации Vir. E 2 с T-strand, и образования зрелого T-комплекса, последний импортируется через цитоплазму хозяина; 7. T-комплекс активно импортируется вовнутрь ядра клетки растения-хозяина; 8. Оказавшись внутри ядра, the T-DNA is recruited to the point of integration; 9. T-DNA освобождается от эскортирующих ее белков. 10. Наступает момент интеграция T-DNA в геном клетки хозяина посредством Vir. D 2 и/или Vir. E 2 и факторов хозяина. Источник: Tzvi Tzfira and Vitaly Citovsky, Agrobacterium-mediated genetic transformation of plants: biology and biotechnology, Current Opinion in Biotechnology 2006, 17: 147– 154] Проф. А. К. Гапоненко 15
В процессе генетической трансформации растительной клетки можно выделить десять главных событий: 1. Процесс начинается с распознания агробактерией специфических рецепторов клетки хозяина и прикрепления бактерии к клетке хозяина (растения-реципиента), посредством белков, кодируемых хромосомой агробактерии; 2. Опознавание специфических сигналов растительной клетки двух компонентной системой агробактерии (Vir. A–Vir. G) сигнально – трансдукцион ного механизма; 3. Далее следует Vir. G-mediated сигнальная трансдукция и активация вирулентных (vir) генов в vir области агробактерии; 4. Образование мобильной копии T-DNA, the T-strand; 5. Доставка Vir. D 2–DNA комплекса (незрелый T-комплекс), вместе с несколькими другими Vir белками, в цитоплазму клетки растения реципиента; 6. После ассоциации Vir. E 2 с T-strand, и образования зрелого T-комплекса, последний импортируется через цитоплазму хозяина; 7. T-комплекс активно импортируется вовнутрь ядра клетки растения-хозяина; 8. Оказавшись внутри ядра, the T-DNA is recruited to the point of integration; 9. T-DNA освобождается от эскортирующих ее белков. 10. Наступает момент интеграция T-DNA в геном клетки хозяина посредством Vir. D 2 и/или Vir. E 2 и факторов хозяина. Источник: Tzvi Tzfira and Vitaly Citovsky, Agrobacterium-mediated genetic transformation of plants: biology and biotechnology, Current Opinion in Biotechnology 2006, 17: 147– 154] Проф. А. К. Гапоненко 15
 Активаторы генов вирулентности Проф. А. К. Гапоненко 16
Активаторы генов вирулентности Проф. А. К. Гапоненко 16
 Роль факторов хозяина и клеточных процессов в генетической трансформации клеток растений посредством агробактерии Agrobacterium (е) а. После экспорта в клетку растения-хозяина, агробактериальная T-DNA должна пройти сквозь плотную структурированную цитоплазмы клетки хозяина. Биофизически обнаружили возможность участия микротрубочек и отрицательного заряда зрелого T-комплекса через цитоплазму в ядро. b. Факторы хозяина (karyopherin a и VIP 1) и бактериальные факторы (Vir. D 2, Vir. E 2 и Vir. E 3) взаимодействуют в течение транслокации T-комплекса через комплекс ядерной поры (NPC). В. В то время как Vir. D 2 напрямую узнается механизмом ядерного импорта хозяина, прямым взаимодействием с At. KAPa, оба VIP 1 и Vir. E 3 действуют, как адаптеры между Vir. E 2 и karyopherins a хозяина. c. Способность VIP 1 взаимодействовать с хромосомным гистоновым белком H 2 A-1, функционирующем в течении стадии интеграции T-DNA , и его взаимодействия с Vir. E 2 позволяют предположить, что Agrobacterium использует внутриядерную мобильность VIP 1 для доставки T-комплекса в место интеграции хроматина хозяина. d. Использование механизмов протеосомальной деградации T-комплекса агробактериального белка Vir. F с VIP 1 с одной стороны, и ASK 1 с другой, приводит к протеолитическому «оголению» T-DNA перед его интеграцией в геном хозяина. . e. Роль специфических факторов хозяина и молекулярные механизмы интеграции все еще неизвестны, хотя интеграция двунитевой T-DNA молекулы в разрывы двунитевой (DSBs) ДНК растения, посредством растительного фактора KU 80, могут представлять важный механизм для интеграции T-DNA в клетки растений. Проф. А. К. Гапоненко 17
Роль факторов хозяина и клеточных процессов в генетической трансформации клеток растений посредством агробактерии Agrobacterium (е) а. После экспорта в клетку растения-хозяина, агробактериальная T-DNA должна пройти сквозь плотную структурированную цитоплазмы клетки хозяина. Биофизически обнаружили возможность участия микротрубочек и отрицательного заряда зрелого T-комплекса через цитоплазму в ядро. b. Факторы хозяина (karyopherin a и VIP 1) и бактериальные факторы (Vir. D 2, Vir. E 2 и Vir. E 3) взаимодействуют в течение транслокации T-комплекса через комплекс ядерной поры (NPC). В. В то время как Vir. D 2 напрямую узнается механизмом ядерного импорта хозяина, прямым взаимодействием с At. KAPa, оба VIP 1 и Vir. E 3 действуют, как адаптеры между Vir. E 2 и karyopherins a хозяина. c. Способность VIP 1 взаимодействовать с хромосомным гистоновым белком H 2 A-1, функционирующем в течении стадии интеграции T-DNA , и его взаимодействия с Vir. E 2 позволяют предположить, что Agrobacterium использует внутриядерную мобильность VIP 1 для доставки T-комплекса в место интеграции хроматина хозяина. d. Использование механизмов протеосомальной деградации T-комплекса агробактериального белка Vir. F с VIP 1 с одной стороны, и ASK 1 с другой, приводит к протеолитическому «оголению» T-DNA перед его интеграцией в геном хозяина. . e. Роль специфических факторов хозяина и молекулярные механизмы интеграции все еще неизвестны, хотя интеграция двунитевой T-DNA молекулы в разрывы двунитевой (DSBs) ДНК растения, посредством растительного фактора KU 80, могут представлять важный механизм для интеграции T-DNA в клетки растений. Проф. А. К. Гапоненко 17
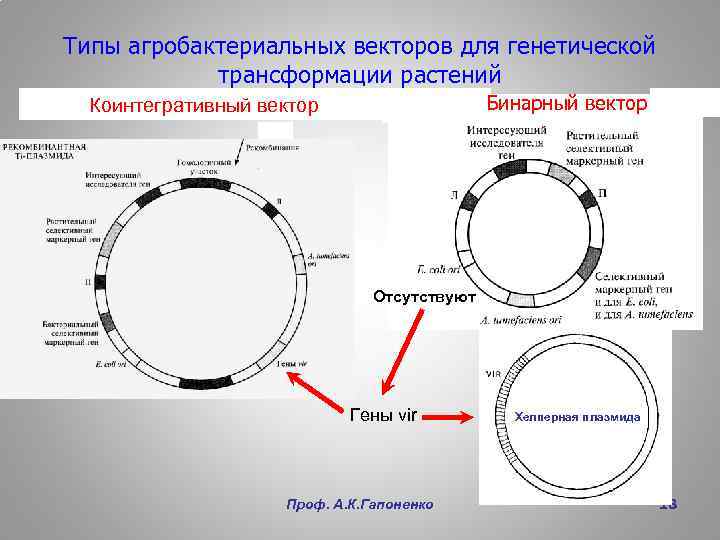 Типы агробактериальных векторов для генетической трансформации растений Бинарный вектор Коинтегративный вектор Отсутствуют Гены vir Проф. А. К. Гапоненко Хелперная плазмида 18
Типы агробактериальных векторов для генетической трансформации растений Бинарный вектор Коинтегративный вектор Отсутствуют Гены vir Проф. А. К. Гапоненко Хелперная плазмида 18
 Бинарный вектор Проф. А. К. Гапоненко 19
Бинарный вектор Проф. А. К. Гапоненко 19
 Для клонирования генов in vitro используются E. coli. Для тиражирования бинарных Ti векторов также используются обе бактерии: E. coli и Agrobacterium. Приведен список наиболее употребляемых и доступных бинарных Ti векторов. Проф. А. К. Гапоненко 20
Для клонирования генов in vitro используются E. coli. Для тиражирования бинарных Ti векторов также используются обе бактерии: E. coli и Agrobacterium. Приведен список наиболее употребляемых и доступных бинарных Ti векторов. Проф. А. К. Гапоненко 20
 Вирулентные плазмиды-помощники A. tumefaciens Линия Устойчивость К антибиотику Тип опина Analysis of Plant Transformation Systems by Elizabeth E. Hood Проф. А. К. Гапоненко 21
Вирулентные плазмиды-помощники A. tumefaciens Линия Устойчивость К антибиотику Тип опина Analysis of Plant Transformation Systems by Elizabeth E. Hood Проф. А. К. Гапоненко 21
 Список «Разоруженных» линий агробактерии» , лишенных генов аналогов фитогор-монов – ауксинов и цитокининов, вызывающих образование опухолей Проф. А. К. Гапоненко 22
Список «Разоруженных» линий агробактерии» , лишенных генов аналогов фитогор-монов – ауксинов и цитокининов, вызывающих образование опухолей Проф. А. К. Гапоненко 22
 Бинарные векторы CAMBIA Маркерный ген Селективный ген Вначале CAMBIA было акронимом "Center for the Application of Molecular Biology to International Agriculture". Однако после значительного расширения работы в фундаментальной науке это полное имя больше не используется. Перевод слова cambia с итальянского и испанского означает change (смена) и теперь это официальное имя компании, которая рассылает свою продукцию по всему миру. Проф. А. К. Гапоненко 23
Бинарные векторы CAMBIA Маркерный ген Селективный ген Вначале CAMBIA было акронимом "Center for the Application of Molecular Biology to International Agriculture". Однако после значительного расширения работы в фундаментальной науке это полное имя больше не используется. Перевод слова cambia с итальянского и испанского означает change (смена) и теперь это официальное имя компании, которая рассылает свою продукцию по всему миру. Проф. А. К. Гапоненко 23
 ДЛЯ УСПЕШНОГО ПРОИЗВОДСТВА ТРАНСГЕННЫХ РАСТЕНИЙ НЕОБХОДИМА ТРЕХКОМПОНЕНТАЯ СИСТЕМА: ИНТЕГРАЦИЯ СИСТЕМЫ КУЛЬТУРЫ ТКАНИ, СИСТЕМА ДОСТАВКИ ДНК, И ВЕКТОРА, НЕСУЩЕГО ГЕН ИНТЕРЕСА Проф. А. К. Гапоненко 24
ДЛЯ УСПЕШНОГО ПРОИЗВОДСТВА ТРАНСГЕННЫХ РАСТЕНИЙ НЕОБХОДИМА ТРЕХКОМПОНЕНТАЯ СИСТЕМА: ИНТЕГРАЦИЯ СИСТЕМЫ КУЛЬТУРЫ ТКАНИ, СИСТЕМА ДОСТАВКИ ДНК, И ВЕКТОРА, НЕСУЩЕГО ГЕН ИНТЕРЕСА Проф. А. К. Гапоненко 24
 Схематическое представление физических и биологических методов, используемых для переноса генов в растения Проф. А. К. Гапоненко 25
Схематическое представление физических и биологических методов, используемых для переноса генов в растения Проф. А. К. Гапоненко 25
 Методы генетической трансформации растений Генетическая трансформация растительных клеток путем Биологической баллистики (Biolistic) Принципиальная схема Источник давления «Макроноситель» Металлические частицы с ДНК Клетки растений Проф. А. К. Гапоненко 26
Методы генетической трансформации растений Генетическая трансформация растительных клеток путем Биологической баллистики (Biolistic) Принципиальная схема Источник давления «Макроноситель» Металлические частицы с ДНК Клетки растений Проф. А. К. Гапоненко 26
 Разработка «генной пушки» под руководством Джона Сандфорда и Теодора Клейна в Корнельском Университете, США (1983 – 1987) Klein T. M. Джон Сандфорд Source: (2000) In Vitro, Cell Dev Biol Plant 36: 303– 308; Sanford JC, Klein TM, Wolf ED, Allen N (1987), J Part Sci Technol 5: 27– 37 Права на технологию были проданы Du Pont вn 1990. Проф. А. К. Гапоненко 27
Разработка «генной пушки» под руководством Джона Сандфорда и Теодора Клейна в Корнельском Университете, США (1983 – 1987) Klein T. M. Джон Сандфорд Source: (2000) In Vitro, Cell Dev Biol Plant 36: 303– 308; Sanford JC, Klein TM, Wolf ED, Allen N (1987), J Part Sci Technol 5: 27– 37 Права на технологию были проданы Du Pont вn 1990. Проф. А. К. Гапоненко 27
 Общая схема установки PDS 1000 SYSTEM Bio Rad Проф. А. К. Гапоненко 28
Общая схема установки PDS 1000 SYSTEM Bio Rad Проф. А. К. Гапоненко 28
 PDS 1000 He SYSTEM Bio Rad Проф. А. К. Гапоненко 29
PDS 1000 He SYSTEM Bio Rad Проф. А. К. Гапоненко 29
 Прибор компании Bio Rad для генетической трансформации клеток растений in vivo методом биологической баллистики Проф. А. К. Гапоненко 30
Прибор компании Bio Rad для генетической трансформации клеток растений in vivo методом биологической баллистики Проф. А. К. Гапоненко 30
 Установка для биобаллистики др. Кристофера Сауттера, Цюрих, Федеральный Институт Технологии, 1991 год. Проф. А. К. Гапоненко 31
Установка для биобаллистики др. Кристофера Сауттера, Цюрих, Федеральный Институт Технологии, 1991 год. Проф. А. К. Гапоненко 31
 История баллистической трансформации растений Доктор Кристофера Сауттер, Цюрих, Федеральный Институт Технологии, 1991 год. Проф. А. К. Гапоненко 32
История баллистической трансформации растений Доктор Кристофера Сауттер, Цюрих, Федеральный Институт Технологии, 1991 год. Проф. А. К. Гапоненко 32
 История баллистической трансформации растений Джон Файнер, 1992 год, один из создателей PIG (particle inflow gun) Проф. А. К. Гапоненко 33
История баллистической трансформации растений Джон Файнер, 1992 год, один из создателей PIG (particle inflow gun) Проф. А. К. Гапоненко 33
 Генная пушка PIG (Particle Inflow Gun), конструкции Д. Файнера и др. Проф. А. К. Гапоненко 34
Генная пушка PIG (Particle Inflow Gun), конструкции Д. Файнера и др. Проф. А. К. Гапоненко 34
 Сотрудники лаборатории проф. Д. Файнера (1993 г. ) Вустер, Огайо, США Проф. А. К. Гапоненко 35
Сотрудники лаборатории проф. Д. Файнера (1993 г. ) Вустер, Огайо, США Проф. А. К. Гапоненко 35
 Методы генетической трансформации растений Д. б. н. , А. К. Гапоненко 36
Методы генетической трансформации растений Д. б. н. , А. К. Гапоненко 36
 PIG в секторе клеточной инженерии растений института биологии развития им. Н. К. Кольцова РАН Проф. А. К. Гапоненко 37
PIG в секторе клеточной инженерии растений института биологии развития им. Н. К. Кольцова РАН Проф. А. К. Гапоненко 37
 Электрическая “генная пушка” Accell Проф. А. К. Гапоненко 38
Электрическая “генная пушка” Accell Проф. А. К. Гапоненко 38
 Требования к системам генетической трансформации (СГТ) Трансформационное событие сопровождается рядом негативных для селекционера процессов: • Инсерционным мутагенезом, вследствие случайности сайта интеграции ДНК • Феном «умолкания генов» (gene silencing phenomenon) • Трансгенные растения показывают различную степень экспрессии трансгенов вследствие эффекта положения, количества встроенных копий и etc. Правила биобезопастености, принятые в Евросоюзе не рекомендуют использовать гены устойчивости к антибиотикам в качестве селективных • Необходима позитивная селекция на основе гена фосфоманозаизомеразы (PMI) или гербицид устойчивости – bar или: • Необходимо использование « Систем удаления селективного гена посредством индукции рекомбинации» Для получения достаточной выборки трансгенных растений, фенотипические не отличающихся от исходных (только по вводимому гену) СГТ должна обладать: • • • Высокой эффективностью; Воспроизводимостью; Для уменьшения риска сомаклональной изменчивости уменьшением фазы культуры in vitro Проф. А. К. Гапоненко 39
Требования к системам генетической трансформации (СГТ) Трансформационное событие сопровождается рядом негативных для селекционера процессов: • Инсерционным мутагенезом, вследствие случайности сайта интеграции ДНК • Феном «умолкания генов» (gene silencing phenomenon) • Трансгенные растения показывают различную степень экспрессии трансгенов вследствие эффекта положения, количества встроенных копий и etc. Правила биобезопастености, принятые в Евросоюзе не рекомендуют использовать гены устойчивости к антибиотикам в качестве селективных • Необходима позитивная селекция на основе гена фосфоманозаизомеразы (PMI) или гербицид устойчивости – bar или: • Необходимо использование « Систем удаления селективного гена посредством индукции рекомбинации» Для получения достаточной выборки трансгенных растений, фенотипические не отличающихся от исходных (только по вводимому гену) СГТ должна обладать: • • • Высокой эффективностью; Воспроизводимостью; Для уменьшения риска сомаклональной изменчивости уменьшением фазы культуры in vitro Проф. А. К. Гапоненко 39
 Вектор для биобаллистической трансформации злаков с GFP (маркерный) и BAR (селективный) генами под контролем злаковых промоторов ( P. Quail and B. V. Conger 2001) Селективный ген Маркерный ген Плазмида любезно предоставлена нам Prof. P. Conger & Prof. B. Quial Д. б. н. А. К. Гапоненко 40
Вектор для биобаллистической трансформации злаков с GFP (маркерный) и BAR (селективный) генами под контролем злаковых промоторов ( P. Quail and B. V. Conger 2001) Селективный ген Маркерный ген Плазмида любезно предоставлена нам Prof. P. Conger & Prof. B. Quial Д. б. н. А. К. Гапоненко 40
 Векторные конструкции, созданные на основе вектора ps. GFPBAR, с Gly I and GST генами, которые любезно предоставлены проф. S. K. Sopory (ICGEB, New-Delhi). Целевой ген Д. б. н. А. К. Гапоненко GST Целевой ген 41
Векторные конструкции, созданные на основе вектора ps. GFPBAR, с Gly I and GST генами, которые любезно предоставлены проф. S. K. Sopory (ICGEB, New-Delhi). Целевой ген Д. б. н. А. К. Гапоненко GST Целевой ген 41
 Возможные пути, экспланты и органы растений для переноса гетерологических генов в растения Прямой перенос генов via Agrobacterium Меристе Соцветие, пыльца со-культивирование апексов Соникация Целое растение Меристемы стеблевых апексов Укол; со-культивирование Протопласты Биобаллистика При помощи ПЭГ; Электропорация; Микроинъекция; при помощи липосом. Инфильтрация Зародыши Культивируемые in vitro клетки, компетентные к регенерации Инфильтрация укол со-культивирование Биобаллистика укол со-культивирование Соцветие Биобаллистика Проф. А. К. Гапоненко Культивируемые in vitro клетки, компетентные к регенерации Биобаллистика; Микроинъекция; силикон-карбид метод; 42
Возможные пути, экспланты и органы растений для переноса гетерологических генов в растения Прямой перенос генов via Agrobacterium Меристе Соцветие, пыльца со-культивирование апексов Соникация Целое растение Меристемы стеблевых апексов Укол; со-культивирование Протопласты Биобаллистика При помощи ПЭГ; Электропорация; Микроинъекция; при помощи липосом. Инфильтрация Зародыши Культивируемые in vitro клетки, компетентные к регенерации Инфильтрация укол со-культивирование Биобаллистика укол со-культивирование Соцветие Биобаллистика Проф. А. К. Гапоненко Культивируемые in vitro клетки, компетентные к регенерации Биобаллистика; Микроинъекция; силикон-карбид метод; 42
 Практические методы генетической трансформации растений q Посредством Agrobacterium tumefaciens q Прямой ввод генов методом биобаллистики q Методы микроинъекций, электропорации протопластов не имеют практического значения, кроме как для нескольких генотипов риса. Проф. А. К. Гапоненко 43
Практические методы генетической трансформации растений q Посредством Agrobacterium tumefaciens q Прямой ввод генов методом биобаллистики q Методы микроинъекций, электропорации протопластов не имеют практического значения, кроме как для нескольких генотипов риса. Проф. А. К. Гапоненко 43
 Agrobacterium Mediated transformation Microprojectile Bombardment (Biolistic) Индукция морфогенного каллуса, выбор экспланта или клеточной структуры, компетентной к прямой регенерации растения in vitro. Bombardment Селективный отбор трансформированных клеток, на среде с селективным агентом Индукция регенерации побегов или эмбриогенеза in vitro. Укоренение или прививка побегов Молекулярный – ПСР, RT-PCR и Cаузерн, Вестерн анализы на предмет интеграции в геном и определение числа копий введенного гена. Control plants Transgenic lines Control plants Адаптация пробирочных растений к условиям теплицы. Отбор трансформантов с высокой экспрессией трансгена. Prof. Alex Gaponenko и с наименьшими отклонениями от исходного фенотипа. Полевые испытания и испытания на биобезопасность UPOF. 44
Agrobacterium Mediated transformation Microprojectile Bombardment (Biolistic) Индукция морфогенного каллуса, выбор экспланта или клеточной структуры, компетентной к прямой регенерации растения in vitro. Bombardment Селективный отбор трансформированных клеток, на среде с селективным агентом Индукция регенерации побегов или эмбриогенеза in vitro. Укоренение или прививка побегов Молекулярный – ПСР, RT-PCR и Cаузерн, Вестерн анализы на предмет интеграции в геном и определение числа копий введенного гена. Control plants Transgenic lines Control plants Адаптация пробирочных растений к условиям теплицы. Отбор трансформантов с высокой экспрессией трансгена. Prof. Alex Gaponenko и с наименьшими отклонениями от исходного фенотипа. Полевые испытания и испытания на биобезопасность UPOF. 44
 Основные этапы генетической трансформации и получения генетически модифицированного (генноинженерного или биотехнологического) растения 1. Индукция морфогенного каллуса или прямой регенерации клеточной структуры, компетентной к прямой регенерации растения in vitro. 2. Создание векторных конструкций для доставки и регуляции экспрессии генов «интереса» в клетку-мишень, компетентную к регенерации в растение. 3. Встраивание чужеродных генов в геном реципиента – посредством агробактериальной трансформации или прямого ввода генов via биобаллистики. 4. Селективный отбор трансформированных клеток. Введение наряду с геном «интереса» селективного гена для негативной - (устойчивость к антибиотикам – гены hyg, npt. II) или позитивной селекции – (способность усваивать продукт – ген PMI фосфоманозаизомераза). 5. Индукция регенерации побегов или эмбриогенеза in vitro. 6. Укоренение или прививка побегов. 7. Адаптация пробирочных растений к условиям теплицы. 8. Молекулярный – ПСР и саузерн анализы на предмет интеграции в геном и определение числа копий введенного гена. 9. Отбор трансформантов с высокой экспрессией трансгена и с наименьшими отклонениями от исходного фенотипа. 10. UPOF – полевые испытания и испытания на биобезопасность. Проф. А. К. Гапоненко 45
Основные этапы генетической трансформации и получения генетически модифицированного (генноинженерного или биотехнологического) растения 1. Индукция морфогенного каллуса или прямой регенерации клеточной структуры, компетентной к прямой регенерации растения in vitro. 2. Создание векторных конструкций для доставки и регуляции экспрессии генов «интереса» в клетку-мишень, компетентную к регенерации в растение. 3. Встраивание чужеродных генов в геном реципиента – посредством агробактериальной трансформации или прямого ввода генов via биобаллистики. 4. Селективный отбор трансформированных клеток. Введение наряду с геном «интереса» селективного гена для негативной - (устойчивость к антибиотикам – гены hyg, npt. II) или позитивной селекции – (способность усваивать продукт – ген PMI фосфоманозаизомераза). 5. Индукция регенерации побегов или эмбриогенеза in vitro. 6. Укоренение или прививка побегов. 7. Адаптация пробирочных растений к условиям теплицы. 8. Молекулярный – ПСР и саузерн анализы на предмет интеграции в геном и определение числа копий введенного гена. 9. Отбор трансформантов с высокой экспрессией трансгена и с наименьшими отклонениями от исходного фенотипа. 10. UPOF – полевые испытания и испытания на биобезопасность. Проф. А. К. Гапоненко 45
 Схема зерно-специфичного промотора гена высокомолекулярной субъединицы глютелина (HMW subunit) Glu-1 D-1, экспрессирующегося в эндосперме развивающегося зерна (Lamaccia et al 2001). . Д. б. н. , Александр Гапоненко 46
Схема зерно-специфичного промотора гена высокомолекулярной субъединицы глютелина (HMW subunit) Glu-1 D-1, экспрессирующегося в эндосперме развивающегося зерна (Lamaccia et al 2001). . Д. б. н. , Александр Гапоненко 46
 Схема химерного гена HMW-GUS, обеспечивающего экспрессию маркерного гена в эндосперме развивающегося зерна на 12 сутки после опыления (Lamaccia et al 2001). . Д. б. н. , Александр Гапоненко 47
Схема химерного гена HMW-GUS, обеспечивающего экспрессию маркерного гена в эндосперме развивающегося зерна на 12 сутки после опыления (Lamaccia et al 2001). . Д. б. н. , Александр Гапоненко 47
 Тканеспецифичная экспрессия маркерного гена HMW-Gus, под контролем в эндосперме развивающегося зерна трансгенной пшеницы на 12 сутки после опыления. Д. б. н. , Александр Гапоненко 48
Тканеспецифичная экспрессия маркерного гена HMW-Gus, под контролем в эндосперме развивающегося зерна трансгенной пшеницы на 12 сутки после опыления. Д. б. н. , Александр Гапоненко 48
 Маркерные гены, для отслеживания процессов трансформации и экспрессии в трансгенных клетках, тканях и растениях Проф. А. К. Гапоненко 49
Маркерные гены, для отслеживания процессов трансформации и экспрессии в трансгенных клетках, тканях и растениях Проф. А. К. Гапоненко 49
 Маркерные гены: ген люцефиразы luc Проф. А. К. Гапоненко 50
Маркерные гены: ген люцефиразы luc Проф. А. К. Гапоненко 50
 Маркерные гены β-глюкоронидаза - uid. A A B Мониторинг транзиентной экспрессии гена β-глюкоронидазы uid. A, при биобаллистической трансформации подсолнечника: A – незрелых зародышах, B – семядолях подсолнечника. (Гапоненко, 1993 ) Проф. А. К. Гапоненко 51
Маркерные гены β-глюкоронидаза - uid. A A B Мониторинг транзиентной экспрессии гена β-глюкоронидазы uid. A, при биобаллистической трансформации подсолнечника: A – незрелых зародышах, B – семядолях подсолнечника. (Гапоненко, 1993 ) Проф. А. К. Гапоненко 51
 Маркерные гены β-глюкоронидаза - uid. A Мониторинг стабильной экспрессии гена β-глюкоронидазы uid. A при агробактериальной трансформации подсолнечника (Гапоненко, 1993 ) 52
Маркерные гены β-глюкоронидаза - uid. A Мониторинг стабильной экспрессии гена β-глюкоронидазы uid. A при агробактериальной трансформации подсолнечника (Гапоненко, 1993 ) 52
 Экспрессия маркерного гена β-глюкоронидазы - uid. A в трансгенном подсолнечнике: A – разрез незрелого соцветия; B – цветках и развивающихся семенах; C – прорастающих семенах T 1 (2 ой генерации) и D – различных тканях растения. A D B C (Гапоненко, 1997 ) 53
Экспрессия маркерного гена β-глюкоронидазы - uid. A в трансгенном подсолнечнике: A – разрез незрелого соцветия; B – цветках и развивающихся семенах; C – прорастающих семенах T 1 (2 ой генерации) и D – различных тканях растения. A D B C (Гапоненко, 1997 ) 53
 Экспрессия маркерного гена β-глюкоронидазы - uid. A в трансгенном подсолнечнике: A – разрез незрелого соцветия; B – специфическая экспрессия гена uid. A в пыльцевых нитях. A B (Гапоненко, 1997) 54
Экспрессия маркерного гена β-глюкоронидазы - uid. A в трансгенном подсолнечнике: A – разрез незрелого соцветия; B – специфическая экспрессия гена uid. A в пыльцевых нитях. A B (Гапоненко, 1997) 54
 Маркерные гены: Green Fluorescent Protein - GFP Мониторинг транзиентной экспрессии гена gfp в незрелых зародышах и каллусных тканях пшеницы после биобаллистики а б в г (а) Транзиентная экспрессия гена gfp в незрелом зародыше пшеницы (б, в) Транзиентная экспрессия гена gfp в каллусных тканях через 24 часа после 55 биобаллистической трансформации Проф. А. К. Гапоненко (г) контроль не трансформированный каллус (Фадеев, Гапоненко, 2006) (
Маркерные гены: Green Fluorescent Protein - GFP Мониторинг транзиентной экспрессии гена gfp в незрелых зародышах и каллусных тканях пшеницы после биобаллистики а б в г (а) Транзиентная экспрессия гена gfp в незрелом зародыше пшеницы (б, в) Транзиентная экспрессия гена gfp в каллусных тканях через 24 часа после 55 биобаллистической трансформации Проф. А. К. Гапоненко (г) контроль не трансформированный каллус (Фадеев, Гапоненко, 2006) (
 Оценка стабильной экспрессии гена gfp Стабильная экспрессия gfp гена в трансгенных тканях пшеницы а б а) Эмбриогенный каллус. б) Побег трансгенной Экспрессия GFP, наблюдаемая пшеницы. 35 дней на 21 день после трансформации. в в) Корешок трансгенной пшеницы. 35 дней после трансформации Экспрессия маркерного гена gfp, обнаруживаемая на 17 день после биобаллистической трансформации, определяется как стабильная (Фадеев, Гапоненко, 2006) 56
Оценка стабильной экспрессии гена gfp Стабильная экспрессия gfp гена в трансгенных тканях пшеницы а б а) Эмбриогенный каллус. б) Побег трансгенной Экспрессия GFP, наблюдаемая пшеницы. 35 дней на 21 день после трансформации. в в) Корешок трансгенной пшеницы. 35 дней после трансформации Экспрессия маркерного гена gfp, обнаруживаемая на 17 день после биобаллистической трансформации, определяется как стабильная (Фадеев, Гапоненко, 2006) 56
 Типы селекции (отбора) трансформированных клеток растений Позитивная Негативная придает преимущество в росте трансформированных клеток селекция препятствуют росту трансформированных клеток q. ПРИ НЕГАТИВНОЙ СЕЛЕКЦИИ, более традиционной, в среду для культивирования клеток добавляют токсичные или тормозящие развитие соединения, такие как антибиотики или гербициды, которые используются для уничтожения или предотвращения роста нетрансформированных клеток. q. ПРИ ПОЗИТИВНОЙ СЕЛЕКЦИИ, трансформированные клетки получают возможность расти с использованием специального источника сахаров, азота или регуляторов роста, как агента селекции. q. Таким образом, при позитивной селекции селективные гены способствуют росту трансформированных тканей, в при негативной селекции селективные гены ведут к смерти или торможение роста нетрансформированных ткани. q. Как относительно новый тип, позитивная селекция показана как более успешная и для однодольных и двудольных видов, и обычно обеспечивает более высокие частоты трансформации, чем негативный отбор. Проф. А. К. Гапоненко 57
Типы селекции (отбора) трансформированных клеток растений Позитивная Негативная придает преимущество в росте трансформированных клеток селекция препятствуют росту трансформированных клеток q. ПРИ НЕГАТИВНОЙ СЕЛЕКЦИИ, более традиционной, в среду для культивирования клеток добавляют токсичные или тормозящие развитие соединения, такие как антибиотики или гербициды, которые используются для уничтожения или предотвращения роста нетрансформированных клеток. q. ПРИ ПОЗИТИВНОЙ СЕЛЕКЦИИ, трансформированные клетки получают возможность расти с использованием специального источника сахаров, азота или регуляторов роста, как агента селекции. q. Таким образом, при позитивной селекции селективные гены способствуют росту трансформированных тканей, в при негативной селекции селективные гены ведут к смерти или торможение роста нетрансформированных ткани. q. Как относительно новый тип, позитивная селекция показана как более успешная и для однодольных и двудольных видов, и обычно обеспечивает более высокие частоты трансформации, чем негативный отбор. Проф. А. К. Гапоненко 57
 Гены для позитивной селекции, для увеличение частоты образования побегов или корней ГЕН IPT показал высокую эффективность при позитивной селекции для табака, томатов, дыни, сладкого перца, и цитрусовых Проф. А. К. Гапоненко 58
Гены для позитивной селекции, для увеличение частоты образования побегов или корней ГЕН IPT показал высокую эффективность при позитивной селекции для табака, томатов, дыни, сладкого перца, и цитрусовых Проф. А. К. Гапоненко 58
 Гены кодирующие токсичные антибиотики для негативной селекции Проф. А. К. Гапоненко 59
Гены кодирующие токсичные антибиотики для негативной селекции Проф. А. К. Гапоненко 59
 Вещества и ферменты для углеводород зависимой позитивной селекции Проф. А. К. Гапоненко 60
Вещества и ферменты для углеводород зависимой позитивной селекции Проф. А. К. Гапоненко 60
 Токсичные гербициды, гены их кодирующие для условно-позитивной селекции Проф. А. К. Гапоненко 61
Токсичные гербициды, гены их кодирующие для условно-позитивной селекции Проф. А. К. Гапоненко 61
 НЕОБХОДИМЫЕ КОМПОНЕНТЫ УЛУЧШЕНИЯ СЕЛЬХОЗКУЛЬТУР МЕТОДАМИ ГЕННОЙ ИНЖЕНЕРИИ 1. ВЫСОКОПРОДУКТИВНЫЕ СОРТА ИЛИ ЛИНИИКОМПОНЕНТЫ ГИБРИДОВ 2. 3. ГЕНЫ «ИНТЕРЕСА» ИНТЕЛЛЕКТУАЛЬНАЯ СОБСТВЕННОСТЬ, ОХРАНЯЕМАЯ ПАТЕНТАМИ ГМ КУЛЬТУРЫ С НОВЫМИ ИЛИ УЛУЧШЕННЫМИ ПРИЗНАКАМИ СИСТЕМЫ ГЕНЕТИЧЕСКОЙ ТРАНСФОРМАЦИИ 4. ФАКТОРЫ ДОСТИЖЕНИЯ ВЫСОКОГО УРОВНЯ ЭКСПРЕССИИ или УМОЛКАНИЯ ГЕНОВ В НУЖНОЕ ВРЕМЯ И НУЖНОЙ ТКАНИ РАСТЕНИЯ Проф. А. К. Гапоненко 62
НЕОБХОДИМЫЕ КОМПОНЕНТЫ УЛУЧШЕНИЯ СЕЛЬХОЗКУЛЬТУР МЕТОДАМИ ГЕННОЙ ИНЖЕНЕРИИ 1. ВЫСОКОПРОДУКТИВНЫЕ СОРТА ИЛИ ЛИНИИКОМПОНЕНТЫ ГИБРИДОВ 2. 3. ГЕНЫ «ИНТЕРЕСА» ИНТЕЛЛЕКТУАЛЬНАЯ СОБСТВЕННОСТЬ, ОХРАНЯЕМАЯ ПАТЕНТАМИ ГМ КУЛЬТУРЫ С НОВЫМИ ИЛИ УЛУЧШЕННЫМИ ПРИЗНАКАМИ СИСТЕМЫ ГЕНЕТИЧЕСКОЙ ТРАНСФОРМАЦИИ 4. ФАКТОРЫ ДОСТИЖЕНИЯ ВЫСОКОГО УРОВНЯ ЭКСПРЕССИИ или УМОЛКАНИЯ ГЕНОВ В НУЖНОЕ ВРЕМЯ И НУЖНОЙ ТКАНИ РАСТЕНИЯ Проф. А. К. Гапоненко 62
 НАМИ РАЗРАБОТАНЫ ИННОВАЦИОННЫЕ ПРОЕКТЫ ДЛЯ УВЕЛИЧЕНИЯ РЕНТАБЕЛЬНОСТИ ПРОИЗВОДСТВА И УЛУЧШЕНИЯ КАЧЕСТВА ПРОДУКЦИИ Мягкой (Triticum aestivum L) и твердой пшеницы (T. durum Desf) Сахарной свеклы (Beta vulgaris L) Подсолнечника (Helianthus annuus L) 63
НАМИ РАЗРАБОТАНЫ ИННОВАЦИОННЫЕ ПРОЕКТЫ ДЛЯ УВЕЛИЧЕНИЯ РЕНТАБЕЛЬНОСТИ ПРОИЗВОДСТВА И УЛУЧШЕНИЯ КАЧЕСТВА ПРОДУКЦИИ Мягкой (Triticum aestivum L) и твердой пшеницы (T. durum Desf) Сахарной свеклы (Beta vulgaris L) Подсолнечника (Helianthus annuus L) 63
 МЫ УСПЕШНО РАБОТАЕМ НАД РАЗРАБОТКОЙ МЕТОДОВ КУЛЬТИВИРОВАНИЯ КЛЕТОК, РЕГЕНЕРАЦИИ ИЗ НИХ РАСТЕНИЙ С 1981 г. И ГЕНЕТИЧЕСКОЙ ТРАНСФОРМАЦИИ ПШЕНИЦЫ С 1991 г. Callus with shoots Stages of culture in vitro Shoots rooting Number Plantlets adaptation for greenhou Number of regeneration, % Morphogenical calli 156 Calli with shoots 138 88, 7 +/- 6, 00 Rooted shoots 136 87, 2 +/- 5. 21 Plants obtained for green house 136 87, 2 +/- 5. 21 A. Gaponenko et al, 1984; 1987; 1997; 2006; 2007
МЫ УСПЕШНО РАБОТАЕМ НАД РАЗРАБОТКОЙ МЕТОДОВ КУЛЬТИВИРОВАНИЯ КЛЕТОК, РЕГЕНЕРАЦИИ ИЗ НИХ РАСТЕНИЙ С 1981 г. И ГЕНЕТИЧЕСКОЙ ТРАНСФОРМАЦИИ ПШЕНИЦЫ С 1991 г. Callus with shoots Stages of culture in vitro Shoots rooting Number Plantlets adaptation for greenhou Number of regeneration, % Morphogenical calli 156 Calli with shoots 138 88, 7 +/- 6, 00 Rooted shoots 136 87, 2 +/- 5. 21 Plants obtained for green house 136 87, 2 +/- 5. 21 A. Gaponenko et al, 1984; 1987; 1997; 2006; 2007
 Параметры баллистической трансформации, влияющие на эффективность трансформации q. Физические параметры Ø Физические и химические свойства металлических частиц используемых для переноса ДНК (размер, хим. инертность) Ø Природа ДНК (концентрация, размер молекул), преципитация ДНК на частицы Ø Давление и обьем Не при выстреле Ø Величина отрицательного давления вакуума в камере Ø Расстояние от источника частиц до ткани-мишени Ø Количество выстрелов на один образец ткани q. Биологические параметры q Точное воспроизведение оптимальных условий выращивания растений используемых в эксперименте q Выбор экспланта q Обработка ткани-мишени осмотическим шоком до и после бомбардмента Проф. А. К. Гапоненко 65
Параметры баллистической трансформации, влияющие на эффективность трансформации q. Физические параметры Ø Физические и химические свойства металлических частиц используемых для переноса ДНК (размер, хим. инертность) Ø Природа ДНК (концентрация, размер молекул), преципитация ДНК на частицы Ø Давление и обьем Не при выстреле Ø Величина отрицательного давления вакуума в камере Ø Расстояние от источника частиц до ткани-мишени Ø Количество выстрелов на один образец ткани q. Биологические параметры q Точное воспроизведение оптимальных условий выращивания растений используемых в эксперименте q Выбор экспланта q Обработка ткани-мишени осмотическим шоком до и после бомбардмента Проф. А. К. Гапоненко 65
 Оптимизация параметров баллистической трансформации мягкой пшеницы Описание эксперимента: Оцениваемые сорта: Лада, Эстер, Мис Баллистическая пушка PIG Сравниваемые параметры: • давление гелия 5, 6, 7 и 8 атм • расстояние 10, 12, 14 см • Срок с момента индукции культуры 4, 7, 10, 14 сутки Морфогенетические Транзиентная экспрессия В эксперименте оценено каллусы, подготовленные гена uid. A через 2 дня после ~20000 эксплантов к трансформации Оценка эффективности параметров: Способом оценки эффективности доставки вектора экспрессии, содержащего гены интереса с регуляторными элементами, является сравнение количества участков экспрессии маркерного гена uid. A на единицу поверхности ткани-мишени, при различных вариантах опыта (Фадеев, Гапоненко, 2006) Проф. А. К. Гапоненко 66
Оптимизация параметров баллистической трансформации мягкой пшеницы Описание эксперимента: Оцениваемые сорта: Лада, Эстер, Мис Баллистическая пушка PIG Сравниваемые параметры: • давление гелия 5, 6, 7 и 8 атм • расстояние 10, 12, 14 см • Срок с момента индукции культуры 4, 7, 10, 14 сутки Морфогенетические Транзиентная экспрессия В эксперименте оценено каллусы, подготовленные гена uid. A через 2 дня после ~20000 эксплантов к трансформации Оценка эффективности параметров: Способом оценки эффективности доставки вектора экспрессии, содержащего гены интереса с регуляторными элементами, является сравнение количества участков экспрессии маркерного гена uid. A на единицу поверхности ткани-мишени, при различных вариантах опыта (Фадеев, Гапоненко, 2006) Проф. А. К. Гапоненко 66
 Оптимизация параметров баллистической трансформации мягкой пшеницы Количественная оценка доставки вектора экспрессии, содержащего ген -глюкоронидазы (uid. A) на 3 -4 мм 2 (размер экспланта) через 2 дня после трансформации 46 участков экспрессии гена uid. A/эксплант 14 см, 5 атм 96 участков экспрессии гена uid. A /эксплант 189 участков экспрессии гена uid. A /эксплант 14 см, 8 атм 12 см, 6 атм (Фадеев, Гапоненко, 2006) Проф. А. К. Гапоненко 67 β
Оптимизация параметров баллистической трансформации мягкой пшеницы Количественная оценка доставки вектора экспрессии, содержащего ген -глюкоронидазы (uid. A) на 3 -4 мм 2 (размер экспланта) через 2 дня после трансформации 46 участков экспрессии гена uid. A/эксплант 14 см, 5 атм 96 участков экспрессии гена uid. A /эксплант 189 участков экспрессии гена uid. A /эксплант 14 см, 8 атм 12 см, 6 атм (Фадеев, Гапоненко, 2006) Проф. А. К. Гапоненко 67 β
 Анализ трансгенных растений с помощью Полимеразной Цепной Реакции на наличие гена bar Электрофореграмма ПЦР анализа трансгенных растений мягкой пшеницы (праймер для гена bar) 1, 20 MWMarker 1 kb 2 негативный контроль ДНК пшеницы 3– 17 ДНК первичных трансформантов 18 позитивной контроль ДНК трансгенного картофеля 19 плазмида p. GFPBAR Электрофореграмма ПЦР анализа трансгенных растений мягкой пшеницы (праймер для nos’ 3 терминатора) (Фадеев, Гапоненко, 2006) 1, 20 MWMarker 1 kb 2 негативный контроль ДНК пшеницы 3– 17 ДНК первичных трансформантов 18 позитивной контроль ДНК трансгенного картофеля 19 плазмида p. GFPBAR Проф. А. К. Гапоненко 68
Анализ трансгенных растений с помощью Полимеразной Цепной Реакции на наличие гена bar Электрофореграмма ПЦР анализа трансгенных растений мягкой пшеницы (праймер для гена bar) 1, 20 MWMarker 1 kb 2 негативный контроль ДНК пшеницы 3– 17 ДНК первичных трансформантов 18 позитивной контроль ДНК трансгенного картофеля 19 плазмида p. GFPBAR Электрофореграмма ПЦР анализа трансгенных растений мягкой пшеницы (праймер для nos’ 3 терминатора) (Фадеев, Гапоненко, 2006) 1, 20 MWMarker 1 kb 2 негативный контроль ДНК пшеницы 3– 17 ДНК первичных трансформантов 18 позитивной контроль ДНК трансгенного картофеля 19 плазмида p. GFPBAR Проф. А. К. Гапоненко 68
 69
69
 70
70
 Схема получения трансгенных растений пшеницы методом биобаллистики по Гапоненко А. К. и Фадееву В. С. (2004) 10 -12 день 13 день 25 день 55 день 100 день
Схема получения трансгенных растений пшеницы методом биобаллистики по Гапоненко А. К. и Фадееву В. С. (2004) 10 -12 день 13 день 25 день 55 день 100 день
 ПОЛУЧЕНИЕ ТРАНСГЕННЫХ РАСТЕНИЙ САХАРНОЙ СВЕКЛЫ С ГЕНОМ bar ПРИ КОНЦЕНТРАЦИИ PPT – 2 МГ/Л, ПРОДОЛЖИТЕЛЬНОСТЬ СЕЛЕКЦИИ - 8 НЕДЕЛЬ Генотип Кол-во эксплант атов, шт. Кол-во регенерант ов после селекции, шт. Кол-во трансформа нтов (подтв. ПЦР), шт. Частота трансформац ии, % Кол-во химерных растений, шт. РМС 73 307 10 3 0, 97 3 Льговская одн. 52 484 15 5 1, 03 5 Рамонская одн. 47 572 21 10 1, 74 10 ЭЛЕКТРОФОРЕТИЧЕСКИЙ АНАЛИЗ РЕЗУЛЬТАТОВ ПЦР НА ГЕН BAR ИЗ ДНК ТРАНСГЕННОЙ САХАРНОЙ СВЕКЛЫ 350 п. н. 1, 14 Маркер длины фрагментов ДНК (100 bp), 2 Контроль реакции без ДНК, 3 ПЦР на препарате ДНК Pbar, 4 -13 ПЦР на препаратах ДНК сахарной свеклы, Ожидаемая длина – 339 п. н. Проф. А. К. Гапоненко 72 (Мишуткина Я. В. , Гапоненко А. К. , 2004)
ПОЛУЧЕНИЕ ТРАНСГЕННЫХ РАСТЕНИЙ САХАРНОЙ СВЕКЛЫ С ГЕНОМ bar ПРИ КОНЦЕНТРАЦИИ PPT – 2 МГ/Л, ПРОДОЛЖИТЕЛЬНОСТЬ СЕЛЕКЦИИ - 8 НЕДЕЛЬ Генотип Кол-во эксплант атов, шт. Кол-во регенерант ов после селекции, шт. Кол-во трансформа нтов (подтв. ПЦР), шт. Частота трансформац ии, % Кол-во химерных растений, шт. РМС 73 307 10 3 0, 97 3 Льговская одн. 52 484 15 5 1, 03 5 Рамонская одн. 47 572 21 10 1, 74 10 ЭЛЕКТРОФОРЕТИЧЕСКИЙ АНАЛИЗ РЕЗУЛЬТАТОВ ПЦР НА ГЕН BAR ИЗ ДНК ТРАНСГЕННОЙ САХАРНОЙ СВЕКЛЫ 350 п. н. 1, 14 Маркер длины фрагментов ДНК (100 bp), 2 Контроль реакции без ДНК, 3 ПЦР на препарате ДНК Pbar, 4 -13 ПЦР на препаратах ДНК сахарной свеклы, Ожидаемая длина – 339 п. н. Проф. А. К. Гапоненко 72 (Мишуткина Я. В. , Гапоненко А. К. , 2004)
 ОПРЕДЕЛЕНИЕ ОПТИМАЛЬНОЙ СЕЛЕКТИВНОЙ КОНЦЕНТРАЦИИ ФОСФИНОТРИЦИНА IN VITRO ВЫЖИВАЕМОСТЬ ПОБЕГОВ НА СРЕДАХ С РАЗЛИЧНЫМИ КОНЦЕНТРАЦИЯМИ ФОСФИНОТРИЦИНА НСР 0, 05= 2, 53 (Мишуткина Я. В. , Гапоненко А. К. , 2004) 0 РРТ 0, 5 РРТ 2 РРТ 4 РРТ 150 эксплантов на каждую концентрацию (3 повтора по 50 эксплантов) минимальная концентрация PPT вызывающая 100% гибель эксплантов за 8 недель селекции - 2 мг/л Проф. А. К. Гапоненко 8 РРТ 73
ОПРЕДЕЛЕНИЕ ОПТИМАЛЬНОЙ СЕЛЕКТИВНОЙ КОНЦЕНТРАЦИИ ФОСФИНОТРИЦИНА IN VITRO ВЫЖИВАЕМОСТЬ ПОБЕГОВ НА СРЕДАХ С РАЗЛИЧНЫМИ КОНЦЕНТРАЦИЯМИ ФОСФИНОТРИЦИНА НСР 0, 05= 2, 53 (Мишуткина Я. В. , Гапоненко А. К. , 2004) 0 РРТ 0, 5 РРТ 2 РРТ 4 РРТ 150 эксплантов на каждую концентрацию (3 повтора по 50 эксплантов) минимальная концентрация PPT вызывающая 100% гибель эксплантов за 8 недель селекции - 2 мг/л Проф. А. К. Гапоненко 8 РРТ 73
 ОПРЕДЕЛЕНИЕ НАЛИЧИЯ ФЕРМЕНТА РАТ С ПОМОЩЬЮ ТЕСТСИСТЕМЫ Trait LL Lateral Flow Test Kit (ИСТОЧНИК) ИЛЛЮСТРАЦИЯ НАЛИЧИЯ (А) И ОТСУТСТВИЯ (В) РАТ ФЕРМЕНТА РЕЗУЛЬТАТЫ АНАЛИЗА НАЛИЧИЯ ФЕРМЕНТА РАТ к - контрольное (нетрансгенное) растение сахарной свеклы, 1 -11 – трансгенные растения сахарной свеклы ОЦЕНКА УСТОЙЧИВОСТИ ТРАНСГЕННЫХ ЛИНИЙ К ДЕЙСТВИЮ ФОСФИНОТРИЦИНА В УСЛОВИЯХ in vitro Нетрансгенная линия после 4 недель селекции (концентрация фосфинотрици на 0, 20 и 40 мг/л) Трансгенная линия после 4 недель селекции (концентрация фосфинотрици на 0, 100, 200 и 400 мг/л). Проф. А. К. Гапоненко 74
ОПРЕДЕЛЕНИЕ НАЛИЧИЯ ФЕРМЕНТА РАТ С ПОМОЩЬЮ ТЕСТСИСТЕМЫ Trait LL Lateral Flow Test Kit (ИСТОЧНИК) ИЛЛЮСТРАЦИЯ НАЛИЧИЯ (А) И ОТСУТСТВИЯ (В) РАТ ФЕРМЕНТА РЕЗУЛЬТАТЫ АНАЛИЗА НАЛИЧИЯ ФЕРМЕНТА РАТ к - контрольное (нетрансгенное) растение сахарной свеклы, 1 -11 – трансгенные растения сахарной свеклы ОЦЕНКА УСТОЙЧИВОСТИ ТРАНСГЕННЫХ ЛИНИЙ К ДЕЙСТВИЮ ФОСФИНОТРИЦИНА В УСЛОВИЯХ in vitro Нетрансгенная линия после 4 недель селекции (концентрация фосфинотрици на 0, 20 и 40 мг/л) Трансгенная линия после 4 недель селекции (концентрация фосфинотрици на 0, 100, 200 и 400 мг/л). Проф. А. К. Гапоненко 74
 ОЦЕНКА УСТОЙЧИВОСТИ ТРАНСГЕННЫХ ЛИНИЙ САХАРНОЙ СВЕКЛЫ К РАЗЛИЧНЫМ КОНЦЕНТРАЦИЯМ PPT IN VITRO * + растения фенотипически не отличаются от контрольных, ** +/– растения с признаками токсикации (частичные ожоги листьев, замедление роста). Мишуткина Я. В. , Гапоненко А. К. , 2004. Проф. А. К. Гапоненко 75
ОЦЕНКА УСТОЙЧИВОСТИ ТРАНСГЕННЫХ ЛИНИЙ САХАРНОЙ СВЕКЛЫ К РАЗЛИЧНЫМ КОНЦЕНТРАЦИЯМ PPT IN VITRO * + растения фенотипически не отличаются от контрольных, ** +/– растения с признаками токсикации (частичные ожоги листьев, замедление роста). Мишуткина Я. В. , Гапоненко А. К. , 2004. Проф. А. К. Гапоненко 75
 ОЦЕНКА УСТОЙЧИВОСТИ ТРАНСГЕННЫХ ЛИНИЙ К ДЕЙСТВИЮ ГЕРБИЦИДА «БАСТА» 3 Л/ГА КОНТРОЛЬ ТРАНСГЕННЫЕ ЛИНИИ 6 Л/ГА 9 Л/ГА ТРАНСГЕННЫЕ ЛИНИИ КОНТРОЛЬ ТРАНСГЕННЫЕ ЛИНИИ 76
ОЦЕНКА УСТОЙЧИВОСТИ ТРАНСГЕННЫХ ЛИНИЙ К ДЕЙСТВИЮ ГЕРБИЦИДА «БАСТА» 3 Л/ГА КОНТРОЛЬ ТРАНСГЕННЫЕ ЛИНИИ 6 Л/ГА 9 Л/ГА ТРАНСГЕННЫЕ ЛИНИИ КОНТРОЛЬ ТРАНСГЕННЫЕ ЛИНИИ 76
 Генетическая трансформация подсолнечника via Agrobacteria (патент А. К. Гапоненко, 2002 г. ) A. tumefaciens line used EHA -105 (Elizabeth Hood et al. , 1993) Binary Vectors used p 35 SGUSINT; р. НВТ 14; p. HBT 59; Cambia 1300; Cambia 1301; Genes introduced uid. A; Hyg. R; NPTII; fbp 14 ; Cpt-1; HMGR; НАМ 59. Explants Split of 2 days old induced apical meristems, obtained in cultured hypocotyls segments. Multiples apical meristems, which have been induced in vitro. Additional treatment Explants were bombarded twice by tungsten particles using PIG. Co-cultivation time 2 -4 days on media, containing acetosyringone Selection On media, containing Hygromycin B, & the cefotaxime to inhibit Agrobacterium growth. PCR & Southern analysis of transformed tissues Micropropagation of shoots passed through selection Could be continued more then 1 month (it is allow to multiple transgenic shoots and avoid loss during grafting or rooting). Grafting or rooting 2 -3 weeks in the tube, than in the climate control chamber. Plant recovering Average up to 4 month for full seeds maturation. Проф. А. К. Гапоненко 77
Генетическая трансформация подсолнечника via Agrobacteria (патент А. К. Гапоненко, 2002 г. ) A. tumefaciens line used EHA -105 (Elizabeth Hood et al. , 1993) Binary Vectors used p 35 SGUSINT; р. НВТ 14; p. HBT 59; Cambia 1300; Cambia 1301; Genes introduced uid. A; Hyg. R; NPTII; fbp 14 ; Cpt-1; HMGR; НАМ 59. Explants Split of 2 days old induced apical meristems, obtained in cultured hypocotyls segments. Multiples apical meristems, which have been induced in vitro. Additional treatment Explants were bombarded twice by tungsten particles using PIG. Co-cultivation time 2 -4 days on media, containing acetosyringone Selection On media, containing Hygromycin B, & the cefotaxime to inhibit Agrobacterium growth. PCR & Southern analysis of transformed tissues Micropropagation of shoots passed through selection Could be continued more then 1 month (it is allow to multiple transgenic shoots and avoid loss during grafting or rooting). Grafting or rooting 2 -3 weeks in the tube, than in the climate control chamber. Plant recovering Average up to 4 month for full seeds maturation. Проф. А. К. Гапоненко 77
 Оптимизация параметров баллистической трансформации подсолнечника Маркерный ген β-глюкоронидаза - uid. A A B Мониторинг транзиентной экспрессии гена β-глюкоронидазы uid. A, при биобаллистической трансформации подсолнечника: A – незрелых зародышах, B – семядолях подсолнечника. (Гапоненко, 1993 ) Проф. А. К. Гапоненко 78
Оптимизация параметров баллистической трансформации подсолнечника Маркерный ген β-глюкоронидаза - uid. A A B Мониторинг транзиентной экспрессии гена β-глюкоронидазы uid. A, при биобаллистической трансформации подсолнечника: A – незрелых зародышах, B – семядолях подсолнечника. (Гапоненко, 1993 ) Проф. А. К. Гапоненко 78
 Сравнение свойств агробактериальной и биобаллистическая трансформации Агробактериальная трансформация Плюсы Минусы • Относительная дешевизна и изученность метода • Более предсказуемые результаты внедрения трансгена в геном реципиента ·Вид и генотип зависимость - трудность применения для многих видов и генотипов • Ограничения по количеству вводимых генов Биобаллистическая трансформация Плюсы • Пригодна для любых объектов in vitro (хвойные, злаки, бобовые). • Универсальная доставка ДНК в любую ткань и орган. • Возможно использовать при прямой регенерации растений, минуя каллус. • Позволяет вводить одновременно несколько генов. • Не нуждается в сложных векторах. Используется для трансформации пластид Минусы • Относительная дороговизна метода • Непредсказуемость интеграции и копийности вводимых генов • Проф. А. К. Гапоненко 79
Сравнение свойств агробактериальной и биобаллистическая трансформации Агробактериальная трансформация Плюсы Минусы • Относительная дешевизна и изученность метода • Более предсказуемые результаты внедрения трансгена в геном реципиента ·Вид и генотип зависимость - трудность применения для многих видов и генотипов • Ограничения по количеству вводимых генов Биобаллистическая трансформация Плюсы • Пригодна для любых объектов in vitro (хвойные, злаки, бобовые). • Универсальная доставка ДНК в любую ткань и орган. • Возможно использовать при прямой регенерации растений, минуя каллус. • Позволяет вводить одновременно несколько генов. • Не нуждается в сложных векторах. Используется для трансформации пластид Минусы • Относительная дороговизна метода • Непредсказуемость интеграции и копийности вводимых генов • Проф. А. К. Гапоненко 79
 Time line of first reports of transformation of major cereal species. Biolistic ( black ), Agrobacterium ( grey ). Проф. А. К. Гапоненко 80
Time line of first reports of transformation of major cereal species. Biolistic ( black ), Agrobacterium ( grey ). Проф. А. К. Гапоненко 80
 Трансформация пшеницы via Agrobacterium с селекцией на глифосате Agrobacterium-mediated large-scale transformation of wheat (Triticum aestivum L. ) using glyphosate selection, Plant Cell Rep (2003) 21: 1010– Plant Cell Rep 1019, T. Hu · S. Metz · C. Chay · H. P. Zhou · N. Biest ·G. Chen · M. Cheng · X. Feng ·M. Radionenko · F. Lu ·J. Fry a Four-day precultured immature embryo b Agrobacterium infection, c embryogenic callus after 1 week m. M glyphosate selection medium, d shoot differentiation C+0. 1 m. M glyphosate e plantlet regeneration +0. 02 m. M glyphosate f T 0 transgenic plant (left) and non-transgenic control (right) 7 days after being sprayed with Roundup Ultra; this kind of transgenic event (left) with some vegetative damage will not be advanced to the next generation Проф. А. К. Гапоненко 81
Трансформация пшеницы via Agrobacterium с селекцией на глифосате Agrobacterium-mediated large-scale transformation of wheat (Triticum aestivum L. ) using glyphosate selection, Plant Cell Rep (2003) 21: 1010– Plant Cell Rep 1019, T. Hu · S. Metz · C. Chay · H. P. Zhou · N. Biest ·G. Chen · M. Cheng · X. Feng ·M. Radionenko · F. Lu ·J. Fry a Four-day precultured immature embryo b Agrobacterium infection, c embryogenic callus after 1 week m. M glyphosate selection medium, d shoot differentiation C+0. 1 m. M glyphosate e plantlet regeneration +0. 02 m. M glyphosate f T 0 transgenic plant (left) and non-transgenic control (right) 7 days after being sprayed with Roundup Ultra; this kind of transgenic event (left) with some vegetative damage will not be advanced to the next generation Проф. А. К. Гапоненко 81
 Я благодарен моим аспирантам и дипломникам, напряженным трудом которых, была получена часть из представленных данных ГРУППА ТРАНСФОРМАЦИИ ПОДСОЛНЕЧНИКА Ярик Нескородов Мадина Савитова ГРУППА ТРАНСФОРМАЦИИ ПШЕНИЦЫ Виталий Фадеев ГРУППА ТРАНСФОРМАЦИИ САХАРНОЙ СВЕКЛЫ Яна Мишуткина Аня Филипьева Саша Маркеев Маша Трухина Аня Славохотова
Я благодарен моим аспирантам и дипломникам, напряженным трудом которых, была получена часть из представленных данных ГРУППА ТРАНСФОРМАЦИИ ПОДСОЛНЕЧНИКА Ярик Нескородов Мадина Савитова ГРУППА ТРАНСФОРМАЦИИ ПШЕНИЦЫ Виталий Фадеев ГРУППА ТРАНСФОРМАЦИИ САХАРНОЙ СВЕКЛЫ Яна Мишуткина Аня Филипьева Саша Маркеев Маша Трухина Аня Славохотова
 Благодарю за внимание. Проф. А. К. Гапоненко 83
Благодарю за внимание. Проф. А. К. Гапоненко 83


