Лекция 11 генная инженерия.ppt
- Количество слайдов: 61
 Генетическая инженерия o Генетическая инженерия – конструирование in vitro функционально активных генетических структур (рекомбинантных или гибридных ДНК) или создание искусственных генетических программ
Генетическая инженерия o Генетическая инженерия – конструирование in vitro функционально активных генетических структур (рекомбинантных или гибридных ДНК) или создание искусственных генетических программ
 Основы генетической инженерии o Генетическая инженерия — это отрасль молекулярной биологии, в которой разрабатываются методы передачи генетического материала от одного живого организма к другому с целью получения новой генетической информации и управления наследственностью.
Основы генетической инженерии o Генетическая инженерия — это отрасль молекулярной биологии, в которой разрабатываются методы передачи генетического материала от одного живого организма к другому с целью получения новой генетической информации и управления наследственностью.
 Экономическое значение генной инженерии o Генная инженерия служит для получения желаемых качеств генетически модифицированного организма. o В отличие от традиционной селекции, в ходе которой генотип подвергается изменениям лишь косвенно, генная инженерия позволяет непосредственно вмешиваться в генетический аппарат, применяя технику молекулярного клонирования. o Примерами применения генной инженерии являются получение новых генетически модифицированных сортов зерновых культур, производство человеческого инсулина путём использования генномодифицированных бактерий, производство эритропоэтина в культуре клеток или новых пород экспериментальных мышей для научных исследований.
Экономическое значение генной инженерии o Генная инженерия служит для получения желаемых качеств генетически модифицированного организма. o В отличие от традиционной селекции, в ходе которой генотип подвергается изменениям лишь косвенно, генная инженерия позволяет непосредственно вмешиваться в генетический аппарат, применяя технику молекулярного клонирования. o Примерами применения генной инженерии являются получение новых генетически модифицированных сортов зерновых культур, производство человеческого инсулина путём использования генномодифицированных бактерий, производство эритропоэтина в культуре клеток или новых пород экспериментальных мышей для научных исследований.
 История развития генетической инженерии o Генетическая инженерия возникла на стыке многих биологических дисциплин: молекулярной генетики, энзимологии, биохимии нуклеиновых кислот и др. o 1972 г. получена первая рекомбинантная ДНК (П. Берг с сотр. ). o 1971 г. получены первые трансгенные растения. o 1981 -1982 гг. получена трансгенная мышь (Р. Пальмитер, Р. Бринстер и др. ) o 1993 г. получены трансгенные овцы с геном химозина (Л. К. Эрнст, Г. Брем, И. В. Прокофьев)
История развития генетической инженерии o Генетическая инженерия возникла на стыке многих биологических дисциплин: молекулярной генетики, энзимологии, биохимии нуклеиновых кислот и др. o 1972 г. получена первая рекомбинантная ДНК (П. Берг с сотр. ). o 1971 г. получены первые трансгенные растения. o 1981 -1982 гг. получена трансгенная мышь (Р. Пальмитер, Р. Бринстер и др. ) o 1993 г. получены трансгенные овцы с геном химозина (Л. К. Эрнст, Г. Брем, И. В. Прокофьев)
 Задачи генетической инженерии o Основная задача генетической инженерии – создание in vitro молекул ДНК с помощью соединения фрагментов ДНК, которые в естественных условиях не сочетаются из-за межвидовых барьеров (рекомбинантные ДНК)
Задачи генетической инженерии o Основная задача генетической инженерии – создание in vitro молекул ДНК с помощью соединения фрагментов ДНК, которые в естественных условиях не сочетаются из-за межвидовых барьеров (рекомбинантные ДНК)
 Предмет генной инженерии o Размер молекулы ДНК измеряется числом пар комплементарных нуклеотидов – от нескольких тысяч пар до миллиона пар нуклеотидов. o У человека длина ДНК составляющей первую хромосому составляет 263 миллионов пар нуклеотидов.
Предмет генной инженерии o Размер молекулы ДНК измеряется числом пар комплементарных нуклеотидов – от нескольких тысяч пар до миллиона пар нуклеотидов. o У человека длина ДНК составляющей первую хромосому составляет 263 миллионов пар нуклеотидов.
 Геном человека o Человеческий геном состоит из 23 пар хромосом содержащих примерно 3, 1 млрд пар оснований. o В ходе выполнения проекта «Геном человека» была определена последовательность ДНК всех хромосом. o В настоящее время эти данные активно используется по всему миру в биомедицинских исследованиях. o Полное секвенирование выявило, что человеческий геном содержит 20 000— 25 000 генов.
Геном человека o Человеческий геном состоит из 23 пар хромосом содержащих примерно 3, 1 млрд пар оснований. o В ходе выполнения проекта «Геном человека» была определена последовательность ДНК всех хромосом. o В настоящее время эти данные активно используется по всему миру в биомедицинских исследованиях. o Полное секвенирование выявило, что человеческий геном содержит 20 000— 25 000 генов.
 Биотехнология рекомбинантных ДНК o Рекомбинантные ДНК - это молекулы ДНК, полученные вне живой клетки путем соединения природных или синтетических фрагментов ДНК с молекулами, способными синтезировать дочернюю молекулу ДНК на матрице родительской ДНК в клетке (репликация). o В рекомбинантной ДНК соединены в бесклеточной системе два компонента: 1. Вектор – обеспечивает механизм репликации и проявление генетической информации записанной в гене (экспрессии) 2. Фрагмент клонируемой ( «чужеродной» ) ДНК, содержащий интересующие нас генетические элементы.
Биотехнология рекомбинантных ДНК o Рекомбинантные ДНК - это молекулы ДНК, полученные вне живой клетки путем соединения природных или синтетических фрагментов ДНК с молекулами, способными синтезировать дочернюю молекулу ДНК на матрице родительской ДНК в клетке (репликация). o В рекомбинантной ДНК соединены в бесклеточной системе два компонента: 1. Вектор – обеспечивает механизм репликации и проявление генетической информации записанной в гене (экспрессии) 2. Фрагмент клонируемой ( «чужеродной» ) ДНК, содержащий интересующие нас генетические элементы.
 Методы биотехнологии рекомбинантных ДНК o Специфическое расщепление ДНК по участку узнавания рестрикцирующими нуклеазами (рестриктазами). o Быстрое секвенирование нуклеотидов в ДНК, позволяющее определить аминокислотную последовательность полипептида. o Конструирование рекомбинантной ДНК o Гибридизация нуклеиновых кислот, выявление специфических последовательностей ДНК. o Клонирование ДНК (введение ДНК-фрагмента в самореплицирующийся генетический аппарат (плазмиду или вирус), который используют для трансформации бактерий. Бактериальная клетка после трансформации способна воспроизводить этот фрагмент во многих миллионах идентичных копий. o Введение модифицированных версий генов (рекомбинантной ДНК) в клетки или организмы.
Методы биотехнологии рекомбинантных ДНК o Специфическое расщепление ДНК по участку узнавания рестрикцирующими нуклеазами (рестриктазами). o Быстрое секвенирование нуклеотидов в ДНК, позволяющее определить аминокислотную последовательность полипептида. o Конструирование рекомбинантной ДНК o Гибридизация нуклеиновых кислот, выявление специфических последовательностей ДНК. o Клонирование ДНК (введение ДНК-фрагмента в самореплицирующийся генетический аппарат (плазмиду или вирус), который используют для трансформации бактерий. Бактериальная клетка после трансформации способна воспроизводить этот фрагмент во многих миллионах идентичных копий. o Введение модифицированных версий генов (рекомбинантной ДНК) в клетки или организмы.
 Технология получения рекомбинантных ДНК
Технология получения рекомбинантных ДНК
 Технология получения рекомбинантных ДНК
Технология получения рекомбинантных ДНК
 Ферменты- инструменты конструирования рекомбинантных ДНК o Ферменты, с помощью которых выделяют фрагмента ДНК – «умные ножницы» - рестриктазы. o Ферменты, синтезирующие ДНК на матрице ДНК (полимеразы) или РНК (обратные транскриптазы, ревертазы) «копирка» . o Ферменты соединяющие фрагменты ДНК «сшивка» . o Ферменты, изменяющие строение концов фрагментов ДНК «защита»
Ферменты- инструменты конструирования рекомбинантных ДНК o Ферменты, с помощью которых выделяют фрагмента ДНК – «умные ножницы» - рестриктазы. o Ферменты, синтезирующие ДНК на матрице ДНК (полимеразы) или РНК (обратные транскриптазы, ревертазы) «копирка» . o Ферменты соединяющие фрагменты ДНК «сшивка» . o Ферменты, изменяющие строение концов фрагментов ДНК «защита»
 Специфическое расщепление ДНК o Расщепление ДНК в специфических участках нуклеотидных последовательностей осуществляется особыми ферментами – рестрикцирующими нуклеазами (рестриктазы) o Фермент рестриктаза опознает специфическую последовательность из 4– 6 нуклеотидов (сайт узнавания или рестрикции) и расщепляет чужеродную ДНК либо внутри этого сайта узнавания либо по его краю.
Специфическое расщепление ДНК o Расщепление ДНК в специфических участках нуклеотидных последовательностей осуществляется особыми ферментами – рестрикцирующими нуклеазами (рестриктазы) o Фермент рестриктаза опознает специфическую последовательность из 4– 6 нуклеотидов (сайт узнавания или рестрикции) и расщепляет чужеродную ДНК либо внутри этого сайта узнавания либо по его краю.
 Рестриктазы o В настоящее время различные фирмы выпускают более 100 разнообразных ферментов, опознающих различные последовательности нуклеотидов. Всего известно 2000 рестриктаз, которые могут узнавать более 150 сайтов. o Для каждого конкретного фермента они различаются по длине, первичной структуре и Участки узнавания ДНК способу разрыва молекулы тремя различными рестриктазами ДНК.
Рестриктазы o В настоящее время различные фирмы выпускают более 100 разнообразных ферментов, опознающих различные последовательности нуклеотидов. Всего известно 2000 рестриктаз, которые могут узнавать более 150 сайтов. o Для каждого конкретного фермента они различаются по длине, первичной структуре и Участки узнавания ДНК способу разрыва молекулы тремя различными рестриктазами ДНК.

 Рестриктазы o Рестриктазы выделяют из бактерий, реже дрожжей и одноклеточных водорослей. Естественной функцией рестриктаз является защита бактерий от чужеродной ДНК (ДНК бактериофагов) ограничивая возможность ее размножения, разрезая ее на части. o Рестриктазы не могут разрезать свою собственную ДНК, т. к. она защищена метилированием. o Метилирование ДНК заключается в присоединении метильной группы к цитозину в составе Cp. G-динуклеотида в позиции С 5 цитозинового кольца. Цитозин
Рестриктазы o Рестриктазы выделяют из бактерий, реже дрожжей и одноклеточных водорослей. Естественной функцией рестриктаз является защита бактерий от чужеродной ДНК (ДНК бактериофагов) ограничивая возможность ее размножения, разрезая ее на части. o Рестриктазы не могут разрезать свою собственную ДНК, т. к. она защищена метилированием. o Метилирование ДНК заключается в присоединении метильной группы к цитозину в составе Cp. G-динуклеотида в позиции С 5 цитозинового кольца. Цитозин
 Рестриктазы o Подавляющее большинство ферментов разрывает только двунитевую ДНК с образованием серии фрагментов (рестрикты) с тупыми либо липкими концами. o Липкие концы позволяют легко соединить два любых фрагментов ДНК в одно целое o Полученный фрагмент ДНК можно встроить в очищенную ДНК плазмиды или бактериального вируса.
Рестриктазы o Подавляющее большинство ферментов разрывает только двунитевую ДНК с образованием серии фрагментов (рестрикты) с тупыми либо липкими концами. o Липкие концы позволяют легко соединить два любых фрагментов ДНК в одно целое o Полученный фрагмент ДНК можно встроить в очищенную ДНК плазмиды или бактериального вируса.
 Ферменты синтезирующие ДНК на матрице o ДНК-полимеразы, (обратные транскриптазы, ревертазы) o В естественных условиях ДНКполимераза восстанавливает структуру поврежденной ДНК (репарация)
Ферменты синтезирующие ДНК на матрице o ДНК-полимеразы, (обратные транскриптазы, ревертазы) o В естественных условиях ДНКполимераза восстанавливает структуру поврежденной ДНК (репарация)
 Лигазы o Лигазы – ферменты, которые «сшивают, склеивают» фрагменты ДНК за счет фосфодиэфирных связей. o На практике обычно используют универсальную лигазу фага Т 4. o ДНК-лигазы в естественных условиях осуществляют процессы репарации ДНК и репликации при удвоении цепи ДНК.
Лигазы o Лигазы – ферменты, которые «сшивают, склеивают» фрагменты ДНК за счет фосфодиэфирных связей. o На практике обычно используют универсальную лигазу фага Т 4. o ДНК-лигазы в естественных условиях осуществляют процессы репарации ДНК и репликации при удвоении цепи ДНК.
 Ферменты, изменяющие строение концов фрагментов ДНК o Щелочная фосфатаза отщепляет от линейного фрагмента ДНК 5 -фосфатные группы, снижая количество случайных, нежелательных комбинаций фрагментов ДНК o Нуклеаза Bal 31 – это фермент, удаляющий нуклеотиды из последовательности ДНК, позволяющий укоротить несимметричные концы ДНК и сблизить их функционально значимые элементы.
Ферменты, изменяющие строение концов фрагментов ДНК o Щелочная фосфатаза отщепляет от линейного фрагмента ДНК 5 -фосфатные группы, снижая количество случайных, нежелательных комбинаций фрагментов ДНК o Нуклеаза Bal 31 – это фермент, удаляющий нуклеотиды из последовательности ДНК, позволяющий укоротить несимметричные концы ДНК и сблизить их функционально значимые элементы.
 Определение нуклеотидной последовательности (секвенирование) ДНК o Для успешного решения задач генетической инженерии очень важно быстро определить полную нуклеотидную последовательность любых фрагментов ДНК длиной 100 -500 нуклеотидных пар (секвенирование). o В настоящее время объем информации о последовательностях ДНК столь велик, что для хранения и анализа данных о фрагментах целых геномов необходимы новые технологии и компьютерная техника.
Определение нуклеотидной последовательности (секвенирование) ДНК o Для успешного решения задач генетической инженерии очень важно быстро определить полную нуклеотидную последовательность любых фрагментов ДНК длиной 100 -500 нуклеотидных пар (секвенирование). o В настоящее время объем информации о последовательностях ДНК столь велик, что для хранения и анализа данных о фрагментах целых геномов необходимы новые технологии и компьютерная техника.
 Методы секвенирования С помощью ферментов ДНК разделяют на фрагменты и определяют в них позиции нуклеотидов химическим или ферментативным (энзиматическим) методом.
Методы секвенирования С помощью ферментов ДНК разделяют на фрагменты и определяют в них позиции нуклеотидов химическим или ферментативным (энзиматическим) методом.
 Химическое расщепление ДНК Химический метод основан на химической деградации ДНК и анализом образовавшихся продуктов методом гельэлектрофореза. Перед началом опыта на один из концов фрагмента ДНК ставят изотопную радиоактивную метку 32 Р
Химическое расщепление ДНК Химический метод основан на химической деградации ДНК и анализом образовавшихся продуктов методом гельэлектрофореза. Перед началом опыта на один из концов фрагмента ДНК ставят изотопную радиоактивную метку 32 Р
 Ферментативный метод расщепления ДНК o Энзиматический метод разработан М. Сенгером с использованием ДНК полимеразы. o Анализируемый фрагмент ДНК используют в качестве матрицы в реакции полимеразного копирования. Метод получил название «плюсминус-метод» , поскольку реакцию полимеризации проводят либо в отсутствии одного из четырех типов нуклеотидов ( «минус» -система), либо в присутствии только одного нуклеотида ( «плюс» система. o Продукты реакций анализируют методом электрофореза, и нуклеотидную последовательность считывают с радиографа, так же как при анализе химического секвенирования.
Ферментативный метод расщепления ДНК o Энзиматический метод разработан М. Сенгером с использованием ДНК полимеразы. o Анализируемый фрагмент ДНК используют в качестве матрицы в реакции полимеразного копирования. Метод получил название «плюсминус-метод» , поскольку реакцию полимеризации проводят либо в отсутствии одного из четырех типов нуклеотидов ( «минус» -система), либо в присутствии только одного нуклеотида ( «плюс» система. o Продукты реакций анализируют методом электрофореза, и нуклеотидную последовательность считывают с радиографа, так же как при анализе химического секвенирования.
 Конструирование фрагментов рекомбинантных ДНК ( «сшивка» генов) Фрагменты рекомбинантных ДНК, полученные после действия рестриктаз и содержащие определенные гены, «сшивают» либо по «липким» концам либо с помощью искусственно достроенных «липких» концов. В этом случае возможны два варианта: o «Сшивка» по «тупым» концам o «Сшивка» фрагментов с разноименными концами.
Конструирование фрагментов рекомбинантных ДНК ( «сшивка» генов) Фрагменты рекомбинантных ДНК, полученные после действия рестриктаз и содержащие определенные гены, «сшивают» либо по «липким» концам либо с помощью искусственно достроенных «липких» концов. В этом случае возможны два варианта: o «Сшивка» по «тупым» концам o «Сшивка» фрагментов с разноименными концами.
 Тупые и липкие концы
Тупые и липкие концы
 Сшивка по «липким» концам o Сшивка ДНК по «липким» концам, т. е. взаимнокомплементарным участкам, длиной из 4– 6 пар нуклеотидов, достаточно легко осуществляется ферментом ДНК-лигазой с образованием ковалентной фосфодиэфирной связи между соседними нуклеотидами
Сшивка по «липким» концам o Сшивка ДНК по «липким» концам, т. е. взаимнокомплементарным участкам, длиной из 4– 6 пар нуклеотидов, достаточно легко осуществляется ферментом ДНК-лигазой с образованием ковалентной фосфодиэфирной связи между соседними нуклеотидами
 «Сшивка» по «тупым» и разноименным концам o При отсутствии комплементарных «липких» концов у сшиваемых фрагментов их достраивают, т. е. синтезируют искусственно ферментативным путем (коннекторный метод получения гибридных молекул ДНК), используя концевую (терминальную) дезоксинуклеотидилтрансферазу из тимуса теленка или поли(А) – полимеразу E. coli. o Также, для стыковки фрагментов применяют так называемые линкеры (или «переходники» ) – короткие участки ДНК, имеющие разные «липкие» концы
«Сшивка» по «тупым» и разноименным концам o При отсутствии комплементарных «липких» концов у сшиваемых фрагментов их достраивают, т. е. синтезируют искусственно ферментативным путем (коннекторный метод получения гибридных молекул ДНК), используя концевую (терминальную) дезоксинуклеотидилтрансферазу из тимуса теленка или поли(А) – полимеразу E. coli. o Также, для стыковки фрагментов применяют так называемые линкеры (или «переходники» ) – короткие участки ДНК, имеющие разные «липкие» концы
 Перерыв
Перерыв
 Методы клонирования ДНК o После того как рекомбинантная ДНК сшита, ее вводят в живые клетки. Рекомбинантные ДНК становятся составной частью генетического аппарата организма-реципиента. o Рекомбинантные ДНК привносят в него новые генетические и физиолого-биохимические свойства, нужные человеку.
Методы клонирования ДНК o После того как рекомбинантная ДНК сшита, ее вводят в живые клетки. Рекомбинантные ДНК становятся составной частью генетического аппарата организма-реципиента. o Рекомбинантные ДНК привносят в него новые генетические и физиолого-биохимические свойства, нужные человеку.
 Методы клонирования ДНК o Рекомбинантная ДНК не способна к самовоспроизведению и её разрушают внутриклеточные нуклеазы. o Для того чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться (интегрироваться) в её геном и реплицироваться за его счет, либо быть способной к автономной репликации (воспроизведению). o Молекулы ДНК, способные акцептировать чужеродную ДНК и при этом автономно реплицироваться, называются векторными молекулами или векторами.
Методы клонирования ДНК o Рекомбинантная ДНК не способна к самовоспроизведению и её разрушают внутриклеточные нуклеазы. o Для того чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться (интегрироваться) в её геном и реплицироваться за его счет, либо быть способной к автономной репликации (воспроизведению). o Молекулы ДНК, способные акцептировать чужеродную ДНК и при этом автономно реплицироваться, называются векторными молекулами или векторами.
 Векторные молекулы (векторы) o К числу векторов относят плазмиды, бактериофаги, вирусы животных. o Свойства векторов: 1. Имеют субстратные участки для рестрикции. 2. Способность к автономной репликации в клетке реципиента. 3. Содержать один или несколько маркерных генов, позволяющих отличить трансформированные клетки от исходных ( «векторная метка» ). o Чаще других в генетической инженерии в качестве векторов используют плазмиды - двуцепочечные кольцевые молекулы ДНК.
Векторные молекулы (векторы) o К числу векторов относят плазмиды, бактериофаги, вирусы животных. o Свойства векторов: 1. Имеют субстратные участки для рестрикции. 2. Способность к автономной репликации в клетке реципиента. 3. Содержать один или несколько маркерных генов, позволяющих отличить трансформированные клетки от исходных ( «векторная метка» ). o Чаще других в генетической инженерии в качестве векторов используют плазмиды - двуцепочечные кольцевые молекулы ДНК.
 Методы клонирования ДНК o Методы клонирования ДНК основаны на двух подходах: 1. Использование бактериальных или дрожжевых клеток для размножения введенной в них чужеродной ДНК (клонирование ДНК in vivo). 2. Амплификация ДНК in vitro
Методы клонирования ДНК o Методы клонирования ДНК основаны на двух подходах: 1. Использование бактериальных или дрожжевых клеток для размножения введенной в них чужеродной ДНК (клонирование ДНК in vivo). 2. Амплификация ДНК in vitro
 Клонирование ДНК in vivo o Фрагменты ДНК, полученные с помощью рестриктаз, вводят в плазмиду или бактериофаг, получают вектор, а затем размножают эти генетические элементы в клетках бактерий или дрожжей, увеличивая их число в миллионы раз. o Чтобы клонировать ДНК in vivo, создают банк генов (библиотеку или коллекцию клонов ДНК), включающих все фрагменты генома данного вида
Клонирование ДНК in vivo o Фрагменты ДНК, полученные с помощью рестриктаз, вводят в плазмиду или бактериофаг, получают вектор, а затем размножают эти генетические элементы в клетках бактерий или дрожжей, увеличивая их число в миллионы раз. o Чтобы клонировать ДНК in vivo, создают банк генов (библиотеку или коллекцию клонов ДНК), включающих все фрагменты генома данного вида
 Амплификация ДНК in vitro o Амплификация – это увеличение числа копий молекул ДНК. o Амплификация осуществляется вне клетки (in vitro) с помощью химических методов: полимеразной цепной реакции (ПЦР). o Амплификация фрагментов ДНК осуществляется благодаря работе фермента – термостабильной ДНКполимеразы – Tag-полимеразы
Амплификация ДНК in vitro o Амплификация – это увеличение числа копий молекул ДНК. o Амплификация осуществляется вне клетки (in vitro) с помощью химических методов: полимеразной цепной реакции (ПЦР). o Амплификация фрагментов ДНК осуществляется благодаря работе фермента – термостабильной ДНКполимеразы – Tag-полимеразы
 Амплификация ДНК in vitro o Размноженный in vitro фрагмент получают в количествах, достаточных для его прямого секвенирования (определения полной нуклеотидной последовательности). Промежуточного этапа клонирования фрагментов не требуется. o Автоматизированная процедура Tagполимеразной цепной реакции (ПЦР), состоит из 30 и более циклов и занимает всего 3 -4 часа.
Амплификация ДНК in vitro o Размноженный in vitro фрагмент получают в количествах, достаточных для его прямого секвенирования (определения полной нуклеотидной последовательности). Промежуточного этапа клонирования фрагментов не требуется. o Автоматизированная процедура Tagполимеразной цепной реакции (ПЦР), состоит из 30 и более циклов и занимает всего 3 -4 часа.
 Введение нового (рекомбинантного) гена в клетку. o Введение нового гена в клетку можно проводить двумя способами: 1. Используя вектор – молекулу ДНК или РНК способную переносить включенные в нее чужеродные гены в клетку для репликации. 2. Путем прямого введения генетического материала различными методами.
Введение нового (рекомбинантного) гена в клетку. o Введение нового гена в клетку можно проводить двумя способами: 1. Используя вектор – молекулу ДНК или РНК способную переносить включенные в нее чужеродные гены в клетку для репликации. 2. Путем прямого введения генетического материала различными методами.
 Методы прямого переноса генов в клетку. 1. Трансформация – метод введения рекомбинантной ДНК в клетку благодаря увеличению проницаемости ее клеточной оболочки (обработка ледяным растворам хлорида кальция). 2. Трансдукция – процесс переноса ДНК из одной клетки в другую бактериофагом (генетика бактерий). 3. Трансфекция – введение ДНК, адсорбированной на кристаллах фосфата кальция.
Методы прямого переноса генов в клетку. 1. Трансформация – метод введения рекомбинантной ДНК в клетку благодаря увеличению проницаемости ее клеточной оболочки (обработка ледяным растворам хлорида кальция). 2. Трансдукция – процесс переноса ДНК из одной клетки в другую бактериофагом (генетика бактерий). 3. Трансфекция – введение ДНК, адсорбированной на кристаллах фосфата кальция.
 Методы прямого переноса генов в клетку. 4. Электропорация – воздействие электрических импульсов на клеточную мембрану для временного образования большого количества пор. 5. Микроинъекции ДНК с помощью микроигл и микроманипулятора. 6. Упаковка в липосомы (фосфолипиды). Липосомы, содержащие внутри себя рекомбинантную ДНК, сливаются с мембраной и поглощаются клеткой. В клетке происходит разрушение оболочки липосом и высвобождение ДНК. 7. Биологическая баллистика. Метод базируется на напылении рекомбинантной ДНК на частицы золота или вольфрама и бомбардировки ими клеток. При достаточной скорости эти частицы может непосредственно проникать в ядро.
Методы прямого переноса генов в клетку. 4. Электропорация – воздействие электрических импульсов на клеточную мембрану для временного образования большого количества пор. 5. Микроинъекции ДНК с помощью микроигл и микроманипулятора. 6. Упаковка в липосомы (фосфолипиды). Липосомы, содержащие внутри себя рекомбинантную ДНК, сливаются с мембраной и поглощаются клеткой. В клетке происходит разрушение оболочки липосом и высвобождение ДНК. 7. Биологическая баллистика. Метод базируется на напылении рекомбинантной ДНК на частицы золота или вольфрама и бомбардировки ими клеток. При достаточной скорости эти частицы может непосредственно проникать в ядро.
 Основные этапы создания трансгенных организмов. 1. Получение (выделение) нужного гена, намеченного для переноса. Ген может быть: o выделен из естественных источников или из геномной библиотеки; o синтезирован искусственно – химическим или ферментативным путем; o получен с помощью полимеразной цепной реакции (ПЦР).
Основные этапы создания трансгенных организмов. 1. Получение (выделение) нужного гена, намеченного для переноса. Ген может быть: o выделен из естественных источников или из геномной библиотеки; o синтезирован искусственно – химическим или ферментативным путем; o получен с помощью полимеразной цепной реакции (ПЦР).
 Основные этапы создания трансгенных организмов. 2. Создание векторов - специальных генетических конструкций – (переносчиков), в состав которых входят гены, которые будут внедряться в геном другого вида. 3. Генетическая трансформация. Перенос и включение рекомбинантной ДНК, содержащей трансген в клетки реципиента
Основные этапы создания трансгенных организмов. 2. Создание векторов - специальных генетических конструкций – (переносчиков), в состав которых входят гены, которые будут внедряться в геном другого вида. 3. Генетическая трансформация. Перенос и включение рекомбинантной ДНК, содержащей трансген в клетки реципиента
 Основные этапы создания трансгенных организмов. 4. Молекулярная селекция. – отбор трансформантов (клонов) несущих рекомбинантную ДНК. В процессе генетической трансформации могут образоваться три типа клеток: o не содержащие плазмиду o содержащие плазмиду без встройки (без рекомбинантной ДНК) o содержащие плазмиду с рекомбинантной ДНК Для отбора клеток трансформантов используют различные маркерные гены, которые находятся в векторной молекуле наряду с трансгеном.
Основные этапы создания трансгенных организмов. 4. Молекулярная селекция. – отбор трансформантов (клонов) несущих рекомбинантную ДНК. В процессе генетической трансформации могут образоваться три типа клеток: o не содержащие плазмиду o содержащие плазмиду без встройки (без рекомбинантной ДНК) o содержащие плазмиду с рекомбинантной ДНК Для отбора клеток трансформантов используют различные маркерные гены, которые находятся в векторной молекуле наряду с трансгеном.
 Основные этапы создания трансгенных организмов. 5. Выращивание измененных клеток в целые трансгенные организмы. Синтез определенного белка – продукта введенного гена. После введения в реципиентную клетку фрагмента чужеродной ДНК происходит ее клонирование, получения большого числа копий или начинается синтез продукта закодированного во введенном гене. Чаще всего эти процессы осуществляются в бактериальных клетках.
Основные этапы создания трансгенных организмов. 5. Выращивание измененных клеток в целые трансгенные организмы. Синтез определенного белка – продукта введенного гена. После введения в реципиентную клетку фрагмента чужеродной ДНК происходит ее клонирование, получения большого числа копий или начинается синтез продукта закодированного во введенном гене. Чаще всего эти процессы осуществляются в бактериальных клетках.
 Применение генной инженерии По областям применения можно выделить генетическую инженерию микроорганизмов, растений и животных.
Применение генной инженерии По областям применения можно выделить генетическую инженерию микроорганизмов, растений и животных.
 Генетическая инженерия микроорганизмов o Началом промышленной генетической инженерии микроорганизмов принято считать 1980 год, когда в США был выдан первый патент на модифицированный штамм микроорганизма, способного разлагать нефть. o Еще через два года был разрешен для клинического использования полученный из бактерии первый лекарственный препарат – человеческий инсулин.
Генетическая инженерия микроорганизмов o Началом промышленной генетической инженерии микроорганизмов принято считать 1980 год, когда в США был выдан первый патент на модифицированный штамм микроорганизма, способного разлагать нефть. o Еще через два года был разрешен для клинического использования полученный из бактерии первый лекарственный препарат – человеческий инсулин.
 Основные направления развития промышленной микробиологии 1. Производство продуктов биосинтеза трансгенных микроорганизмов, (антибиотики, гормоны, ферменты и витамины). 2. Использование биомассы микроорганизмов для производства медицинских вакцин, различных дрожжей, белково-витаминных концентратов и заквасок для получения кисломолочных продуктов и силосования кормов; 3. Биотехнологии, основанные на уникальных способностях некоторых бактерий производить органические кислоты, этанол, углеводы и метан. Сюда же можно отнести и переработку некоторых отходов с возможностью получения полезных соединений, в первую очередь, горючих газов.
Основные направления развития промышленной микробиологии 1. Производство продуктов биосинтеза трансгенных микроорганизмов, (антибиотики, гормоны, ферменты и витамины). 2. Использование биомассы микроорганизмов для производства медицинских вакцин, различных дрожжей, белково-витаминных концентратов и заквасок для получения кисломолочных продуктов и силосования кормов; 3. Биотехнологии, основанные на уникальных способностях некоторых бактерий производить органические кислоты, этанол, углеводы и метан. Сюда же можно отнести и переработку некоторых отходов с возможностью получения полезных соединений, в первую очередь, горючих газов.
 Использование трансгенных микроорганизмов в медицине o o o К самому большому классу лекарств, получаемых путем микробного синтеза, относятся антибиотики. Вторым классом лекарственных препаратов, производимых биотехнологическим путем, являются стероидные и пептидные гормоны. Важное место среди лекарственных средств получаемых биотехнологическим путем занимают ферменты. На основе трансгенных микроорганизмов производят вакцины против различных инфекций. Необходимый антиген можно получить с помощью непатогенного микроорганизма, полученного генно-инженерными методами, и таким образом избежать опасностей, связанных с применением обычных вакцин. К числу важных практических достижений генной инженерии необходимо отнести и получение диагностических препаратов.
Использование трансгенных микроорганизмов в медицине o o o К самому большому классу лекарств, получаемых путем микробного синтеза, относятся антибиотики. Вторым классом лекарственных препаратов, производимых биотехнологическим путем, являются стероидные и пептидные гормоны. Важное место среди лекарственных средств получаемых биотехнологическим путем занимают ферменты. На основе трансгенных микроорганизмов производят вакцины против различных инфекций. Необходимый антиген можно получить с помощью непатогенного микроорганизма, полученного генно-инженерными методами, и таким образом избежать опасностей, связанных с применением обычных вакцин. К числу важных практических достижений генной инженерии необходимо отнести и получение диагностических препаратов.
 Генетическая инженерия растений o Важным преимуществом растений, по сравнению с животными, является способность их клеток развиваться в целое растение, создавая трансгенное растение.
Генетическая инженерия растений o Важным преимуществом растений, по сравнению с животными, является способность их клеток развиваться в целое растение, создавая трансгенное растение.
 Достижения генетической инженерии растений. o Изменение пищевой ценности растений. o Запасные белки. Улучшение аминокислотного состава белков (в запасном белке злаковых – мало лизина, треонина и триптофана, а в бобовых – дефицит метионина и цистеина). Растения могут производить и белки животного происхождения. 1. Трансгенные растения табака синтезируют иммуноглобулины – барьер на пути кишечных инфекций и кариеса (антикариесная зубная паста). 2. Синтез человеческого β-интерферона 3. Получен картофель, экспрессирующий нетоксичные субъединицы токсина холеры (вакцина).
Достижения генетической инженерии растений. o Изменение пищевой ценности растений. o Запасные белки. Улучшение аминокислотного состава белков (в запасном белке злаковых – мало лизина, треонина и триптофана, а в бобовых – дефицит метионина и цистеина). Растения могут производить и белки животного происхождения. 1. Трансгенные растения табака синтезируют иммуноглобулины – барьер на пути кишечных инфекций и кариеса (антикариесная зубная паста). 2. Синтез человеческого β-интерферона 3. Получен картофель, экспрессирующий нетоксичные субъединицы токсина холеры (вакцина).
 Достижения генетической инженерии растений. Изменение пищевой ценности растений. o Жиры. Были получены трансгенные растения рапса с измененным составом растительного масла. Повышенное содержание (до 45%) лауриновой кислоты, используемой для производства стиральных порошков, шампуней и косметики. o Полисахариды. Трансгенный картофель для синтеза модифицированного крахмала амилопектина (разветвленная форма крахмала) для производства питательных смесей.
Достижения генетической инженерии растений. Изменение пищевой ценности растений. o Жиры. Были получены трансгенные растения рапса с измененным составом растительного масла. Повышенное содержание (до 45%) лауриновой кислоты, используемой для производства стиральных порошков, шампуней и косметики. o Полисахариды. Трансгенный картофель для синтеза модифицированного крахмала амилопектина (разветвленная форма крахмала) для производства питательных смесей.
 Достижения генетической инженерии растений. Создание гербицидоустойчивых растений. o Повышение устойчивости к насекомым вредителям. Цель – снижение применения инсектицидов. Введение в растение генов синтезирующие токсины для насекомых-вредителей и безопасные для млекопитающих. o Трансгенные растения табака, картофеля, томатов, хлопчатника, кукурузы, риса, рапса и др. не поедаемые насекомыми. Получен трансгенный картофель устойчивый к колорадскому жуку.
Достижения генетической инженерии растений. Создание гербицидоустойчивых растений. o Повышение устойчивости к насекомым вредителям. Цель – снижение применения инсектицидов. Введение в растение генов синтезирующие токсины для насекомых-вредителей и безопасные для млекопитающих. o Трансгенные растения табака, картофеля, томатов, хлопчатника, кукурузы, риса, рапса и др. не поедаемые насекомыми. Получен трансгенный картофель устойчивый к колорадскому жуку.
 Достижения генетической инженерии растений. o Повышение устойчивости растений к стрессам (устойчивость к засухе, засолению, затоплению, низким температурам). o Повышение эффективности биологической азотфиксации o Повышение эффективности биосинтеза o Изменение окраски цветков у декоративных растений o Регуляция сроков созревания и хранения плодов. o Повышение урожайности.
Достижения генетической инженерии растений. o Повышение устойчивости растений к стрессам (устойчивость к засухе, засолению, затоплению, низким температурам). o Повышение эффективности биологической азотфиксации o Повышение эффективности биосинтеза o Изменение окраски цветков у декоративных растений o Регуляция сроков созревания и хранения плодов. o Повышение урожайности.
 Генетическая инженерия животных Как правило, носителем чужеродной ДНК в животную клетку являются векторы на основе ДНК вирусов. Они легко проникают в клетку хозяина, встраиваются в ее ДНК путем обычной инфекции и обеспечивают эффективный перенос генов. o Все генно-инженерные методы работы с клетками животных можно разделить на две группы: 1. Эксперименты с соматическими клетками 2. Эксперименты по трансформации половых клеток (в этом случае конечный результат – получение трансгенных животных)
Генетическая инженерия животных Как правило, носителем чужеродной ДНК в животную клетку являются векторы на основе ДНК вирусов. Они легко проникают в клетку хозяина, встраиваются в ее ДНК путем обычной инфекции и обеспечивают эффективный перенос генов. o Все генно-инженерные методы работы с клетками животных можно разделить на две группы: 1. Эксперименты с соматическими клетками 2. Эксперименты по трансформации половых клеток (в этом случае конечный результат – получение трансгенных животных)
 Генетическая трансформация соматических клеток животных. o Культуры клеток млекопитающих используют для получения различных веществ: 1. Модификация белков (присоединение к молекуле белка углеводов или липидов) 2. Синтез вирусных антигенов (ДНКвакцин).
Генетическая трансформация соматических клеток животных. o Культуры клеток млекопитающих используют для получения различных веществ: 1. Модификация белков (присоединение к молекуле белка углеводов или липидов) 2. Синтез вирусных антигенов (ДНКвакцин).
 Генетическая трансформация половых клеток животных. o Для изменения свойств всего организма надо изменить геном половых клеток или зиготы, которые передадут новые свойства потомкам. o Разработаны способы введения генов в эмбриональные клетки разных животных и насекомых.
Генетическая трансформация половых клеток животных. o Для изменения свойств всего организма надо изменить геном половых клеток или зиготы, которые передадут новые свойства потомкам. o Разработаны способы введения генов в эмбриональные клетки разных животных и насекомых.
 Схемы создания трансгенных животных. o Микроинъекция чужеродной ДНК Микроинъекцию клонированных генов проводят в только что оплодотворенную яйцеклетку. После инъекции яйцеклетку немедленно имплантируют приемной (суррогатной) матери или дают ей возможность развиваться в культуре до стадии бластоцисты и, затем, имплантируют в матку. o Можно вводить ген в сперматозоиды и затем проводить ими оплодотворение. Таким образом, были введены гены интерферона и инсулина человека.
Схемы создания трансгенных животных. o Микроинъекция чужеродной ДНК Микроинъекцию клонированных генов проводят в только что оплодотворенную яйцеклетку. После инъекции яйцеклетку немедленно имплантируют приемной (суррогатной) матери или дают ей возможность развиваться в культуре до стадии бластоцисты и, затем, имплантируют в матку. o Можно вводить ген в сперматозоиды и затем проводить ими оплодотворение. Таким образом, были введены гены интерферона и инсулина человека.
 Схемы создания трансгенных животных. o Введение генетической конструкции в эмбриональные стволовые клетки (ЭСК). o Впервые культивируемые линии стволовых клеток были получены Эвансом и соавт. В 1981 г. позже аналогичные линии были получены из бластоцид других млекопитающих: золотистый хомячок (1988), свинья, овца (1990), корова, норка (1992), кролик (1993), крыса, обезьяна и человек (19941995 гг. )
Схемы создания трансгенных животных. o Введение генетической конструкции в эмбриональные стволовые клетки (ЭСК). o Впервые культивируемые линии стволовых клеток были получены Эвансом и соавт. В 1981 г. позже аналогичные линии были получены из бластоцид других млекопитающих: золотистый хомячок (1988), свинья, овца (1990), корова, норка (1992), кролик (1993), крыса, обезьяна и человек (19941995 гг. )
 Эмбриональные стволовые клетки o Когда число клеток эмбриона не превышает восьми, они являются недифференцированными и способны давать начало (дифференцироваться) любым типам клеток, включая клетки зародышевой линии, и каждая из них может дать начало новому организму. Эти клетки можно культивировать in vitro и после введения в них необходимого трансгена ввести в другой эмбрион на стадии бластоцисты, а затем имплантировать в матку суррогатной матери, производящей потомство. o Скрещивая животных-основателей, несущих трансген в клетках зародышевой линии, можно получить линии трансгенных животных.
Эмбриональные стволовые клетки o Когда число клеток эмбриона не превышает восьми, они являются недифференцированными и способны давать начало (дифференцироваться) любым типам клеток, включая клетки зародышевой линии, и каждая из них может дать начало новому организму. Эти клетки можно культивировать in vitro и после введения в них необходимого трансгена ввести в другой эмбрион на стадии бластоцисты, а затем имплантировать в матку суррогатной матери, производящей потомство. o Скрещивая животных-основателей, несущих трансген в клетках зародышевой линии, можно получить линии трансгенных животных.
 Создание трансгенных животных o Создание трансгенных животных – очень сложный и трудоемкий процесс. По статистике одно трансгенное животное удается получить на 40 инъекцированных мышах, 100 овцах и 1500 коров. o К тому же это и неоднозначный процесс, т. к. интеграция чужеродных генов носит случайный характер и могут быть повреждены соседние гены реципиента. из трансгенных животных не более 50% экспрессируют трансгенный белок и не у всех животных чужеродный ген попадает в половые клетки и передается потомству.
Создание трансгенных животных o Создание трансгенных животных – очень сложный и трудоемкий процесс. По статистике одно трансгенное животное удается получить на 40 инъекцированных мышах, 100 овцах и 1500 коров. o К тому же это и неоднозначный процесс, т. к. интеграция чужеродных генов носит случайный характер и могут быть повреждены соседние гены реципиента. из трансгенных животных не более 50% экспрессируют трансгенный белок и не у всех животных чужеродный ген попадает в половые клетки и передается потомству.
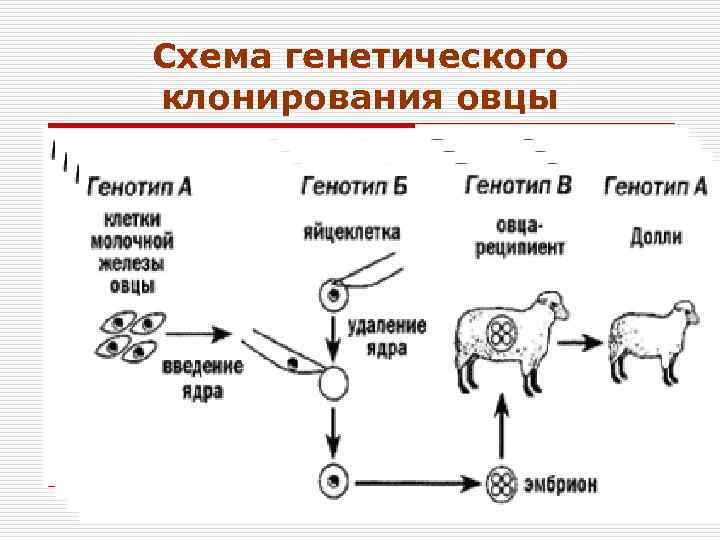 Схема генетического клонирования овцы
Схема генетического клонирования овцы
 Достижения генетической инженерии животных o Трансгенные животные как модели наследственных заболеваний человека o Использование трансгенных животных в качестве биореакторов o Трансгенные животные с выключенными генами (генный нокаут) o Трансгенные животные – источники органов для пересадки человека.
Достижения генетической инженерии животных o Трансгенные животные как модели наследственных заболеваний человека o Использование трансгенных животных в качестве биореакторов o Трансгенные животные с выключенными генами (генный нокаут) o Трансгенные животные – источники органов для пересадки человека.


