лекция4.ppt
- Количество слайдов: 44
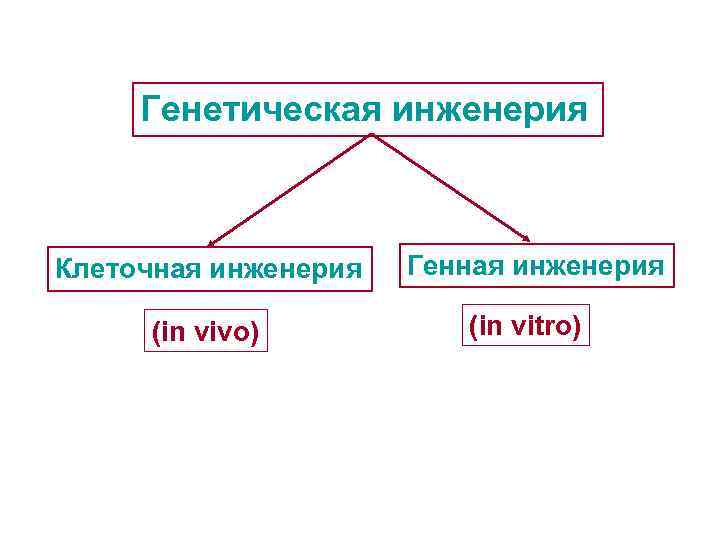 Генетическая инженерия Клеточная инженерия (in vivo) Генная инженерия (in vitro)
Генетическая инженерия Клеточная инженерия (in vivo) Генная инженерия (in vitro)
 ГЕННАЯ ИНЖЕНЕРИЯ Технология рекомбинантных ДНК (р. ДНК) Этапы генетического конструирования in vitro: 1. Получение нужного гена (выделение нужных генов из ДНК, химикоферментативный синтез, ферментативный синтез гена на основе выделенной м. РНК); 2. Встраивание полученного гена в генетический элемент, способный к репликации (вектор), например, получение рекомбинантной плазмиды; 3. Введение гена в составе вектора (например, рекомбинантной плазмиды) в организм-реципиент, например в клетки E. coli (конъюгация, трансформация, трансдукция); 4. Клонирование в E. coli фрагмента ДНК; 5. Идентификацию (скрининг) и отбор клеток, которые приобрели нужный ген или гены. 6. Полученные гибридные ДНК подвергают дальнейшим перестройкам и затем вводят в реципиентные клетки, изменяя их генотип и фенотип.
ГЕННАЯ ИНЖЕНЕРИЯ Технология рекомбинантных ДНК (р. ДНК) Этапы генетического конструирования in vitro: 1. Получение нужного гена (выделение нужных генов из ДНК, химикоферментативный синтез, ферментативный синтез гена на основе выделенной м. РНК); 2. Встраивание полученного гена в генетический элемент, способный к репликации (вектор), например, получение рекомбинантной плазмиды; 3. Введение гена в составе вектора (например, рекомбинантной плазмиды) в организм-реципиент, например в клетки E. coli (конъюгация, трансформация, трансдукция); 4. Клонирование в E. coli фрагмента ДНК; 5. Идентификацию (скрининг) и отбор клеток, которые приобрели нужный ген или гены. 6. Полученные гибридные ДНК подвергают дальнейшим перестройкам и затем вводят в реципиентные клетки, изменяя их генотип и фенотип.
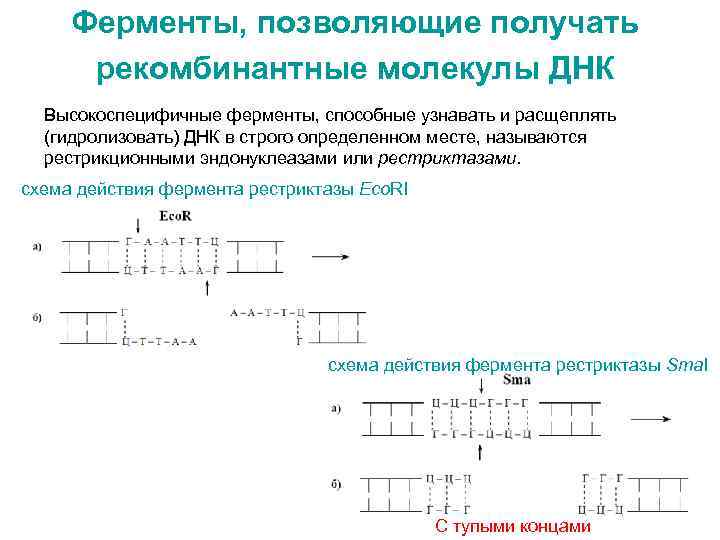 Ферменты, позволяющие получать рекомбинантные молекулы ДНК Высокоспецифичные ферменты, способные узнавать и расщеплять (гидролизовать) ДНК в строго определенном месте, называются рестрикционными эндонуклеазами или рестриктазами. схема действия фермента рестриктазы Eco. RI схема действия фермента рестриктазы Sma. I С тупыми концами
Ферменты, позволяющие получать рекомбинантные молекулы ДНК Высокоспецифичные ферменты, способные узнавать и расщеплять (гидролизовать) ДНК в строго определенном месте, называются рестрикционными эндонуклеазами или рестриктазами. схема действия фермента рестриктазы Eco. RI схема действия фермента рестриктазы Sma. I С тупыми концами
 Некоторые рестриктазы и расщепляемые ими последовательности Для устранения разрыва после рекомбинации фрагментов ДНК используют другой фермент - ДНК-лигазу, катализирующий образование фосфодиэфирных связей между концами полинуклеотидных цепей, которые удерживаются вместе водородными связями при соединении липких концов. ДНК-лигаза сшивает и тупые концы.
Некоторые рестриктазы и расщепляемые ими последовательности Для устранения разрыва после рекомбинации фрагментов ДНК используют другой фермент - ДНК-лигазу, катализирующий образование фосфодиэфирных связей между концами полинуклеотидных цепей, которые удерживаются вместе водородными связями при соединении липких концов. ДНК-лигаза сшивает и тупые концы.
 Векторы для экспрессии и клонирования Требования, предъявляемые к векторам: • Способность реплицироваться в клетке-хозяина (содержат ori репликации=Origin-точка начала репликации); • Способность включать чужеродные ДНК различной молекулярной массы без нарушения способности к репликации; • Легкость введения в клетку-хозяина; • Наличие генетического маркера селекции, обеспечивающего быструю селекцию клеток, содержащих вектор; • Наличие только 1 сайта рестрикции для каждой рестриктазы. • Легко извлекаются из клеток хозяина Плазмидные векторы Внехромосомные двуспиральные малые молекулы ДНК, длиной в 1 -200 тысяч пар нуклеотидов автономно размножающиеся в клетке, называются плазмидами. Размеры плазмид варьируют от менее 1 до более 500 т. п. н. С помощью плазмидных векторов можно клонировать фрагменты ДНК длиной до 10 т. п. н.
Векторы для экспрессии и клонирования Требования, предъявляемые к векторам: • Способность реплицироваться в клетке-хозяина (содержат ori репликации=Origin-точка начала репликации); • Способность включать чужеродные ДНК различной молекулярной массы без нарушения способности к репликации; • Легкость введения в клетку-хозяина; • Наличие генетического маркера селекции, обеспечивающего быструю селекцию клеток, содержащих вектор; • Наличие только 1 сайта рестрикции для каждой рестриктазы. • Легко извлекаются из клеток хозяина Плазмидные векторы Внехромосомные двуспиральные малые молекулы ДНК, длиной в 1 -200 тысяч пар нуклеотидов автономно размножающиеся в клетке, называются плазмидами. Размеры плазмид варьируют от менее 1 до более 500 т. п. н. С помощью плазмидных векторов можно клонировать фрагменты ДНК длиной до 10 т. п. н.
 Генетическая карта плазмиды p. BR 322 (41 т. п. н. ) Плазмида несет гены устойчивости к двум антибиотикам: ампициллину (ген bla) и тетрациклину (ген tet), а также уникальные сайты для Bam. HI, Eco. RV и Sal. I в гене Теt, один Pst. Iсайт в гене Bla, один сайт для Eco. RI, находящийся за пределами кодирующих последовательностей, и сигнал начала репликации, обеспечивающий репликацию исключительно в Е. coli.
Генетическая карта плазмиды p. BR 322 (41 т. п. н. ) Плазмида несет гены устойчивости к двум антибиотикам: ампициллину (ген bla) и тетрациклину (ген tet), а также уникальные сайты для Bam. HI, Eco. RV и Sal. I в гене Теt, один Pst. Iсайт в гене Bla, один сайт для Eco. RI, находящийся за пределами кодирующих последовательностей, и сигнал начала репликации, обеспечивающий репликацию исключительно в Е. coli.
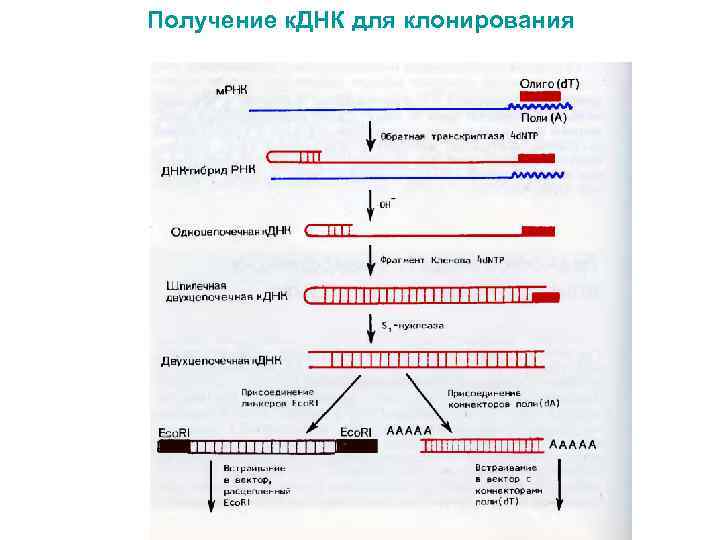 Получение к. ДНК для клонирования
Получение к. ДНК для клонирования
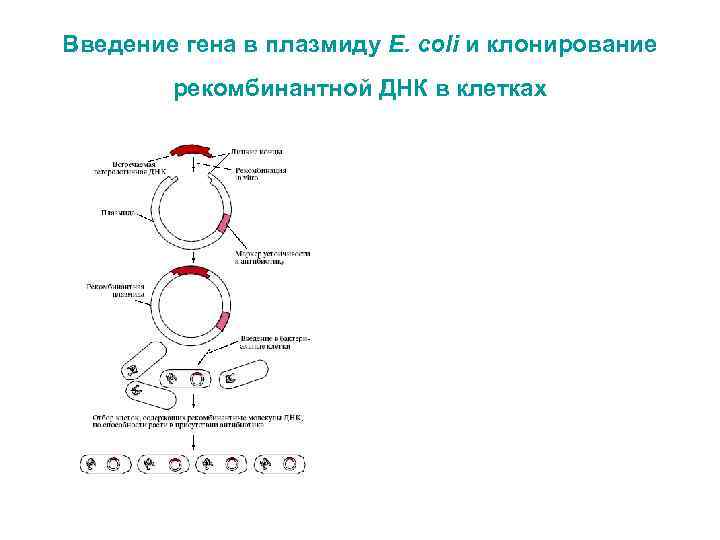 Введение гена в плазмиду E. coli и клонирование рекомбинантной ДНК в клетках
Введение гена в плазмиду E. coli и клонирование рекомбинантной ДНК в клетках
 Введение рекомбинантной ДНК в организмреципиент Особенности пермиссивных клеток: • 1. Внутриклеточные нуклеазы не разрушают включаемую ДНК или РНК. • 2. Вектор способен реплицироваться в пермиссивной клетке. • 3. Выраженная активность промотора и/или терминатора транскрипции р. ДНК. • 4. Сплайсинг РНК. • 5. Наблюдается эффективная трансляция м. РНК. • 6. Нет выраженной активности пептидогидролаз, катализирующих гидролиз экспрессируемых чужеродных белков. Для включения р. ДНК в пермиссивные клетки пользуются методами трансформации, инфекции, микроинъекций, электропорации. Ввод рекомбинантной ДНК в клетку-хозяина называется трансформацией обрабатывают клетки бактерий полиэтиленгликолем или хлористым кальцием на холоду
Введение рекомбинантной ДНК в организмреципиент Особенности пермиссивных клеток: • 1. Внутриклеточные нуклеазы не разрушают включаемую ДНК или РНК. • 2. Вектор способен реплицироваться в пермиссивной клетке. • 3. Выраженная активность промотора и/или терминатора транскрипции р. ДНК. • 4. Сплайсинг РНК. • 5. Наблюдается эффективная трансляция м. РНК. • 6. Нет выраженной активности пептидогидролаз, катализирующих гидролиз экспрессируемых чужеродных белков. Для включения р. ДНК в пермиссивные клетки пользуются методами трансформации, инфекции, микроинъекций, электропорации. Ввод рекомбинантной ДНК в клетку-хозяина называется трансформацией обрабатывают клетки бактерий полиэтиленгликолем или хлористым кальцием на холоду
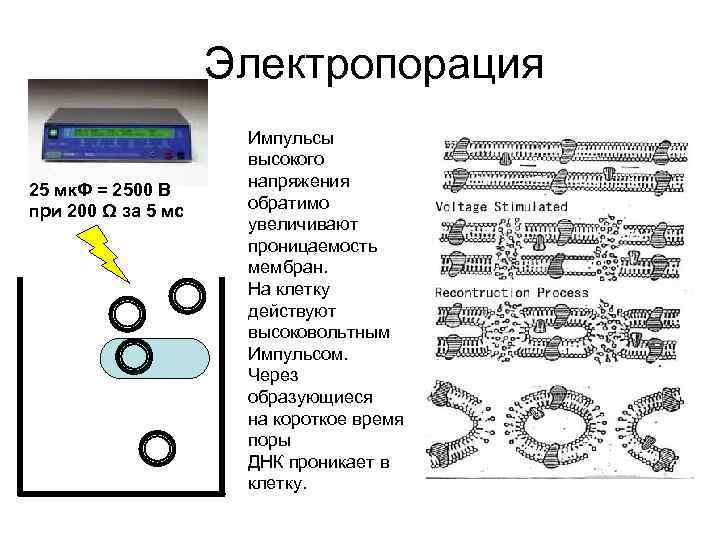 Электропорация 25 мк. Ф = 2500 В при 200 Ω за 5 мс Импульсы высокого напряжения обратимо увеличивают проницаемость мембран. На клетку действуют высоковольтным Импульсом. Через образующиеся на короткое время поры ДНК проникает в клетку.
Электропорация 25 мк. Ф = 2500 В при 200 Ω за 5 мс Импульсы высокого напряжения обратимо увеличивают проницаемость мембран. На клетку действуют высоковольтным Импульсом. Через образующиеся на короткое время поры ДНК проникает в клетку.
 Бомбардировка (баллистическая трансформация) 1) ДНК с целевыми генами, адсорбируется на поверхности микрочастиц (0, 6 -6 мкм) из инертных металлов - золота или вольфрама. 2) Частицам сообщается кинетическая энергия, достаточная для прохождения через клеточные стенки. 3) Оказавшись внутри клетки, ДНК с поверхности частиц освобождается в цитоплазму и, если оказывается в ядре, встраивается в ядерный геном.
Бомбардировка (баллистическая трансформация) 1) ДНК с целевыми генами, адсорбируется на поверхности микрочастиц (0, 6 -6 мкм) из инертных металлов - золота или вольфрама. 2) Частицам сообщается кинетическая энергия, достаточная для прохождения через клеточные стенки. 3) Оказавшись внутри клетки, ДНК с поверхности частиц освобождается в цитоплазму и, если оказывается в ядре, встраивается в ядерный геном.
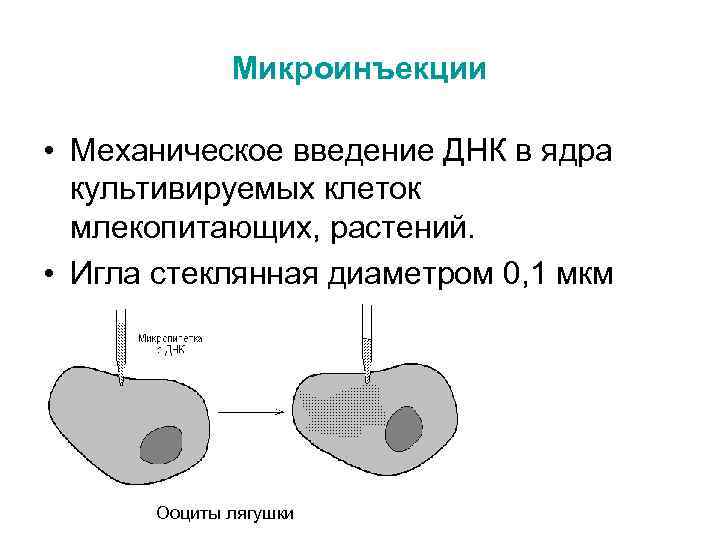 Микроинъекции • Механическое введение ДНК в ядра культивируемых клеток млекопитающих, растений. • Игла стеклянная диаметром 0, 1 мкм Ооциты лягушки
Микроинъекции • Механическое введение ДНК в ядра культивируемых клеток млекопитающих, растений. • Игла стеклянная диаметром 0, 1 мкм Ооциты лягушки
 Преимущества и недостатки Esherichia coli в качестве системы экспрессии эукариотических генов • Преимущества: • Быстрый рост (6 -12 часов от посева до окончания индукции) • Относительно высокий выход целевого белка (1002000 мг/л) • Низкая цена ростовой среды (натуральные простые компоненты) • Низкая стоимость ферментации • Возможность получать микрокристаллы целевого белка (тельца включения) Недостатки: Затруднен биосинтез крупных полипептидов (>50 к. Да) Нет системы гликозилирования Ограниченные возможности секреции белков Многие гетерологичные белки токсичны для клеток Затруднено образование дисульфидных связей (важно для восстановления третичной структуры белка) Многие гетерологичные белки образуют только тельца включения
Преимущества и недостатки Esherichia coli в качестве системы экспрессии эукариотических генов • Преимущества: • Быстрый рост (6 -12 часов от посева до окончания индукции) • Относительно высокий выход целевого белка (1002000 мг/л) • Низкая цена ростовой среды (натуральные простые компоненты) • Низкая стоимость ферментации • Возможность получать микрокристаллы целевого белка (тельца включения) Недостатки: Затруднен биосинтез крупных полипептидов (>50 к. Да) Нет системы гликозилирования Ограниченные возможности секреции белков Многие гетерологичные белки токсичны для клеток Затруднено образование дисульфидных связей (важно для восстановления третичной структуры белка) Многие гетерологичные белки образуют только тельца включения
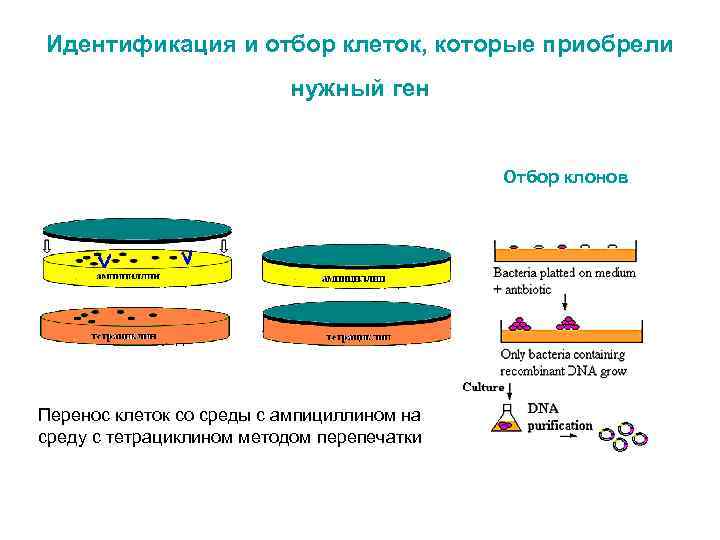 Идентификация и отбор клеток, которые приобрели нужный ген Отбор клонов Перенос клеток со среды с ампициллином на среду с тетрациклином методом перепечатки
Идентификация и отбор клеток, которые приобрели нужный ген Отбор клонов Перенос клеток со среды с ампициллином на среду с тетрациклином методом перепечатки
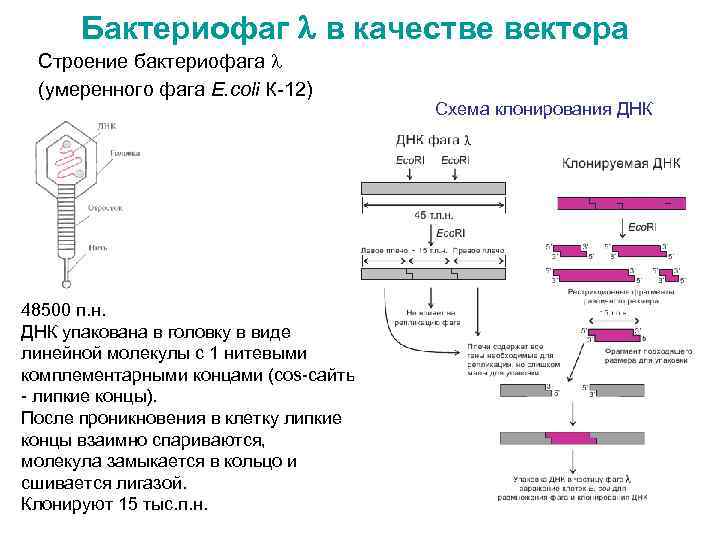 Бактериофаг в качестве вектора Строение бактериофага (умеренного фага E. coli К-12) 48500 п. н. ДНК упакована в головку в виде линейной молекулы с 1 нитевыми комплементарными концами (cos-сайты - липкие концы). После проникновения в клетку липкие концы взаимно спариваются, молекула замыкается в кольцо и сшивается лигазой. Клонируют 15 тыс. п. н. Схема клонирования ДНК
Бактериофаг в качестве вектора Строение бактериофага (умеренного фага E. coli К-12) 48500 п. н. ДНК упакована в головку в виде линейной молекулы с 1 нитевыми комплементарными концами (cos-сайты - липкие концы). После проникновения в клетку липкие концы взаимно спариваются, молекула замыкается в кольцо и сшивается лигазой. Клонируют 15 тыс. п. н. Схема клонирования ДНК
 КОСМИДЫ • Плазмиды, содержащие липкие концы ДНК (cosучастки) фага лямбда. М. б. введены в клетку путем обычной инфекции. • Клонируют фрагменты ДНК размером 33 -39 тыс. п. н. Наличие cos-сайтов в ДНК является единственным необходимым условием упаковываемости ДНК в фаговые частицы. После адсорбции химерной фаговой частицы на поверхности бактериальной клетки заключенная в ней ДНК проникает (вводится фаговой частицей) внутрь бактерии и начинает автономно реплицироваться как плазмида, размер которой составляет 30 -40 т. п. о.
КОСМИДЫ • Плазмиды, содержащие липкие концы ДНК (cosучастки) фага лямбда. М. б. введены в клетку путем обычной инфекции. • Клонируют фрагменты ДНК размером 33 -39 тыс. п. н. Наличие cos-сайтов в ДНК является единственным необходимым условием упаковываемости ДНК в фаговые частицы. После адсорбции химерной фаговой частицы на поверхности бактериальной клетки заключенная в ней ДНК проникает (вводится фаговой частицей) внутрь бактерии и начинает автономно реплицироваться как плазмида, размер которой составляет 30 -40 т. п. о.
 ФАЗМИДЫ • Фазмиды представляют собой векторные молекулы ДНК, которые содержат в себе генетические элементы плазмид и ДНК бактериофагов. Они могут обладать емкостью в отношении клонируемой ДНК, характерной для лямбдавекторов, и существовать в определенных условиях в бактериальных клетках в виде плазмиды или же упаковываться в фаговые частицы in vivo при изменении этих условий.
ФАЗМИДЫ • Фазмиды представляют собой векторные молекулы ДНК, которые содержат в себе генетические элементы плазмид и ДНК бактериофагов. Они могут обладать емкостью в отношении клонируемой ДНК, характерной для лямбдавекторов, и существовать в определенных условиях в бактериальных клетках в виде плазмиды или же упаковываться в фаговые частицы in vivo при изменении этих условий.
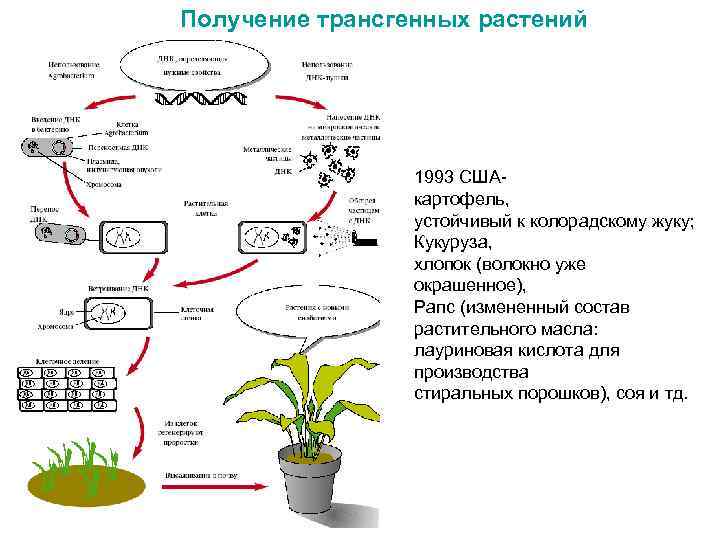 Получение трансгенных растений 1993 СШАкартофель, устойчивый к колорадскому жуку; Кукуруза, хлопок (волокно уже окрашенное), Рапс (измененный состав растительного масла: лауриновая кислота для производства стиральных порошков), соя и тд.
Получение трансгенных растений 1993 СШАкартофель, устойчивый к колорадскому жуку; Кукуруза, хлопок (волокно уже окрашенное), Рапс (измененный состав растительного масла: лауриновая кислота для производства стиральных порошков), соя и тд.
 Генная инженерия растений
Генная инженерия растений
 Клеточная инженерия Соматическая гибридизация Протопласт клеток листа петунии Генетическое конструирование in vivo (клеточная инженерия) включает получение и выделение мутантов и использование различных способов обмена наследственной информацией живых клеток Основой клеточной инженерии является слияние неполовых клеток (гибридизация соматических клеток) с образованием единого целого. Протопласт – это растительная или бактериальная клетка без клеточной стенки, окруженная цитоплазматической мембраной. Протопласт получают, обрабатывая клетку ферментами, которые гидролизуют полимеры в клеточной стенке.
Клеточная инженерия Соматическая гибридизация Протопласт клеток листа петунии Генетическое конструирование in vivo (клеточная инженерия) включает получение и выделение мутантов и использование различных способов обмена наследственной информацией живых клеток Основой клеточной инженерии является слияние неполовых клеток (гибридизация соматических клеток) с образованием единого целого. Протопласт – это растительная или бактериальная клетка без клеточной стенки, окруженная цитоплазматической мембраной. Протопласт получают, обрабатывая клетку ферментами, которые гидролизуют полимеры в клеточной стенке.
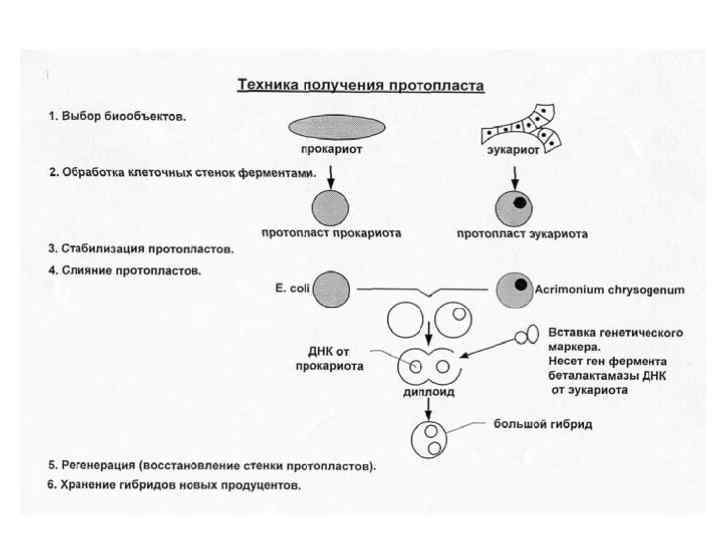
 Стабилизация протопластов Гипертонический раствор, состоящий из 10%-ных маннита, сахарозы, хлорида натрия. Ионная сила раствора такова, что клетка находится в состоянии тургора, но не лопается, при этом раствором также производится отмывание фермента. Слияние протопластов производится в среде ПАВ в полиэтиленгликоле, который нарушает клеточную цитоплазму и ДНК двух протопластов объединяются. Этот процесс происходит постепенно. "ПЭГ - высокие значения р. Н - высокая концентрация Са 2+", которая дает до 50% слившихся протопластов (р. Н 9 - 11, концентрация Са 2+ 100 - 300 ммоль/л). (Используют действие постоянного и переменного электрического тока) Для облегчения клетке процесса фузии (слияния) клетку необходимо сделать компетентной. Для этого: 1. обрабатывают клетку тяжелыми металлами 2. производят быструю заморозку и оттаивание клеток 3. обрабатывают клетки ферментами. При слиянии получается протопласт с двумя наборами хромосом – диплоидный набор (при образовании гибрида происходит рекомбинация ДНК). Регенерация (восстановление клеточной стенки протопласта). Полученный гибрид засевают на плотную питательную среду с необходимыми компонентами для прокариот и эукариот. При этом происходит восстановление клеточной оболочки.
Стабилизация протопластов Гипертонический раствор, состоящий из 10%-ных маннита, сахарозы, хлорида натрия. Ионная сила раствора такова, что клетка находится в состоянии тургора, но не лопается, при этом раствором также производится отмывание фермента. Слияние протопластов производится в среде ПАВ в полиэтиленгликоле, который нарушает клеточную цитоплазму и ДНК двух протопластов объединяются. Этот процесс происходит постепенно. "ПЭГ - высокие значения р. Н - высокая концентрация Са 2+", которая дает до 50% слившихся протопластов (р. Н 9 - 11, концентрация Са 2+ 100 - 300 ммоль/л). (Используют действие постоянного и переменного электрического тока) Для облегчения клетке процесса фузии (слияния) клетку необходимо сделать компетентной. Для этого: 1. обрабатывают клетку тяжелыми металлами 2. производят быструю заморозку и оттаивание клеток 3. обрабатывают клетки ферментами. При слиянии получается протопласт с двумя наборами хромосом – диплоидный набор (при образовании гибрида происходит рекомбинация ДНК). Регенерация (восстановление клеточной стенки протопласта). Полученный гибрид засевают на плотную питательную среду с необходимыми компонентами для прокариот и эукариот. При этом происходит восстановление клеточной оболочки.
 Для того, чтобы отличить гибридную клетку от негибридной, необходимо на стадии слияния включить еще один протопласт, несущий маркер. Маркер – это участок гена, кодирующий какой-либо фермент, позволяющий отличить гибрид при высеве на питательную среду. В данном случае маркером является β-лактамаза. В среду добавляют бензилпенициллин и вырастают только те клетки, которые содержат βлактамазу, расщепляющую его. А так как β-лактамазу содержат только клетки гибриды, то на среде и вырастают только гибриды. Техника парасексуальной гибридизации может позволить: 1. скрещивание филогенетически отдаленных видов растений (организмов), 2. получение асимметричных гибридов, несущих генный набор одного из родителей наряду с несколькими хромосомами, органеллами или цитоплазмой другого, 3. слияние трех и более клеток, 4. получение гибридов, представляющих сумму генотипов родителей, 5. перевод мутаций в гетерозиготное состояние, что позволяет получать жизнеспособные формы при слиянии протопластов, поскольку мутагенез довольно часто дает дефектное по морфогенезу растение, 6. получение растений, гетерозиготных по внеядерным генам и др.
Для того, чтобы отличить гибридную клетку от негибридной, необходимо на стадии слияния включить еще один протопласт, несущий маркер. Маркер – это участок гена, кодирующий какой-либо фермент, позволяющий отличить гибрид при высеве на питательную среду. В данном случае маркером является β-лактамаза. В среду добавляют бензилпенициллин и вырастают только те клетки, которые содержат βлактамазу, расщепляющую его. А так как β-лактамазу содержат только клетки гибриды, то на среде и вырастают только гибриды. Техника парасексуальной гибридизации может позволить: 1. скрещивание филогенетически отдаленных видов растений (организмов), 2. получение асимметричных гибридов, несущих генный набор одного из родителей наряду с несколькими хромосомами, органеллами или цитоплазмой другого, 3. слияние трех и более клеток, 4. получение гибридов, представляющих сумму генотипов родителей, 5. перевод мутаций в гетерозиготное состояние, что позволяет получать жизнеспособные формы при слиянии протопластов, поскольку мутагенез довольно часто дает дефектное по морфогенезу растение, 6. получение растений, гетерозиготных по внеядерным генам и др.
 Полимеразная цепная реакция Для проведения ПЦР в простейшем случае требуются следующие компоненты: • ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. • Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. • Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfuполимераза), Pyrococcus woesei (Pwo-полимераза) и другие. • Дезоксирибонуклеозидтрифосфаты (d. ATP, d. GTP, d. CTP, d. TTP). • Ионы Mg 2+, необходимые для работы полимеразы. • • Амплификация - увеличение числа копий ДНК. В клетке амплификация происходит в результате репликации ДНК, в искусственных условиях увеличения числа копий ДНК добиваются с помощью полимеразной цепной реакции. Праймеры - короткие синтетические олигонуклеотиды длиной 18 - 30 оснований. Каждый из праймеров комплементарен 3’-концевым последовательностям одной из цепей двухцепочечной матрицы и ограничивает начало и конец амплифицируемого участка.
Полимеразная цепная реакция Для проведения ПЦР в простейшем случае требуются следующие компоненты: • ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать. • Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. • Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfuполимераза), Pyrococcus woesei (Pwo-полимераза) и другие. • Дезоксирибонуклеозидтрифосфаты (d. ATP, d. GTP, d. CTP, d. TTP). • Ионы Mg 2+, необходимые для работы полимеразы. • • Амплификация - увеличение числа копий ДНК. В клетке амплификация происходит в результате репликации ДНК, в искусственных условиях увеличения числа копий ДНК добиваются с помощью полимеразной цепной реакции. Праймеры - короткие синтетические олигонуклеотиды длиной 18 - 30 оснований. Каждый из праймеров комплементарен 3’-концевым последовательностям одной из цепей двухцепочечной матрицы и ограничивает начало и конец амплифицируемого участка.
 Полимеразная цепная реакция Включает -денатурацию -отжиг -синтез ДНК (удлинение праймера) в присутствии ДНК-полимеразы, дезоксирибонуклеотидтрифосфатов и праймеров. Образование дополнительных копий ДНК – амплификация. Праймеры – олигонуклеотиды, комплементарные концевым последовательностям амплифицируемого фрагмента ДНК. Отжиг – реассоциация комплементарных цепей. Taq-полимераза (70 -75 о. С)
Полимеразная цепная реакция Включает -денатурацию -отжиг -синтез ДНК (удлинение праймера) в присутствии ДНК-полимеразы, дезоксирибонуклеотидтрифосфатов и праймеров. Образование дополнительных копий ДНК – амплификация. Праймеры – олигонуклеотиды, комплементарные концевым последовательностям амплифицируемого фрагмента ДНК. Отжиг – реассоциация комплементарных цепей. Taq-полимераза (70 -75 о. С)
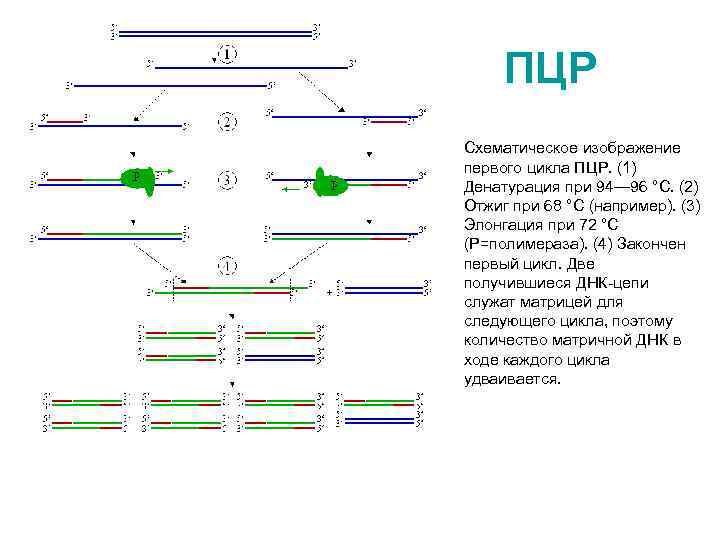 ПЦР Схематическое изображение первого цикла ПЦР. (1) Денатурация при 94— 96 °C. (2) Отжиг при 68 °C (например). (3) Элонгация при 72 °C (P=полимераза). (4) Закончен первый цикл. Две получившиеся ДНК-цепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается.
ПЦР Схематическое изображение первого цикла ПЦР. (1) Денатурация при 94— 96 °C. (2) Отжиг при 68 °C (например). (3) Элонгация при 72 °C (P=полимераза). (4) Закончен первый цикл. Две получившиеся ДНК-цепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается.
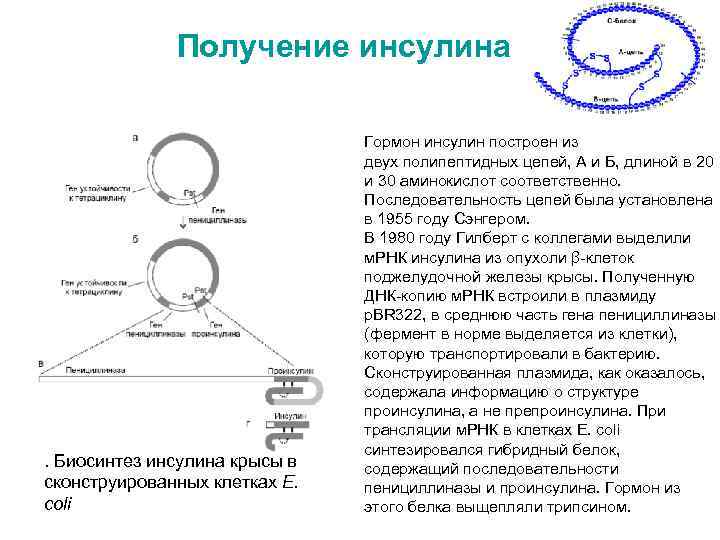 Получение инсулина . Биосинтез инсулина крысы в сконструированных клетках E. coli Гормон инсулин построен из двух полипептидных цепей, А и Б, длиной в 20 и 30 аминокислот соответственно. Последовательность цепей была установлена в 1955 году Сэнгером. В 1980 году Гилберт с коллегами выделили м. РНК инсулина из опухоли β-клеток поджелудочной железы крысы. Полученную ДНК-копию м. РНК встроили в плазмиду p. BR 322, в среднюю часть гена пенициллиназы (фермент в норме выделяется из клетки), которую транспортировали в бактерию. Сконструированная плазмида, как оказалось, содержала информацию о структуре проинсулина, а не препроинсулина. При трансляции м. РНК в клетках E. coli синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина. Гормон из этого белка выщепляли трипсином.
Получение инсулина . Биосинтез инсулина крысы в сконструированных клетках E. coli Гормон инсулин построен из двух полипептидных цепей, А и Б, длиной в 20 и 30 аминокислот соответственно. Последовательность цепей была установлена в 1955 году Сэнгером. В 1980 году Гилберт с коллегами выделили м. РНК инсулина из опухоли β-клеток поджелудочной железы крысы. Полученную ДНК-копию м. РНК встроили в плазмиду p. BR 322, в среднюю часть гена пенициллиназы (фермент в норме выделяется из клетки), которую транспортировали в бактерию. Сконструированная плазмида, как оказалось, содержала информацию о структуре проинсулина, а не препроинсулина. При трансляции м. РНК в клетках E. coli синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина. Гормон из этого белка выщепляли трипсином.
 ФЕРМЕНТЫ Строение, свойства, применение
ФЕРМЕНТЫ Строение, свойства, применение
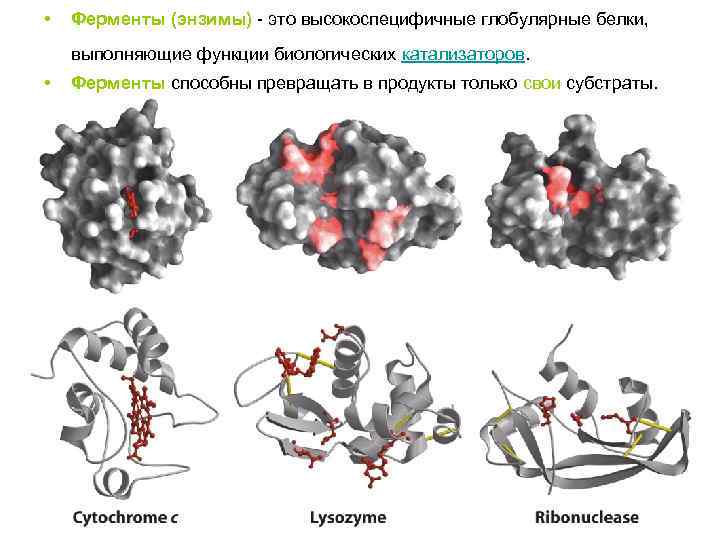 • Ферменты (энзимы) - это высокоспецифичные глобулярные белки, выполняющие функции биологических катализаторов. • Ферменты способны превращать в продукты только свои субстраты.
• Ферменты (энзимы) - это высокоспецифичные глобулярные белки, выполняющие функции биологических катализаторов. • Ферменты способны превращать в продукты только свои субстраты.
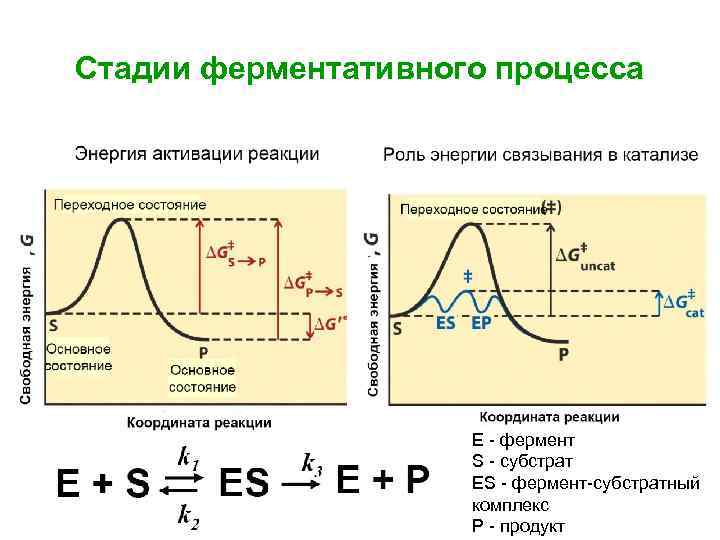 Стадии ферментативного процесса Е - фермент S - субстрат ЕS - фермент-субстратный комплекс Р - продукт
Стадии ферментативного процесса Е - фермент S - субстрат ЕS - фермент-субстратный комплекс Р - продукт
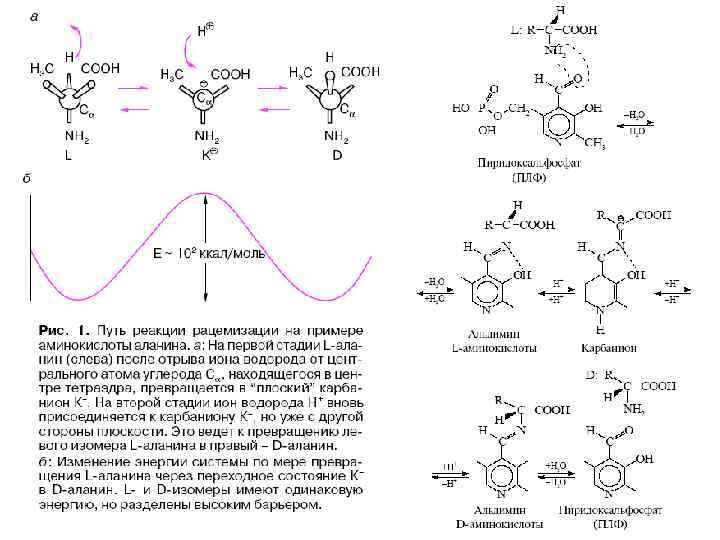
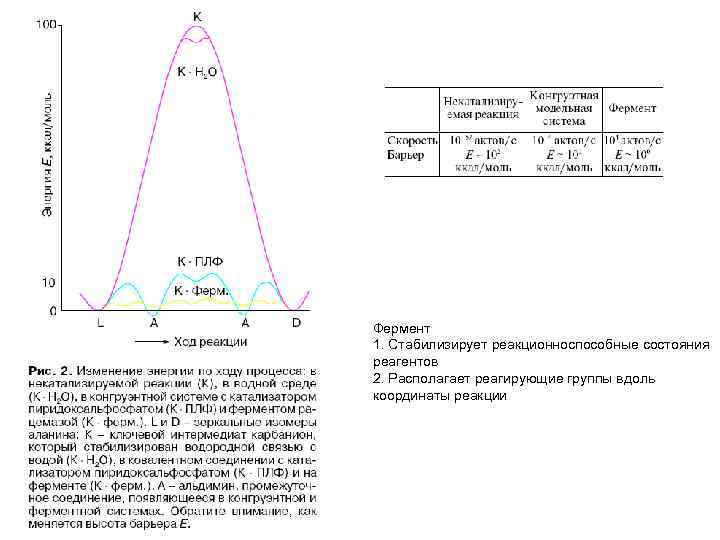 Фермент 1. Стабилизирует реакционноспособные состояния реагентов 2. Располагает реагирующие группы вдоль координаты реакции
Фермент 1. Стабилизирует реакционноспособные состояния реагентов 2. Располагает реагирующие группы вдоль координаты реакции
 (Без участия воды)
(Без участия воды)
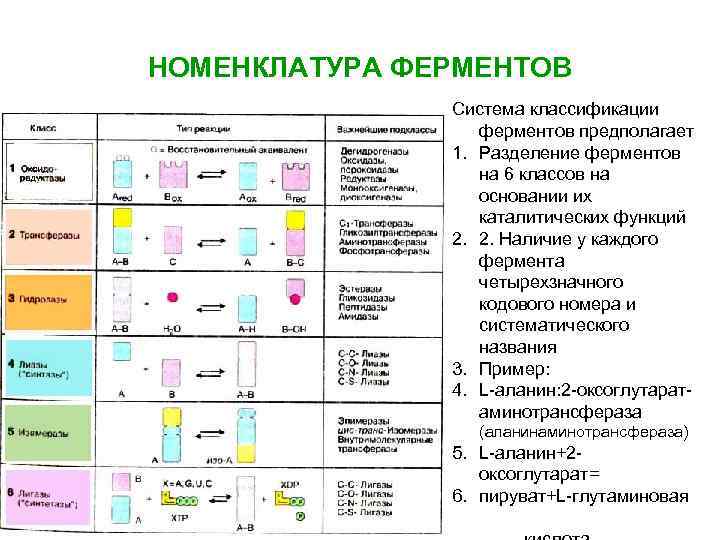 НОМЕНКЛАТУРА ФЕРМЕНТОВ Система классификации ферментов предполагает 1. Разделение ферментов на 6 классов на основании их каталитических функций 2. 2. Наличие у каждого фермента четырехзначного кодового номера и систематического названия 3. Пример: 4. L-аланин: 2 -оксоглутаратаминотрансфераза (аланинаминотрансфераза) 5. L-аланин+2 оксоглутарат= 6. пируват+L-глутаминовая
НОМЕНКЛАТУРА ФЕРМЕНТОВ Система классификации ферментов предполагает 1. Разделение ферментов на 6 классов на основании их каталитических функций 2. 2. Наличие у каждого фермента четырехзначного кодового номера и систематического названия 3. Пример: 4. L-аланин: 2 -оксоглутаратаминотрансфераза (аланинаминотрансфераза) 5. L-аланин+2 оксоглутарат= 6. пируват+L-глутаминовая
 Общие свойства ферментов (особенности ферментов как биологических катализаторов) • Высокая эффективность действия. Ферменты могут ускорять реакцию в 108 -1012 раз. • Высокая избирательность ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (специфичность действия). • Высокая чувствительность ферментов к неспецифическим физикохимическим факторам среды - температуре, р. Н, ионной силе раствора и т. д. • Высокая чувствительность к химическим реагентам. • Высокая и избирательная чувствительность к физико-химическим воздействиям тех или иных химических веществ, которые благодаря этому могут взаимодействовать с ферментом, улучшая или затрудняя его работу. • Способность регуляции ферментативной активности • Наличие кофакторов
Общие свойства ферментов (особенности ферментов как биологических катализаторов) • Высокая эффективность действия. Ферменты могут ускорять реакцию в 108 -1012 раз. • Высокая избирательность ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (специфичность действия). • Высокая чувствительность ферментов к неспецифическим физикохимическим факторам среды - температуре, р. Н, ионной силе раствора и т. д. • Высокая чувствительность к химическим реагентам. • Высокая и избирательная чувствительность к физико-химическим воздействиям тех или иных химических веществ, которые благодаря этому могут взаимодействовать с ферментом, улучшая или затрудняя его работу. • Способность регуляции ферментативной активности • Наличие кофакторов
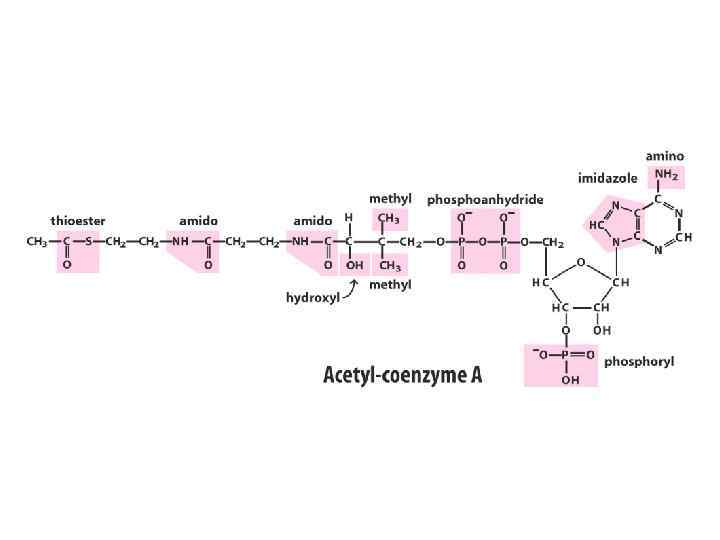
 Кофакторы ферментов • Кофакторы – компоненты ферментов небелковой природы. Молекулярный комплекс белковой части (апофермента) и кофактора называется холоферментом. Роль кофактора могут выполнять ионы металлов (Zn 2+, Mg 2+, Mn 2+, Fe 2+, Cu 2+, K+, Na+) или сложные органические соединения. Органические кофакторы обычно называют коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными ковалентными связями. В последнем случае небелковая часть фермента называется простетической группой. Некоторые коферменты • NAD+ , NADP+ FAD Кофермент А Пиридоксальфосфат Роль кофактора в основном сводится к следующему: • изменение третичной структуры белка и создание комплементарности между ферментом и субстратом; • непосредственное участие в реакции в качестве еще одного субстрата. В этой роли обычно выступают органические коферменты. Их участие в реакции иногда сводится к тому, что они выступают как доноры или акцепторы определенных химических групп.
Кофакторы ферментов • Кофакторы – компоненты ферментов небелковой природы. Молекулярный комплекс белковой части (апофермента) и кофактора называется холоферментом. Роль кофактора могут выполнять ионы металлов (Zn 2+, Mg 2+, Mn 2+, Fe 2+, Cu 2+, K+, Na+) или сложные органические соединения. Органические кофакторы обычно называют коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными ковалентными связями. В последнем случае небелковая часть фермента называется простетической группой. Некоторые коферменты • NAD+ , NADP+ FAD Кофермент А Пиридоксальфосфат Роль кофактора в основном сводится к следующему: • изменение третичной структуры белка и создание комплементарности между ферментом и субстратом; • непосредственное участие в реакции в качестве еще одного субстрата. В этой роли обычно выступают органические коферменты. Их участие в реакции иногда сводится к тому, что они выступают как доноры или акцепторы определенных химических групп.
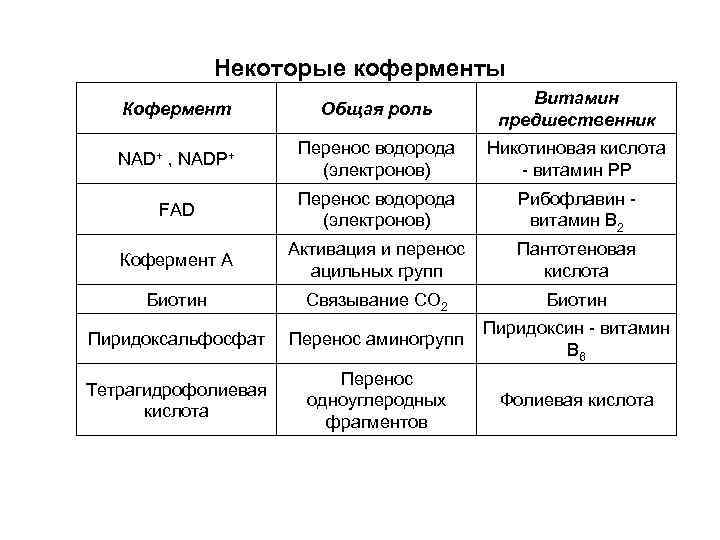 Некоторые коферменты Кофермент Общая роль Витамин предшественник NAD+ , NADP+ Перенос водорода (электронов) Никотиновая кислота - витамин РР FAD Перенос водорода (электронов) Рибофлавин - витамин В 2 Кофермент А Активация и перенос ацильных групп Пантотеновая кислота Биотин Связывание СО 2 Биотин Пиридоксальфосфат Перенос аминогрупп Пиридоксин - витамин В 6 Тетрагидрофолиевая кислота Перенос одноуглеродных фрагментов Фолиевая кислота
Некоторые коферменты Кофермент Общая роль Витамин предшественник NAD+ , NADP+ Перенос водорода (электронов) Никотиновая кислота - витамин РР FAD Перенос водорода (электронов) Рибофлавин - витамин В 2 Кофермент А Активация и перенос ацильных групп Пантотеновая кислота Биотин Связывание СО 2 Биотин Пиридоксальфосфат Перенос аминогрупп Пиридоксин - витамин В 6 Тетрагидрофолиевая кислота Перенос одноуглеродных фрагментов Фолиевая кислота
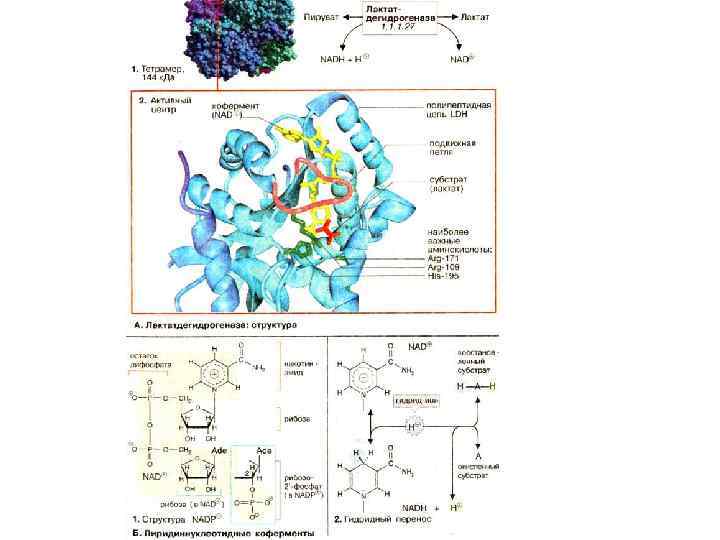
 Механизм каталитического действия ферментов Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е). Тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата, называется активным центром фермента. Активный центр фермента образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента. В активном центре происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями.
Механизм каталитического действия ферментов Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е). Тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата, называется активным центром фермента. Активный центр фермента образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента. В активном центре происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями.
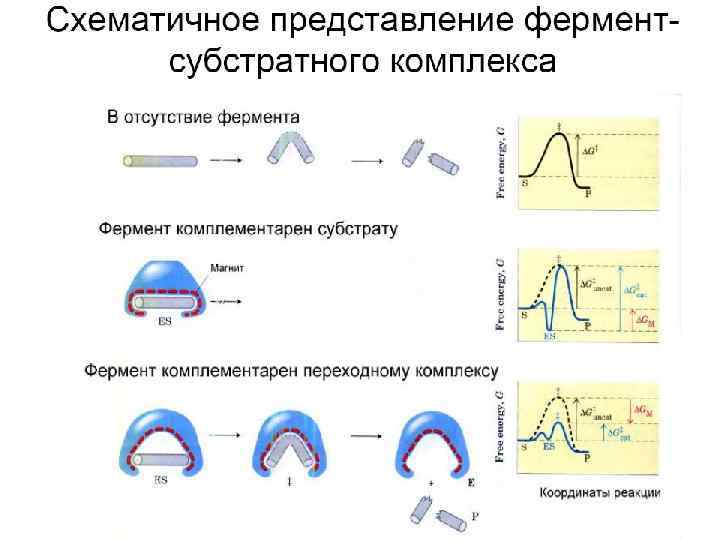
 Теория индуцированного соответствия • Индуцированное соответствие достигается смещением либо крупных блоков, либо целых белковых доменов, - а не полной перестройкой укладки белковой цепи. Смещения эти происходят в основном путем мелких локальных деформаций. Схематическое изображение конформационных изменений в ферменте, индуцированных субстратом. . Впоследствии опыт полностью подтвердил эту гипотезу, но только для тех белков, которым нужно скрыть обрабатываемый субстрат от конкурирующей с ним воды. Для действия трипсина, например, этого не нужно, и в нем индуцированного соответствия субстрату не наблюдается: трипсин (а также - химотрипсин, эластаза, субтилизин и т. д. ) не деформируется и опознает субстрат по простейшему принципу "ключ - замок". • .
Теория индуцированного соответствия • Индуцированное соответствие достигается смещением либо крупных блоков, либо целых белковых доменов, - а не полной перестройкой укладки белковой цепи. Смещения эти происходят в основном путем мелких локальных деформаций. Схематическое изображение конформационных изменений в ферменте, индуцированных субстратом. . Впоследствии опыт полностью подтвердил эту гипотезу, но только для тех белков, которым нужно скрыть обрабатываемый субстрат от конкурирующей с ним воды. Для действия трипсина, например, этого не нужно, и в нем индуцированного соответствия субстрату не наблюдается: трипсин (а также - химотрипсин, эластаза, субтилизин и т. д. ) не деформируется и опознает субстрат по простейшему принципу "ключ - замок". • .

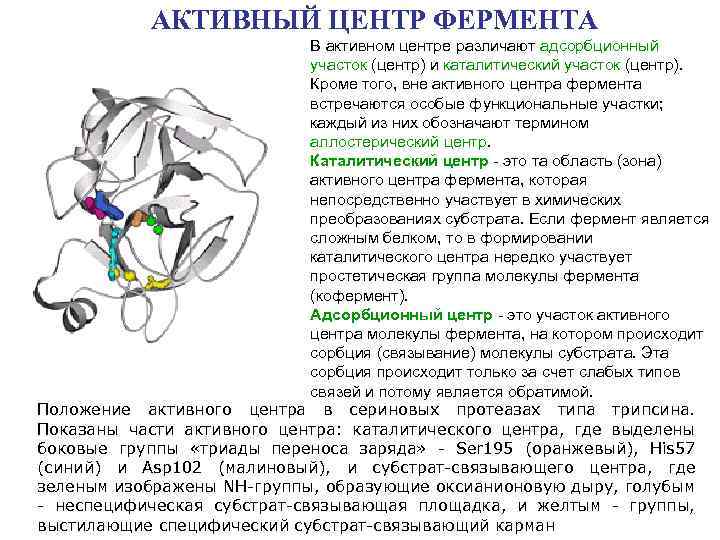 АКТИВНЫЙ ЦЕНТР ФЕРМЕНТА В активном центре различают адсорбционный участок (центр) и каталитический участок (центр). Кроме того, вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином аллостерический центр. Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Адсорбционный центр - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Эта сорбция происходит только за счет слабых типов связей и потому является обратимой. Положение активного центра в сериновых протеазах типа трипсина. Показаны части активного центра: каталитического центра, где выделены боковые группы «триады переноса заряда» - Ser 195 (оранжевый), His 57 (синий) и Asp 102 (малиновый), и субстрат-связывающего центра, где зеленым изображены NH-группы, образующие оксианионовую дыру, голубым - неспецифическая субстрат-связывающая площадка, и желтым - группы, выстилающие специфический субстрат-связывающий карман
АКТИВНЫЙ ЦЕНТР ФЕРМЕНТА В активном центре различают адсорбционный участок (центр) и каталитический участок (центр). Кроме того, вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином аллостерический центр. Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Адсорбционный центр - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Эта сорбция происходит только за счет слабых типов связей и потому является обратимой. Положение активного центра в сериновых протеазах типа трипсина. Показаны части активного центра: каталитического центра, где выделены боковые группы «триады переноса заряда» - Ser 195 (оранжевый), His 57 (синий) и Asp 102 (малиновый), и субстрат-связывающего центра, где зеленым изображены NH-группы, образующие оксианионовую дыру, голубым - неспецифическая субстрат-связывающая площадка, и желтым - группы, выстилающие специфический субстрат-связывающий карман


