12-Гемсодержащие металлопротеины (22).ppt
- Количество слайдов: 22
 Гемсодержащие металлопротеины
Гемсодержащие металлопротеины
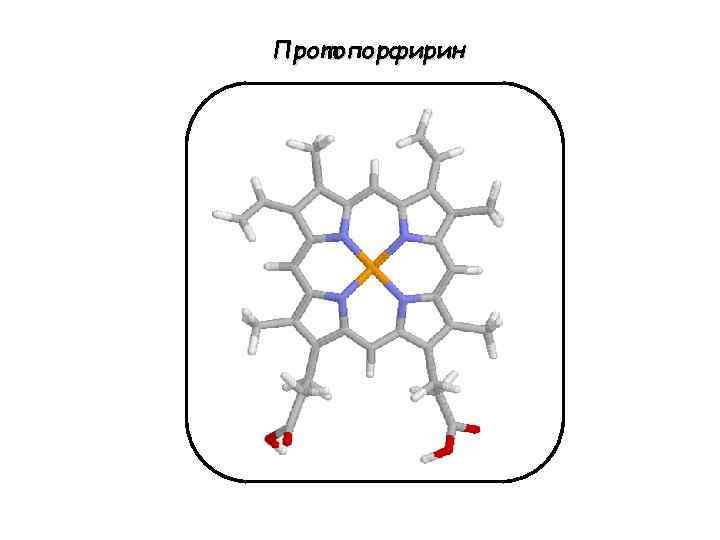 Протопорфирин
Протопорфирин
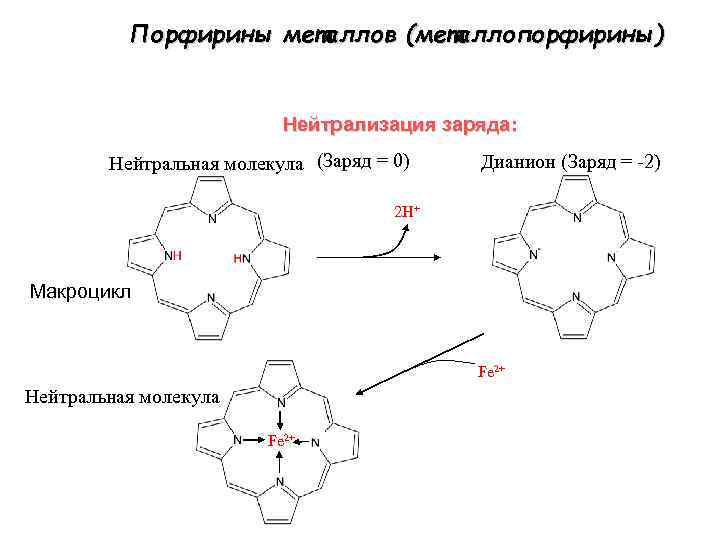 Порфирины металлов (металлопорфирины) Нейтрализация заряда: Нейтральная молекула (Заряд = 0) Дианион (Заряд = -2) 2 H+ Maкроцикл Fe 2+ Нейтральная молекула Fe 2+
Порфирины металлов (металлопорфирины) Нейтрализация заряда: Нейтральная молекула (Заряд = 0) Дианион (Заряд = -2) 2 H+ Maкроцикл Fe 2+ Нейтральная молекула Fe 2+
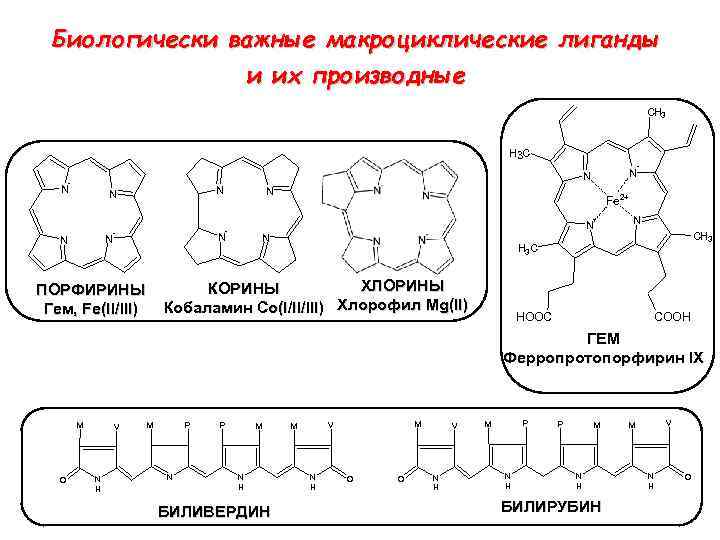 Биологически важные мaкроциклические лиганды и их производные CH 3 H 3 C - N N N N Fe 2+ - N N - - N CH 3 H 3 C ХЛОРИНЫ Кобаламин Co(I/II/III) Хлорофил Mg(II) ПОРФИРИНЫ Гем, Fe(II/III) N HOOC COOH ГЕМ Ферропротопорфирин IX M O V N H P M N H БИЛИВЕРДИН M V M N H O O V N H P M N H БИЛИРУБИН V M N H O
Биологически важные мaкроциклические лиганды и их производные CH 3 H 3 C - N N N N Fe 2+ - N N - - N CH 3 H 3 C ХЛОРИНЫ Кобаламин Co(I/II/III) Хлорофил Mg(II) ПОРФИРИНЫ Гем, Fe(II/III) N HOOC COOH ГЕМ Ферропротопорфирин IX M O V N H P M N H БИЛИВЕРДИН M V M N H O O V N H P M N H БИЛИРУБИН V M N H O
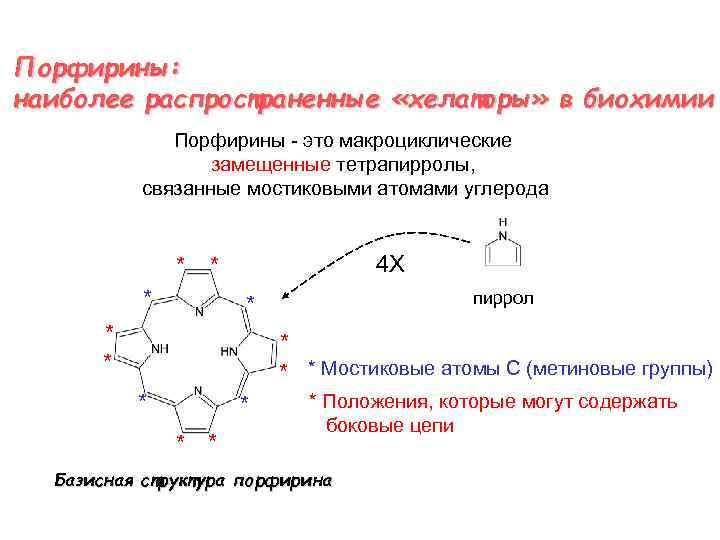 Порфирины: наиболее распространенные «хелаторы» в биохимии Порфирины - это макроциклические замещенные тетрапирролы, связанные мостиковыми атомами углерода * 4 X * * пиррол * * * Мостиковые атомы С (метиновые группы) * * * Положения, которые могут содержать боковые цепи Базисная структура порфирина
Порфирины: наиболее распространенные «хелаторы» в биохимии Порфирины - это макроциклические замещенные тетрапирролы, связанные мостиковыми атомами углерода * 4 X * * пиррол * * * Мостиковые атомы С (метиновые группы) * * * Положения, которые могут содержать боковые цепи Базисная структура порфирина
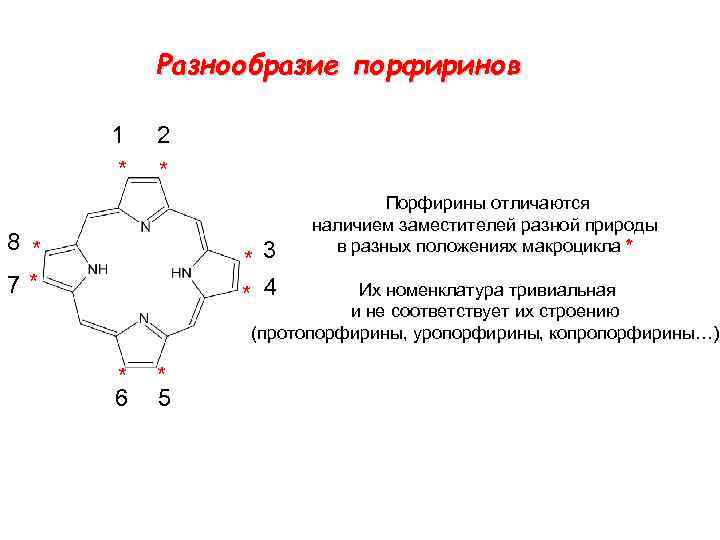 Разнообразие порфиринов 1 * 2 * 8 * 7* * 3 * 4 Порфирины отличаются наличием заместителей разной природы в разных положениях макроцикла * Их номенклатура тривиальная и не соответствует их строению (протопорфирины, уропорфирины, копропорфирины…) * 6 * 5
Разнообразие порфиринов 1 * 2 * 8 * 7* * 3 * 4 Порфирины отличаются наличием заместителей разной природы в разных положениях макроцикла * Их номенклатура тривиальная и не соответствует их строению (протопорфирины, уропорфирины, копропорфирины…) * 6 * 5
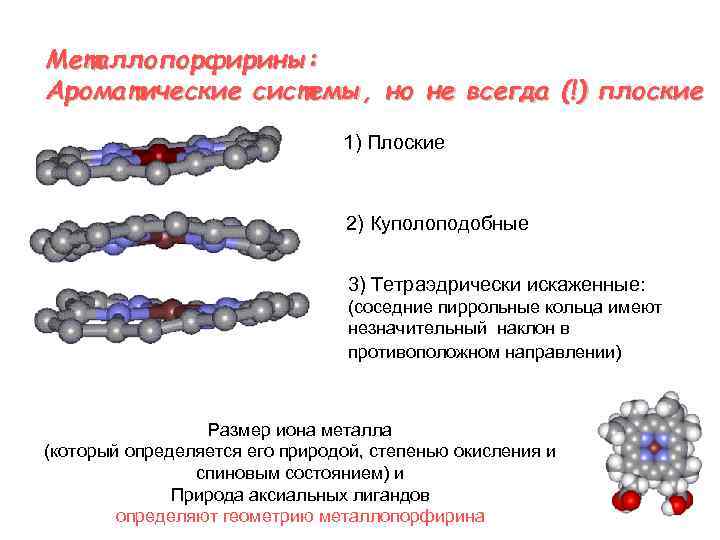 Meталлопорфирины: Ароматические системы, но не всегда (!) плоские 1) Плоские 2) Куполоподобные 3) Тетраэдрически искаженные: (соседние пиррольные кольца имеют незначительный наклон в противоположном направлении) Размер иона металла (который определяется его природой, степенью окисления и спиновым состоянием) и Природа аксиальных лигандов определяют геометрию металлопорфирина
Meталлопорфирины: Ароматические системы, но не всегда (!) плоские 1) Плоские 2) Куполоподобные 3) Тетраэдрически искаженные: (соседние пиррольные кольца имеют незначительный наклон в противоположном направлении) Размер иона металла (который определяется его природой, степенью окисления и спиновым состоянием) и Природа аксиальных лигандов определяют геометрию металлопорфирина
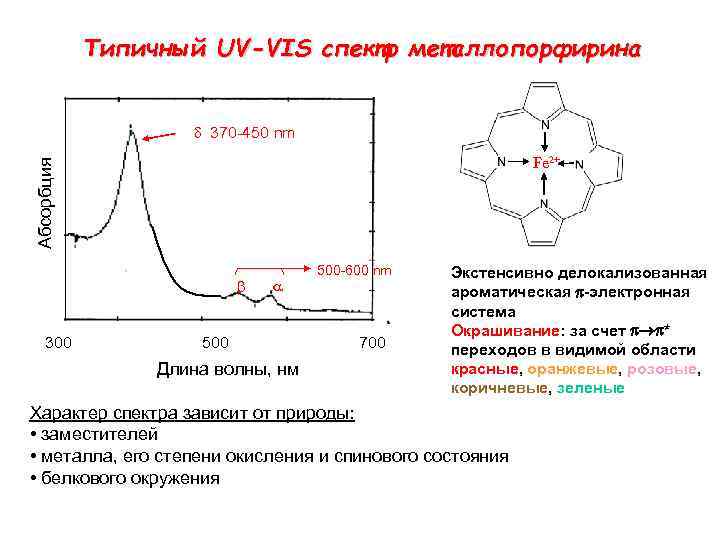 Типичный UV-VIS спектр металлопорфирина d 370 -450 nm Aбсорбция Fe 2+ b 300 a 500 Длина волны, нм 500 -600 nm 700 Экстенсивно делокализованная ароматическая p-электронная система Окрашивание: за счет p p* переходов в видимой области красные, оранжевые, розовые, коричневые, зеленые Характер спектра зависит от природы: • заместителей • металла, его степени окисления и спинового состояния • белкового окружения
Типичный UV-VIS спектр металлопорфирина d 370 -450 nm Aбсорбция Fe 2+ b 300 a 500 Длина волны, нм 500 -600 nm 700 Экстенсивно делокализованная ароматическая p-электронная система Окрашивание: за счет p p* переходов в видимой области красные, оранжевые, розовые, коричневые, зеленые Характер спектра зависит от природы: • заместителей • металла, его степени окисления и спинового состояния • белкового окружения
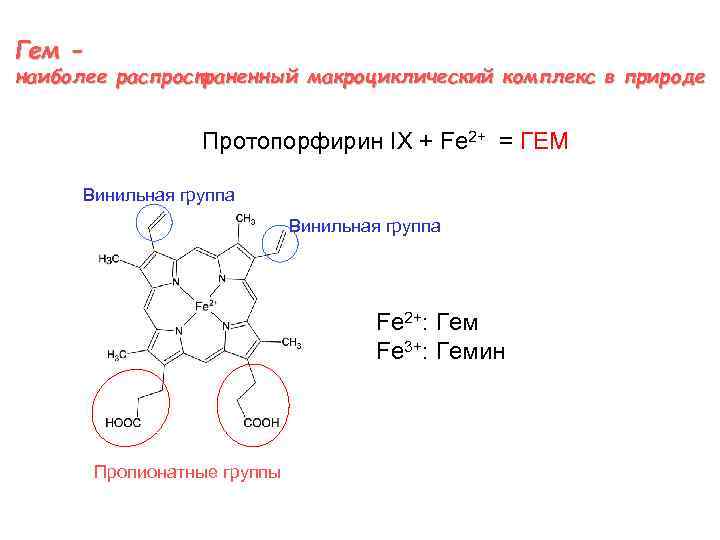 Гем - наиболее распространенный макроциклический комплекс в природе Протопорфирин IX + Fe 2+ = ГЕМ Винильная группа Fe 2+: Гем Fe 3+: Гемин Пропионатные группы
Гем - наиболее распространенный макроциклический комплекс в природе Протопорфирин IX + Fe 2+ = ГЕМ Винильная группа Fe 2+: Гем Fe 3+: Гемин Пропионатные группы
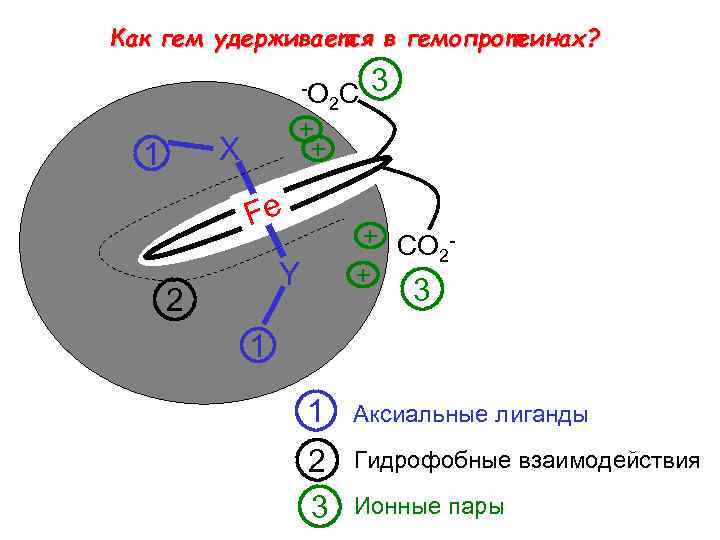 Как гем удерживается в гемопротеинах? -O + + X 1 Fe + CO 2 + Y 2 C 3 2 3 1 1 Aксиальные лиганды 2 3 Гидрофобные взаимодействия Ионные пары
Как гем удерживается в гемопротеинах? -O + + X 1 Fe + CO 2 + Y 2 C 3 2 3 1 1 Aксиальные лиганды 2 3 Гидрофобные взаимодействия Ионные пары
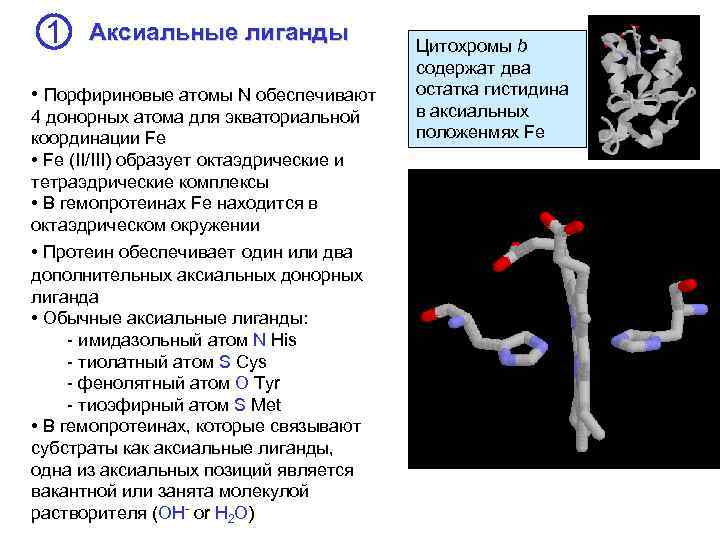 1 Аксиальные лиганды • Порфириновые атомы N обеспечивают 4 донорных атома для экваториальной координации Fe • Fe (II/III) образует октаэдрические и тетраэдрические комплексы • В гемопротеинах Fe находится в октаэдрическом окружении • Протеин обеспечивает один или два дополнительных аксиальных донорных лиганда • Обычные аксиальные лиганды: - имидазольный атом N His - тиолатный атом S Cys - фенолятный атом O Tyr - тиоэфирный атом S Met • В гемопротеинах, которые связывают субстраты как аксиальные лиганды, одна из аксиальных позиций является вакантной или занята молекулой растворителя (OH- or H 2 O) Цитохромы b содержат два остатка гистидина в аксиальных положенмях Fe
1 Аксиальные лиганды • Порфириновые атомы N обеспечивают 4 донорных атома для экваториальной координации Fe • Fe (II/III) образует октаэдрические и тетраэдрические комплексы • В гемопротеинах Fe находится в октаэдрическом окружении • Протеин обеспечивает один или два дополнительных аксиальных донорных лиганда • Обычные аксиальные лиганды: - имидазольный атом N His - тиолатный атом S Cys - фенолятный атом O Tyr - тиоэфирный атом S Met • В гемопротеинах, которые связывают субстраты как аксиальные лиганды, одна из аксиальных позиций является вакантной или занята молекулой растворителя (OH- or H 2 O) Цитохромы b содержат два остатка гистидина в аксиальных положенмях Fe
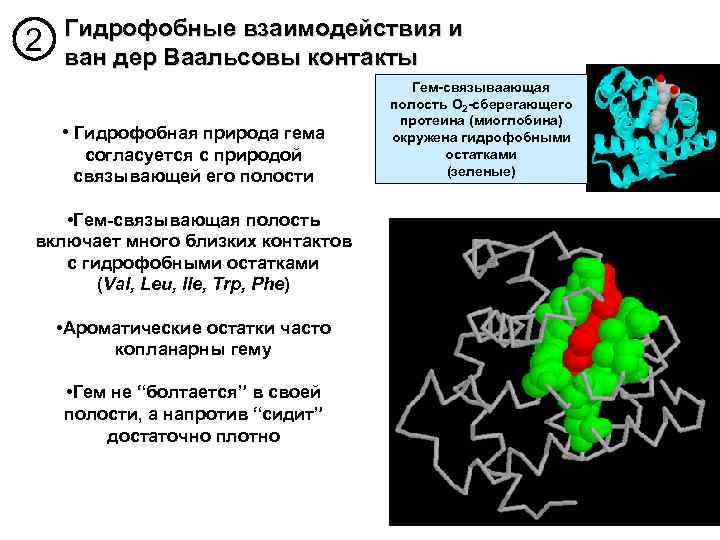 2 Гидрофобные взаимодействия и ван дер Ваальсовы контакты • Гидрофобная природа гема согласуется с природой связывающей его полости • Гем-связывающая полость включает много близких контактов с гидрофобными остатками (Val, Leu, Ile, Trp, Phe) • Ароматические остатки часто копланарны гему • Гем не “болтается” в своей полости, а напротив “сидит” достаточно плотно Гем-связываающая полость O 2 -сберегающего протеина (миоглобина) окружена гидрофобными остатками (зеленые)
2 Гидрофобные взаимодействия и ван дер Ваальсовы контакты • Гидрофобная природа гема согласуется с природой связывающей его полости • Гем-связывающая полость включает много близких контактов с гидрофобными остатками (Val, Leu, Ile, Trp, Phe) • Ароматические остатки часто копланарны гему • Гем не “болтается” в своей полости, а напротив “сидит” достаточно плотно Гем-связываающая полость O 2 -сберегающего протеина (миоглобина) окружена гидрофобными остатками (зеленые)
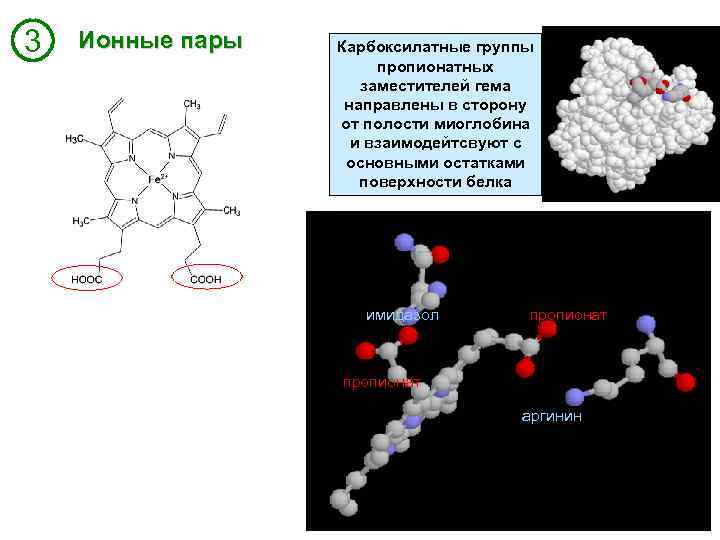 3 Ионные пары Карбоксилатные группы пропионатных заместителей гема направлены в сторону от полости миоглобина и взаимодейтсвуют с основными остатками поверхности белка имидазол пропионат аргинин
3 Ионные пары Карбоксилатные группы пропионатных заместителей гема направлены в сторону от полости миоглобина и взаимодейтсвуют с основными остатками поверхности белка имидазол пропионат аргинин
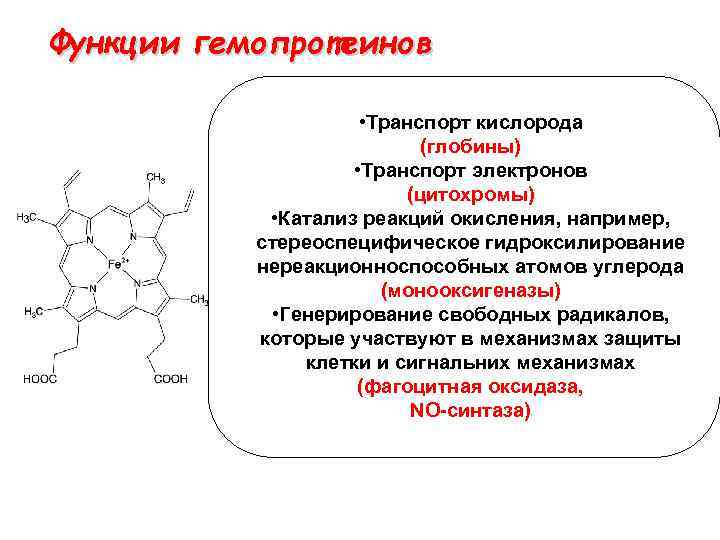 Функции гемопротеинов • Транспорт кислорода (глобины) • Транспорт электронов (цитохромы) • Катализ реакций окисления, например, стереоспецифическое гидроксилирование нереакционноспособных атомов углерода (монооксигеназы) • Генерирование свободных радикалов, которые участвуют в механизмах защиты клетки и сигнальних механизмах (фагоцитная оксидаза, NO-синтаза)
Функции гемопротеинов • Транспорт кислорода (глобины) • Транспорт электронов (цитохромы) • Катализ реакций окисления, например, стереоспецифическое гидроксилирование нереакционноспособных атомов углерода (монооксигеназы) • Генерирование свободных радикалов, которые участвуют в механизмах защиты клетки и сигнальних механизмах (фагоцитная оксидаза, NO-синтаза)
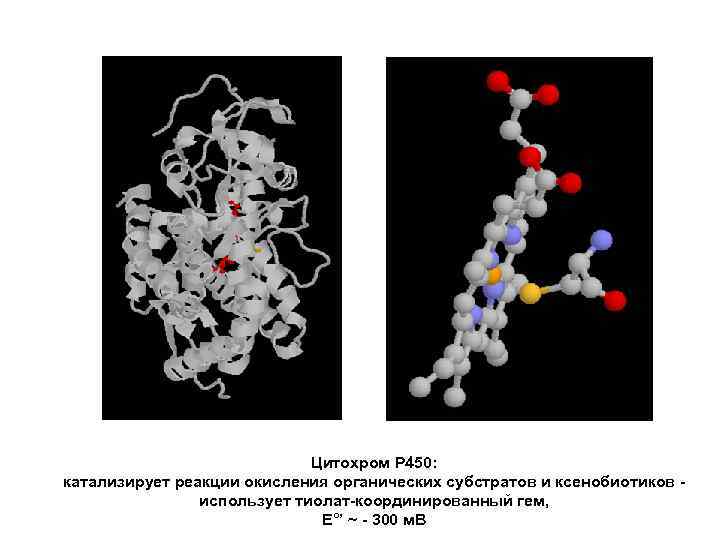 Цитохром P 450: катализирует реакции окисления органических субстратов и ксенобиотиков использует тиолат-координированный гем, E°’ ~ - 300 м. В
Цитохром P 450: катализирует реакции окисления органических субстратов и ксенобиотиков использует тиолат-координированный гем, E°’ ~ - 300 м. В
 Гем может иметь любой редокс-потенциал от -300 до +300 м. В Феррогем: заряд = 0, Fe 2+ Ферригем: заряд = +1, Fe 3+
Гем может иметь любой редокс-потенциал от -300 до +300 м. В Феррогем: заряд = 0, Fe 2+ Ферригем: заряд = +1, Fe 3+
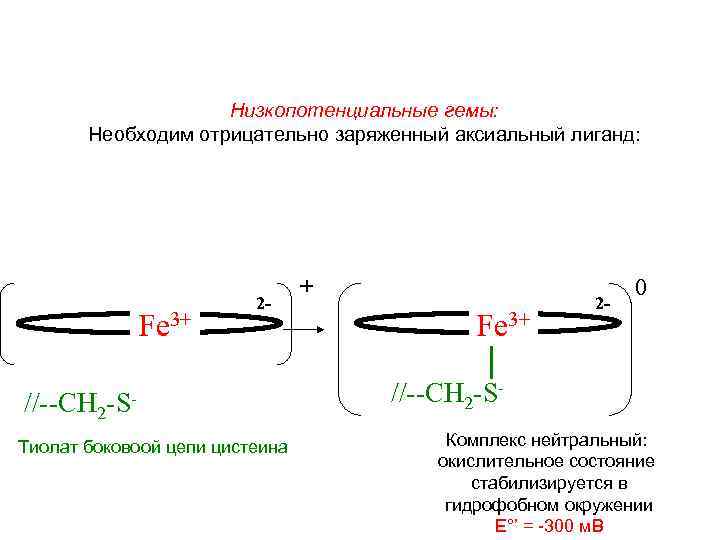 Низкопотенциальные гемы: Необходим отрицательно заряженный аксиальный лиганд: Fe 3+ 2 - //--CH 2 -SТиолат боковоой цепи цистеина + Fe 3+ 2 - 0 //--CH 2 -SКомплекс нейтральный: окислительное состояние стабилизируется в гидрофобном окружении E°’ = -300 м. В
Низкопотенциальные гемы: Необходим отрицательно заряженный аксиальный лиганд: Fe 3+ 2 - //--CH 2 -SТиолат боковоой цепи цистеина + Fe 3+ 2 - 0 //--CH 2 -SКомплекс нейтральный: окислительное состояние стабилизируется в гидрофобном окружении E°’ = -300 м. В
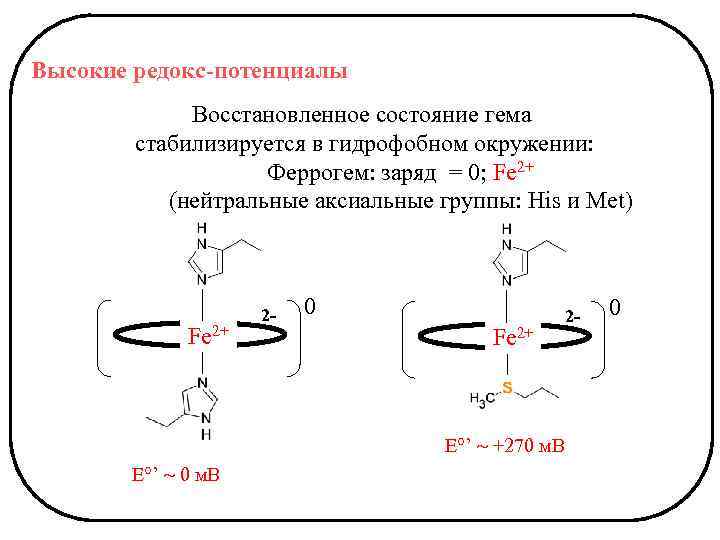 Высокие редокс-потенциалы Восстановленное состояние гема стабилизируется в гидрофобном окружении: Феррогем: заряд = 0; Fe 2+ (нейтральные аксиальные группы: His и Met) Fe 2+ 2 - 0 Fe 2+ E°’ +270 м. В E°’ 0 м. В 2 - 0
Высокие редокс-потенциалы Восстановленное состояние гема стабилизируется в гидрофобном окружении: Феррогем: заряд = 0; Fe 2+ (нейтральные аксиальные группы: His и Met) Fe 2+ 2 - 0 Fe 2+ E°’ +270 м. В E°’ 0 м. В 2 - 0
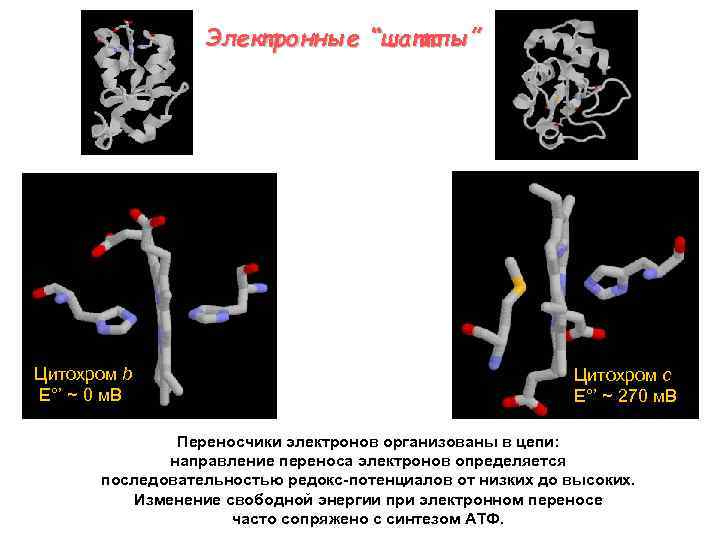 Электронные “шаттлы” Цитохром b E°’ ~ 0 м. В Цитохром c E°’ ~ 270 м. В Переносчики электронов организованы в цепи: направление переноса электронов определяется последовательностью редокс-потенциалов от низких до высоких. Изменение свободной энергии при электронном переносе часто сопряжено с синтезом АТФ.
Электронные “шаттлы” Цитохром b E°’ ~ 0 м. В Цитохром c E°’ ~ 270 м. В Переносчики электронов организованы в цепи: направление переноса электронов определяется последовательностью редокс-потенциалов от низких до высоких. Изменение свободной энергии при электронном переносе часто сопряжено с синтезом АТФ.
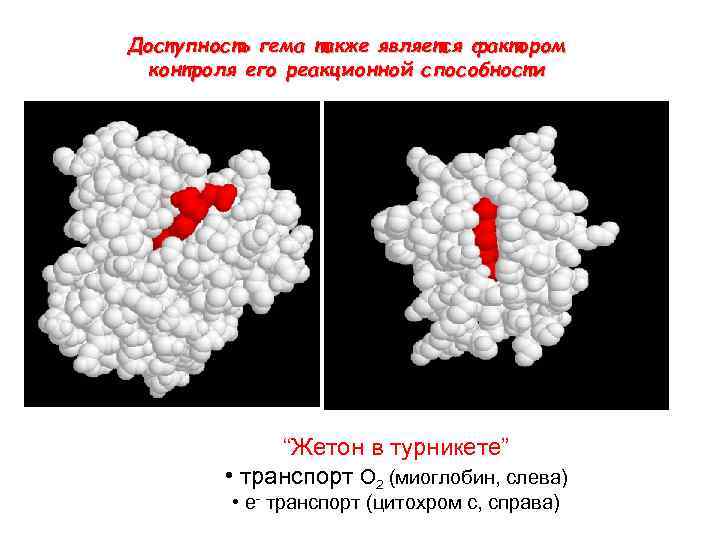 Доступность гема также является фактором контроля его реакционной способности “Жетон в турникете” • транспорт O 2 (миоглобин, слева) • e- транспорт (цитохром c, справа)
Доступность гема также является фактором контроля его реакционной способности “Жетон в турникете” • транспорт O 2 (миоглобин, слева) • e- транспорт (цитохром c, справа)
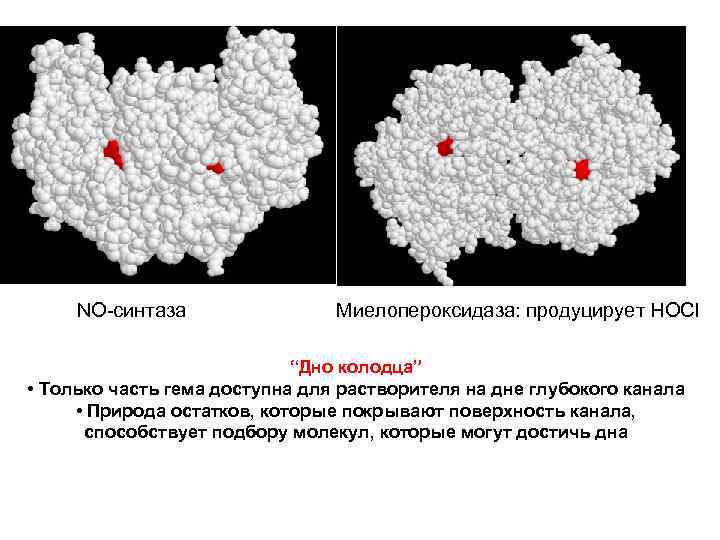 NO-синтаза Миелопероксидаза: продуцирует HOCl “Дно колодца” • Только часть гема доступна для растворителя на дне глубокого канала • Природа остатков, которые покрывают поверхность канала, способствует подбору молекул, которые могут достичь дна
NO-синтаза Миелопероксидаза: продуцирует HOCl “Дно колодца” • Только часть гема доступна для растворителя на дне глубокого канала • Природа остатков, которые покрывают поверхность канала, способствует подбору молекул, которые могут достичь дна
 • В некоторых случаях (например, цитохром P 450) гем в значительной мере недоступен, даже для субстратов • (O 2, органические субстраты) • “Структурное дыхание”
• В некоторых случаях (например, цитохром P 450) гем в значительной мере недоступен, даже для субстратов • (O 2, органические субстраты) • “Структурное дыхание”


