гомеостаз.pptx
- Количество слайдов: 21

 • Гемостаз является эволюционно сложившейся защитной реакцией организма, выражающейся в остановке кровотечения при повреждении стенки сосуда. Он возникает в результате спазма кровеносных сосудов и появления закупоривающего сосуд кровяного сгустка. ГЕМОСТАЗ (ОСТАНОВКА КРОВОТЕЧЕНИЯ)
• Гемостаз является эволюционно сложившейся защитной реакцией организма, выражающейся в остановке кровотечения при повреждении стенки сосуда. Он возникает в результате спазма кровеносных сосудов и появления закупоривающего сосуд кровяного сгустка. ГЕМОСТАЗ (ОСТАНОВКА КРОВОТЕЧЕНИЯ)
 • МЕХАНИЗМ СВЕРТЫВАНИЯ КРОВИ • В современной схеме свертывания крови выделяют четыре фазы: • Протромбинообразование (контактно-калликреинкиниикаскадная активация) - 5. . 7 минут; • Тромбинообразование - 2. . 5 секунд; • Фибринообразование - 2. . 5 секунд; • Посткоагуляционная фаза (образование гемостатически полноценного сгустка) - 55. . 85 минут.
• МЕХАНИЗМ СВЕРТЫВАНИЯ КРОВИ • В современной схеме свертывания крови выделяют четыре фазы: • Протромбинообразование (контактно-калликреинкиниикаскадная активация) - 5. . 7 минут; • Тромбинообразование - 2. . 5 секунд; • Фибринообразование - 2. . 5 секунд; • Посткоагуляционная фаза (образование гемостатически полноценного сгустка) - 55. . 85 минут.
 • Биологическое значение экстраваскулярных тканей сводится к образованию в них активного тканевого тромбопластина. Тромбопластин включается в цепь последующих реакций, конечным продуктом которых является фибрин. Окружающие сосуд ткани также механически препятствуют выходу крови из поврежденного сосуда. В самой стенке сосуда имеется ряд механизмов, оказывающих влияние на процесс свертывания крови. Так, при повреждении сосудистой стенки в связи с изменением электрического заряда (с отрицательного на положительный) отрицательно заряженные тромбоциты приклеиваются к месту повреждения. Происходит адгезия (прилипание) тромбоцитов. Другим типом взаимодействия тромбоцитов является агрегация (объединение частиц в одно целое), способствующая образованию тромбоцитарной пробки.
• Биологическое значение экстраваскулярных тканей сводится к образованию в них активного тканевого тромбопластина. Тромбопластин включается в цепь последующих реакций, конечным продуктом которых является фибрин. Окружающие сосуд ткани также механически препятствуют выходу крови из поврежденного сосуда. В самой стенке сосуда имеется ряд механизмов, оказывающих влияние на процесс свертывания крови. Так, при повреждении сосудистой стенки в связи с изменением электрического заряда (с отрицательного на положительный) отрицательно заряженные тромбоциты приклеиваются к месту повреждения. Происходит адгезия (прилипание) тромбоцитов. Другим типом взаимодействия тромбоцитов является агрегация (объединение частиц в одно целое), способствующая образованию тромбоцитарной пробки.
 • Уже через доли секунды после повреждения стенки сосуда в зоне травмы наблюдается спазм сосудов, и развивается цепь тромбоцитарных реакций, в результате которых образуется тромбоцитарная пробка. Прежде всего, происходит активация тромбоцитов факторами, выделяющимися из поврежденных тканей сосуда, а также малыми количествами тромбина - фермента, образующегося в ответ на повреждение. Затем происходит склеивание (агрегация) тромбоцитов друг с другом и с фибриногеном, содержащимся в плазме крови, и одновременное прилипание (адгезия) тромбоцитов к коллагеновым волокнам, находящимся в стенке сосуда, и поверхностным адгезивным белкам клеток эндотелия. В процесс вовлекается все большее и большее число тромбоцитов, поступающих в зону повреждения. Первая стадия адгезии и агрегации обратима, но позже эти процессы становятся необратимыми.
• Уже через доли секунды после повреждения стенки сосуда в зоне травмы наблюдается спазм сосудов, и развивается цепь тромбоцитарных реакций, в результате которых образуется тромбоцитарная пробка. Прежде всего, происходит активация тромбоцитов факторами, выделяющимися из поврежденных тканей сосуда, а также малыми количествами тромбина - фермента, образующегося в ответ на повреждение. Затем происходит склеивание (агрегация) тромбоцитов друг с другом и с фибриногеном, содержащимся в плазме крови, и одновременное прилипание (адгезия) тромбоцитов к коллагеновым волокнам, находящимся в стенке сосуда, и поверхностным адгезивным белкам клеток эндотелия. В процесс вовлекается все большее и большее число тромбоцитов, поступающих в зону повреждения. Первая стадия адгезии и агрегации обратима, но позже эти процессы становятся необратимыми.
 • грегаты тромбоцитов уплотняются, образуя пробку, плотно закрывающую дефект в сосудах малого и среднего размера. Из адгезированных тромбоцитов высвобождаются факторы, активирующие все клетки крови и некоторые факторы свертывания, находящиеся в крови, в результате чего на основе тромбоцитарной пробки формируется фибриновый сгусток. В сети фибрина задерживаются форменные элементы крови и в результате образуется кровяной сгусток. Позднее из сгустка вытесняется жидкость, и он превращается в тромб, который препятствует дальнейшей потере крови, он же является барьером для проникновения патогенных агентов.
• грегаты тромбоцитов уплотняются, образуя пробку, плотно закрывающую дефект в сосудах малого и среднего размера. Из адгезированных тромбоцитов высвобождаются факторы, активирующие все клетки крови и некоторые факторы свертывания, находящиеся в крови, в результате чего на основе тромбоцитарной пробки формируется фибриновый сгусток. В сети фибрина задерживаются форменные элементы крови и в результате образуется кровяной сгусток. Позднее из сгустка вытесняется жидкость, и он превращается в тромб, который препятствует дальнейшей потере крови, он же является барьером для проникновения патогенных агентов.
 Фактор: Название фактора Свойства и функции Факторы свертывания крови Белок-гликопротеид, который I II IV V Фибриноген вырабатывается пареихиматозными клетками печени, превращается под влиянием тромбина в фибрин. Протромбин Белок-гликопротеид, неактивная форма фермента тромбина, синтезируется в печени при участии витамина К. Тромбопластин Липопротеид (протеолитический фермент), участвующий в местном гемостазе, при контакте с плазменными факторами (VII и Ca) способен активировать фактор X (внешний путь формирования протромбиназы). Проще говоря: превращает протромбин в тромбин. Кальций Потенцирует большинство факторов свертывания крови - участвувет в активации протромбиназы и образовании тромбина, в процессе свертывания не расходуется. Проакцелерин Ас-глобулин, образуется в печени, необходим для образования протромбиназы.
Фактор: Название фактора Свойства и функции Факторы свертывания крови Белок-гликопротеид, который I II IV V Фибриноген вырабатывается пареихиматозными клетками печени, превращается под влиянием тромбина в фибрин. Протромбин Белок-гликопротеид, неактивная форма фермента тромбина, синтезируется в печени при участии витамина К. Тромбопластин Липопротеид (протеолитический фермент), участвующий в местном гемостазе, при контакте с плазменными факторами (VII и Ca) способен активировать фактор X (внешний путь формирования протромбиназы). Проще говоря: превращает протромбин в тромбин. Кальций Потенцирует большинство факторов свертывания крови - участвувет в активации протромбиназы и образовании тромбина, в процессе свертывания не расходуется. Проакцелерин Ас-глобулин, образуется в печени, необходим для образования протромбиназы.
 VI VIII IX X XI XIII Потенцирует превращение протромбина в тромбин. Синтезируется в печени при участии витамина К, Проконвертин в активной форме вместе с факторами III и IV активирует фактор X. Сложный гликопротеид, место синтеза точно не Антигемофильный установлено, активирует глобулин А образование тромбопластина. Бета-глобулин, Антигемофильный образуется в печени, глобулин В (Фактор участвует в образовании Кристмаса) тромбина. Гликопротеид, Тромботропин (Фактор вырабатывается в Стюарта-Прауэра) печени, участвует в образовании тромбина. Предшественник плазменного Гликопротеид, тромбопластина активирует фактор X. (Фактор Розенталя) Активатор пусковой реакции свертывания Фактор контактной крови и кининовой активации (Фактор системы. Проще говоря, Хагемана) начинает и локализует тромбообразование. Фибриназа, стабилизирует фибрин в присутствии кальция, Фибринстабилизирующ катализирует ий фактор трансаминирование Акцелерин
VI VIII IX X XI XIII Потенцирует превращение протромбина в тромбин. Синтезируется в печени при участии витамина К, Проконвертин в активной форме вместе с факторами III и IV активирует фактор X. Сложный гликопротеид, место синтеза точно не Антигемофильный установлено, активирует глобулин А образование тромбопластина. Бета-глобулин, Антигемофильный образуется в печени, глобулин В (Фактор участвует в образовании Кристмаса) тромбина. Гликопротеид, Тромботропин (Фактор вырабатывается в Стюарта-Прауэра) печени, участвует в образовании тромбина. Предшественник плазменного Гликопротеид, тромбопластина активирует фактор X. (Фактор Розенталя) Активатор пусковой реакции свертывания Фактор контактной крови и кининовой активации (Фактор системы. Проще говоря, Хагемана) начинает и локализует тромбообразование. Фибриназа, стабилизирует фибрин в присутствии кальция, Фибринстабилизирующ катализирует ий фактор трансаминирование Акцелерин
 Фактор Флетчера. Плазменный прекалликреин, активирует факторы VII, IX, переводит киинноген в кинин Фактор Фитцжеральда Киинноген, в активной форме (кинин) активирует фактор XI. Фактор Виллебранда Компонент фактора VIII, вырабатывается в эндотелии, в кровотоке, соединяясь с коагуляционной частью, образует полиоценный фактор VIII (антигемофильный глобулин А).
Фактор Флетчера. Плазменный прекалликреин, активирует факторы VII, IX, переводит киинноген в кинин Фактор Фитцжеральда Киинноген, в активной форме (кинин) активирует фактор XI. Фактор Виллебранда Компонент фактора VIII, вырабатывается в эндотелии, в кровотоке, соединяясь с коагуляционной частью, образует полиоценный фактор VIII (антигемофильный глобулин А).
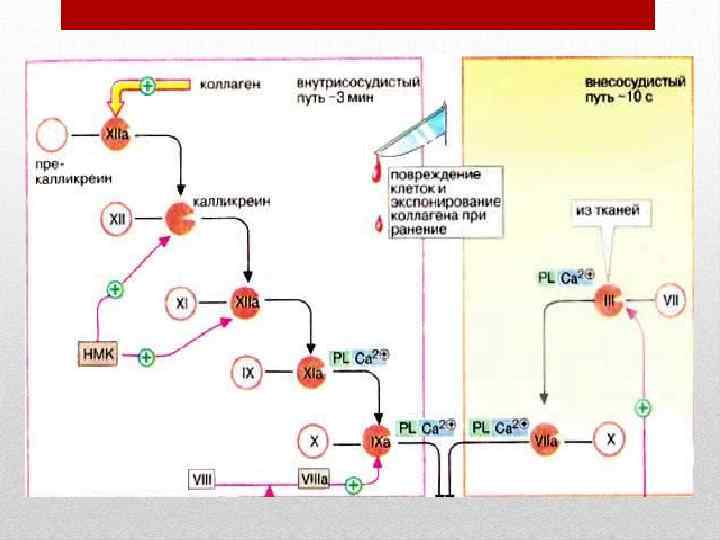
 • Соприкосновение с инородной поверхностью служит пусковым механизмом для активации системы свертывания крови. В этом случае на схемах активные факторы обозначаются добавлением к соответствующей римской цифре буквы «а» . Величина повреждения сосуда, а также степень участия отдельных факторов определяют два основных механизма гемостаза: сосудисто— тромбоцитарный и коагуляционный.
• Соприкосновение с инородной поверхностью служит пусковым механизмом для активации системы свертывания крови. В этом случае на схемах активные факторы обозначаются добавлением к соответствующей римской цифре буквы «а» . Величина повреждения сосуда, а также степень участия отдельных факторов определяют два основных механизма гемостаза: сосудисто— тромбоцитарный и коагуляционный.
 • Сосудисто—тромбоцитарный механизм гемостаза в остановке кровотечения опирается на ведущую роль сосудистой стенки и тромбоцитов. Этот механизм характерен для гемостаза в мелких сосудах с низким кровяным давлением — артериолах, прекапиллярах, венулах. Он состоит из ряда последовательных этапов. • 1. Кратковременный спазм сосудов, возникающий под влиянием высвобождающихся из тромбоцитов адреналина, норадреналина, серотонина. • 2. Адгезия тромбоцитов к раневой поверхности, происходящая из—за изменения потенциала стенки сосуда: в месте повреждения отрицательный заряд меняется на положительный. В результате тромбоциты крови, несущие на своей поверхности отрицательный заряд, начинают задерживаться у травмированного участка.
• Сосудисто—тромбоцитарный механизм гемостаза в остановке кровотечения опирается на ведущую роль сосудистой стенки и тромбоцитов. Этот механизм характерен для гемостаза в мелких сосудах с низким кровяным давлением — артериолах, прекапиллярах, венулах. Он состоит из ряда последовательных этапов. • 1. Кратковременный спазм сосудов, возникающий под влиянием высвобождающихся из тромбоцитов адреналина, норадреналина, серотонина. • 2. Адгезия тромбоцитов к раневой поверхности, происходящая из—за изменения потенциала стенки сосуда: в месте повреждения отрицательный заряд меняется на положительный. В результате тромбоциты крови, несущие на своей поверхности отрицательный заряд, начинают задерживаться у травмированного участка.
 • 3. Накопление и окучивание (агрегация) тромбоцитов у места повреждения. Этому способствует выделение поврежденной стенкой сосуда и поверхностью тромбоцитов АТФ и АДФ. В результате образуется рыхлая тромбоцитарная пробка, через которую может проходить плазма крови. • 4. Необратимая агрегация тромбоцитов. На этой стадии тромбоциты сливаются в однообразную массу, образуя пробку, непроницаемую для плазмы крови. Реакция происходит под влиянием тромбина, разрушающего мембрану тромбоцитов, что, в свою очередь, ведет к выходу из тромбоцитов физиологически активных веществ: серотонина, гистамина, нуклеотидов, ферментов и факторов свертывания крови. Их выделение способствует вторичному спазму сосудов. Фактор 3 посредством тромбоцитарной протромбиназы запускает механизм коагуляционного гемостаза. •
• 3. Накопление и окучивание (агрегация) тромбоцитов у места повреждения. Этому способствует выделение поврежденной стенкой сосуда и поверхностью тромбоцитов АТФ и АДФ. В результате образуется рыхлая тромбоцитарная пробка, через которую может проходить плазма крови. • 4. Необратимая агрегация тромбоцитов. На этой стадии тромбоциты сливаются в однообразную массу, образуя пробку, непроницаемую для плазмы крови. Реакция происходит под влиянием тромбина, разрушающего мембрану тромбоцитов, что, в свою очередь, ведет к выходу из тромбоцитов физиологически активных веществ: серотонина, гистамина, нуклеотидов, ферментов и факторов свертывания крови. Их выделение способствует вторичному спазму сосудов. Фактор 3 посредством тромбоцитарной протромбиназы запускает механизм коагуляционного гемостаза. •
 • 5. Ретракция тромбоцитарного тромба. Фибриновые нити и последующая ретракция кровяного сгустка уплотняют тромбоцитарную пробку, закрепляя ее в поврежденном сосуде. Все это приводит к остановке кровотечения. В мелких сосудах гемостаз на этом заканчивается. Тромбоцитарный тромб, будучи непрочным, не выдерживает большого кровяного давления и вымывается. Поэтому в крупных сосудах на этой основе образуется уже более прочный фибриновый тромб. Для его образования включается еще один — ферментативный коагуляционный механизм.
• 5. Ретракция тромбоцитарного тромба. Фибриновые нити и последующая ретракция кровяного сгустка уплотняют тромбоцитарную пробку, закрепляя ее в поврежденном сосуде. Все это приводит к остановке кровотечения. В мелких сосудах гемостаз на этом заканчивается. Тромбоцитарный тромб, будучи непрочным, не выдерживает большого кровяного давления и вымывается. Поэтому в крупных сосудах на этой основе образуется уже более прочный фибриновый тромб. Для его образования включается еще один — ферментативный коагуляционный механизм.
 • • Коагуляционный механизм Этот механизм имеет место при травме крупных сосудов, когда после описанного выше первого этапа начинается процесс ферментативного свертывания крови. Основные элементы ферментативной теории были открыты профессором Дерптского (Тартуского) университета А. А. Шмидтом (1872) и уточнены П. Моравцем (1905). Коагуляционный процесс протекает в форме трех последовательных фаз. В первой фазе происходит образование активного, или полного, тромбопластина (фактора III). Оно осуществляется путем взаимодействия предшественников со специфическими белками плазмы. Предшественники тромбопластина содержатся в форменных элементах крови и тканях. В зависимости от источника тромбопластин бывает кровяным и тканевым. Процесс образования активного тромбопластина представляет сложную последовательность событий. Он протекает в несколько стадий и требует непременного участия плазменных и тканевых факторов, таких как факторы V, VIII, IX, X, XI, Са 2+. Возникновение кровяного тромбопластина начинается с активирования особого вещества плазмы фактора Хагемана (фактора XII). В крови он находится в неактивном состоянии из—за наличия в плазме препятствующего активации антифактора. При соприкосновении с шероховатой поверхностью поврежденного сосуда антифактор разрушается, что позволяет фактору XII выйти из—под его контроля и активироваться. Одновременно с этим на той же шероховатой поверхности активируется и другое вещество — фактор XI (предшественник плазменного тромбопластина). Считают, что фактор XI, взаимодействуя с активированным фактором XII, образует так называемый контактный фактор. Контактный фактор в свою очередь активирует фактор VIII (антигемофильный глобулин А). Последний взаимодействует с фактором IX (антигемофильным глобулином В, или фактором Кристмаса), а также с Са 2+. Факторы VIII, IX и ионы кальция (фактор IV) образуют кальциевый комплекс.
• • Коагуляционный механизм Этот механизм имеет место при травме крупных сосудов, когда после описанного выше первого этапа начинается процесс ферментативного свертывания крови. Основные элементы ферментативной теории были открыты профессором Дерптского (Тартуского) университета А. А. Шмидтом (1872) и уточнены П. Моравцем (1905). Коагуляционный процесс протекает в форме трех последовательных фаз. В первой фазе происходит образование активного, или полного, тромбопластина (фактора III). Оно осуществляется путем взаимодействия предшественников со специфическими белками плазмы. Предшественники тромбопластина содержатся в форменных элементах крови и тканях. В зависимости от источника тромбопластин бывает кровяным и тканевым. Процесс образования активного тромбопластина представляет сложную последовательность событий. Он протекает в несколько стадий и требует непременного участия плазменных и тканевых факторов, таких как факторы V, VIII, IX, X, XI, Са 2+. Возникновение кровяного тромбопластина начинается с активирования особого вещества плазмы фактора Хагемана (фактора XII). В крови он находится в неактивном состоянии из—за наличия в плазме препятствующего активации антифактора. При соприкосновении с шероховатой поверхностью поврежденного сосуда антифактор разрушается, что позволяет фактору XII выйти из—под его контроля и активироваться. Одновременно с этим на той же шероховатой поверхности активируется и другое вещество — фактор XI (предшественник плазменного тромбопластина). Считают, что фактор XI, взаимодействуя с активированным фактором XII, образует так называемый контактный фактор. Контактный фактор в свою очередь активирует фактор VIII (антигемофильный глобулин А). Последний взаимодействует с фактором IX (антигемофильным глобулином В, или фактором Кристмаса), а также с Са 2+. Факторы VIII, IX и ионы кальция (фактор IV) образуют кальциевый комплекс.
 • • Под действием этого комплекса происходит склеивание и набухание кровяных пластинок. Из их гранул выделяется Тромбоцитарный фактор 3. Этот фактор вместе с кальциевым комплексом и контактным фактором образуют промежуточный продукт, который взаимодействует с фактором V (Ас—глобулином) и фактором Х (тромботропином). Следовательно, образование кровяного тромбопластина является результатом взаимодействия факторов плазмы и фактора 3 кровяных пластинок. Тканевой тромбопластин значительно активнее, чем кровяной. Его возникновение является результатом взаимодействия тканевых жидкостей с факторами V, VII, X, Са 2+. Таким образом, первая фаза свертывания крови с участием ферментативных механизмов заканчивается образованием кровяного и тканевого тромбопластинов. Вторая фаза представляет собой активацию неактивного фермента плазмы протромбина (фактор II) и переход его в активный фактор тромбин. Этот процесс осуществляется под воздействием образовавшегося в первой фазе «полного» тромбопластина. В превращении протромбина в тромбин участвуют факторы V, VII, Са 2+, а также факторы 1 и 2 тромбоцитов. В третьей фазе происходит образование нерастворимого сгустка нитей фибрина из растворенного в плазме белка фибриногена (фактор I). Процесс превращения идет под влиянием тромбина с участием Са 2+ и факторов кровяных пластинок в два этапа. На первом, ферментативно—протеолитическом, этапе от фибриногена под влиянием тромбина отщепляются пептиды. Итогом этой реакции является образование промежуточного продукта профибрина — фибрин—мономера. На втором, полимеризационном, этапе молекулы фибрин—мономера взаимодействуют между собой, образуя нерастворимый сгусток фибрина. Полимеризация осуществляется в присутствии ионов Ca 2+ и XIII фактора (фибринстабилизирующего). В фибриновую сеть вовлекаются форменные элементы крови, формируется кровяной сгусток, который уменьшает или полностью предотвращает кровопотерю. Образование сгустка фибрина не является конечным этапом свертывания крови. Спустя некоторое время в результате сокращения нитей фибрина тромб начинает уплотняться, из него удаляется сыворотка.
• • Под действием этого комплекса происходит склеивание и набухание кровяных пластинок. Из их гранул выделяется Тромбоцитарный фактор 3. Этот фактор вместе с кальциевым комплексом и контактным фактором образуют промежуточный продукт, который взаимодействует с фактором V (Ас—глобулином) и фактором Х (тромботропином). Следовательно, образование кровяного тромбопластина является результатом взаимодействия факторов плазмы и фактора 3 кровяных пластинок. Тканевой тромбопластин значительно активнее, чем кровяной. Его возникновение является результатом взаимодействия тканевых жидкостей с факторами V, VII, X, Са 2+. Таким образом, первая фаза свертывания крови с участием ферментативных механизмов заканчивается образованием кровяного и тканевого тромбопластинов. Вторая фаза представляет собой активацию неактивного фермента плазмы протромбина (фактор II) и переход его в активный фактор тромбин. Этот процесс осуществляется под воздействием образовавшегося в первой фазе «полного» тромбопластина. В превращении протромбина в тромбин участвуют факторы V, VII, Са 2+, а также факторы 1 и 2 тромбоцитов. В третьей фазе происходит образование нерастворимого сгустка нитей фибрина из растворенного в плазме белка фибриногена (фактор I). Процесс превращения идет под влиянием тромбина с участием Са 2+ и факторов кровяных пластинок в два этапа. На первом, ферментативно—протеолитическом, этапе от фибриногена под влиянием тромбина отщепляются пептиды. Итогом этой реакции является образование промежуточного продукта профибрина — фибрин—мономера. На втором, полимеризационном, этапе молекулы фибрин—мономера взаимодействуют между собой, образуя нерастворимый сгусток фибрина. Полимеризация осуществляется в присутствии ионов Ca 2+ и XIII фактора (фибринстабилизирующего). В фибриновую сеть вовлекаются форменные элементы крови, формируется кровяной сгусток, который уменьшает или полностью предотвращает кровопотерю. Образование сгустка фибрина не является конечным этапом свертывания крови. Спустя некоторое время в результате сокращения нитей фибрина тромб начинает уплотняться, из него удаляется сыворотка.
 • Этот процесс называют ретракцией сгустка. Он происходит при участии тромбоцитов и Са 2+. Благодаря ретракции тромб плотнее закупоривает поврежденный сосуд и сближает края раны. • Одновременно с ретракцией сгустка, хотя и с меньшей скоростью, начинается постепенное ферментативное растворение образовавшегося фибрина — фибринолиз. Это расщепление происходит под влиянием фибринолизина (плазмина). В обычных условиях фибринолизин находится в плазме крови в неактивном состоянии в форме профибринолизина. Под влиянием естественных активаторов плазмы он превращается в активный фермент — фибринолизин. Высвободившийся фибринолизин разрывает пептидные связи фибрина, в результате чего фибрин растворяется. Активаторы профибринолизина возникают в плазме особенно интенсивно после усиленной мышечной работы, эмоций. Они также появляются после смерти организма, в результате чего через несколько часов кровь снова становится жидкой. • Усиление фибринолиза и укорочение времени свертывания крови при гипоксии, интенсивной мышечной работе, стрессе и других подобных состояниях связано с повышением тонуса симпатической нервной системы и, соответственно, выбросом в кровь катехоламинов. При этом посредством фактора Хагемана запускается механизм образования протромбиназы и фибринолиза, усиливается образование составных частей протромбина, а также происходит отрыв клеточных мембран, обладающих свойствами тромбопластина, от эндотелия. Последнее способствует резкому ускорению свертывания крови. • Ускорение свертываемости крови и усиление фибринолиза наблюдается также и при повышении тонуса парасимпатической нервной системы, равно как и при стимуляции блуждающего нерва, введении ацетилхолина, пилокарпина. В этом случае из эндотелия сердца и сосудов происходит выброс активаторов плазминогена и тромбопластина.
• Этот процесс называют ретракцией сгустка. Он происходит при участии тромбоцитов и Са 2+. Благодаря ретракции тромб плотнее закупоривает поврежденный сосуд и сближает края раны. • Одновременно с ретракцией сгустка, хотя и с меньшей скоростью, начинается постепенное ферментативное растворение образовавшегося фибрина — фибринолиз. Это расщепление происходит под влиянием фибринолизина (плазмина). В обычных условиях фибринолизин находится в плазме крови в неактивном состоянии в форме профибринолизина. Под влиянием естественных активаторов плазмы он превращается в активный фермент — фибринолизин. Высвободившийся фибринолизин разрывает пептидные связи фибрина, в результате чего фибрин растворяется. Активаторы профибринолизина возникают в плазме особенно интенсивно после усиленной мышечной работы, эмоций. Они также появляются после смерти организма, в результате чего через несколько часов кровь снова становится жидкой. • Усиление фибринолиза и укорочение времени свертывания крови при гипоксии, интенсивной мышечной работе, стрессе и других подобных состояниях связано с повышением тонуса симпатической нервной системы и, соответственно, выбросом в кровь катехоламинов. При этом посредством фактора Хагемана запускается механизм образования протромбиназы и фибринолиза, усиливается образование составных частей протромбина, а также происходит отрыв клеточных мембран, обладающих свойствами тромбопластина, от эндотелия. Последнее способствует резкому ускорению свертывания крови. • Ускорение свертываемости крови и усиление фибринолиза наблюдается также и при повышении тонуса парасимпатической нервной системы, равно как и при стимуляции блуждающего нерва, введении ацетилхолина, пилокарпина. В этом случае из эндотелия сердца и сосудов происходит выброс активаторов плазминогена и тромбопластина.
 • • Противосвертывающие механизмы Кровь в организме находится в жидком состоянии, хотя в ней содержатся все необходимые компоненты для свертывания. Это объясняется тем, что у животных и человека существуют специальные. Противосвертывающие механизмы, включающие целый ряд веществ. К их числу относятся антитромбопластин, являющийся ингибитором фактора XII и ингибитором превращения протромбина в тромбин. Из последних наиболее активным является гепарин. Он образуется в тучных клетках тканей и базофилах крови. Много гепарина содержится в печени, мышцах, легких. Гепарин обладает многообразным действием, тормозит превращение протромбина в тромбин, препятствует образованию тромбопластина, угнетает процесс образования фибрина. В эту же группу входят ингибитор фактора VII и ингибитор фактора X. Кроме того, в крови имеются вещества, разрушающие тромбин, — антитромбины. Они адсорбируют на своей поверхности образовавшийся тромбин, способствуют возникновению комплексов с гепарином, блокируют активность и ускоряют распад тромбина. В целом противосвертывающий механизм может быть кратко представлен в следующем виде. При небольших концентрациях тромбина в крови происходит его инактивация антитромбинами и гепарином плазмы, поглощение клетками мононуклеарной фагоцитарной системы. При быстром нарастании концентрации тромбина в крови этих механизмов уже недостаточно для предотвращения нарастающей угрозы тромбообразования и тогда включается следующая, более сложная — нейрогуморальная — противосвертывающая система. Повышенный уровень тромбина воспринимается хеморецепторами сосудистого русла и передается структурам продолговатого мозга. В результате в кровь рефлекторно выбрасываются гепарин и активаторы фибринолитического процесса. Свертывающая и противосвертывающая системы находятся в организме в постоянной взаимосвязи и взаимодействии, в результате чего кровь в сосудистом русле пребывает в жидком состоянии
• • Противосвертывающие механизмы Кровь в организме находится в жидком состоянии, хотя в ней содержатся все необходимые компоненты для свертывания. Это объясняется тем, что у животных и человека существуют специальные. Противосвертывающие механизмы, включающие целый ряд веществ. К их числу относятся антитромбопластин, являющийся ингибитором фактора XII и ингибитором превращения протромбина в тромбин. Из последних наиболее активным является гепарин. Он образуется в тучных клетках тканей и базофилах крови. Много гепарина содержится в печени, мышцах, легких. Гепарин обладает многообразным действием, тормозит превращение протромбина в тромбин, препятствует образованию тромбопластина, угнетает процесс образования фибрина. В эту же группу входят ингибитор фактора VII и ингибитор фактора X. Кроме того, в крови имеются вещества, разрушающие тромбин, — антитромбины. Они адсорбируют на своей поверхности образовавшийся тромбин, способствуют возникновению комплексов с гепарином, блокируют активность и ускоряют распад тромбина. В целом противосвертывающий механизм может быть кратко представлен в следующем виде. При небольших концентрациях тромбина в крови происходит его инактивация антитромбинами и гепарином плазмы, поглощение клетками мононуклеарной фагоцитарной системы. При быстром нарастании концентрации тромбина в крови этих механизмов уже недостаточно для предотвращения нарастающей угрозы тромбообразования и тогда включается следующая, более сложная — нейрогуморальная — противосвертывающая система. Повышенный уровень тромбина воспринимается хеморецепторами сосудистого русла и передается структурам продолговатого мозга. В результате в кровь рефлекторно выбрасываются гепарин и активаторы фибринолитического процесса. Свертывающая и противосвертывающая системы находятся в организме в постоянной взаимосвязи и взаимодействии, в результате чего кровь в сосудистом русле пребывает в жидком состоянии
 • Регуляция свертывания крови осуществляется посредством нейрогуморальных механизмов. Возбуждение симпатической нервной системы, возникающее при стрессовых ситуациях, страхе, боли, а также повышенная секреция адреналина мозговым слоем надпочечников резко ускоряют свертывание крови, вызывая состояние, называемое гиперкоагулемией. Тем самым организм в случае физического повреждения подготавливается к более быстрому тромбообразованию. • Основная роль в этом механизме принадлежит адреналину и норадреналину. Выбрасыва емый в кровоток адреналин запускает ряд тканевых и плазменных реакций. Это, во—первых, высвобождение из сосудистой стенки тромбопластина,
• Регуляция свертывания крови осуществляется посредством нейрогуморальных механизмов. Возбуждение симпатической нервной системы, возникающее при стрессовых ситуациях, страхе, боли, а также повышенная секреция адреналина мозговым слоем надпочечников резко ускоряют свертывание крови, вызывая состояние, называемое гиперкоагулемией. Тем самым организм в случае физического повреждения подготавливается к более быстрому тромбообразованию. • Основная роль в этом механизме принадлежит адреналину и норадреналину. Выбрасыва емый в кровоток адреналин запускает ряд тканевых и плазменных реакций. Это, во—первых, высвобождение из сосудистой стенки тромбопластина,
 • • • который быстро превращается в крови в протромбиназу, во—вторых, активация в крови фактора Хагемана, влияющего на образование кровяной протромбиназы в—третьих, стимуляция появления в крови тканевых липаз, которые расщепляют жиры и тем самым увеличивают количество жирных кислот и усиливают их тромбопластическую активность, в—четвертых, активация высвобождения фосфолипидов из эритроцитов и других форменных элементов крови. Совокупность этих реакций приводит в итоге к расходу факторов свертывания крови, поэтому с прекращением действия раздражителя активируется противосвертывающая система, действие которой направлено на замедление свертывания крови — гипокоагуляцию. В это время наблюдается усиление фибринолиза, приводящее к расщеплению избытка фибрина. Процесс свертывания крови может регулироваться условнорефлекторно через автономную нервную систему (рис. 7. 12) и эндокринные механизмы. Путем многократного сочетания условного раздражителя, например метронома, с болевым вырабатывается условный рефлекс на метроном. После этого включение одного лишь метронома будет вызывать гиперкоагуляцию. Процесс условнорефлекторной гиперкоагуляции также проходит в две фазы: рефлекторную и рефлекторно—гуморальную. На начальном этапе импульсы из ЦНС поступают к кроветворным органам и кровяным депо, что сопровождается резким выходом тромбоцитов из печени, селезенки, кожи и активацией плазменных факторов. В результате происходит быстрое образование тромбопластина. Затем включаются гуморальные механизмы. Они поддерживают и продолжают активацию свертывающей системы и одновременно снижают действие противосвертывающей системы. Значение условнорефлекторной гиперкоагуляции состоит в подготовке организма к защите от кровопотери.
• • • который быстро превращается в крови в протромбиназу, во—вторых, активация в крови фактора Хагемана, влияющего на образование кровяной протромбиназы в—третьих, стимуляция появления в крови тканевых липаз, которые расщепляют жиры и тем самым увеличивают количество жирных кислот и усиливают их тромбопластическую активность, в—четвертых, активация высвобождения фосфолипидов из эритроцитов и других форменных элементов крови. Совокупность этих реакций приводит в итоге к расходу факторов свертывания крови, поэтому с прекращением действия раздражителя активируется противосвертывающая система, действие которой направлено на замедление свертывания крови — гипокоагуляцию. В это время наблюдается усиление фибринолиза, приводящее к расщеплению избытка фибрина. Процесс свертывания крови может регулироваться условнорефлекторно через автономную нервную систему (рис. 7. 12) и эндокринные механизмы. Путем многократного сочетания условного раздражителя, например метронома, с болевым вырабатывается условный рефлекс на метроном. После этого включение одного лишь метронома будет вызывать гиперкоагуляцию. Процесс условнорефлекторной гиперкоагуляции также проходит в две фазы: рефлекторную и рефлекторно—гуморальную. На начальном этапе импульсы из ЦНС поступают к кроветворным органам и кровяным депо, что сопровождается резким выходом тромбоцитов из печени, селезенки, кожи и активацией плазменных факторов. В результате происходит быстрое образование тромбопластина. Затем включаются гуморальные механизмы. Они поддерживают и продолжают активацию свертывающей системы и одновременно снижают действие противосвертывающей системы. Значение условнорефлекторной гиперкоагуляции состоит в подготовке организма к защите от кровопотери.



