Клиническая биохимия ЭЛЕКТИВ ЛЕКЦИЯ 3 2012.ppt
- Количество слайдов: 92

ГБОУ ВПО УГМА Минздравсоцразвития РФ Кафедра биохимии Дисциплина : Клиническая биохимия Лекция 3 Клиническая энзимодиагностика. Регуляция и патология БО (МХО, МКО, ПОЛ). Факультет: ОП. 2 курс г. Екатеринбург, 2012

Аминотрансферазы Трансаминирование — реакция переноса α-аминогруппы с АК на αкетокислоту: образуются новая α-кетокислота и новая АК. Реакции катализируют аминотрансферазы, они легко обратимы: У человека найдено более 10 аминотрансфераз, локализуются они в цитоплазме и митохондриях клеток. В реакции трансаминирования вступают почти все АК, за исключением лизина, треонина и пролина Наиболее распространёнными аминотрансферазами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT). Биологическое значение трансаминирования Обеспечивают синтез и распад амино- и кетокислот, перераспределение аминного азота в тканях организма

Аспартатаминотрансфераза (АСТ, GOT) КФ 2. 6. 1. 1 Асп + α-КГ ↔ ЩУК + Глу Локализация по тканям: • • Нервная ткань Миокард Печень Скелетные мышцы Почки Легкие Поджелудочная железа Эритроциты Большинство тканей имеют минимум 2 изофермента АСТ, состоящих из 2 субъединиц: 1. м. АСТ (митохондриальная) разные субъединицы, движется к катоду, 91 к. Да 2. ц. АСТ (цитоплазматическая) одинаковые субъединицы, движется к аноду, 93 к. Да

Аланинаминотрансфераза (АЛТ, GTP) КФ 2. 6. 1. 2 Ала + α-КГ ↔ ПВК + Глу Локализация по тканям: • • Печень Миокард Скелетные мышцы Почки Поджелудочная железа Нервная ткань Легкие Эритроциты Большинство тканей имеют 2 изофермента АЛТ: 1. м. АЛТ (митохондриальная) мало, нестабильная 2. ц. АЛТ (цитоплазматическая)
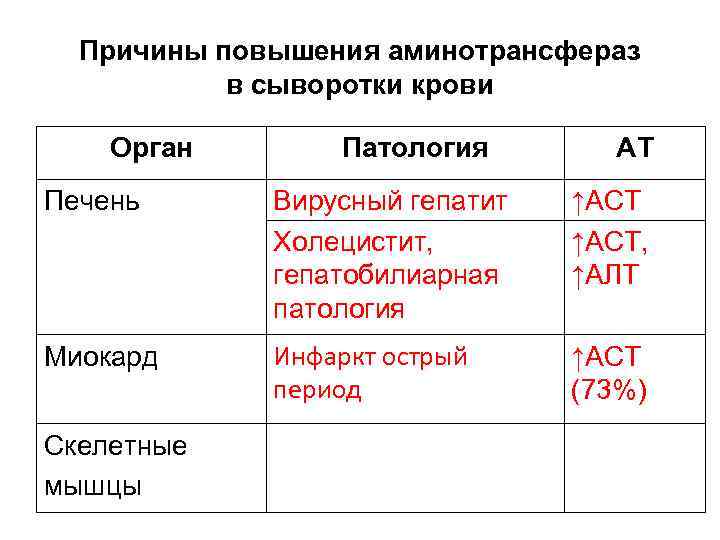
Причины повышения аминотрансфераз в сыворотки крови Орган Патология АТ Печень Вирусный гепатит Холецистит, гепатобилиарная патология ↑АСТ, ↑АЛТ Миокард Инфаркт острый период ↑АСТ (73%) Скелетные мышцы
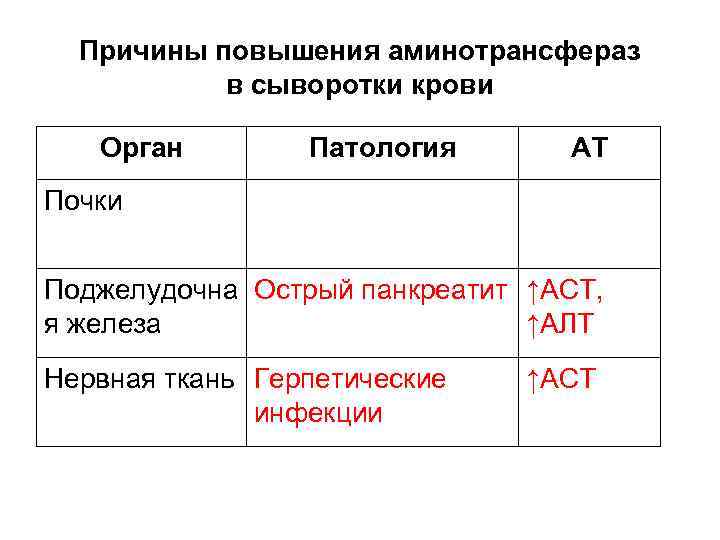
Причины повышения аминотрансфераз в сыворотки крови Орган Патология АТ Почки Поджелудочна Острый панкреатит ↑АСТ, я железа ↑АЛТ Нервная ткань Герпетические инфекции ↑АСТ
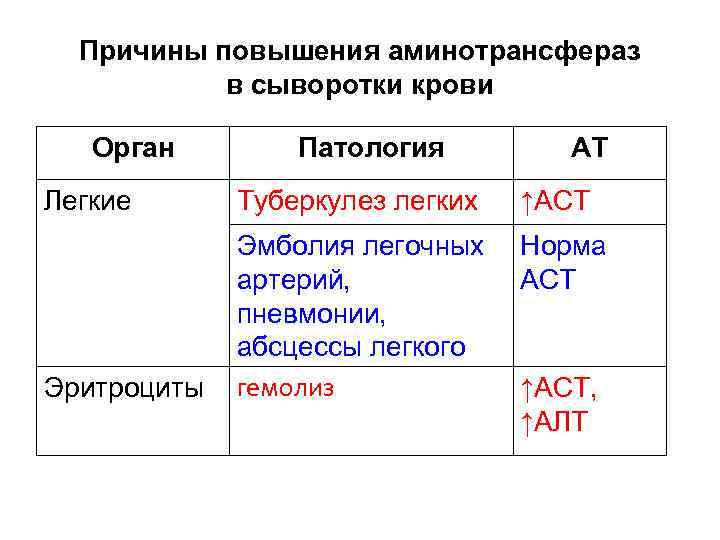
Причины повышения аминотрансфераз в сыворотки крови Орган Патология АТ Легкие Туберкулез легких ↑АСТ Норма АСТ Эритроциты Эмболия легочных артерий, пневмонии, абсцессы легкого гемолиз ↑АСТ, ↑АЛТ

Факторы, повышающие активность АТ в сыворотке крови • • Паразитарные инфекции Псориаз Ожоги Пересадка органов Опухоли различной локализации Острый лейкоз (АСТ) Белковая диета Пиридоксальфосфат (В 6)

Факторы, понижающие активность АТ в сыворотке крови • Малярия (АСТ) • Беременность (АСТ)

Вещества, повышающие активность АТ в сыворотке крови • Гепатотоксичные препараты (сульфаниламиды, барбитураты, антибиотики, опиаты, пиридоксин, пропионлактон, азатиоприн, Циклопорины, Аспирин, Индометацин, Линкомицин) • Стероидные препараты (Пероральные контрацептивы, тестостерон, прогестерон) • Избыток железа, меди

Биологический материал для исследования АТ 1. Свежая сыворотка крови, с минимальным стазом 2. Плазма крови с гепарином, ЭДТА, оксалатом, цитратом 3. Пиридоксаль-5 -фосфат повышает активность АТ 4. Гемолиз мешает определению
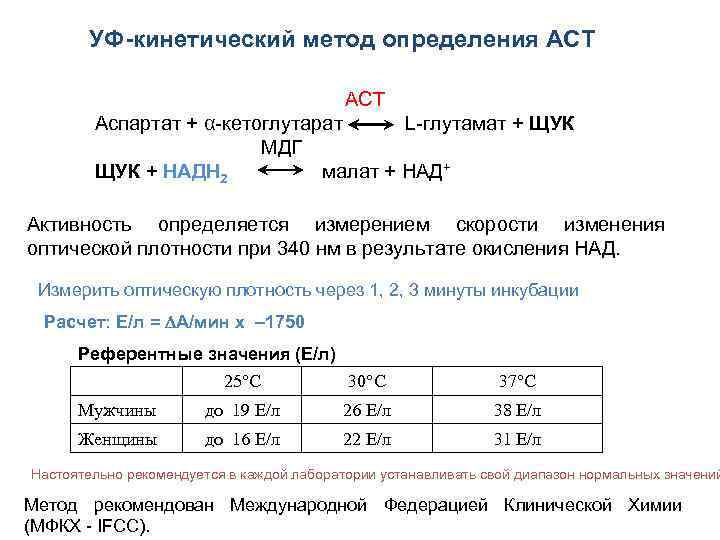
УФ-кинетический метод определения АСТ АСТ Аспартат + α-кетоглутарат L-глутамат + ЩУК МДГ ЩУК + НАДН 2 малат + НАД+ Активность определяется измерением скорости изменения оптической плотности при 340 нм в результате окисления НАД. Измерить оптическую плотность через 1, 2, 3 минуты инкубации Расчет: Е/л = А/мин х – 1750 Референтные значения (Е/л) 25°C 30°C 37°C Мужчины до 19 Е/л 26 Е/л 38 Е/л Женщины до 16 Е/л 22 Е/л 31 Е/л Настоятельно рекомендуется в каждой лаборатории устанавливать свой диапазон нормальных значений Метод рекомендован Международной Федерацией Клинической Химии (МФКХ - IFCC).
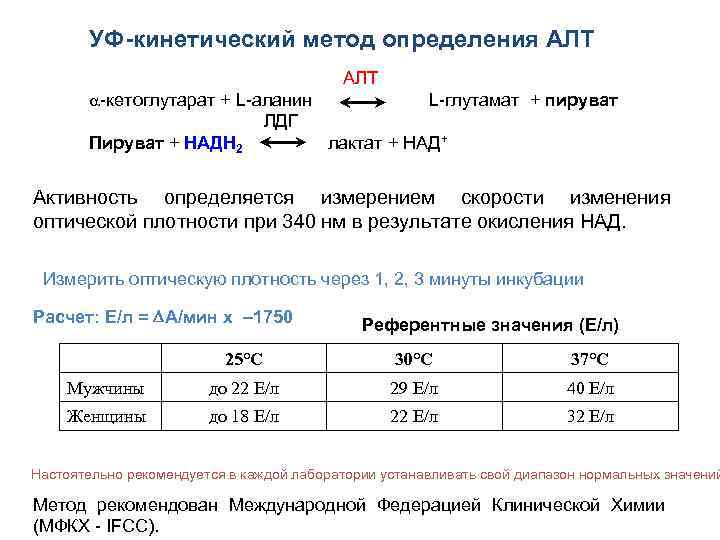
УФ-кинетический метод определения АЛТ АЛТ -кетоглутарат + L-аланин L-глутамат + пируват ЛДГ Пируват + НАДН 2 лактат + НАД+ Активность определяется измерением скорости изменения оптической плотности при 340 нм в результате окисления НАД. Измерить оптическую плотность через 1, 2, 3 минуты инкубации Расчет: Е/л = А/мин х – 1750 Референтные значения (Е/л) 25°C 30°C 37°C Мужчины до 22 Е/л 29 Е/л 40 Е/л Женщины до 18 Е/л 22 Е/л 32 Е/л Настоятельно рекомендуется в каждой лаборатории устанавливать свой диапазон нормальных значений Метод рекомендован Международной Федерацией Клинической Химии (МФКХ - IFCC).

α-Амилаза КФ 3. 2. 1. 1 Гидролизует внутренние связи 1 -4 α-гликозидные связи в крахмале, гликогене и других полимеров глюкозы: α-Амилаза Основные источники: поджелудочная железа, слюнные железы. Имеет 2 семейства с многочисленными изоформами В 1 хромосоме с 1 локуса гена Amy копируется слюнной тип амилазы (С) (имеет две изоформы с углеводами (57 к. Да) и без 55 к. Да, р. Н=5, 5 -6, 5), со 2 локуса гена Amy копируется панкреатический тип амилазы (П) (нет углеводов, 53 к. Да, р. Н=5, 7 -7, 0) Биологическое значение Гидролиз полисахаридов

С-амилаза обнаружена в: • • ткани фоллопиевых труб кисте яичников женском молоке раневой жидкости

Причины повышения α-амилазы в сыворотки крови Орган Патология α-амилаза сыворотки крови α-амилаза мочи Поджелуд Острый 3 -12 часов ↑, N 6 -10 часов ↑, N очная панкреатит и 20 -30 часов ↑ ↑ ↑, N 3 сут до нормы железа др 4 сут до нормы заболевания Острый панкреатит П-изофермент ↑ Хронический П-изофермент ↓ панкреатит Слюнные железы П-изофермент ↑ П-изофермент ↓

Факторы, повышающие активность α-амилазы в сыворотке крови • • • Кишечная непроходимость Заболевания желчных путей Аппендицит Паротит Внематочная беременность Почечная недостаточность (необходима оценка клиренса) • Макроамилаземия (комплексы амилазы с иммуноглобулинами сыворотки крови не проходят почечный фильтр) у 1 -2% населения значительный длительный высокий уровень амилазы.

Методы определения α-амилазы В клинике определяют более 100 лет, создано более 200 методов определения, которые объединены в 3 типа: 1. Амилокластические (по распаду крахмала, например с йодом) 2. Глюкокластические (определение продукта) 3. Хромогенные (по отщеплению хромогена от полисахарида) В настоящее время для амилазы не разработан не только референсный метод определения, но даже оптимальный метод. Отсутствуют унифицированные субстраты, стандарты

Биологический материал для исследования амилазы 1. Сыворотка, гепаринизированная плазма или моча. 2. Нельзя использовать антикоагулянты, связывающие кальций (ЭДТА, цитрат и др). 3. Отделение сыворотки должно производиться как можно раньше 4. В сыворотке фермент стабилен месяц при 4 С. , устойчив к замораживанию оттаиванию. 5. В моче при р. Н<5 фермент инактивируется 6. Пот и слюна содержат альфа-амилазу. Для предупреждения загрязнения проб не всасывайте жидкости в пипетки ртом и избегайте контакта пробы, реагента и наконечника пипетки с кожей
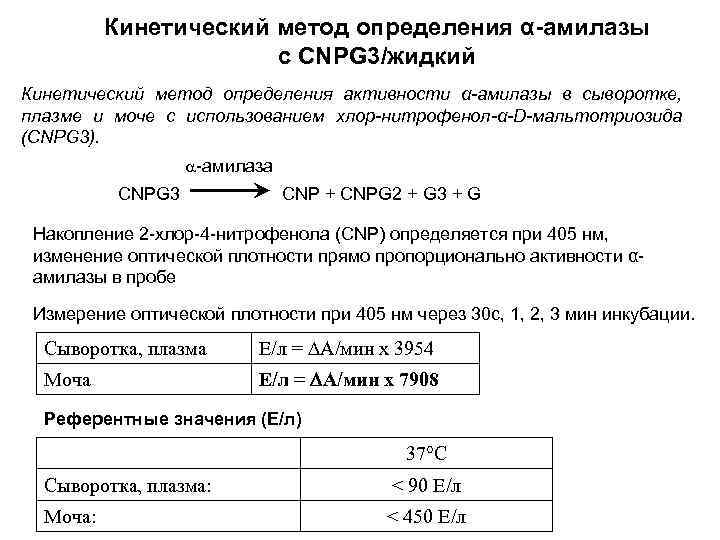
Кинетический метод определения α-амилазы с CNPG 3/жидкий Кинетический метод определения активности α-амилазы в сыворотке, плазме и моче с использованием хлор-нитрофенол-α-D-мальтотриозида (CNPG 3). -амилаза CNPG 3 CNP + CNPG 2 + G 3 + G Накопление 2 -хлор-4 -нитрофенола (CNP) определяется при 405 нм, изменение оптической плотности прямо пропорционально активности αамилазы в пробе Измерение оптической плотности при 405 нм через 30 с, 1, 2, 3 мин инкубации. Сыворотка, плазма Е/л = А/мин х 3954 Моча Е/л = А/мин х 7908 Референтные значения (Е/л) 37°С Сыворотка, плазма: < 90 Е/л Моча: < 450 Е/л

γ-Глутамилтранспептидаза (ГГТ) КФ 3. 2. 2. 2 Функция: Перенос γ-глутамила на АК или пептид. ГГТ - одноцепочечный пептид 90 к. Да, гидрофобной частью прикреплен к мембране ГГТ γ-глутамильный цикл переносит некоторые нейтральные аминокислоты (фенилаланин, лейцин) и аминокислоты с катионными радикалами (лизин) в кишечнике, почках, мозге.

ГГТ. Локализация по тканям ГГТ содержится в эпителиальных клетках • • • Почек Печени Поджелудочной железы Тонкого кишечника Других органов • Активность ГГТ не меняется с возрастом • Нет в скелетных мышцах и миокарде • Содержание в моче ГГТ выше чем в сыворотке (почечная ГГТ)
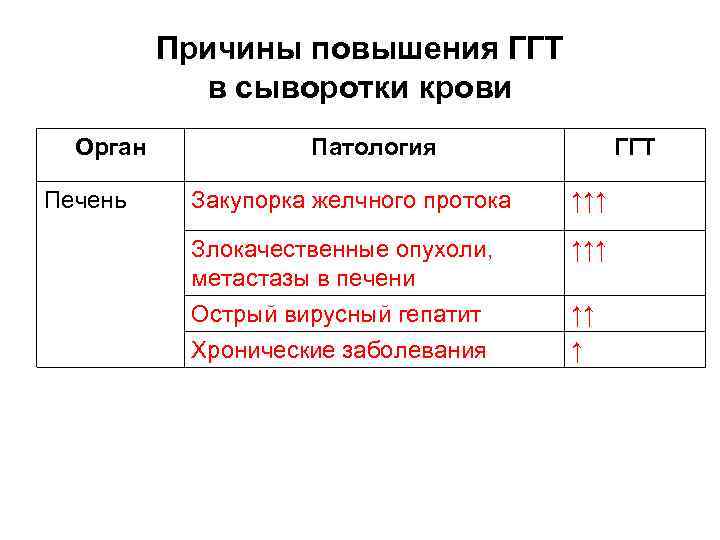
Причины повышения ГГТ в сыворотки крови Орган Печень Патология ГГТ Закупорка желчного протока ↑↑↑ Злокачественные опухоли, метастазы в печени Острый вирусный гепатит Хронические заболевания ↑↑↑ ↑↑ ↑

Факторы, повышающие активность ГГТ в сыворотке крови • Новорожденные ↑↑ (в 8 -10 раз), • Недоношенные ↑↑↑ • У детей в 7 -9 мес на 20 -50% выше взрослых • Гепатотоксичные факторы (алкоголь, лекарства) ↑ • Приступы стенокардии (в 50% случаев) • Недостаточность кровоснабжения, коронарная недостаточность

Факторы, снижающие активность ГГТ в сыворотке крови • Снижение в ходе беременности

Биологический материал для исследования ГГТ • Только сыворотка. Не использовать плазму. Избегать гемолиза! • Активность фермента не уменьшается в течение 1 недели как при +4°С так и при 2025°С.
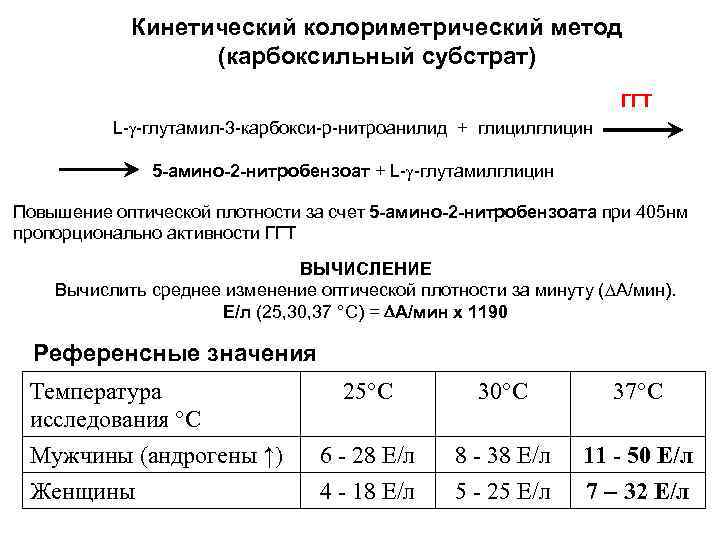
Кинетический колориметрический метод (карбоксильный субстрат) ГГТ L- -глутамил-3 -карбокси-р-нитроанилид + глицилглицин 5 -амино-2 -нитробензоат + L- -глутамилглицин Повышение оптической плотности за счет 5 -амино-2 -нитробензоата при 405 нм пропорционально активности ГГТ ВЫЧИСЛЕНИЕ Вычислить среднее изменение оптической плотности за минуту ( А/мин). E/л (25, 30, 37 °C) = А/мин х 1190 Референсные значения Температура исследования °С Мужчины (андрогены ↑) Женщины 25°С 30°С 37°С 6 - 28 Е/л 4 - 18 Е/л 8 - 38 Е/л 5 - 25 Е/л 11 - 50 Е/л 7 – 32 Е/л

Креатинкиназа КК, (креатинфосфокиназа) КФК КФ 2. 7. 3. 2 Функция: перенос макроэргической связи между АТФ и креатином КК АТФ + креатин АДФ + креатинфосфат Фермент имеет 3 основные изоформы: состоят из 2 субъединиц М и В КК ММ, КК МВ, КК ВВ (движутся к аноду) Иногда встречаются редкие изоформы КК, движущийся к катоду Существует КК: • Митохондриальная АТФ + креатин → АДФ + креатинфосфат • Цитоплазматическая АДФ + креатинфосфат → АТФ + креатин

Локализация по тканям КК • • Скелетная мускулатура (КК ММ) Миокард (КК МВ) Нервная ткань (ВВ), гладкие мышцы вен, аорты Мышцы языка Мышцы диафрагмы Почки Легкие печень • У плода 16 недель в мышечной ткани преобладает КК МВ • Гипертрофия миокарда: растет КК МВ, КК ВВ, уменьшается КК ММ
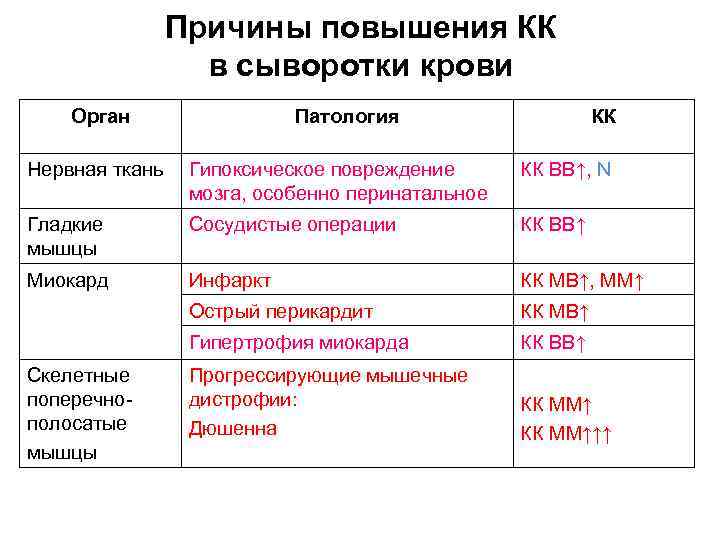
Причины повышения КК в сыворотки крови Орган Патология КК Нервная ткань Гипоксическое повреждение мозга, особенно перинатальное КК ВВ↑, N Гладкие мышцы Сосудистые операции КК ВВ↑ Миокард Инфаркт КК МВ↑, ММ↑ Острый перикардит КК МВ↑ Гипертрофия миокарда КК ВВ↑ Прогрессирующие мышечные дистрофии: Дюшенна КК ММ↑↑↑ Скелетные поперечнополосатые мышцы

Факторы, способные повысить активность КК в сыворотке крови • • • Травма Переохлаждение, перегрев Интоксикация бактериальная Голодание Дегидратация Поражение электрическим током

Факторы, способные повысить активность КК ММ в сыворотке крови • • • Дерматомиозит Полимиозит Гипотериоз После физической нагрузки После внутримышечных инъекций После хирургических операций

Факторы, способные незначительно повысить активность КК МВ в сыворотке крови • • • Недостаточность кровообращения Катетеризация сердца, Аритмии Кардиогенный шок гипотония Отек легких, Травма грудной клетки Шок при анемии, гиперкапнии, гипоксемии Лактоацидоз Алкогольная интоксикация Кровотечение ЖКТ Травматические эпилепсии

Факторы, способные повысить активность КК ВВ в сыворотке крови • • • Рак предстательной железы (метастазы КК ВВ↑↑↑) Мелкоклеточный рак легкого Аденокарцинома желудка Лейкозы Хроническая почечная недостаточность Передозировка миорелаксантов

Биологический материал для исследования КК • Сыворотка, только гепаринизированная плазма, спиномозговая и амниотическая жидкость • Активность КФК в сыворотке уменьшается на 10% в течение 1 дня при 2 -8°С и в течение 1 часа при 15 -25°С. • Рекомендуется исследовать пробы сразу после их сбора

КРЕАТИНКИНАЗА (Creatine Kinase (CK NAC)) УФ-кинетический метод КФК Креатинфосфат + АДФ креатин + АТФ гексокиназа АТФ + Глюкоза глюкозо-6 -фосфат + АДФ Г-6 Ф-ДГ Глюкозо-6 - фосфат + НАДФ+ 6 -Фосфоглюконат + НАДФН 2 Скорость образования НАДФН 2, измеряемая при 340 нм, прямо пропорциональна активности КФК Вычислить изменение оптической плотности за минуту: А/мин. Расчет (Е/л)= А/мин х 9003 Референсные значения Температура исследования Мужчины Женщины 25°C 10 -80 Е/л 10 -70 Е/л 30°C 15 -130 Е/л 15 -110 Е/л 37°C 24 -195 Е/л 24 -170 Е/л

Лактатдегидрогеназа (ЛДГ, LDH) КФ 1. 1. 1. 27 Функция: окислительно-восстановительные реакции гликолиза: ЛДГ содержит цинк, состоит из 4 -х субъединиц 2 типов М (muscle) и Н (heart), которые в разных комбинациях образуют 5 изоформ Н (heart) 330 АК, 35 к. Да, в составе преобладают дикарбоновые АК М (muscle) 330 АК, 35 к. Да, в составе преобладают диаминомонокарбоновые АК
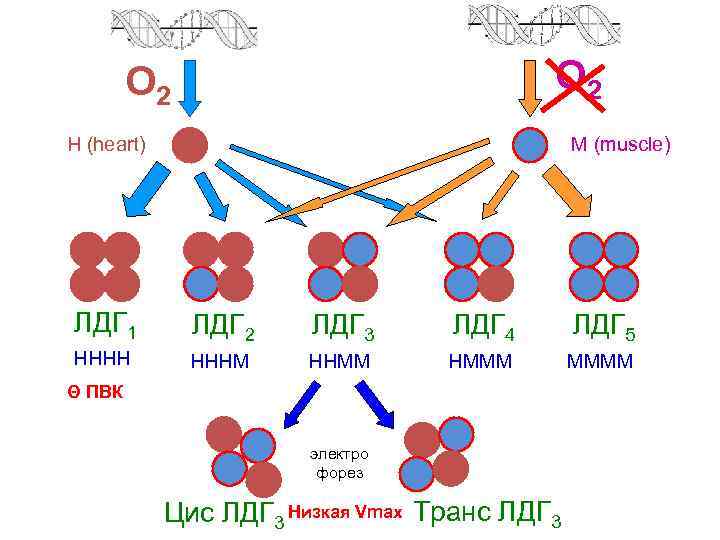
О 2 Н (heart) ЛДГ 1 НННН М (muscle) ЛДГ 2 НННМ ЛДГ 3 ННММ ЛДГ 4 НМММ Θ ПВК электро форез Цис ЛДГ 3 Низкая Vmax Транс ЛДГ 3 ЛДГ 5 ММММ

Локализация по тканям ЛДГ Присутствует во всех тканях! • • • Почки Скелетная мускулатура Миокард Поджелудочная железа Печень селезенка Плацента Эритроциты, Тромбоциты Лейкоциты
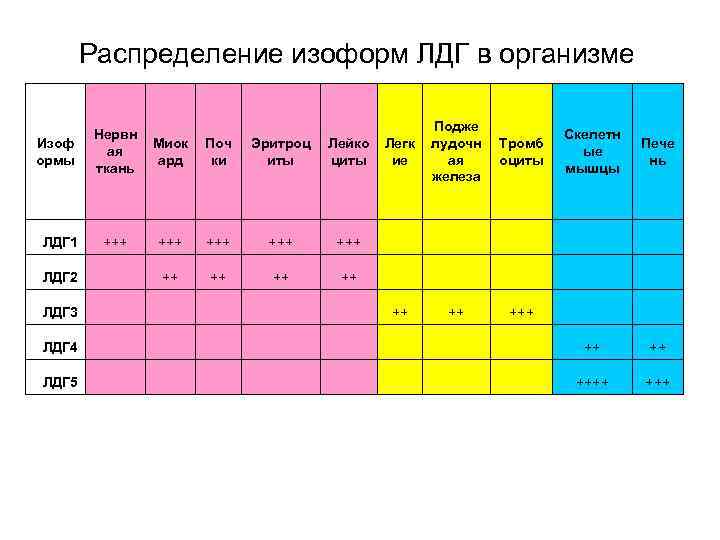
Распределение изоформ ЛДГ в организме Легк ие Подже лудочн ая железа Тромб оциты Скелетн ые мышцы Пече нь +++ ++ ++ +++ ++ ++ ++++ Нервн ая ткань Миок ард Поч ки Эритроц иты Лейко циты ЛДГ 1 +++ +++ ЛДГ 2 ++ ++ ЛДГ 3 ЛДГ 4 ЛДГ 5 Изоф ормы
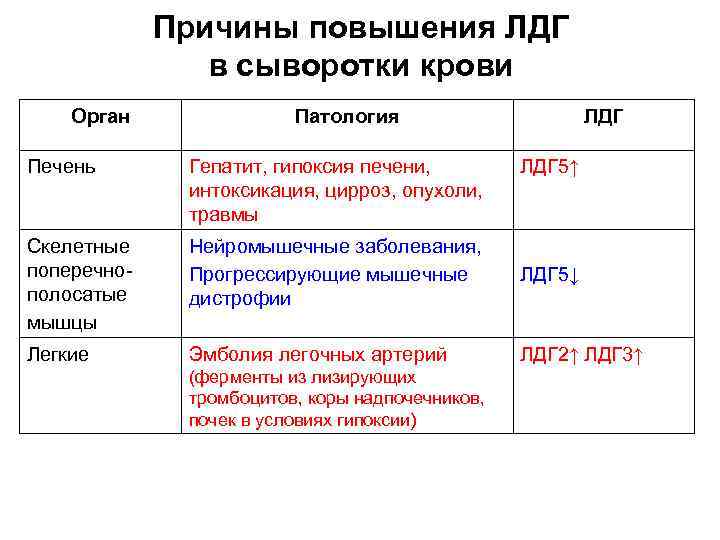
Причины повышения ЛДГ в сыворотки крови Орган Патология ЛДГ Печень Гепатит, гипоксия печени, интоксикация, цирроз, опухоли, травмы Скелетные поперечнополосатые мышцы Нейромышечные заболевания, Прогрессирующие мышечные дистрофии ЛДГ 5↓ Легкие Эмболия легочных артерий ЛДГ 2↑ ЛДГ 3↑ (ферменты из лизирующих тромбоцитов, коры надпочечников, почек в условиях гипоксии) ЛДГ 5↑
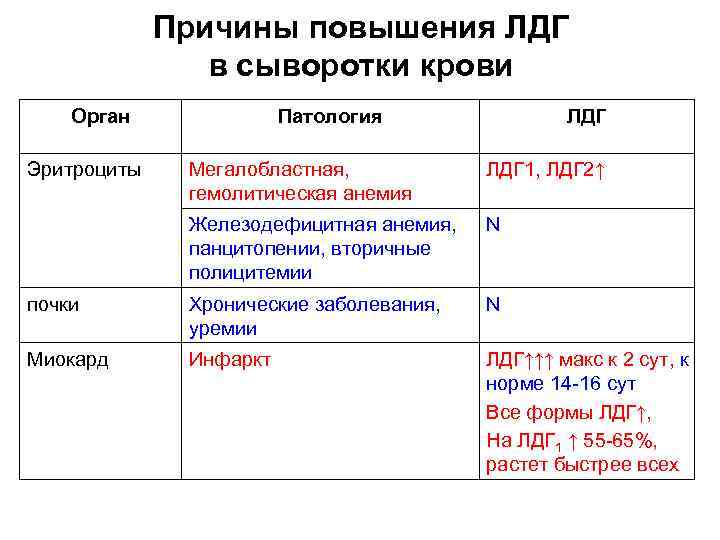
Причины повышения ЛДГ в сыворотки крови Орган Эритроциты Патология ЛДГ Мегалобластная, гемолитическая анемия ЛДГ 1, ЛДГ 2↑ Железодефицитная анемия, панцитопении, вторичные полицитемии N почки Хронические заболевания, уремии N Миокард Инфаркт ЛДГ↑↑↑ макс к 2 сут, к норме 14 -16 сут Все формы ЛДГ↑, На ЛДГ 1 ↑ 55 -65%, растет быстрее всех

Факторы, способные повысить активность ЛДГ в сыворотке крови • • • Адреналин и норадреналин (ЛДГ 1 ↑↑, ЛДГ 2 ↑↑) Анаболические стероиды Этанол Лекарства (клофибрат, кофеин, сульфаниламиды) Опухоли (некоторые типы опухолей мозга и половых органов, тестикулярные) ЛДГ 1 ↑ • Опухоли (лейкоз, злокачественная лимфома, нейробластома, феохромоцитома, полости рта, рак бронхов, некоторые типы опухолей мозга) ЛДГ 2 ↑, ЛДГ 3↑, ЛДГ 4↑ • Опухоли (предстательной железы, матки, молочных желез, желудка, толстой кишки, мочевого пузыря, некоторые типы опухолей мозга) ЛДГ 4 ↑, ЛДГ 5↑

Факторы, способные снизить активность ЛДГ в сыворотке крови • Большие дозы тироксина подавляют синтез ЛДГ, особенно М субъединицы • Эффективное лечение онкологических заболеваний (нормализация изоформ) • Редко в крови здоровых лиц активность ЛДГ может снижаться термозависимым ингибитором (Ig. G, Ig. A, Ig. M) ~↓ 2 раза. • Генетические дефекты синтеза ЛДГ.

ЛДГ 6 • • У тяжелобольных пациентов часто в терминальном состоянии в сыворотке крови методом электрофореза выявляется новая фракция ЛДГ близкая в ЛДГ 5. Появляется ЛДГ 6 при выраженном ацидозе, гипотонии, сепсисе. Обнаруживается во многих тканях: печень, скелетные мышцы, почки, селезенка, надпочечники Нет в миокарде!

Биологический материал для исследования ЛДГ • Сыворотка. Стабильность – в течение 48 часов при 2 -8°С.

Лактатдегидрогеназа (ЛДГ, LDH). ЛДГ УФ-кинетический метод ПВК + НАДН 2 Лактат + НАД+ Скорость поглощения НАДН 2 при 340 нм пропорциональна активности ЛДГ в пробе ВЫЧИСЛЕНИЕ Вычислить среднее изменение оптической плотности через 1, 2, 3 минуты ( А/мин). E/л (25, 30, 37 °C) = А/мин х – 4925 Референсные нормы 25°C 120 -240 Е/л 30°C 160 -320 Е/л 37°C 230 -460 Е/л "Оптимизированный метод" согласно рекомендациям Международного комитета клинической химии (IFCC).

МХО • • • 1. ОСНОВНОЙ ОБМЕН 2. РАЗОБЩИТЕЛИ 3. БЛОКАТОРЫ 4. ГИПОКСИЯ 5. ГИПЕРОКСИЯ 6. КОРРЕКТОРЫ МХО (ФАРМПРЕПАРАТЫ КИСЛОРОД, КАРБОГЕН, ЦИТОХРОМ С, АТФ (? ) ).

Основной обмен — - показатель интенсивности обмена веществ и энергии в организме; выражается количеством энергии, необходимой для поддержания жизни в состоянии полного физического и психического покоя, натощак, в условиях теплового комфорта. Отражает энергетические траты организма, обеспечивающие постоянную деятельность органов и тканей. Методы измерения 1. Манометрия (поглощение кислорода) 2. Колориметрия (выделение тепла)
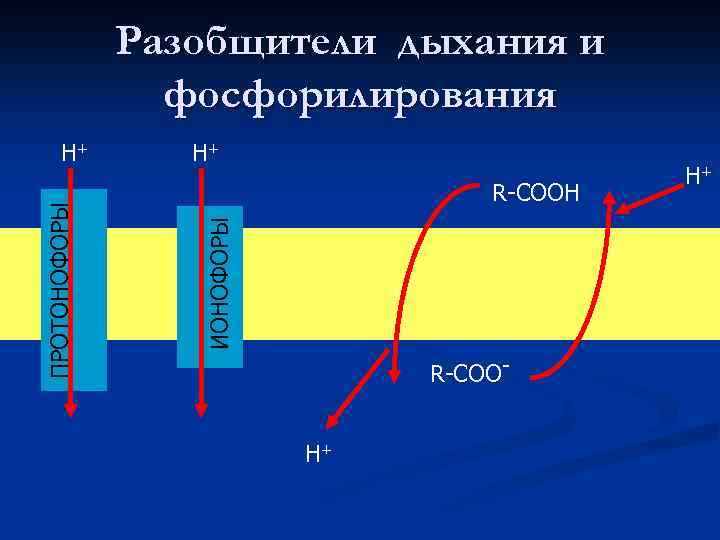
Разобщители дыхания и фосфорилирования Н+ R-СООН ИОНОФОРЫ ПРОТОНОФОРЫ Н+ R-СООН+ Н+

2, 4 -Динитрофенол • 2, 4 -динитрофенол является классическим разобщителем окислительного фосфорилирования. При действии на митохондрии стимулирует их дыхание, но ингибирует сопряженное с ним фосфорилирование, т. е. синтез АТФ из АДФ и фосфата.

РОТЕНОН специфический ингибитор тканевого дыхания, блокирующий перенос электронов от восстановленной формы никотинамидадениндинуклеотида (НАДН) к цитохрому b, на чем основано его инсектицидное действие.

Коэффициент фосфорилирования n Обмен АТФ-АДФ стремится нейтрализовать мембранный потенциал. 25% общей энергии переноса электронов затрачивается на этот процесс. Соотношение между выбросом протонов из матрикса митохондрий и возврат их по протонным каналам не приводит к синтезу АТФ в стехиометрическом соотношении. Поэтому нельзя однозначно ответить на вопрос, сколько молекул АТФ образуется при окислении цитоплазматической молекулы НАД·Н митохондриями эукариотических клеток.

Современные данные n прежние значения коэффициента Р/O равные 3 и 2, завышены, более реальными являются n Р/O = 2, 5 для полной n и Р/O = 1, 5 для укороченной дыхательной цепи.

• СХЕМА ПАТОХИМИИ ГИПОКСИИ (НА ДОСКЕ)

• СХЕМА ПАТОХИМИИ ГИПЕРОКСИИ (НА ДОСКЕ)

МКО • ТРАДИЦИОННЫЕ И СОВРЕМЕННЫЕ ЛАБОРАТОРНЫЕ ТЕСТЫ • ФАРМПРЕПАРАТЫ – АКТИВАТОРЫ (ФЕНОБАРБИТАЛ)

• В отношении метаболизма лекарственных средств - две группы - лиц с высокой (большинство людей) и низкой скоростью МК метаболизма. • Изофермент IID 6 цитохрома Р 450

• разрушают цитохром Р 450: ксикаин, совкаин, бенкаин, индерал • индуцируюn синтез ферментативных белков печени с участием НАДФ. Н 2 -цитохром Р 450 -редуктазы: гексобарбитал, фенобарбитал, пентобарбитал, фенилбутазон, кофеин, этанол, никотин, бутадион, нейролептики, амидопирин, хлорциклизин, димедрол, мепробамат, трициклические антидепрессанты

Методы исследования МКО • Получение с помощью ультрацентрифугирования высокоочищенных микросомальных мембран. • Одномерный и двумерный электрофорез. • Определение функциональной активности цитохромов Р 450 спектральными и флуорометрическими методами.

Регуляция и патология ПОЛ • АОА – антиокислительная (=антиоксидантная) активность – способность хим. в –в тормозить процессы ПОЛ • АРА – антирадикальная активность - способность хим. в –в связывать свободные радикалы (в молекулы, → ↓ ПОЛ) • Восстановительная активность в-в в целом = АОА • Прооксидантная активность- способность хим. в –в активировать процессы ПОЛ = • Окислительная активность -

Антиоксидантная защита (АОЗ) классификация • 1. Неферментативная 2 а. Водорастворимые низкомолекулярные АО (витамин С аскорбат) 2 б. Липидорастворимые низкомолекулярные АО (витамин Е токоферол) • 2. Ферментативная
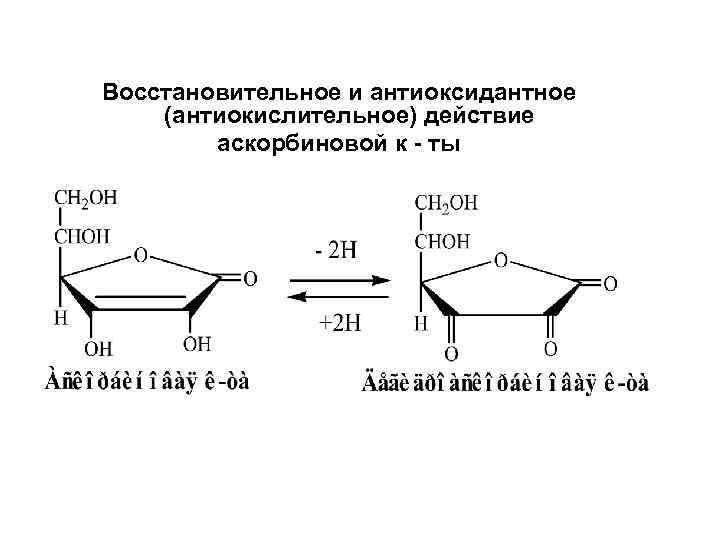
Восстановительное и антиоксидантное (антиокислительное) действие аскорбиновой к - ты
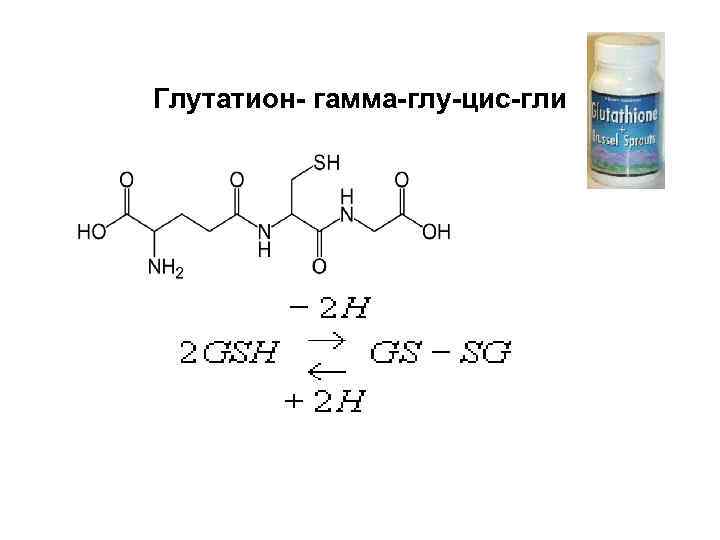
Глутатион- гамма-глу-цис-гли
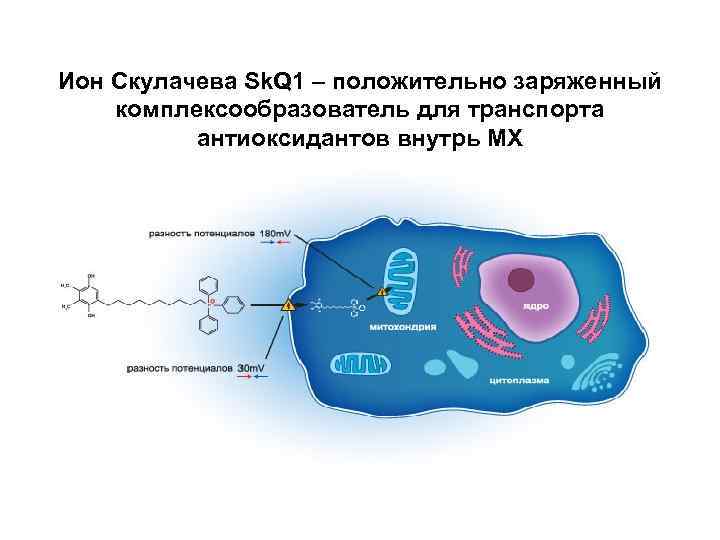
Ион Скулачева Sk. Q 1 – положительно заряженный комплексообразователь для транспорта антиоксидантов внутрь МХ
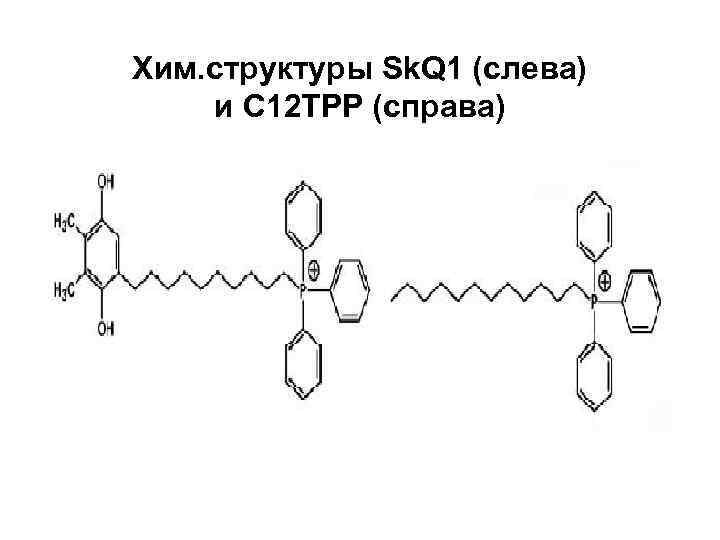
Хим. структуры Sk. Q 1 (слева) и С 12 ТРР (справа)

Препарат Sk. Q 1 - (ион Скулачева) - замедляет развитие признаков старения у мышей, в т. ч. продлевает циклическую эстральную функцию, замедляет развитие остеопороза, поседение • Препарат Sk. Q 1 ( «Ветомитин» ) предназначен для лечения глазных болезней – ретинопатий, врожденной дисплазии, дегенерации сетчатки у животных.

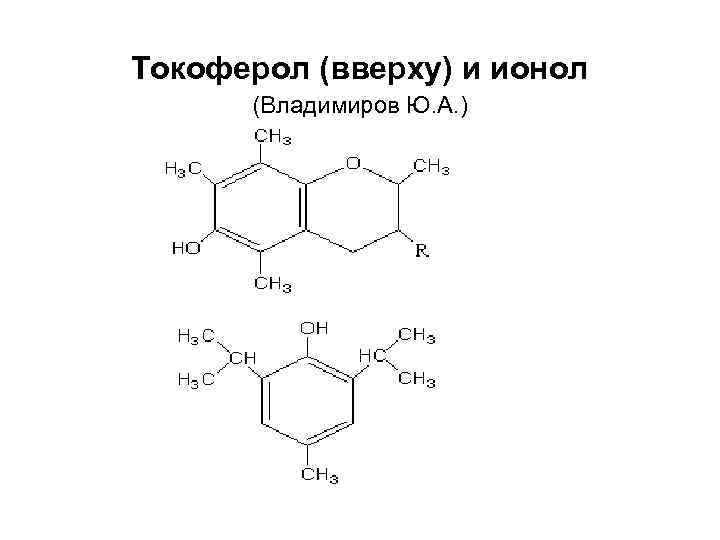
Токоферол (вверху) и ионол (Владимиров Ю. А. )
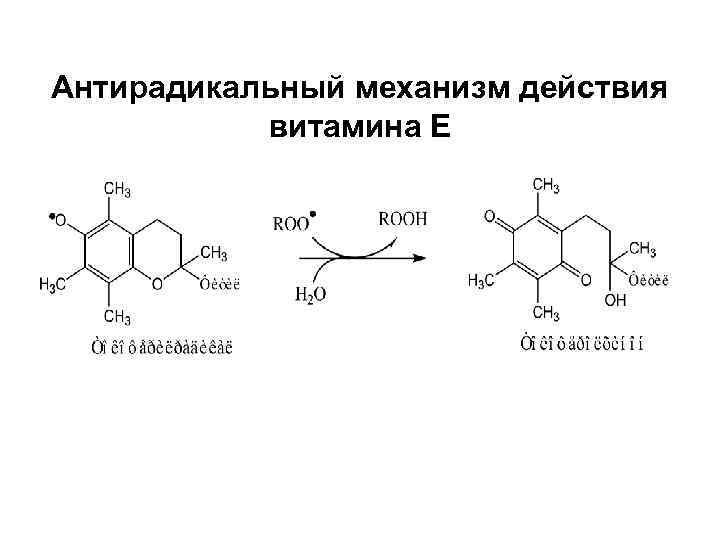
Антирадикальный механизм действия витамина Е
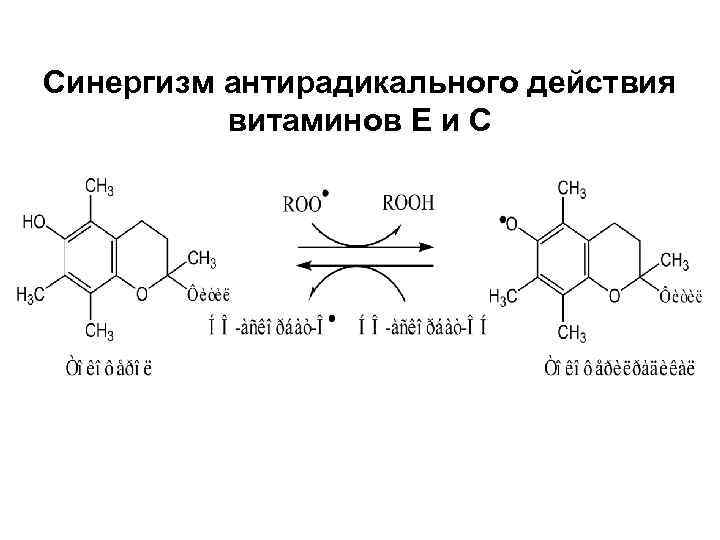
Синергизм антирадикального действия витаминов Е и С
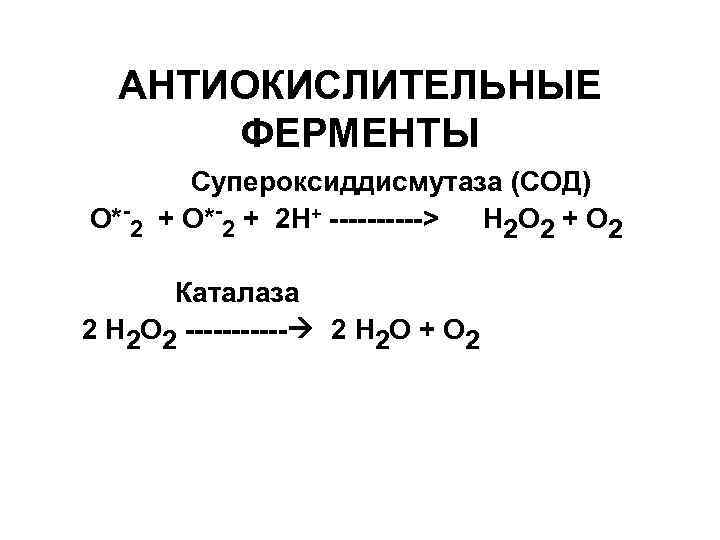
АНТИОКИСЛИТЕЛЬНЫЕ ФЕРМЕНТЫ Супероксиддисмутаза (СОД) О*-2 + 2 Н+ -----> Н 2 О 2 + О 2 Каталаза 2 Н 2 О 2 ------ 2 Н 2 О + О 2

Пероксидаза Н 2 О 2 + НО-S-ОН -----> 2 Н 2 О + О=S=О, S – субстрат окисления Глутатионпероксидаза (Se ) 2 GSH+ROOH -------> GSSG + ROH+ Н 2 О Глутатионредуктаза GSSG + НАДФН + Н+ ---- 2 GSH + НАДФ+ -------------------------------Где, GSSG –глутатион окисленный GSH – глутатион восстановленный


Фосфолипаза А 2 в мембране отщепляет от фосфолипидов окисленные жирные кислоты ROOH → разрушаются гидроперекиси липидов → предотвращается разветвление цепей окисления → ↓ПОЛ



Антиоксиданты крови и цитоплазмы • Церулоплазмин -окисляет Fe 2+ до Fe 3+ молекулярным кислородом • Апо-белок трансферрина связывает Fe 3+ • Ферритин - окисляет Fe 2+ и депонирует Fe 3+ • Карнозин - связывает Fe 2+

СИНДРОМ ЛИПИДНОЙ ПЕРОКСИДАЦИИ - активация ПОЛ при неизменном или сниженном уровне АОА, которые сопровождаются «выгоранием» ФЛ мембран, повышением их проницаемости и разрушением, ингибированием ферментов, нарушением работы ДНК, что ведет подавлением клеточной пролиферации, повышению гемолиза эритроцитов, ускорению темпа старения и гибели организма

Синдром липидной пероксидации N ПОЛ ----- → НОРМА N АОА ↑ПОЛ ------N АОА → ПАТОЛОГИЯ ↑ N ПОЛ или ПОЛ ------------ ↓АОА → ПАТОЛОГИЯ
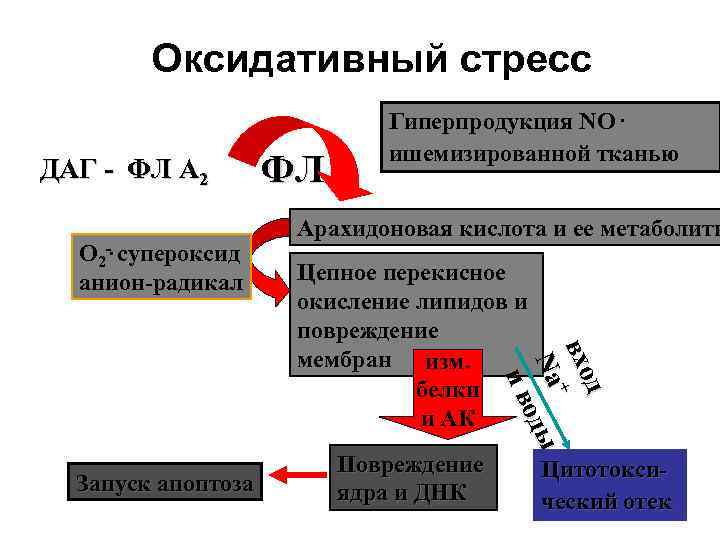
Оксидативный стресс ДАГ - ФЛ A 2 О 2 -. супероксид анион-радикал Арахидоновая кислота и ее метаболиты Цепное перекисное окисление липидов и повреждение мембран изм. белки и АК Повреждение ядра и ДНК д д вхо + Na оды ив ив Запуск апоптоза ФЛ Гиперпродукция NO. ишемизированной тканью Цитотоксический отек

Лабораторные показатели ПОЛ • • • МДА –малоновый диальдегид ДК – диеновые конъюгаты ГП – гидроперекиси ХЛ – хемилюминесценция Шиффовы основания

Люминометр - фотометр Lucy 3 (Anthos Labtec Instruments) США и анализатор АОА

Лабораторные показатели АОА • Активность антиокислительных ферментов • Витамины С, Е, А • Мочевая кислота • Глутатион • Церулоплазмин • Трансферрин • Ферритин • Лактоферрином

Механизм антиоксидантного и геропрофилактического действия озонотерапии у пациентов разного возраста • АФК→ зрелые → →↓ПОЛ→↑АОА→↓БВ • АФК→ пожилые →↑ПОЛ→↓АОА → ↑ гемолиз эритроцитов → = БВ Где БВ – биологический возраст

Классификация препаратов антиоксидантов • 1. Антирадикальные средства • 1. 1. Эндогенные соединения α-Токоферол (Витамин Е), β-Каротин (Провитамин А), Ретинол (Витамин А), кислота аскорбиновая (Витамин С), глутатион восстановленный (Татионил), Кислота α-липоевая (Тиоктацид), Карнозин, Убихинон (Кудесан)

1. 2. Синтетические препараты • Ионол (Дибунол), Тиофан, Мексидол, Ацетилцистеин (АЦЦ), Пробукол (Фенбутол), Сукцинобукол (AGI-1067), Диметилсульфоксид (Димексид), Тирилазад мезилат (Фридокс), Эмоксипин, Олифен (Гипоксен), Эхинохром-А (Гистохром), Церовив (NXY-059))

2. Антиоксидантные ферменты и их активаторы • 2. 1. Препараты супероксиддисмутазы- Эрисод, Орготеин (Пероксинорм) • 2. 2. Препараты ферроксидазы церулоплазмина (Церулоплазмин) • 2. 3. Активаторы антиоксидантных ферментов- Натрия селенит (Селеназа) • 3. Блокаторы образования свободных радикалов- Аллопуринол (Милурит), Оксипуринол, Антигипоксанты

Фрукты и овощи - самые мощные антиоксиданты Jean Carper "Vour Miracle Brain", Harper Colleni Publisher. 2000, pp. 152 -153 • Фрукт или овощ ORAC на 5 кг Одна порция ORAC на 1 порцию ====================== Чернослив _______ 288500 1 ч/слив без кост 462 Изюм ______ 141500 1/4 чашки 1019 Черника_____ 111700 1/2 чашки 1620 Черная смородина 101800 1/2 чашки 1466 Чеснок_____ 96950 1 долька 58 Капуста (вареная) 88500 1/2 чашки 1150 Клюква_____ 87500 1/2 чашки 831 Клубника_______ 76800 1/2 чашки 831 Шпинат (сырой)__ 60500 1 чашка 678 Малина_____ 61300 1/2 чашки 755 Брюссельская кап 51300 1 проросток 206 Сливы_____ 47450 1 слива 626 Люцерна пророст_ 46550 1 чашка 307 Шпинат (туш. )__ 45450 1/2 чашки 1089 Цветки брокколи_ 44500 1/2 чашки вареные 817 Свекла (вареная) 42050 1/2 чашки 715 Авокадо____ 39100 1/2 штуки 149 Апельсин_______ 37500 1 штука 982 Виноград (красн. ) 36950 10 виноградин 177 Перец (красн. )__ 36550 1 средний перец 540 Вишни_____ 33500 10 вишен 455 Киви______ 30250 1 штука 458

• Бобы (вареные)__ 25150 1/2 чашки 640 Грейпфрут (роз ) 24150 1/2 штуки 580 Фасоль (мелкая)_ 23000 1/2 чашки вареной 400 Лук______ 22450 1/2 чашки резаного 360 Виноград (белый) 22300 10 виноградин 107 Кукуруза (вар)___ 20100 1/2 чашки 330 Баклажаны (вар)_ 19300 1/2 чашки 185 Цветная капуста__ 18850 1/2 чашки вареной 234 Цветная капуста__ 18850 1/2 чашки сырой 188 Зеленый гор(замор) 18200 1/2 чашки вареного 291 Картофель ______ 15650 1/2 чашки вареного 244 Картофель (слад) 15050 1/2 чашки вареного 301 Капуста белокоч_ 14900 1/2 чашки сырой 105 Листья салата___ 13100 10 листочков 200 Дыня канталупа 12600 1/2 дыни 670 Банан_____ 11050 1 банан 252 Яблоко____ 10910 1 среднее яблоко 300 Соевый творог тофу 10650 1/2 чашки 195 Морковь_______ 10350 1/2 чашки сырой 115 Морковь_______ 10350 1/2 чашки вареной 160 Фасоль (стручки) 10050 1/2 чашки вареных 125 Помидор_______ 9450 1 средний 233

• Кабачки цукини 8800 1/2 чашки сырых 115 Абрикосы______ 8200 3 сырых абрикоса 175 Персик____ 7910 средний 137 Кабачок (желтый) 7600 1/2 чашки вареных 183 Фасоль (Лима)___ 6800 1/2 чашки вареной 115 Салат (листовой) 5800 5 больших листьев 116 Груша_____ 6700 1 средняя 222 Арбуз______ 5200 1 кусок 501 Дыня (медовая)___ 4850 1 кусок 125 Сельдерей_______ 3050 1/2 чашки нарезан 60 Огурец_____ 2700 1/2 чашки нарезан 28

Спасибо за внимание !
Клиническая биохимия ЭЛЕКТИВ ЛЕКЦИЯ 3 2012.ppt