Гаврилин А. А 10 « 4» Содержание































 Гаврилин А. А 10 « 4»
Гаврилин А. А 10 « 4»
 Содержание 1) Химические свойства 2) Методы получения 3) Применение
Содержание 1) Химические свойства 2) Методы получения 3) Применение
 Химические свойства Свойства, общие с другими органическими веществами: а) окисление: 2 НСООН + O 2 2 CO 2 + 2 H 2 O муравьиная кислота
Химические свойства Свойства, общие с другими органическими веществами: а) окисление: 2 НСООН + O 2 2 CO 2 + 2 H 2 O муравьиная кислота
 Домашнее задание Запишите уравнения реакций полного окисления уксусной и пропановой кислоты
Домашнее задание Запишите уравнения реакций полного окисления уксусной и пропановой кислоты
 б)изомеризация: O to К Н 3 С – НС 2 - С НС 3 – СН - С OH СН 3 метилпропановоя бутановая кислота кислота (изобутановая)
б)изомеризация: O to К Н 3 С – НС 2 - С НС 3 – СН - С OH СН 3 метилпропановоя бутановая кислота кислота (изобутановая)
 Домашнее задание Для каких карбоновых кислот не характерна реакция изомеризации и почему?
Домашнее задание Для каких карбоновых кислот не характерна реакция изомеризации и почему?
 Химические свойства Собственные свойства 1) свойства, общие с минеральными кислотами. а)Диссоцация НСООН НСОО - + Н+ формиат-ион НСООН – кислота средней силы СН 3 СООН СН 3 СОО- + Н+ ацетат-ион СН 3 СООН – слабая кислота
Химические свойства Собственные свойства 1) свойства, общие с минеральными кислотами. а)Диссоцация НСООН НСОО - + Н+ формиат-ион НСООН – кислота средней силы СН 3 СООН СН 3 СОО- + Н+ ацетат-ион СН 3 СООН – слабая кислота
 Домашнее задание Сделайте вывод о влиянии молекулярной массы карбоновой кислоты (через величину углеводородного радикала) на степень диссоцации этих кислот Располжите следующие кислоты в порядке увеличения степени диссоцации: бутановая; метановая; пропановая; уксусная.
Домашнее задание Сделайте вывод о влиянии молекулярной массы карбоновой кислоты (через величину углеводородного радикала) на степень диссоцации этих кислот Располжите следующие кислоты в порядке увеличения степени диссоцации: бутановая; метановая; пропановая; уксусная.
 1) Растворы карбоновых кислот проводят электрический ток 2) Все кислоты на вкус кислые из-за наличия ионов Н+
1) Растворы карбоновых кислот проводят электрический ток 2) Все кислоты на вкус кислые из-за наличия ионов Н+
 3) Изменение окраски индикатора: растворы карбоновых кислот окрашивают лакмус в красный цвет из- за наличия ионов Н+
3) Изменение окраски индикатора: растворы карбоновых кислот окрашивают лакмус в красный цвет из- за наличия ионов Н+
 4) Взаимодействие с активными металлами (от Li до Mg) с образованием соли и газообразного водорода: о 2 HCOOH + Mg. O (HCOO)2 Mg + H 2 формиат магния о Mg + 2 H+ Mg 2+ + H 2 о 2 CH 3 CООН + Mg. O (CH 3 COO)2 Mg + H 2 ацетат магния
4) Взаимодействие с активными металлами (от Li до Mg) с образованием соли и газообразного водорода: о 2 HCOOH + Mg. O (HCOO)2 Mg + H 2 формиат магния о Mg + 2 H+ Mg 2+ + H 2 о 2 CH 3 CООН + Mg. O (CH 3 COO)2 Mg + H 2 ацетат магния
 5)Взаимодействие с оксидами металлов с образованием соли и воды: 2 НСООН + Са. О (НСОО)2 Са + Н 2 О 2 Н+ + Са. О Са 2+ + Н 2 О 2 СН 3 СООН + Са. О (СН 3 СОО)2 Са + Н 2 О
5)Взаимодействие с оксидами металлов с образованием соли и воды: 2 НСООН + Са. О (НСОО)2 Са + Н 2 О 2 Н+ + Са. О Са 2+ + Н 2 О 2 СН 3 СООН + Са. О (СН 3 СОО)2 Са + Н 2 О
 6) Взаимодействие с основаниями с образованием соли и воды лакмус HCOOH + Na. OH HCOONa + H 2 O Н+ + ОН- Н 2 О лакмус СН 3 СООН + Na. OH CH 3 COONa + H 2 O
6) Взаимодействие с основаниями с образованием соли и воды лакмус HCOOH + Na. OH HCOONa + H 2 O Н+ + ОН- Н 2 О лакмус СН 3 СООН + Na. OH CH 3 COONa + H 2 O
 Взаимодействие с солями более слабых кислот с образованием новой соли и новой кислоты 2 НСООН + К 2 СО 3 2 HCOOК + CO 2 + Н 2 О 2 - 2 H+ + CO 3 2 К+ + СО 2 + Н 2 О 2 СН 3 СООН + К 2 СО 3 2 СН 3 COOК + CO 2 + Н 2 О
Взаимодействие с солями более слабых кислот с образованием новой соли и новой кислоты 2 НСООН + К 2 СО 3 2 HCOOК + CO 2 + Н 2 О 2 - 2 H+ + CO 3 2 К+ + СО 2 + Н 2 О 2 СН 3 СООН + К 2 СО 3 2 СН 3 COOК + CO 2 + Н 2 О
 Домашнее задание Запишите уравнения реакций взаимодействия муравьиной и уксусной кислоты с силикатом натрия. Определите, почему эти реакции идут до конца?
Домашнее задание Запишите уравнения реакций взаимодействия муравьиной и уксусной кислоты с силикатом натрия. Определите, почему эти реакции идут до конца?
 2. Собственные свойства карбоновых кислот. 1)Взаимодействие со спиртом (реакция этерификации) с образованием сложного эфира и воды O to ; H+ НСООН + СН 3 ОН Н–С + Н 2 О метановая метанол кислота O – CH 3 метиловый эфир метановой кислоты (метилформиат)
2. Собственные свойства карбоновых кислот. 1)Взаимодействие со спиртом (реакция этерификации) с образованием сложного эфира и воды O to ; H+ НСООН + СН 3 ОН Н–С + Н 2 О метановая метанол кислота O – CH 3 метиловый эфир метановой кислоты (метилформиат)
 Домашнее задание Запишите уравнения реакций получения пропилацетата и этилформиата. Назовите исходные вещества.
Домашнее задание Запишите уравнения реакций получения пропилацетата и этилформиата. Назовите исходные вещества.
 2) Реакции замещения в углеводородном радикале (галогенирование) с образованием галогенокислоты и галогеноводорода P кр. CH 3 COOH + Cl 2 CH 2 – COOH + HCl хлоруксусная кислота Хлоруксусная кислота - сильный электролит
2) Реакции замещения в углеводородном радикале (галогенирование) с образованием галогенокислоты и галогеноводорода P кр. CH 3 COOH + Cl 2 CH 2 – COOH + HCl хлоруксусная кислота Хлоруксусная кислота - сильный электролит
 Домашнее задание 1) Запишите уравнения последовательного галогенирования хлоруксусной кислоты. Назовите продукты этих реакций. 2) Сделайте вывод о влиянии числа атомов галогенов на степень диссоцации карбоновых кислот. 3)Расположите галогенозаменяющие карбоновые кислоты, полученные в задании № 1, по мере уменьшения степени диссоцации.
Домашнее задание 1) Запишите уравнения последовательного галогенирования хлоруксусной кислоты. Назовите продукты этих реакций. 2) Сделайте вывод о влиянии числа атомов галогенов на степень диссоцации карбоновых кислот. 3)Расположите галогенозаменяющие карбоновые кислоты, полученные в задании № 1, по мере уменьшения степени диссоцации.
 Особенности замещения в карбоновых кислотах β α P кр. СН 3 – СН 2 – СООН + Сl 2 CH 3 – CH – COOH + HCl α – хлорпропионовая кислота
Особенности замещения в карбоновых кислотах β α P кр. СН 3 – СН 2 – СООН + Сl 2 CH 3 – CH – COOH + HCl α – хлорпропионовая кислота
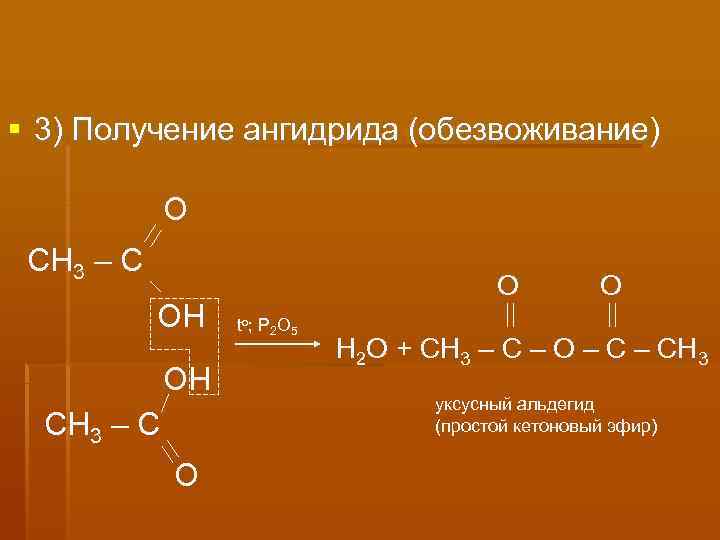
 3) Получение ангидрида (обезвоживание) О СН 3 – С О ОН to ; P 2 O 5 Н 2 О + СН 3 – С – О – СН 3 ОН уксусный альдегид СН 3 – С (простой кетоновый эфир) О
3) Получение ангидрида (обезвоживание) О СН 3 – С О ОН to ; P 2 O 5 Н 2 О + СН 3 – С – О – СН 3 ОН уксусный альдегид СН 3 – С (простой кетоновый эфир) О
 Домашнее задание Запишите уравнения реакций обезвоживания муравьиной; пропановой кислоты.
Домашнее задание Запишите уравнения реакций обезвоживания муравьиной; пропановой кислоты.
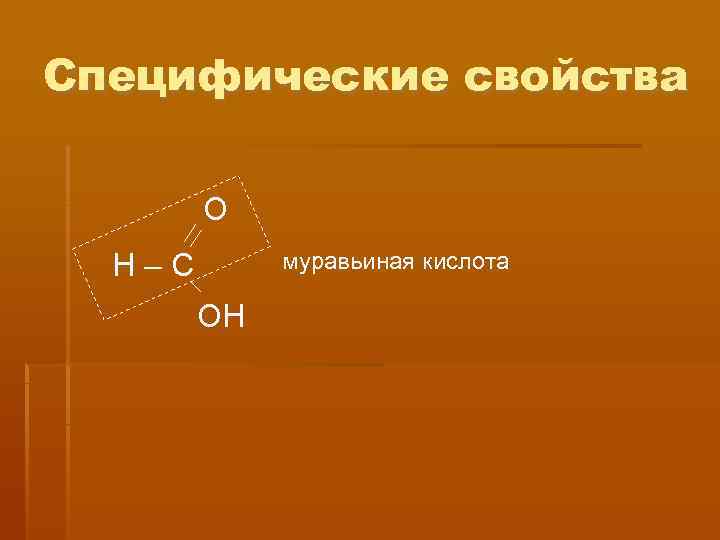
 Специфические свойства О Н–С муравьиная кислота ОН
Специфические свойства О Н–С муравьиная кислота ОН
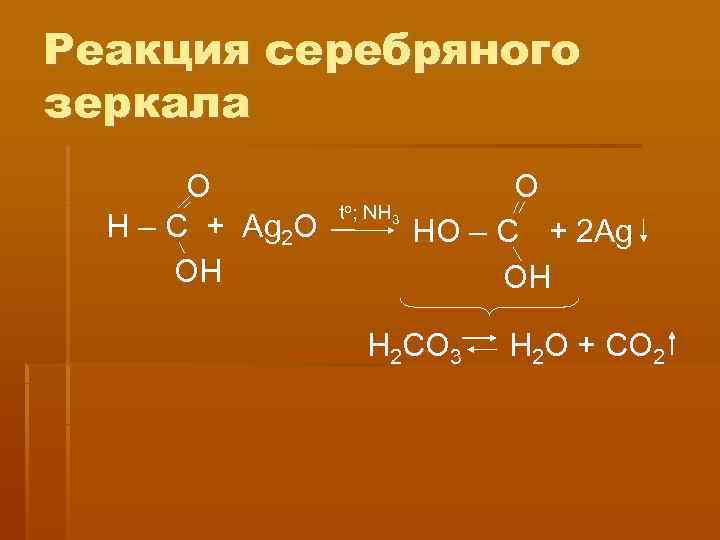
 Реакция серебряного зеркала O to; NH 3 Н – С + Ag 2 O HO – C + 2 Ag OH H 2 CO 3 H 2 O + CO 2
Реакция серебряного зеркала O to; NH 3 Н – С + Ag 2 O HO – C + 2 Ag OH H 2 CO 3 H 2 O + CO 2
 Домашняя работа Запишите уравнение реакции взаимодействия муравьиной кислоты с гидроксидом меди(II) при нагревании. Можно ли с помощью гидроксида меди (II) отличить муравьиную кислоту от уксусной?
Домашняя работа Запишите уравнение реакции взаимодействия муравьиной кислоты с гидроксидом меди(II) при нагревании. Можно ли с помощью гидроксида меди (II) отличить муравьиную кислоту от уксусной?
 Получение 1. Природный способ: 1)Муравьиная кислота содержится в составе едких выделений муравьев, в крапиве и хвое ели. 2)Уксусная кислота часто встречается в растениях, в выделениях животных. 3)Щавелевая кислота содержится в щавеле
Получение 1. Природный способ: 1)Муравьиная кислота содержится в составе едких выделений муравьев, в крапиве и хвое ели. 2)Уксусная кислота часто встречается в растениях, в выделениях животных. 3)Щавелевая кислота содержится в щавеле
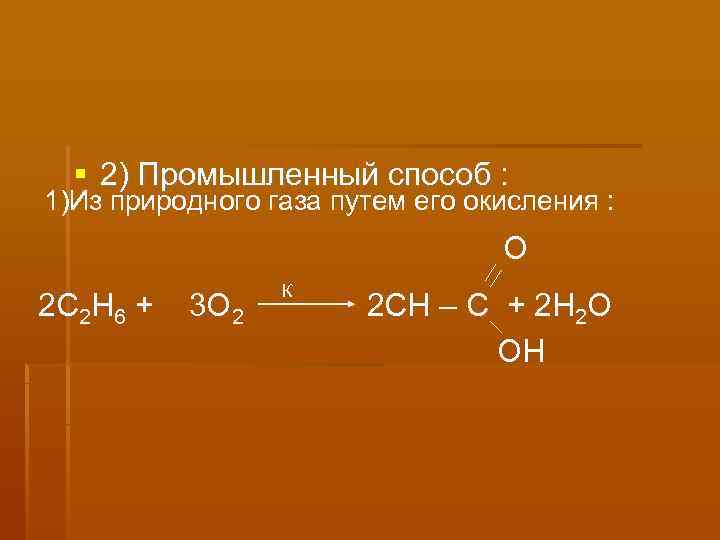
 2) Промышленный способ : 1)Из природного газа путем его окисления : О К 2 С 2 Н 6 + 3 О 2 2 СН – С + 2 H 2 O OH
2) Промышленный способ : 1)Из природного газа путем его окисления : О К 2 С 2 Н 6 + 3 О 2 2 СН – С + 2 H 2 O OH
 Домашнее задание Запишите уравнения реакций получения муравьиной и пальмитиновой кислоты из соответствующих алканов.
Домашнее задание Запишите уравнения реакций получения муравьиной и пальмитиновой кислоты из соответствующих алканов.
 2) окисление альдегидов О К О 2 CH 3 C + O 2 2 CH 3 – C H ОH этаналь этановая кислота
2) окисление альдегидов О К О 2 CH 3 C + O 2 2 CH 3 – C H ОH этаналь этановая кислота
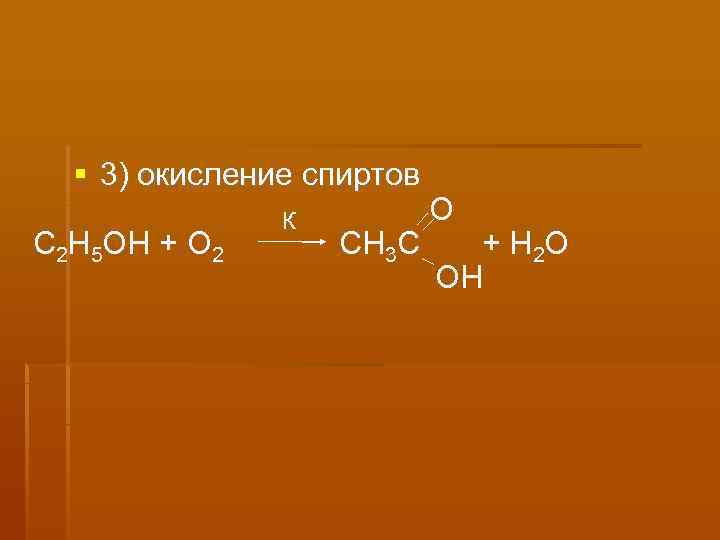
 3) окисление спиртов К О С 2 Н 5 ОН + О 2 СН 3 С + Н 2 О ОH
3) окисление спиртов К О С 2 Н 5 ОН + О 2 СН 3 С + Н 2 О ОH
 Домашнее задание Запишите уравнения реакций получения муравьиной и пропановой кислот из соответствующих спиртов и альдегидов
Домашнее задание Запишите уравнения реакций получения муравьиной и пропановой кислот из соответствующих спиртов и альдегидов
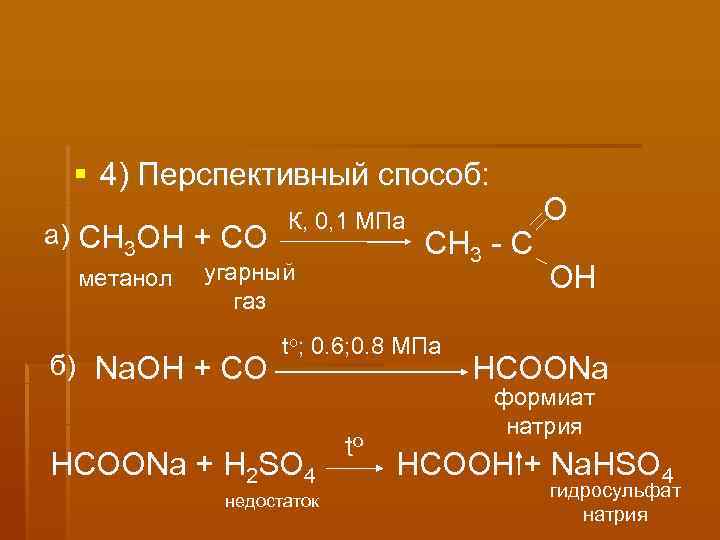
 4) Перспективный способ: К, 0, 1 МПа О а) СН 3 ОН + СО СН 3 - С метанол угарный ОH газ to; 0. 6; 0. 8 МПа б) Na. OH + CO HCOONa формиат натрия to НСООNa + H 2 SO 4 HCOOH + Na. HSO 4 недостаток гидросульфат натрия
4) Перспективный способ: К, 0, 1 МПа О а) СН 3 ОН + СО СН 3 - С метанол угарный ОH газ to; 0. 6; 0. 8 МПа б) Na. OH + CO HCOONa формиат натрия to НСООNa + H 2 SO 4 HCOOH + Na. HSO 4 недостаток гидросульфат натрия
 3) Лабораторный способ При действии на твердую соль соответствующей кислоты концентрированной серной кислотой to 2 СН 3 СOONa + H 2 SO 4 2 CH 3 COOH + Na 2 SO 4 ацетат натрия уксусная кислота
3) Лабораторный способ При действии на твердую соль соответствующей кислоты концентрированной серной кислотой to 2 СН 3 СOONa + H 2 SO 4 2 CH 3 COOH + Na 2 SO 4 ацетат натрия уксусная кислота
 Применение 1. Муравьиную кислоту используют: в технике в качестве восстановителя (из за наличия альдегидной группы) для получения сложных эфиров (растворители и душистые вещества)
Применение 1. Муравьиную кислоту используют: в технике в качестве восстановителя (из за наличия альдегидной группы) для получения сложных эфиров (растворители и душистые вещества)
 2. Уксусная кислота используется: в пищевой промышленности как консервант и приправка к пище для получения солей - ацетатов (некоторые из них используются в сх для борьбы с сорной растительностью) для получения сложных эфиров (растворители и душистые вещества) в производстве ацетатного волокна для синтеза красителей (индиго) для синтеза лекарств (аспирин)
2. Уксусная кислота используется: в пищевой промышленности как консервант и приправка к пище для получения солей - ацетатов (некоторые из них используются в сх для борьбы с сорной растительностью) для получения сложных эфиров (растворители и душистые вещества) в производстве ацетатного волокна для синтеза красителей (индиго) для синтеза лекарств (аспирин)
 3. Пальмитиновая и стеариновая кислоты в виде сложных эфиров глицерина входят в состав растительных и животных жиров.
3. Пальмитиновая и стеариновая кислоты в виде сложных эфиров глицерина входят в состав растительных и животных жиров.

