диссоциация.ppt
- Количество слайдов: 15
 ГАОУ СПО “Казанский медицинский колледж” Теория электролитической диссоциации Преподаватель химии: Тухватуллина Р. З. Казань, 2014 г.
ГАОУ СПО “Казанский медицинский колледж” Теория электролитической диссоциации Преподаватель химии: Тухватуллина Р. З. Казань, 2014 г.
 План урока: 1. Электролиты и неэлектролиты; 2. Электролитическая диссоциация; 3. Механизм диссоциации веществ; 4. Алгоритм составления уравнений реакций электролитической диссоциации оснований, кислот, солей; 5. Кислоты и основания с точки зрения электролитической диссоциации.
План урока: 1. Электролиты и неэлектролиты; 2. Электролитическая диссоциация; 3. Механизм диссоциации веществ; 4. Алгоритм составления уравнений реакций электролитической диссоциации оснований, кислот, солей; 5. Кислоты и основания с точки зрения электролитической диссоциации.
 1. Электролиты и неэлектролиты. 1) Электролиты – это вещества, растворы и расплавы, которых проводят электрический ток (соли, щёлочи, кислоты). 2) Неэлектролиты – это вещества, растворы и расплавы, которых не проводят электрический ток (дистиллированная вода, оксиды, газы, сахар и другие органические вещества).
1. Электролиты и неэлектролиты. 1) Электролиты – это вещества, растворы и расплавы, которых проводят электрический ток (соли, щёлочи, кислоты). 2) Неэлектролиты – это вещества, растворы и расплавы, которых не проводят электрический ток (дистиллированная вода, оксиды, газы, сахар и другие органические вещества).
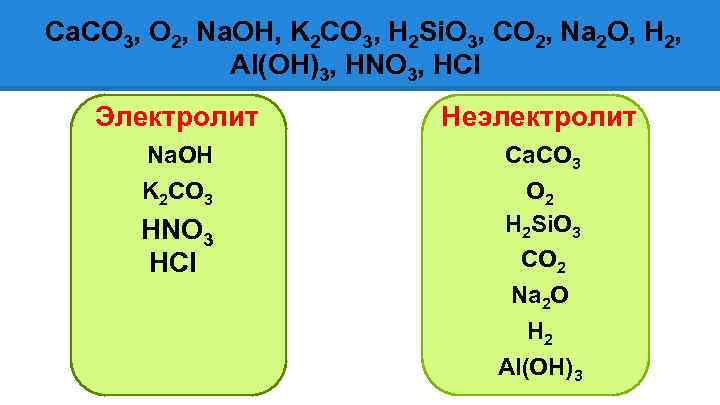 Ca. CO 3, O 2, Na. OH, K 2 CO 3, H 2 Si. O 3, CO 2, Na 2 O, H 2, Al(OH)3, HNO 3, HCl Электролит Неэлектролит Na. OH Ca. CO 3 K 2 CO 3 O 2 H 2 Si. O 3 CO 2 HNO 3 HCl Na 2 O H 2 Al(OH)3
Ca. CO 3, O 2, Na. OH, K 2 CO 3, H 2 Si. O 3, CO 2, Na 2 O, H 2, Al(OH)3, HNO 3, HCl Электролит Неэлектролит Na. OH Ca. CO 3 K 2 CO 3 O 2 H 2 Si. O 3 CO 2 HNO 3 HCl Na 2 O H 2 Al(OH)3

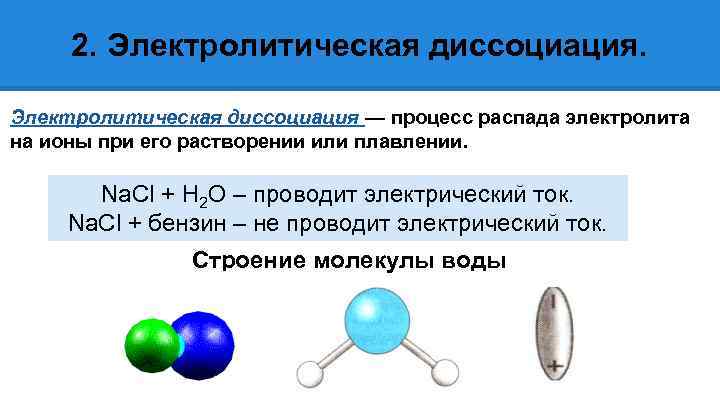 2. Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Na. Cl + H 2 O – проводит электрический ток. Na. Cl + бензин – не проводит электрический ток. Строение молекулы воды
2. Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Na. Cl + H 2 O – проводит электрический ток. Na. Cl + бензин – не проводит электрический ток. Строение молекулы воды
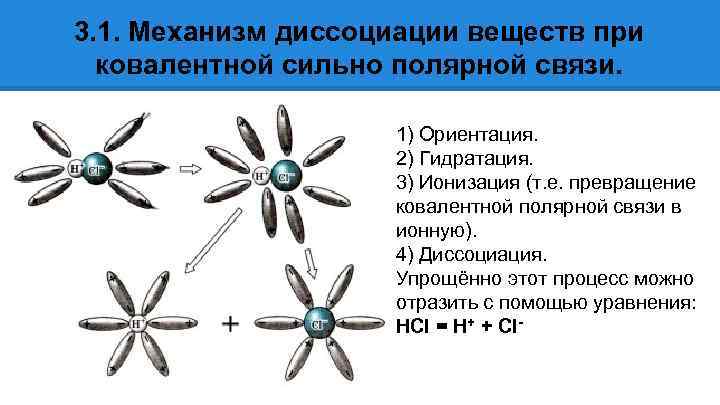 3. 1. Механизм диссоциации веществ при ковалентной сильно полярной связи. 1) Ориентация. 2) Гидратация. 3) Ионизация (т. е. превращение ковалентной полярной связи в ионную). 4) Диссоциация. Упрощённо этот процесс можно отразить с помощью уравнения: HCl = H+ + Cl-
3. 1. Механизм диссоциации веществ при ковалентной сильно полярной связи. 1) Ориентация. 2) Гидратация. 3) Ионизация (т. е. превращение ковалентной полярной связи в ионную). 4) Диссоциация. Упрощённо этот процесс можно отразить с помощью уравнения: HCl = H+ + Cl-
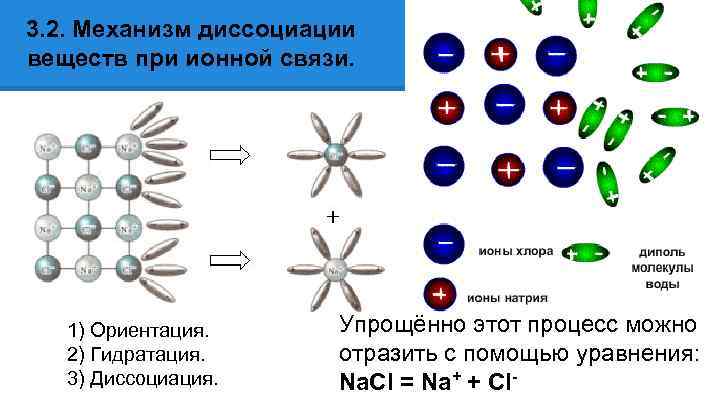 3. 2. Механизм диссоциации веществ при ионной связи. 1) Ориентация. 2) Гидратация. 3) Диссоциация. Упрощённо этот процесс можно отразить с помощью уравнения: Na. Cl = Na+ + Cl-
3. 2. Механизм диссоциации веществ при ионной связи. 1) Ориентация. 2) Гидратация. 3) Диссоциация. Упрощённо этот процесс можно отразить с помощью уравнения: Na. Cl = Na+ + Cl-
 4. Алгоритм составления уравнений реакций электролитической диссоциации оснований, кислот, солей. 1. Запишите формулу электролита в левой части уравнения, а формулы катионов и анионов в правой Ва(ОН)2 → Ва 2+ + ОНH 2 SO 4 →H+ + SO 42 Al 2(SO 4) →Аl 3+ + +SO 42 - 2. Поставьте между ними знак = , если это сильный электролит, знак обратимости ↔, если это слабый электролит. (Многоосновные к-ты и многокислотные основания диссоциируют ступенчато!) Ва(ОН)2 = Ва 2+ + ОНH 2 SO 4 =H+ + SO 42 Al 2(SO 4) = Аl 3+ + +SO 42 H 2 O ↔ H+ + OH- 3. Расставьте коэффициенты, (если они нужны) Ва(ОН)2 = Ва 2+ + 2 ОНH 2 SO 4 =2 H+ + SO 42 Al 2(SO 4) = 2 Аl 3+ + +3 SO 42 -
4. Алгоритм составления уравнений реакций электролитической диссоциации оснований, кислот, солей. 1. Запишите формулу электролита в левой части уравнения, а формулы катионов и анионов в правой Ва(ОН)2 → Ва 2+ + ОНH 2 SO 4 →H+ + SO 42 Al 2(SO 4) →Аl 3+ + +SO 42 - 2. Поставьте между ними знак = , если это сильный электролит, знак обратимости ↔, если это слабый электролит. (Многоосновные к-ты и многокислотные основания диссоциируют ступенчато!) Ва(ОН)2 = Ва 2+ + ОНH 2 SO 4 =H+ + SO 42 Al 2(SO 4) = Аl 3+ + +SO 42 H 2 O ↔ H+ + OH- 3. Расставьте коэффициенты, (если они нужны) Ва(ОН)2 = Ва 2+ + 2 ОНH 2 SO 4 =2 H+ + SO 42 Al 2(SO 4) = 2 Аl 3+ + +3 SO 42 -
 Напишите уравнения электролитической диссоциации следующих соединений: Na. OH Na+ + ОН- Na 2 SO 4 2 Na+ + SO 42 - H 2 SO 4 2 Н+ + SO 42 - Al 2(SO 4)3 2 Al 3+ + 3 SO 42 -
Напишите уравнения электролитической диссоциации следующих соединений: Na. OH Na+ + ОН- Na 2 SO 4 2 Na+ + SO 42 - H 2 SO 4 2 Н+ + SO 42 - Al 2(SO 4)3 2 Al 3+ + 3 SO 42 -
 Ступенчатая диссоциация многоосновных кислот и многокислотных оснований. В общем виде диссоциацию серной кислоты можно представить в виде: H 2 SO 4 2 H+ + SO 42 - Первая ступень: H 2 SO 4 Вторая ступень: HSO 4 - H+ + HSO 4 - катион гидросульфат водорода анион H+ + SO 42 - катион сульфат водорода анион
Ступенчатая диссоциация многоосновных кислот и многокислотных оснований. В общем виде диссоциацию серной кислоты можно представить в виде: H 2 SO 4 2 H+ + SO 42 - Первая ступень: H 2 SO 4 Вторая ступень: HSO 4 - H+ + HSO 4 - катион гидросульфат водорода анион H+ + SO 42 - катион сульфат водорода анион
 Ступенчатая диссоциация ортофосфорной кислоты В общем виде диссоциацию ортофосфорной кислоты можно представить в виде: H 3 PO 4 3 H+ + PO 43 - Первая ступень: H 3 PO 4 H+ + H 2 PO 4 - дигидрофосфат анион H 2 PO 4 - H+ + HPO 42 - гидрофосфат анион HPO 42 - H+ + фосфат анион Вторая ступень: Третья ступень (практически не идет): PO 43 -
Ступенчатая диссоциация ортофосфорной кислоты В общем виде диссоциацию ортофосфорной кислоты можно представить в виде: H 3 PO 4 3 H+ + PO 43 - Первая ступень: H 3 PO 4 H+ + H 2 PO 4 - дигидрофосфат анион H 2 PO 4 - H+ + HPO 42 - гидрофосфат анион HPO 42 - H+ + фосфат анион Вторая ступень: Третья ступень (практически не идет): PO 43 -
 5. Кислоты и основания в свете теории электролитической диссоциации Кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+. H 2 SO 4 ↔ 2 H+ + SO 42 CH 3 COOH ↔ H+ = CH 3 COOОснования-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-. Na. OH ↔ Na+ + OHBa(OH)2 ↔ Ba 2+ + 2 OHNH 3·H 2 O ↔ NH 4+ + OH-
5. Кислоты и основания в свете теории электролитической диссоциации Кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+. H 2 SO 4 ↔ 2 H+ + SO 42 CH 3 COOH ↔ H+ = CH 3 COOОснования-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-. Na. OH ↔ Na+ + OHBa(OH)2 ↔ Ba 2+ + 2 OHNH 3·H 2 O ↔ NH 4+ + OH-
 Изменение окраски индикаторов в различных средах Среда / Индикатор Кислая среда Нейтральная среда Щелочная среда Лакмус Красный Фиолетовый Синий Метилоранж Розовый Оранжевый Желтый Фенолфталеин Бесцветный Малиновый
Изменение окраски индикаторов в различных средах Среда / Индикатор Кислая среда Нейтральная среда Щелочная среда Лакмус Красный Фиолетовый Синий Метилоранж Розовый Оранжевый Желтый Фенолфталеин Бесцветный Малиновый
 Домашняя работа: 1. Учить определения, уметь составлять уравнения электролитической диссоциации 2. Работа по карточкам
Домашняя работа: 1. Учить определения, уметь составлять уравнения электролитической диссоциации 2. Работа по карточкам


