ПОТЕНЦИОМЕТРИЯ.pptx
- Количество слайдов: 53

Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод.
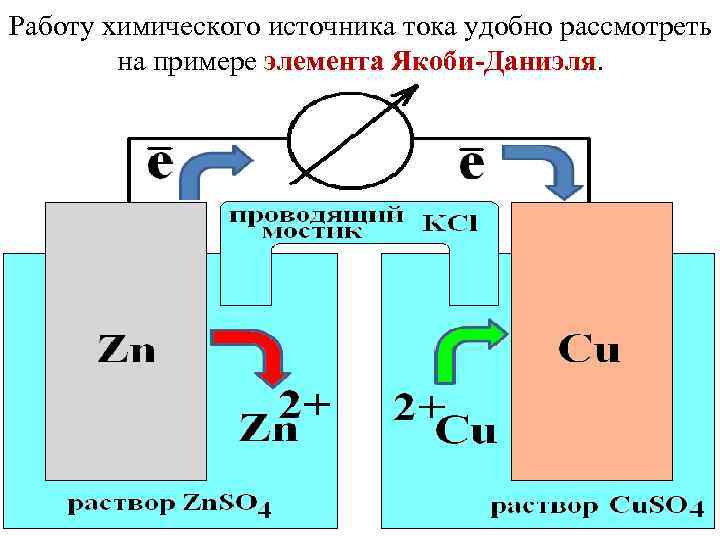
Работу химического источника тока удобно рассмотреть на примере элемента Якоби-Даниэля.

При замыкании элемента е- переходят с цинковой пластинки на медную. Ионы Zn 2+ с цинкового электрода переходят в раствор. Цинковая пластинка растворяется. На цинковом электроде протекает полуреакция окисления. Zn (т) – 2 е- → Zn 2+ (р-р) Ионы Cu 2+ осаждаются из раствора на медный электрод. На медном электроде протекает полуреакция восстановления. Сu 2+ (р-р) + 2 е- → Сu (т) В целом это можно рассматривать, как окислительно-восстановительную реакцию. Zn (т) + Сu 2+ (р-р) → Zn 2+ (р-р) + Сu (т)

Запись гальванической цепи (–)Сu, Zn | Zn. SО 4 (р) || Сu. SO 4 (р) | Сu(+) Электрод – устройство для осуществления полуреакции, состоящее из проводников разного рода (1 и 2 рода). Проводник 1 рода – обладает электронной проводимостью (металлы); Проводник 2 рода – обладает ионной проводимостью (растворы или расплавы электролитов);

Скачок потенциала на границе раздела металл – раствор его соли, называется электродным или окислительно-восстановительным (ОВ) потенциалом. Зависимость электродного потенциала от природы металла, активности его ионов в растворе и температуры выражается уравнением немецкого физика В. Нернста (1864 -1941). Выводится уравнение Нернста на основе уравнения изотермы химической реакции, т. е. является одним из следствий 2 -го начала термодинамики. Электрическая работа перевода одного моль ионов из металла в раствор: M→ nе- + Mn+ Wэл = -∆G = n. Fφ n – число электронов, F – постоянная Фарадея (≈96500 Кл/моль), φ – потенциал электрода (В).

φ = φО + RT ln с (Mn+) n. F Стандартным электродным (ОВ) потенциалом (φО) называют скачок потенциала на границе раздела металл – раствор его соли с активностью ионов металла, равной 1 моль/л.

Классификация электродов: Первого рода (φ зависит от концентрации катиона) φ = φО + RT ln с(Mn+) n. F Второго рода (φ зависит от концентрации аниона) φ = φО + RT ln с(Аn-) n. F Окислительно-восстановительные (φ зависит от концентрации окисленной и восстановленной формы какого-либо вещества) Мембранные электроды
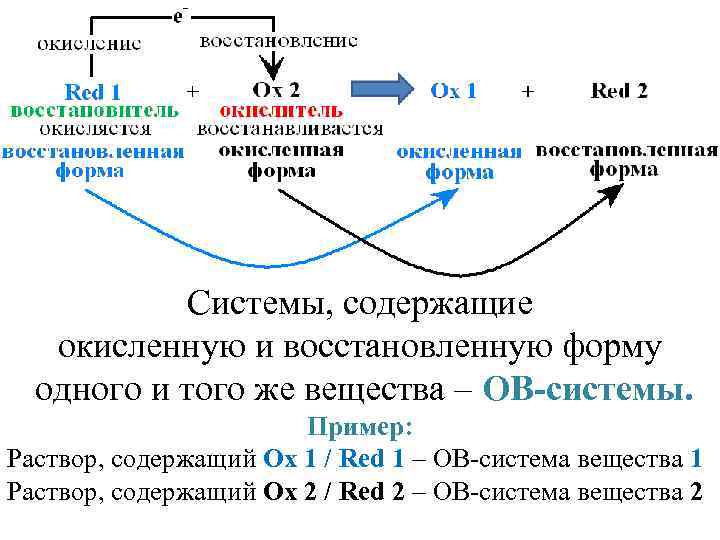
Системы, содержащие окисленную и восстановленную форму одного и того же вещества – ОВ-системы. Пример: Раствор, содержащий Ох 1 / Rеd 1 – ОВ-система вещества 1 Раствор, содержащий Ох 2 / Rеd 2 – ОВ-система вещества 2

10 Fe. SO 4 + 2 KMn. O 4 + 8 H 2 SO 4 → 5 Fe 2(SO 4)3 + 2 Mn. SO 4 + К 2 SO 4 + 8 H 2 O краткая запись: 5 Fe 2+ + Mn. O 4 - + 8 H+ → 5 Fe 3+ + Mn 2+ + 4 H 2 O Восстановитель Окислитель Fe 2+ – 1 е-→ Fe 3+ Rеd- Охформа форма Mn 7+O 4 - + 5 е- + 8 H+ → Mn 2+ + 4 H 2 O Ох- Rеd- форма ОВ-системы: Fe 3+/ Fe 2+ ОВ-система I типа: участвуют только е. Mn. O 4 -/ Mn 2+ ОВ-система II типа: участвуют е- и Н+

Зависимость φ от природы ОВ-системы, соотношения активностей (концентраций) окисленной и восстановленной форм, температуры и активности ионов водорода для систем I-го и II-го типа устанавливается уравнениями Петерса I типа φ = φО + RT ln с(Ох) n. F c(Red) II типа φ = φО + RT ln c(Ох) сm(Н+) n. F c(Red) m – стехиометрический коэффициент перед Н+ в Ох/Rеd полуреакции – число протонов, которое присоединяет частица окисленной формы, переходя в восстановленную.

φ (Fe 3+/ Fe 2+) = φО(Fe 3+/ Fe 2+) + 8, 31 ∙ T ln с(Fe 3+) 1 ∙ 96500 c(Fe 2+) φ(Mn. O 4 -/ Mn 2+) = φО(Mn. O 4 -/ Mn 2+) + 8, 31∙ T ln c(Mn. O 4 -) с8(Н+) 5∙ 96500 c(Mn 2+) Стандартный ОВ-потенциал – это потенциал, возникающий на границе раздела инертный металл – раствор, в котором с(Ох-формы) = c(Red-формы) = 1 моль/л, а для систем II типа, кроме того с(Н+) = 1 моль/л. Электродвижущая сила (ЭДС) гальванического элемента равна разности потенциалов окислителя (φОх) и восстановителя (φRed). Е = φОх – φRed φОх > φRed Е >0

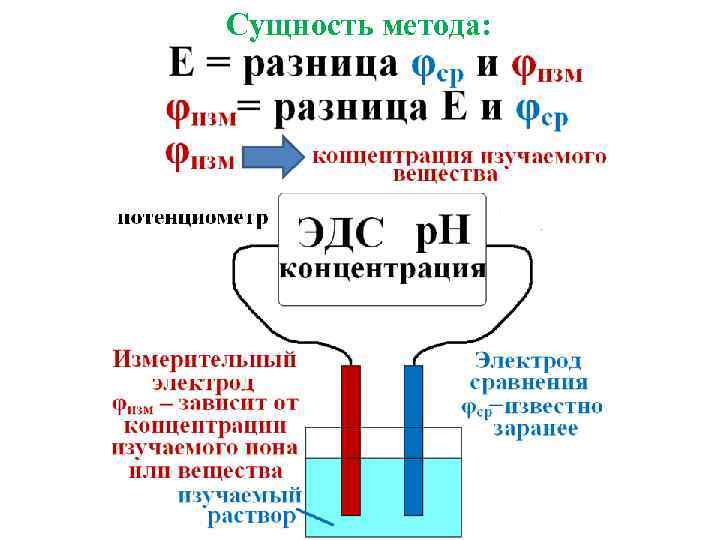
Потенциометрия – совокупность физ-хим. методов исследования, в основе которых лежит измерение ЭДС цепей, составленных из индикаторного электрода и электрода сравнения. Потенциал электрода сравнения (φср) – известен, постоянен, воспроизводим.

Электроды сравнения: 1. Сереброхлоридный 2. Каломельный 3. Водородный (относительно стандартного водородного электрода измерены потенциалы вех остальных электродов, φО H 2 = 0) Измерительные электроды : 1. Платиновый 2. Стеклянный и т. д.
Сущность метода:
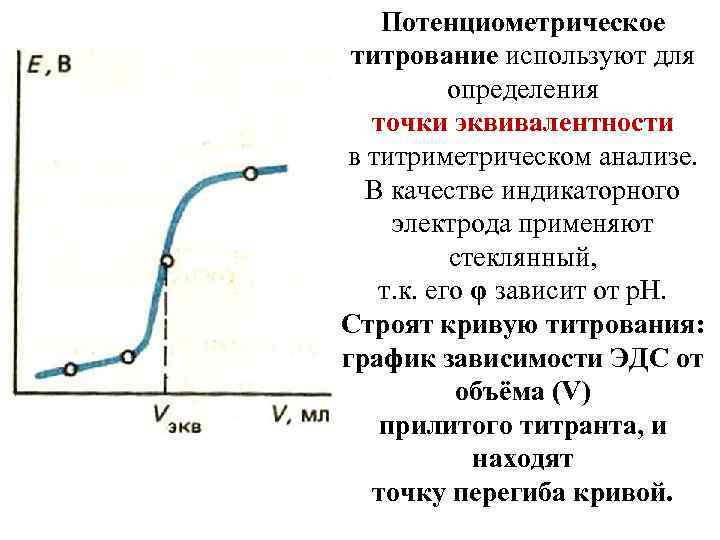
Потенциометрическое титрование используют для определения точки эквивалентности в титриметрическом анализе. В качестве индикаторного электрода применяют стеклянный, т. к. его φ зависит от р. Н. Строят кривую титрования: график зависимости ЭДС от объёма (V) прилитого титранта, и находят точку перегиба кривой.
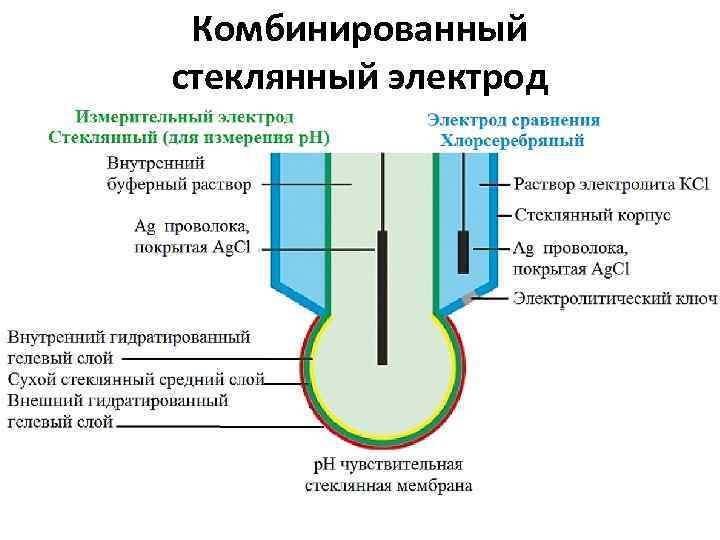
Комбинированный стеклянный электрод

Различные типы выпускаемых стеклянных электродов











Стеклянный электрод относится к ионоселективным, или мембранным электродам. Принцип действия заключается в том, что тонкая мембрана (в данном случае стеклянная) разделяет две среды с разной активностью ионов водорода (исследуемый раствор и буферный раствор, которым заполнен электрод). В результате между двумя сторонами мембраны образуется разность потенциалов, которая и является измеряемой величиной.

Стеклянные электроды могут быть различной конструкции. Например, для измерения р. Н твердых веществ (таких как кожа, бумага и т. д. ) очень удобны электроды с плоской мембраной. Для вязких сред, для измерения р. Н почвы; для медицинских применений, в пищевой промышленности часто применяют электроды с конусной или заостренной поверхностью. 1. корпус (может быть из стекла и пластика), 2. тонкая мембрана в виде сферы, конуса или плоскости, в зависимости от применения, 3. внутри размещен электрод сравнения, покрытый солью этого металла (чаще всего серебро с хлоридом серебра) который помещен в буферный раствор, слабый раствор кислоты или соли

Мембрана изготавливается из специальных сортов стекла, характеризуется определенной электропроводностью. Такое стекло является проницаемым для ионов водорода Н+, и не проницаемым для других ионов (селективность мембраны). Электропроводность его обусловлена наличием ионов Na+, К+ или Li+, вводимых в его состав при изготовлении. Существуют различные теории, объясняющие, каким образом возникает потенциал в стеклянном электроде.

Больше экспериментальное подтверждение нашли основные положения ионообменной теории Б. П. Никольского. Согласно ей, во внешнем слое мембраны, граничащей с раствором, образуется тонкий гидратированный слой вследствие того, что катионы щелочных металлов из стекла могут переходить в раствор, а их место могут занимать другие катионы из раствора. Такие процессы происходят с обеих сторон мембраны, и с стороны исследуемого раствора, и с стороны буферного раствора в электроде.

Борис Петрович Никольский – советский физикохимик и радиохимик. Родился в Мензелинске Уфимской губернии (ныне Татарстан). В 1918 г. поступил на физико-математический факультета Томского университета, который не окончил из-за Гражданской войны. В 1920 г. продолжил обучение в Иркутском университете, в 1922 г. перешёл на химическое отделение физико-математического факультета Петроградского (впоследствии Ленинградского) университета, который окончил в 1925 г. Работал там же. В 1935 г. был арестован и выслан в Саратов; в 1937 г. вновь арестован, приговорён к 10 годам лишения свободы за антисоветскую агитацию и отправлен в ББЛАГ. В 1939 г. дело было прекращено (в 1994 г. посмертно реабилитирован). С 1939 по 1988 г. профессор и заведующий кафедрой физической химии химического факультета Ленинградского университета, в 1961 -1963 гг. декан химического факультета ЛГУ. С 1946 г. одновременно работал в Радиевом институте. Основные работы посвящены физикохимии растворов. Изучал процессы ионного обмена между водными растворами и твёрдыми фазами, разработал теорию таких процессов. Совместно с М. С. Вревским создал (1929) методы определения скрытых теплот испарения растворов, парциального давления пара и степени диссоциации ассоциатов в парах. Разработал (1932) метод потенциометрического титрования. Предложил (1932 -1937) ионообменную теорию стеклянного электрода, которую подтвердил экспериментально (1951). Совместно с А. Н. Несмеяновым изучил (19671969) окислительно-восстановительную систему ферроцен – ион феррициния. Выполнил большой цикл работ в области теоретической и прикладной радиохимии. Один из руководителей работ по созданию и освоению промышленной технологии плутония, реализованной на химкомбинате "Маяк". Главный редактор журнала "Радиохимия". Герой Социалистического Труда (1971), лауреат Сталинской (1949) и Ленинской (1961) премий, Государственной премии СССР (1973).

Особую популярность получили комбинированные электроды, сочетающие в себе функции индикаторного электрода и электрода сравнения. Взаимодействие электрода сравнения с исследуемым раствором проходит через электролитический ключ, функция которого стабилизировать потенциал вспомогательного электрода. Раствор хлорида калия через пористую мембрану постоянно просачивается во внешней раствор.

Преимуществами стеклянного электрода являются 1. стабильные характеристики, 2. возможность работы в широком диапазоне значений р. Н, 3. различные температурные режимы, 4. высокое быстродействие, 5. не поддаются окислению. Однако для обеспечения правильной работы, электроды нужно хранить в соответствующих буферных растворах, промывать дистиллированной водой после каждого использования и калибровать перед началом работы.

Изученные на занятии типы ИОНОМЕРОВ

1. Иономер И-160 МИ лабораторный





2. р. Н метр р. Н 410




3. р. Н 510






ПОТЕНЦИОМЕТРИЯ.pptx