Lecture9_181214.ppt
- Количество слайдов: 33
 Гальванические элементы, электролиз Лекция 9 1
Гальванические элементы, электролиз Лекция 9 1
 Реакция цинка с раствором соли меди Cu 2+ + 2 e Cu Zn – 2 e Zn 2+ Zn + Cu 2+ Zn 2+ + Cu Реакция протекает самопроизвольно! 2
Реакция цинка с раствором соли меди Cu 2+ + 2 e Cu Zn – 2 e Zn 2+ Zn + Cu 2+ Zn 2+ + Cu Реакция протекает самопроизвольно! 2
 Электрохимические процессы – это окислительновосстановительные процессы, сопровождающиеся превращениями химической энергии в электрическую или наоборот. Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток. Гальванический элемент состоит из двух электродов, соединенных металлическим проводником. Работа гальванических элементов основана на пространственном разделении процессов окисления и восстановления. 3
Электрохимические процессы – это окислительновосстановительные процессы, сопровождающиеся превращениями химической энергии в электрическую или наоборот. Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток. Гальванический элемент состоит из двух электродов, соединенных металлическим проводником. Работа гальванических элементов основана на пространственном разделении процессов окисления и восстановления. 3
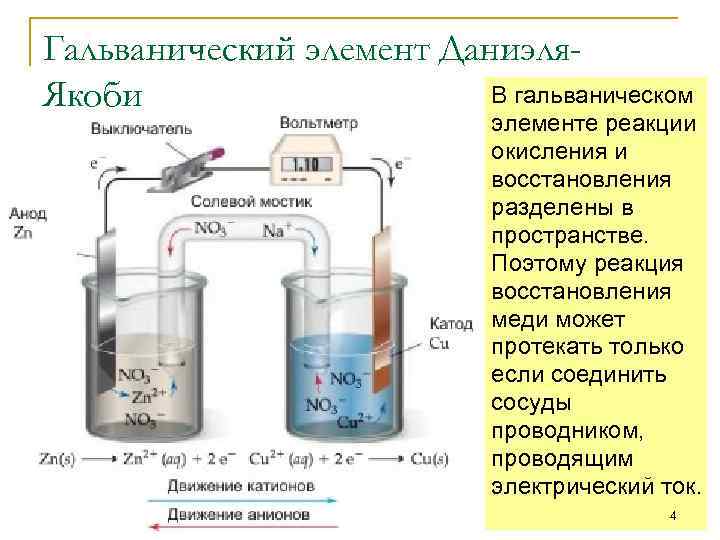 Гальванический элемент Даниэля. В гальваническом Якоби элементе реакции окисления и восстановления разделены в пространстве. Поэтому реакция восстановления меди может протекать только если соединить сосуды проводником, проводящим электрический ток. 4
Гальванический элемент Даниэля. В гальваническом Якоби элементе реакции окисления и восстановления разделены в пространстве. Поэтому реакция восстановления меди может протекать только если соединить сосуды проводником, проводящим электрический ток. 4
 Гальванический элемент Пластинка металла или другого проводника, на которой происходит реакция окисления или восстановления, называется электродом. Электрод, на котором происходит реакция окисления называется анодом. В ходе реакции анод принимает электроны и заряжается отрицательно. Электрод, на котором происходит реакция восстановление называется катодом. В ходе реакции катод отдает электроны и получает положительный заряд. Для непрерывной работы гальванического элемента растворы, в которые опущены электроды должны оставаться электрически нейтральными. Поэтому нужно обеспечить транспорт отрицательных ионов из катодного отделения в анодное. Для этого из соединяют солевым мостиком или пористой перегородкой, через которые могут перемещаться 5 заряженные ионы.
Гальванический элемент Пластинка металла или другого проводника, на которой происходит реакция окисления или восстановления, называется электродом. Электрод, на котором происходит реакция окисления называется анодом. В ходе реакции анод принимает электроны и заряжается отрицательно. Электрод, на котором происходит реакция восстановление называется катодом. В ходе реакции катод отдает электроны и получает положительный заряд. Для непрерывной работы гальванического элемента растворы, в которые опущены электроды должны оставаться электрически нейтральными. Поэтому нужно обеспечить транспорт отрицательных ионов из катодного отделения в анодное. Для этого из соединяют солевым мостиком или пористой перегородкой, через которые могут перемещаться 5 заряженные ионы.
 Разность потенциалов в гальваническом элементе 6
Разность потенциалов в гальваническом элементе 6
 Электродвижущая сила Как вода самопроизвольно падает к утеса за счет разницы потенциальной энергии на вершине водопада и внизу, так и электроны самопроизвольно движутся от анода к катоду под действием разницы потенциалов между двумя электродами. Поскольку такая разница потенциалов приводит в движение электроны, она получила название электродвижущей силы (эдс). Также она называется потенциалом гальванического элемента. Единицей измерения потенциала в системе СИ является Вольт (В). Ее можно измерить прибором с высоким сопротивлением, называемым вольтметром. Потенциал любого элемента, где протекает самопроизвольная реакция, считается положительным. 7
Электродвижущая сила Как вода самопроизвольно падает к утеса за счет разницы потенциальной энергии на вершине водопада и внизу, так и электроны самопроизвольно движутся от анода к катоду под действием разницы потенциалов между двумя электродами. Поскольку такая разница потенциалов приводит в движение электроны, она получила название электродвижущей силы (эдс). Также она называется потенциалом гальванического элемента. Единицей измерения потенциала в системе СИ является Вольт (В). Ее можно измерить прибором с высоким сопротивлением, называемым вольтметром. Потенциал любого элемента, где протекает самопроизвольная реакция, считается положительным. 7
 Стандартный потенциал Оказалось, что потенциал элемента зависит от типа реакций, протекающих на катоде и аноде, концентраций реагентов и продуктов, а также температуры. В стандартных условиях потенциал зависит только от типа реакций. Стандартные условия – температура – 25°С, концентрация растворенных веществ – 1 М, давление газообразных веществ – 1 атм. Потенциал элемента в стандартных условия называется стандартным и обозначается E°. Для медь цинкового элемента – стандартный потенциал равен 1, 10 В. 8
Стандартный потенциал Оказалось, что потенциал элемента зависит от типа реакций, протекающих на катоде и аноде, концентраций реагентов и продуктов, а также температуры. В стандартных условиях потенциал зависит только от типа реакций. Стандартные условия – температура – 25°С, концентрация растворенных веществ – 1 М, давление газообразных веществ – 1 атм. Потенциал элемента в стандартных условия называется стандартным и обозначается E°. Для медь цинкового элемента – стандартный потенциал равен 1, 10 В. 8
 Стандартный электродный потенциал Каждое из двух отделение гальванического элемента называется полуячейкой. В каждой полуячейке протекает или реакция окисления или реакция восстановления. Оказалось, каждой индивидуальной полуячейке можно приписать свой потенциал. Принято записывать потенциал каждой полуячейки (электрода) как потенциал реакции восстановления, протекающей на этом электроде. В этой случае потенциал гальванического элемента будет равен разности потенциалов полуячеек. E = Eкат - Eан Для самопроизвольной реакции E > 0. Потенциал реакции восстановления, протекающей на электроде в стандартных условиях, называют стандартным 9 электродным потенциалом.
Стандартный электродный потенциал Каждое из двух отделение гальванического элемента называется полуячейкой. В каждой полуячейке протекает или реакция окисления или реакция восстановления. Оказалось, каждой индивидуальной полуячейке можно приписать свой потенциал. Принято записывать потенциал каждой полуячейки (электрода) как потенциал реакции восстановления, протекающей на этом электроде. В этой случае потенциал гальванического элемента будет равен разности потенциалов полуячеек. E = Eкат - Eан Для самопроизвольной реакции E > 0. Потенциал реакции восстановления, протекающей на электроде в стандартных условиях, называют стандартным 9 электродным потенциалом.
 Стандартный водородный электрод Как и в случае потенциальной энергии, физический смысл имеет только разность потенциалов полуячеек. Поэтому необходимо было выбрать стандартный потенциал какого-то электрода за ноль и измерять потенциалы остальных электродов по отношению к нему. Согласно международному соглашению в качестве такого электрода был выбран водородный электрод, потенциал которого принят равным нулю. Водородный электрод состоит из платиновой пластины, покрытой тонким слоем платиной черни и опущенной в водный раствор серной кислоты с активной концентрацией Н+, равной 1 М. Через этот раствор пропускается ток чистого водорода под давлением 1 атм. 10
Стандартный водородный электрод Как и в случае потенциальной энергии, физический смысл имеет только разность потенциалов полуячеек. Поэтому необходимо было выбрать стандартный потенциал какого-то электрода за ноль и измерять потенциалы остальных электродов по отношению к нему. Согласно международному соглашению в качестве такого электрода был выбран водородный электрод, потенциал которого принят равным нулю. Водородный электрод состоит из платиновой пластины, покрытой тонким слоем платиной черни и опущенной в водный раствор серной кислоты с активной концентрацией Н+, равной 1 М. Через этот раствор пропускается ток чистого водорода под давлением 1 атм. 10
 Стандартный водородный электрод 2 H+ (р-р, 1 M) + 2 e = H 2 (г, 1 атм) E°= 0, 000 В 11
Стандартный водородный электрод 2 H+ (р-р, 1 M) + 2 e = H 2 (г, 1 атм) E°= 0, 000 В 11
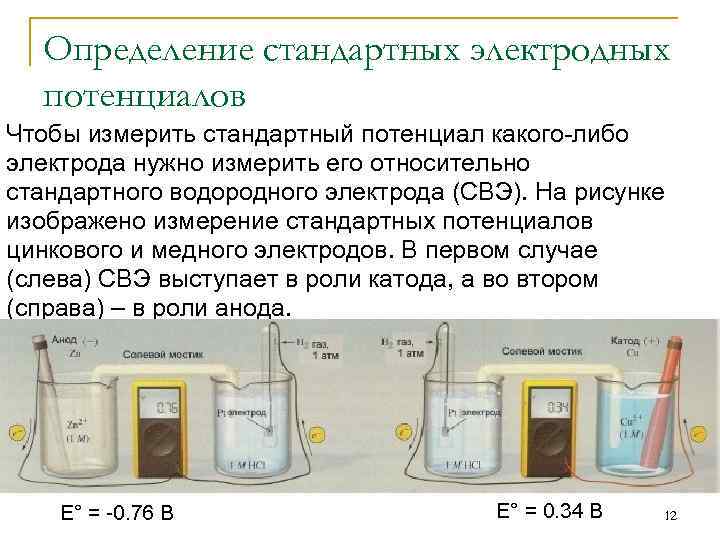 Определение стандартных электродных потенциалов Чтобы измерить стандартный потенциал какого-либо электрода нужно измерить его относительно стандартного водородного электрода (СВЭ). На рисунке изображено измерение стандартных потенциалов цинкового и медного электродов. В первом случае (слева) СВЭ выступает в роли катода, а во втором (справа) – в роли анода. E° = -0. 76 В E° = 0. 34 В 12
Определение стандартных электродных потенциалов Чтобы измерить стандартный потенциал какого-либо электрода нужно измерить его относительно стандартного водородного электрода (СВЭ). На рисунке изображено измерение стандартных потенциалов цинкового и медного электродов. В первом случае (слева) СВЭ выступает в роли катода, а во втором (справа) – в роли анода. E° = -0. 76 В E° = 0. 34 В 12
 Определение стандартных электродных потенциалов Потенциал цинкового электрода отрицательный, потому что в элементе с СВЭ он выполняет роль анода. E° = E°кат – E°ан 0, 76 В = 0 В - E°(Zn 2+/Zn) = - 0, 76 В Медный электрод выполняет роль катода. Поэтому его стандартный потенциал положительный. E°(Cu 2+/Cu) = 0, 34 В Следует отметить, что стандартный водородный электрод неудобен для практического применения. Однако, на практике можно измерять потенциалы неизвестных электродов относительно любого электрода, стандартный потенциал которого известен! Стандартный электродный потенциал – величина интенсивная, т. е. не зависит от стехиометрического 13 коэффициента!
Определение стандартных электродных потенциалов Потенциал цинкового электрода отрицательный, потому что в элементе с СВЭ он выполняет роль анода. E° = E°кат – E°ан 0, 76 В = 0 В - E°(Zn 2+/Zn) = - 0, 76 В Медный электрод выполняет роль катода. Поэтому его стандартный потенциал положительный. E°(Cu 2+/Cu) = 0, 34 В Следует отметить, что стандартный водородный электрод неудобен для практического применения. Однако, на практике можно измерять потенциалы неизвестных электродов относительно любого электрода, стандартный потенциал которого известен! Стандартный электродный потенциал – величина интенсивная, т. е. не зависит от стехиометрического 13 коэффициента!
 Сокращенная запись процессов в гальванических элементах Химиками была разработана условная сокращенная запись гальванических элементов. Схема медно-цинкового элемента записывается как: Zn | Zn 2+ || Cu 2+ | Cu Слева в такой записи записывается анодная полуреакция. При этом вещества, находящиеся в разных фазах обычно разделяют одинарной вертикальной чертой. Анодная полуреакция отделяется от катодной двойной вертикальной чертой. Если в реакции участвует инертный электрод, как в СВЭ, то его записывают снаружи. Также можно записать концентрацию ионов и давление газов. Например, элементы для определения потенциалов Zn и Cu электродов относительно СВЭ записываются так: Zn | Zn 2+ || H+ | H 2 | Pt Pt | H 2 | H+ || Cu 2+ | Cu 14
Сокращенная запись процессов в гальванических элементах Химиками была разработана условная сокращенная запись гальванических элементов. Схема медно-цинкового элемента записывается как: Zn | Zn 2+ || Cu 2+ | Cu Слева в такой записи записывается анодная полуреакция. При этом вещества, находящиеся в разных фазах обычно разделяют одинарной вертикальной чертой. Анодная полуреакция отделяется от катодной двойной вертикальной чертой. Если в реакции участвует инертный электрод, как в СВЭ, то его записывают снаружи. Также можно записать концентрацию ионов и давление газов. Например, элементы для определения потенциалов Zn и Cu электродов относительно СВЭ записываются так: Zn | Zn 2+ || H+ | H 2 | Pt Pt | H 2 | H+ || Cu 2+ | Cu 14
 Ряд напряжений металлов 15
Ряд напряжений металлов 15
 Расчет стандартного потенциала элемента Пример. Рассчитайте стандартный потенциал гальванического элемента, в котором протекают следующие полуреакции: Cd 2+ + 2 e Cd Sn 2+ + 2 e Sn и определите, какой из электродов является анодом, а какой катодом. Решение. В таблице стандартных электродных потенциалов находим стандартные потенциалы полуреакций: E°(Cd 2+/Cd) = -0, 403 В; E°(Sn 2+/Sn) = -0, 136 В. Поскольку стандартный потенциал второй полуреакции больше (менее отрицательный), именно олово будет катодом. Катодная полуреакция : Sn 2+ + 2 e Sn Анодная полуреакция: Cd - 2 e Cd 2+ E°элемента = E°катод – E°анод = -0, 136 – (-0, 403) = 0, 267 В. 16
Расчет стандартного потенциала элемента Пример. Рассчитайте стандартный потенциал гальванического элемента, в котором протекают следующие полуреакции: Cd 2+ + 2 e Cd Sn 2+ + 2 e Sn и определите, какой из электродов является анодом, а какой катодом. Решение. В таблице стандартных электродных потенциалов находим стандартные потенциалы полуреакций: E°(Cd 2+/Cd) = -0, 403 В; E°(Sn 2+/Sn) = -0, 136 В. Поскольку стандартный потенциал второй полуреакции больше (менее отрицательный), именно олово будет катодом. Катодная полуреакция : Sn 2+ + 2 e Sn Анодная полуреакция: Cd - 2 e Cd 2+ E°элемента = E°катод – E°анод = -0, 136 – (-0, 403) = 0, 267 В. 16
 Зависимость потенциала элемента от концентрации Потенциал гальванического элемента зависит от концентраций ионов согласно уравнению Нернста. E = E° - RT/n. F * ln ([прод]/[реаг]). Здесь, R – универсальная газовая постоянная, T – абсолютная температура, n – число электронов, переносимых в реакции, F – постоянная Фарадея, [прод] – произведение концентраций всех продуктов, [реаг] – произведение концентраций всех реагентов. При 25°С оно приобретает вид: E = E° - 0, 0592/n * lg ([прод]/[реаг]). Вальтер Герман Нернст (1864 -1941) Нобелевская премия по химии 1920 г. 17
Зависимость потенциала элемента от концентрации Потенциал гальванического элемента зависит от концентраций ионов согласно уравнению Нернста. E = E° - RT/n. F * ln ([прод]/[реаг]). Здесь, R – универсальная газовая постоянная, T – абсолютная температура, n – число электронов, переносимых в реакции, F – постоянная Фарадея, [прод] – произведение концентраций всех продуктов, [реаг] – произведение концентраций всех реагентов. При 25°С оно приобретает вид: E = E° - 0, 0592/n * lg ([прод]/[реаг]). Вальтер Герман Нернст (1864 -1941) Нобелевская премия по химии 1920 г. 17
 Концентрационные элементы Концентрационными элементами называют гальванические элементы, имеющие одинаковый химический состав реагирующих частиц в анодном и катодном отделениях, и различающихся только концентрацией этих частиц. Очевидно, что стандартный потенциал такого элемента равен нулю, т. е. его потенциал определяется по уравнению Нернста как: E = - 0, 0592/n * lg ([прод]/[реаг]). Чтобы общий потенциал был положителен, в числитель под логарифмом пойдем концентрация более разбавленного раствора, а в знаменатель – более концентрированного. Концентрационные элементы удобно использовать для определения концентрации раствора, т. к. если концентрация одного из растворов известна, то эдс элемента будет 18 пропорциональна логарифму концентрации другого раствора
Концентрационные элементы Концентрационными элементами называют гальванические элементы, имеющие одинаковый химический состав реагирующих частиц в анодном и катодном отделениях, и различающихся только концентрацией этих частиц. Очевидно, что стандартный потенциал такого элемента равен нулю, т. е. его потенциал определяется по уравнению Нернста как: E = - 0, 0592/n * lg ([прод]/[реаг]). Чтобы общий потенциал был положителен, в числитель под логарифмом пойдем концентрация более разбавленного раствора, а в знаменатель – более концентрированного. Концентрационные элементы удобно использовать для определения концентрации раствора, т. к. если концентрация одного из растворов известна, то эдс элемента будет 18 пропорциональна логарифму концентрации другого раствора
 Электролизом называется совокупность химических процессов, протекающих при пропускании постоянного электрического тока через растворы или расплавы электролитов. При электролизе химическая (окислительновосстановительная реакция) протекает за счет энергии электрического тока. Ячейка для электролиза называется электролизером, состоит из двух электродов, погруженных в электролит. Электрод, подключенный к отрицательному полюсу внешнего источника тока, называется катодом. На нем протекают реакции восстановления. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом, на нем протекают реакции окисления. 19
Электролизом называется совокупность химических процессов, протекающих при пропускании постоянного электрического тока через растворы или расплавы электролитов. При электролизе химическая (окислительновосстановительная реакция) протекает за счет энергии электрического тока. Ячейка для электролиза называется электролизером, состоит из двух электродов, погруженных в электролит. Электрод, подключенный к отрицательному полюсу внешнего источника тока, называется катодом. На нем протекают реакции восстановления. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом, на нем протекают реакции окисления. 19
 Реакции на катоде при электролизе На катоде в первую очередь восстанавливаются наиболее сильные окислители с большим значением электродного потенциала: 1) легко восстанавливаются катионы металлов, имеющие положительные значения стандартных электродных потенциалов (Au+, Pt 2+, Hg 2+, Cu 2+ и т. д. ), а также другие окислители (Pb. O 2, Gal 2, O 2 и т. д. ); 2) не восстанавливаются из водных растворов катионы металлов, имеющих значения стандартных электродных потенциалов меньше – 0, 8 В (Na+, Mg 2+, Al 3+ и т. д. ), а восстанавливаются катионы водорода (при р. Н < 7) или молекулы воды (при р. Н ≥ 7): 2 H+ + 2ē → H 2, 2 H 2 O + 2ē → H 2 + 2 OH–; 3) при больших плотностях тока, восстанавливаются катионы металлов со значением потенциала от – 0, 8 В до 0, 0 В (Zn 2+, Fe 2+, Ni 2+ и т. д. ). Если в растворе электролита находится смесь катионов, то они восстанавливаются на катоде в порядке уменьшения величины стандартного электродного потенциала. 20
Реакции на катоде при электролизе На катоде в первую очередь восстанавливаются наиболее сильные окислители с большим значением электродного потенциала: 1) легко восстанавливаются катионы металлов, имеющие положительные значения стандартных электродных потенциалов (Au+, Pt 2+, Hg 2+, Cu 2+ и т. д. ), а также другие окислители (Pb. O 2, Gal 2, O 2 и т. д. ); 2) не восстанавливаются из водных растворов катионы металлов, имеющих значения стандартных электродных потенциалов меньше – 0, 8 В (Na+, Mg 2+, Al 3+ и т. д. ), а восстанавливаются катионы водорода (при р. Н < 7) или молекулы воды (при р. Н ≥ 7): 2 H+ + 2ē → H 2, 2 H 2 O + 2ē → H 2 + 2 OH–; 3) при больших плотностях тока, восстанавливаются катионы металлов со значением потенциала от – 0, 8 В до 0, 0 В (Zn 2+, Fe 2+, Ni 2+ и т. д. ). Если в растворе электролита находится смесь катионов, то они восстанавливаются на катоде в порядке уменьшения величины стандартного электродного потенциала. 20
 Реакции на аноде при электролизе На аноде протекают процессы окисления восстановителей, веществ с меньшим значением потенциала. Различают процессы с растворимым и нерастворимым анодом. В качестве нерастворимого (инертного) анода чаще всего используется графит, золото, платина, а также диоксид свинца и оксид рутения. В случае нерастворимого анода: 1) легко окисляются анионы бескислородных кислот (Сl–, Br–, S 2–); 2) не окисляются из водного раствора анионы кислородсодержащих кислот в высших степенях оксиления (SO 42–, NO 3–, PO 43–и т. д. ), а окисляются гидроксо-группы (при р. Н≥ 7) или молекулы воды (при р. Н≤ 7): 4 OH– – 4ē → O 2 + 2 H 2 O, 2 H 2 O – 4ē → O 2 + 4 H+. Если потенциал анода имеет меньшее значение, чем потенциалы других восстановителей в растворе, то происходит растворение (окисление) анода: 21 Me 0 – nē → Men+.
Реакции на аноде при электролизе На аноде протекают процессы окисления восстановителей, веществ с меньшим значением потенциала. Различают процессы с растворимым и нерастворимым анодом. В качестве нерастворимого (инертного) анода чаще всего используется графит, золото, платина, а также диоксид свинца и оксид рутения. В случае нерастворимого анода: 1) легко окисляются анионы бескислородных кислот (Сl–, Br–, S 2–); 2) не окисляются из водного раствора анионы кислородсодержащих кислот в высших степенях оксиления (SO 42–, NO 3–, PO 43–и т. д. ), а окисляются гидроксо-группы (при р. Н≥ 7) или молекулы воды (при р. Н≤ 7): 4 OH– – 4ē → O 2 + 2 H 2 O, 2 H 2 O – 4ē → O 2 + 4 H+. Если потенциал анода имеет меньшее значение, чем потенциалы других восстановителей в растворе, то происходит растворение (окисление) анода: 21 Me 0 – nē → Men+.
 Получение натрия и хлора электролизом В промышленности электролиз используется для получения многих металлов из расплавов солей. Например, металлический натрий и хлор получают электролизом расплава Na. Cl при Т > 800°C. Катод 2 Na+ + 2 e 2 Na Анод 2 Cl- Cl 2 + 2 e E° = - 4 В Для протекания реакции в стандартных условиях необходимо приложение внешнего потенциала больше 4 В. 22
Получение натрия и хлора электролизом В промышленности электролиз используется для получения многих металлов из расплавов солей. Например, металлический натрий и хлор получают электролизом расплава Na. Cl при Т > 800°C. Катод 2 Na+ + 2 e 2 Na Анод 2 Cl- Cl 2 + 2 e E° = - 4 В Для протекания реакции в стандартных условиях необходимо приложение внешнего потенциала больше 4 В. 22
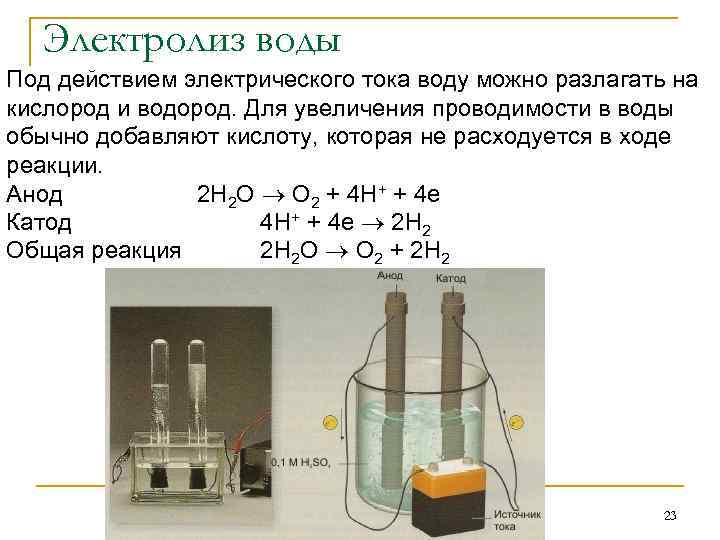 Электролиз воды Под действием электрического тока воду можно разлагать на кислород и водород. Для увеличения проводимости в воды обычно добавляют кислоту, которая не расходуется в ходе реакции. Анод 2 H 2 O O 2 + 4 H+ + 4 e Катод 4 H+ + 4 e 2 H 2 Общая реакция 2 H 2 O O 2 + 2 H 2 23
Электролиз воды Под действием электрического тока воду можно разлагать на кислород и водород. Для увеличения проводимости в воды обычно добавляют кислоту, которая не расходуется в ходе реакции. Анод 2 H 2 O O 2 + 4 H+ + 4 e Катод 4 H+ + 4 e 2 H 2 Общая реакция 2 H 2 O O 2 + 2 H 2 23
 1 -й закон Фарадея Законы Фарадея устанавливают зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химическое превращение на электроде. 1 -й закон: масса вещества, испытавшего электрохимическое превращение на электроде, прямо пропорционально количеству прошедшего электричества: m = M 1/z * I * t / F = M * I * t / (n * F) где m – масса вещества, г; M 1/z – молярная масса эквивалента вещества, г/моль; M - молярная масса вещества, г/моль; I – сила тока, А; t – время процесса, с; F – постоянная Фарадея, равная 96485 Кл/моль; n – количество электронов в реакции на электроде. 24
1 -й закон Фарадея Законы Фарадея устанавливают зависимость между количеством прошедшего электричества и количеством вещества, испытавшего химическое превращение на электроде. 1 -й закон: масса вещества, испытавшего электрохимическое превращение на электроде, прямо пропорционально количеству прошедшего электричества: m = M 1/z * I * t / F = M * I * t / (n * F) где m – масса вещества, г; M 1/z – молярная масса эквивалента вещества, г/моль; M - молярная масса вещества, г/моль; I – сила тока, А; t – время процесса, с; F – постоянная Фарадея, равная 96485 Кл/моль; n – количество электронов в реакции на электроде. 24
 2 -й закон Фарадея: массы прореагировавших на электродах веществ, при постоянном количестве электричества, относятся друг к другу как их химические эквиваленты: m 1: m 2: m 3 = M 1/z 1: M 1/z 2: M 1/z 3. На законах Фарадея основаны расчеты электрохимических установок: зная количество вещества, испытавшего превращение на электроде, можно рассчитать количество электричества, затраченное на процесс электролиза. 25
2 -й закон Фарадея: массы прореагировавших на электродах веществ, при постоянном количестве электричества, относятся друг к другу как их химические эквиваленты: m 1: m 2: m 3 = M 1/z 1: M 1/z 2: M 1/z 3. На законах Фарадея основаны расчеты электрохимических установок: зная количество вещества, испытавшего превращение на электроде, можно рассчитать количество электричества, затраченное на процесс электролиза. 25
 Поляризация электродов При прохождении электрического тока через электролизёр на каждом электроде происходит отклонение их потенциалов от своих равновесных значений – поляризация: ΔЕ = Еi – Ер, где ΔЕ – поляризация электрода, В; Еi – потенциал электрода при прохождении тока, В; Ер – равновесный потенциал электрода, В. Различают катодную и анодную поляризацию. Вследствие катодной поляризации (ΔЕк) потенциал катода становится более отрицательным, а в результате анодной поляризации (ΔЕа) потенциал анода – более положительным. ΔЕ = ΔЕк + ΔЕа Следовательно, разность потенциалов электродов при электролизе гораздо больше, чем разность равновесных электродных потенциалов. 26
Поляризация электродов При прохождении электрического тока через электролизёр на каждом электроде происходит отклонение их потенциалов от своих равновесных значений – поляризация: ΔЕ = Еi – Ер, где ΔЕ – поляризация электрода, В; Еi – потенциал электрода при прохождении тока, В; Ер – равновесный потенциал электрода, В. Различают катодную и анодную поляризацию. Вследствие катодной поляризации (ΔЕк) потенциал катода становится более отрицательным, а в результате анодной поляризации (ΔЕа) потенциал анода – более положительным. ΔЕ = ΔЕк + ΔЕа Следовательно, разность потенциалов электродов при электролизе гораздо больше, чем разность равновесных электродных потенциалов. 26
 Коррозия Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды, например образование ржавчины из железа. Потери металлов от коррозии очень велики и только в США оцениваются в 70 миллиардов долларов в год. В процессе коррозии происходит переход из металлического состояния в ионное. Коррозия – самопроизвольный процесс, сопровождается уменьшением свободной энергии (ΔG<0), увеличением энтропии системы и определенным энергетическим 27 эффектом.
Коррозия Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды, например образование ржавчины из железа. Потери металлов от коррозии очень велики и только в США оцениваются в 70 миллиардов долларов в год. В процессе коррозии происходит переход из металлического состояния в ионное. Коррозия – самопроизвольный процесс, сопровождается уменьшением свободной энергии (ΔG<0), увеличением энтропии системы и определенным энергетическим 27 эффектом.
 Электрохимическая коррозия Разрушение металла при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической коррозией. В атмосферных условиях роль электролита играет водная пленка на металлической поверхности, в которых часто растворены электропроводящие примеси. Электродами обычно являются сам металл и примеси в нем содержащиеся. Скорость коррозии тем больше, чем дальше отстоят в ряду напряжений металлы, из которых образовалась гальваническая пара. Скорость коррозии возрастает с ростом температуры и с увеличением концентрации окислителя в растворе. 28
Электрохимическая коррозия Разрушение металла при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической коррозией. В атмосферных условиях роль электролита играет водная пленка на металлической поверхности, в которых часто растворены электропроводящие примеси. Электродами обычно являются сам металл и примеси в нем содержащиеся. Скорость коррозии тем больше, чем дальше отстоят в ряду напряжений металлы, из которых образовалась гальваническая пара. Скорость коррозии возрастает с ростом температуры и с увеличением концентрации окислителя в растворе. 28
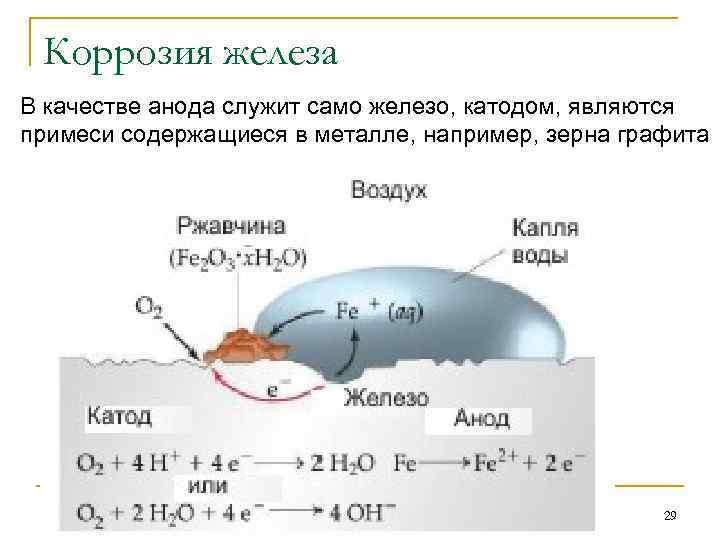 Коррозия железа В качестве анода служит само железо, катодом, являются примеси содержащиеся в металле, например, зерна графита 29
Коррозия железа В качестве анода служит само железо, катодом, являются примеси содержащиеся в металле, например, зерна графита 29
 Методы защиты от коррозии Широко применяются следующие методы защиты металлических конструкций от коррозии: 1. Защитные покрытия. 2. Антикоррозионное легирование металла. 3. Электрохимическая защита. 4. Обработка коррозионной среды. 5. Разработка и производство новых металлических конструкционных материалов повышенной коррозионной устойчивости. Выбор одного из методов защиты основывается не только на технических соображениях, но и на экономических расчетах. Самым дешевым и распространенным методом являются лакокрасочные покрытия. 30
Методы защиты от коррозии Широко применяются следующие методы защиты металлических конструкций от коррозии: 1. Защитные покрытия. 2. Антикоррозионное легирование металла. 3. Электрохимическая защита. 4. Обработка коррозионной среды. 5. Разработка и производство новых металлических конструкционных материалов повышенной коррозионной устойчивости. Выбор одного из методов защиты основывается не только на технических соображениях, но и на экономических расчетах. Самым дешевым и распространенным методом являются лакокрасочные покрытия. 30
 Катодные и анодные покрытия Для защиты от коррозии используют металлические покрытия. По характеру защитного действия различают анодные и катодные покрытия. К анодным покрытиям относятся такие покрытия, в которых покрывающий металл обладает в данной среде более отрицательным электродным потенциалом (оцинкованное железо). К катодным относятся покрытия из менее активных металлов (луженое железо, никелевое покрытие железа). Пока слой, покрывающий основной металл, полностью изолирует его от воздействия окружающей среды, принципиального различия между этими двумя видами покрытий нет. При нарушении целостности покрытия создаются различные условия. В порах цинкового покрытия на железе цинк является анодом, а железо - катодом. Цинк растворяется в электролите, а железо не будет разрушаться, пока сохраняется цинковое покрытие. Никелевое покрытие на железе - катодное. 31 Железо выполняет роль анода и разрушается.
Катодные и анодные покрытия Для защиты от коррозии используют металлические покрытия. По характеру защитного действия различают анодные и катодные покрытия. К анодным покрытиям относятся такие покрытия, в которых покрывающий металл обладает в данной среде более отрицательным электродным потенциалом (оцинкованное железо). К катодным относятся покрытия из менее активных металлов (луженое железо, никелевое покрытие железа). Пока слой, покрывающий основной металл, полностью изолирует его от воздействия окружающей среды, принципиального различия между этими двумя видами покрытий нет. При нарушении целостности покрытия создаются различные условия. В порах цинкового покрытия на железе цинк является анодом, а железо - катодом. Цинк растворяется в электролите, а железо не будет разрушаться, пока сохраняется цинковое покрытие. Никелевое покрытие на железе - катодное. 31 Железо выполняет роль анода и разрушается.
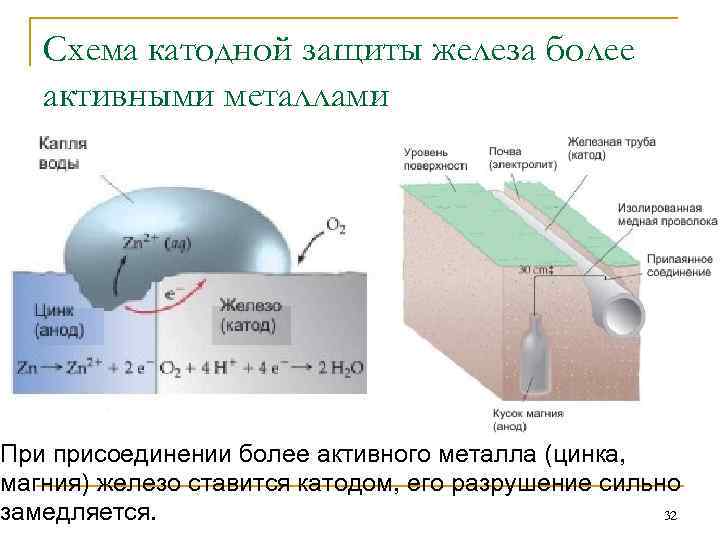 Схема катодной защиты железа более активными металлами При присоединении более активного металла (цинка, магния) железо ставится катодом, его разрушение сильно замедляется. 32
Схема катодной защиты железа более активными металлами При присоединении более активного металла (цинка, магния) железо ставится катодом, его разрушение сильно замедляется. 32
 Пример экзаменационного билета 33
Пример экзаменационного билета 33


