Галогены Выполнил: Яров А. В.














 Галогены Выполнил: Яров А. В.
Галогены Выполнил: Яров А. В.
 Общее рассмотрение Физические свойства галогенов существенно различаются: так, при нормальных условиях фтор – бледно-желтый, трудносжижаемый газ; хлор – также газ желто-зеленого цвета, но 2 2 сжижается легко; бром – красно-коричневая густая жидкость; йод – блестящие серо-черные кристаллы.
Общее рассмотрение Физические свойства галогенов существенно различаются: так, при нормальных условиях фтор – бледно-желтый, трудносжижаемый газ; хлор – также газ желто-зеленого цвета, но 2 2 сжижается легко; бром – красно-коричневая густая жидкость; йод – блестящие серо-черные кристаллы.
 Галоген + Металл l Фтор взаимодействует со ВСЕМИ Ме. l Хлор, бром и йод без нагревания реагирует с щелочными и щелочноземельными металлами, с сурьмой. При нагревании – с медью, железом и оловом. В результате взаимодействия образуются галогениды, которые являются солями: 2 Мe + n. Hal 2 = 2 Me. Haln.
Галоген + Металл l Фтор взаимодействует со ВСЕМИ Ме. l Хлор, бром и йод без нагревания реагирует с щелочными и щелочноземельными металлами, с сурьмой. При нагревании – с медью, железом и оловом. В результате взаимодействия образуются галогениды, которые являются солями: 2 Мe + n. Hal 2 = 2 Me. Haln.
 Галоген + Неметалл l Фтор реагирует со всеми Неме, кроме He, Ne, и Ar. Реакция Хе с F 2 происходят под действием электрического разряда, в результате чего образуются фториды Хе (Хе. F 2, Xe. F 4 и Xe. F 6). Так же под действием электрического разряда фтор реагирует с О 2 F 2 + O 2 = F 2 O 2 l Хлор непосредственно не реагирует с углеродом, азотом и кислородом. l Бром менее химически активен, чем фтор и хлор, хотя с некоторыми неме способен реагировать без нагревания(S, Si, P, Se, Te) l Из неметаллов реагирует напрямую без нагревания только с фосфором и мышьяком. Si + F 2 = Si. F 4 Si + Br 2 = Si. Br 4 2 Pбел + 5 Cl 2 = 2 PCl 5 Br + 2 S = S 2 Cl 2 2 B + 3 F 2 = 2 BF 3
Галоген + Неметалл l Фтор реагирует со всеми Неме, кроме He, Ne, и Ar. Реакция Хе с F 2 происходят под действием электрического разряда, в результате чего образуются фториды Хе (Хе. F 2, Xe. F 4 и Xe. F 6). Так же под действием электрического разряда фтор реагирует с О 2 F 2 + O 2 = F 2 O 2 l Хлор непосредственно не реагирует с углеродом, азотом и кислородом. l Бром менее химически активен, чем фтор и хлор, хотя с некоторыми неме способен реагировать без нагревания(S, Si, P, Se, Te) l Из неметаллов реагирует напрямую без нагревания только с фосфором и мышьяком. Si + F 2 = Si. F 4 Si + Br 2 = Si. Br 4 2 Pбел + 5 Cl 2 = 2 PCl 5 Br + 2 S = S 2 Cl 2 2 B + 3 F 2 = 2 BF 3
 Галогены + Н 2 l Фтор реагирует с H 2 при обычных условиях. l Хлор с водородом реагирует при нагревании или на свету. - - Сl- + hv = Cl + Cl+ 2 Cl + H 2 = HCl + H l Бром реагирует с водородом только при нагревании. l Йод реагирует с водородом при сильном нагревании. Эта реакция обратима и эндотермична. Br 2 + H 2 = 2 HBr +73 к. Дж I 2 + H 2 2 HI - 53 к. Дж
Галогены + Н 2 l Фтор реагирует с H 2 при обычных условиях. l Хлор с водородом реагирует при нагревании или на свету. - - Сl- + hv = Cl + Cl+ 2 Cl + H 2 = HCl + H l Бром реагирует с водородом только при нагревании. l Йод реагирует с водородом при сильном нагревании. Эта реакция обратима и эндотермична. Br 2 + H 2 = 2 HBr +73 к. Дж I 2 + H 2 2 HI - 53 к. Дж
 Галоген + Галоген (интергалогены) l При взаимодействии галогенов между собой образуются интергалогены. В роли восстановителя выступает элемент с меньшей электроотрицательностью. I 2 + 3 Cl 2 = 2 ICl 3 I 2 + Br 2 = 2 IBr l Взаимодействие галогенов с фтором(при нагревании) приводит к образованию фторидгалогенов (с. о. хлора, брома, йода +1, фтора -1) t Hal + F 2 2 Hal. F
Галоген + Галоген (интергалогены) l При взаимодействии галогенов между собой образуются интергалогены. В роли восстановителя выступает элемент с меньшей электроотрицательностью. I 2 + 3 Cl 2 = 2 ICl 3 I 2 + Br 2 = 2 IBr l Взаимодействие галогенов с фтором(при нагревании) приводит к образованию фторидгалогенов (с. о. хлора, брома, йода +1, фтора -1) t Hal + F 2 2 Hal. F
 Галоген + H 2 O l F 2 + H 2 O = 2 HF + O +Q Атомарный кислород взаимодействуют друг с другом, а также с молекулами H 2 O и F 2. 3 F 2 + 3 H 2 O = F 2 O + HF + H 2 O 2 l Хлор и Бром реагируют с водой одинаково: Cl 2 + H 2 O HCl + HCl. O Br 2 + H 2 O HBr + HBr. O l ЙОД НЕ РЕАГИРУЕТ С ВОДОЙ!
Галоген + H 2 O l F 2 + H 2 O = 2 HF + O +Q Атомарный кислород взаимодействуют друг с другом, а также с молекулами H 2 O и F 2. 3 F 2 + 3 H 2 O = F 2 O + HF + H 2 O 2 l Хлор и Бром реагируют с водой одинаково: Cl 2 + H 2 O HCl + HCl. O Br 2 + H 2 O HBr + HBr. O l ЙОД НЕ РЕАГИРУЕТ С ВОДОЙ!
 Галоген + Щелочи l При взаимодействии щелочей и Фтора, щелочи участвуют в ОВР. 2 F 2 + 2 Nа. ОН = 2 Nа. F + Н 2 О + F 2 О l Остальные галогены диспрапорцианируют. холод - + Сl 2 + 2 KOH Na. Cl + Na. Cl. O + H 2 O t - +5 3 Cl 2 + 6 Na. OH 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O 3 l Для брома и йода: 3 Hal 2 + 6 Na. OH = 5 Na. Hal +Na. Hal. O 3 + 3 H 2 O
Галоген + Щелочи l При взаимодействии щелочей и Фтора, щелочи участвуют в ОВР. 2 F 2 + 2 Nа. ОН = 2 Nа. F + Н 2 О + F 2 О l Остальные галогены диспрапорцианируют. холод - + Сl 2 + 2 KOH Na. Cl + Na. Cl. O + H 2 O t - +5 3 Cl 2 + 6 Na. OH 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O 3 l Для брома и йода: 3 Hal 2 + 6 Na. OH = 5 Na. Hal +Na. Hal. O 3 + 3 H 2 O
 Галоген + Галоген-ион l Более активные галогены способны вытеснять менее активные из растворов галогеноводородных кислот и их солей: Сl 2 + 2 HBr = 2 HCl + Br 2 + KI = 2 KBr + I 2
Галоген + Галоген-ион l Более активные галогены способны вытеснять менее активные из растворов галогеноводородных кислот и их солей: Сl 2 + 2 HBr = 2 HCl + Br 2 + KI = 2 KBr + I 2
 Галоген + Сложные вещества l Галогены способны отнимать водород от водородных соединений других элементов: Hal 2 + H 2 S = 2 HHal + S l Галогены – сильные окислители. Они могут доокислять сульфит-ионы до сульфатов, нитрит-ионы до нитратов H 2 SO 3 + Br 2 + H 2 O = H 2 SO 4 + HBr l йод может проявлять восстановительные свойства: 0 +5 I + 5 HCl. O + H 2 O = 2 HIO 3 + 5 HCl 2
Галоген + Сложные вещества l Галогены способны отнимать водород от водородных соединений других элементов: Hal 2 + H 2 S = 2 HHal + S l Галогены – сильные окислители. Они могут доокислять сульфит-ионы до сульфатов, нитрит-ионы до нитратов H 2 SO 3 + Br 2 + H 2 O = H 2 SO 4 + HBr l йод может проявлять восстановительные свойства: 0 +5 I + 5 HCl. O + H 2 O = 2 HIO 3 + 5 HCl 2
 Галогеноводороды l При растворении галогеноводородов в воде образуются растворы галогеноводородных кислот. HF HCl HBr HI увеличение силы кислоты Все галогеноводородные кислоты, кроме плавиковой – сильные. В хим. реакциях они проявляют все свойства сильных кислот: Mg + HCl = Mg. Cl 2 + H 2 Fe. O + 2 HBr = Fe. Br 2 + H 2 O Al(OH)3 + 3 HI = Al. I 3 + H 2 O Mg(HCO 3)2 + 2 HCl = Mg + 2 CO 2 + 2 H 2 O BF 3 + HF = HBF 4 В отличие от всех других галогеноводородных кислот, плавиковая кислота в растворах частично полимеризована за счет водородных связей с образованием молекул (HF)x – H 2 F 2, H 3 F 3 и т. д. 2 Zn + 2 H 2 F 2 = 2 Zn. HF 2 + H 2 Также для плавиковой кислоты характерно присоединение к фторидам активных ме за счет водородных связей: KF + HF = K{F(HF)}
Галогеноводороды l При растворении галогеноводородов в воде образуются растворы галогеноводородных кислот. HF HCl HBr HI увеличение силы кислоты Все галогеноводородные кислоты, кроме плавиковой – сильные. В хим. реакциях они проявляют все свойства сильных кислот: Mg + HCl = Mg. Cl 2 + H 2 Fe. O + 2 HBr = Fe. Br 2 + H 2 O Al(OH)3 + 3 HI = Al. I 3 + H 2 O Mg(HCO 3)2 + 2 HCl = Mg + 2 CO 2 + 2 H 2 O BF 3 + HF = HBF 4 В отличие от всех других галогеноводородных кислот, плавиковая кислота в растворах частично полимеризована за счет водородных связей с образованием молекул (HF)x – H 2 F 2, H 3 F 3 и т. д. 2 Zn + 2 H 2 F 2 = 2 Zn. HF 2 + H 2 Также для плавиковой кислоты характерно присоединение к фторидам активных ме за счет водородных связей: KF + HF = K{F(HF)}
 Реакции с галогенводородами l Галогены в HHal имеют минимальную с. о. (-1), следовательно они - - - способны только окисляться. Восстановительная активность в ряду Сl-Br-I повышается. HI + O 2 = I 2 + H 2 O 2 KMn. O 4 + 16 HCl = 2 Mn. Cl 2 + 2 KCl + 8 H 2 O + 5 Cl 2 +7 - +2 0 2 KMn. O 4 + 10 KI + 8 H 2 SO 4 = 2 Mn. SO 4 + 5 I 2 + 6 KSO 4 + 8 H 2 O Отдельного внимания заслуживает реакция плавиковой кислоты с оксидом кремния IV HF + Si. O 2 = Si. F 4 + H 2 O изб HF + Si. O 2 = H 2 Si. F 6 + H 2 O , т. к Si. F 4 + 2 Hf = H 2 Si. F 6 изб
Реакции с галогенводородами l Галогены в HHal имеют минимальную с. о. (-1), следовательно они - - - способны только окисляться. Восстановительная активность в ряду Сl-Br-I повышается. HI + O 2 = I 2 + H 2 O 2 KMn. O 4 + 16 HCl = 2 Mn. Cl 2 + 2 KCl + 8 H 2 O + 5 Cl 2 +7 - +2 0 2 KMn. O 4 + 10 KI + 8 H 2 SO 4 = 2 Mn. SO 4 + 5 I 2 + 6 KSO 4 + 8 H 2 O Отдельного внимания заслуживает реакция плавиковой кислоты с оксидом кремния IV HF + Si. O 2 = Si. F 4 + H 2 O изб HF + Si. O 2 = H 2 Si. F 6 + H 2 O , т. к Si. F 4 + 2 Hf = H 2 Si. F 6 изб
 Получение галогеноводородов l В промышленности HF и HCl получают действие конц. серной кислоты на галогениды: Сa. F 2 тв + H 2 SO 4 конц = 2 HF + Ca. SO 4 2 Na. Cl + H 2 SO 4 конц = 2 HCl +Na 2 SO 4 Этот процесс НЕ используют для получения HBr и HI из-за их окисления серной кислотой l Бромид и йодид водорода получают гидролизом соответствующих галогенидо фосфора: PHal 3 + 3 H 2 O = H 3 PO 3 + HHal
Получение галогеноводородов l В промышленности HF и HCl получают действие конц. серной кислоты на галогениды: Сa. F 2 тв + H 2 SO 4 конц = 2 HF + Ca. SO 4 2 Na. Cl + H 2 SO 4 конц = 2 HCl +Na 2 SO 4 Этот процесс НЕ используют для получения HBr и HI из-за их окисления серной кислотой l Бромид и йодид водорода получают гидролизом соответствующих галогенидо фосфора: PHal 3 + 3 H 2 O = H 3 PO 3 + HHal
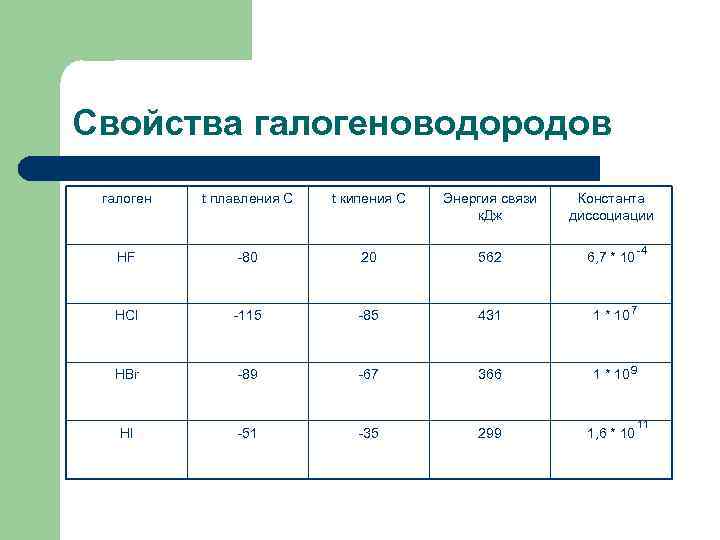
 Свойства галогеноводородов галоген t плавления С t кипения С Энергия связи Константа к. Дж диссоциации -4 HF -80 20 562 6, 7 * 10 HCl -115 -85 431 1 * 10 7 HBr -89 -67 366 1 * 10 9 11 HI -51 -35 299 1, 6 * 10
Свойства галогеноводородов галоген t плавления С t кипения С Энергия связи Константа к. Дж диссоциации -4 HF -80 20 562 6, 7 * 10 HCl -115 -85 431 1 * 10 7 HBr -89 -67 366 1 * 10 9 11 HI -51 -35 299 1, 6 * 10

