21926.ppt
- Количество слайдов: 70
 ГАЛОГЕНОПРОИЗВОДНЫЕ Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены галогеном. Их общая формула: R–X где R – углеводородный радикал; X = F, Cl, Br или I. Если R = Сn. Н 2 n+1, т. е. является алкильным радикалом, то галогенопроизводные называются алкилгалогенидами или галогеналканами.
ГАЛОГЕНОПРОИЗВОДНЫЕ Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены галогеном. Их общая формула: R–X где R – углеводородный радикал; X = F, Cl, Br или I. Если R = Сn. Н 2 n+1, т. е. является алкильным радикалом, то галогенопроизводные называются алкилгалогенидами или галогеналканами.
 ГАЛОГЕНОПРОИЗВОДНЫЕ ИЗОМЕРИЯ R – X. НОМЕНКЛАТУРА Изомерия Cn. H 2 n+1 X обусловлена: а) изомерией углеродного скелета; б) положением галогена; –С–С–С–С–С– Х а) Х б) –С–С–С–С–С– Х–С– Х
ГАЛОГЕНОПРОИЗВОДНЫЕ ИЗОМЕРИЯ R – X. НОМЕНКЛАТУРА Изомерия Cn. H 2 n+1 X обусловлена: а) изомерией углеродного скелета; б) положением галогена; –С–С–С–С–С– Х а) Х б) –С–С–С–С–С– Х–С– Х
 ГАЛОГЕНОПРОИЗВОДНЫЕ НОМЕНКЛАТУРА R – X 1. Рациональная номенклатура = название радикала R + название галогена X Причем название X ставится либо перед, либо после названия радикала: СН 3 Сl хлористый метил (метилхлорид) СН 3 – СН 2 – Br бромистый пропил (пропилбромид)
ГАЛОГЕНОПРОИЗВОДНЫЕ НОМЕНКЛАТУРА R – X 1. Рациональная номенклатура = название радикала R + название галогена X Причем название X ставится либо перед, либо после названия радикала: СН 3 Сl хлористый метил (метилхлорид) СН 3 – СН 2 – Br бромистый пропил (пропилбромид)
 ГАЛОГЕНОПРОИЗВОДНЫЕ 2. Заместительная номенклатура: CH 3 5 4 CI 3 2 1 СН 3–СН–СН 2– СН–СН 3 4 -метил-2 -хлорпентан 5 H 3 C 4 3 1 СН 2 Cl 2 СН 3 –СН = С – СН–СН 2 –СН 3 3 -метил-1 хлор-2 -этилпентан-3
ГАЛОГЕНОПРОИЗВОДНЫЕ 2. Заместительная номенклатура: CH 3 5 4 CI 3 2 1 СН 3–СН–СН 2– СН–СН 3 4 -метил-2 -хлорпентан 5 H 3 C 4 3 1 СН 2 Cl 2 СН 3 –СН = С – СН–СН 2 –СН 3 3 -метил-1 хлор-2 -этилпентан-3
 ГАЛОГЕНОПРОИЗВОДНЫЕ АРИЛГАЛОГЕНИДЫ Общая формула Ar – X; в этих соединениях галоген непосредственно связан с атомом углерода ароматического кольца (поэтому мало подвижен!!): СH 3 Br бромбензол Br 1 -бром-3 -метилбензол (М-бромтолуол)
ГАЛОГЕНОПРОИЗВОДНЫЕ АРИЛГАЛОГЕНИДЫ Общая формула Ar – X; в этих соединениях галоген непосредственно связан с атомом углерода ароматического кольца (поэтому мало подвижен!!): СH 3 Br бромбензол Br 1 -бром-3 -метилбензол (М-бромтолуол)
 ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X (звездочкой (*) отмечены методы, используемые также в промышленности). 1. Из спиртов: действием галогеноводородов (НХ) и галогенидов фосфора (РХ): Общая схема: НХ или R – OH РХ , PX R–X 3 5 спирт алкилгалогенид
ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X (звездочкой (*) отмечены методы, используемые также в промышленности). 1. Из спиртов: действием галогеноводородов (НХ) и галогенидов фосфора (РХ): Общая схема: НХ или R – OH РХ , PX R–X 3 5 спирт алкилгалогенид
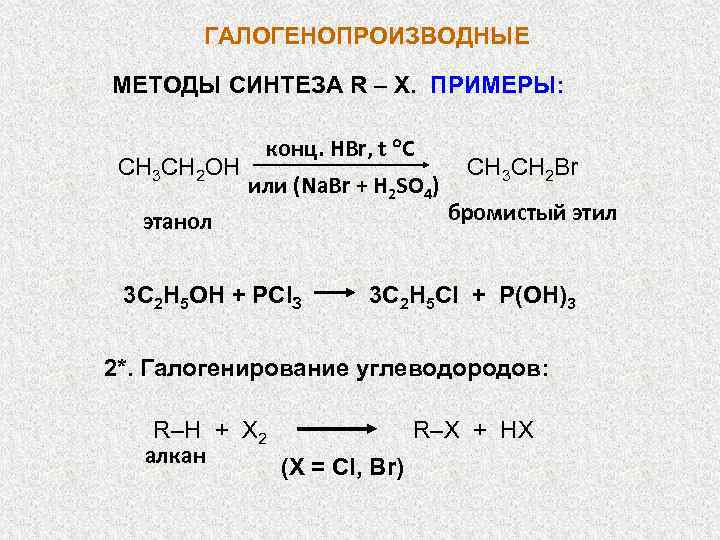 ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X. ПРИМЕРЫ: СН 3 СН 2 OН конц. НBr, t C или (Na. Br + H 2 SO 4) этанол 3 С 2 Н 5 ОН + РСl. З СН 3 СН 2 Br бромистый этил 3 C 2 H 5 Cl + P(OH)3 2*. Галогенирование углеводородов: R–H + X 2 алкан R–X + HX (X = Cl, Br)
ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X. ПРИМЕРЫ: СН 3 СН 2 OН конц. НBr, t C или (Na. Br + H 2 SO 4) этанол 3 С 2 Н 5 ОН + РСl. З СН 3 СН 2 Br бромистый этил 3 C 2 H 5 Cl + P(OH)3 2*. Галогенирование углеводородов: R–H + X 2 алкан R–X + HX (X = Cl, Br)
 ГАЛОГЕНОПРОИЗВОДНЫЕ 3*. Присоединение галогеноводородов к алкенам: –С=С– HX –С–С– H алкен Х 4*. Присоединение галогенов к алкенам и алкинам: –С=С– Х 2 –С–С– Х Н– С ≡ С –Н Х 2 Х Н– СХ 2–Н
ГАЛОГЕНОПРОИЗВОДНЫЕ 3*. Присоединение галогеноводородов к алкенам: –С=С– HX –С–С– H алкен Х 4*. Присоединение галогенов к алкенам и алкинам: –С=С– Х 2 –С–С– Х Н– С ≡ С –Н Х 2 Х Н– СХ 2–Н
 ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ Промышленные способы: 1. 1. Галогенирование алканов (обычно образуются смеси изомеров, что несколько снижает ценность метода): CH 4 метан CI 2 t 0 C CH 3 Cl CI 2 t 0 C CH 2 Cl 2 CI 2 t 0 C CHCl 3 CI 2 CCl 4 1. 2. Присоединение галогеноводородов и галогенов к алкенам и алкинам: HCl, Hg. Cl 2 НС≡СН СН 2=СН–Сl ацетилен хлористый винил
ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ Промышленные способы: 1. 1. Галогенирование алканов (обычно образуются смеси изомеров, что несколько снижает ценность метода): CH 4 метан CI 2 t 0 C CH 3 Cl CI 2 t 0 C CH 2 Cl 2 CI 2 t 0 C CHCl 3 CI 2 CCl 4 1. 2. Присоединение галогеноводородов и галогенов к алкенам и алкинам: HCl, Hg. Cl 2 НС≡СН СН 2=СН–Сl ацетилен хлористый винил
 ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ СН 2 = СН 2 Cl 2 СН 2 – СН 2 Сl этилен Сl 500 C СН 2=СН–Сl хлористый винил 1. 3. Фторопроизводные получают из других галогенопроизводных при помощи неорганических фторидов: 2 СН 3 Cl + Hg 2 F 2 C 7 H 16 + 32 Co. F 3 2 CH 3 F + Hg 2 Cl 2 C 7 F 16 + 16 HF + 32 Co. F 2 полифториды:
ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ СН 2 = СН 2 Cl 2 СН 2 – СН 2 Сl этилен Сl 500 C СН 2=СН–Сl хлористый винил 1. 3. Фторопроизводные получают из других галогенопроизводных при помощи неорганических фторидов: 2 СН 3 Cl + Hg 2 F 2 C 7 H 16 + 32 Co. F 3 2 CH 3 F + Hg 2 Cl 2 C 7 F 16 + 16 HF + 32 Co. F 2 полифториды:
 ГАЛОГЕНОПРОИЗВОДНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА R – X 1. Температура плавления и кипения R – X > Температура плавления и кипения R – H ? 2. При данном R температура кипения повышается в ряду: R–F R–Cl R–Br R–I ? 3. Растворимость R – X: хотя R – X – полярные соединения, они нерастворимы в воде (почему ? ), но хорошо растворимы в обычных органических растворителях.
ГАЛОГЕНОПРОИЗВОДНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА R – X 1. Температура плавления и кипения R – X > Температура плавления и кипения R – H ? 2. При данном R температура кипения повышается в ряду: R–F R–Cl R–Br R–I ? 3. Растворимость R – X: хотя R – X – полярные соединения, они нерастворимы в воде (почему ? ), но хорошо растворимы в обычных органических растворителях.
 ГАЛОГЕНОПРОИЗВОДНЫЕ РАСТВОРИМОСТЬ: ОБЩИЕ ЗАКОНОМЕРНОСТИ Старинное правило: «ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ» Компонент В Компонент А (Растворяемое вещество) (Растворитель) ЭНЕРГИЯ СВЯЗЕЙ Е: 1. ЕА∙∙∙A > ЕA∙∙∙B нет растворения 2. ЕB∙∙∙B > ЕA∙∙∙B нет растворения 3. ЕA∙∙∙A ЕA∙∙∙B ЕB∙∙∙B есть растворение
ГАЛОГЕНОПРОИЗВОДНЫЕ РАСТВОРИМОСТЬ: ОБЩИЕ ЗАКОНОМЕРНОСТИ Старинное правило: «ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ» Компонент В Компонент А (Растворяемое вещество) (Растворитель) ЭНЕРГИЯ СВЯЗЕЙ Е: 1. ЕА∙∙∙A > ЕA∙∙∙B нет растворения 2. ЕB∙∙∙B > ЕA∙∙∙B нет растворения 3. ЕA∙∙∙A ЕA∙∙∙B ЕB∙∙∙B есть растворение
 ГАЛОГЕНОПРОИЗВОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА R – X Характерной чертой RX является наличие группировки: . . δ– C –. . : X δ+ Анализ строения позволяет отметить следующее: 1. функциональная группа не имеет кратных связей, поэтому несклонна к реакциям присоединения; 2. галогены как элементы более электроотрицательные, чем углерод, создают на связанном с ними атоме углерода частичный положительный заряд ( +).
ГАЛОГЕНОПРОИЗВОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА R – X Характерной чертой RX является наличие группировки: . . δ– C –. . : X δ+ Анализ строения позволяет отметить следующее: 1. функциональная группа не имеет кратных связей, поэтому несклонна к реакциям присоединения; 2. галогены как элементы более электроотрицательные, чем углерод, создают на связанном с ними атоме углерода частичный положительный заряд ( +).
 ГАЛОГЕНОПРОИЗВОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА R – X Отмеченные обстоятельства заставляют предположить: Наиболее характерными реакциями галогено-производных будут реакции нуклеофильного замещения (SN – реакции). «S» - от слова «substitution» - замещение; «N» - от слова «nucleophilic» . В SN – реакциях происходит атака нуклеофила : Nu (т. е. реагента, предоставляющего электронную пару) на атом углерода с вытеснением галогена в виде : X– Nu: + R : X R: Nu + : X–
ГАЛОГЕНОПРОИЗВОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА R – X Отмеченные обстоятельства заставляют предположить: Наиболее характерными реакциями галогено-производных будут реакции нуклеофильного замещения (SN – реакции). «S» - от слова «substitution» - замещение; «N» - от слова «nucleophilic» . В SN – реакциях происходит атака нуклеофила : Nu (т. е. реагента, предоставляющего электронную пару) на атом углерода с вытеснением галогена в виде : X– Nu: + R : X R: Nu + : X–
 НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: МЕХАНИЗМ РЕАКЦИИ В зависимости от природы галогенопроизводного (R – X), нуклеофильного реагента (: Nu) и условий реакции (растворитель, температура) процессы нуклеофильного замещения могут идти по двум механизмам: SN 1 или SN 2.
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: МЕХАНИЗМ РЕАКЦИИ В зависимости от природы галогенопроизводного (R – X), нуклеофильного реагента (: Nu) и условий реакции (растворитель, температура) процессы нуклеофильного замещения могут идти по двум механизмам: SN 1 или SN 2.
 ХИМИЧЕСКИЕ СВОЙСТВА R – X SN – реакция: механизм и кинетика. Рассмотрим реакцию между трет-бутилбромидом и гидроксид-ионом: CH 3 СН 3 – С – Br + : OH– CH 3 – C – OH + : Br– CH 3 трет-бутилбромид CH 3 трет-бутанол Известно (экспериментальный факт!), что скорость этой реакции зависит от концентрации только одного реагента - трет-бутилбромида: = К (СН 3)3 СBr
ХИМИЧЕСКИЕ СВОЙСТВА R – X SN – реакция: механизм и кинетика. Рассмотрим реакцию между трет-бутилбромидом и гидроксид-ионом: CH 3 СН 3 – С – Br + : OH– CH 3 – C – OH + : Br– CH 3 трет-бутилбромид CH 3 трет-бутанол Известно (экспериментальный факт!), что скорость этой реакции зависит от концентрации только одного реагента - трет-бутилбромида: = К (СН 3)3 СBr
 ХИМИЧЕСКИЕ СВОЙСТВА R – X SN – РЕАКЦИЯ: МЕХАНИЗМ И КИНЕТИКА. Возникает вопрос, почему скорость реакции не зависит от концентрации гидроксид-иона : ОН– ? Ответ: Если скорость реакции не зависит от ОН– , это может означать только то, что гидроксид-ион не участвует в реакции, скорость которой определяют.
ХИМИЧЕСКИЕ СВОЙСТВА R – X SN – РЕАКЦИЯ: МЕХАНИЗМ И КИНЕТИКА. Возникает вопрос, почему скорость реакции не зависит от концентрации гидроксид-иона : ОН– ? Ответ: Если скорость реакции не зависит от ОН– , это может означать только то, что гидроксид-ион не участвует в реакции, скорость которой определяют.
 Отсюда можно предположить следующий механизм реакции: 1. Медленная стадия (лимитирующая скорость): CH 3 – C – Br CH 3 – C+ + : Br– CH 3 2. Вторая стадия: быстрая (СН 3)3 С+ + : ОН– (СН 3)3 С–ОН
Отсюда можно предположить следующий механизм реакции: 1. Медленная стадия (лимитирующая скорость): CH 3 – C – Br CH 3 – C+ + : Br– CH 3 2. Вторая стадия: быстрая (СН 3)3 С+ + : ОН– (СН 3)3 С–ОН
 SN 1 -ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД: Первая стадия – ионизация реагента и образование карбкатиона (протекает медленно) Вторая стадия – взаимодействие карбкатиона с нуклеофильной частицей (идет быстро) + – 1. R : X – + 2. R + : Nu – + R + : X медленно + – R : Nu быстро
SN 1 -ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД: Первая стадия – ионизация реагента и образование карбкатиона (протекает медленно) Вторая стадия – взаимодействие карбкатиона с нуклеофильной частицей (идет быстро) + – 1. R : X – + 2. R + : Nu – + R + : X медленно + – R : Nu быстро
 SN 1 -ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД: Скорость SN 1 – реакции зависит только от концентрации алкилгалогенида, т. е. SN 1 – реакция является реакцией первого порядка: = k RX Скорость общей реакции определяется первой (медленной) стадией: как быстро ионизируется RX. Порядком реакции по данному реагенту называют степень в которой его концентрация входит в уравнение скорости реакции; общий порядок равен сумме этих степеней.
SN 1 -ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД: Скорость SN 1 – реакции зависит только от концентрации алкилгалогенида, т. е. SN 1 – реакция является реакцией первого порядка: = k RX Скорость общей реакции определяется первой (медленной) стадией: как быстро ионизируется RX. Порядком реакции по данному реагенту называют степень в которой его концентрация входит в уравнение скорости реакции; общий порядок равен сумме этих степеней.
 ХИМИЧЕСКИЕ СВОЙСТВА R – X SN – РЕАКЦИЯ: МЕХАНИЗМ И КИНЕТИКА. Рассмотрим теперь реакцию бромистого метила с гидроксид-ионом, приводящую к метиловому спирту: СН 3 Br + : ОН– ‒ СН 3 ОН + : Br Кинетические данные для этой реакции показывают, что скорость реакции в этом случае зависит от концентрации обоих реагентов и выражается кинетическим уравнением второго порядка: = К [НО: ][СН 3 Br] Это бимолекулярное нуклеофильное замещение или SN 2 -реакция
ХИМИЧЕСКИЕ СВОЙСТВА R – X SN – РЕАКЦИЯ: МЕХАНИЗМ И КИНЕТИКА. Рассмотрим теперь реакцию бромистого метила с гидроксид-ионом, приводящую к метиловому спирту: СН 3 Br + : ОН– ‒ СН 3 ОН + : Br Кинетические данные для этой реакции показывают, что скорость реакции в этом случае зависит от концентрации обоих реагентов и выражается кинетическим уравнением второго порядка: = К [НО: ][СН 3 Br] Это бимолекулярное нуклеофильное замещение или SN 2 -реакция
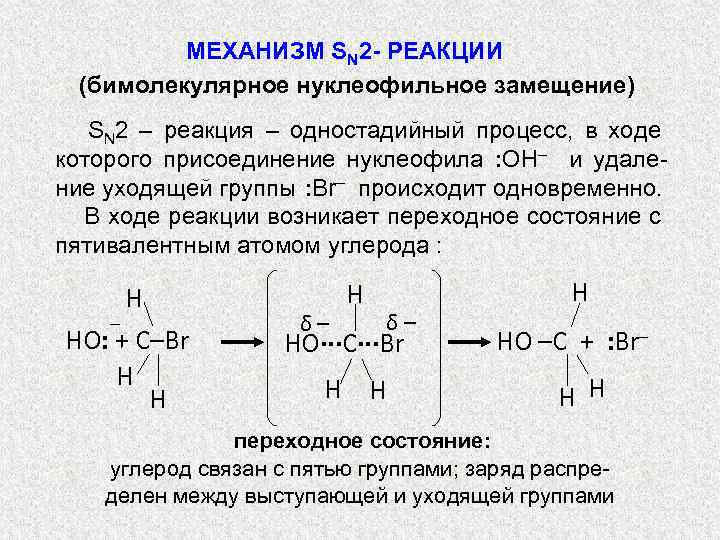 МЕХАНИЗМ SN 2 - РЕАКЦИИ (бимолекулярное нуклеофильное замещение) SN 2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила : OH– и удаление уходящей группы : Br– происходит одновременно. В ходе реакции возникает переходное состояние с пятивалентным атомом углерода : – H HO: + С–Br H H δ– HO∙∙∙C∙∙∙Br H HO –C + : Br– H H переходное состояние: углерод связан с пятью группами; заряд распределен между выступающей и уходящей группами
МЕХАНИЗМ SN 2 - РЕАКЦИИ (бимолекулярное нуклеофильное замещение) SN 2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила : OH– и удаление уходящей группы : Br– происходит одновременно. В ходе реакции возникает переходное состояние с пятивалентным атомом углерода : – H HO: + С–Br H H δ– HO∙∙∙C∙∙∙Br H HO –C + : Br– H H переходное состояние: углерод связан с пятью группами; заряд распределен между выступающей и уходящей группами
 SN 2 -ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД: SN 2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила : Nu– и удаление уходящей группы : X– происходит одновременно. В ходе реакции возникает переходное состояние с пятивалентным атомом углерода : Nu: – – С –X δδNu∙∙∙C∙∙∙X Nu –C – +: X– переходное состояние: углерод связан с пятью группами; заряд распре делен между выступающей и уходящей группами
SN 2 -ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД: SN 2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила : Nu– и удаление уходящей группы : X– происходит одновременно. В ходе реакции возникает переходное состояние с пятивалентным атомом углерода : Nu: – – С –X δδNu∙∙∙C∙∙∙X Nu –C – +: X– переходное состояние: углерод связан с пятью группами; заряд распре делен между выступающей и уходящей группами
 ПРИРОДА НУКЛЕОФИЛЬНОГО РЕАГЕНТА: Роль нуклеофильного реагента могут играть как анионы, так и нейтральные частицы. Характер действия каждого их них иллюстрируется следующими уравнениями: 1. R–X + : Nu– 2. R–X + : Nu R–Nu 3. R–X + H–Nu: R–Nu: + : X– + : X R–Nu+–H + : X– + HX
ПРИРОДА НУКЛЕОФИЛЬНОГО РЕАГЕНТА: Роль нуклеофильного реагента могут играть как анионы, так и нейтральные частицы. Характер действия каждого их них иллюстрируется следующими уравнениями: 1. R–X + : Nu– 2. R–X + : Nu R–Nu 3. R–X + H–Nu: R–Nu: + : X– + : X R–Nu+–H + : X– + HX
 ПРИМЕРЫ НУКЛЕОФИЛОВ: а) Анионы: НО– RO– RCOO– СN– (гидроксил-анион) (алкоголят-ионы) (ионы органических кислот) (цианид-ион) . . б) Нейтральные молекулы: Н 2 О, NH 3 и их производные. . ROR, NH 2 R, NHR 2, NR 3 – нуклеофильные свойства нейтральных молекул обусловлены свободной электронной парой.
ПРИМЕРЫ НУКЛЕОФИЛОВ: а) Анионы: НО– RO– RCOO– СN– (гидроксил-анион) (алкоголят-ионы) (ионы органических кислот) (цианид-ион) . . б) Нейтральные молекулы: Н 2 О, NH 3 и их производные. . ROR, NH 2 R, NHR 2, NR 3 – нуклеофильные свойства нейтральных молекул обусловлены свободной электронной парой.
 ГАЛОГЕНОПРОИЗВОДНЫЕ НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: примеры реакций + + – С 2 H 5 Cl + KOH CH 3 CH 2 Cl + H 2 O этилхлорид C 2 H 5 OH + KCl CH 3 CH 2 OH + HCl этанол
ГАЛОГЕНОПРОИЗВОДНЫЕ НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: примеры реакций + + – С 2 H 5 Cl + KOH CH 3 CH 2 Cl + H 2 O этилхлорид C 2 H 5 OH + KCl CH 3 CH 2 OH + HCl этанол
 НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: ОБШАЯ СХЕМА: R: X + : Nu R: Nu + : X– ПРИМЕРЫ РЕАКЦИЙ 1. R: X + : ОН– R: OH + : X– 2. R: X + Н 2 О: R: OH + H: X 3. R: X + R: OR′ + : X– -: OR′ спирт простой эфир
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: ОБШАЯ СХЕМА: R: X + : Nu R: Nu + : X– ПРИМЕРЫ РЕАКЦИЙ 1. R: X + : ОН– R: OH + : X– 2. R: X + Н 2 О: R: OH + H: X 3. R: X + R: OR′ + : X– -: OR′ спирт простой эфир
 НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: ПРИМЕРЫ РЕАКЦИЙ 4. R: X + –: С ≡ СR′ R: C ≡ CR′ + : X– алкин 5. R: X + Na: R′ R: R′ + : X– алкан 6. R: X + : I– R: I + : X– иодистый алкил 7. R: X + : CN– R: CN + : X– нитрил 8. R: X + R′COO: – R′COO: R + : X– сложный эфир
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: ПРИМЕРЫ РЕАКЦИЙ 4. R: X + –: С ≡ СR′ R: C ≡ CR′ + : X– алкин 5. R: X + Na: R′ R: R′ + : X– алкан 6. R: X + : I– R: I + : X– иодистый алкил 7. R: X + : CN– R: CN + : X– нитрил 8. R: X + R′COO: – R′COO: R + : X– сложный эфир
 НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: ПРИМЕРЫ РЕАКЦИЙ R: NH 3 9. R: X+ : NH 3 10. R: X + : NH 2 R′ +: X– : NH 3 R: NH 2 R′ +X– R–NH 2 амин RNHR′ + НX вторичный амин реакция Фриделя – Крафтса: 11. R: X + Ar. H арен 12. и др. … Al. Cl 3 Ar – R алкилбензол
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ: ПРИМЕРЫ РЕАКЦИЙ R: NH 3 9. R: X+ : NH 3 10. R: X + : NH 2 R′ +: X– : NH 3 R: NH 2 R′ +X– R–NH 2 амин RNHR′ + НX вторичный амин реакция Фриделя – Крафтса: 11. R: X + Ar. H арен 12. и др. … Al. Cl 3 Ar – R алкилбензол
 ДРУГИЕ РЕАКЦИИ ГАЛОГЕНОПРОИЗВОДНЫ 2) Дегидрогалогенирование: отщепление –С–С– H Х КОН (спирт) – С = С – + НХ 3) Синтез реактива Гриньяра: RX + Mg эфир RMg. X
ДРУГИЕ РЕАКЦИИ ГАЛОГЕНОПРОИЗВОДНЫ 2) Дегидрогалогенирование: отщепление –С–С– H Х КОН (спирт) – С = С – + НХ 3) Синтез реактива Гриньяра: RX + Mg эфир RMg. X
 СТЕРЕОХИМИЯ SN 1 -Реакций 1. Первая стадия: ионизация галогенопроизводного (медленная стадия). 1 R C–X 3 2 R R 1 R + C 3 R +: X– 2 R карбкатион (плоская конфигурация)
СТЕРЕОХИМИЯ SN 1 -Реакций 1. Первая стадия: ионизация галогенопроизводного (медленная стадия). 1 R C–X 3 2 R R 1 R + C 3 R +: X– 2 R карбкатион (плоская конфигурация)
 СТЕРЕОХИМИЯ SN 1 -Реакций 2. Вторая стадия (быстрая): подход нуклеофила возможен с любой стороны плоскости. 1 R + C 2 R C – Nu 2 3 R R 3 R + : Nu– 1 R Nu – C 2 3 R R рацемат
СТЕРЕОХИМИЯ SN 1 -Реакций 2. Вторая стадия (быстрая): подход нуклеофила возможен с любой стороны плоскости. 1 R + C 2 R C – Nu 2 3 R R 3 R + : Nu– 1 R Nu – C 2 3 R R рацемат
 СТЕРЕОХИМИЯ SN 1 - Реакций повторение пройденного 1. + C – С –X расположение связей тетраэдрическое + 2. C + : X– карбкатион расположение связей: плоское треугольное – С – Nu + : Nu Nu – C – рацемат (равномолекулярная) смесь оптических антиподов
СТЕРЕОХИМИЯ SN 1 - Реакций повторение пройденного 1. + C – С –X расположение связей тетраэдрическое + 2. C + : X– карбкатион расположение связей: плоское треугольное – С – Nu + : Nu Nu – C – рацемат (равномолекулярная) смесь оптических антиподов
 КИНЕТИКА SN 1 -Реакций повторение пройденного Скорость SN 1 – реакции определяется кинетическим уравнением первого порядка, т. е. зависит только от концентрации RX: = К (СН 3)3 С–Cl CH 3 1. СН 3–С–Сl + (CH 3)3 C + : Cl– ; CH 3 2. + (СН 3)3 С + : ОН– (СН 3)3 С–ОН
КИНЕТИКА SN 1 -Реакций повторение пройденного Скорость SN 1 – реакции определяется кинетическим уравнением первого порядка, т. е. зависит только от концентрации RX: = К (СН 3)3 С–Cl CH 3 1. СН 3–С–Сl + (CH 3)3 C + : Cl– ; CH 3 2. + (СН 3)3 С + : ОН– (СН 3)3 С–ОН
 СТЕХЕОХИМИЯ SN 1 – РЕАКЦИЙ Конечный продукт SN 1 – реакции представляет собой смесь оптических антиподов – рацемат. Образование рацемата можно представить из схемы:
СТЕХЕОХИМИЯ SN 1 – РЕАКЦИЙ Конечный продукт SN 1 – реакции представляет собой смесь оптических антиподов – рацемат. Образование рацемата можно представить из схемы:
 СТЕХЕОХИМИЯ SN 1 – РЕАКЦИЙ : Nu‒ R′′ R″ R′ R′ R′ C Nu C+ Nu R″ C R″′ R′″ подход нуклеофила возможен с любой стороны плоского карбкатиона
СТЕХЕОХИМИЯ SN 1 – РЕАКЦИЙ : Nu‒ R′′ R″ R′ R′ R′ C Nu C+ Nu R″ C R″′ R′″ подход нуклеофила возможен с любой стороны плоского карбкатиона
 SN 2 – РЕАКЦИИ δ- δ- Nu: – + – С –X Nu –C – +: X– Nu∙∙∙C∙∙∙X переходное состояние СТЕРИЧЕСКИЕ (ПРОСТРАНСТВЕННЫЕ) ЗАТРУДНЕНИЯ CH 3 Nu: C CH 3 X
SN 2 – РЕАКЦИИ δ- δ- Nu: – + – С –X Nu –C – +: X– Nu∙∙∙C∙∙∙X переходное состояние СТЕРИЧЕСКИЕ (ПРОСТРАНСТВЕННЫЕ) ЗАТРУДНЕНИЯ CH 3 Nu: C CH 3 X
 SN 1 – МЕХАНИЗМ: РЕАКЦИОННАЯ СПОСОБНОСТЬ Выше отмечалось, что SN 1 – реакция – двухстадийный процесс, общая скорость которого определяется лимитирующей стадией, т. е. стадией образования карбкатиона: 1. R: X 2. R+ + : Nu– R + + : X – R: Nu медленно быстро Поэтому реакционная способность RX изменяется в том же направлении, что и устойчивость карбкатионов.
SN 1 – МЕХАНИЗМ: РЕАКЦИОННАЯ СПОСОБНОСТЬ Выше отмечалось, что SN 1 – реакция – двухстадийный процесс, общая скорость которого определяется лимитирующей стадией, т. е. стадией образования карбкатиона: 1. R: X 2. R+ + : Nu– R + + : X – R: Nu медленно быстро Поэтому реакционная способность RX изменяется в том же направлении, что и устойчивость карбкатионов.
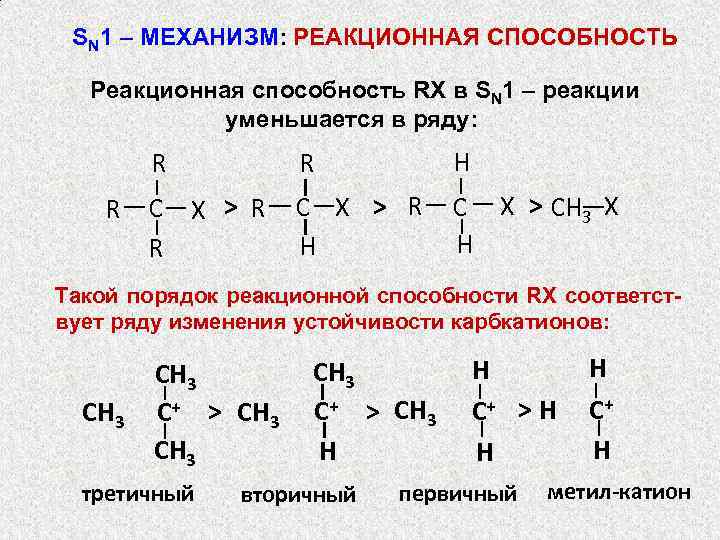 SN 1 – МЕХАНИЗМ: РЕАКЦИОННАЯ СПОСОБНОСТЬ Реакционная способность RX в SN 1 – реакции уменьшается в ряду: R R R H C X > R R C X > R H C X > CH 3 X H Такой порядок реакционной способности RX соответствует ряду изменения устойчивости карбкатионов: CH 3 C+ > CH 3 третичный CH 3 C+ > CH 3 H вторичный H C+ > H H первичный H C+ H метил-катион
SN 1 – МЕХАНИЗМ: РЕАКЦИОННАЯ СПОСОБНОСТЬ Реакционная способность RX в SN 1 – реакции уменьшается в ряду: R R R H C X > R R C X > R H C X > CH 3 X H Такой порядок реакционной способности RX соответствует ряду изменения устойчивости карбкатионов: CH 3 C+ > CH 3 третичный CH 3 C+ > CH 3 H вторичный H C+ > H H первичный H C+ H метил-катион
 ГАЛОГЕНОПРОИЗВОДНЫЕ Механизм SN 2 (бимолекулярное нуклеофильное замещение) SN 2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила : Nu– и удаление уходящей группы : X– происходит одновременно. В ходе реакции возникает переходное состояние с пятивалентным атомом углерода : Nu: – – С –X δNu. CX δ- Nu –C – +: X– переходное состояние: углерод связан с пятью группами; заряд распределен между вступающей и уходящей группами
ГАЛОГЕНОПРОИЗВОДНЫЕ Механизм SN 2 (бимолекулярное нуклеофильное замещение) SN 2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила : Nu– и удаление уходящей группы : X– происходит одновременно. В ходе реакции возникает переходное состояние с пятивалентным атомом углерода : Nu: – – С –X δNu. CX δ- Nu –C – +: X– переходное состояние: углерод связан с пятью группами; заряд распределен между вступающей и уходящей группами
 ГАЛОГЕНОПРОИЗВОДНЫЕ Такой механизм согласуется с данными по кинетике, стереохимиии и реакционной способности процесса: 1. Кинетические данные: В качестве примера рассмотрим реакцию бромистого метила с гидроксид-ионом, приводящую к метиловому спирту: – H HO: + С–Br H H δ– HO∙∙∙C∙∙∙Br H HO –C + : Br– H H
ГАЛОГЕНОПРОИЗВОДНЫЕ Такой механизм согласуется с данными по кинетике, стереохимиии и реакционной способности процесса: 1. Кинетические данные: В качестве примера рассмотрим реакцию бромистого метила с гидроксид-ионом, приводящую к метиловому спирту: – H HO: + С–Br H H δ– HO∙∙∙C∙∙∙Br H HO –C + : Br– H H
 ГАЛОГЕНОПРОИЗВОДНЫЕ В решающей стадии реакции участвуют оба реагента и НО: – и СН 3 Br, следовательно скорость реакции должна быть пропорциональна концентрации обоих реагентов: = К [НО: ][СН 3 Br] (кинетическое уравнение второго порядка) Эксперименты показывают, что это действительно так, т. е. SN 2 – реакция имеет второй порядок.
ГАЛОГЕНОПРОИЗВОДНЫЕ В решающей стадии реакции участвуют оба реагента и НО: – и СН 3 Br, следовательно скорость реакции должна быть пропорциональна концентрации обоих реагентов: = К [НО: ][СН 3 Br] (кинетическое уравнение второго порядка) Эксперименты показывают, что это действительно так, т. е. SN 2 – реакция имеет второй порядок.
 2. СТЕРЕОХИМИЯ SN 2 – ЗАМЕЩЕНИЯ: Изучение SN – реакций на примере оптически активных алкилгалогенидов (и др. веществ) показало, что в том случае, когда реакция имеет второй порядок (т. е. вслучае SN 2 – замещения) конечный продукт имеет конфигурацию противоположную конфигурации исходного вещества (является оптическим антиподом). ВАЛЬДЕНОВСКОЕ ОБРАЩЕНИЕ (П. Вальден, кон. XIX в. ). Процесс обращения конфигурации можно сравнить с выворачиванием зонтика от сильного ветра. Роль «ветра» здесь играет нуклеофил : Nu–, роль «спиц» валентные связи:
2. СТЕРЕОХИМИЯ SN 2 – ЗАМЕЩЕНИЯ: Изучение SN – реакций на примере оптически активных алкилгалогенидов (и др. веществ) показало, что в том случае, когда реакция имеет второй порядок (т. е. вслучае SN 2 – замещения) конечный продукт имеет конфигурацию противоположную конфигурации исходного вещества (является оптическим антиподом). ВАЛЬДЕНОВСКОЕ ОБРАЩЕНИЕ (П. Вальден, кон. XIX в. ). Процесс обращения конфигурации можно сравнить с выворачиванием зонтика от сильного ветра. Роль «ветра» здесь играет нуклеофил : Nu–, роль «спиц» валентные связи:
 2. СТЕРЕОХИМИЯ SN 2 – ЗАМЕЩЕНИЯ: R 2 R 1 R 2 −Br Nu: – R 3 R 1 δ∙∙∙Br δ- Nu ∙∙∙ R 3 R 2 + : Br– Nu― R 3 Обращение конфигурации в SN 2 – реакциях указыва-ет на то, что нуклеофил атакует молекулу с тыла, т. е. со стороны, противоположной той, где находится галоген. Если бы нуклеофил атаковал молекулу с той же стороны, где находится галоген (фронтальная атака), то обращение конфигурации не наблюдалось бы. Это наглядно видно на примере взаимодействия гидроксидиона с цис-3 -метилциклопентилхлоридом:
2. СТЕРЕОХИМИЯ SN 2 – ЗАМЕЩЕНИЯ: R 2 R 1 R 2 −Br Nu: – R 3 R 1 δ∙∙∙Br δ- Nu ∙∙∙ R 3 R 2 + : Br– Nu― R 3 Обращение конфигурации в SN 2 – реакциях указыва-ет на то, что нуклеофил атакует молекулу с тыла, т. е. со стороны, противоположной той, где находится галоген. Если бы нуклеофил атаковал молекулу с той же стороны, где находится галоген (фронтальная атака), то обращение конфигурации не наблюдалось бы. Это наглядно видно на примере взаимодействия гидроксидиона с цис-3 -метилциклопентилхлоридом:
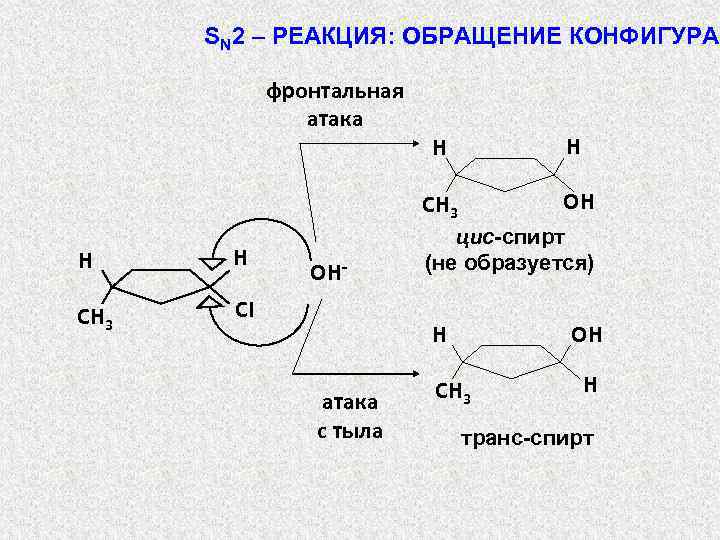 SN 2 – РЕАКЦИЯ: ОБРАЩЕНИЕ КОНФИГУРАЦ фронтальная атака H CH 3 CI OH- H CH 3 H H OH цис-спирт (не образуется) H атака с тыла OH CH 3 H транс-спирт
SN 2 – РЕАКЦИЯ: ОБРАЩЕНИЕ КОНФИГУРАЦ фронтальная атака H CH 3 CI OH- H CH 3 H H OH цис-спирт (не образуется) H атака с тыла OH CH 3 H транс-спирт
 SN 2 – РЕАКЦИЯ 3. Данные по реакционной способности: В SN 2 – реакциях реакционная способность RX уменьшается в следующем порядке: CH 3 X > R H C X > R H R C X R Для объяснения данной закономерности нужно рассмотреть влияние пространственных факторов в реакциях SN 2 – замещения:
SN 2 – РЕАКЦИЯ 3. Данные по реакционной способности: В SN 2 – реакциях реакционная способность RX уменьшается в следующем порядке: CH 3 X > R H C X > R H R C X R Для объяснения данной закономерности нужно рассмотреть влияние пространственных факторов в реакциях SN 2 – замещения:
 Пространственные факторы в SN 2 – реакциях. H H Nu CH 3 H Х Nu Х H H метил этил CH 3 Nu Х H CH 3 изопропил трет-бутил
Пространственные факторы в SN 2 – реакциях. H H Nu CH 3 H Х Nu Х H H метил этил CH 3 Nu Х H CH 3 изопропил трет-бутил
 Пространственные факторы в SN 2 – реакциях. Увеличение числа алкильных заместителей создает пространственные препятствия для приближения атакующего реагента с тыльной стороны. Более объемным заместителям труднее разместиться вокруг центрального углерода, это повышает энергию переходного состояния и замедляет реакцию.
Пространственные факторы в SN 2 – реакциях. Увеличение числа алкильных заместителей создает пространственные препятствия для приближения атакующего реагента с тыльной стороны. Более объемным заместителям труднее разместиться вокруг центрального углерода, это повышает энергию переходного состояния и замедляет реакцию.
 ВЛИЯНИЕ СТРУКТУРНЫХ ФАКТОРОВ И ПРИРОДЫ РАСТВОРИТЕЛЯ В SN 2 – РЕАКЦИЯХ Механизму SN 1 способствуют: 1) Большой объем заместителей (центральный углерод третичный или вторичный). 2) Растворитель с большой диэлектрической постоянной. 3) Малоактивный нуклеофильный реагент. 4) Легко уходящая группа X. Механизму SN 2 способствуют: 1) Малый объем заместителей (центральный углерод первичный или вторичный). 2) Растворитель с малой диэлектрической постоянной. 3) Активный нуклеофильный реагент. 4) Трудно уходящая группа X.
ВЛИЯНИЕ СТРУКТУРНЫХ ФАКТОРОВ И ПРИРОДЫ РАСТВОРИТЕЛЯ В SN 2 – РЕАКЦИЯХ Механизму SN 1 способствуют: 1) Большой объем заместителей (центральный углерод третичный или вторичный). 2) Растворитель с большой диэлектрической постоянной. 3) Малоактивный нуклеофильный реагент. 4) Легко уходящая группа X. Механизму SN 2 способствуют: 1) Малый объем заместителей (центральный углерод первичный или вторичный). 2) Растворитель с малой диэлектрической постоянной. 3) Активный нуклеофильный реагент. 4) Трудно уходящая группа X.
 ВЛИЯНИЕ АЛКИЛЬНОГО РАДИКАЛА: Полезно правило: первичные алкилгалогениды реагируют по механизму SN 2, а третичные – по механизму SN 1.
ВЛИЯНИЕ АЛКИЛЬНОГО РАДИКАЛА: Полезно правило: первичные алкилгалогениды реагируют по механизму SN 2, а третичные – по механизму SN 1.
 ГАЛОГЕНОПРОИЗВОДНЫЕ Скорость SN 2 – реакции возрастает RX=CH X, первичный, вторичный, третичный Скорость SN 1 – реакции возрастает
ГАЛОГЕНОПРОИЗВОДНЫЕ Скорость SN 2 – реакции возрастает RX=CH X, первичный, вторичный, третичный Скорость SN 1 – реакции возрастает
 RBr + I– RI + : Br– (SN 2) RBr + H 2 O: ROH + НBr (SN 1) Относительная R скорость SN 2 -реакции SN 1 -реакции СРАВНЕНИЕ СКОРОСТЕЙ РЕАКЦИЙ SN 1 И SN 2 – CH 3 145 1, 05 – CH 2 CH 3 1 1 – CH(CH 3)2 8 • 103 12 – C(CH 3)3 5 • 104 1, 2 • 105
RBr + I– RI + : Br– (SN 2) RBr + H 2 O: ROH + НBr (SN 1) Относительная R скорость SN 2 -реакции SN 1 -реакции СРАВНЕНИЕ СКОРОСТЕЙ РЕАКЦИЙ SN 1 И SN 2 – CH 3 145 1, 05 – CH 2 CH 3 1 1 – CH(CH 3)2 8 • 103 12 – C(CH 3)3 5 • 104 1, 2 • 105
 SN - РЕАКЦИИ НЕКОТОРЫЕ ОПРЕДЕЛЕНИЯ: Нуклеофил – частица, предоставляющая электронную пару другому атому: Nu: δ+ δ- X–Y нуклеофил атакует электронодефицитный участок другой молекулы Основание – частица, предоставляющая электронную пару для связывания протона (Н+): А: – + основание Н А–Н кислота, сопряженная основанию : А–
SN - РЕАКЦИИ НЕКОТОРЫЕ ОПРЕДЕЛЕНИЯ: Нуклеофил – частица, предоставляющая электронную пару другому атому: Nu: δ+ δ- X–Y нуклеофил атакует электронодефицитный участок другой молекулы Основание – частица, предоставляющая электронную пару для связывания протона (Н+): А: – + основание Н А–Н кислота, сопряженная основанию : А–
 НУКЛЕОФИЛ И ОСНОВАНИЕ Общее: и нуклеофил, и основание – доноры электронных пар. Различие: если электронной парой частицы атакуется углерод, то частицу называют «нуклеофилом» , если протон – «основанием» . Вывод: термины «нуклеофил» и «основание» могут быть использованы для описания одних и тех же частиц, но участвующих в различных реакциях :
НУКЛЕОФИЛ И ОСНОВАНИЕ Общее: и нуклеофил, и основание – доноры электронных пар. Различие: если электронной парой частицы атакуется углерод, то частицу называют «нуклеофилом» , если протон – «основанием» . Вывод: термины «нуклеофил» и «основание» могут быть использованы для описания одних и тех же частиц, но участвующих в различных реакциях :
 НУКЛЕОФИЛ И ОСНОВАНИЕ. . – HO: . . С–Br: . . –. . H–O–C + : Br : . . нуклеофил –. . H–O. . основание . . H–O–C. . –. . H–O–H + : O –C. .
НУКЛЕОФИЛ И ОСНОВАНИЕ. . – HO: . . С–Br: . . –. . H–O–C + : Br : . . нуклеофил –. . H–O. . основание . . H–O–C. . –. . H–O–H + : O –C. .
 Нуклеофильность частицы – способность к взаимодействию за счет своей электронной пары с атомом углерода. Основность частицы – способность связывать протон НУКЛЕОФИЛЬНОСТЬ И ОСНОВНОСТЬ: за счет своей электронной пары. Основность частицы можно оценить по константе диссоциации кислоты, сопряженной данному основанию:
Нуклеофильность частицы – способность к взаимодействию за счет своей электронной пары с атомом углерода. Основность частицы – способность связывать протон НУКЛЕОФИЛЬНОСТЬ И ОСНОВНОСТЬ: за счет своей электронной пары. Основность частицы можно оценить по константе диссоциации кислоты, сопряженной данному основанию:
 СОПРЯЖЕННАЯ КИСЛОТА И ОСНОВАНИЕ А– + Н+ сопряженное основание Н–А сопряженная кислота Правило: Чем сильнее кислота, тем слабее сопряженное ей основание и, наоборот, сильному основанию соответствует слабая сопряженная кислота: Сила кислот: H–F < H–Cl < H–Br < H–I Сила оснований: : F– > : Cl– > : Br– > : I–
СОПРЯЖЕННАЯ КИСЛОТА И ОСНОВАНИЕ А– + Н+ сопряженное основание Н–А сопряженная кислота Правило: Чем сильнее кислота, тем слабее сопряженное ей основание и, наоборот, сильному основанию соответствует слабая сопряженная кислота: Сила кислот: H–F < H–Cl < H–Br < H–I Сила оснований: : F– > : Cl– > : Br– > : I–
 ГАЛОГЕНОПРОИЗВОДНЫЕ Нуклеофильность реагентов не всегда изменяется параллельно их основности: нуклеофильность растет: F– , Cl– , Br– , I– основность растет: Нуклеофильность частицы (аниона) зависит от двух свойств: основности и поляризуемости: нуклеофильность = f (основность, поляризуемость)
ГАЛОГЕНОПРОИЗВОДНЫЕ Нуклеофильность реагентов не всегда изменяется параллельно их основности: нуклеофильность растет: F– , Cl– , Br– , I– основность растет: Нуклеофильность частицы (аниона) зависит от двух свойств: основности и поляризуемости: нуклеофильность = f (основность, поляризуемость)
 ГАЛОГЕНОПРОИЗВОДНЫЕ Правило: 1. Если атакующий атом один и тот же, то нуклеофильность аниона прямо пропорциональна его основности: СН 3 – С – О: – < НО: – < СН 3 – О: – O основность и нуклеофильность растут 2. Если атакующие атомы (нуклеофильные центры) различны по природе, то нуклеофильность пропорциональна их поляризуемости:
ГАЛОГЕНОПРОИЗВОДНЫЕ Правило: 1. Если атакующий атом один и тот же, то нуклеофильность аниона прямо пропорциональна его основности: СН 3 – С – О: – < НО: – < СН 3 – О: – O основность и нуклеофильность растут 2. Если атакующие атомы (нуклеофильные центры) различны по природе, то нуклеофильность пропорциональна их поляризуемости:
 ГАЛОГЕНОПРОИЗВОДНЫЕ нуклеофильность растет (основность падает) : F– , : Cl– , : Br– , : I– поляризуемость растет Поляризуемость электронов – способность электронов смещаться под воздействием внешнего электрического поля (деформация внешней электронной оболочки). Поляризуемость растет с увеличением радиуса частицы (атома, иона) и уменьшением его заряда.
ГАЛОГЕНОПРОИЗВОДНЫЕ нуклеофильность растет (основность падает) : F– , : Cl– , : Br– , : I– поляризуемость растет Поляризуемость электронов – способность электронов смещаться под воздействием внешнего электрического поля (деформация внешней электронной оболочки). Поляризуемость растет с увеличением радиуса частицы (атома, иона) и уменьшением его заряда.
 ГАЛОГЕНОПРОИЗВОДНЫЕ Наименее прочно удерживаются несвязывающие электроны, откуда следует, что атом, выступая в качестве нуклеофила, использует, как правило, несвязывающие электроны: порядок нуклеофильности: несвязывающие >> π–связывающие >> σ–связывающие электроны Природа уходящей группы X Правило: Хорошие уходящие группы, покидая молекулу, обозначают устойчивые ионы. Плохие уходящие группы образуют нестойкие ионы.
ГАЛОГЕНОПРОИЗВОДНЫЕ Наименее прочно удерживаются несвязывающие электроны, откуда следует, что атом, выступая в качестве нуклеофила, использует, как правило, несвязывающие электроны: порядок нуклеофильности: несвязывающие >> π–связывающие >> σ–связывающие электроны Природа уходящей группы X Правило: Хорошие уходящие группы, покидая молекулу, обозначают устойчивые ионы. Плохие уходящие группы образуют нестойкие ионы.
 ГАЛОГЕНОПРОИЗВОДНЫЕ Из этого правила следует: сильные основания обычно бывают плохими уходящими группами; слабые основания обычно являются хорошими уходящими группами, т. е. [Существует обратное соотношение между основностью частицы и ее способностью быть уходящей группой. ] основность растет: F– , Cl– , Br– , I– способность быть уходящей группой растет:
ГАЛОГЕНОПРОИЗВОДНЫЕ Из этого правила следует: сильные основания обычно бывают плохими уходящими группами; слабые основания обычно являются хорошими уходящими группами, т. е. [Существует обратное соотношение между основностью частицы и ее способностью быть уходящей группой. ] основность растет: F– , Cl– , Br– , I– способность быть уходящей группой растет:
 ГАЛОГЕНОПРОИЗВОДНЫЕ плохие уходящие группы (сильные основания): : ОН– , RO: – , : NH 2– , : CH 3– , : H– хорошие уходящие группы (слабые основания): R–SO 3– , I– , Br– , Cl– ион : ОН– – более сильное основание, чем Н 2 О: и является худшей уходящей группой, чем вода: : Br– + R–OH спирт R–Br + : OH– реакция не идет
ГАЛОГЕНОПРОИЗВОДНЫЕ плохие уходящие группы (сильные основания): : ОН– , RO: – , : NH 2– , : CH 3– , : H– хорошие уходящие группы (слабые основания): R–SO 3– , I– , Br– , Cl– ион : ОН– – более сильное основание, чем Н 2 О: и является худшей уходящей группой, чем вода: : Br– + R–OH спирт R–Br + : OH– реакция не идет
 ГАЛОГЕНОПРОИЗВОДНЫЕ 1. . . + R–O–H+H. . R–O–H + H 2. : Br– + + R–OH 2 R–Br + H 2 O замещение идет хорошо Протонные растворители – растворители типа воды НОН и спиртов R – OH; эти растворители содержат водород, связанный с кислородом (или другим сильно электроотрицательным элементом) и вследствие этого довольно кислый.
ГАЛОГЕНОПРОИЗВОДНЫЕ 1. . . + R–O–H+H. . R–O–H + H 2. : Br– + + R–OH 2 R–Br + H 2 O замещение идет хорошо Протонные растворители – растворители типа воды НОН и спиртов R – OH; эти растворители содержат водород, связанный с кислородом (или другим сильно электроотрицательным элементом) и вследствие этого довольно кислый.
 ПРИРОДА РАСТВОРИТЕЛЯ Протонные растворители – растворители типа воды НОН и спиртов R – OH; эти растворители содержат водород, связанный с кислородом (или другим сильно электроотрицательным элементом) и вследствие этого довольно кислый.
ПРИРОДА РАСТВОРИТЕЛЯ Протонные растворители – растворители типа воды НОН и спиртов R – OH; эти растворители содержат водород, связанный с кислородом (или другим сильно электроотрицательным элементом) и вследствие этого довольно кислый.
 ГАЛОГЕНОПРОИЗВОДНЫЕ Образуя водородные связи с анионами такие растворители понижают их основность, а следовательно и нуклеофильность. АПРОТОННЫЕ РАСТВОРИТЕЛИ: CH 3 – S – CH 3 О диметилсульфоксид (ДМСО) S О H–C–N О сульфолан О CH 3 N, N-диметилформамид (ДМФ)
ГАЛОГЕНОПРОИЗВОДНЫЕ Образуя водородные связи с анионами такие растворители понижают их основность, а следовательно и нуклеофильность. АПРОТОННЫЕ РАСТВОРИТЕЛИ: CH 3 – S – CH 3 О диметилсульфоксид (ДМСО) S О H–C–N О сульфолан О CH 3 N, N-диметилформамид (ДМФ)
 ГАЛОГЕНОПРОИЗВОДНЫЕ Апротонные растворители – полярные растворители с высокой диэлектрической проницаемостью, но не способны к образованию водородных связей. Они составляют анионы относительно свободными и сильно реакционноспособными (высоко нуклеофильными). Реакции отщепления: Реакции отщепления приводят к образованию алкенов. Эти реакции часто конкурируют с реакциями нуклеофильного замещения: (CH 3)3 C–Cl (CH 3)3 C + + : Cl– -H+ CH 3–C=CH 2
ГАЛОГЕНОПРОИЗВОДНЫЕ Апротонные растворители – полярные растворители с высокой диэлектрической проницаемостью, но не способны к образованию водородных связей. Они составляют анионы относительно свободными и сильно реакционноспособными (высоко нуклеофильными). Реакции отщепления: Реакции отщепления приводят к образованию алкенов. Эти реакции часто конкурируют с реакциями нуклеофильного замещения: (CH 3)3 C–Cl (CH 3)3 C + + : Cl– -H+ CH 3–C=CH 2
 ГАЛОГЕНОПРОИЗВОДНЫЕ Реакциям отщепления способствует высокая t˚ и основность среды. Конкуренция реакций замещения (SN– реакций) и отщепления (Е – реакций) Х –С – С– H : Nu SN 2, Е 2 –С – С+ H : Nu SN 1, Е 1
ГАЛОГЕНОПРОИЗВОДНЫЕ Реакциям отщепления способствует высокая t˚ и основность среды. Конкуренция реакций замещения (SN– реакций) и отщепления (Е – реакций) Х –С – С– H : Nu SN 2, Е 2 –С – С+ H : Nu SN 1, Е 1
 ГАЛОГЕНОПРОИЗВОДНЫЕ Важнейшие представители Ненасыщенные галогенопроизводные могут вступать в реакции присоединения, обладая способностью легко полимеризовываться, образуя высокомолекулярные вещества: Примеры: 1. n. CH 2=CHCI [–CH 2 –CHCI –]n винилхлорид поливинилхлорид 2. n. CF 2=CF 2 тетрафторэтилен 3. n. CH 2=CHF фторэтен [–CF 2 –]n тефлон [–CH 2 –CHF –]n поливинилфторид
ГАЛОГЕНОПРОИЗВОДНЫЕ Важнейшие представители Ненасыщенные галогенопроизводные могут вступать в реакции присоединения, обладая способностью легко полимеризовываться, образуя высокомолекулярные вещества: Примеры: 1. n. CH 2=CHCI [–CH 2 –CHCI –]n винилхлорид поливинилхлорид 2. n. CF 2=CF 2 тетрафторэтилен 3. n. CH 2=CHF фторэтен [–CF 2 –]n тефлон [–CH 2 –CHF –]n поливинилфторид
 ГАЛОГЕНОПРОИЗВОДНЫЕ 4. n. CH 2=CF 2 1, 1 -дифторэтан 5. n. CF 2=CFCI 1, 1, 2 -трифтор-2 -хлорэтен [–CH 2 –CF 2 –]n поливинилиденфторид [–CF 2 –CFCI –]n политрифтор-хлорэтилен Фреоны (CF 2 CI 2)– галогеналканы, фторсодержащие производные насыщенных углеводо-родов, используемые как хладагенты. Это бесцветные газы или жидкости, без характерного запаха, очень инертны, не горят в воздухе, взрывобезопасны.
ГАЛОГЕНОПРОИЗВОДНЫЕ 4. n. CH 2=CF 2 1, 1 -дифторэтан 5. n. CF 2=CFCI 1, 1, 2 -трифтор-2 -хлорэтен [–CH 2 –CF 2 –]n поливинилиденфторид [–CF 2 –CFCI –]n политрифтор-хлорэтилен Фреоны (CF 2 CI 2)– галогеналканы, фторсодержащие производные насыщенных углеводо-родов, используемые как хладагенты. Это бесцветные газы или жидкости, без характерного запаха, очень инертны, не горят в воздухе, взрывобезопасны.


