
ГАЛОГЕНИ
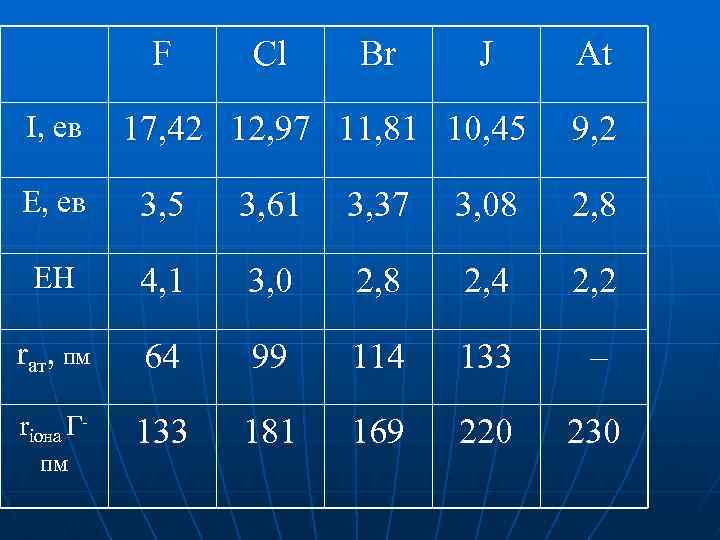
F І, ев Cl Br J 17, 42 12, 97 11, 81 10, 45 At 9, 2 Е, ев 3, 5 3, 61 3, 37 3, 08 2, 8 ЕН 4, 1 3, 0 2, 8 2, 4 2, 2 rат, пм 64 99 114 133 – rіона Г- 133 181 169 220 230 пм
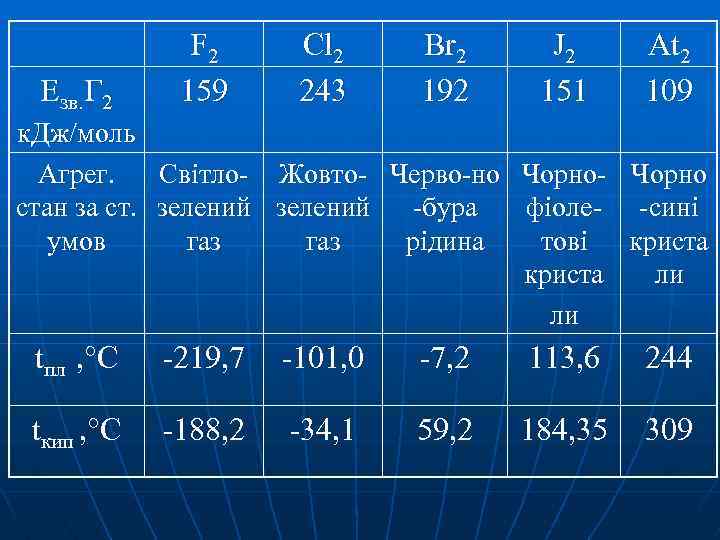
Езв. Г 2 F 2 159 Cl 2 243 Br 2 192 J 2 151 At 2 109 к. Дж/моль Агрег. Світло- Жовто- Черво-но Чорно- Чорно стан за ст. зелений -бура фіоле- -сині умов газ рідина тові криста ли ли tпл , °С -219, 7 -101, 0 -7, 2 113, 6 244 tкип , °С -188, 2 -34, 1 59, 2 184, 35 309

Знаходження в природі F Cl ат. % 2, 8· 10 -2 2, 6· 10 -2 Br 1, 5· 10 -5 J At 4· 10 -6 — Ca. F 2 – флюорит (плавиковий шпат) 3 Ca 3(PO 4)2·Ca. F 2 – апатит
![Na 3[Al. F 6] – кріоліт Основні запаси цього мінералу в Гренландії майже повністю Na 3[Al. F 6] – кріоліт Основні запаси цього мінералу в Гренландії майже повністю](https://present5.com/presentation/3/98402915_158305133.pdf-img/98402915_158305133.pdf-6.jpg)
Na 3[Al. F 6] – кріоліт Основні запаси цього мінералу в Гренландії майже повністю вичерпані Склад емалі зубів наближується до Ca 5 F(PO 4)3 Добова потреба організму у F становить 1 мг, оптимальна концентрація у питній воді 1 мг/л

Na. Cl - камяна сіль (галіт) KCl - сильвін Na. Cl·KCl - сильвініт KCl·Mg. Cl 2· 6 H 2 O - карналіт Mg. Cl 2· 6 H 2 O – бішофіт Хлоридів(особливо Na. Cl) багато в соляних озерах, соляних відкладеннях. НCl – шлунковий сік Na. Cl – клітинна рідина

Бром та йод досить поширені, але власних покладів мінералів вони не мають, а супроводжують хлор. Морська вода мiстить ~ 7· 10 -3 % Br і ~ 5· 10 -6 % J. Деякі морські водорості накопичують йод. Попіл ламінаріі містить до 0, 5% йоду. KJO 3 (в покладах селітри в Чілі та Болівії)

Найбільше йоду в бурових водах (до 3· 10 -3 %) Організм людини містить близько 35 мг йоду, з них – 15 мг в щитовидній залозі. At (від грецького astatos – нестійкий) радіоактивний елемент, відомо понад 20 ізотопів, жодного стабільного. Загальний вміст в земній корі товщиною 1, 6 км ~ 70 мг. (Максимальна маса At, з якою мали справу дослідники - 2· 10 -9 г)

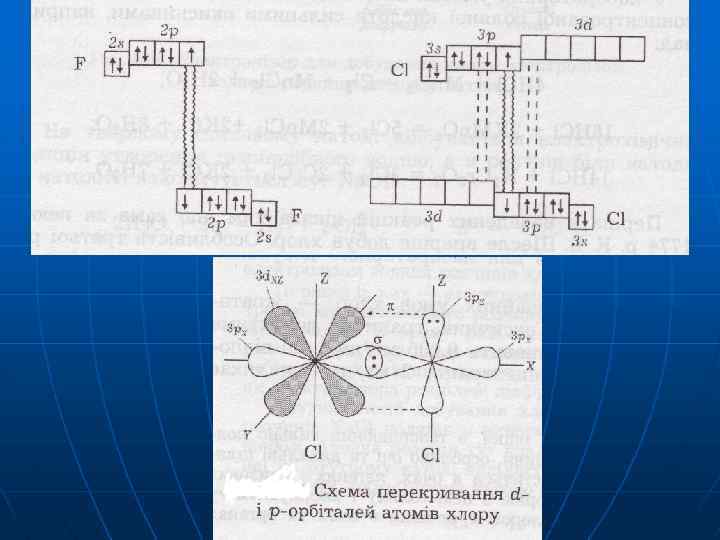
Головна підгрупа VII гр. ns 2 np 5 F 2 s 22 p 5 валентність = 1 ст. ок. 0, -1 ЕН = 4, 1 3 s 23 p 53 d 0 Сl валетність = 1, 3, 5, 7 ст. ок. -1 0 +1 +3 +4 +5 +6 +7

Добування У всіх випадках це процес окислення F 2 – добувають електролізом розплаву KF·2 HF K(-) A (+) 2 H+ + 2 e → H 2↑ 2 F- - 2 e → F 2

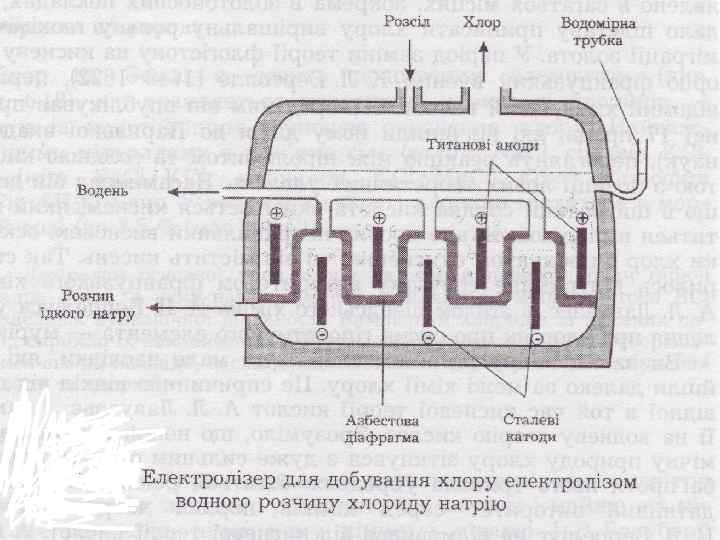
Cl 2 добувають електролізом розчину Na. Cl K (-) Na+ 2 H 2 O + 2 e → H 2 + 2 OH-, Е 0 = -0, 41 В. A (+) 2 Cl- - 2 e → Cl 2, Е 0 = 1, 36 В 2 H 2 O - 4 e → О 2 + 4 H+, Е 0 = 1, 23 В Рівновагу в бік виділення Cl 2 зміщують 1) підвищуючи [Cl-] 2) створюючи перенапругу виділенню О

2 Br - + Cl 2 → Br 2 + 2 Cl. Br 2 відганяють струменем водяної пари та повітря 2 J - + Cl 2 → J 2 + 2 Clз бурових вод 2 Na. J+2 Na. NO 2+2 H 2 SO 4→J 2+2 NO+Na 2 SO 4+2 H 2 O з селітри Na. JO 3 + 3 Na. HSO 3 → Na. J + 3 Na. HSO 4 J 2 адсорбують активованим вугіллям або


Лабораторні способи добування Дія окисників на HCl або на Na. Cl 16 HCl+2 KMn. O 4 → 5 Cl 2+2 Mn. Cl 2+2 KCl+8 H 2 O 4 HCl + Mn. O 2 →Cl 2 + Mn. Cl 2 + 2 H 2 O 14 HCl+K 2 Cr 2 O 7 → 3 Cl 2+2 Cr. Cl 3+2 KCl+7 H 2 O

10 Na. Cl+2 KMn. O 4+8 H 2 SO 4→ 5 Cl 2+2 Mn. SO 4+ K 2 SO 4+5 Na 2 SO 4+8 H 2 O Br 2 i J 2 отримують із солей 2 KBr + Cl 2 → Br 2 + 2 KCl 2 KJ + Cl 2 → J 2 + 2 KCl 6 KBr + K 2 Cr 2 O 7 + 7 H 2 SO 4→ 5 Br 2 + Cr 2(SO 4)3 + K 2 SO 4 + 8 H 2 O 10 KJ + 2 KMn. O 4 + 8 H 2 SO 4 → 5 J 2+ 2 Mn. SO 4+ K 2 SO 4 + 8 H 2 O



Властивості F 2 Cl 2 Br 2 J 2 Енергія дисперсійної взаємодії Ткипіння pозчинність у воді найвища у Br 2 J 2 розчиняється погано, але в присутності КJ – розчинність J 2 зростає

KJ + J 2 → KJ 3 J- + J 2 → J 3 J → ← J- → ← J 0, 5 (J : J)-


Галогени – типові окисники ns 2 np 5 Самий сильний - F 2 + 2 e → 2 F- Е 0 = 2, 85 В 2 H 2 O + 2 F 2 → 4 HF + O 2, ΔН < 0 пісок, асбест спалахують в атмосфері фтору Si. O 2 + 2 F 2 → Si. F 4 + O 2 Kr + F 2 → Kr. F 2

Xe + F 2 → Xe. F 2 Xe + 2 F 2 → Xe. F 4 Xe + 3 F 2 → Xe. F 6 S + 3 F 2 → SF 6, ΔН= -1207 к. Дж 2 P + 5 F 2 → 2 PF 5, ΔН= -1385 к. Дж ці реакції протікають навіть за t < 00 С 2 NH 3 + 6 F 2 → 6 HF + 2 NF 3 (за низьких t) 2 NH 3 + 3 F 2 → 6 HF + N 2 (за високих t)

Cl 2 + 2 e → 2 Cl- E 0 = 1, 36 В 2 Sb + 3 Cl 2 → 2 Sb. Cl 3 2 P + 3 Cl 2 → 2 PCl 3 2 P + 5 Cl 2 → 2 PCl 5 2 Fe + 3 Cl 2 → 2 Fe. Cl 3 J 2 + 2 e → 2 J- E 0 = 0, 53 В Zn + J 2 → Zn. J 2 3 J 2 + 10 HNO 3 → 6 HJO 3 + 10 NO + 2 H 2 O







F 2 Cl 2 Br 2 J 2 E°, B 2, 87 1, 36 1, 06 0, 53 окислювальні властивості зменшуються H 2 + F 2 → 2 HF H 2 + Cl 2 2 HCl H 2 + Br 2 2 HBr H 2 + J 2 2 HJ
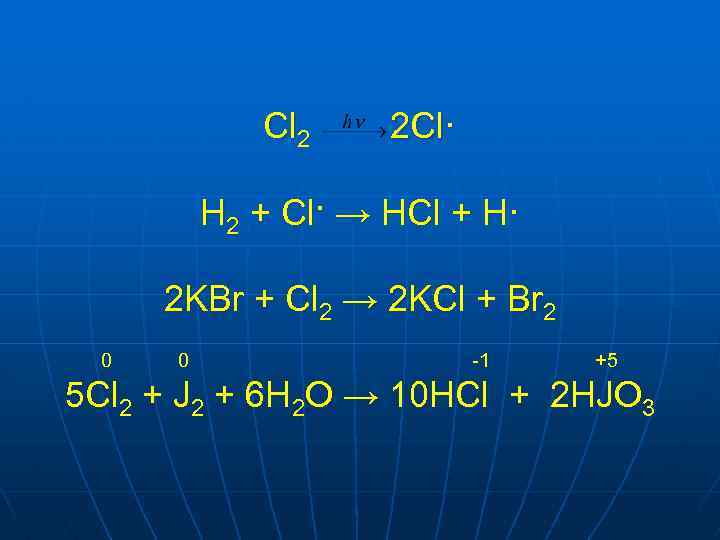
Cl 2 2 Cl· H 2 + Cl· → HCl + H· 2 KBr + Cl 2 → 2 KCl + Br 2 0 0 -1 +5 5 Cl 2 + J 2 + 6 H 2 O → 10 HCl + 2 HJO 3

Галогеноводні Добування HF H 2 + F 2 → 2 HF для добування не використовують Ca. F 2 + H 2 SO 4(р)→ Ca. SO 4↓ + 2 HF(розчин) Ca. F 2 + H 2 SO 4(к)→ Ca. SO 4↓ + 2 HF↑
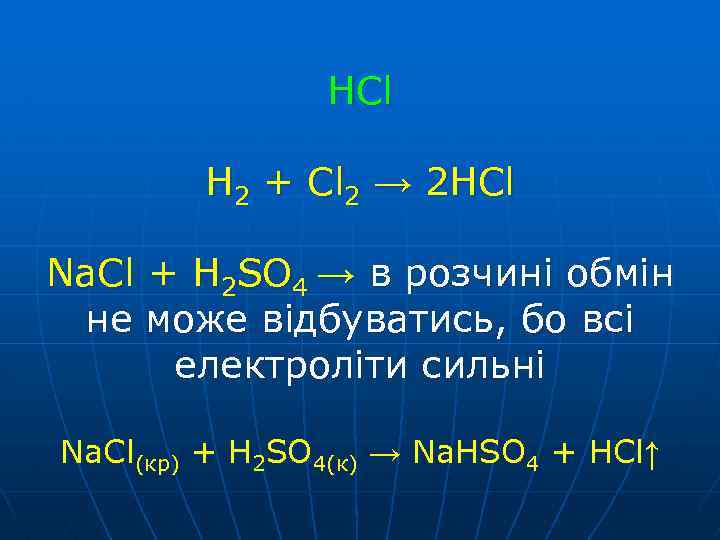
HCl H 2 + Cl 2 → 2 HCl Na. Cl + H 2 SO 4 → в розчині обмін не може відбуватись, бо всі електроліти сильні Na. Cl(кр) + H 2 SO 4(к) → Na. HSO 4 + HCl↑


HBr KBr(кp) + H 2 SO 4(к)→ KHSO 4 + HBr 2 HBr + H 2 SO 4 → Br 2 +SO 2 + 2 H 2 O сумарна реакція 2 KBr(кp)+2 H 2 SO 4(K)→Br 2+SO 2+K 2 SO 4+2 H 2 O PBr 3 + 3 H 2 O → H 3 PO 3 + 3 HBr Ba. S +4 Br 2+4 H 2 O→Ba. SO 4↓+ 8 HBr

Аналогічно для HJ 8 KJ +5 H 2 SO 4 → 4 J 2 +H 2 S+4 K 2 SO 4+4 H 2 O PJ 3 + 3 H 2 O → H 3 PO 3 + 3 HJ J 2 + H 2 S → S↓ + 2 HJ

tкип, °С HF 19, 5 HCl -85 HBr -67 ЕММВз зростає В HF – водневий зв’зок H-F···H-F ··· HJ -35
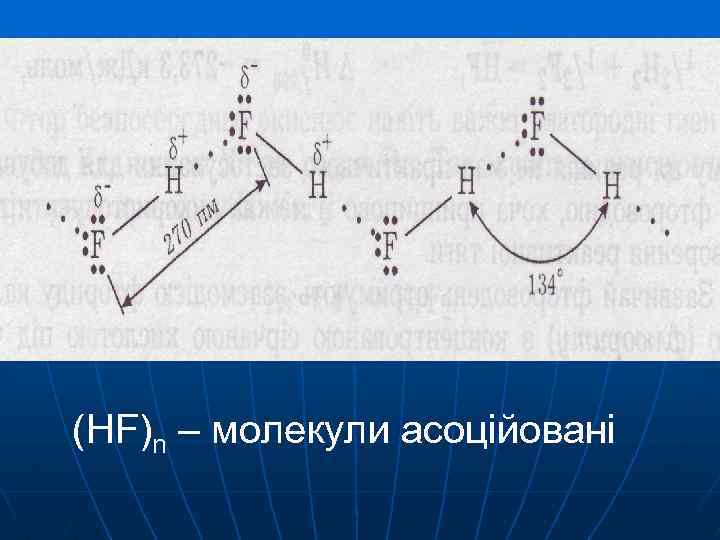
(HF)n – молекули асоційовані
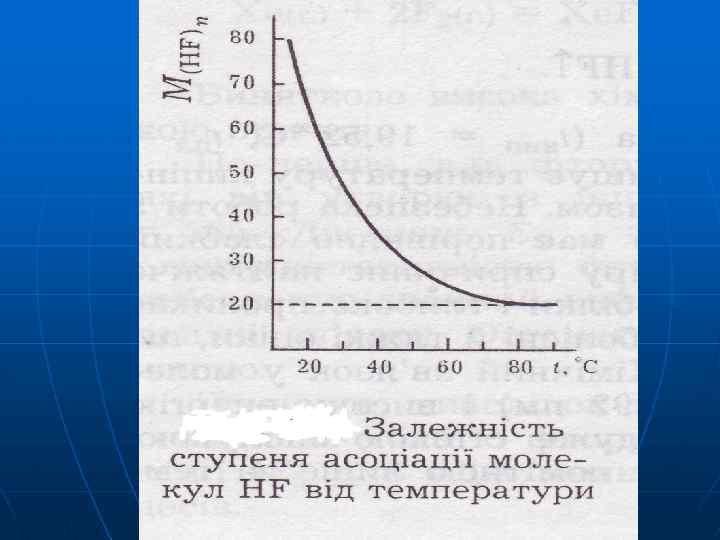

В водних розчинах HF + H 2 O ↔ Н 3 O++ FHF + F- ↔ НF 2 - K 1=7, 2· 10 -4 K 2=5, 1 В розчинах плавикої кислоти йонів НF 2 - найбільше Відомі кислі солі KHF 2 (KF·HF), KH 2 F 3 (KF· 2 HF)

HCl HBr HJ сила кислот сильні одноосновні кислоти НГ → Н+ + ГРадіус атома галогену збільшується, збільшується довжина зв'язку, зменшується Езв’язку, збільшується здатність зв'язку до поляризації і під дією H 2 O зв’язки легше розриваються
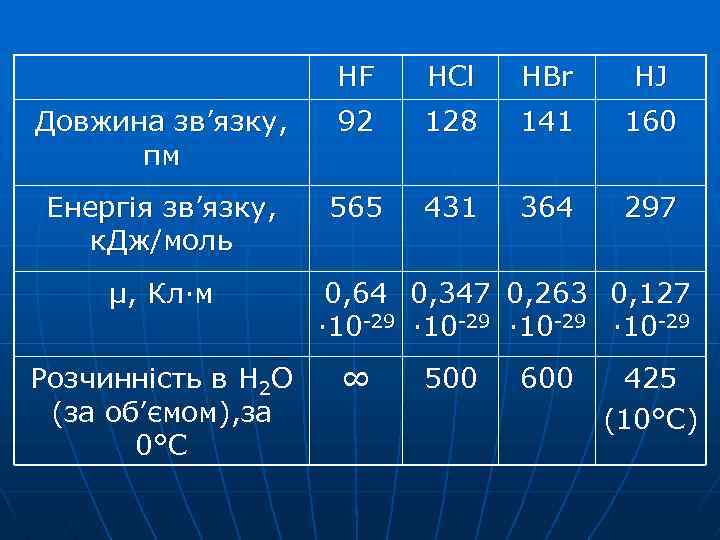
HF HCl HBr HJ Довжина зв’язку, пм 92 128 141 160 Енергія зв’язку, к. Дж/моль 565 431 364 297 μ, Кл·м Розчинність в H 2 O (за об’ємом), за 0° С 0, 64 0, 347 0, 263 0, 127 · 10 -29 ∞ 500 600 425 (10°С)

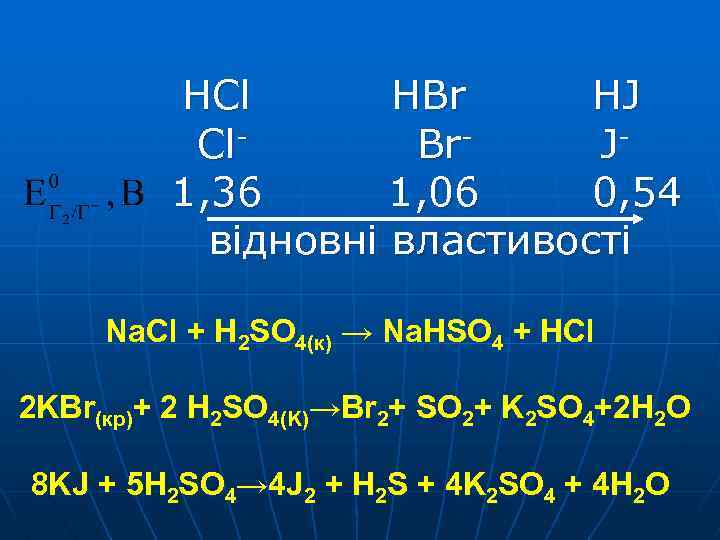
HCl HBr HJ Cl. Br. J 1, 36 1, 06 0, 54 відновні властивості Na. Cl + H 2 SO 4(к) → Na. HSO 4 + HCl 2 KBr(кp)+ 2 H 2 SO 4(K)→Br 2+ SO 2+ K 2 SO 4+2 H 2 O 8 KJ + 5 H 2 SO 4→ 4 J 2 + H 2 S + 4 K 2 SO 4 + 4 H 2 O

Якісні реакції на галогенідйони + Ag + Cl → Ag. Cl↓
