1333918_presentation.ppt
- Количество слайдов: 134
 ФОТОСИНТЕЗ Оксигенная фотоавтотрофия растений
ФОТОСИНТЕЗ Оксигенная фотоавтотрофия растений
 Краткая история изучения фотосинтеза растений n n Джозеф Пристли (1771) – растения делают воздух пригодным для горения и дыхания (выделяют кислород) Ян Ингенхауз (1779) – процесс происходит только на свету Жан Сенебье (1782) – кислород выделяют только зеленые части растения при наличии в воздухе углекислого газа Н. Соссюр (1804) – объем поглощаемого на свету СО 2 равен объему выделяемого О 2. Поглощение СО 2 – углеродное питание растений. В процессе принимает участие вода.
Краткая история изучения фотосинтеза растений n n Джозеф Пристли (1771) – растения делают воздух пригодным для горения и дыхания (выделяют кислород) Ян Ингенхауз (1779) – процесс происходит только на свету Жан Сенебье (1782) – кислород выделяют только зеленые части растения при наличии в воздухе углекислого газа Н. Соссюр (1804) – объем поглощаемого на свету СО 2 равен объему выделяемого О 2. Поглощение СО 2 – углеродное питание растений. В процессе принимает участие вода.
 n n n Пельтье и Каванту (1817) – открыли зеленый пигмент листьев – хлорофилл. Жан-Батист Буссенго (1840) – составил уравнение: 6 СО 2+: Н 2 О=С 6 Н 12 О 6+6 О 2 Р. Майр (1842) – растения превращают энергию света в химическую энергию. У. Сакс (1864) – основной продукт синтеза на свету в листьях – крахмал. К. А. Тимирязев (1869) – экспериментально обосновал аккумуляцию и превращение энергии зеленым листом. Доказал, что для этого нужен красный свет. В. Пфеффер (1877) – ввел термин «фотосинтез» .
n n n Пельтье и Каванту (1817) – открыли зеленый пигмент листьев – хлорофилл. Жан-Батист Буссенго (1840) – составил уравнение: 6 СО 2+: Н 2 О=С 6 Н 12 О 6+6 О 2 Р. Майр (1842) – растения превращают энергию света в химическую энергию. У. Сакс (1864) – основной продукт синтеза на свету в листьях – крахмал. К. А. Тимирязев (1869) – экспериментально обосновал аккумуляцию и превращение энергии зеленым листом. Доказал, что для этого нужен красный свет. В. Пфеффер (1877) – ввел термин «фотосинтез» .
 Ф. Блэкман (1905) – двухфазный характер фотосинтеза. n. Р. Эмерсон, А. Арнольд (1932) – быстрые фотохимические и медленные биохимические реакции фотосинтеза; (1942 -1957) – наличие 2 фотосистем. n. Р. Хилл (1937) – нециклический поток электронов, источник электронов – вода, акцепторы – окисленные соединения. Для выделения О 2 необходима вода. n. К. Ван-Ниль, А. П. Виноградов, Р. В. Тейс, С. Рубен, М. Камен (1935 -1941) – кислород при фотосинтезе имеет водное происхождение. n. М. Кальвин, Бенсон, Бассем (1947 -1954) – метаболизм углерода при фотосинтезе. n
Ф. Блэкман (1905) – двухфазный характер фотосинтеза. n. Р. Эмерсон, А. Арнольд (1932) – быстрые фотохимические и медленные биохимические реакции фотосинтеза; (1942 -1957) – наличие 2 фотосистем. n. Р. Хилл (1937) – нециклический поток электронов, источник электронов – вода, акцепторы – окисленные соединения. Для выделения О 2 необходима вода. n. К. Ван-Ниль, А. П. Виноградов, Р. В. Тейс, С. Рубен, М. Камен (1935 -1941) – кислород при фотосинтезе имеет водное происхождение. n. М. Кальвин, Бенсон, Бассем (1947 -1954) – метаболизм углерода при фотосинтезе. n
 Д. Арнон (1954 -1957) – циклическое и нециклическое фотофосфорилирование – фотоэнергетические реакции хлоропластов. n. Л. Дюйзенс (1951 -1952) – перенос энергии возбужденного состояния от антеннных пигментов в реакционный центр, модель фотосинтетической единицы. n. Р. Хилл, Ф. Бендалл, Б. Кок и др. (1961) – Z-схема фотосинтеза. n. Ю. Карпилов, Х. Корчак, М. Хэч, К. Слэк (1957 -1964) – С 4 тип фотосинтетического метаболизма. n. О. Варбург (1920), Н. Воскресенская, В. Джексон, Н. Толберт, И. Зелитч (1968 -1974) – фотодыхание, гликолатный путь фотосинтеза. n
Д. Арнон (1954 -1957) – циклическое и нециклическое фотофосфорилирование – фотоэнергетические реакции хлоропластов. n. Л. Дюйзенс (1951 -1952) – перенос энергии возбужденного состояния от антеннных пигментов в реакционный центр, модель фотосинтетической единицы. n. Р. Хилл, Ф. Бендалл, Б. Кок и др. (1961) – Z-схема фотосинтеза. n. Ю. Карпилов, Х. Корчак, М. Хэч, К. Слэк (1957 -1964) – С 4 тип фотосинтетического метаболизма. n. О. Варбург (1920), Н. Воскресенская, В. Джексон, Н. Толберт, И. Зелитч (1968 -1974) – фотодыхание, гликолатный путь фотосинтеза. n
 Современный этап в исследовании фотосинтеза: n n n Расшифрована генетическая система хлоропластов, известны гены, ответственные за фотосинтетические процессы. Изучена структура фотосистем I и II. Сформулированы представления о механизмах выделения кислорода (окисления воды). Определена роль фотосинтеза в донорно-акцепторных связях в растении. Активно исследуются экологические аспекты фотосинтеза. Разрабатываются прикладные исследования фотосинтеза.
Современный этап в исследовании фотосинтеза: n n n Расшифрована генетическая система хлоропластов, известны гены, ответственные за фотосинтетические процессы. Изучена структура фотосистем I и II. Сформулированы представления о механизмах выделения кислорода (окисления воды). Определена роль фотосинтеза в донорно-акцепторных связях в растении. Активно исследуются экологические аспекты фотосинтеза. Разрабатываются прикладные исследования фотосинтеза.
 Глобальная роль фотосинтеза ( «Космическая роль зеленого растения» К. А. Тимирязев) 1) Создание первичной биопродуктивности (100170 млрд. тонн/год на суше и 60 -70 млрд. тонн/год в океане). В ходе фотосинтеза создано: n Живое вещество биосферы (2400 млрд. тонн растений, 23 млрд. тонн гетеротрофов) n Гумус, торф, подстилка n Уголь, газ, нефть n Вещество осадочных пород
Глобальная роль фотосинтеза ( «Космическая роль зеленого растения» К. А. Тимирязев) 1) Создание первичной биопродуктивности (100170 млрд. тонн/год на суше и 60 -70 млрд. тонн/год в океане). В ходе фотосинтеза создано: n Живое вещество биосферы (2400 млрд. тонн растений, 23 млрд. тонн гетеротрофов) n Гумус, торф, подстилка n Уголь, газ, нефть n Вещество осадочных пород
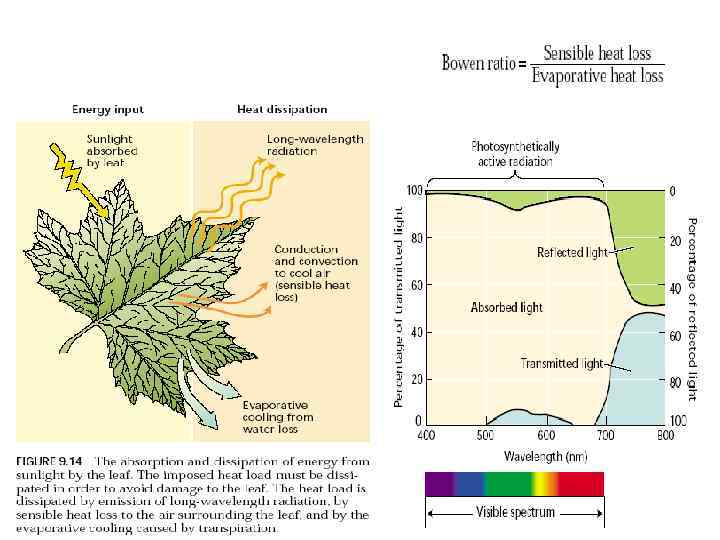
 2) Трансформация энергии солнца в энергию химических связей органических соединений 80 -85% ФАР и около 25% ИК лучей поглощается листьями растений; пропускается, соответственно, 5% и 30%, отражается – 10% и 45%. Из поглощенной энергии эффективно тратится в процессе фотосинтеза 0, 5 -2% ФАР. Остальная энергия используется преимущественно для испарения воды.
2) Трансформация энергии солнца в энергию химических связей органических соединений 80 -85% ФАР и около 25% ИК лучей поглощается листьями растений; пропускается, соответственно, 5% и 30%, отражается – 10% и 45%. Из поглощенной энергии эффективно тратится в процессе фотосинтеза 0, 5 -2% ФАР. Остальная энергия используется преимущественно для испарения воды.
 3) Продукция кислорода (70 -120 млрд. тонн/год) Обеспечение жизнедеятельности всех аэробов и производственных нужд человечества 4) Создание и поддержание озонового экрана Защита от жесткого космического излучения, фактор выхода жизни из океана на сушу около 400 -500 тыс. лет назад
3) Продукция кислорода (70 -120 млрд. тонн/год) Обеспечение жизнедеятельности всех аэробов и производственных нужд человечества 4) Создание и поддержание озонового экрана Защита от жесткого космического излучения, фактор выхода жизни из океана на сушу около 400 -500 тыс. лет назад
 5) Поддержание концентрации углекислого газа в атмосфере Баланс поступления: - дыхание живых организмов (37 млрд. тонн/год) - Производство ( 5 млрд. тонн/год) - геохимичекие процессы (0, 5 млрд. тонн/год) и поглощения (фотосинтез). 6) Предотвращение парникового эффекта 7) Формирование и поддержание газового состава атмосферы
5) Поддержание концентрации углекислого газа в атмосфере Баланс поступления: - дыхание живых организмов (37 млрд. тонн/год) - Производство ( 5 млрд. тонн/год) - геохимичекие процессы (0, 5 млрд. тонн/год) и поглощения (фотосинтез). 6) Предотвращение парникового эффекта 7) Формирование и поддержание газового состава атмосферы
 Уровни организации фотосинтетического аппарата Фотосинтетический аппарат – материальная основа фотосинтеза, совокупность структур, обеспечивающих фотосинтез: - Растительность Земного шара Растительность биомов Фитоценоз Растение Лист Фототрофные ткани Клетка мезофилла хлоропласт
Уровни организации фотосинтетического аппарата Фотосинтетический аппарат – материальная основа фотосинтеза, совокупность структур, обеспечивающих фотосинтез: - Растительность Земного шара Растительность биомов Фитоценоз Растение Лист Фототрофные ткани Клетка мезофилла хлоропласт
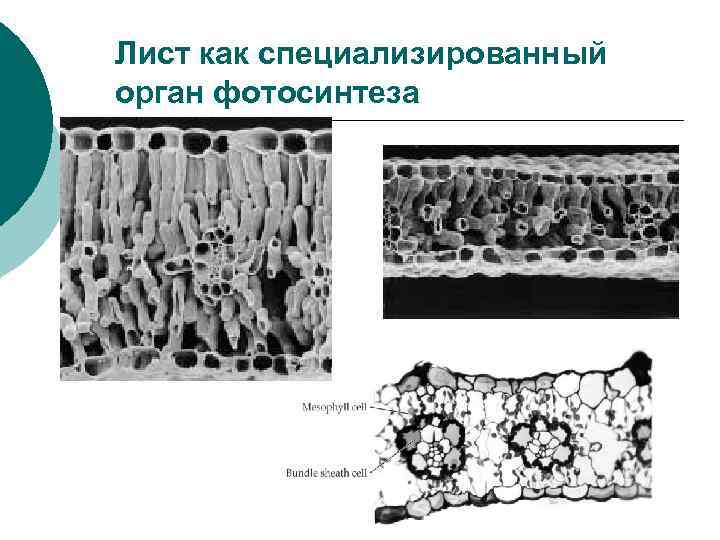 Лист как специализированный орган фотосинтеза
Лист как специализированный орган фотосинтеза
 Хлоропласты эукариотных фотосинтетических клеток имеют наиболее сложную структурную организацию внутренних мембран по сравнению с другими органоидами клеток. В этом отношении с ними сравнимы только рецепторные клетки сетчатки глаза, также выполняющие функцию преобразования световой энергии, но для информационных целей. Впервые специализированные органеллы хлоропласты появились у криптофитов. У них по 2 хлоропласта на клетку с одним или несколькими тилакоидами. Наиболее развиты мембраны хлоропластов высших растений с многослойной упорядоченной системой гран.
Хлоропласты эукариотных фотосинтетических клеток имеют наиболее сложную структурную организацию внутренних мембран по сравнению с другими органоидами клеток. В этом отношении с ними сравнимы только рецепторные клетки сетчатки глаза, также выполняющие функцию преобразования световой энергии, но для информационных целей. Впервые специализированные органеллы хлоропласты появились у криптофитов. У них по 2 хлоропласта на клетку с одним или несколькими тилакоидами. Наиболее развиты мембраны хлоропластов высших растений с многослойной упорядоченной системой гран.
 Основные компоненты хлоропластов высших растений: ¡ 1) двойная мембрана – внешняя более простая 7 нм и внутренняя ~ 10 нм, образующая впячивания внутрь хлоропласта, из которых возникает система внутренних мембран; ¡ 2) строма – внутренняя растворимая фаза хлоропласта с ферментами С-цикла, синтеза белка (ДНК, РНК, рибосомы) и др. растворимыми компонентами; 3) собственно фотосинтетические мембраны - стопки гран (диаметр 0. 5 мкм) и стромальных ламелл (диаметр 5 -7 мкм), пронизывающих весь хлоропласт и связывающих граны. ¡ Среднее число хлоропластов в клетке палисадной ткани листа ~ 60 -80, в клетках губчатой ткани ~ 15 -40. У некоторых видов в клетках более 400 хлоропластов. Средний объем хлоропласта 30 -60 мкм 3. Суммарный объем составляет 10 -20% объема клеток, а у древесных растений до 35 -70%. В одном хлоропласте (1 -2) · 109 молекул Хл, у тенелюбивых до (5 -10) · 109.
Основные компоненты хлоропластов высших растений: ¡ 1) двойная мембрана – внешняя более простая 7 нм и внутренняя ~ 10 нм, образующая впячивания внутрь хлоропласта, из которых возникает система внутренних мембран; ¡ 2) строма – внутренняя растворимая фаза хлоропласта с ферментами С-цикла, синтеза белка (ДНК, РНК, рибосомы) и др. растворимыми компонентами; 3) собственно фотосинтетические мембраны - стопки гран (диаметр 0. 5 мкм) и стромальных ламелл (диаметр 5 -7 мкм), пронизывающих весь хлоропласт и связывающих граны. ¡ Среднее число хлоропластов в клетке палисадной ткани листа ~ 60 -80, в клетках губчатой ткани ~ 15 -40. У некоторых видов в клетках более 400 хлоропластов. Средний объем хлоропласта 30 -60 мкм 3. Суммарный объем составляет 10 -20% объема клеток, а у древесных растений до 35 -70%. В одном хлоропласте (1 -2) · 109 молекул Хл, у тенелюбивых до (5 -10) · 109.
 Положение хлоропластов в клетке
Положение хлоропластов в клетке
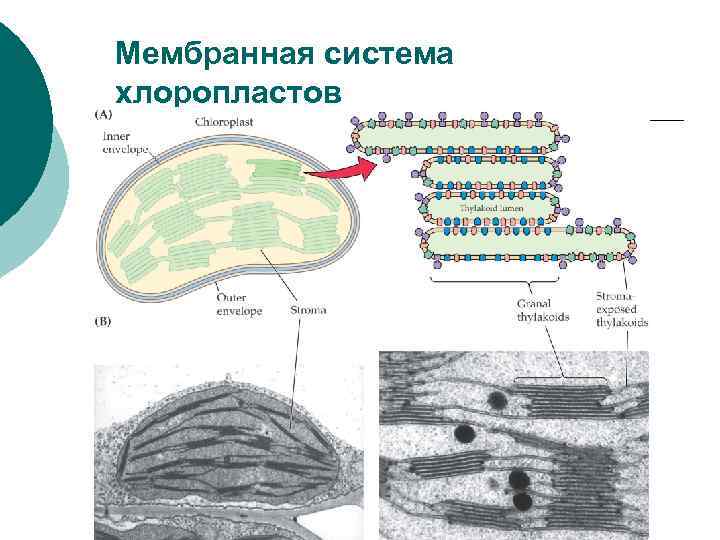 Мембранная система хлоропластов
Мембранная система хлоропластов
 3 -мерная модель организации внутренних мембран хлоропластов
3 -мерная модель организации внутренних мембран хлоропластов
 Особенности фотосинтетических мембран прокариот ¡ ¡ Все фотосинтетические мембраны прокариот – производные от цитоплазматической мембраны (ЦПМ), возникшие в результате ее разрастания и глубокого впячивания (инвагинации) в цитоплазму. У пурпурных бактерий мембраны сохраняют тесную связь с ЦПМ, а у цианобактерий эта связь не очевидна и они могут быть автономными структурами. Фотосинтетические мембраны имеют вид трубочек, пузырьков (хроматофоров), уплощенных замкнутых дисков (тилакоидов), образованных тесно сближенными мембранами (ламеллами). У пурпурных бактерий мембранные структуры в виде стопок тесно упакованных ламелл расположены на периферии клеток и связаны с ЦПМ. У некоторых видов есть везикулярные мембранные структуры. Средний размер хроматофора Rhodopseudomonas sphaeroides по диаметру ~ 50 нм и в нем 3000 Бхл и ~40 РЦ. В одной клетке ~550 хроматофоров, (1. 6– 2) · 106 молекул Бхл. Однако есть фототрофы без специализированных внутриклеточных фотосинтетических мембран – галофильные архебактерии, родопсинсодержащие эубактерии, гелиобактерии, зеленые бактерии и один уникальный вид цианобактерий Gloeobacter violaceus. У всех этих видов фотосинтетические комплексы локализованы в ЦПМ, а светособирающие пигменты – в особых комплексах хлоросом (зеленые бактерии) и фикобилисом (Gloeobacter violaceus).
Особенности фотосинтетических мембран прокариот ¡ ¡ Все фотосинтетические мембраны прокариот – производные от цитоплазматической мембраны (ЦПМ), возникшие в результате ее разрастания и глубокого впячивания (инвагинации) в цитоплазму. У пурпурных бактерий мембраны сохраняют тесную связь с ЦПМ, а у цианобактерий эта связь не очевидна и они могут быть автономными структурами. Фотосинтетические мембраны имеют вид трубочек, пузырьков (хроматофоров), уплощенных замкнутых дисков (тилакоидов), образованных тесно сближенными мембранами (ламеллами). У пурпурных бактерий мембранные структуры в виде стопок тесно упакованных ламелл расположены на периферии клеток и связаны с ЦПМ. У некоторых видов есть везикулярные мембранные структуры. Средний размер хроматофора Rhodopseudomonas sphaeroides по диаметру ~ 50 нм и в нем 3000 Бхл и ~40 РЦ. В одной клетке ~550 хроматофоров, (1. 6– 2) · 106 молекул Бхл. Однако есть фототрофы без специализированных внутриклеточных фотосинтетических мембран – галофильные архебактерии, родопсинсодержащие эубактерии, гелиобактерии, зеленые бактерии и один уникальный вид цианобактерий Gloeobacter violaceus. У всех этих видов фотосинтетические комплексы локализованы в ЦПМ, а светособирающие пигменты – в особых комплексах хлоросом (зеленые бактерии) и фикобилисом (Gloeobacter violaceus).
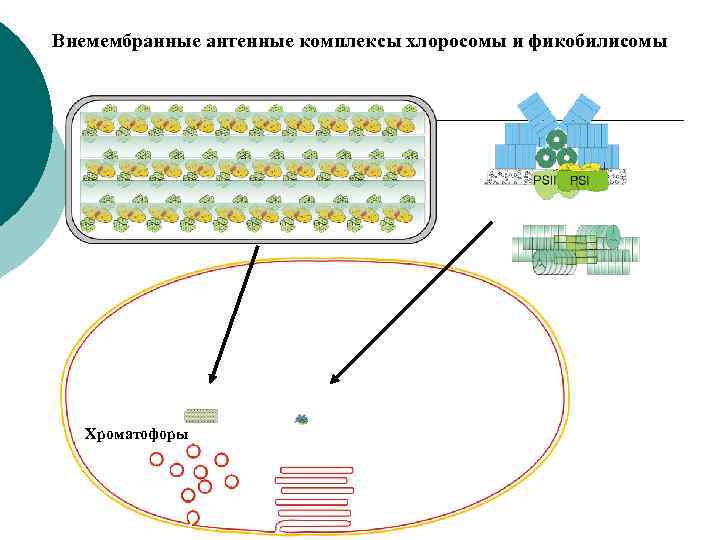 Внемембранные антенные комплексы хлоросомы и фикобилисомы Хроматофоры
Внемембранные антенные комплексы хлоросомы и фикобилисомы Хроматофоры
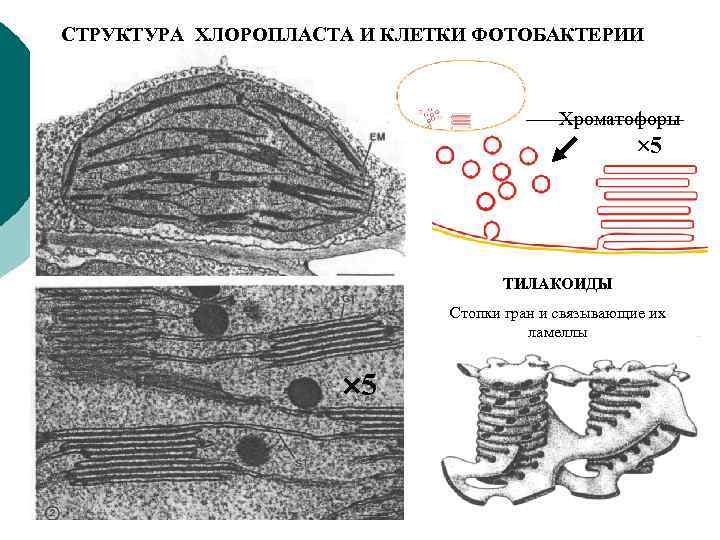 СТРУКТУРА ХЛОРОПЛАСТА И КЛЕТКИ ФОТОБАКТЕРИИ Хроматофоры 5 ТИЛАКОИДЫ Стопки гран и связывающие их ламеллы 5
СТРУКТУРА ХЛОРОПЛАСТА И КЛЕТКИ ФОТОБАКТЕРИИ Хроматофоры 5 ТИЛАКОИДЫ Стопки гран и связывающие их ламеллы 5
 СВОЙСТВА ХЛОРОПЛАСТНЫХ МЕМБРАН 1) отрицательный поверхностный потенциал, связанный с карбоксильными остатками Асп и Глу интегральных белков. Этот поверхностный заряд важен для формирования гран. Катионы среды, экранируя отрицательные заряды поверхности мембран снижают их отталкивание и способствуют слипанию стопок гран.
СВОЙСТВА ХЛОРОПЛАСТНЫХ МЕМБРАН 1) отрицательный поверхностный потенциал, связанный с карбоксильными остатками Асп и Глу интегральных белков. Этот поверхностный заряд важен для формирования гран. Катионы среды, экранируя отрицательные заряды поверхности мембран снижают их отталкивание и способствуют слипанию стопок гран.
 ¡ 2) Трансмембранная и латеральная асимметрия. Трансмембранная асимметрия выражается в строгой ориентации белковых комплексов, что создает структурную основу направленного фотоиндуцированного потока электронов и сопряженного транспорта протонов. Липиды наружного слоя обогащены фосфатидилглицеролом, а внутренний слой содержит больше моногалактозилдиглицерида и сульфолипида. Латеральная асимметрия проявляется в распределении белковых комплексов между стромальными и гранальными тилакоидами. Различие поверхностных потенциалов комплексов ФС 1 (больший) и ФС 2 (меньший) вызывает их сегрегацию. При формировании гран ФС 1 вытесняются из области межмембранных контактов под действием электростатического отталкивания.
¡ 2) Трансмембранная и латеральная асимметрия. Трансмембранная асимметрия выражается в строгой ориентации белковых комплексов, что создает структурную основу направленного фотоиндуцированного потока электронов и сопряженного транспорта протонов. Липиды наружного слоя обогащены фосфатидилглицеролом, а внутренний слой содержит больше моногалактозилдиглицерида и сульфолипида. Латеральная асимметрия проявляется в распределении белковых комплексов между стромальными и гранальными тилакоидами. Различие поверхностных потенциалов комплексов ФС 1 (больший) и ФС 2 (меньший) вызывает их сегрегацию. При формировании гран ФС 1 вытесняются из области межмембранных контактов под действием электростатического отталкивания.
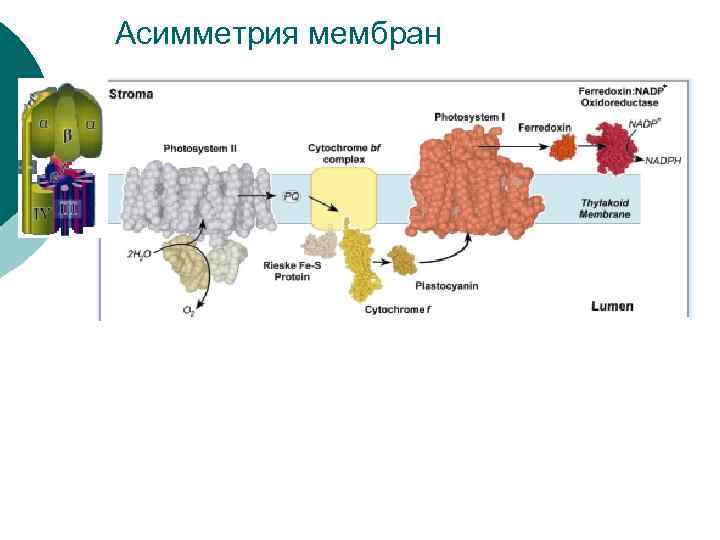 Асимметрия мембран
Асимметрия мембран
 Химическая организация мембран хлоропластов ¡ Липиды и белки – основные компоненты мембран хлоропластов
Химическая организация мембран хлоропластов ¡ Липиды и белки – основные компоненты мембран хлоропластов
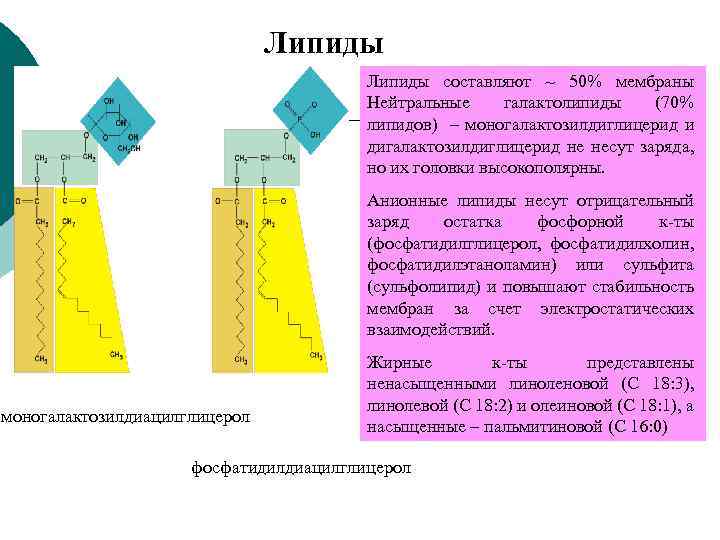 Липиды составляют ~ 50% мембраны Нейтральные галактолипиды (70% липидов) – моногалактозилдиглицерид и дигалактозилдиглицерид не несут заряда, но их головки высокополярны. Анионные липиды несут отрицательный заряд остатка фосфорной к-ты (фосфатидилглицерол, фосфатидилхолин, фосфатидилэтаноламин) или сульфита (сульфолипид) и повышают стабильность мембран за счет электростатических взаимодействий. моногалактозилдиацилглицерол Жирные к-ты представлены ненасыщенными линоленовой (С 18: 3), линолевой (С 18: 2) и олеиновой (С 18: 1), а насыщенные – пальмитиновой (С 16: 0) фосфатидилдиацилглицерол
Липиды составляют ~ 50% мембраны Нейтральные галактолипиды (70% липидов) – моногалактозилдиглицерид и дигалактозилдиглицерид не несут заряда, но их головки высокополярны. Анионные липиды несут отрицательный заряд остатка фосфорной к-ты (фосфатидилглицерол, фосфатидилхолин, фосфатидилэтаноламин) или сульфита (сульфолипид) и повышают стабильность мембран за счет электростатических взаимодействий. моногалактозилдиацилглицерол Жирные к-ты представлены ненасыщенными линоленовой (С 18: 3), линолевой (С 18: 2) и олеиновой (С 18: 1), а насыщенные – пальмитиновой (С 16: 0) фосфатидилдиацилглицерол
 Роль липидов в фотосинтезе Липопротеиновые мембраны как структурная основа энергетических процессов возникли на самых ранних этапах эволюции. Основные липидные компоненты мембран – фосфолипиды образовались в пребиотических условиях. Формирование липидных комплексов обусловило возможность включения в них различных соединений с первичными каталитическими функциями. Ограничение липидной мембраной определенных участков с набором ферментов позволило скооперировать отдельные группы каталитических систем, что легло в основу первичных клеточных образований. Липиды поддерживают механическую стабильность мембраны и придают ей гидрофобные свойства. Благодаря липидам обеспечиваются подвижность и динамические свойства мембран, возможность молекулярного взаимодействия отдельных функциональных комплексов. Ненасыщенные кислоты необходимы для ассоциации ССК II с ФС 2. Специфическая связь гликолипидов с интегральными белками обеспечивает их стабильность и необходимую конформацию в мембране. Конусовидная форма молекул моногалактозилдиглицерида может стабилизировать участки мембран с большой кривизной.
Роль липидов в фотосинтезе Липопротеиновые мембраны как структурная основа энергетических процессов возникли на самых ранних этапах эволюции. Основные липидные компоненты мембран – фосфолипиды образовались в пребиотических условиях. Формирование липидных комплексов обусловило возможность включения в них различных соединений с первичными каталитическими функциями. Ограничение липидной мембраной определенных участков с набором ферментов позволило скооперировать отдельные группы каталитических систем, что легло в основу первичных клеточных образований. Липиды поддерживают механическую стабильность мембраны и придают ей гидрофобные свойства. Благодаря липидам обеспечиваются подвижность и динамические свойства мембран, возможность молекулярного взаимодействия отдельных функциональных комплексов. Ненасыщенные кислоты необходимы для ассоциации ССК II с ФС 2. Специфическая связь гликолипидов с интегральными белками обеспечивает их стабильность и необходимую конформацию в мембране. Конусовидная форма молекул моногалактозилдиглицерида может стабилизировать участки мембран с большой кривизной.
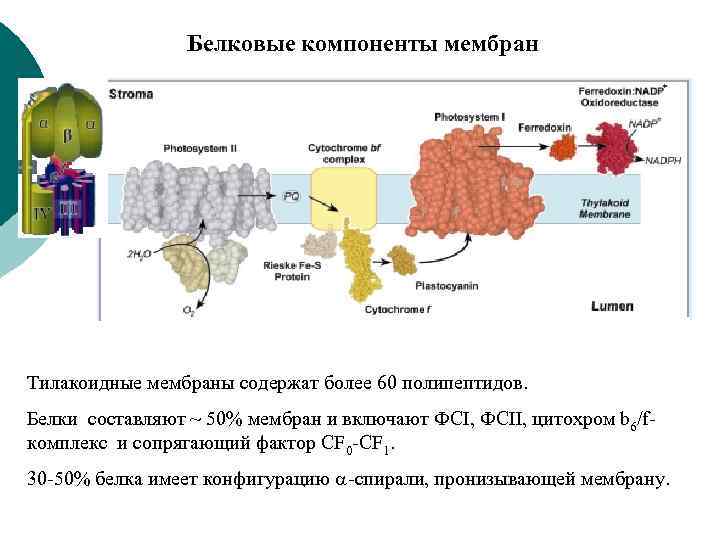 Белковые компоненты мембран Тилакоидные мембраны содержат более 60 полипептидов. Белки составляют ~ 50% мембран и включают ФСI, ФСII, цитохром b 6/fкомплекс и сопрягающий фактор CF 0 -CF 1. 30 -50% белка имеет конфигурацию -спирали, пронизывающей мембрану.
Белковые компоненты мембран Тилакоидные мембраны содержат более 60 полипептидов. Белки составляют ~ 50% мембран и включают ФСI, ФСII, цитохром b 6/fкомплекс и сопрягающий фактор CF 0 -CF 1. 30 -50% белка имеет конфигурацию -спирали, пронизывающей мембрану.


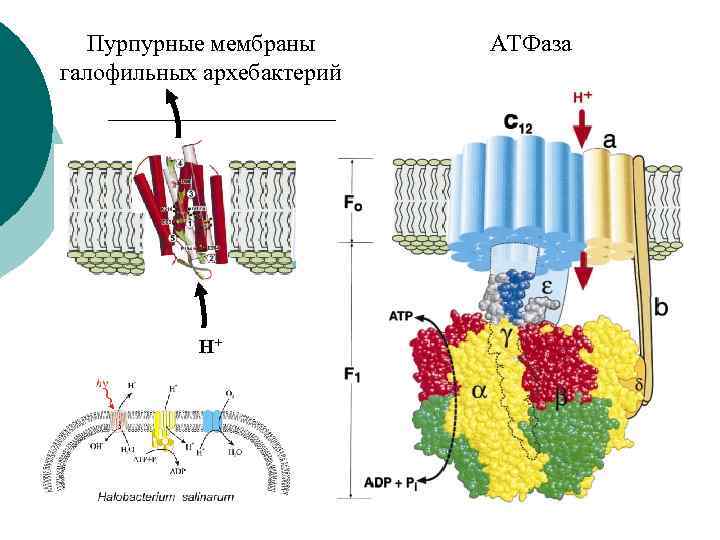 Пурпурные мембраны галофильных архебактерий H+ АТФаза
Пурпурные мембраны галофильных архебактерий H+ АТФаза
 Пигментные системы фотосинтеза
Пигментные системы фотосинтеза
 Фотосинтетические пигменты фотосенсибилизаторы В мембранах хлоропластов высших растений – 2 группы фотосинтетических пигментов: • Хлорофиллы • Каротиноиды В фотосинтетических мембранах низших растений и цианобактерий – 3 группы фотосинтетических пигментов: • Хлорофиллы • Каротиноиды • Фикобилипротеины
Фотосинтетические пигменты фотосенсибилизаторы В мембранах хлоропластов высших растений – 2 группы фотосинтетических пигментов: • Хлорофиллы • Каротиноиды В фотосинтетических мембранах низших растений и цианобактерий – 3 группы фотосинтетических пигментов: • Хлорофиллы • Каротиноиды • Фикобилипротеины
 Хлорофиллы Важнейшие фотосенсибилизаторы молекулы чувствительные к свету, поглощающие свет, возбуждающиеся под действием света В мембранах тилакоидов – в виде липопротеидных комплексов Функции: 1) поглощение света; 2) передача энергии возбуждения с одних молекул на другие; 3) первичное разделение зарядов на мембране
Хлорофиллы Важнейшие фотосенсибилизаторы молекулы чувствительные к свету, поглощающие свет, возбуждающиеся под действием света В мембранах тилакоидов – в виде липопротеидных комплексов Функции: 1) поглощение света; 2) передача энергии возбуждения с одних молекул на другие; 3) первичное разделение зарядов на мембране
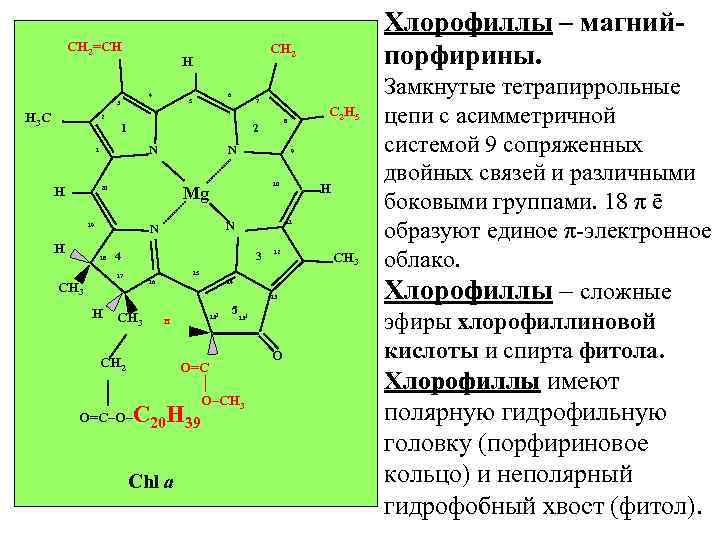 CH 2=CH Хлорофиллы – магнийпорфирины. CH 2 H 4 6 5 3 H 3 C 7 2 1 2 N 1 H N 19 H 10 4 3 12 15 17 16 CH 3 14 13 H CH 3 CH 2 O=C–O– 132 H 131 O=C │ O–CH 3 C 20 H 39 Chl a 5 H 11 N N 18 9 Mg 20 C 2 H 5 8 O CH 3 Замкнутые тетрапиррольные цепи с асимметричной системой 9 сопряженных двойных связей и различными боковыми группами. 18 π ē образуют единое π-электронное облако. Хлорофиллы – сложные эфиры хлорофиллиновой кислоты и спирта фитола. Хлорофиллы имеют полярную гидрофильную головку (порфириновое кольцо) и неполярный гидрофобный хвост (фитол).
CH 2=CH Хлорофиллы – магнийпорфирины. CH 2 H 4 6 5 3 H 3 C 7 2 1 2 N 1 H N 19 H 10 4 3 12 15 17 16 CH 3 14 13 H CH 3 CH 2 O=C–O– 132 H 131 O=C │ O–CH 3 C 20 H 39 Chl a 5 H 11 N N 18 9 Mg 20 C 2 H 5 8 O CH 3 Замкнутые тетрапиррольные цепи с асимметричной системой 9 сопряженных двойных связей и различными боковыми группами. 18 π ē образуют единое π-электронное облако. Хлорофиллы – сложные эфиры хлорофиллиновой кислоты и спирта фитола. Хлорофиллы имеют полярную гидрофильную головку (порфириновое кольцо) и неполярный гидрофобный хвост (фитол).
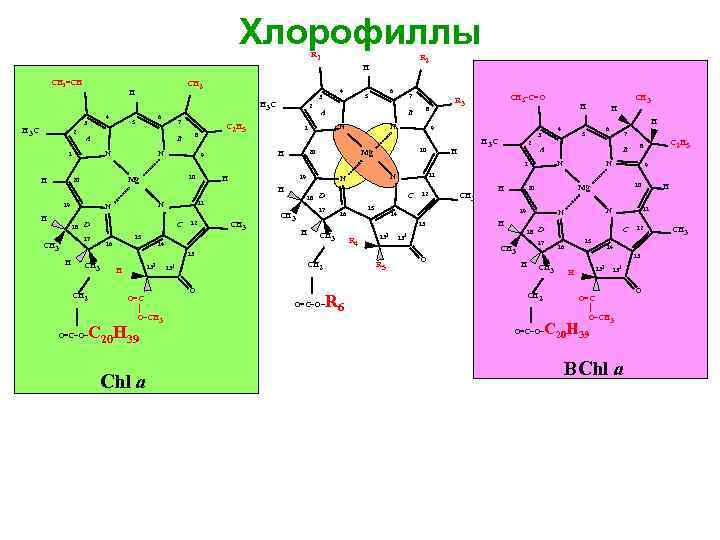 Хлорофиллы R 1 R 2 H CH 2=CH CH 2 H 4 3 H 3 C 2 6 5 7 A B N 1 N 2 C 2 H 5 8 6 5 7 A N 9 10 Mg 20 CH 3–C=O R 3 8 B N 1 H 9 4 3 H 3 C H 2 H Mg 20 19 H 18 D C 17 CH 3 11 N N 15 16 18 12 14 CH 3 D 17 CH 3 C 15 16 CH 3 R 4 CH 3 CH 2 132 H O=C │ O–CH 3 C 20 H 39 O=C–O– Chl a CH 2 131 O 132 R 5 R 6 O=C–O– CH 3 H 7 N C 2 H 5 8 B N 9 19 18 O D C 17 CH 3 15 16 12 14 13 H CH 3 CH 2 132 Н H 11 N N H 131 10 Mg 20 14 13 H 12 13 H H 6 5 11 N N H CH 3 H A 1 10 H 131 O=C │ O–CH 3 C 20 H 39 O=C–O– BChl a O CH 3
Хлорофиллы R 1 R 2 H CH 2=CH CH 2 H 4 3 H 3 C 2 6 5 7 A B N 1 N 2 C 2 H 5 8 6 5 7 A N 9 10 Mg 20 CH 3–C=O R 3 8 B N 1 H 9 4 3 H 3 C H 2 H Mg 20 19 H 18 D C 17 CH 3 11 N N 15 16 18 12 14 CH 3 D 17 CH 3 C 15 16 CH 3 R 4 CH 3 CH 2 132 H O=C │ O–CH 3 C 20 H 39 O=C–O– Chl a CH 2 131 O 132 R 5 R 6 O=C–O– CH 3 H 7 N C 2 H 5 8 B N 9 19 18 O D C 17 CH 3 15 16 12 14 13 H CH 3 CH 2 132 Н H 11 N N H 131 10 Mg 20 14 13 H 12 13 H H 6 5 11 N N H CH 3 H A 1 10 H 131 O=C │ O–CH 3 C 20 H 39 O=C–O– BChl a O CH 3
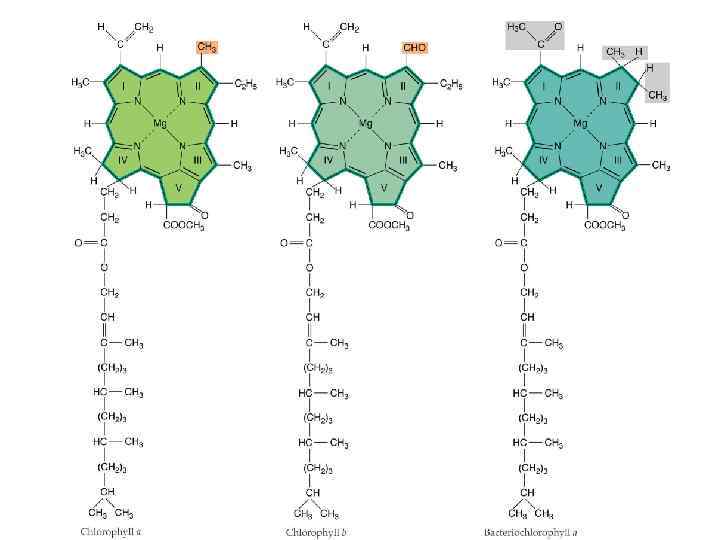
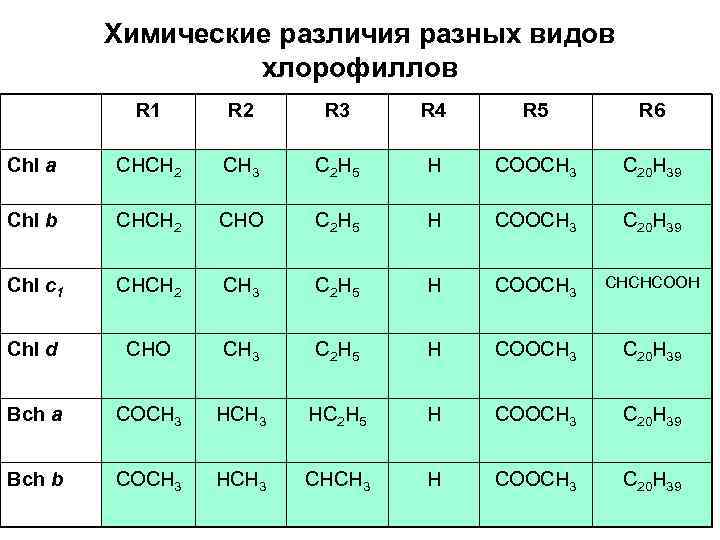 Химические различия разных видов хлорофиллов R 1 R 2 R 3 R 4 R 5 R 6 Chl a CHCH 2 CH 3 C 2 H 5 H COOCH 3 C 20 H 39 Chl b CHCH 2 CHO C 2 H 5 H COOCH 3 C 20 H 39 Chl c 1 CHCH 2 CH 3 C 2 H 5 H COOCH 3 CHCHCOOH Chl d CHO CH 3 C 2 H 5 H COOCH 3 C 20 H 39 Bсh a COCH 3 HC 2 H 5 H COOCH 3 C 20 H 39 Bсh b COCH 3 HCH 3 CHCH 3 H COOCH 3 C 20 H 39
Химические различия разных видов хлорофиллов R 1 R 2 R 3 R 4 R 5 R 6 Chl a CHCH 2 CH 3 C 2 H 5 H COOCH 3 C 20 H 39 Chl b CHCH 2 CHO C 2 H 5 H COOCH 3 C 20 H 39 Chl c 1 CHCH 2 CH 3 C 2 H 5 H COOCH 3 CHCHCOOH Chl d CHO CH 3 C 2 H 5 H COOCH 3 C 20 H 39 Bсh a COCH 3 HC 2 H 5 H COOCH 3 C 20 H 39 Bсh b COCH 3 HCH 3 CHCH 3 H COOCH 3 C 20 H 39
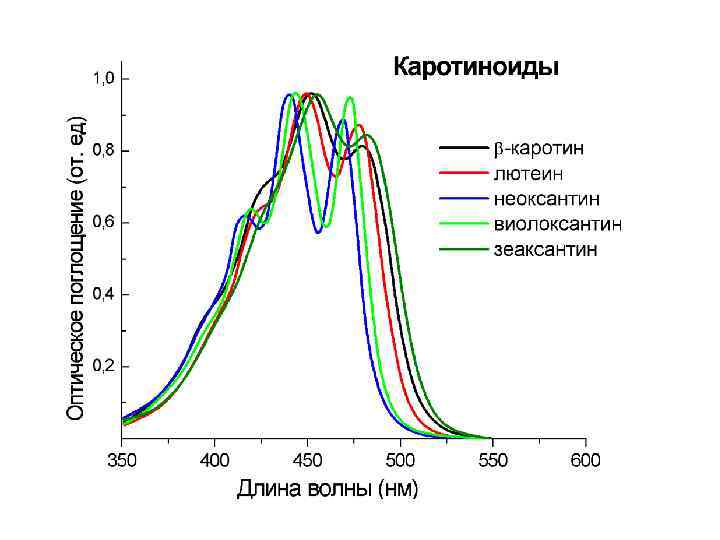
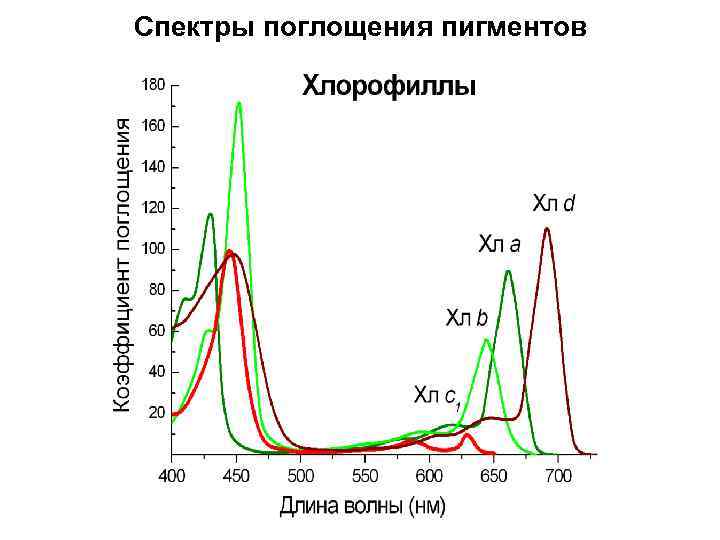 Спектры поглощения пигментов
Спектры поглощения пигментов
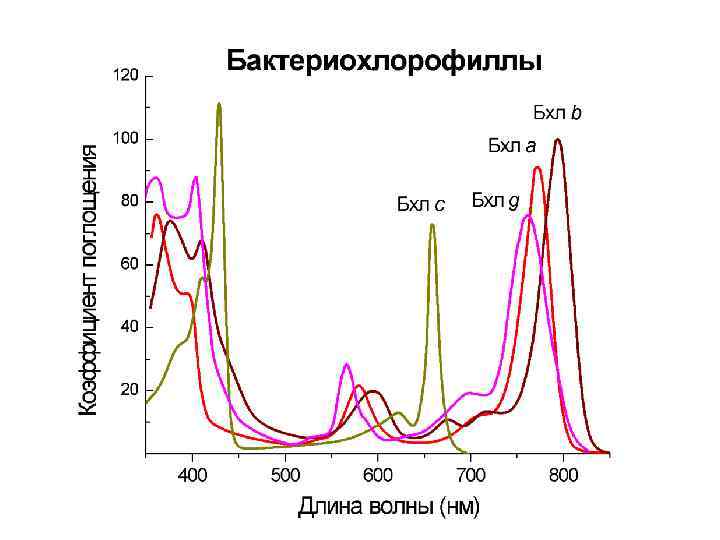
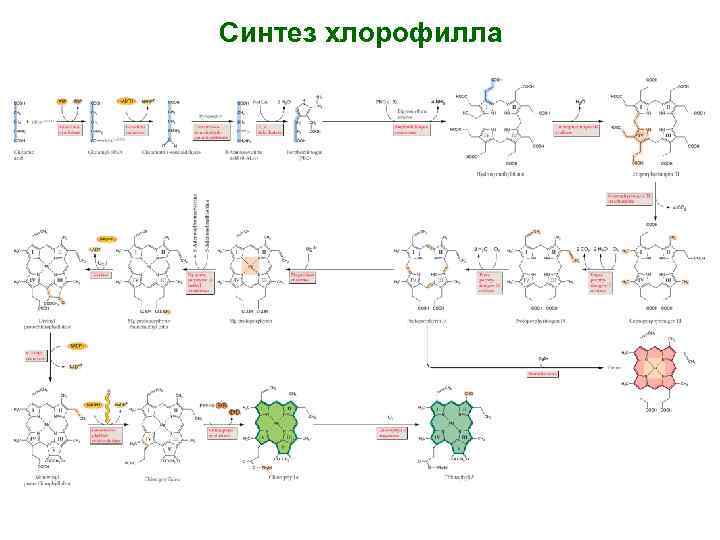 Синтез хлорофилла
Синтез хлорофилла
 Каротиноиды – добавочные фотосинтетические пигменты Пигменты желтого, оранжевого и красного цвета. Встречаются у всех фотосинтезирующих организмов. По химической природе – дитерпены. Полиизопреноидная цепочка замыкается в βиононовые кольца. 9 сопряженных двойных связей в центральной части молекулы. Существуют цис- (изогнутая) и транс- (линейная) конфигурация. Большая часть каротиноидов в ССК – транс-изомеры. Липофильные соединения. Локализованы в липидной фазе мембран тилакоидов. 2 группы каротиноидов: 1) Каротины – не содержат кислорода (С 40 Н 56) 2) Ксантофиллы – содержат атомы кислорода.
Каротиноиды – добавочные фотосинтетические пигменты Пигменты желтого, оранжевого и красного цвета. Встречаются у всех фотосинтезирующих организмов. По химической природе – дитерпены. Полиизопреноидная цепочка замыкается в βиононовые кольца. 9 сопряженных двойных связей в центральной части молекулы. Существуют цис- (изогнутая) и транс- (линейная) конфигурация. Большая часть каротиноидов в ССК – транс-изомеры. Липофильные соединения. Локализованы в липидной фазе мембран тилакоидов. 2 группы каротиноидов: 1) Каротины – не содержат кислорода (С 40 Н 56) 2) Ксантофиллы – содержат атомы кислорода.
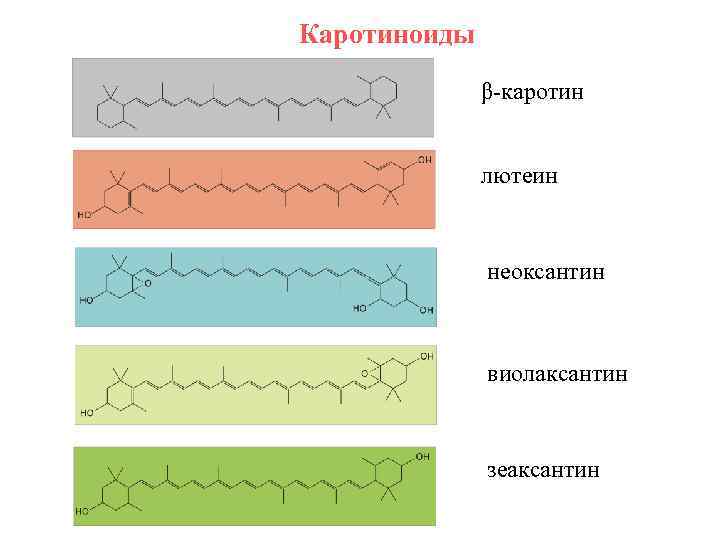 Каротиноиды β-каротин лютеин неоксантин виолаксантин зеаксантин
Каротиноиды β-каротин лютеин неоксантин виолаксантин зеаксантин
 Функции каротиноидов 1) Компоненты ССК (антенная функция) - поглощение света в синей части спектра 2) Передача энергии возбужденного состояния на хлорофиллы 1 Car + hν 1 Car* 1 Car* + 1 Хл 1 Car + 1 Хл* 3) Образование и удаление синглетного кислорода 1 Хл + hν 1 Хл* 1 О * + 1 Car 3 О + 3 Car* 2 2 1 Хл* 3 Хл* 3 Car* 1 Car + тепло 3 Хл* + 3 О 1 Хл + 1 О * 2 2 4) Тушение триплетного хлорофилла 3 Хл* + 1 Car 1 Хл + 3 Car* 1 Car + тепло 1) 5) Фотопротекторная функция – ксантофилльный (виолоксантиновый) 2) цикл – регуляция светового потока. 3) деэпоксидаза 4) Виолоксантин Антераксантин Зеаксантин эпоксидаза (+О 2+ НАДФН)
Функции каротиноидов 1) Компоненты ССК (антенная функция) - поглощение света в синей части спектра 2) Передача энергии возбужденного состояния на хлорофиллы 1 Car + hν 1 Car* 1 Car* + 1 Хл 1 Car + 1 Хл* 3) Образование и удаление синглетного кислорода 1 Хл + hν 1 Хл* 1 О * + 1 Car 3 О + 3 Car* 2 2 1 Хл* 3 Хл* 3 Car* 1 Car + тепло 3 Хл* + 3 О 1 Хл + 1 О * 2 2 4) Тушение триплетного хлорофилла 3 Хл* + 1 Car 1 Хл + 3 Car* 1 Car + тепло 1) 5) Фотопротекторная функция – ксантофилльный (виолоксантиновый) 2) цикл – регуляция светового потока. 3) деэпоксидаза 4) Виолоксантин Антераксантин Зеаксантин эпоксидаза (+О 2+ НАДФН)
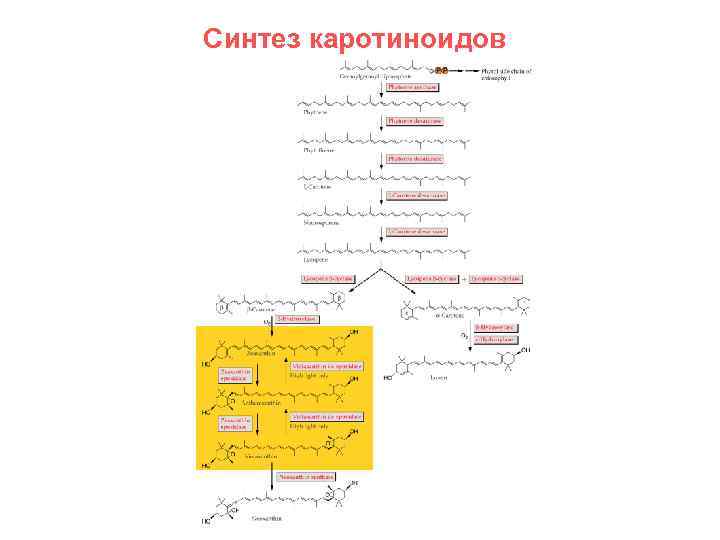 Синтез каротиноидов
Синтез каротиноидов
 Фикобилипротеины – добавочные пигменты цианобактерий и красных водорослей • Пигменты красного и синего цвета. • По химической природе – хромопротеины, хромофорная группа которых – фикобилины (тетрапирролы с открытой цепью). Связь хромофора с белком – ковалентная. Пиррольные кольца соединены метиновыми и метиленовыми мостиками. Имеют 2 остатка пропионовой кислоты, метильные, этильные и винильные радикалы.
Фикобилипротеины – добавочные пигменты цианобактерий и красных водорослей • Пигменты красного и синего цвета. • По химической природе – хромопротеины, хромофорная группа которых – фикобилины (тетрапирролы с открытой цепью). Связь хромофора с белком – ковалентная. Пиррольные кольца соединены метиновыми и метиленовыми мостиками. Имеют 2 остатка пропионовой кислоты, метильные, этильные и винильные радикалы.
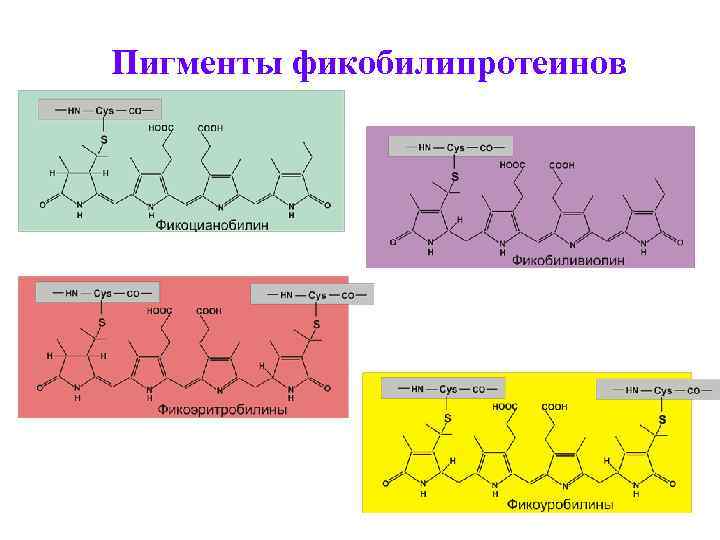 Пигменты фикобилипротеинов
Пигменты фикобилипротеинов
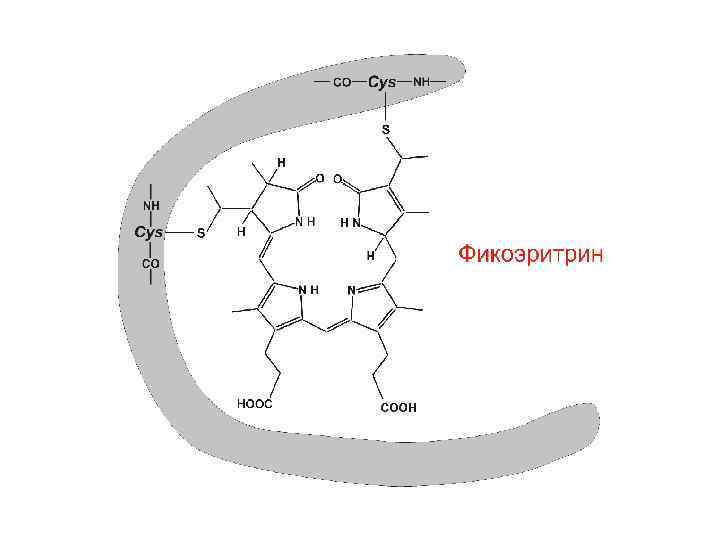
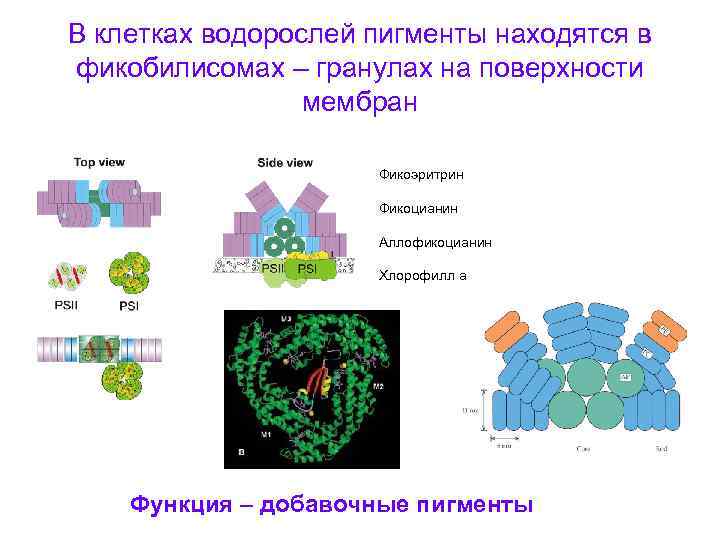 В клетках водорослей пигменты находятся в фикобилисомах – гранулах на поверхности мембран Фикоэритрин Фикоцианин Аллофикоцианин Хлорофилл а Функция – добавочные пигменты
В клетках водорослей пигменты находятся в фикобилисомах – гранулах на поверхности мембран Фикоэритрин Фикоцианин Аллофикоцианин Хлорофилл а Функция – добавочные пигменты
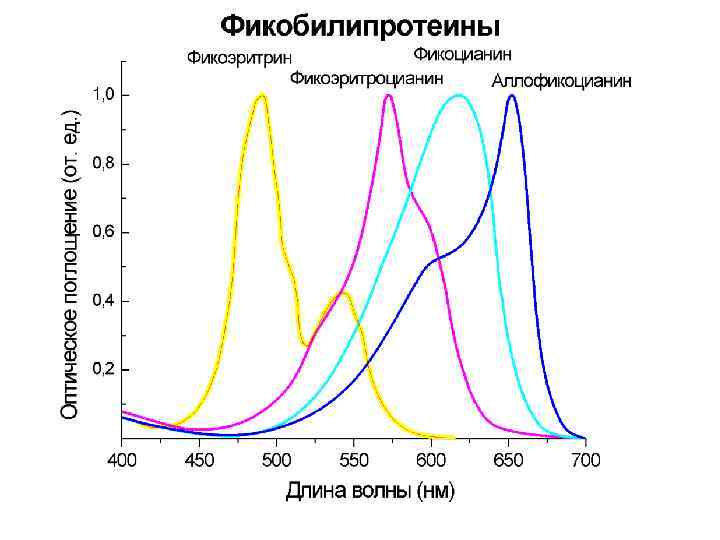
 Пигментные системы n n Действуют кооперативно, образуя антенну, с которой энергия возбуждения переносится на реакционные центры. Между молекулами пигментов в реакционных центрах происходит первичное разделение зарядов.
Пигментные системы n n Действуют кооперативно, образуя антенну, с которой энергия возбуждения переносится на реакционные центры. Между молекулами пигментов в реакционных центрах происходит первичное разделение зарядов.
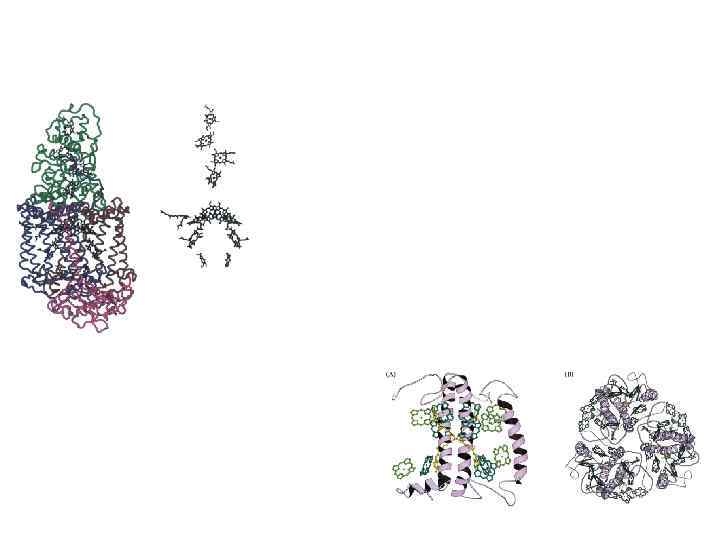
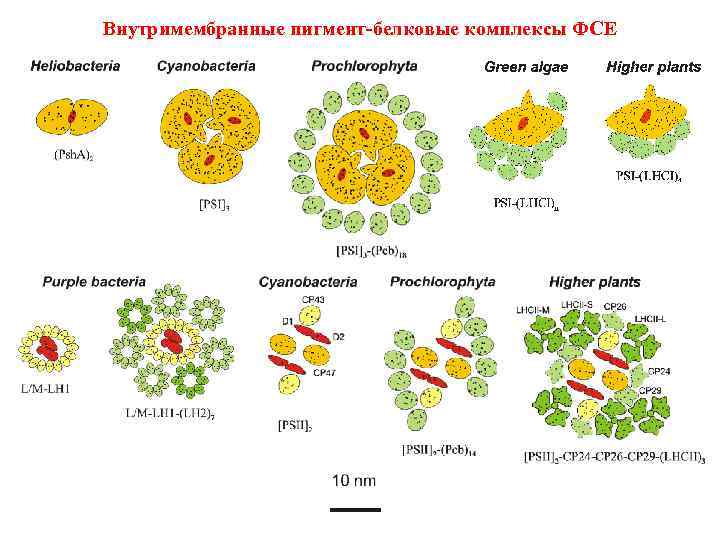 Внутримембранные пигмент-белковые комплексы ФСЕ
Внутримембранные пигмент-белковые комплексы ФСЕ

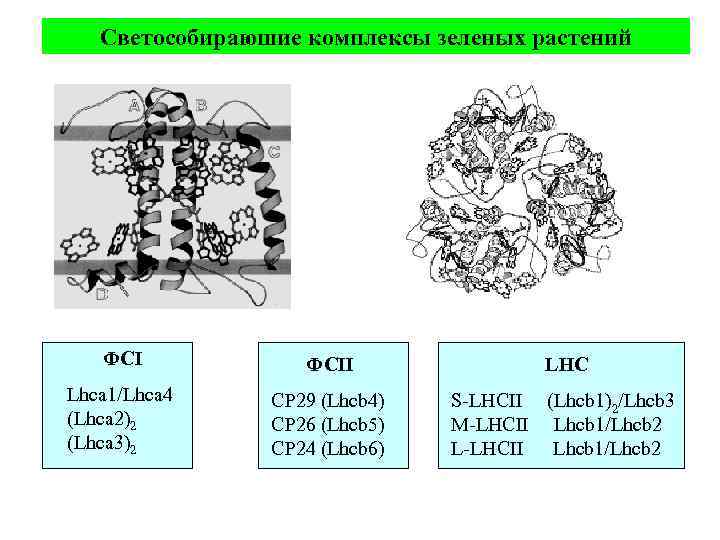 Светособираюшие комплексы зеленых растений ФСII Lhca 1/Lhca 4 (Lhca 2)2 (Lhca 3)2 CP 29 (Lhcb 4) CP 26 (Lhcb 5) CP 24 (Lhcb 6) LHC S-LHCII (Lhcb 1)2/Lhcb 3 M-LHCII Lhcb 1/Lhcb 2 L-LHCII Lhcb 1/Lhcb 2
Светособираюшие комплексы зеленых растений ФСII Lhca 1/Lhca 4 (Lhca 2)2 (Lhca 3)2 CP 29 (Lhcb 4) CP 26 (Lhcb 5) CP 24 (Lhcb 6) LHC S-LHCII (Lhcb 1)2/Lhcb 3 M-LHCII Lhcb 1/Lhcb 2 L-LHCII Lhcb 1/Lhcb 2
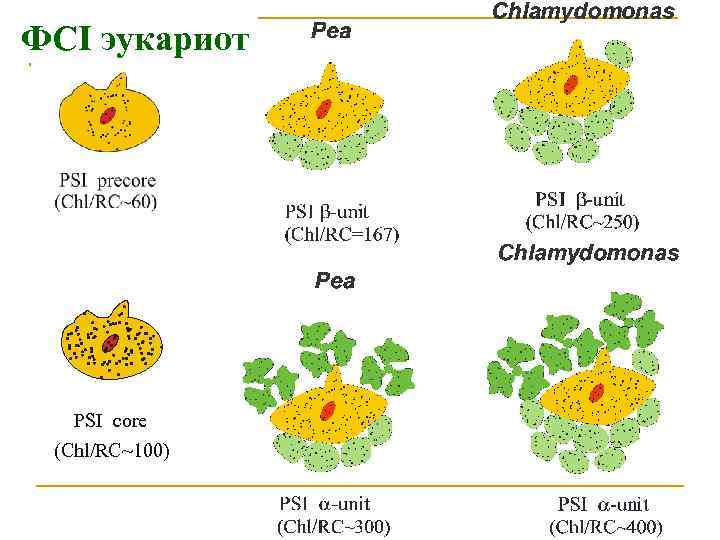
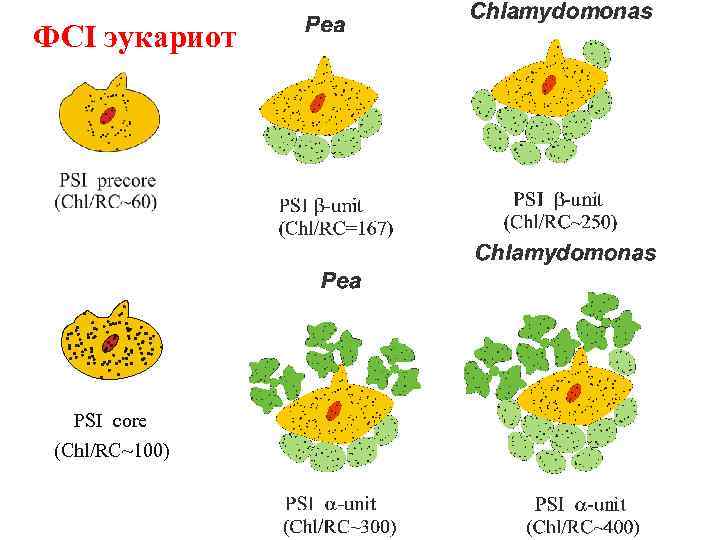 ФСI эукариот PSI core (Chl/RC~100)
ФСI эукариот PSI core (Chl/RC~100)
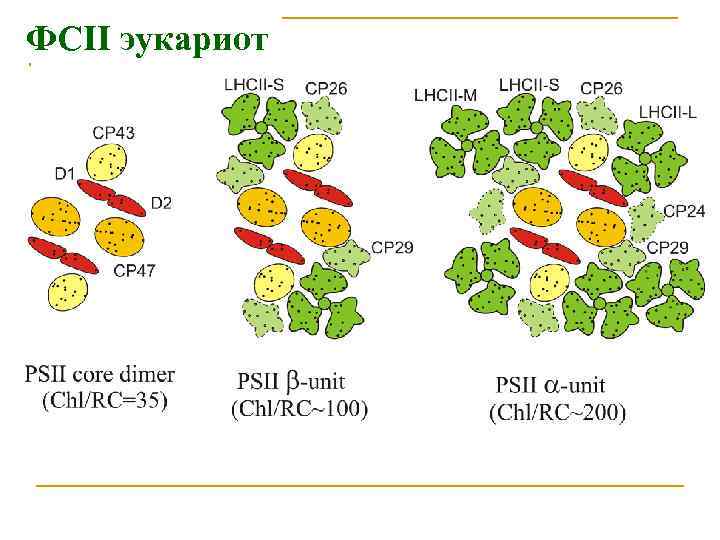
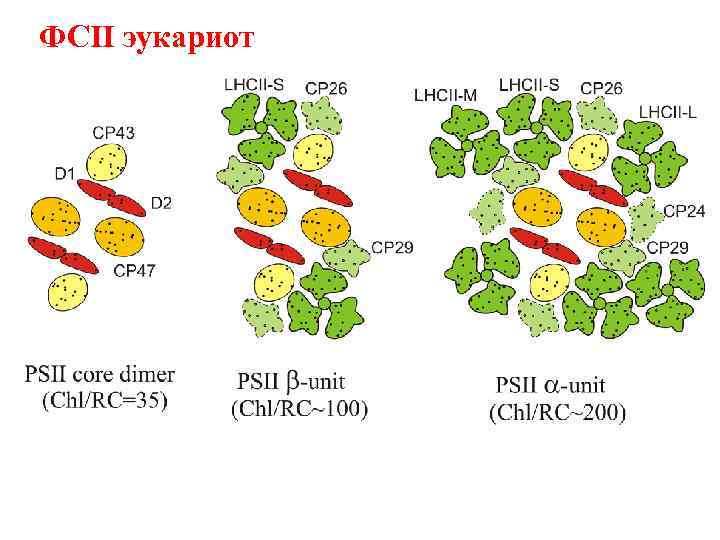 ФСII эукариот
ФСII эукариот
 Структура и функционирование фотосистем. ЭТЦ хлоропластов
Структура и функционирование фотосистем. ЭТЦ хлоропластов
 Структурная основа первичных процессов фотосинтеза – фотосинтетическая единица (ФСЕ). ФСЕ = ССК+РЦ Идея ФСЕ – Х. Гаффрон, К. Воль (1936), Дюйзенс (1952) В ФСЕ пигменты функционально гетерогенны (В. Н. Любименко, 1930) и взаимодействуют между собой (Р. Эмерсон и В. Арнольд, 1943), что обеспечивает высокую эффективность поглощения и преобразования световой энергии в первичных процессах. Для ФСЕ характерна высокая структурно-функциональная упорядоченность.
Структурная основа первичных процессов фотосинтеза – фотосинтетическая единица (ФСЕ). ФСЕ = ССК+РЦ Идея ФСЕ – Х. Гаффрон, К. Воль (1936), Дюйзенс (1952) В ФСЕ пигменты функционально гетерогенны (В. Н. Любименко, 1930) и взаимодействуют между собой (Р. Эмерсон и В. Арнольд, 1943), что обеспечивает высокую эффективность поглощения и преобразования световой энергии в первичных процессах. Для ФСЕ характерна высокая структурно-функциональная упорядоченность.
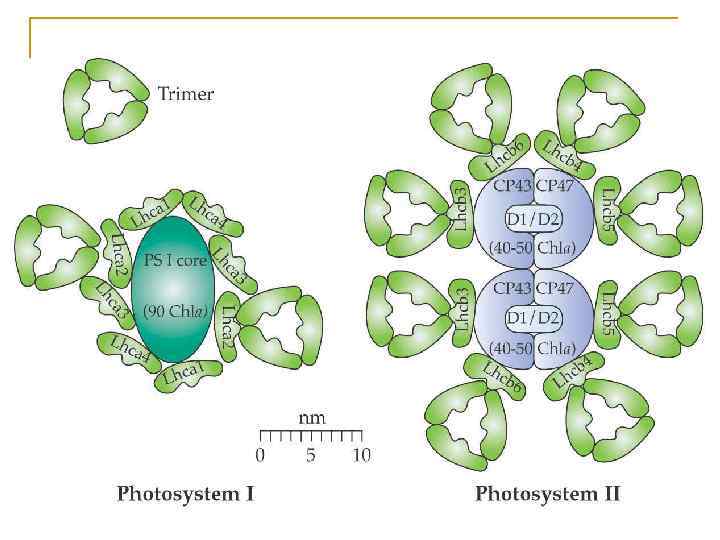
 Основные типы пигмент белковых комплексов высших растений: РЦ ФСI – ядро (core): РЦ ФСII – ядро (core): димер П 700, 2 β-каротина, димер П 680, хлорофилл «а» ≈100 молекул хл «a» (внутренняя содержащие белки CP 43 и CP 47 антенна) (внутренняя антенна), связанные с ССК I (LHC I): белками D 1/D 2, цитохром b 559 80 -120 молекул хл «а» и «b» , ССК II (LHC II): каротиноиды Хлорофиллы «а» , «b» , каротиноиды, Состоит из 4 типов субъединиц S-LHCII (Lhcb 1)2/Lhcb 3 LHCa 1, LHCa 2, LHCa 3, LHCa 4, M-LHCII Lhcb 1/Lhcb 2 которые образуют комплексы L-LHCII Lhcb 1/Lhcb 2 n Lhca 1/Lhca 4 3 минорных типа ССК (расположены n (Lhca 2)2 между РЦ и ССК II) – CP 29 (LHCb 4), n (Lhca 3)2 CP 26 (LHCb 5), CP 24 (LHCb 6),
Основные типы пигмент белковых комплексов высших растений: РЦ ФСI – ядро (core): РЦ ФСII – ядро (core): димер П 700, 2 β-каротина, димер П 680, хлорофилл «а» ≈100 молекул хл «a» (внутренняя содержащие белки CP 43 и CP 47 антенна) (внутренняя антенна), связанные с ССК I (LHC I): белками D 1/D 2, цитохром b 559 80 -120 молекул хл «а» и «b» , ССК II (LHC II): каротиноиды Хлорофиллы «а» , «b» , каротиноиды, Состоит из 4 типов субъединиц S-LHCII (Lhcb 1)2/Lhcb 3 LHCa 1, LHCa 2, LHCa 3, LHCa 4, M-LHCII Lhcb 1/Lhcb 2 которые образуют комплексы L-LHCII Lhcb 1/Lhcb 2 n Lhca 1/Lhca 4 3 минорных типа ССК (расположены n (Lhca 2)2 между РЦ и ССК II) – CP 29 (LHCb 4), n (Lhca 3)2 CP 26 (LHCb 5), CP 24 (LHCb 6),
 ФСI эукариот PSI core (Chl/RC~100)
ФСI эукариот PSI core (Chl/RC~100)
 ФСII эукариот
ФСII эукариот
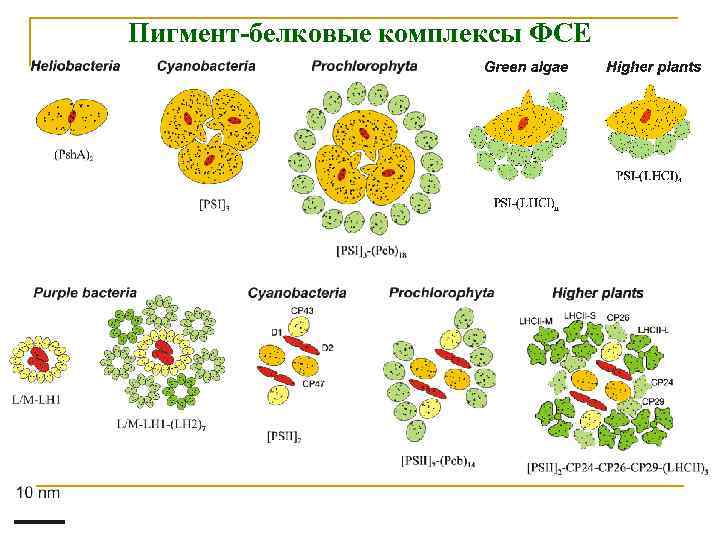 Пигмент-белковые комплексы ФСЕ
Пигмент-белковые комплексы ФСЕ
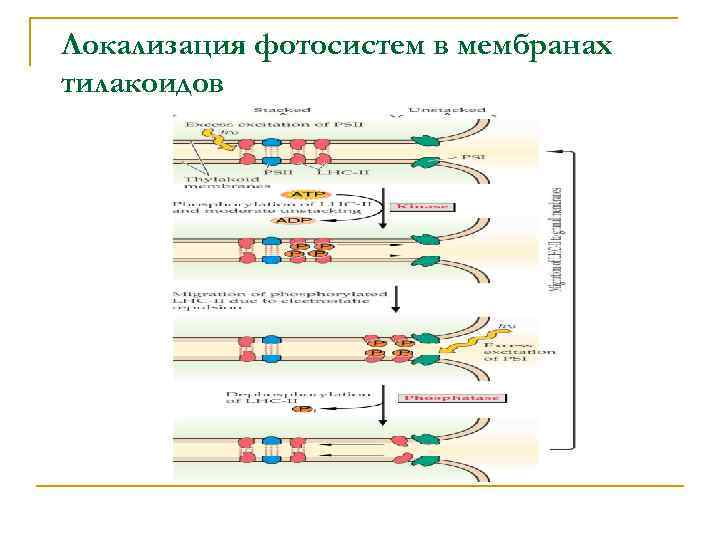 Локализация фотосистем в мембранах тилакоидов
Локализация фотосистем в мембранах тилакоидов
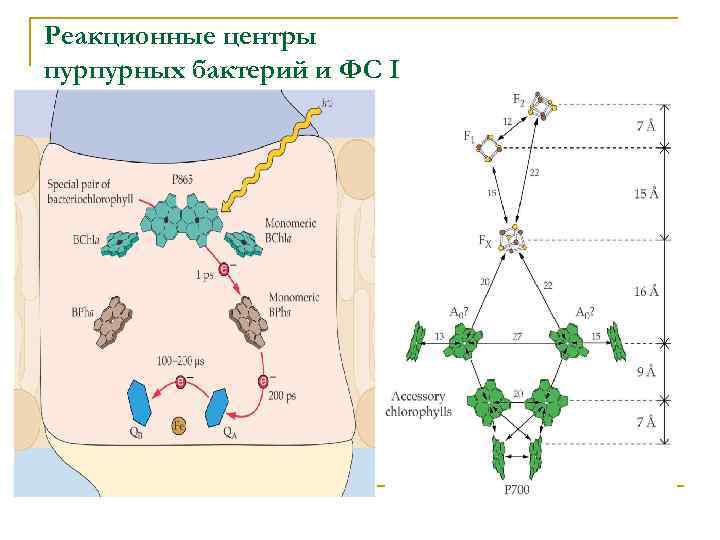 Реакционные центры пурпурных бактерий и ФС I
Реакционные центры пурпурных бактерий и ФС I
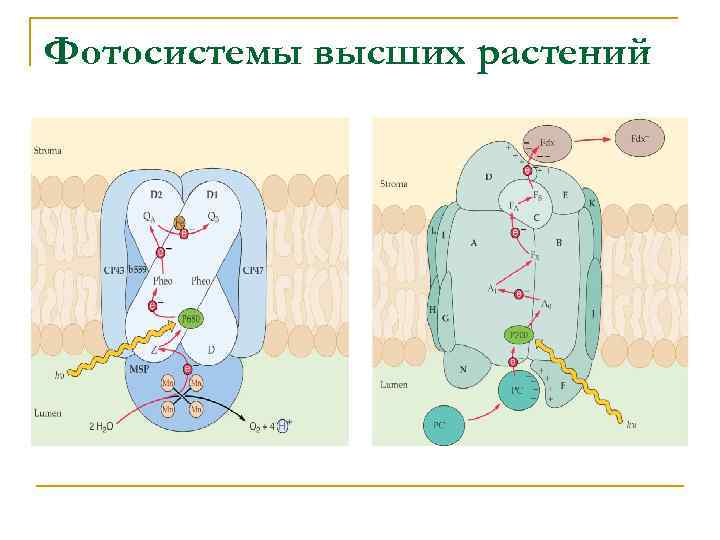 Фотосистемы высших растений
Фотосистемы высших растений
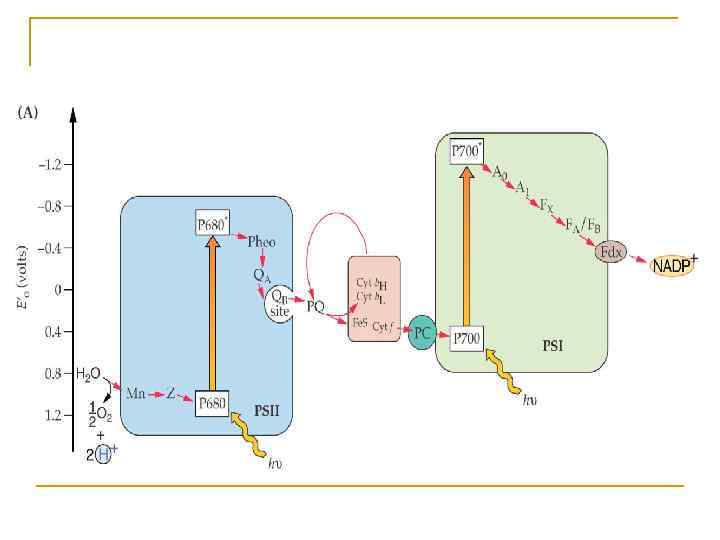
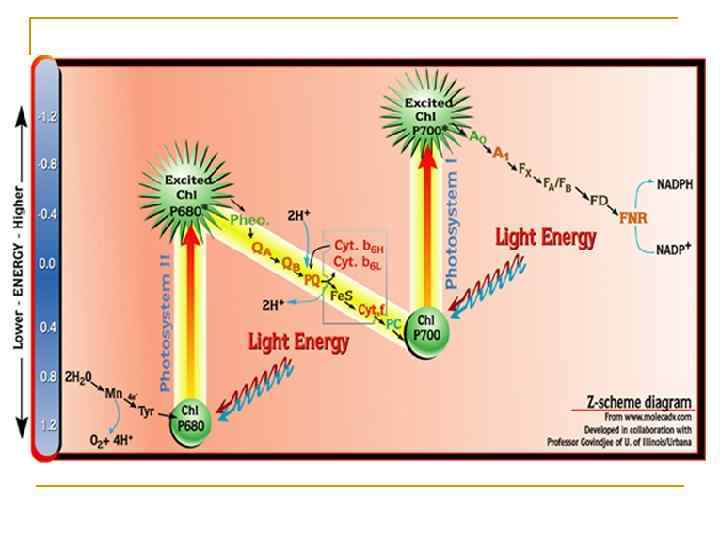
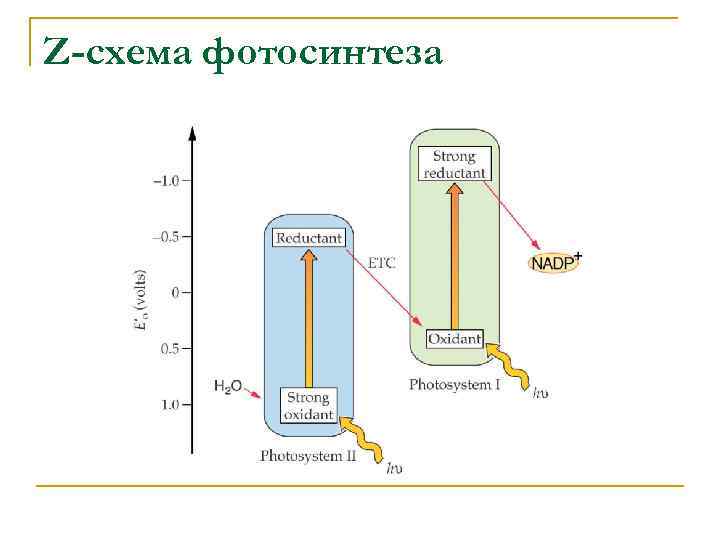 Z-схема фотосинтеза
Z-схема фотосинтеза
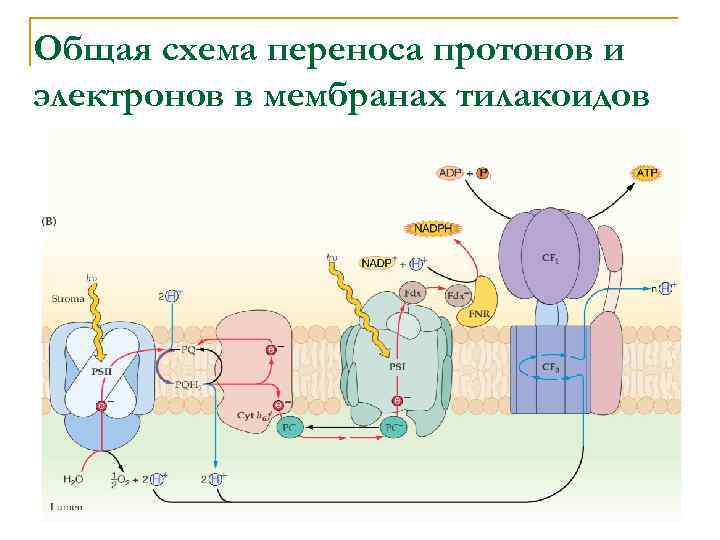 Общая схема переноса протонов и электронов в мембранах тилакоидов
Общая схема переноса протонов и электронов в мембранах тилакоидов
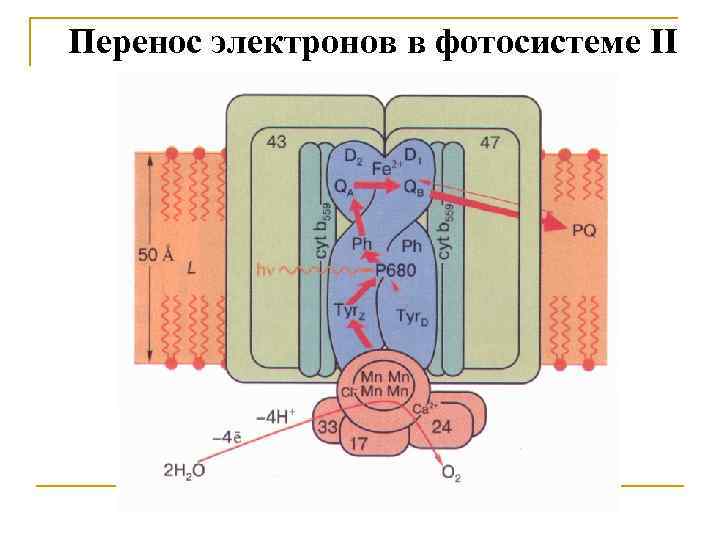 Перенос электронов в фотосистеме II
Перенос электронов в фотосистеме II
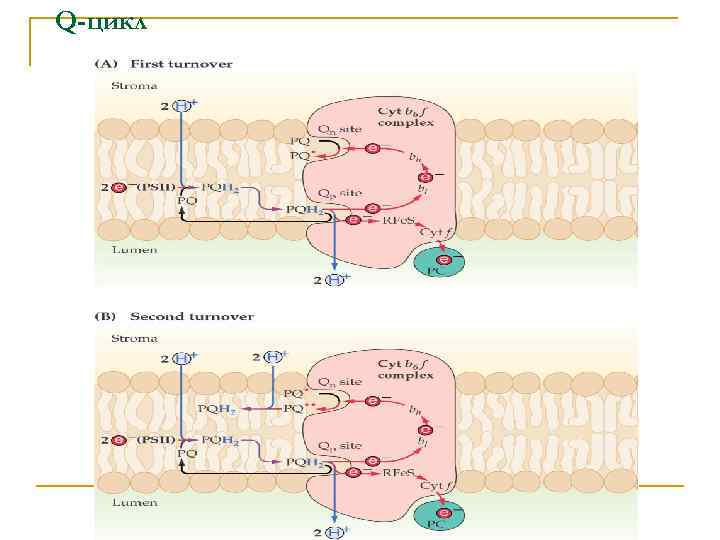 Q-цикл
Q-цикл
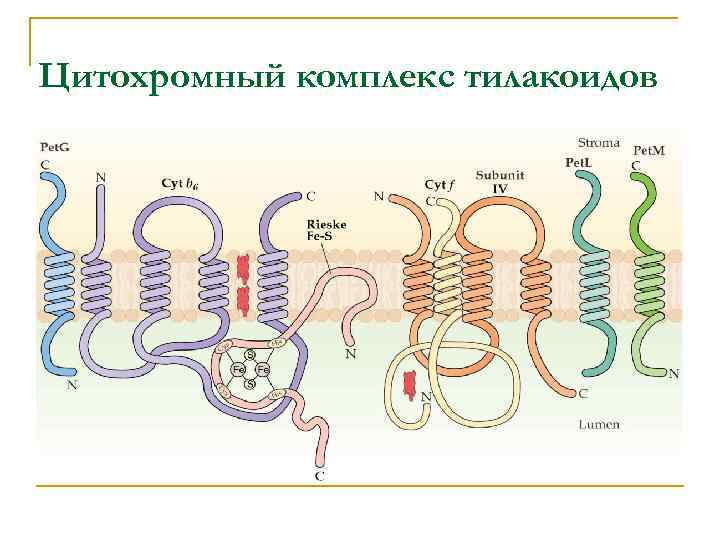 Цитохромный комплекс тилакоидов
Цитохромный комплекс тилакоидов
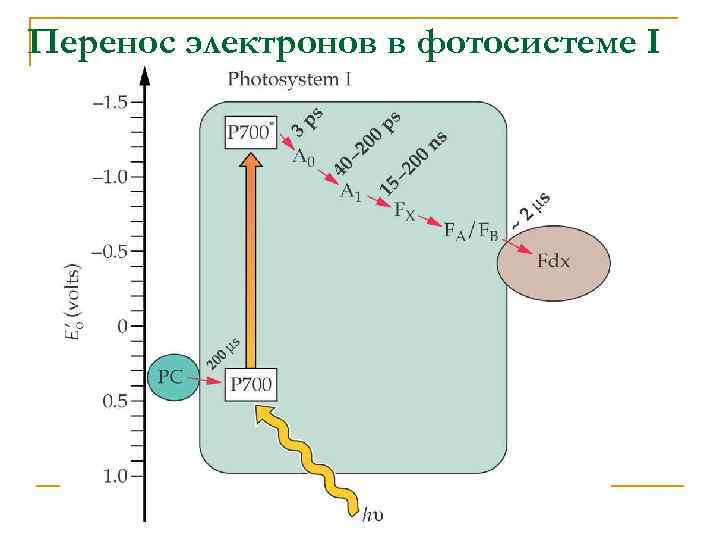 Перенос электронов в фотосистеме I
Перенос электронов в фотосистеме I
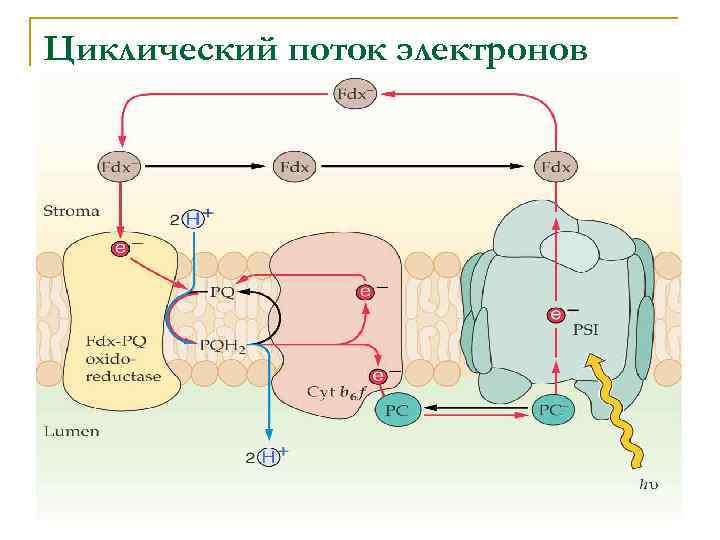 Циклический поток электронов
Циклический поток электронов
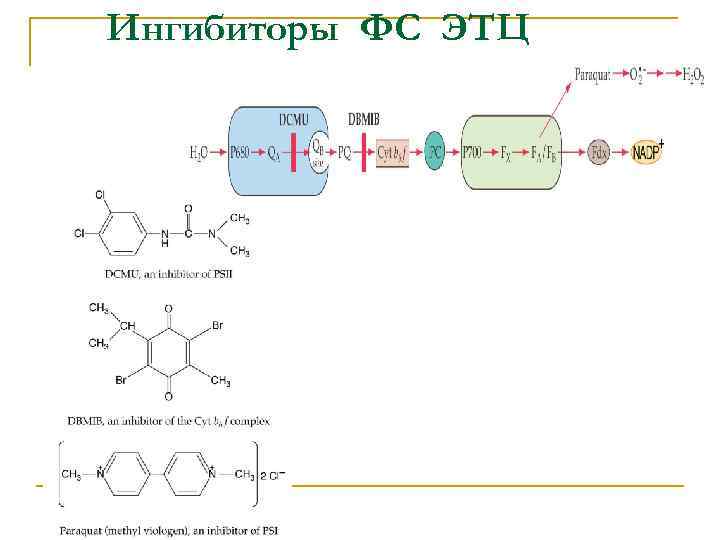 Ингибиторы ФС ЭТЦ
Ингибиторы ФС ЭТЦ
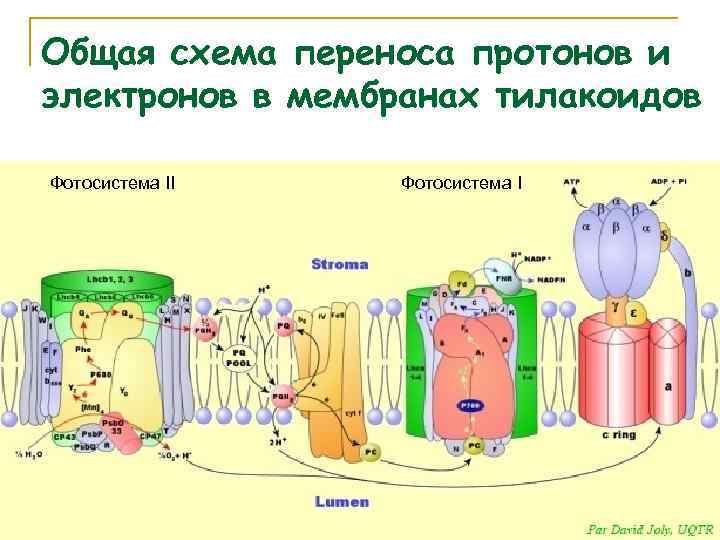 Общая схема переноса протонов и электронов в мембранах тилакоидов Фотосистема II Фотосистема I
Общая схема переноса протонов и электронов в мембранах тилакоидов Фотосистема II Фотосистема I
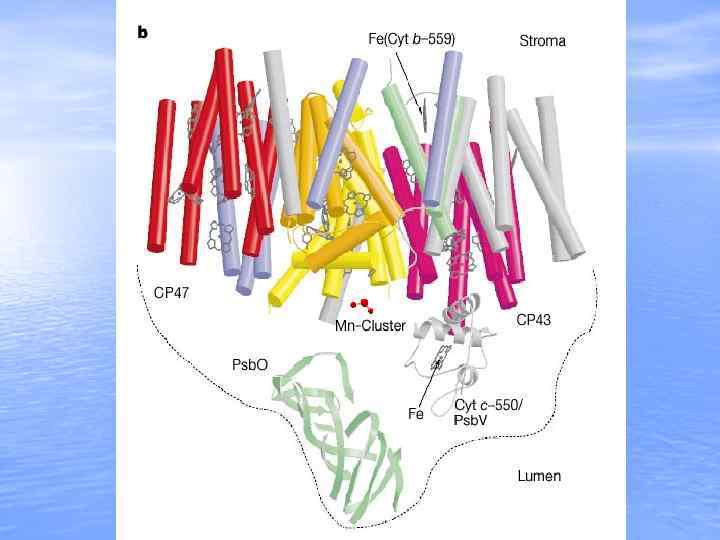
 Фотосинтетическое окисление воды
Фотосинтетическое окисление воды
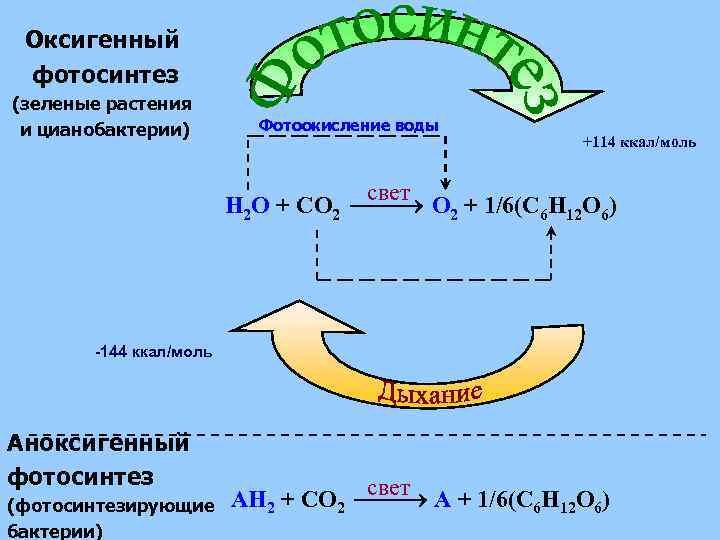 Оксигенный фотосинтез (зеленые растения и цианобактерии) Фотоокисление воды +114 ккал/моль свет H 2 O + CO 2 + 1/6(C 6 H 12 O 6) -144 ккал/моль Аноксигенный фотосинтез (фотосинтезирующие бактерии) свет AH 2 + CO 2 A + 1/6(C 6 H 12 O 6)
Оксигенный фотосинтез (зеленые растения и цианобактерии) Фотоокисление воды +114 ккал/моль свет H 2 O + CO 2 + 1/6(C 6 H 12 O 6) -144 ккал/моль Аноксигенный фотосинтез (фотосинтезирующие бактерии) свет AH 2 + CO 2 A + 1/6(C 6 H 12 O 6)
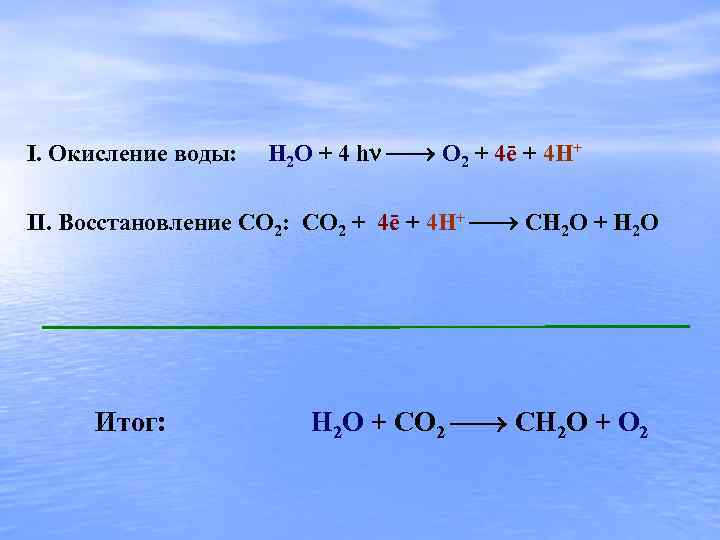 I. Окисление воды: H 2 O + 4 h O 2 + 4ē + 4 H+ II. Восстановление CO 2: CO 2 + 4ē + 4 H+ CH 2 O + H 2 O Итог: H 2 O + CO 2 CH 2 O + O 2
I. Окисление воды: H 2 O + 4 h O 2 + 4ē + 4 H+ II. Восстановление CO 2: CO 2 + 4ē + 4 H+ CH 2 O + H 2 O Итог: H 2 O + CO 2 CH 2 O + O 2
 “ … не знаю другого, более удивительного процесса, который бы смог так преобразовать Землю. ” академик А. П. Виноградов (1973)
“ … не знаю другого, более удивительного процесса, который бы смог так преобразовать Землю. ” академик А. П. Виноградов (1973)
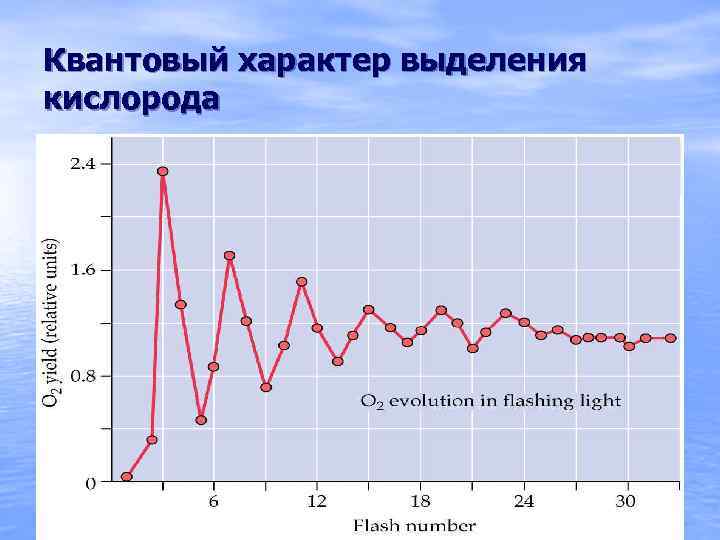 Квантовый характер выделения кислорода
Квантовый характер выделения кислорода
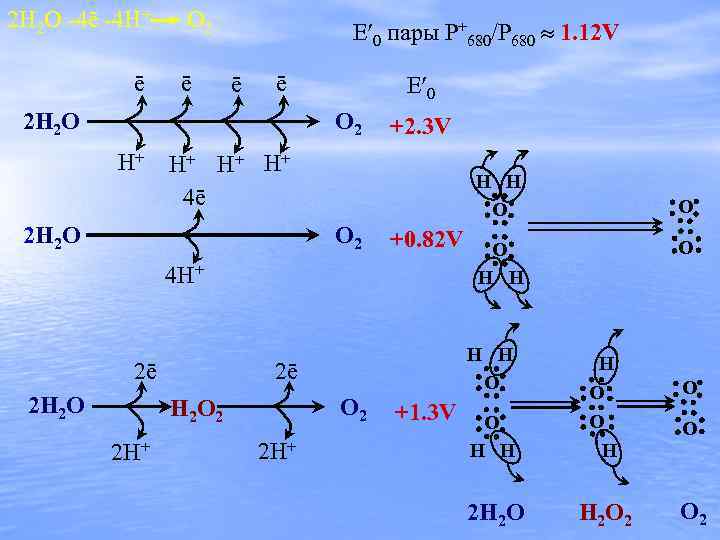 2 H 2 O -4ē -4 H+ O 2 ē ē E 0 пары P+680/P 680 1. 12 V ē ē 2 H 2 O E 0 O 2 H+ +2. 3 V H+ H+ H+ 4ē H H O O 2 2 H 2 O +0. 82 V 4 H+ 2 H 2 O O 2 H 2 O 2 2 H+ +1. 3 V O O H H O 2ē 2ē O O H H 2 H 2 O H O O H H 2 O 2 O O O 2
2 H 2 O -4ē -4 H+ O 2 ē ē E 0 пары P+680/P 680 1. 12 V ē ē 2 H 2 O E 0 O 2 H+ +2. 3 V H+ H+ H+ 4ē H H O O 2 2 H 2 O +0. 82 V 4 H+ 2 H 2 O O 2 H 2 O 2 2 H+ +1. 3 V O O H H O 2ē 2ē O O H H 2 H 2 O H O O H H 2 O 2 O O O 2
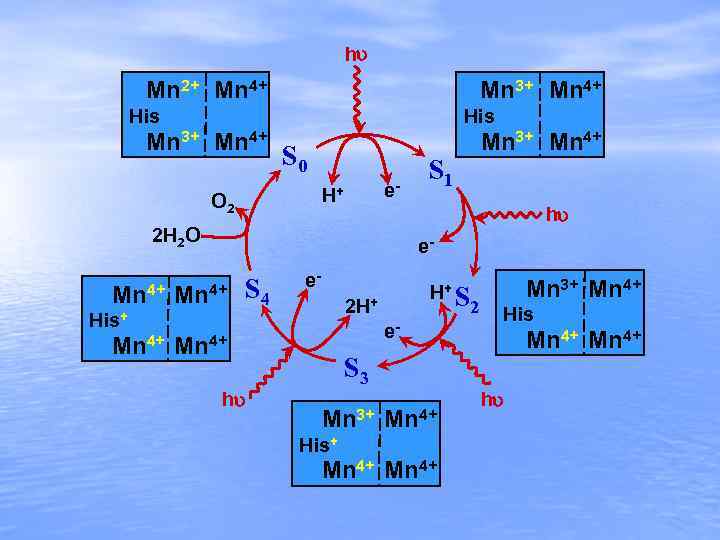 h Mn 2+ Mn 4+ Mn 3+ Mn 4+ His Mn 3+ Mn 4+ S 0 e- H+ O 2 S 1 h 2 H 2 O Mn 4+ Mn 3+ Mn 4+ e- Mn 4+ S 4 e 2 H+ His+ e- Mn 4+ h H+ S 2 Mn 3+ Mn 4+ His Mn 4+ S 3 Mn 3+ Mn 4+ His+ Mn 4+ h
h Mn 2+ Mn 4+ Mn 3+ Mn 4+ His Mn 3+ Mn 4+ S 0 e- H+ O 2 S 1 h 2 H 2 O Mn 4+ Mn 3+ Mn 4+ e- Mn 4+ S 4 e 2 H+ His+ e- Mn 4+ h H+ S 2 Mn 3+ Mn 4+ His Mn 4+ S 3 Mn 3+ Mn 4+ His+ Mn 4+ h
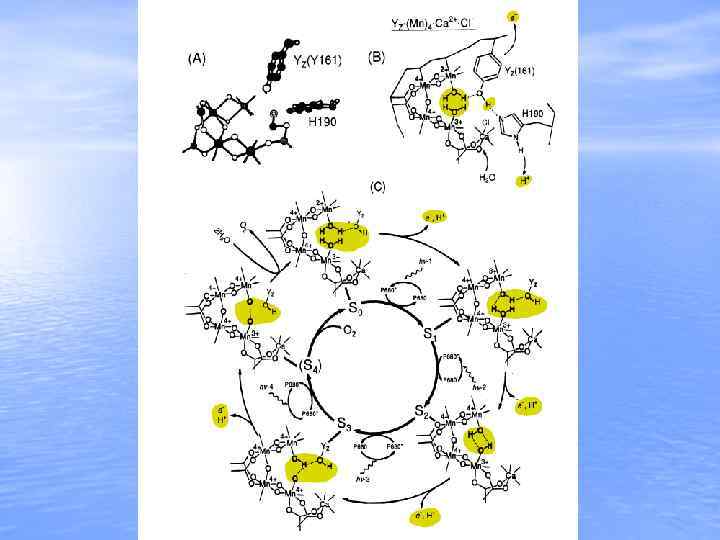
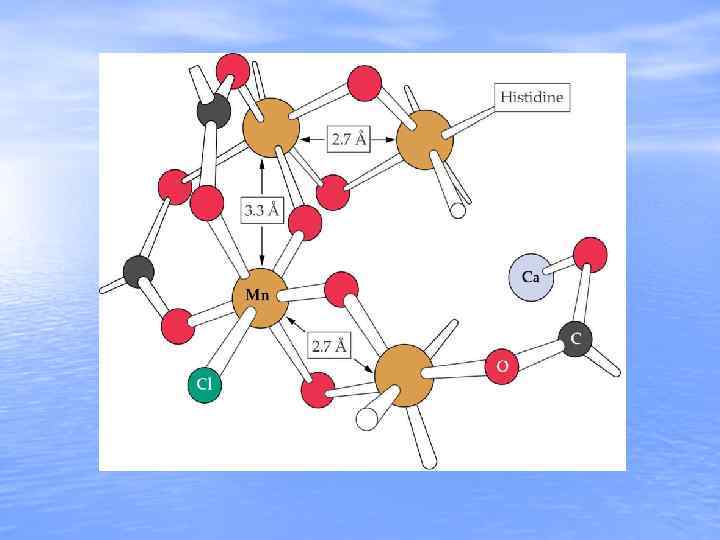
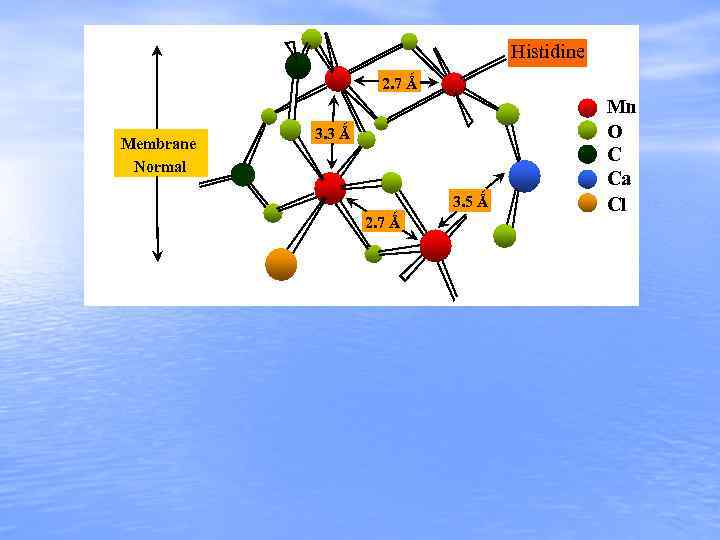 Histidine 2. 7 Ǻ Membrane Normal 3. 3 Ǻ 3. 5 Ǻ 2. 7 Ǻ Mn O C Ca Cl
Histidine 2. 7 Ǻ Membrane Normal 3. 3 Ǻ 3. 5 Ǻ 2. 7 Ǻ Mn O C Ca Cl
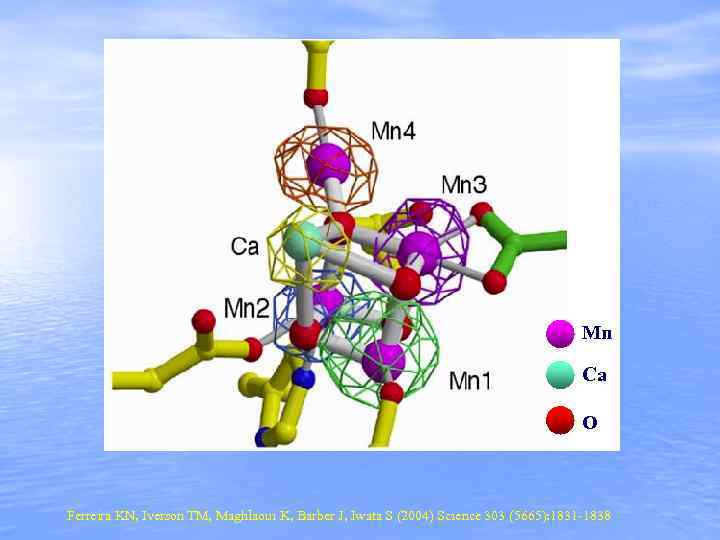 Mn Ca O Ferreira KN, Iverson TM, Maghlaoui K, Barber J, Iwata S (2004) Science 303 (5665): 1831 -1838
Mn Ca O Ferreira KN, Iverson TM, Maghlaoui K, Barber J, Iwata S (2004) Science 303 (5665): 1831 -1838
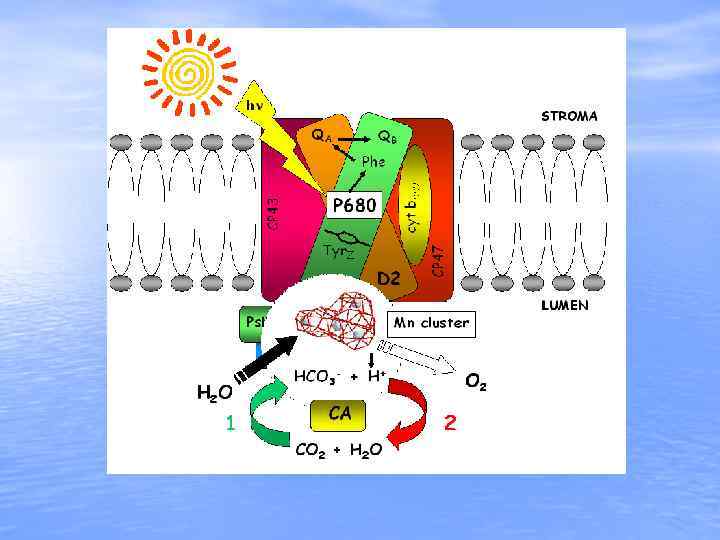
 Фотоэнергетические реакции хлоропластов
Фотоэнергетические реакции хлоропластов
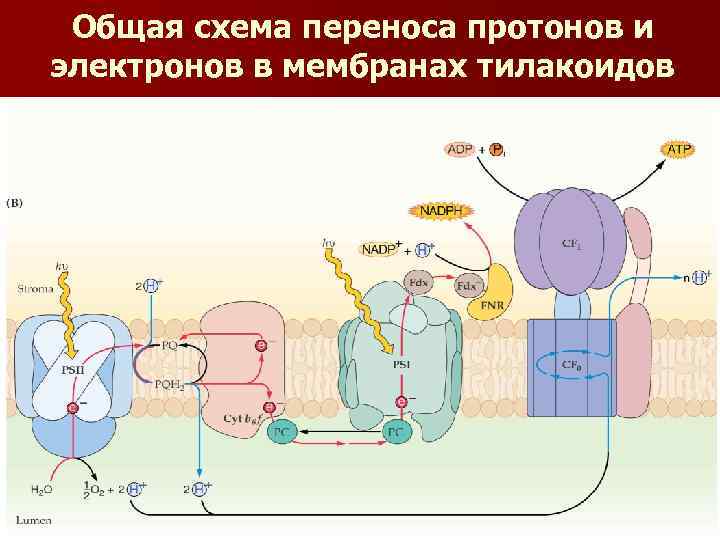 Общая схема переноса протонов и электронов в мембранах тилакоидов
Общая схема переноса протонов и электронов в мембранах тилакоидов
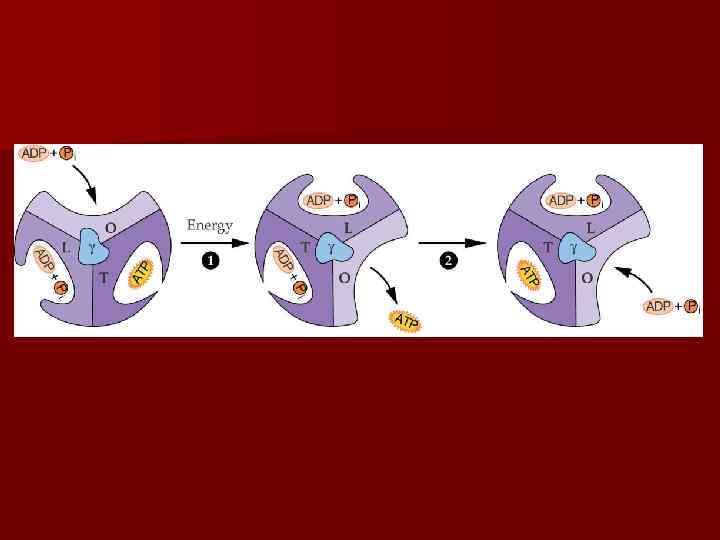
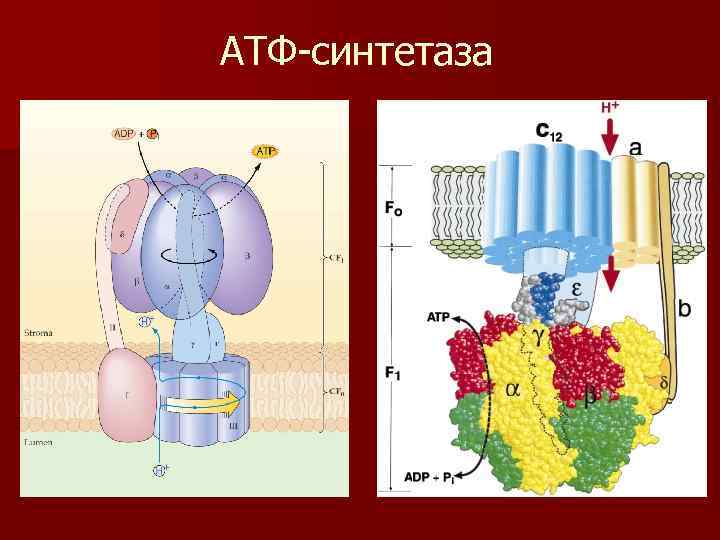 АТФ-синтетаза
АТФ-синтетаза

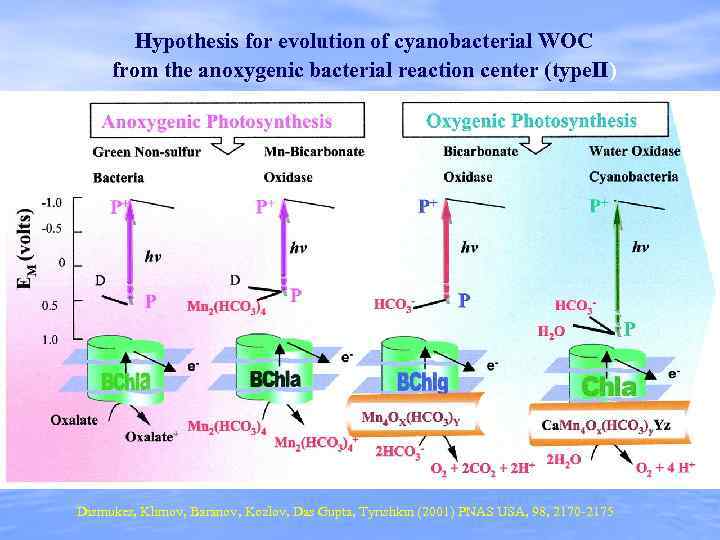 Hypothesis for evolution of cyanobacterial WOC from the anoxygenic bacterial reaction center (type. II) Dismukes, Klimov, Baranov, Kozlov, Das Gupta, Tyrishkin (2001) PNAS USA, 98, 2170 -2175
Hypothesis for evolution of cyanobacterial WOC from the anoxygenic bacterial reaction center (type. II) Dismukes, Klimov, Baranov, Kozlov, Das Gupta, Tyrishkin (2001) PNAS USA, 98, 2170 -2175
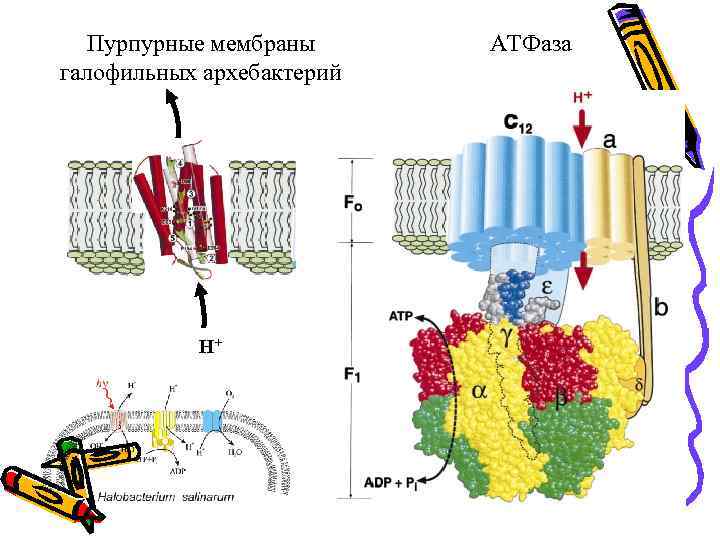 Пурпурные мембраны галофильных архебактерий H+ АТФаза
Пурпурные мембраны галофильных архебактерий H+ АТФаза
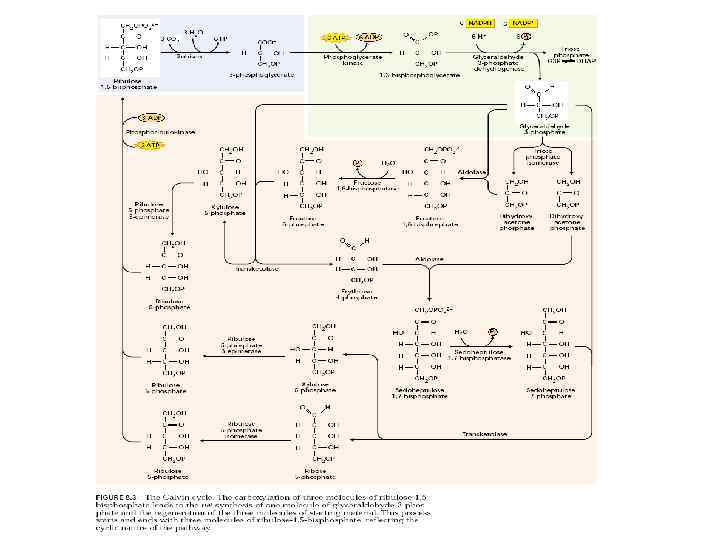
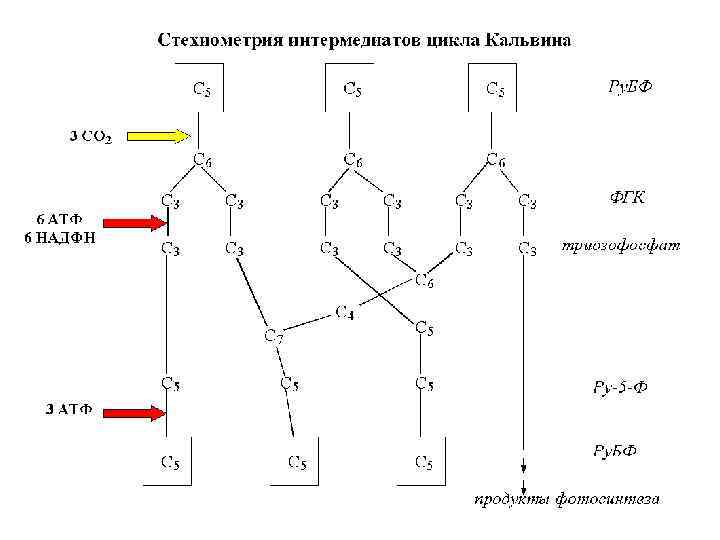
 Фотосинтетический метаболизм углерода (ВПФЦ, цикл Кальвина-Бенсона)
Фотосинтетический метаболизм углерода (ВПФЦ, цикл Кальвина-Бенсона)

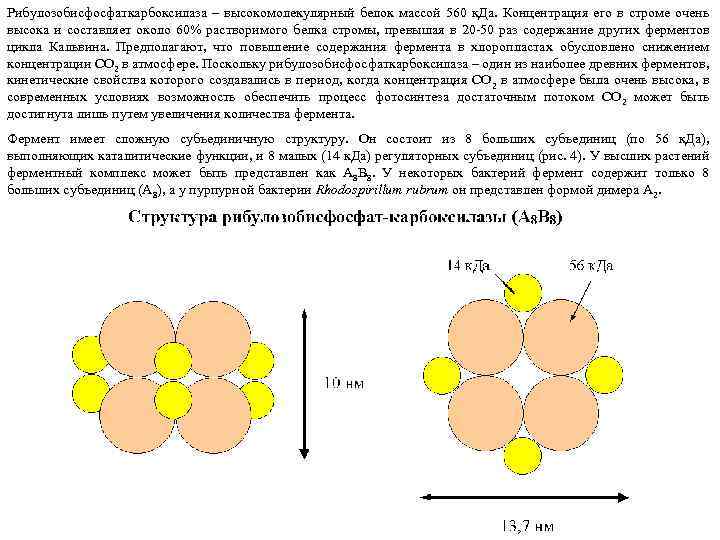 Рибулозобисфосфаткарбоксилаза – высокомолекулярный белок массой 560 к. Да. Концентрация его в строме очень высока и составляет около 60% растворимого белка стромы, превышая в 20 -50 раз содержание других ферментов цикла Кальвина. Предполагают, что повышение содержания фермента в хлоропластах обусловлено снижением концентрации СО 2 в атмосфере. Поскольку рибулозобисфосфаткарбоксилаза – один из наиболее древних ферментов, кинетические свойства которого создавались в период, когда концентрация СО 2 в атмосфере была очень высока, в современных условиях возможность обеспечить процесс фотосинтеза достаточным потоком СО 2 может быть достигнута лишь путем увеличения количества фермента. Фермент имеет сложную субъединичную структуру. Он состоит из 8 больших субъединиц (по 56 к. Да), выполняющих каталитические функции, и 8 малых (14 к. Да) регуляторных субъединиц (рис. 4). У высших растений ферментный комплекс может быть представлен как A 8 B 8. У некоторых бактерий фермент содержит только 8 больших субъединиц (А 8), а у пурпурной бактерии Rhodospirillum rubrum он представлен формой димера А 2.
Рибулозобисфосфаткарбоксилаза – высокомолекулярный белок массой 560 к. Да. Концентрация его в строме очень высока и составляет около 60% растворимого белка стромы, превышая в 20 -50 раз содержание других ферментов цикла Кальвина. Предполагают, что повышение содержания фермента в хлоропластах обусловлено снижением концентрации СО 2 в атмосфере. Поскольку рибулозобисфосфаткарбоксилаза – один из наиболее древних ферментов, кинетические свойства которого создавались в период, когда концентрация СО 2 в атмосфере была очень высока, в современных условиях возможность обеспечить процесс фотосинтеза достаточным потоком СО 2 может быть достигнута лишь путем увеличения количества фермента. Фермент имеет сложную субъединичную структуру. Он состоит из 8 больших субъединиц (по 56 к. Да), выполняющих каталитические функции, и 8 малых (14 к. Да) регуляторных субъединиц (рис. 4). У высших растений ферментный комплекс может быть представлен как A 8 B 8. У некоторых бактерий фермент содержит только 8 больших субъединиц (А 8), а у пурпурной бактерии Rhodospirillum rubrum он представлен формой димера А 2.
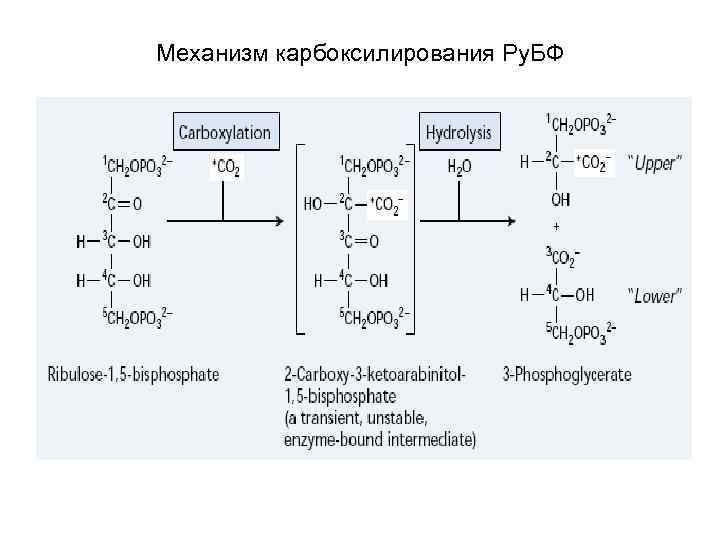 Механизм карбоксилирования Ру. БФ
Механизм карбоксилирования Ру. БФ
 Активация светозависимых ферментов регулирует цикл Кальвина
Активация светозависимых ферментов регулирует цикл Кальвина
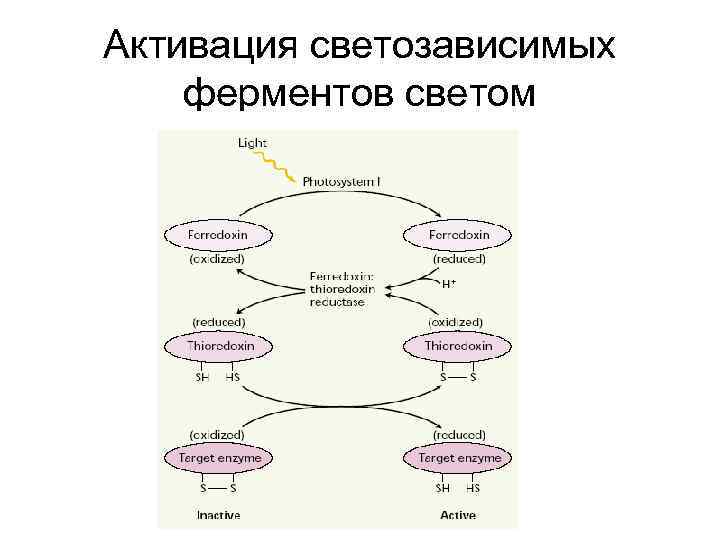 Активация светозависимых ферментов светом
Активация светозависимых ферментов светом
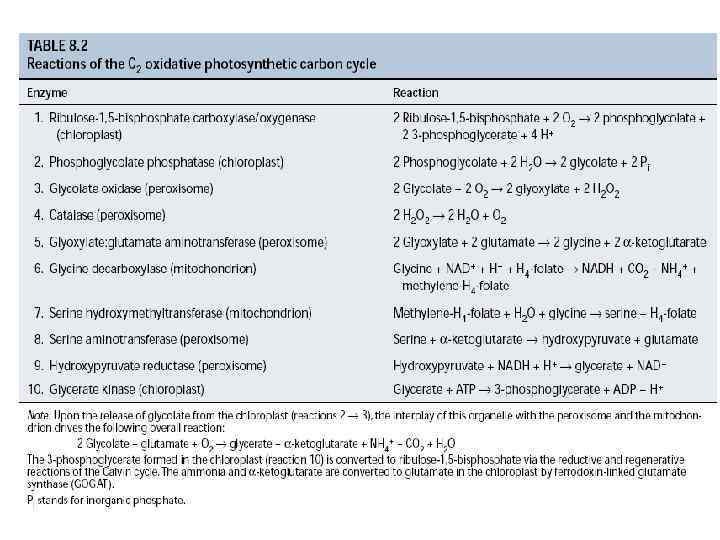
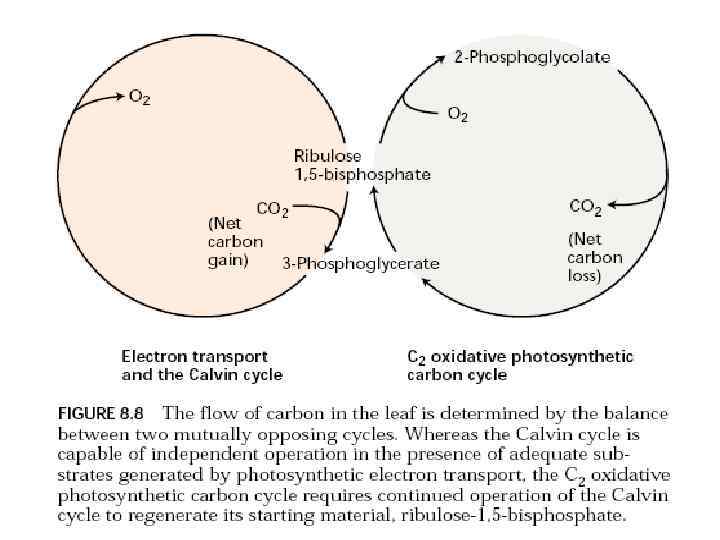
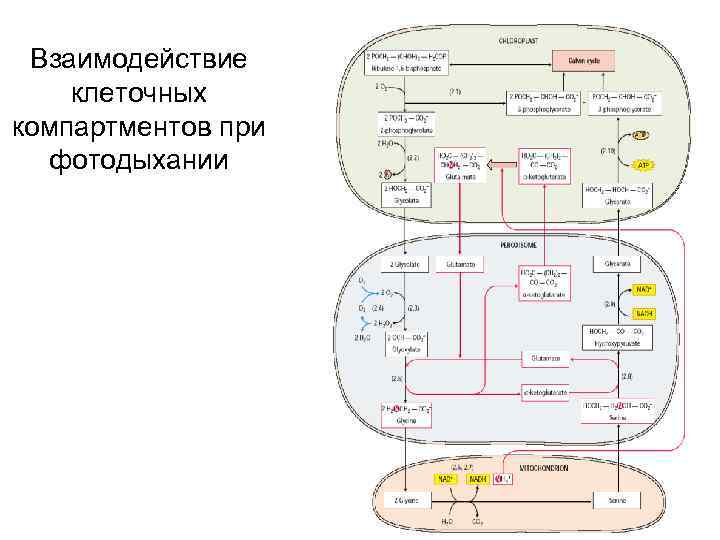 Взаимодействие клеточных компартментов при фотодыхании
Взаимодействие клеточных компартментов при фотодыхании

 Метаболизм углерода при фотосинтезе Фотодыхание С-4 САМ
Метаболизм углерода при фотосинтезе Фотодыхание С-4 САМ
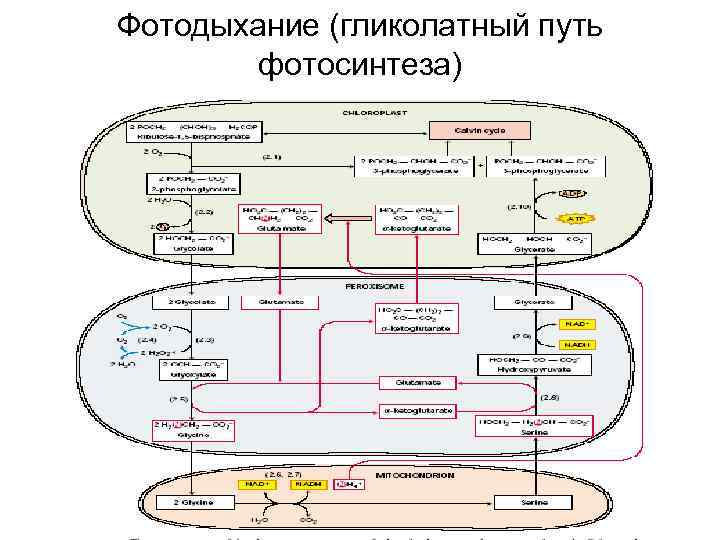 Фотодыхание (гликолатный путь фотосинтеза)
Фотодыхание (гликолатный путь фотосинтеза)
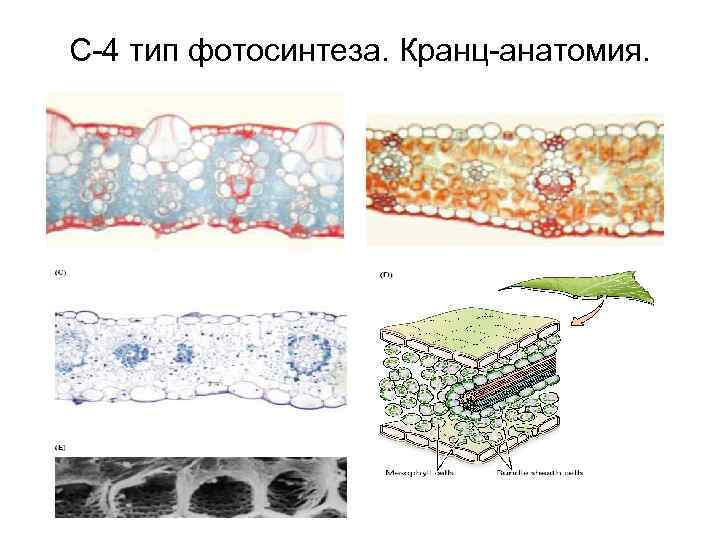 С-4 тип фотосинтеза. Кранц-анатомия.
С-4 тип фотосинтеза. Кранц-анатомия.
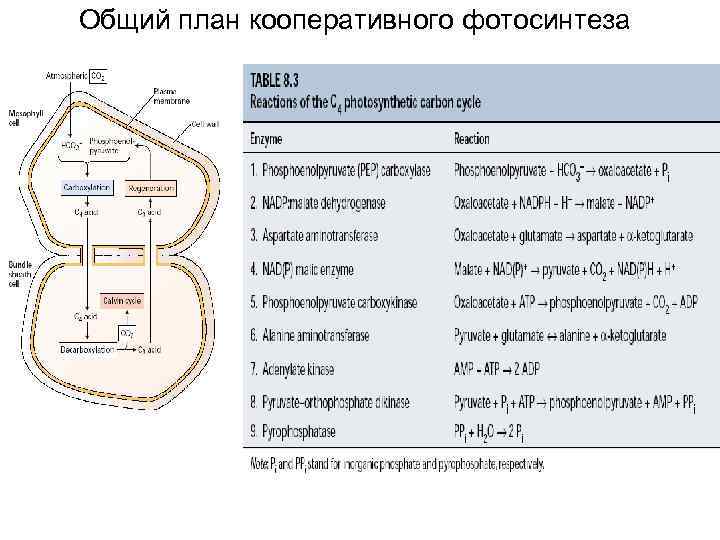 Общий план кооперативного фотосинтеза
Общий план кооперативного фотосинтеза
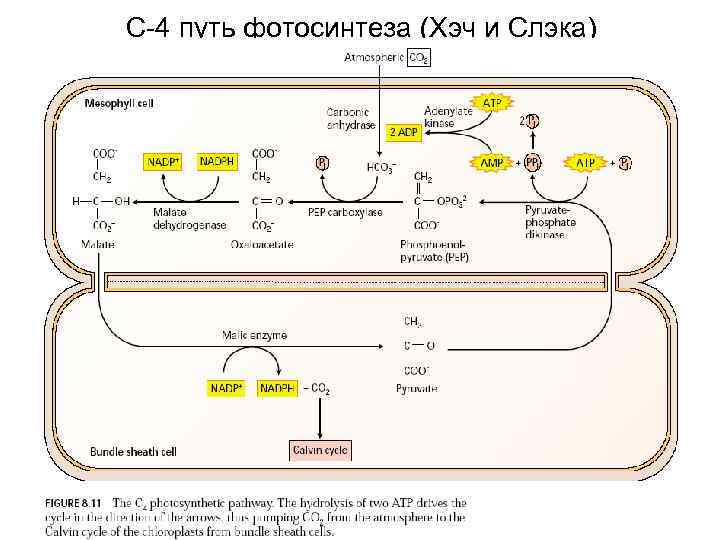 С-4 путь фотосинтеза (Хэч и Слэка)
С-4 путь фотосинтеза (Хэч и Слэка)

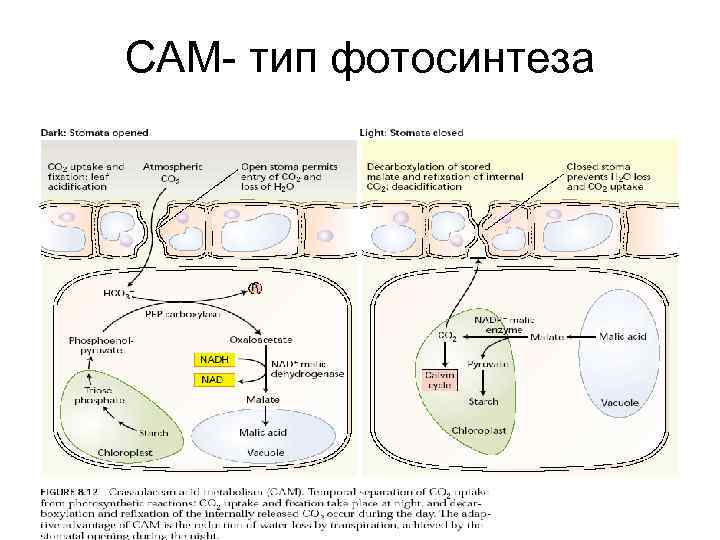 САМ- тип фотосинтеза
САМ- тип фотосинтеза
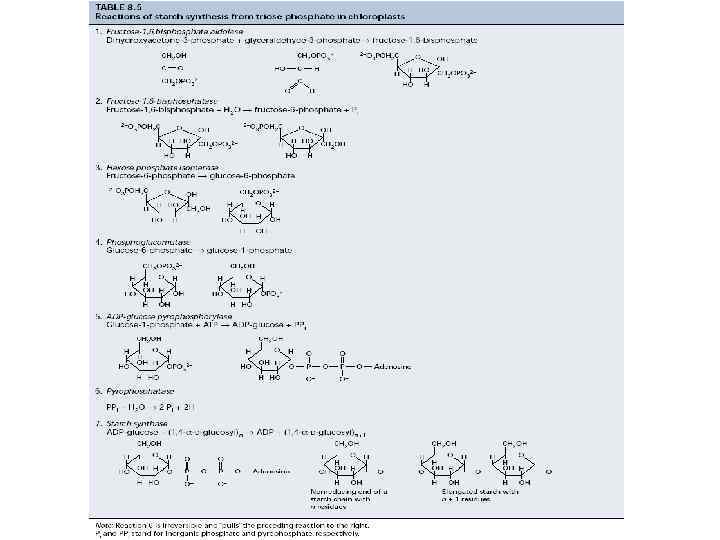
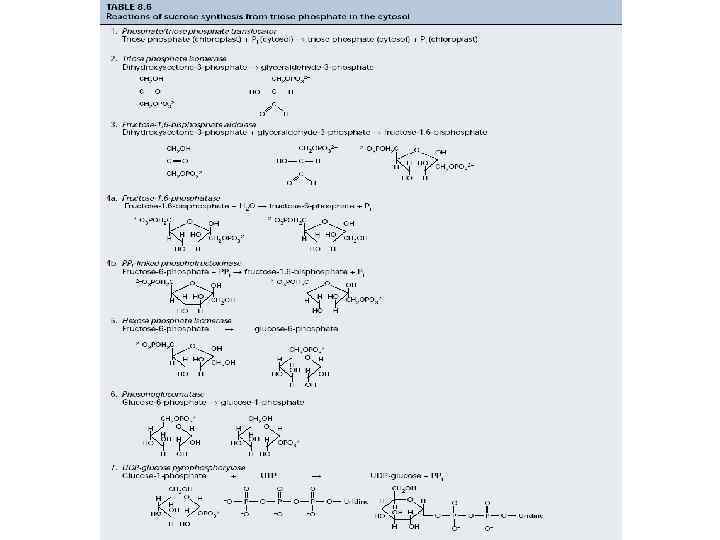
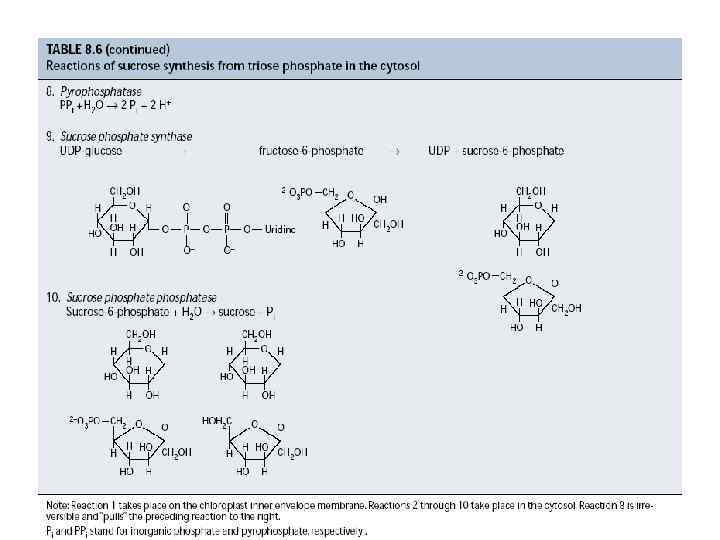
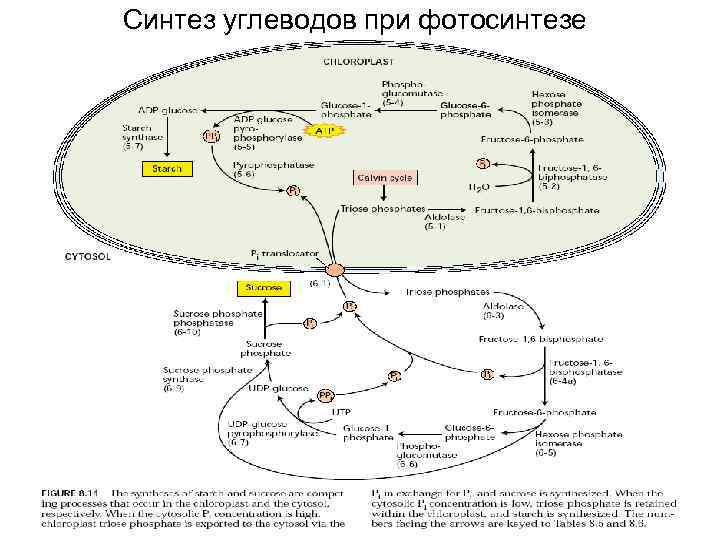 Синтез углеводов при фотосинтезе
Синтез углеводов при фотосинтезе
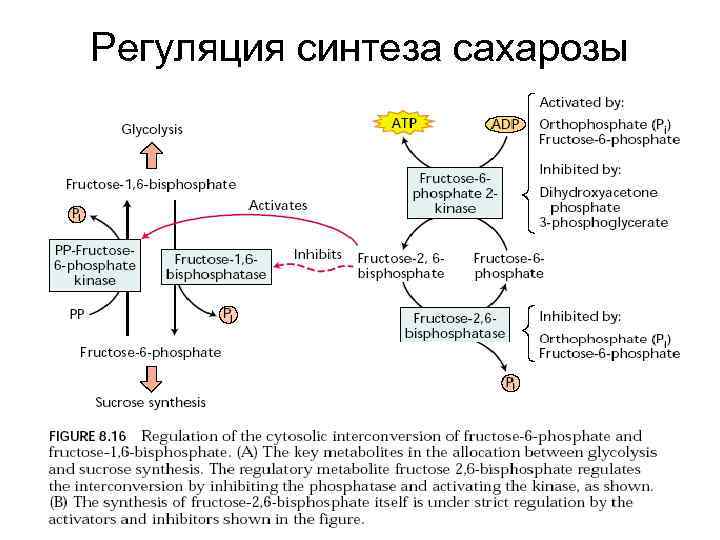 Регуляция синтеза сахарозы
Регуляция синтеза сахарозы
 Экология фотосинтеза
Экология фотосинтеза
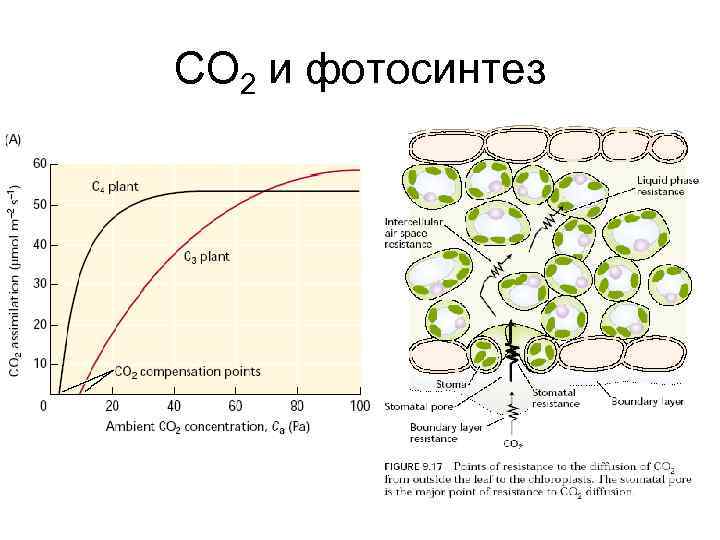 СО 2 и фотосинтез
СО 2 и фотосинтез
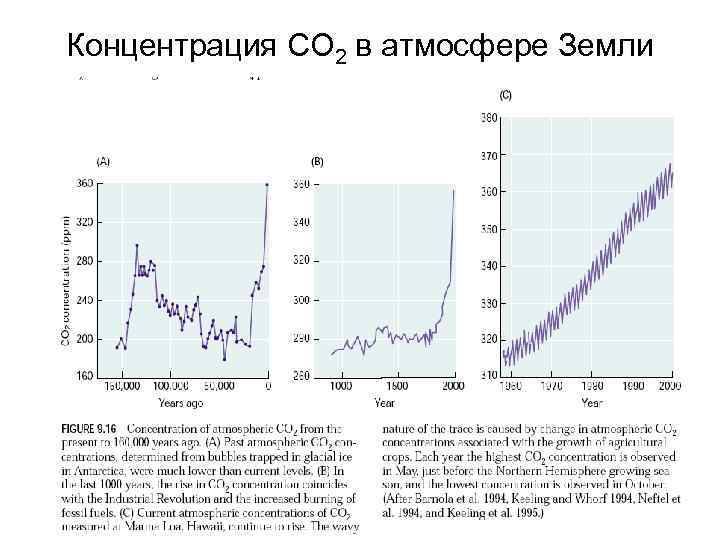 Концентрация СО 2 в атмосфере Земли
Концентрация СО 2 в атмосфере Земли
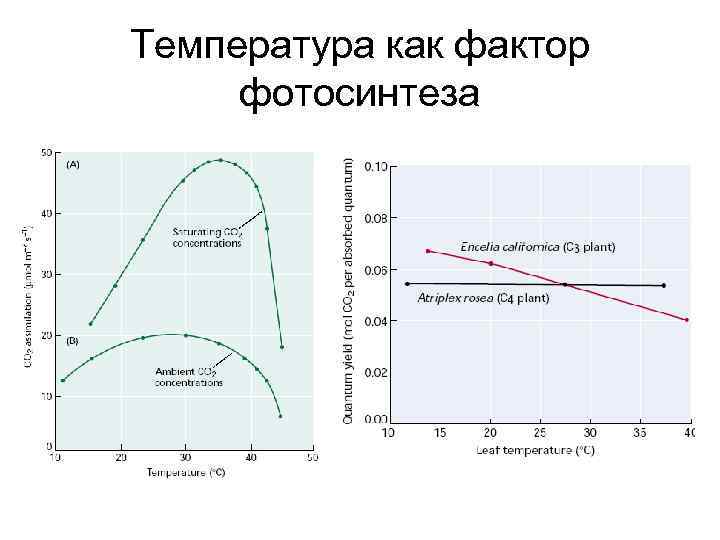 Температура как фактор фотосинтеза
Температура как фактор фотосинтеза
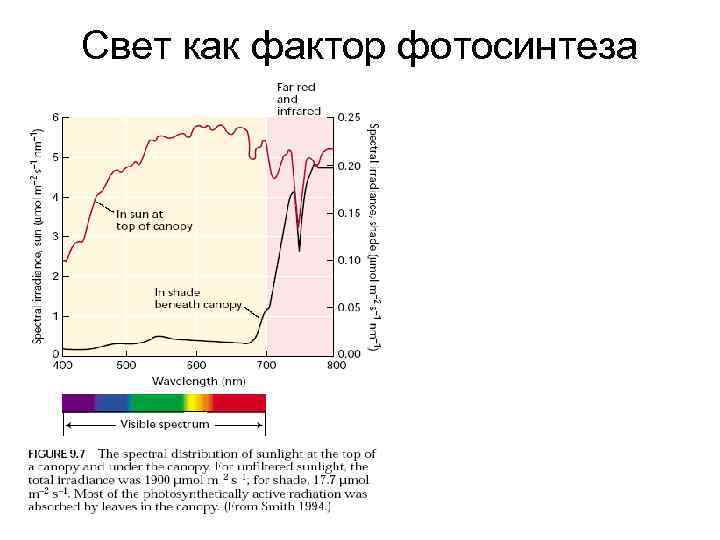 Свет как фактор фотосинтеза
Свет как фактор фотосинтеза
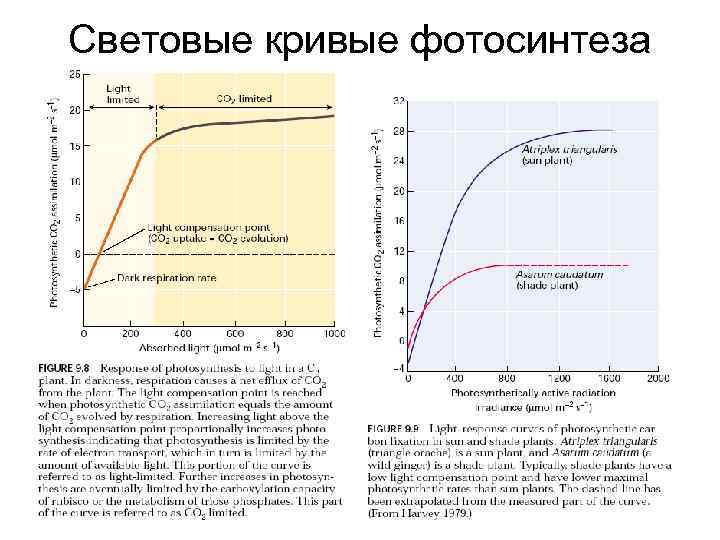 Световые кривые фотосинтеза
Световые кривые фотосинтеза
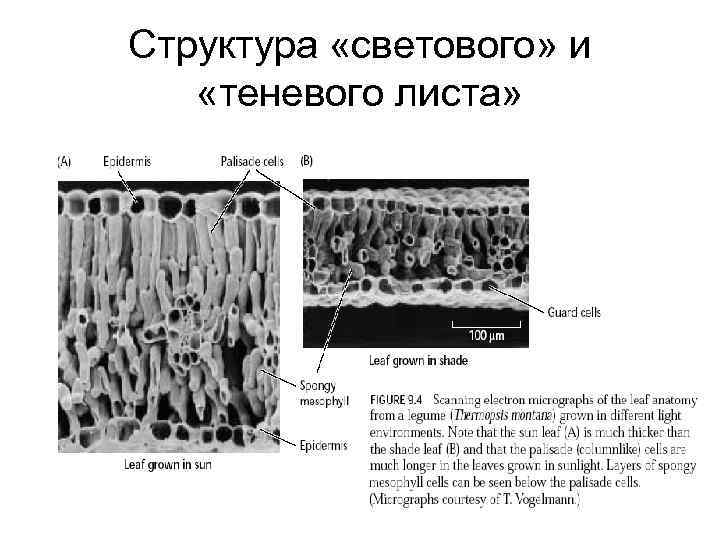 Структура «светового» и «теневого листа»
Структура «светового» и «теневого листа»
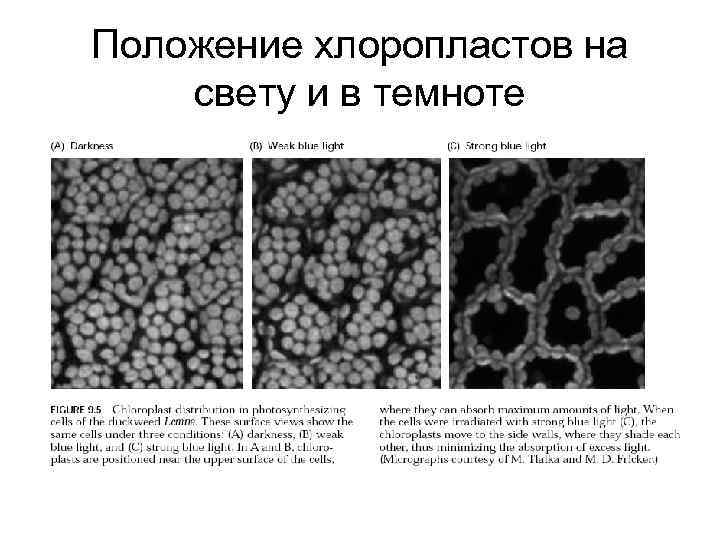 Положение хлоропластов на свету и в темноте
Положение хлоропластов на свету и в темноте
 Ориентация листьев по отношению к свету
Ориентация листьев по отношению к свету
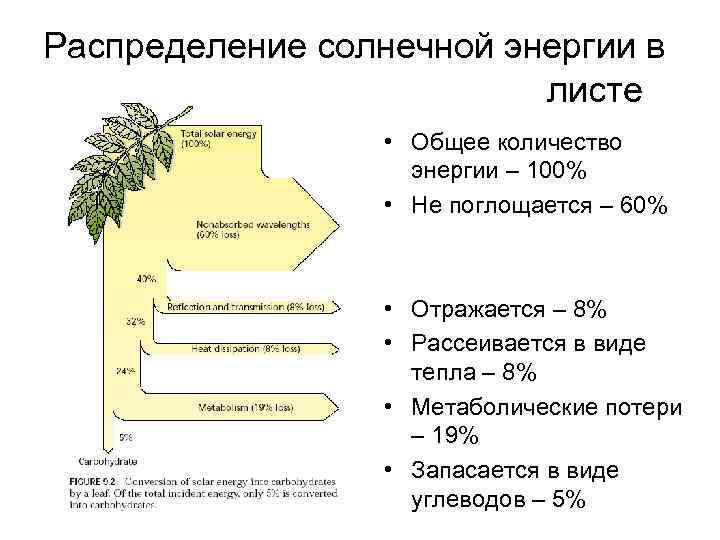 Распределение солнечной энергии в листе • Общее количество энергии – 100% • Не поглощается – 60% • Отражается – 8% • Рассеивается в виде тепла – 8% • Метаболические потери – 19% • Запасается в виде углеводов – 5%
Распределение солнечной энергии в листе • Общее количество энергии – 100% • Не поглощается – 60% • Отражается – 8% • Рассеивается в виде тепла – 8% • Метаболические потери – 19% • Запасается в виде углеводов – 5%