Фосфор и мышьяк.ppt
- Количество слайдов: 37
 Фосфор, Мышьяк I. История открытия II. Химический элемент 1. Положение в периодической системе химических элементов. Строение атома. 2. Нахождение в природе. III. Простое вещество 1. Аллотропные модификации. 2. Получение. 3. Химические свойства. 4. Применение.
Фосфор, Мышьяк I. История открытия II. Химический элемент 1. Положение в периодической системе химических элементов. Строение атома. 2. Нахождение в природе. III. Простое вещество 1. Аллотропные модификации. 2. Получение. 3. Химические свойства. 4. Применение.
 Фосфор был открыт гамбургским алхимиком Xеннингом Брандом в 1669 г. Позже А. Лавуазье доказал, что фосфор самостоятельный химический элемент. Ж. Пруст и М. Клапорт установили его широкое распространение в земной коре, в основном в виде фосфата кальция.
Фосфор был открыт гамбургским алхимиком Xеннингом Брандом в 1669 г. Позже А. Лавуазье доказал, что фосфор самостоятельный химический элемент. Ж. Пруст и М. Клапорт установили его широкое распространение в земной коре, в основном в виде фосфата кальция.
 Открытие способа получения металлического мышьяка приписывают знаменитому средневековому алхимику Альберту Великому, жившему в XIII в. В 1789 г. А. Л. Лавуазье признал мышьяк самостоятельным элементом и присвоил ему название «арсеникум» .
Открытие способа получения металлического мышьяка приписывают знаменитому средневековому алхимику Альберту Великому, жившему в XIII в. В 1789 г. А. Л. Лавуазье признал мышьяк самостоятельным элементом и присвоил ему название «арсеникум» .
 Положение в периодической системе химических элементов. Строение атома.
Положение в периодической системе химических элементов. Строение атома.
 Положение фосфора в ПСХЭ Д. И. Менделеева. Строение атома. порядковый номер период группа Р +15 неметалл 3 VA 2 8 5 3 p 3 3 s 2 1 s 22 p 63 s 23 p 3 2 s 2 1 s 2 3 d 0 валентные электроны 2 p 6
Положение фосфора в ПСХЭ Д. И. Менделеева. Строение атома. порядковый номер период группа Р +15 неметалл 3 VA 2 8 5 3 p 3 3 s 2 1 s 22 p 63 s 23 p 3 2 s 2 1 s 2 3 d 0 валентные электроны 2 p 6
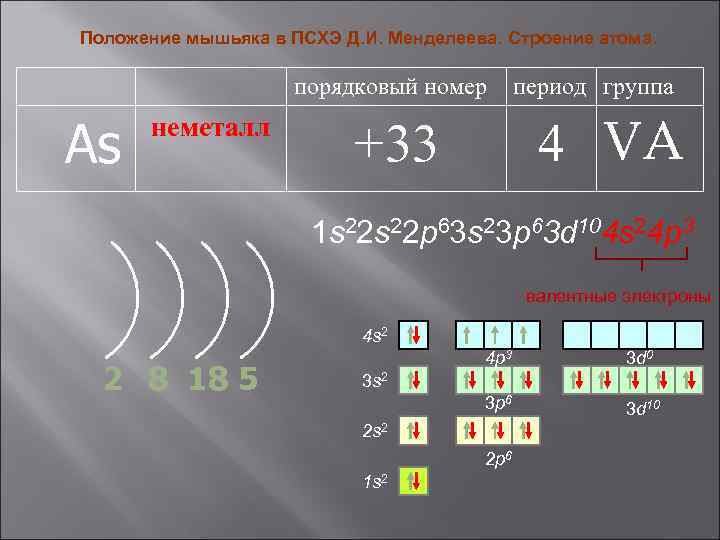 Положение мышьяка в ПСХЭ Д. И. Менделеева. Строение атома. порядковый номер As неметалл период группа 4 VA +33 1 s 22 p 63 s 23 p 63 d 104 s 24 p 3 валентные электроны 4 s 2 2 8 18 5 4 p 3 3 d 0 3 p 6 3 d 10 3 s 2 2 p 6 1 s 2
Положение мышьяка в ПСХЭ Д. И. Менделеева. Строение атома. порядковый номер As неметалл период группа 4 VA +33 1 s 22 p 63 s 23 p 63 d 104 s 24 p 3 валентные электроны 4 s 2 2 8 18 5 4 p 3 3 d 0 3 p 6 3 d 10 3 s 2 2 p 6 1 s 2
 Нахождение в природе.
Нахождение в природе.
 Нахождение в природе Содержание фосфора в земной коре составляет 0, 093%. В природе фосфор встречается только в виде соединений, главным образом апатитов, фосфоритов.
Нахождение в природе Содержание фосфора в земной коре составляет 0, 093%. В природе фосфор встречается только в виде соединений, главным образом апатитов, фосфоритов.
 Мышьяк — рассеянный элемент. Содержание в земной коре 1, 7× 10− 4% по массе. В морской воде 0, 003 мг/л. Это вещество может встречаться в самородном состоянии, имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из маленьких зернышек. Известно около 200 мышьяксодержащих минералов. Лёллингит Скородит
Мышьяк — рассеянный элемент. Содержание в земной коре 1, 7× 10− 4% по массе. В морской воде 0, 003 мг/л. Это вещество может встречаться в самородном состоянии, имеет вид металлически блестящих серых скорлупок или плотных масс, состоящих из маленьких зернышек. Известно около 200 мышьяксодержащих минералов. Лёллингит Скородит
 Аллотропные модификации.
Аллотропные модификации.
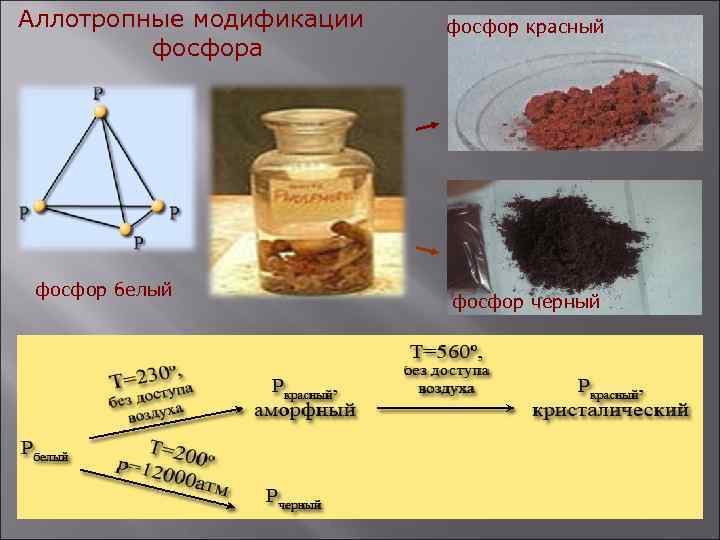 Аллотропные модификации фосфора фосфор белый фосфор красный фосфор черный
Аллотропные модификации фосфора фосфор белый фосфор красный фосфор черный
 Белый фосфор - твердое кристаллическое вещество, плотность его 1, 82 г/см 3. На воздухе самовоспламеняется, в темноте светится. Получают быстрым охлаждением паров фосфора. Очень ядовит. Красный фосфор - порошок темно-красного цвета, плотность его 2, 2 г/см 3. Получают длительным нагреванием белого фосфора без доступа воздуха при температуре 250 -300°С. По своим свойствам отличается от белого, не ядовит. Черный фосфор - твердое вещество, плотность его 2, 7 г/см 3. Образуется при нагревании белого фосфора при температуре 200 °С под высоким давлением. Используется в производстве спичек, снарядов и т. д.
Белый фосфор - твердое кристаллическое вещество, плотность его 1, 82 г/см 3. На воздухе самовоспламеняется, в темноте светится. Получают быстрым охлаждением паров фосфора. Очень ядовит. Красный фосфор - порошок темно-красного цвета, плотность его 2, 2 г/см 3. Получают длительным нагреванием белого фосфора без доступа воздуха при температуре 250 -300°С. По своим свойствам отличается от белого, не ядовит. Черный фосфор - твердое вещество, плотность его 2, 7 г/см 3. Образуется при нагревании белого фосфора при температуре 200 °С под высоким давлением. Используется в производстве спичек, снарядов и т. д.
 Аллотропные модификации мышьяка Металлический мышьяк Черный мышьяк Имеет 4 аллотропные модификациибелый, желтый, черный и металлический (или серый) мышьяк. Последние 2 обладают свойствами металлов.
Аллотропные модификации мышьяка Металлический мышьяк Черный мышьяк Имеет 4 аллотропные модификациибелый, желтый, черный и металлический (или серый) мышьяк. Последние 2 обладают свойствами металлов.
 Серый мышьяк - хрупкая серо-стальная кристаллическая масса с металлическим блеском, который на воздухе быстро пропадает из-за окисления поверхностного слоя. Черный мышьяк - самая устойчивая его форма - порошок черного цвета, как и большинство металлов, в мелкодисперсном (очень мелком, который может пройти через сито. ) состоянии (вспомните чернь серебра). В отличие от серой формы устойчива на воздухе, но при 2859 °С переходит в серую форму. Белый мышьяк - мышьяковистый ангидрид, As 2 O 3. Тверд. 1, 5; удельный вес 3, 69. Продукт разложения мышьяковист. минералов. Ядовит.
Серый мышьяк - хрупкая серо-стальная кристаллическая масса с металлическим блеском, который на воздухе быстро пропадает из-за окисления поверхностного слоя. Черный мышьяк - самая устойчивая его форма - порошок черного цвета, как и большинство металлов, в мелкодисперсном (очень мелком, который может пройти через сито. ) состоянии (вспомните чернь серебра). В отличие от серой формы устойчива на воздухе, но при 2859 °С переходит в серую форму. Белый мышьяк - мышьяковистый ангидрид, As 2 O 3. Тверд. 1, 5; удельный вес 3, 69. Продукт разложения мышьяковист. минералов. Ядовит.
 Получение.
Получение.
 Получение фосфора Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и песком при температуре 1500 °С Ca 3(PO 4)2 +3 Si. O 2 +5 C = 2 P +3 Ca. Si. O 3 +5 CO Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту: 4 HPO 3 + 12 C = 4 P +2 H 2+12 CO
Получение фосфора Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и песком при температуре 1500 °С Ca 3(PO 4)2 +3 Si. O 2 +5 C = 2 P +3 Ca. Si. O 3 +5 CO Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту: 4 HPO 3 + 12 C = 4 P +2 H 2+12 CO
 Получение мышьяка Мышьяк получают в промышленности нагреванием мышьякового колчедана: Fe. As. S = Fe. S + As
Получение мышьяка Мышьяк получают в промышленности нагреванием мышьякового колчедана: Fe. As. S = Fe. S + As
 Химические свойства.
Химические свойства.
 Химические свойства Р В соединениях Р обычно проявляет степень окисления +5, реже +3, -3 1. Реакция с кислородом: 4 P + 5 O 2 = 2 P 2 O 5 при недостатке кислорода : 4 P+3 O 2=2 P 2 O 3 2. С галогенами и серой: 2 P+3 Cl 2 = 2 PCl 3 P+ 5 S = P 2 S 5 Галогениды фосфора легко разлагаются водой: PCl 3+3 H 2 O = H 3 PO 3 + 3 HCl
Химические свойства Р В соединениях Р обычно проявляет степень окисления +5, реже +3, -3 1. Реакция с кислородом: 4 P + 5 O 2 = 2 P 2 O 5 при недостатке кислорода : 4 P+3 O 2=2 P 2 O 3 2. С галогенами и серой: 2 P+3 Cl 2 = 2 PCl 3 P+ 5 S = P 2 S 5 Галогениды фосфора легко разлагаются водой: PCl 3+3 H 2 O = H 3 PO 3 + 3 HCl
 3. С азотной кислотой: 3 Р+5 HNO 3+2 H 2 O = 3 H 3 PO 4 + 5 NO 4. С металлами образует фосфиды, в которых фосфор проявляет СО -3: 2 P+3 Mg= Mg 3 P 2 Фосфиды легко разлагаются водой: Mg 3 P 2+6 H 2 O = 3 Mg(OH)2+2 PH 3 (фосфин) 5. Со щелочью: 4 P+3 Na. OH +3 H 2 O = PH 3+3 Na. H 2 PO 4 Пример реакции диспропорционирования.
3. С азотной кислотой: 3 Р+5 HNO 3+2 H 2 O = 3 H 3 PO 4 + 5 NO 4. С металлами образует фосфиды, в которых фосфор проявляет СО -3: 2 P+3 Mg= Mg 3 P 2 Фосфиды легко разлагаются водой: Mg 3 P 2+6 H 2 O = 3 Mg(OH)2+2 PH 3 (фосфин) 5. Со щелочью: 4 P+3 Na. OH +3 H 2 O = PH 3+3 Na. H 2 PO 4 Пример реакции диспропорционирования.
 Оксид фосфора (V) Получение : 4 P + O 2 = 2 P 2 O 5 Химические свойства: 1) P 2 O 5+ H 2 O = 2 HPO 3 P 2 O 5 + 2 H 2 O = H 4 P 2 O 7 P 2 O 5 + 3 H 2 O = 2 H 3 PO 4 2) P 2 O 5 + 3 Ba. O = Ba 3(PO 4)2 3) P 2 O 5 + 6 Na. OH = 2 Na 3 PO 4 + 3 H 2 O P 2 O 5 +4 Na. OH = 2 Na 2 HPO 4 + H 2 O P 2 O 5 +2 Na. OH = 2 Na. H 2 PO 4
Оксид фосфора (V) Получение : 4 P + O 2 = 2 P 2 O 5 Химические свойства: 1) P 2 O 5+ H 2 O = 2 HPO 3 P 2 O 5 + 2 H 2 O = H 4 P 2 O 7 P 2 O 5 + 3 H 2 O = 2 H 3 PO 4 2) P 2 O 5 + 3 Ba. O = Ba 3(PO 4)2 3) P 2 O 5 + 6 Na. OH = 2 Na 3 PO 4 + 3 H 2 O P 2 O 5 +4 Na. OH = 2 Na 2 HPO 4 + H 2 O P 2 O 5 +2 Na. OH = 2 Na. H 2 PO 4
 Ортофосфорная кислота Получение: в лаб-и 3 Р+5 HNO 3+2 H 2 O =3 H 3 PO 4 + 5 NO в пром-ти Ca 3(PO 4)2 +3 Si. O 2 +5 C =2 P +3 Ca. Si. O 3+5 CO Химические свойства: 1) С металлами: 6 Na + 2 H 3 PO 4 = 2 Na 3 PO 4 + 3 H 2 2) С основными оксидами: 3 Сa. O +2 H 3 PO 4 = Ca 3(PO 4)2 + 3 H 2 O
Ортофосфорная кислота Получение: в лаб-и 3 Р+5 HNO 3+2 H 2 O =3 H 3 PO 4 + 5 NO в пром-ти Ca 3(PO 4)2 +3 Si. O 2 +5 C =2 P +3 Ca. Si. O 3+5 CO Химические свойства: 1) С металлами: 6 Na + 2 H 3 PO 4 = 2 Na 3 PO 4 + 3 H 2 2) С основными оксидами: 3 Сa. O +2 H 3 PO 4 = Ca 3(PO 4)2 + 3 H 2 O
 3) C основаниями и аммиаком: H 3 PO 4 + 3 Na. OH = Na 3 PO 4 + 3 H 2 O H 3 PO 4 + Na. OH = Na 2 HPO 4 + H 2 O H 3 PO 4 + Na. OH = Na. H 2 PO 4 + H 2 O H 3 PO 4 + 2 NH 3 = (NH 4)2 HPO 4 4) С солями слабых кислот: 2 H 3 PO 4 + 3 Na 2 CO 3 = 2 Na 3 PO 4 + 3 CO 2 + 3 H 2 O Специфические 1) 2 H 3 PO 4 = H 4 P 2 O 7 + H 2 O H 4 P 2 O 7= 2 HPO 3 + H 2 O 2) H 3 PO 4 + 3 Ag. NO 3 = Ag 3 PO 4 + 3 HNO 3
3) C основаниями и аммиаком: H 3 PO 4 + 3 Na. OH = Na 3 PO 4 + 3 H 2 O H 3 PO 4 + Na. OH = Na 2 HPO 4 + H 2 O H 3 PO 4 + Na. OH = Na. H 2 PO 4 + H 2 O H 3 PO 4 + 2 NH 3 = (NH 4)2 HPO 4 4) С солями слабых кислот: 2 H 3 PO 4 + 3 Na 2 CO 3 = 2 Na 3 PO 4 + 3 CO 2 + 3 H 2 O Специфические 1) 2 H 3 PO 4 = H 4 P 2 O 7 + H 2 O H 4 P 2 O 7= 2 HPO 3 + H 2 O 2) H 3 PO 4 + 3 Ag. NO 3 = Ag 3 PO 4 + 3 HNO 3
 Химические свойства: Мышьяк химически активен. В соединениях проявляет степень окисления - +5, +3, -3. 1) Реакция с кислородом: 4 As + 3 O 2 = 2 As 2 O 3 2) С галогенами: 2 As + 5 S = As 2 S 5 3) С азотной кислотой: 3 As + 5 HNO 3 +2 H 2 O = 3 H 3 As. O 4 + 5 NO
Химические свойства: Мышьяк химически активен. В соединениях проявляет степень окисления - +5, +3, -3. 1) Реакция с кислородом: 4 As + 3 O 2 = 2 As 2 O 3 2) С галогенами: 2 As + 5 S = As 2 S 5 3) С азотной кислотой: 3 As + 5 HNO 3 +2 H 2 O = 3 H 3 As. O 4 + 5 NO
 Белый мышьяк As 2 O 3 1) As 2 O 3 + 3 H 2 O = 2 H 3 As. O 3 2) As 2 O 3 + 8 HCl = 2 HAs. Cl 4 + 3 H 2 O As 2 O 5 + 3 H 2 O = 2 H 3 As. O 4 H 3 As арсин Mg 3 As 2 + 6 HCl = 3 Mg. Cl 2 + 2 H 3 As As 2 O 3 + 6 Zn +12 HCl = 2 H 3 As + 6 Zn. Cl 2 + 3 H 2 O
Белый мышьяк As 2 O 3 1) As 2 O 3 + 3 H 2 O = 2 H 3 As. O 3 2) As 2 O 3 + 8 HCl = 2 HAs. Cl 4 + 3 H 2 O As 2 O 5 + 3 H 2 O = 2 H 3 As. O 4 H 3 As арсин Mg 3 As 2 + 6 HCl = 3 Mg. Cl 2 + 2 H 3 As As 2 O 3 + 6 Zn +12 HCl = 2 H 3 As + 6 Zn. Cl 2 + 3 H 2 O
 Биологическая роль.
Биологическая роль.
 Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3 Са 3(РО 4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800— 1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3 Са 3(РО 4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800— 1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
 Мышьяк и все его соединения ядовиты. При остром отравлении мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. Мышьяк использывают в качестве смертельного яда. Мышьяк в малых дозах канцерогенен, его использование в качестве лекарства, «улучшающего кровь» (так называемый «белый мышьяк» ) продолжалось до середины 1950 -х гг. , и внесло свой весомый вклад в развитие онкологических заболеваний. Считалось, что «микродозы мышьяка, вводимые с осторожностью в растущий организм, способствуют росту костей человека и животных в длину и толщину» . Считалось также, что «При длительном потреблении небольших доз мышьяка у организма вырабатывается иммунитет: Этот факт установлен как для людей, так и для животных.
Мышьяк и все его соединения ядовиты. При остром отравлении мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. Мышьяк использывают в качестве смертельного яда. Мышьяк в малых дозах канцерогенен, его использование в качестве лекарства, «улучшающего кровь» (так называемый «белый мышьяк» ) продолжалось до середины 1950 -х гг. , и внесло свой весомый вклад в развитие онкологических заболеваний. Считалось, что «микродозы мышьяка, вводимые с осторожностью в растущий организм, способствуют росту костей человека и животных в длину и толщину» . Считалось также, что «При длительном потреблении небольших доз мышьяка у организма вырабатывается иммунитет: Этот факт установлен как для людей, так и для животных.
 Физические свойства.
Физические свойства.
 Физические свойства фосфора: ü ü ü ü Атомная масса – 30, 974 г/моль Радиус атома – 128 пм Структура решетки – кубическая. Активный неметалл Строение чёрного фосфора схоже со строением мышьяка. Плотность (при н. у. )- 1, 82 г/см³ (белый фосфор) Температура кипения = 553 K (Кельвин) Температура плавления = 317, 3 К (Кельвин)
Физические свойства фосфора: ü ü ü ü Атомная масса – 30, 974 г/моль Радиус атома – 128 пм Структура решетки – кубическая. Активный неметалл Строение чёрного фосфора схоже со строением мышьяка. Плотность (при н. у. )- 1, 82 г/см³ (белый фосфор) Температура кипения = 553 K (Кельвин) Температура плавления = 317, 3 К (Кельвин)
 Физические свойства мышьяка: ü ü ü ü Хрупкий полуметалл стального цвета. Атомная масса – 74, 922 г/моль Радиус атома – 139 пм Структура решетки – тригональная. Тугоплавкий Структура похожа на сурьму, а строение на чёрный фосфор. Плотность (при н. у. )- 5, 73 г/см³ (серый мышьяк) Температура кипения = 876 K (Кельвин)
Физические свойства мышьяка: ü ü ü ü Хрупкий полуметалл стального цвета. Атомная масса – 74, 922 г/моль Радиус атома – 139 пм Структура решетки – тригональная. Тугоплавкий Структура похожа на сурьму, а строение на чёрный фосфор. Плотность (при н. у. )- 5, 73 г/см³ (серый мышьяк) Температура кипения = 876 K (Кельвин)
 Применение.
Применение.
 Применение фосфора Белый фосфор применяется для получения красного фосфора Фосфор применяется для получения фосфорных кислот и их производных. Основная область применения красного фосфора – производство спичек Фосфор применяется как раскислитель и компонент некоторых металлических сплавов Производство лекарственных препаратов Средства борьбы с вредителями сельского хозяйства Производство моющих средств Органический синтез Р 2 О 5 как осушитель газов и жидкостей
Применение фосфора Белый фосфор применяется для получения красного фосфора Фосфор применяется для получения фосфорных кислот и их производных. Основная область применения красного фосфора – производство спичек Фосфор применяется как раскислитель и компонент некоторых металлических сплавов Производство лекарственных препаратов Средства борьбы с вредителями сельского хозяйства Производство моющих средств Органический синтез Р 2 О 5 как осушитель газов и жидкостей
 Применение мышьяка Используется для легирования сплавов свинца, идущих на приготовление дроби. Мышьяк чистоты 99, 9999 % используется для синтеза арсенидов и сложных алмазоподобных полупроводников. Сульфидные соединения мышьяка используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. Многие из мышьяковых соединений в очень малых дозах применяются в качестве лекарств для борьбы с малокровием и рядом тяжелых заболеваний. Мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство.
Применение мышьяка Используется для легирования сплавов свинца, идущих на приготовление дроби. Мышьяк чистоты 99, 9999 % используется для синтеза арсенидов и сложных алмазоподобных полупроводников. Сульфидные соединения мышьяка используются в живописи в качестве красок и в кожевенной отрасли промышленности в качестве средств для удаления волос с кожи. Многие из мышьяковых соединений в очень малых дозах применяются в качестве лекарств для борьбы с малокровием и рядом тяжелых заболеваний. Мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство.
 Мышьяк — стимулятор технического прогресса Самая перспективная область применения мышьяка - это полупроводниковая техника. Особое значение приобрели в ней арсениды галлия Ga. As и индия In. As. Арсенид галлия важен также для нового направления электронной техники — оптоэлектроники, оптики и электроники. Этот же материал помог создать первые полупроводниковые лазеры. Мышьяк как ценную присадку используют в цветной металлургии. Так, добавка к свинцу 0, 2—l%As значительно повышает его твердость. Дробь, например, всегда делают из свинца, легированного мышьяком — иначе не получить строго шарообразной формы дробинок. Добавка 0, 15— 0, 45% мышьяка в медь увеличивает ее прочность на разрыв, твердость и коррозионную стойкость при работе в загазованной среде. Кроме того, мышьяк увеличивает текучесть меди при литье, облегчает процесс волочения проволоки.
Мышьяк — стимулятор технического прогресса Самая перспективная область применения мышьяка - это полупроводниковая техника. Особое значение приобрели в ней арсениды галлия Ga. As и индия In. As. Арсенид галлия важен также для нового направления электронной техники — оптоэлектроники, оптики и электроники. Этот же материал помог создать первые полупроводниковые лазеры. Мышьяк как ценную присадку используют в цветной металлургии. Так, добавка к свинцу 0, 2—l%As значительно повышает его твердость. Дробь, например, всегда делают из свинца, легированного мышьяком — иначе не получить строго шарообразной формы дробинок. Добавка 0, 15— 0, 45% мышьяка в медь увеличивает ее прочность на разрыв, твердость и коррозионную стойкость при работе в загазованной среде. Кроме того, мышьяк увеличивает текучесть меди при литье, облегчает процесс волочения проволоки.
 Перспективны новые высококонцентрированные Ф. у. (полифосфаты аммония, метафосфаты калия), содержащие от 50 до 80% P 2 O 5. По эффективности они равноценны, а в ряде случаев превосходят стандартные формы Ф. у. Использование этих удобрений позволяет полностью механизировать их внесение, до минимума сократить потери, равномерно заделывать в почву, одновременно вносить микроэлементы и пестициды. Ф. у. увеличивают урожай и улучшают его качество, ускоряют созревание растений, повышают их устойчивость к полеганию и засухе. Положительное действие их особенно проявляется на фоне обеспечения растений азотом и калием, при глубокой заделке Ф. у. в почву.
Перспективны новые высококонцентрированные Ф. у. (полифосфаты аммония, метафосфаты калия), содержащие от 50 до 80% P 2 O 5. По эффективности они равноценны, а в ряде случаев превосходят стандартные формы Ф. у. Использование этих удобрений позволяет полностью механизировать их внесение, до минимума сократить потери, равномерно заделывать в почву, одновременно вносить микроэлементы и пестициды. Ф. у. увеличивают урожай и улучшают его качество, ускоряют созревание растений, повышают их устойчивость к полеганию и засухе. Положительное действие их особенно проявляется на фоне обеспечения растений азотом и калием, при глубокой заделке Ф. у. в почву.
 СПАСИБО ЗА ВНИМАНИЕ!!!
СПАСИБО ЗА ВНИМАНИЕ!!!


