2f7b6eed58b94fe5b31b861548dd4643.ppt
- Количество слайдов: 22
 “Фосфор … - элемент жизни и мысли”. А. Е. Ферсман Фосфор и его соединения Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
“Фосфор … - элемент жизни и мысли”. А. Е. Ферсман Фосфор и его соединения Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Фосфор в природе P (фосфор) в свободном состоянии не встречается. Минералы: ü Фосфориты Са 3(РО 4)2 ü Апатиты: фторапатит Са 3(РО 4)2 ·Са. F 2 хлорапатит Са 3(РО 4)2 ·Са. Cl 2 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Фосфор в природе P (фосфор) в свободном состоянии не встречается. Минералы: ü Фосфориты Са 3(РО 4)2 ü Апатиты: фторапатит Са 3(РО 4)2 ·Са. F 2 хлорапатит Са 3(РО 4)2 ·Са. Cl 2 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
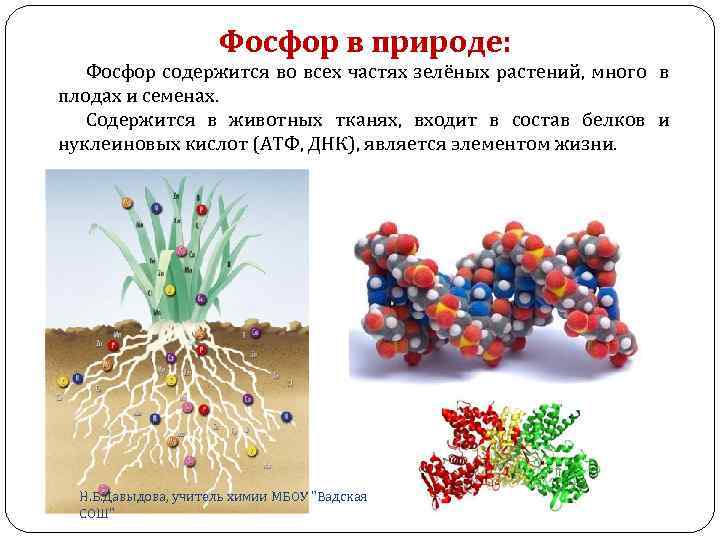 Фосфор в природе: Фосфор содержится во всех частях зелёных растений, много в плодах и семенах. Содержится в животных тканях, входит в состав белков и нуклеиновых кислот (АТФ, ДНК), является элементом жизни. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Фосфор в природе: Фосфор содержится во всех частях зелёных растений, много в плодах и семенах. Содержится в животных тканях, входит в состав белков и нуклеиновых кислот (АТФ, ДНК), является элементом жизни. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
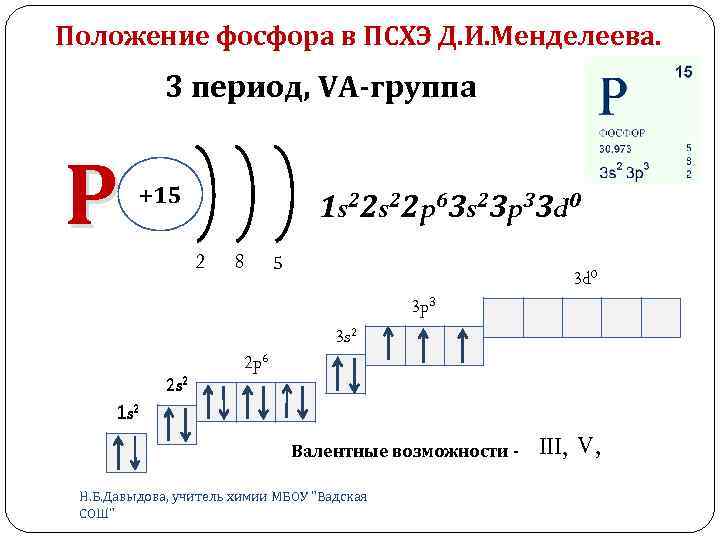 Положение фосфора в ПСХЭ Д. И. Менделеева. 3 период, VА-группа Р +15 1 s 22 p 63 s 23 p 33 d 0 2 8 5 3 d 0 3 p 3 3 s 2 2 p 6 1 s 2 Валентные возможности Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ" III, V,
Положение фосфора в ПСХЭ Д. И. Менделеева. 3 период, VА-группа Р +15 1 s 22 p 63 s 23 p 33 d 0 2 8 5 3 d 0 3 p 3 3 s 2 2 p 6 1 s 2 Валентные возможности Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ" III, V,
 Положение фосфора в ПСХЭ Д. И. Менделеева. 5 валентных электронов Степени окисления: -3, 0, +3, +5 Образует: Р 2 О 5 – высший оксид (кислотный) РН 3 – летучее водородное соединение Окислительно-восстановительные свойства Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Положение фосфора в ПСХЭ Д. И. Менделеева. 5 валентных электронов Степени окисления: -3, 0, +3, +5 Образует: Р 2 О 5 – высший оксид (кислотный) РН 3 – летучее водородное соединение Окислительно-восстановительные свойства Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
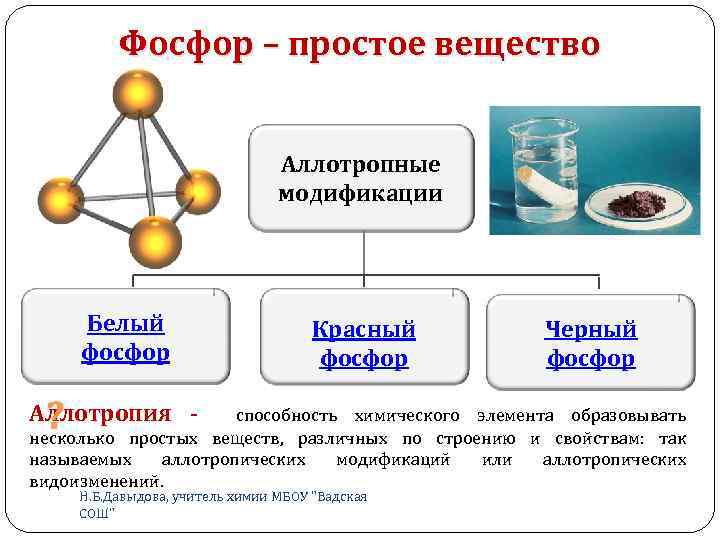 Фосфор – простое вещество Аллотропные модификации Белый фосфор Черный фосфор Красный фосфор способность химического элемента образовывать ? несколько простых веществ, различных по строению и свойствам: так Аллотропия - называемых аллотропических видоизменений. модификаций Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ" или аллотропических
Фосфор – простое вещество Аллотропные модификации Белый фосфор Черный фосфор Красный фосфор способность химического элемента образовывать ? несколько простых веществ, различных по строению и свойствам: так Аллотропия - называемых аллотропических видоизменений. модификаций Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ" или аллотропических
 Химические свойства фосфора окислитель восстановитель 0 -3 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ" +3 +5
Химические свойства фосфора окислитель восстановитель 0 -3 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ" +3 +5
 I. Окислительные свойства фосфора (с. о. – 3): 1) Взаимодействие с металлами 3 Ca 0 + 2 P 0 → Ca 3+2 P 2 -3 в-ль о-ль фосфид кальция Опыт. "Получение фосфида кальция" Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина PH 3 Mg 3 P 2 + 6 H 2 O → 3 Mg(OH)2 + 2 PH 3↑ Опыт "Гидролиз фосфида кальция" Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
I. Окислительные свойства фосфора (с. о. – 3): 1) Взаимодействие с металлами 3 Ca 0 + 2 P 0 → Ca 3+2 P 2 -3 в-ль о-ль фосфид кальция Опыт. "Получение фосфида кальция" Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина PH 3 Mg 3 P 2 + 6 H 2 O → 3 Mg(OH)2 + 2 PH 3↑ Опыт "Гидролиз фосфида кальция" Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 II. Восстановительные свойства фосфора (+3, +5): фосфора 1) Взаимодействие с простыми веществами: 4 Р 0+ 5 О 20 → 2 Р 2+5 О 5 -2 +Q 4 Р 0+ 3 О 20 → 2 Р 2+3 О 3 -2 +Q медленное окисление (свечение фосфора) Опыт. «Горение фосфора» Опыт. «Горение белого фосфора под водой» Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
II. Восстановительные свойства фосфора (+3, +5): фосфора 1) Взаимодействие с простыми веществами: 4 Р 0+ 5 О 20 → 2 Р 2+5 О 5 -2 +Q 4 Р 0+ 3 О 20 → 2 Р 2+3 О 3 -2 +Q медленное окисление (свечение фосфора) Опыт. «Горение фосфора» Опыт. «Горение белого фосфора под водой» Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 II. Восстановительные свойства фосфора (+3, +5): фосфора 1) Взаимодействие с простыми веществами: 2 P 0 + 5 Cl 2 0(изб. ) → 2 P+5 Cl 5 -1 +Q 2 P 0 + 3 Cl 2 0(нед. ) → 2 P+3 Cl 3 -1 +Q Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
II. Восстановительные свойства фосфора (+3, +5): фосфора 1) Взаимодействие с простыми веществами: 2 P 0 + 5 Cl 2 0(изб. ) → 2 P+5 Cl 5 -1 +Q 2 P 0 + 3 Cl 2 0(нед. ) → 2 P+3 Cl 3 -1 +Q Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 II. Восстановительные свойства фосфора (+3, +5): 2) Взаимодействие со сложными веществами: Р 0 + 5 HN+5 O 3 конц. → Н 3 Р+5 O 4 + 5 N+2 O 2 + Н 2 О ЗР 0 + 5 HN+5 O 3 + 2 Н 2 О → ЗН 3 Р+5 O 4 + 5 N+2 O 5 KCl+5 O 3 + 6 P 0 → 3 P+52 O 5 + 5 KCl-1 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
II. Восстановительные свойства фосфора (+3, +5): 2) Взаимодействие со сложными веществами: Р 0 + 5 HN+5 O 3 конц. → Н 3 Р+5 O 4 + 5 N+2 O 2 + Н 2 О ЗР 0 + 5 HN+5 O 3 + 2 Н 2 О → ЗН 3 Р+5 O 4 + 5 N+2 O 5 KCl+5 O 3 + 6 P 0 → 3 P+52 O 5 + 5 KCl-1 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Получение фосфора Прокаливание фосфата кальция с углем (коксом) и речным песком при 15000 С в электропечах: 2 Ca 3(PO 4)2 + 10 C + 6 Si. O 2 → P 4 + 6 Ca. Si. O 3 + 10 CO Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Получение фосфора Прокаливание фосфата кальция с углем (коксом) и речным песком при 15000 С в электропечах: 2 Ca 3(PO 4)2 + 10 C + 6 Si. O 2 → P 4 + 6 Ca. Si. O 3 + 10 CO Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Применение фосфора 1. Производство спичек. 2. Производство фосфорной кислоты. 3. В военном деле для производства зажигательных снарядов, дымовых шашек, бомб. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Применение фосфора 1. Производство спичек. 2. Производство фосфорной кислоты. 3. В военном деле для производства зажигательных снарядов, дымовых шашек, бомб. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Водородное соединение фосфора P-3 H 3 Фосфин Бесцветный, ядовит, с чесночным запахом. Самовозгорается на воздухе. 2 PH 3 + 4 O 2 → P 2 O 5 + 3 H 2 O Получение: Ca 3 P 2+6 H 2 O → 3 Ca(OH)2+2 PH 3↑ Ca 3 P 2+6 HCl → 3 Ca. Cl 2+2 PH 3↑ PH 3 P 2 H 6 орг. останки Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ" «Блуждающие огни»
Водородное соединение фосфора P-3 H 3 Фосфин Бесцветный, ядовит, с чесночным запахом. Самовозгорается на воздухе. 2 PH 3 + 4 O 2 → P 2 O 5 + 3 H 2 O Получение: Ca 3 P 2+6 H 2 O → 3 Ca(OH)2+2 PH 3↑ Ca 3 P 2+6 HCl → 3 Ca. Cl 2+2 PH 3↑ PH 3 P 2 H 6 орг. останки Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ" «Блуждающие огни»
 Кислородсодержащие соединения фосфора (V) Оксид фосфора (V), фосфорный ангидрид Р 2 О 5 (Р 4 О 10) - белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах. Получение: Получается при горении фосфора в избытке воздуха или кислорода 4 P + 5 O 2 → 2 P 2 O 5 Применение: осушение газов и жидкостей. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Кислородсодержащие соединения фосфора (V) Оксид фосфора (V), фосфорный ангидрид Р 2 О 5 (Р 4 О 10) - белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах. Получение: Получается при горении фосфора в избытке воздуха или кислорода 4 P + 5 O 2 → 2 P 2 O 5 Применение: осушение газов и жидкостей. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Оксид фосфора (V) – это кислотный оксид, взаимодействует с водой, основными оксидами и основаниями. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Оксид фосфора (V) – это кислотный оксид, взаимодействует с водой, основными оксидами и основаниями. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Кислородсодержащие соединения фосфора (V) Ортофосфорная кислота Н 3 РО 4 - белое, твердое вещество, расплывается на воздухе, не ядовита, хорошо растворима в воде. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Кислородсодержащие соединения фосфора (V) Ортофосфорная кислота Н 3 РО 4 - белое, твердое вещество, расплывается на воздухе, не ядовита, хорошо растворима в воде. Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Кислородсодержащие соединения фосфора (V) Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Кислородсодержащие соединения фосфора (V) Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Химические свойства фосфорной кислоты 2. Взаимодействует с металлами в ряду активности до (Н 2). 3. Взаимодействует с основными и амфотерными оксидами. 4. Взаимодействует с основаниями: основание + H 3 PO 4 = соль + Н 2 О если кислота в избытке, то образуется кислая соль: H 3 PO 4(изб) + Na. OH = Na. H 2 PO 4 + H 2 O Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Химические свойства фосфорной кислоты 2. Взаимодействует с металлами в ряду активности до (Н 2). 3. Взаимодействует с основными и амфотерными оксидами. 4. Взаимодействует с основаниями: основание + H 3 PO 4 = соль + Н 2 О если кислота в избытке, то образуется кислая соль: H 3 PO 4(изб) + Na. OH = Na. H 2 PO 4 + H 2 O Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Химические свойства фосфорной кислоты Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Химические свойства фосфорной кислоты Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Химические свойства фосфорной кислоты 5. Качественная реакция на РO 43 -- фосфат ион Реактив: нитрат серебра Результат: образуется жёлтый осадок Н 3 РО 4 + 3 Ag. NO 3 → Ag 3 PO 4↓+ 3 HNO 3 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Химические свойства фосфорной кислоты 5. Качественная реакция на РO 43 -- фосфат ион Реактив: нитрат серебра Результат: образуется жёлтый осадок Н 3 РО 4 + 3 Ag. NO 3 → Ag 3 PO 4↓+ 3 HNO 3 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
 Домашнее задание: § 26, 27 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"
Домашнее задание: § 26, 27 Н. Б. Давыдова, учитель химии МБОУ "Вадская СОШ"


