28_Фосфор.ppt
- Количество слайдов: 18
 Фосфор, его физические и химические свойства
Фосфор, его физические и химические свойства
 Строение атома ФОСФОР Его положение в Периодической системе История открытия Фосфор в природе Фосфор в организме Круговорот в природе Белый фосфор Черный и красный фосфор Химические свойства Получение Применение
Строение атома ФОСФОР Его положение в Периодической системе История открытия Фосфор в природе Фосфор в организме Круговорот в природе Белый фосфор Черный и красный фосфор Химические свойства Получение Применение

 В 1669 Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём» . Вторичное название «фосфор» происходит от греческих слов: «фос» -свет, «феро» - несу. Phosphorus- Светоносный. Лавуазье определил фосфор, как новый химический элемент!
В 1669 Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём» . Вторичное название «фосфор» происходит от греческих слов: «фос» -свет, «феро» - несу. Phosphorus- Светоносный. Лавуазье определил фосфор, как новый химический элемент!
 Р заряд ядра= +15 31 P Электронная конфигурация: 1 s 2 2 р6 3 s 2 3 p 3 (стационарное) стационарное Р (возбужденное) 1 s 2 2 p 6 3 s 1 3 p 3 3 d 1 Р* Типичные степени окисления Примеры -3 0 +3 +5 PH 3 P 4 P 2 O 3 P 2 O 5
Р заряд ядра= +15 31 P Электронная конфигурация: 1 s 2 2 р6 3 s 2 3 p 3 (стационарное) стационарное Р (возбужденное) 1 s 2 2 p 6 3 s 1 3 p 3 3 d 1 Р* Типичные степени окисления Примеры -3 0 +3 +5 PH 3 P 4 P 2 O 3 P 2 O 5
 Устойчивая степень окисления в соединениях +V. Шкала степеней окисления фосфора:
Устойчивая степень окисления в соединениях +V. Шкала степеней окисления фосфора:
 АЛЛОТРОПНЫЕ МОДИФИКАЦИИ В уравнениях реакций аллотропные формы представляют как Р (красн. ) и Р (бел. ). БЕЛЫЙ Р ЧЕРНЫЙ КРАСНЫЙ
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ В уравнениях реакций аллотропные формы представляют как Р (красн. ) и Р (бел. ). БЕЛЫЙ Р ЧЕРНЫЙ КРАСНЫЙ
 БЕЛЫЙ ФОСФОРP 4 Молекулы P 4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44, 1 о. С, t(кип)=275 о. С, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в сероуглероде и ряде других органических растворителей. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды. Применяется в производстве Н 3 РO 4 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
БЕЛЫЙ ФОСФОРP 4 Молекулы P 4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44, 1 о. С, t(кип)=275 о. С, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в сероуглероде и ряде других органических растворителей. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды. Применяется в производстве Н 3 РO 4 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
 КРАСНЫЙ ФОСФОР Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их температура плавления 585 -600 о. С, цвет от темно-корчневого до красного и фиолетового. Не ядовит. Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек.
КРАСНЫЙ ФОСФОР Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их температура плавления 585 -600 о. С, цвет от темно-корчневого до красного и фиолетового. Не ядовит. Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек.
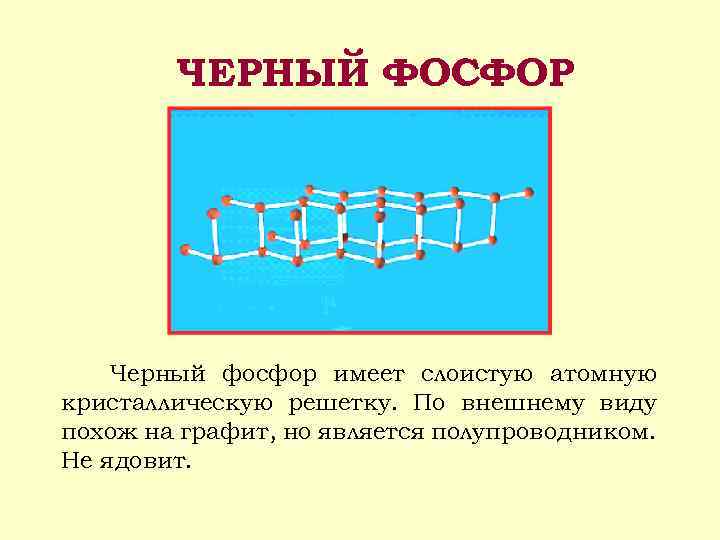 ЧЕРНЫЙ ФОСФОР Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником. Не ядовит.
ЧЕРНЫЙ ФОСФОР Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником. Не ядовит.
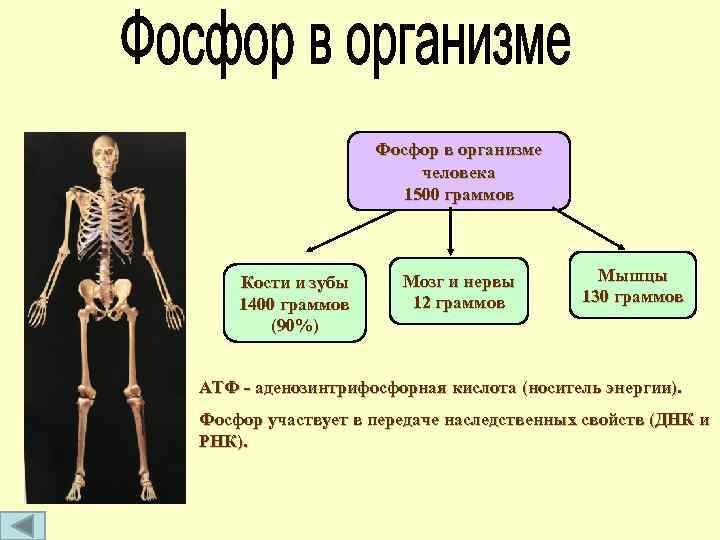 Фосфор в организме человека 1500 граммов Кости и зубы 1400 граммов (90%) Мозг и нервы 12 граммов Мышцы 130 граммов АТФ - аденозинтрифосфорная кислота (носитель энергии). Фосфор участвует в передаче наследственных свойств (ДНК и РНК).
Фосфор в организме человека 1500 граммов Кости и зубы 1400 граммов (90%) Мозг и нервы 12 граммов Мышцы 130 граммов АТФ - аденозинтрифосфорная кислота (носитель энергии). Фосфор участвует в передаче наследственных свойств (ДНК и РНК).
 назад Из апатитов и фосфоритов в электрической печи: Са 3(РО 4)2+5 С+3 Si. O 2 3 Ca. Si. O 3+2 P+5 CO P+5 +5 e P 2 C 0 -2 e C+2 5
назад Из апатитов и фосфоритов в электрической печи: Са 3(РО 4)2+5 С+3 Si. O 2 3 Ca. Si. O 3+2 P+5 CO P+5 +5 e P 2 C 0 -2 e C+2 5
 Р+5 Р 0 восстановитель Р-3 окислитель I. Фосфор – окислитель: При реакции с активными металлами: 3 Ca + 2 P = Ca 3 P 2 фосфид кальция Фосфиды разлагаются водой: Сa 3 P 2 + 6 H 2 O = 3 Ca(OH)2 + 2 PH 3↑ фосфин С водородом фосфор не взаимодействует. II. Фосфор – восстановитель: 1. При реакции с другими неметаллами: 4 P + 5 O 2 = 2 P 2 O 5 + Q – белый фосфор горит под водой Красный фосфор сгорает менее энергично 2 P + 5 Cl 2 = 2 PCl 5 + Q 2. В реакции со сложными веществами –окислителями: 3 P + 5 HNO 3(конц) + 2 H 2 O = 3 H 3 PO 4 + 5 NO 6 P + 5 KCl. O 3 = 3 P 2 O 5 + 5 KCl
Р+5 Р 0 восстановитель Р-3 окислитель I. Фосфор – окислитель: При реакции с активными металлами: 3 Ca + 2 P = Ca 3 P 2 фосфид кальция Фосфиды разлагаются водой: Сa 3 P 2 + 6 H 2 O = 3 Ca(OH)2 + 2 PH 3↑ фосфин С водородом фосфор не взаимодействует. II. Фосфор – восстановитель: 1. При реакции с другими неметаллами: 4 P + 5 O 2 = 2 P 2 O 5 + Q – белый фосфор горит под водой Красный фосфор сгорает менее энергично 2 P + 5 Cl 2 = 2 PCl 5 + Q 2. В реакции со сложными веществами –окислителями: 3 P + 5 HNO 3(конц) + 2 H 2 O = 3 H 3 PO 4 + 5 NO 6 P + 5 KCl. O 3 = 3 P 2 O 5 + 5 KCl
 При взаимодействии со щелочами образуется фосфин PH 3: 2 Р + 2 Na. OH + H 2 O = Na 2 HPO 3 + PH 3
При взаимодействии со щелочами образуется фосфин PH 3: 2 Р + 2 Na. OH + H 2 O = Na 2 HPO 3 + PH 3

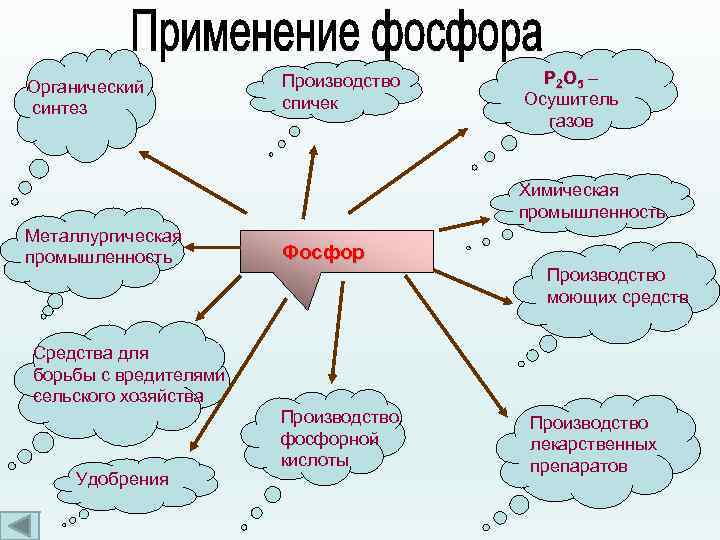 Органический синтез Производство спичек Р 2 О 5 – Осушитель газов Химическая промышленность Металлургическая промышленность Фосфор Производство моющих средств Средства для борьбы с вредителями сельского хозяйства Удобрения Производство фосфорной кислоты Производство лекарственных препаратов
Органический синтез Производство спичек Р 2 О 5 – Осушитель газов Химическая промышленность Металлургическая промышленность Фосфор Производство моющих средств Средства для борьбы с вредителями сельского хозяйства Удобрения Производство фосфорной кислоты Производство лекарственных препаратов
 Фосфин РН 3. • Бинарное соединение, степень окисления фосфора равна – III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3 -гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH 3). Сильный восстановитель, сгорает на воздухе, окисляется в HNO 3 (конц. ). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит.
Фосфин РН 3. • Бинарное соединение, степень окисления фосфора равна – III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3 -гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH 3). Сильный восстановитель, сгорает на воздухе, окисляется в HNO 3 (конц. ). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит.
 Уравнения важнейших реакций:
Уравнения важнейших реакций:


