Фосфор Белый


Фосфор Белый Красный Черный Металличе Формула – Р 4. Формула – Рn. ский Самый реакцион- Полимер. Похож на Хорошо носпособный. графит. проводит При ударе ток. Ядовит. Светится взрывается. Полупроводни в темноте. к.

ФОСФОР - «светоносный» hν, 1200 о. С 220 о, 120 МПа P↑ P 4(бел) Р (красн. ) Р (черн. ) 1, 82 2, 7 г/см 3 Получение: 1500 о. С Ca 3(PO 4)2 + C + Si. O 2 Ca. Si. O 3 + P↑ + CO Фосфорит Апатит Ca 3(PO 4)2 Ca 3(PO 4)2+Ca. F 2
Химические свойства 1) С кислородом 2) С некоторыми металлами (окислитель) 3) С галогенами, серой (восстановитель) 5) С щелочами 6) С кислотами 7) Реакция окисления фосфора при поджигании спичек, в качестве окислителя – бертолетова соль. 8)Не взаимодействует с водородом

МЫШЬЯК - «мышиный яд» СУРЬМА – «антимонашеский металл» (антимониум) ВИСМУТ – «белый металл» Получение Э = As, Sb, Bi Э 2 S 3 + O 2 Э 2 O 3 + SO 2 (обжиг) Э 2 O 3 + C Э + CO 2 ( восстановление) Мышьяк имеет две модификации (желтый и серый), сурьма тоже две (серая и черная).
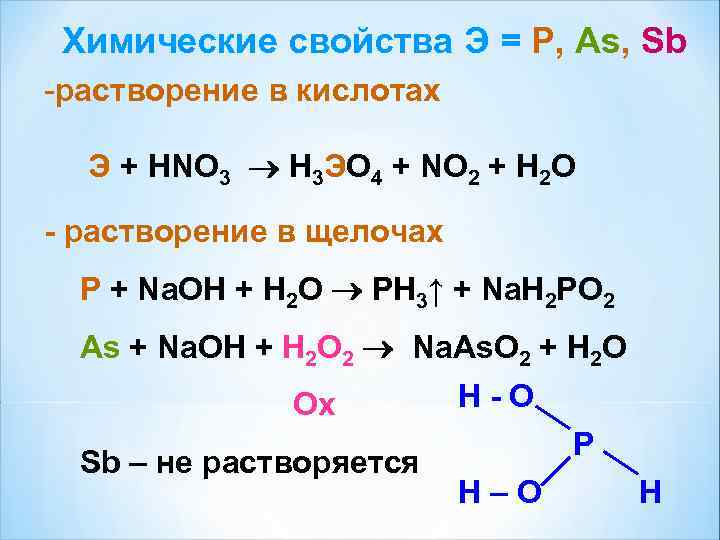
Химические свойства Э = P, As, Sb -растворение в кислотах Э + HNO 3 H 3 ЭO 4 + NO 2 + H 2 O - растворение в щелочах P + Na. OH + H 2 O PH 3↑ + Na. H 2 PO 2 As + Na. OH + H 2 O 2 Na. As. O 2 + H 2 O Ох H-O P Sb – не растворяется H–O H

- с неметаллами ( Н 2, O 2, Hal 2, S) 1) Э + Н 2 ЭН 3 ( фосфин, арсин, стибин) 1) Э + O 2 Э 2 O 3 Э 2 O 5 оксиды 2) Э + Cl 2 ЭCl 3 ЭCl 5 хлориды Галогенангидриды кислот: PCl 3 + 3 H 2 O = H 3 PO 3 + 3 HCl; PCl 5 + 4 H 2 O = H 3 PO 4 + 5 HCl 4) Э + S Э 2 S 3 Э 2 S 5 сульфиды - с металлами Ме + Э Ca 3 P 2, Al. P фосфиды могут быть нестехио- Ni 3 As 2, Ga. As арсениды метрического состава Na Sb, In. Sb антимониды и интерметаллические 3 соединения
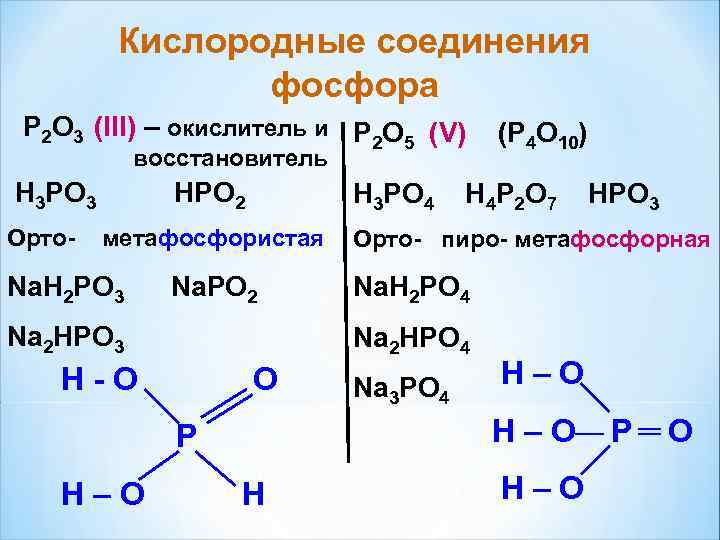
Кислородные соединения фосфора P 2 O 3 (III) – окислитель и P 2 O 5 (V) (Р 4 О 10) восстановитель H 3 PO 3 HPO 2 H 3 PO 4 H 4 P 2 O 7 HPO 3 Орто- метафосфористая Орто- пиро- метафосфорная Na. H 2 PO 3 Na. PO 2 Na. H 2 PO 4 Na 2 HPO 3 Na 2 HPO 4 H-O O Na 3 PO 4 H–O P H–O P O H–O H H–O

Фосфорная кислота Получение в промышленности: 1) Экстракционный метод Ca 3(PO 4)2 +3 H 2 SO 4 = 3 Ca. SO 4 +2 H 3 PO 4 2) Термический метод Ca 3(PO 4)2 → Р → P 2 O 5 → Н 3 PO 4 Ортофосфорная кислота не ядовита, не обладает окислительно-восстановительными свойствами. Используется в пищевой промышленности как консервант. Идет на производство минеральных удобрений.

Фосфорные удобрения *Ca 3(PO 4)2 +2 H 2 SO 4 = 2 Ca. SO 4 + Ca(H 2 PO 4)2 (простой суперфосфат) *Сa 3(PO 4)2 + 4 H 3 PO 4 = 3 Ca(H 2 PO 4)2 (двойной суперфосфат) *Ca(OH)2 + H 3 PO 4 = Ca. HPO 4 · 2 H 2 O (преципитат) *3 NH 4 OH+2 H 3 PO 4=(NH 4)2 HPO 4+NH 4 H 2 PO 4+3 H 2 O (аммофос)
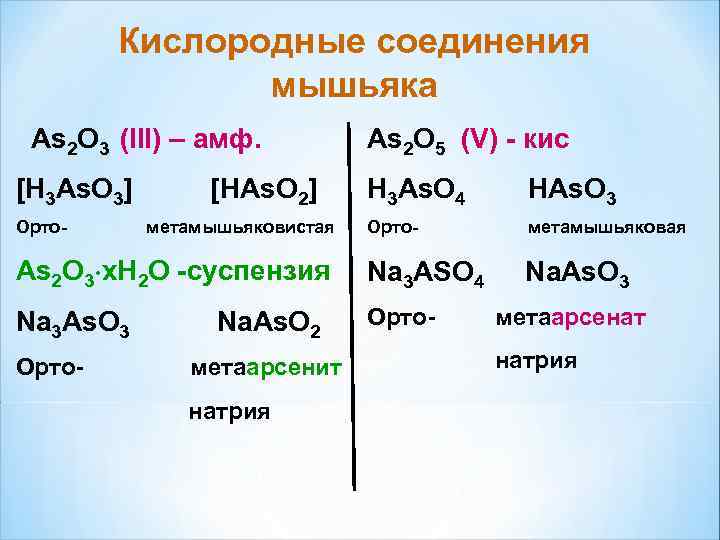
Кислородные соединения мышьяка As 2 O 3 (III) – амф. As 2 O 5 (V) - кис [H 3 As. O 3] [HAs. O 2] H 3 As. O 4 HAs. O 3 Орто- метамышьяковистая Орто- метамышьяковая As 2 O 3∙x. H 2 O -суспензия Na 3 ASO 4 Na. As. O 3 Na 3 As. O 3 Na. As. O 2 Орто- метаарсенат Орто- метаарсенит натрия

Кислородные соединения мышьяка As 2 O 3 плохо растворим в воде. As 2 O 3 и H 3 As. O проявляют амфотерные свойства с преобладанием кислотных: As 2 O 3 + Na. OH = As 2 O 3 + 6 Na. OH = 2 Na 3 As. O 3 + 3 H 2 O As 2 O 3 + H SO 4 = As 2(SO 4)3 + 3 H 2 O As O + 3 H 2 SO= 2 3 2 4 H 3 As. O 3 существует только в растворах. As 2 O 5 – кислотный: As 2 O 5 + 3 H 2 O = 2 H 3 As. O 4 Мышьяковая кислота сильнее фосфорной. Ее можно получить окислением мышьяка в водной среде: 2 As + 5 Cl 2 + 8 H 2 O = 2 H 3 As. O 4 +
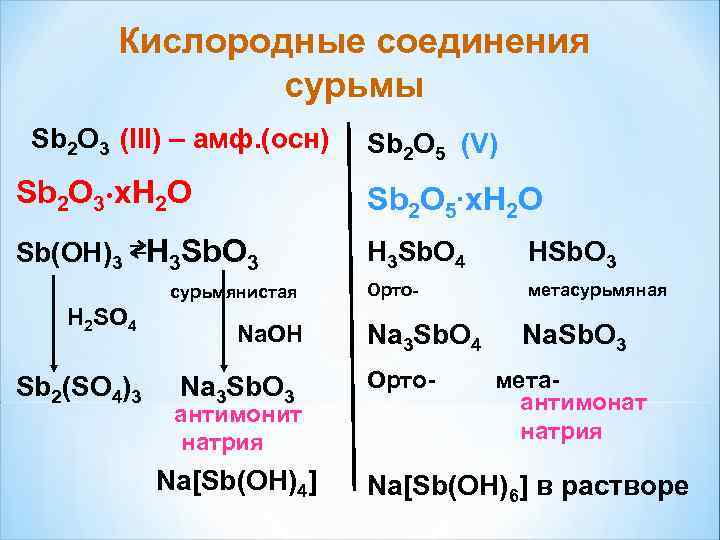
Кислородные соединения сурьмы Sb 2 O 3 (III) – амф. (осн) Sb 2 O 5 (V) Sb 2 O 3∙x. H 2 O Sb 2 O 5∙x. H 2 O Sb(OH)3 ⇄H 3 Sb. O 3 H 3 Sb. O 4 HSb. O 3 сурьмянистая Орто- метасурьмяная H 2 SO 4 Na. OH Na 3 Sb. O 4 Na. Sb. O 3 Sb 2(SO 4)3 Na 3 Sb. O 3 Орто- мета- антимонит антимонат натрия Na[Sb(OH)4] Na[Sb(OH)6] в растворе

Кислородные соединения сурьмы Sb 2 O 3 и HSb. O 3 - амфотерные: Sb 2 O 3 + 6 Na. OH = 2 Na 3 Sb. O 3 + 3 H 2 O Sb 2 O 3 + 3 H 2 SO 4 = Sb 2(SO 4)3 + 3 H 2 O Сурьмяную кислоту можно получить из стибатов: Na. Sb. O 3 + H 2 O = Na. OH + HSb. O 3 Sb 3+ легко переходят в Sb 5+ под действием окислителя: Sb(OH)3 + Cl 2 + H 2 O = H 3 Sb. O 4 + 2 HCl Sb 2 O 5 - кислотный Sb 2 O 5 + H 2 O ≠

ВИСМУТ ( III, V) Химические свойства - растворение ( только в кислотах- окисл. ) Bi + HNO 3 → Bi(NO 3)3 + NO + H 2 O Bi + HNO 3 + HCl → Bi. Cl 3 + NO + H 2 O - c неметаллами Bi + O 2 → Bi 2 O 3 → (Bi 2 O 5) неуст. Bi + Cl 2 → Bi. Cl 3
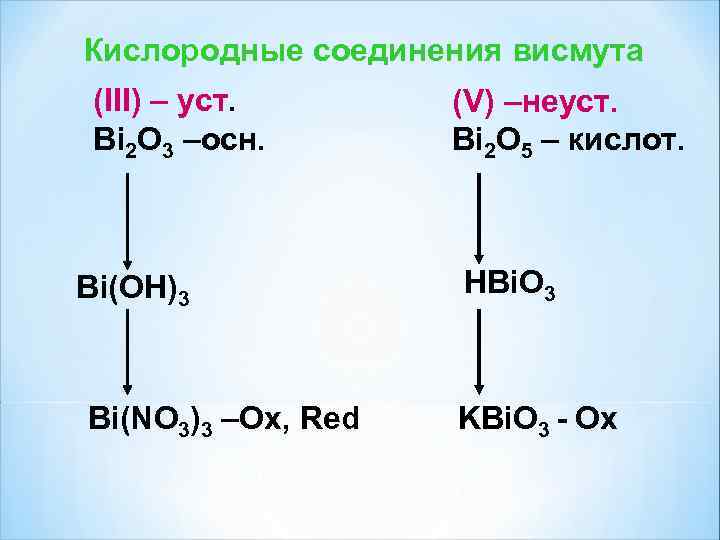
Кислородные соединения висмута (III) – уст. (V) –неуст. Bi 2 O 3 –осн. Bi 2 O 5 – кислот. Bi(OH)3 HBi. O 3 Bi(NO 3)3 –Ox, Red KBi. O 3 - Ох

Кислородные соединения висмута Bi 2 O 3 основного характера: Bi 2 O 3 + 3 H 2 SO 4 = Bi 2(SO 4)3 + 3 H 2 O Bi 2 O 3 + H 2 O ≠ Висмутовая кислота не получена. Соли (висмутаты) легко получаются при реакции: Bi 2 O 5 + 6 Na. OH = 2 Na 3 Bi. O 4 + 3 H 2 O Bi 2 O 5 + 2 Na. OH = 2 Na. Bi. O 3 + H 2 O
![III Bi(OH)3 + Na 2[Sn(OH)4] + Na. OH → Bi + Na III Bi(OH)3 + Na 2[Sn(OH)4] + Na. OH → Bi + Na](https://present5.com/presentation/3/37562034_177393564.pdf-img/37562034_177393564.pdf-17.jpg)
III Bi(OH)3 + Na 2[Sn(OH)4] + Na. OH → Bi + Na 2[Sn(OH)6] Ox Bi(OH)3 + Cl 2 + Na. OH → Na. Bi. O 3 + Na. Cl +… Red Bi(NO 3)3 + H 2 O → Bi. ONO 3 + HNO 3 гидролиз V KBi. O 3 + Mn. SO 4 + H 2 SO 4 → Bi 2(SO 4)3 + HMn. O 4 +… Ox
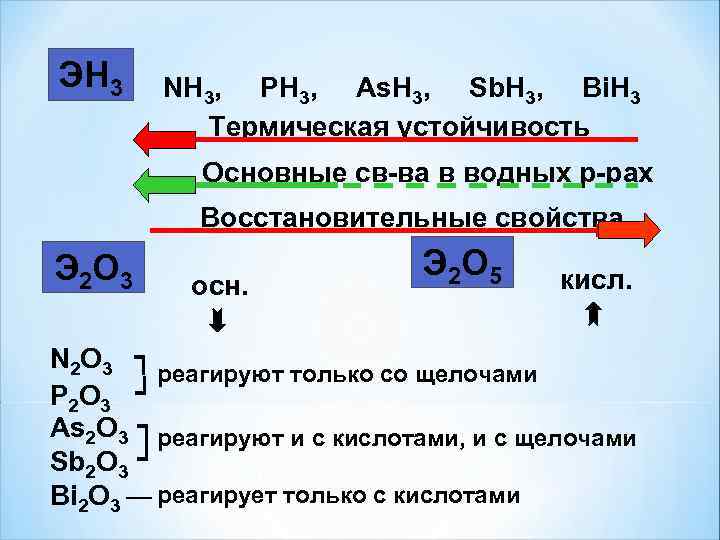
ЭН 3 NH 3, PH 3, As. H 3, Sb. H 3, Bi. H 3 Термическая устойчивость Основные св-ва в водных р-рах Восстановительные свойства Э 2 О 3 Э 2 О 5 кисл. осн. N 2 O 3 ┐ реагируют только со щелочами P 2 O 3 ┘ As 2 O 3 ┐ реагируют и с кислотами, и с щелочами Sb 2 O 3 ┘ Bi 2 O 3 ― реагирует только с кислотами

Применение фосфора - производство спичек, боеприпасов, дымовых шашек, сигнальных ракет; -производство удобрений, - производство пластмасс, каучуков, моющих средств. Применение As, Sb, Bi Полупроводники АIIIBV: Al. As, Ga. As, In. As арсениды Al. Sb, Ga. Sb, In. Sb антимониды Производство диодов, транзисторов, интегральных схем

Белый фосфор применялся американцами в Ираке при атаке Фаллуджи для освещения местности и постановки дымовых завес.

