Лекция 7 ГМ исп.ppt
- Количество слайдов: 37
 Формы переноса генетического материала: трансформация, коньюгация, трансдукция Лекция № 7 Для студентов специальности «Микробиология» по дисциплине «Генетика микроорганизмов»
Формы переноса генетического материала: трансформация, коньюгация, трансдукция Лекция № 7 Для студентов специальности «Микробиология» по дисциплине «Генетика микроорганизмов»
 План лекции: n n n n Трансформация. Открытие эффекта. Природа трансформирующего фактора. Особенности переноса генетического материала при трансформации: компетентность, проникновение ДНК донора в клетку реципиента, эффективность и механизм включения ДНК донора в геном реципиента. Трансформация у грамположительных и грамотрицательных бактерий. Спонтанная трансформация. Генетическое картирование при трансформации. Трансфекция. Конъюгация. Открытие конъюгации у Escherichia coli и особенности этого процесса. Половая дифференцировка у кишечной палочки (свойства F-, F+ и Hfr - штаммов). Доказательства кольцевой природы хромосомы E. coli. Половой фактор, его функции, интеграция в хромосому и исключение. Организация tra-оперона. Стадии процесса конъюгации. Перенос хромосомы при конъюгации. Мерозиготы. Частота переноса и частота включения маркеров. Конъюгация у различных видов бактерий. Картирование хромосом бактерий с использованием систем конъюгации, трансдукции и трансформации. Методы картирования хромосомы при конъюгации по градиенту передачи маркеров, по времени их вхождения в мерозиготу, по частоте кроссинговера. Методы молекулярно-генетического анализа. Трансдукция. Специфическая трансдукция: ее особенности и механизмы. Использование специфической трансдукции при генетическом анализе у бактерий. Общая трансдукция: ее особенности и механизмы. Возможности генетического картирования при неспецифической трансдукции. Абортивная трансдукция. Трансдукция у разных видов бактерий.
План лекции: n n n n Трансформация. Открытие эффекта. Природа трансформирующего фактора. Особенности переноса генетического материала при трансформации: компетентность, проникновение ДНК донора в клетку реципиента, эффективность и механизм включения ДНК донора в геном реципиента. Трансформация у грамположительных и грамотрицательных бактерий. Спонтанная трансформация. Генетическое картирование при трансформации. Трансфекция. Конъюгация. Открытие конъюгации у Escherichia coli и особенности этого процесса. Половая дифференцировка у кишечной палочки (свойства F-, F+ и Hfr - штаммов). Доказательства кольцевой природы хромосомы E. coli. Половой фактор, его функции, интеграция в хромосому и исключение. Организация tra-оперона. Стадии процесса конъюгации. Перенос хромосомы при конъюгации. Мерозиготы. Частота переноса и частота включения маркеров. Конъюгация у различных видов бактерий. Картирование хромосом бактерий с использованием систем конъюгации, трансдукции и трансформации. Методы картирования хромосомы при конъюгации по градиенту передачи маркеров, по времени их вхождения в мерозиготу, по частоте кроссинговера. Методы молекулярно-генетического анализа. Трансдукция. Специфическая трансдукция: ее особенности и механизмы. Использование специфической трансдукции при генетическом анализе у бактерий. Общая трансдукция: ее особенности и механизмы. Возможности генетического картирования при неспецифической трансдукции. Абортивная трансдукция. Трансдукция у разных видов бактерий.
 Определения n n n У прокариот существует три способа включения в геном чужеродной ДНК: трансформация, конъюгация и трансдукция. У некоторых видов известен половой процесс (конъюгация). При конъюгации одна из клеток передает генетическую информацию другой клетке. При этом увеличения числа особей не происходит. Перенос генетической информации может происходить с помощью вирусов (трансдукция) или путем прямого переноса ДНК через мембрану (трансформация).
Определения n n n У прокариот существует три способа включения в геном чужеродной ДНК: трансформация, конъюгация и трансдукция. У некоторых видов известен половой процесс (конъюгация). При конъюгации одна из клеток передает генетическую информацию другой клетке. При этом увеличения числа особей не происходит. Перенос генетической информации может происходить с помощью вирусов (трансдукция) или путем прямого переноса ДНК через мембрану (трансформация).
 Трансформация бактерий заключается в переносе ДНК, выделенной из одних клеток, в другие. Для трансформации не требуется непосредственного контакта между двумя клетками. Способность ДНК проникать в клетку-реципиент зависит как от природы самой ДНК, так и от физиологического состояния клетки-реципиента. Трансформирующей ДНК могут быть только высокомолекулярные двухцепочечные фрагменты, при этом проникать в бактериальную клетку может ДНК, выделенная из разных биологических источников, но включаться в геном — только ДНК с определенной степенью гомологичности. После того как экзогенный фрагмент ДНК, проникший в клетку, нашел гомологичный фрагмент ДНК клеткиреципиента, между ними происходит генетический обмен.
Трансформация бактерий заключается в переносе ДНК, выделенной из одних клеток, в другие. Для трансформации не требуется непосредственного контакта между двумя клетками. Способность ДНК проникать в клетку-реципиент зависит как от природы самой ДНК, так и от физиологического состояния клетки-реципиента. Трансформирующей ДНК могут быть только высокомолекулярные двухцепочечные фрагменты, при этом проникать в бактериальную клетку может ДНК, выделенная из разных биологических источников, но включаться в геном — только ДНК с определенной степенью гомологичности. После того как экзогенный фрагмент ДНК, проникший в клетку, нашел гомологичный фрагмент ДНК клеткиреципиента, между ними происходит генетический обмен.
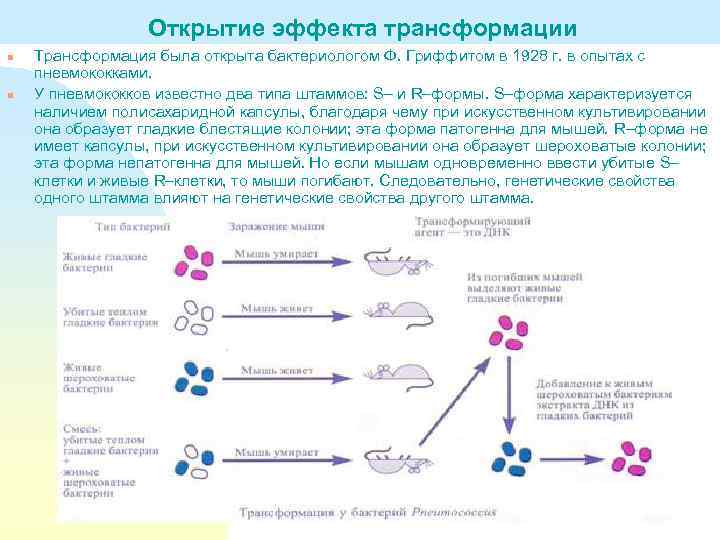 Открытие эффекта трансформации n n Трансформация была открыта бактериологом Ф. Гриффитом в 1928 г. в опытах с пневмококками. У пневмококков известно два типа штаммов: S– и R–формы. S–форма характеризуется наличием полисахаридной капсулы, благодаря чему при искусственном культивировании она образует гладкие блестящие колонии; эта форма патогенна для мышей. R–форма не имеет капсулы, при искусственном культивировании она образует шероховатые колонии; эта форма непатогенна для мышей. Но если мышам одновременно ввести убитые S– клетки и живые R–клетки, то мыши погибают. Следовательно, генетические свойства одного штамма влияют на генетические свойства другого штамма.
Открытие эффекта трансформации n n Трансформация была открыта бактериологом Ф. Гриффитом в 1928 г. в опытах с пневмококками. У пневмококков известно два типа штаммов: S– и R–формы. S–форма характеризуется наличием полисахаридной капсулы, благодаря чему при искусственном культивировании она образует гладкие блестящие колонии; эта форма патогенна для мышей. R–форма не имеет капсулы, при искусственном культивировании она образует шероховатые колонии; эта форма непатогенна для мышей. Но если мышам одновременно ввести убитые S– клетки и живые R–клетки, то мыши погибают. Следовательно, генетические свойства одного штамма влияют на генетические свойства другого штамма.
 Открытие эффекта трансформации n n n В 1944 г. О. Эвери, К. Мак. Леод и М. Мак. Карти доказали, что такое же превращение типов пневмококков может происходить в пробирке, т. е. in vitro. Эти исследователи установили существование особой субстанции - «трансформирующего принципа» - экстракта из клеток штамма S, обогащенного ДНК, выделенная из клеток S –штамма и добавленная в культуру R- штамма, трансформировала часть клеток в S- форму. Клетки стойко передавали это свойство при дальнейшем размножении. Обработка трансформирующего фактора ДНК-азой - ферментом, разрушающем ДНК, блокировала трансформацию. Эти данные в первые показали, что именно ДНК, а не белок, как полагали до тех пор, является трансформирующем фактором, а изменение наследственных свойств клеток связано с переносом ДНК.
Открытие эффекта трансформации n n n В 1944 г. О. Эвери, К. Мак. Леод и М. Мак. Карти доказали, что такое же превращение типов пневмококков может происходить в пробирке, т. е. in vitro. Эти исследователи установили существование особой субстанции - «трансформирующего принципа» - экстракта из клеток штамма S, обогащенного ДНК, выделенная из клеток S –штамма и добавленная в культуру R- штамма, трансформировала часть клеток в S- форму. Клетки стойко передавали это свойство при дальнейшем размножении. Обработка трансформирующего фактора ДНК-азой - ферментом, разрушающем ДНК, блокировала трансформацию. Эти данные в первые показали, что именно ДНК, а не белок, как полагали до тех пор, является трансформирующем фактором, а изменение наследственных свойств клеток связано с переносом ДНК.
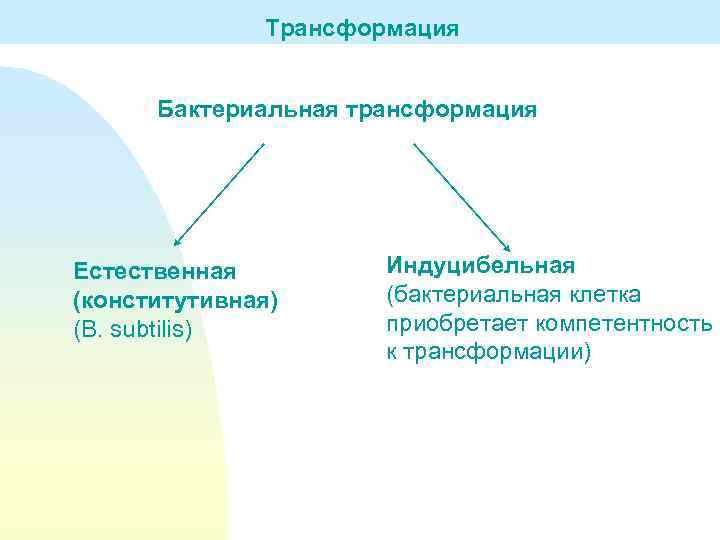 Трансформация Бактериальная трансформация Естественная (конститутивная) (B. subtilis) Индуцибельная (бактериальная клетка приобретает компетентность к трансформации)
Трансформация Бактериальная трансформация Естественная (конститутивная) (B. subtilis) Индуцибельная (бактериальная клетка приобретает компетентность к трансформации)
 Особенности переноса ДНК при трансформации n n n Способность клетки к трансформации возможна при особом ее состоянии, которое называется компетентностью. Компетентными бактерии могут становиться в результате обработки их химическими и физическими агентами, которые способствуют поглощению трансформирующей ДНК. У компетентных клеток изменяется состав клеточной стенки и плазмалеммы: стенка становится пористой, плазмалемма образует многочисленные впячивания, а на внешней поверхности появляются особые антигены – факторы компетентности (в частности, специфические белки с низкой молекулярной массой). Природная компетентность- это генетически и физиологически детерминированное, специфическое свойство штамма. В природных условиях внеклеточная чистая ДНК образуется при гибели (лизисе) прокариот. Как правило, трансформация происходит в пределах одного вида прокариот, но при наличии гомологичных генов наблюдается и межвидовая трансформация.
Особенности переноса ДНК при трансформации n n n Способность клетки к трансформации возможна при особом ее состоянии, которое называется компетентностью. Компетентными бактерии могут становиться в результате обработки их химическими и физическими агентами, которые способствуют поглощению трансформирующей ДНК. У компетентных клеток изменяется состав клеточной стенки и плазмалеммы: стенка становится пористой, плазмалемма образует многочисленные впячивания, а на внешней поверхности появляются особые антигены – факторы компетентности (в частности, специфические белки с низкой молекулярной массой). Природная компетентность- это генетически и физиологически детерминированное, специфическое свойство штамма. В природных условиях внеклеточная чистая ДНК образуется при гибели (лизисе) прокариот. Как правило, трансформация происходит в пределах одного вида прокариот, но при наличии гомологичных генов наблюдается и межвидовая трансформация.
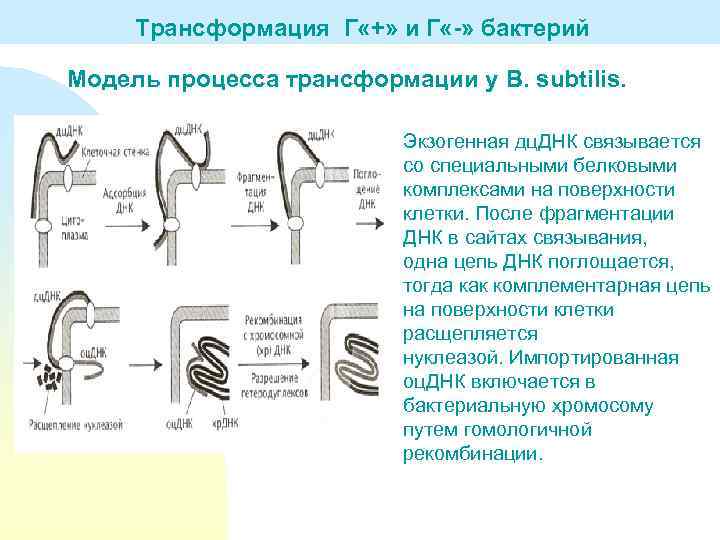 Трансформация Г «+» и Г «-» бактерий Модель процесса трансформации у B. subtilis. Экзогенная дц. ДНК связывается со специальными белковыми комплексами на поверхности клетки. После фрагментации ДНК в сайтах связывания, одна цепь ДНК поглощается, тогда как комплементарная цепь на поверхности клетки расщепляется нуклеазой. Импортированная оц. ДНК включается в бактериальную хромосому путем гомологичной рекомбинации.
Трансформация Г «+» и Г «-» бактерий Модель процесса трансформации у B. subtilis. Экзогенная дц. ДНК связывается со специальными белковыми комплексами на поверхности клетки. После фрагментации ДНК в сайтах связывания, одна цепь ДНК поглощается, тогда как комплементарная цепь на поверхности клетки расщепляется нуклеазой. Импортированная оц. ДНК включается в бактериальную хромосому путем гомологичной рекомбинации.
 Трансформация Г «+» и Г «-» бактерий Трансформация у Haemophilus influenzae. В хромосомной ДНК возникают одноцепочечные бреши и «хвосты» , она как бы подготавливается для включения экзогенной ДНК. Поглощение ДНК носит характер высокоизбирательного процесса в отношении гомологичной ДНК. В узнавании ДНК, а также в ее поглощении и защите от нуклеаз участвуют везикулярные мембранные выросты, Называемые трансформосомами.
Трансформация Г «+» и Г «-» бактерий Трансформация у Haemophilus influenzae. В хромосомной ДНК возникают одноцепочечные бреши и «хвосты» , она как бы подготавливается для включения экзогенной ДНК. Поглощение ДНК носит характер высокоизбирательного процесса в отношении гомологичной ДНК. В узнавании ДНК, а также в ее поглощении и защите от нуклеаз участвуют везикулярные мембранные выросты, Называемые трансформосомами.
 Трансформация Г «+» и Г «-» бактерий Трансформация у Streptococcus pneumoniae Поглощение ДНК сопровождается деградацией одной из ее цепей под действием нуклеаз. Идентифицирована локализованная в мембране нуклеаза, необходимая доя поглощения ДНК. Для Streptococcus pneumoniae установлены (3‘ 5')- полярность поглощения ДНК и использование в этом процессе АТФ.
Трансформация Г «+» и Г «-» бактерий Трансформация у Streptococcus pneumoniae Поглощение ДНК сопровождается деградацией одной из ее цепей под действием нуклеаз. Идентифицирована локализованная в мембране нуклеаза, необходимая доя поглощения ДНК. Для Streptococcus pneumoniae установлены (3‘ 5')- полярность поглощения ДНК и использование в этом процессе АТФ.
 Трансформация Г «+» и Г «-» бактерий Трансформация у Е. соli Трансформация не служит важным механизмом обмена генетической информацией. Обработка клеток бактерий р-ром Са. Сl 2 на холоде делает их компетентными для поглощения экзогенной ДНК в течение короткого периода нагревания.
Трансформация Г «+» и Г «-» бактерий Трансформация у Е. соli Трансформация не служит важным механизмом обмена генетической информацией. Обработка клеток бактерий р-ром Са. Сl 2 на холоде делает их компетентными для поглощения экзогенной ДНК в течение короткого периода нагревания.
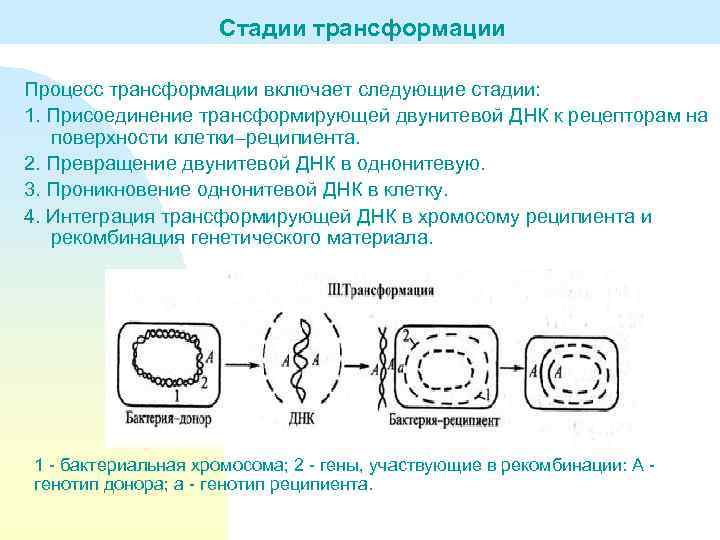 Стадии трансформации Процесс трансформации включает следующие стадии: 1. Присоединение трансформирующей двунитевой ДНК к рецепторам на поверхности клетки–реципиента. 2. Превращение двунитевой ДНК в однонитевую. 3. Проникновение однонитевой ДНК в клетку. 4. Интеграция трансформирующей ДНК в хромосому реципиента и рекомбинация генетического материала. 1 - бактериальная хромосома; 2 - гены, участвующие в рекомбинации: А - генотип донора; а - генотип реципиента.
Стадии трансформации Процесс трансформации включает следующие стадии: 1. Присоединение трансформирующей двунитевой ДНК к рецепторам на поверхности клетки–реципиента. 2. Превращение двунитевой ДНК в однонитевую. 3. Проникновение однонитевой ДНК в клетку. 4. Интеграция трансформирующей ДНК в хромосому реципиента и рекомбинация генетического материала. 1 - бактериальная хромосома; 2 - гены, участвующие в рекомбинации: А - генотип донора; а - генотип реципиента.
 n n n Стадии трансформации Длина трансформирующей ДНК должна быть от 500 до 200 тысяч н. п. Энергия, выделяющаяся при деградации одной из нитей ДНК, используется для активного транспорта оставшейся нити вовнутрь клетки. Первые три стадии трансформации не зависят от нуклеотидного состава ДНК. Однако процесс интеграции трансформирующей ДНК в хромосому реципиента более вероятен при высокой гомологичности этой ДНК по отношению к ДНК реципиента. После окончания репликации ДНК клетка–реципиент делится с образованием двух клеток: частично трансформированной клетки с хромосомой, включающей гетеродуплексный участок ДНК, и нетрансформированной клетки. При репликации ДНК в частично трансформированной клетке на обеих цепях ДНК происходит достраивание комплементарных цепей. Одна цепь сохраняет исходные последовательности нуклеотидов, а другая становится полностью трансформированной. После деления частично трансформированной клетки образуется одна нетрансформированная клетка и одна полностью трансформированная, у которой исходная последовательность нуклеотидов замещена на последовательность нуклеотидов трансформирующей ДНК. Таким образом, при трансформации происходит не добавление новых генов, а замещение генов реципиента на гомологичные нуклеотидные последовательности. Частота трансформации у прокариот зависит от свойств трансформирующей ДНК, от ее концентрации, от состояния клетки–реципиента, от вида бактерий. Максимальная частота трансформированных клеток не превышает 1 на 100 клеток.
n n n Стадии трансформации Длина трансформирующей ДНК должна быть от 500 до 200 тысяч н. п. Энергия, выделяющаяся при деградации одной из нитей ДНК, используется для активного транспорта оставшейся нити вовнутрь клетки. Первые три стадии трансформации не зависят от нуклеотидного состава ДНК. Однако процесс интеграции трансформирующей ДНК в хромосому реципиента более вероятен при высокой гомологичности этой ДНК по отношению к ДНК реципиента. После окончания репликации ДНК клетка–реципиент делится с образованием двух клеток: частично трансформированной клетки с хромосомой, включающей гетеродуплексный участок ДНК, и нетрансформированной клетки. При репликации ДНК в частично трансформированной клетке на обеих цепях ДНК происходит достраивание комплементарных цепей. Одна цепь сохраняет исходные последовательности нуклеотидов, а другая становится полностью трансформированной. После деления частично трансформированной клетки образуется одна нетрансформированная клетка и одна полностью трансформированная, у которой исходная последовательность нуклеотидов замещена на последовательность нуклеотидов трансформирующей ДНК. Таким образом, при трансформации происходит не добавление новых генов, а замещение генов реципиента на гомологичные нуклеотидные последовательности. Частота трансформации у прокариот зависит от свойств трансформирующей ДНК, от ее концентрации, от состояния клетки–реципиента, от вида бактерий. Максимальная частота трансформированных клеток не превышает 1 на 100 клеток.
 Спонтанная трансформация n n n Процесс трансформации может произвольно происходить в природе у некоторых видов бактерий, чаще грамположительных, когда ДНК, выделенная из погибших клеток, захватывается реципиентными клетками. Как правило, любая чужеродная ДНК, попадающая в бактериальную клетку, расщепляется рестрикционными эндонуклеазами; но при некоторых условиях такая ДНК может быть интегрирована в геном бактерии. По происхождению ДНК может быть плазмидной либо хромосомной и нести гены, трансформирующие реципиента. Подобным путем процессы трансформации могут распространять гены, кодирующие факторы вирулентности, среди бактериальных популяций; однако в обмене генетической информацией трансформация играет незначительную роль.
Спонтанная трансформация n n n Процесс трансформации может произвольно происходить в природе у некоторых видов бактерий, чаще грамположительных, когда ДНК, выделенная из погибших клеток, захватывается реципиентными клетками. Как правило, любая чужеродная ДНК, попадающая в бактериальную клетку, расщепляется рестрикционными эндонуклеазами; но при некоторых условиях такая ДНК может быть интегрирована в геном бактерии. По происхождению ДНК может быть плазмидной либо хромосомной и нести гены, трансформирующие реципиента. Подобным путем процессы трансформации могут распространять гены, кодирующие факторы вирулентности, среди бактериальных популяций; однако в обмене генетической информацией трансформация играет незначительную роль.
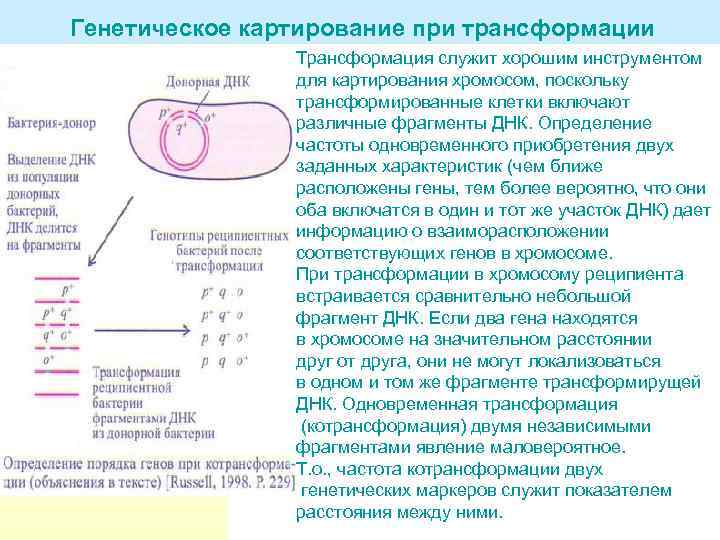 Генетическое картирование при трансформации Трансформация служит хорошим инструментом для картирования хромосом, поскольку трансформированные клетки включают различные фрагменты ДНК. Определение частоты одновременного приобретения двух заданных характеристик (чем ближе расположены гены, тем более вероятно, что они оба включатся в один и тот же участок ДНК) дает информацию о взаиморасположении соответствующих генов в хромосоме. При трансформации в хромосому реципиента встраивается сравнительно небольшой фрагмент ДНК. Если два гена находятся в хромосоме на значительном расстоянии друг от друга, они не могут локализоваться в одном и том же фрагменте трансформирущей ДНК. Одновременная трансформация (котрансформация) двумя независимыми фрагментами явление маловероятное. Т. о. , частота котрансформации двух генетических маркеров служит показателем расстояния между ними.
Генетическое картирование при трансформации Трансформация служит хорошим инструментом для картирования хромосом, поскольку трансформированные клетки включают различные фрагменты ДНК. Определение частоты одновременного приобретения двух заданных характеристик (чем ближе расположены гены, тем более вероятно, что они оба включатся в один и тот же участок ДНК) дает информацию о взаиморасположении соответствующих генов в хромосоме. При трансформации в хромосому реципиента встраивается сравнительно небольшой фрагмент ДНК. Если два гена находятся в хромосоме на значительном расстоянии друг от друга, они не могут локализоваться в одном и том же фрагменте трансформирущей ДНК. Одновременная трансформация (котрансформация) двумя независимыми фрагментами явление маловероятное. Т. о. , частота котрансформации двух генетических маркеров служит показателем расстояния между ними.
 Трансфекция Трансформация известна и для эукариот. Однако на поверхности эукариотических клеток отсутствуют рецепторные сайты, и трансформирующую ДНК вводят в клетки искусственно. Например, в яйцеклетки животных ДНК вводят путем прямой микроинъекции, а в яйцеклетки растений – путем микроинъекции в пыльцевую трубку. n Трансфекция - это встраивание чужеродной ДНК в культивируемые эукариотические клетки в результате обработки их изолированной ДНК. Эффективного поглощения ДНК удалось достичь при добавлении к ней ионов Са. Клетки поглощают частицы кальциевого преципитата ДНК по механизму фагоцитоза, а затем небольшая часть проникших в клетку молекул встраивается в хромосомную ДНК.
Трансфекция Трансформация известна и для эукариот. Однако на поверхности эукариотических клеток отсутствуют рецепторные сайты, и трансформирующую ДНК вводят в клетки искусственно. Например, в яйцеклетки животных ДНК вводят путем прямой микроинъекции, а в яйцеклетки растений – путем микроинъекции в пыльцевую трубку. n Трансфекция - это встраивание чужеродной ДНК в культивируемые эукариотические клетки в результате обработки их изолированной ДНК. Эффективного поглощения ДНК удалось достичь при добавлении к ней ионов Са. Клетки поглощают частицы кальциевого преципитата ДНК по механизму фагоцитоза, а затем небольшая часть проникших в клетку молекул встраивается в хромосомную ДНК.
 Конъюгация В середине двадцатого века был описан половой процесс у бактерий (Дж. Ледерберг и Э. Татум, 1946). При конъюгации, для которой необходим непосредственный контакт между бактериальными клетками, осуществляется направленный перенос генетического материала от клетки-донора в клетку-реципиент. Как правило, в клеткуреципиент переносится только часть генетического материала клеткидонора. Участки перенесенной от донора ДНК находят гомологичные участки в молекуле ДНК реципиента, между которыми происходит генетический обмен. В результате часть донорной ДНК встраивается (интегрируется) в геном реципиента, а соответствующая часть реципиентной ДНК из него исключается.
Конъюгация В середине двадцатого века был описан половой процесс у бактерий (Дж. Ледерберг и Э. Татум, 1946). При конъюгации, для которой необходим непосредственный контакт между бактериальными клетками, осуществляется направленный перенос генетического материала от клетки-донора в клетку-реципиент. Как правило, в клеткуреципиент переносится только часть генетического материала клеткидонора. Участки перенесенной от донора ДНК находят гомологичные участки в молекуле ДНК реципиента, между которыми происходит генетический обмен. В результате часть донорной ДНК встраивается (интегрируется) в геном реципиента, а соответствующая часть реципиентной ДНК из него исключается.
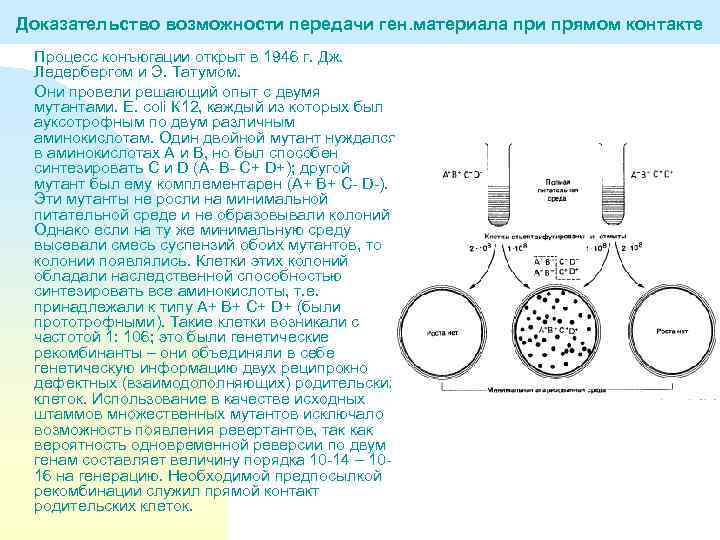 Доказательство возможности передачи ген. материала при прямом контакте Процесс конъюгации открыт в 1946 г. Дж. Ледербергом и Э. Татумом. Они провели решающий опыт с двумя мутантами. E. coli К 12, каждый из которых был ауксотрофным по двум различным аминокислотам. Один двойной мутант нуждался в аминокислотах А и В, но был способен синтезировать С и D (А- В- С+ D+); другой мутант был ему комплементарен (А+ В+ С- D-). Эти мутанты не росли на минимальной питательной среде и не образовывали колоний. Однако если на ту же минимальную среду высевали смесь суспензий обоих мутантов, то колонии появлялись. Клетки этих колоний обладали наследственной способностью синтезировать все аминокислоты, т. е. принадлежали к типу А+ В+ С+ D+ (были прототрофными). Такие клетки возникали с частотой 1: 106; это были генетические рекомбинанты – они объединяли в себе генетическую информацию двух реципрокно дефектных (взаимодополняющих) родительских клеток. Использование в качестве исходных штаммов множественных мутантов исключало возможность появления ревертантов, так как вероятность одновременной реверсии по двум генам составляет величину порядка 10 -14 – 1016 на генерацию. Необходимой предпосылкой рекомбинации служил прямой контакт родительских клеток.
Доказательство возможности передачи ген. материала при прямом контакте Процесс конъюгации открыт в 1946 г. Дж. Ледербергом и Э. Татумом. Они провели решающий опыт с двумя мутантами. E. coli К 12, каждый из которых был ауксотрофным по двум различным аминокислотам. Один двойной мутант нуждался в аминокислотах А и В, но был способен синтезировать С и D (А- В- С+ D+); другой мутант был ему комплементарен (А+ В+ С- D-). Эти мутанты не росли на минимальной питательной среде и не образовывали колоний. Однако если на ту же минимальную среду высевали смесь суспензий обоих мутантов, то колонии появлялись. Клетки этих колоний обладали наследственной способностью синтезировать все аминокислоты, т. е. принадлежали к типу А+ В+ С+ D+ (были прототрофными). Такие клетки возникали с частотой 1: 106; это были генетические рекомбинанты – они объединяли в себе генетическую информацию двух реципрокно дефектных (взаимодополняющих) родительских клеток. Использование в качестве исходных штаммов множественных мутантов исключало возможность появления ревертантов, так как вероятность одновременной реверсии по двум генам составляет величину порядка 10 -14 – 1016 на генерацию. Необходимой предпосылкой рекомбинации служил прямой контакт родительских клеток.
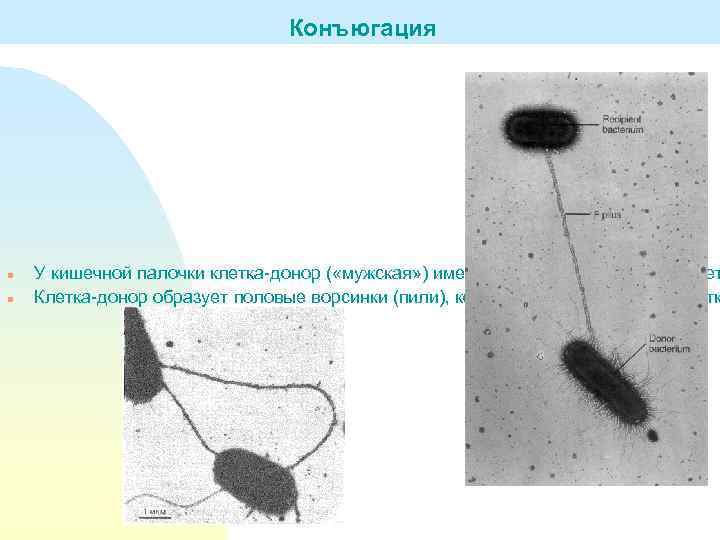 Конъюгация n n У кишечной палочки клетка-донор ( «мужская» ) имеет продолговатую форму, клет Клетка-донор образует половые ворсинки (пили), которые притягивают ее к клетк
Конъюгация n n У кишечной палочки клетка-донор ( «мужская» ) имеет продолговатую форму, клет Клетка-донор образует половые ворсинки (пили), которые притягивают ее к клетк
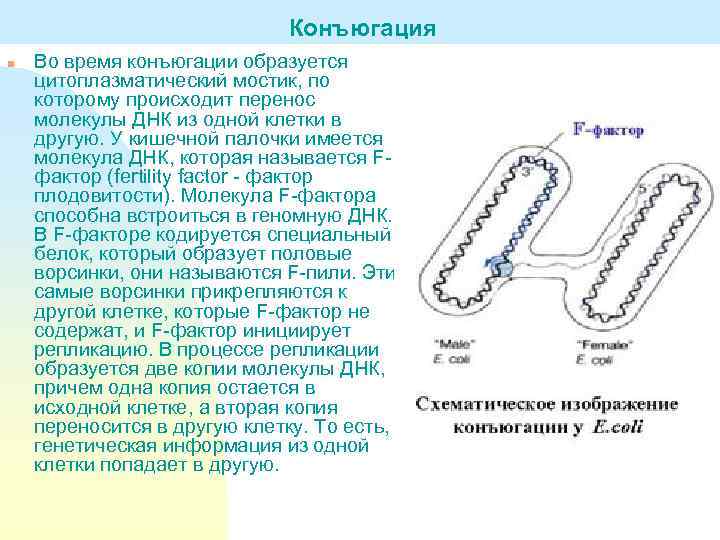 Конъюгация n Во время конъюгации образуется цитоплазматический мостик, по которому происходит перенос молекулы ДНК из одной клетки в другую. У кишечной палочки имеется молекула ДНК, которая называется Fфактор (fertility factor - фактор плодовитости). Молекула F-фактора способна встроиться в геномную ДНК. В F-факторе кодируется специальный белок, который образует половые ворсинки, они называются F-пили. Эти самые ворсинки прикрепляются к другой клетке, которые F-фактор не содержат, и F-фактор инициирует репликацию. В процессе репликации образуется две копии молекулы ДНК, причем одна копия остается в исходной клетке, а вторая копия переносится в другую клетку. То есть, генетическая информация из одной клетки попадает в другую.
Конъюгация n Во время конъюгации образуется цитоплазматический мостик, по которому происходит перенос молекулы ДНК из одной клетки в другую. У кишечной палочки имеется молекула ДНК, которая называется Fфактор (fertility factor - фактор плодовитости). Молекула F-фактора способна встроиться в геномную ДНК. В F-факторе кодируется специальный белок, который образует половые ворсинки, они называются F-пили. Эти самые ворсинки прикрепляются к другой клетке, которые F-фактор не содержат, и F-фактор инициирует репликацию. В процессе репликации образуется две копии молекулы ДНК, причем одна копия остается в исходной клетке, а вторая копия переносится в другую клетку. То есть, генетическая информация из одной клетки попадает в другую.
 Особенности конъюгации n n n Существует три типа клеток-доноров: F+ (эф–плюс), Hfr (эйч–эф–а) и F′ (эф–штрих). F+ -доноры содержат в цитоплазме половой фактор – специфическую F–плазмиду. F–плазмида – это автономный репликон длиной около 100 т. н. п. В составе F–плазмиды изучено более 20 генов. Примерно половина из них образует гигантский оперон tra (длиной около 30 т. н. п. ); продукты этого оперона контролируют образование контакта между донором и реципиентом и собственно перенос ДНК. Остальные гены регулируют работу tra–оперона. Клетка-реципиент не содержит F–плазмиды и обозначается как F– –клетка. Донорские клетки, имеющие встроенный в хромосому F -фактор, называются Hfr клетками (от англ. «высокая частота рекомбинаций» ). В зависимости от условий возможен полный или частичный перенос копии бактериальной хромосомы Hfr–донора в цитоплазму реципиента. В результате образуется клетка с одной исходной двунитевой бактериальной хромосомой и одной полной или неполной гомологичной однонитевой молекулой ДНК. Такая клетка называется мерозигота ( «частичная зигота» ). Хромосомная ДНК реплицируется, одна цепь копии хромосомы переносится в реципиентную F - -клетку, тогда как другая остается в Hfr + -клетке, т. е. донор сохраняет свое генетическое постоянство. Однако существуют штаммы бактерий, у которых копия бактериальной хромосомы вместе с копией F–плазмидной ДНК переносится полностью. Такие клетки называются v. Hfr–доноры (от англ. «очень высокая частота рекомбинаций» ). F–плазмида может переходить из интегрированного состояния в автономное путем самовырезания из бактериальной хромосомы. В этом случае возможен захват и части хромосомной ДНК (до 50 % хромосомных генов). F–плазмида, включающая хромосомные гены, называется F′ –фактором. Перенос генетического материала при скрещиваниях F′ × F– называется сексдукция.
Особенности конъюгации n n n Существует три типа клеток-доноров: F+ (эф–плюс), Hfr (эйч–эф–а) и F′ (эф–штрих). F+ -доноры содержат в цитоплазме половой фактор – специфическую F–плазмиду. F–плазмида – это автономный репликон длиной около 100 т. н. п. В составе F–плазмиды изучено более 20 генов. Примерно половина из них образует гигантский оперон tra (длиной около 30 т. н. п. ); продукты этого оперона контролируют образование контакта между донором и реципиентом и собственно перенос ДНК. Остальные гены регулируют работу tra–оперона. Клетка-реципиент не содержит F–плазмиды и обозначается как F– –клетка. Донорские клетки, имеющие встроенный в хромосому F -фактор, называются Hfr клетками (от англ. «высокая частота рекомбинаций» ). В зависимости от условий возможен полный или частичный перенос копии бактериальной хромосомы Hfr–донора в цитоплазму реципиента. В результате образуется клетка с одной исходной двунитевой бактериальной хромосомой и одной полной или неполной гомологичной однонитевой молекулой ДНК. Такая клетка называется мерозигота ( «частичная зигота» ). Хромосомная ДНК реплицируется, одна цепь копии хромосомы переносится в реципиентную F - -клетку, тогда как другая остается в Hfr + -клетке, т. е. донор сохраняет свое генетическое постоянство. Однако существуют штаммы бактерий, у которых копия бактериальной хромосомы вместе с копией F–плазмидной ДНК переносится полностью. Такие клетки называются v. Hfr–доноры (от англ. «очень высокая частота рекомбинаций» ). F–плазмида может переходить из интегрированного состояния в автономное путем самовырезания из бактериальной хромосомы. В этом случае возможен захват и части хромосомной ДНК (до 50 % хромосомных генов). F–плазмида, включающая хромосомные гены, называется F′ –фактором. Перенос генетического материала при скрещиваниях F′ × F– называется сексдукция.
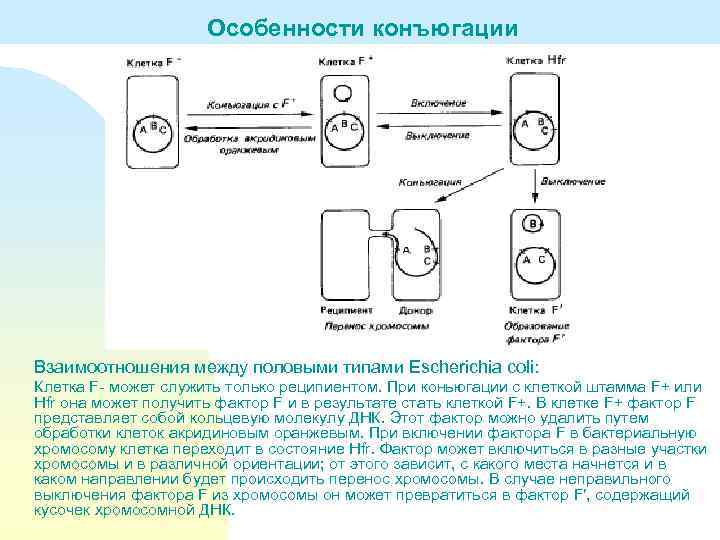 Особенности конъюгации Взаимоотношения между половыми типами Escherichia coli: Клетка F- может служить только реципиентом. При коньюгации с клеткой штамма F+ или Hfr она может получить фактор F и в результате стать клеткой F+. В клетке F+ фактор F представляет собой кольцевую молекулу ДНК. Этот фактор можно удалить путем обработки клеток акридиновым оранжевым. При включении фактора F в бактериальную хромосому клетка переходит в состояние Hfr. Фактор может включиться в разные участки хромосомы и в различной ориентации; от этого зависит, с какого места начнется и в каком направлении будет происходить перенос хромосомы. В случае неправильного выключения фактора F из хромосомы он может превратиться в фактор F′, содержащий кусочек хромосомной ДНК.
Особенности конъюгации Взаимоотношения между половыми типами Escherichia coli: Клетка F- может служить только реципиентом. При коньюгации с клеткой штамма F+ или Hfr она может получить фактор F и в результате стать клеткой F+. В клетке F+ фактор F представляет собой кольцевую молекулу ДНК. Этот фактор можно удалить путем обработки клеток акридиновым оранжевым. При включении фактора F в бактериальную хромосому клетка переходит в состояние Hfr. Фактор может включиться в разные участки хромосомы и в различной ориентации; от этого зависит, с какого места начнется и в каком направлении будет происходить перенос хромосомы. В случае неправильного выключения фактора F из хромосомы он может превратиться в фактор F′, содержащий кусочек хромосомной ДНК.
 Стадии конъюгации n n n Передача генетического материала при конъюгации начинается с расщепления ДНК в районе локализации F -фактора. Одна нить донорской ДНК передается через конъюгационный мостик в клетку-реципиент. Процесс сопровождается достраиванием комплементарной нити до образования двунитевой структуры. Переданная в реципиентную клетку и достроенная до двунитевой структуры, нить ДНК рекомбинирует с гомологичным участком реципиентной ДНК с образованием стабильной генетической структуры.
Стадии конъюгации n n n Передача генетического материала при конъюгации начинается с расщепления ДНК в районе локализации F -фактора. Одна нить донорской ДНК передается через конъюгационный мостик в клетку-реципиент. Процесс сопровождается достраиванием комплементарной нити до образования двунитевой структуры. Переданная в реципиентную клетку и достроенная до двунитевой структуры, нить ДНК рекомбинирует с гомологичным участком реципиентной ДНК с образованием стабильной генетической структуры.
 Стадии конъюгации n n При образовании цитоплазматического мостика одна из цепей F–плазмиды надрезается в определенной точке (точка О), а на комплементарной цепи начинается репликация ДНК по принципу «катящегося кольца» . Копия комплементарной цепи по цитоплазматическому мостику переходит в цитоплазму клетки–реципиента, и на ней достраивается недостающая цепь. После окончания репликации двунитевая плазмидная ДНК замыкается в кольцо, и F– –клетка превращается в F+ –клетку. Полное время переноса копии F–плазмиды в клетку–реципиент составляет примерно 5 минут. Однако при скрещивании F+ × F– в клетку–реципиент попадают только гены, содержащиеся в F–плазмиде; гены домашнего хозяйства, локализованные в бактериальной хромосоме, в клетку–реципиент не переносятся. Перенос копии ДНК начинается примерно с середины F–плазмидной ДНК (с точки О, в которой одна из цепей ДНК надрезается, и начинается репликация F–плазмидной ДНК). Таким образом, половина F–плазмидной ДНК проникает в клетку–реципиент в начале конъюгации, а вторая половина – только после полного переноса копии хромосомной ДНК. Для полного завершения этого процесса при t = 37 0 С требуется более 100 минут. Однако в природных условиях конъюгация прерывается значительно раньше, в клетку–реципиент переходит только часть копии хромосомы донора и только первая половина F– плазмидной ДНК. Таким образом, клетка-реципиент не принимает свойства Hfr–донора. Вероятность переноса определенного гена в клетку–реципиент зависит от его удаления от F–плазмидной ДНК, а точнее, от точки О, в которой начинается репликация F– плазмидной ДНК. Чем больше время конъюгации, тем выше вероятность переноса данного гена. Это дает возможность составить генетическую карту бактерий в минутах конъюгации. Например, у кишечной палочки ген thr (оперон из трех генов, контролирующих биосинтез треонина) находится в нулевой точке (то есть непосредственно рядом с F–плазмидной ДНК), ген lac переносится через 8 мин, ген rec. E – через 30 мин, ген arg. R – через 70 мин и т. д.
Стадии конъюгации n n При образовании цитоплазматического мостика одна из цепей F–плазмиды надрезается в определенной точке (точка О), а на комплементарной цепи начинается репликация ДНК по принципу «катящегося кольца» . Копия комплементарной цепи по цитоплазматическому мостику переходит в цитоплазму клетки–реципиента, и на ней достраивается недостающая цепь. После окончания репликации двунитевая плазмидная ДНК замыкается в кольцо, и F– –клетка превращается в F+ –клетку. Полное время переноса копии F–плазмиды в клетку–реципиент составляет примерно 5 минут. Однако при скрещивании F+ × F– в клетку–реципиент попадают только гены, содержащиеся в F–плазмиде; гены домашнего хозяйства, локализованные в бактериальной хромосоме, в клетку–реципиент не переносятся. Перенос копии ДНК начинается примерно с середины F–плазмидной ДНК (с точки О, в которой одна из цепей ДНК надрезается, и начинается репликация F–плазмидной ДНК). Таким образом, половина F–плазмидной ДНК проникает в клетку–реципиент в начале конъюгации, а вторая половина – только после полного переноса копии хромосомной ДНК. Для полного завершения этого процесса при t = 37 0 С требуется более 100 минут. Однако в природных условиях конъюгация прерывается значительно раньше, в клетку–реципиент переходит только часть копии хромосомы донора и только первая половина F– плазмидной ДНК. Таким образом, клетка-реципиент не принимает свойства Hfr–донора. Вероятность переноса определенного гена в клетку–реципиент зависит от его удаления от F–плазмидной ДНК, а точнее, от точки О, в которой начинается репликация F– плазмидной ДНК. Чем больше время конъюгации, тем выше вероятность переноса данного гена. Это дает возможность составить генетическую карту бактерий в минутах конъюгации. Например, у кишечной палочки ген thr (оперон из трех генов, контролирующих биосинтез треонина) находится в нулевой точке (то есть непосредственно рядом с F–плазмидной ДНК), ген lac переносится через 8 мин, ген rec. E – через 30 мин, ген arg. R – через 70 мин и т. д.
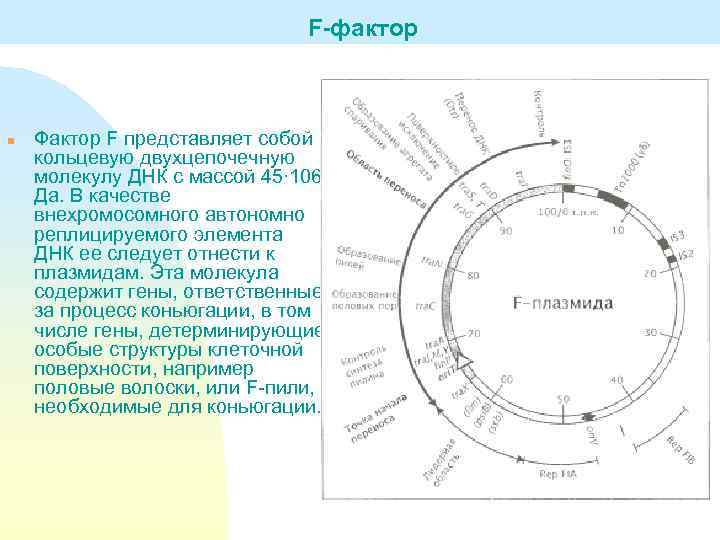 F-фактор n Фактор F представляет собой кольцевую двухцепочечную молекулу ДНК с массой 45∙ 106 Да. В качестве внехромосомного автономно реплицируемого элемента ДНК ее следует отнести к плазмидам. Эта молекула содержит гены, ответственные за процесс коньюгации, в том числе гены, детерминирующие особые структуры клеточной поверхности, например половые волоски, или F-пили, необходимые для коньюгации.
F-фактор n Фактор F представляет собой кольцевую двухцепочечную молекулу ДНК с массой 45∙ 106 Да. В качестве внехромосомного автономно реплицируемого элемента ДНК ее следует отнести к плазмидам. Эта молекула содержит гены, ответственные за процесс коньюгации, в том числе гены, детерминирующие особые структуры клеточной поверхности, например половые волоски, или F-пили, необходимые для коньюгации.
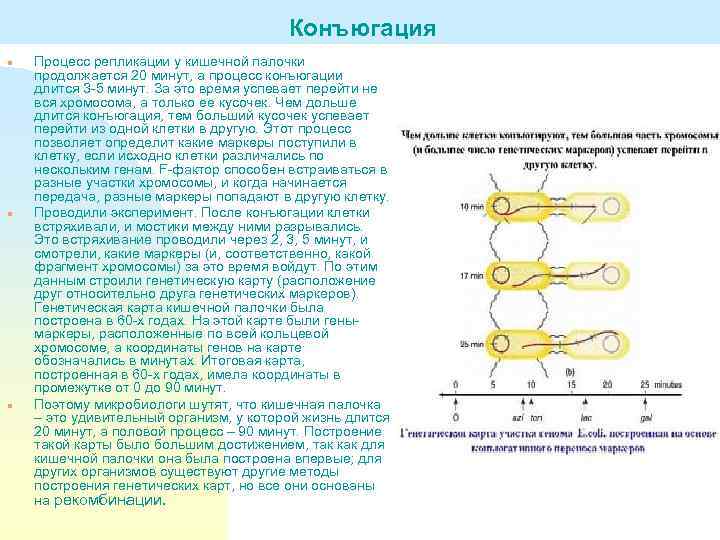 Конъюгация n n n Процесс репликации у кишечной палочки продолжается 20 минут, а процесс конъюгации длится 3 -5 минут. За это время успевает перейти не вся хромосома, а только ее кусочек. Чем дольше длится конъюгация, тем больший кусочек успевает перейти из одной клетки в другую. Этот процесс позволяет определит какие маркеры поступили в клетку, если исходно клетки различались по нескольким генам. F-фактор способен встраиваться в разные участки хромосомы, и когда начинается передача, разные маркеры попадают в другую клетку. Проводили эксперимент. После конъюгации клетки встряхивали, и мостики между ними разрывались. Это встряхивание проводили через 2, 3, 5 минут, и смотрели, какие маркеры (и, соответственно, какой фрагмент хромосомы) за это время войдут. По этим данным строили генетическую карту (расположение друг относительно друга генетических маркеров). Генетическая карта кишечной палочки была построена в 60 -х годах. На этой карте были генымаркеры, расположенные по всей кольцевой хромосоме, а координаты генов на карте обозначались в минутах. Итоговая карта, построенная в 60 -х годах, имела координаты в промежутке от 0 до 90 минут. Поэтому микробиологи шутят, что кишечная палочка – это удивительный организм, у которой жизнь длится 20 минут, а половой процесс – 90 минут. Построение такой карты было большим достижением, так как для кишечной палочки она была построена впервые; для других организмов существуют другие методы построения генетических карт, но все они основаны на рекомбинации.
Конъюгация n n n Процесс репликации у кишечной палочки продолжается 20 минут, а процесс конъюгации длится 3 -5 минут. За это время успевает перейти не вся хромосома, а только ее кусочек. Чем дольше длится конъюгация, тем больший кусочек успевает перейти из одной клетки в другую. Этот процесс позволяет определит какие маркеры поступили в клетку, если исходно клетки различались по нескольким генам. F-фактор способен встраиваться в разные участки хромосомы, и когда начинается передача, разные маркеры попадают в другую клетку. Проводили эксперимент. После конъюгации клетки встряхивали, и мостики между ними разрывались. Это встряхивание проводили через 2, 3, 5 минут, и смотрели, какие маркеры (и, соответственно, какой фрагмент хромосомы) за это время войдут. По этим данным строили генетическую карту (расположение друг относительно друга генетических маркеров). Генетическая карта кишечной палочки была построена в 60 -х годах. На этой карте были генымаркеры, расположенные по всей кольцевой хромосоме, а координаты генов на карте обозначались в минутах. Итоговая карта, построенная в 60 -х годах, имела координаты в промежутке от 0 до 90 минут. Поэтому микробиологи шутят, что кишечная палочка – это удивительный организм, у которой жизнь длится 20 минут, а половой процесс – 90 минут. Построение такой карты было большим достижением, так как для кишечной палочки она была построена впервые; для других организмов существуют другие методы построения генетических карт, но все они основаны на рекомбинации.
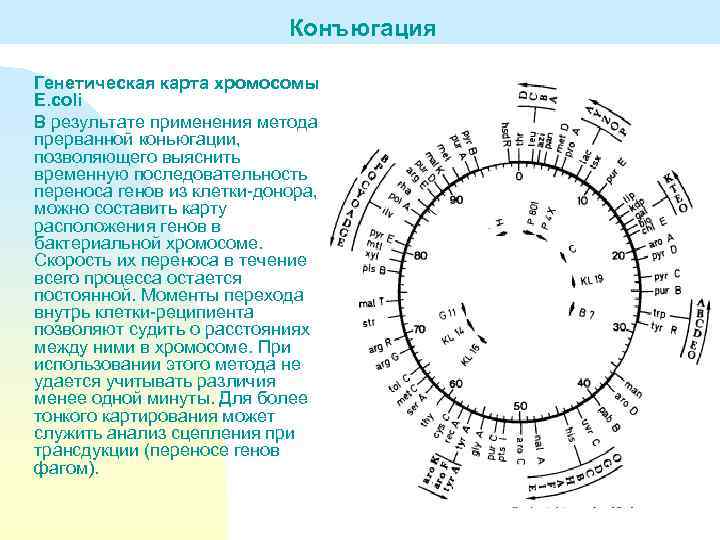 Конъюгация Генетическая карта хромосомы E. coli В результате применения метода прерванной коньюгации, позволяющего выяснить временную последовательность переноса генов из клетки-донора, можно составить карту расположения генов в бактериальной хромосоме. Скорость их переноса в течение всего процесса остается постоянной. Моменты перехода внутрь клетки-реципиента позволяют судить о расстояниях между ними в хромосоме. При использовании этого метода не удается учитывать различия менее одной минуты. Для более тонкого картирования может служить анализ сцепления при трансдукции (переносе генов фагом).
Конъюгация Генетическая карта хромосомы E. coli В результате применения метода прерванной коньюгации, позволяющего выяснить временную последовательность переноса генов из клетки-донора, можно составить карту расположения генов в бактериальной хромосоме. Скорость их переноса в течение всего процесса остается постоянной. Моменты перехода внутрь клетки-реципиента позволяют судить о расстояниях между ними в хромосоме. При использовании этого метода не удается учитывать различия менее одной минуты. Для более тонкого картирования может служить анализ сцепления при трансдукции (переносе генов фагом).
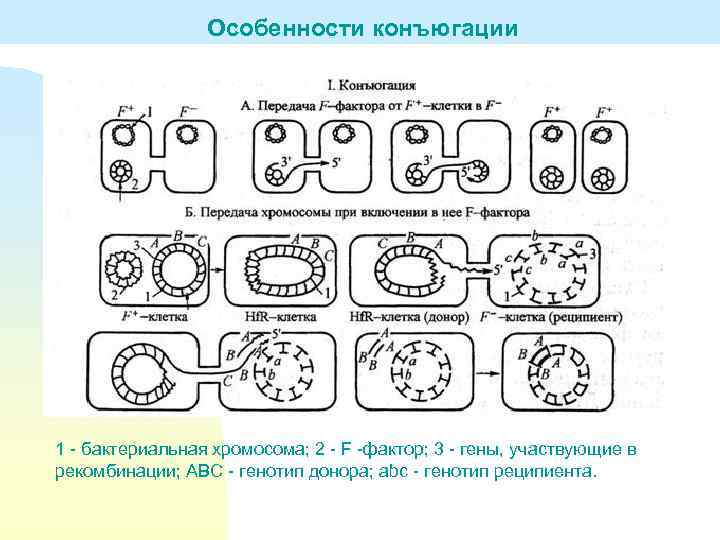 Особенности конъюгации 1 - бактериальная хромосома; 2 - F -фактор; 3 - гены, участвующие в рекомбинации; АВС - генотип донора; abc - генотип реципиента.
Особенности конъюгации 1 - бактериальная хромосома; 2 - F -фактор; 3 - гены, участвующие в рекомбинации; АВС - генотип донора; abc - генотип реципиента.
 Стадии конъюгации Механизм переноса конъюгативных плазмид 1. Образование и стабилизацию межклеточного контакта; 2. Сайт-спецефическое разрезание в точке начала переноса одной из цепей молекулы ДНК; 3. Раскручивание ДНК и перенос разрезанной цепи с 5’ конца в клетку - реципиент с одновременным заменяющим синтезом ДНК в донорной клетке посредством механизма катящегося кольца; 4. Рециркуляризация перенесенной отдельной цепи ДНК; 5. Синтез комплементарной цепи в клеткереципиенте и восстановление сверхспирализации плазмидной ДНК; 6. Расхождение клеток.
Стадии конъюгации Механизм переноса конъюгативных плазмид 1. Образование и стабилизацию межклеточного контакта; 2. Сайт-спецефическое разрезание в точке начала переноса одной из цепей молекулы ДНК; 3. Раскручивание ДНК и перенос разрезанной цепи с 5’ конца в клетку - реципиент с одновременным заменяющим синтезом ДНК в донорной клетке посредством механизма катящегося кольца; 4. Рециркуляризация перенесенной отдельной цепи ДНК; 5. Синтез комплементарной цепи в клеткереципиенте и восстановление сверхспирализации плазмидной ДНК; 6. Расхождение клеток.
 Конъюгация n n n Кроме F–плазмиды у прокариот известны и другие типы половых факторов (R, Ent, Hly, Col), обеспечивающих перенос генетического материала от бактерии к бактерии. На основе природных плазмид (в том числе ДНК хлоропластов и митохондрий) получены полусинтетические молекулы ДНК, обеспечивающие перенос генетического материала из одной клетки в другую, называются векторы. Векторы должны обеспечивать не только устойчивый перенос генов, но и регуляцию их транскрипции. Прокариотические плазмиды могут реплицироваться только в прокариотических клетках. В то же время, существует необходимость переноса генов от эукариот к прокариотам и наоборот. Для этого используются челночные плазмиды, которые содержат два репликатора (прокариотический и эукариотический) и способны реплицироваться и в прокариотических, и в эукариотических клетках, например, Ti– и Ri–плазмиды, способные к репликации в прокариотических и растительных клетках, и полусинтетические векторы, созданные на их основе. Для защиты векторов от разрушения нуклеазами их заключают в фосфолипидные пузырьки – липосомы. Биологическая значимость конъюгации хорошо видна на примере распространения резистентности бактерий к антибиотикам. Устойчивость к антибиотикам бактерия может получить в результате мутации, что происходит 1 раз на каждые 10 6 клеточных делений. Однако, однажды изменившись, генетическая информация может быстро распространяться среди сходных бактерий посредством конъюгации, поскольку каждая третья из близкородственных бактерий способна именно к этому типу генетического переноса.
Конъюгация n n n Кроме F–плазмиды у прокариот известны и другие типы половых факторов (R, Ent, Hly, Col), обеспечивающих перенос генетического материала от бактерии к бактерии. На основе природных плазмид (в том числе ДНК хлоропластов и митохондрий) получены полусинтетические молекулы ДНК, обеспечивающие перенос генетического материала из одной клетки в другую, называются векторы. Векторы должны обеспечивать не только устойчивый перенос генов, но и регуляцию их транскрипции. Прокариотические плазмиды могут реплицироваться только в прокариотических клетках. В то же время, существует необходимость переноса генов от эукариот к прокариотам и наоборот. Для этого используются челночные плазмиды, которые содержат два репликатора (прокариотический и эукариотический) и способны реплицироваться и в прокариотических, и в эукариотических клетках, например, Ti– и Ri–плазмиды, способные к репликации в прокариотических и растительных клетках, и полусинтетические векторы, созданные на их основе. Для защиты векторов от разрушения нуклеазами их заключают в фосфолипидные пузырьки – липосомы. Биологическая значимость конъюгации хорошо видна на примере распространения резистентности бактерий к антибиотикам. Устойчивость к антибиотикам бактерия может получить в результате мутации, что происходит 1 раз на каждые 10 6 клеточных делений. Однако, однажды изменившись, генетическая информация может быстро распространяться среди сходных бактерий посредством конъюгации, поскольку каждая третья из близкородственных бактерий способна именно к этому типу генетического переноса.
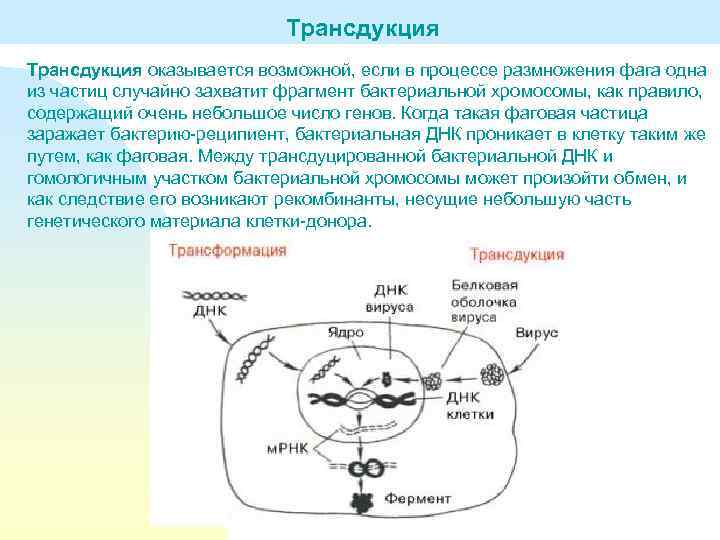 Трансдукция оказывается возможной, если в процессе размножения фага одна из частиц случайно захватит фрагмент бактериальной хромосомы, как правило, содержащий очень небольшое число генов. Когда такая фаговая частица заражает бактерию-реципиент, бактериальная ДНК проникает в клетку таким же путем, как фаговая. Между трансдуцированной бактериальной ДНК и гомологичным участком бактериальной хромосомы может произойти обмен, и как следствие его возникают рекомбинанты, несущие небольшую часть генетического материала клетки-донора.
Трансдукция оказывается возможной, если в процессе размножения фага одна из частиц случайно захватит фрагмент бактериальной хромосомы, как правило, содержащий очень небольшое число генов. Когда такая фаговая частица заражает бактерию-реципиент, бактериальная ДНК проникает в клетку таким же путем, как фаговая. Между трансдуцированной бактериальной ДНК и гомологичным участком бактериальной хромосомы может произойти обмен, и как следствие его возникают рекомбинанты, несущие небольшую часть генетического материала клетки-донора.
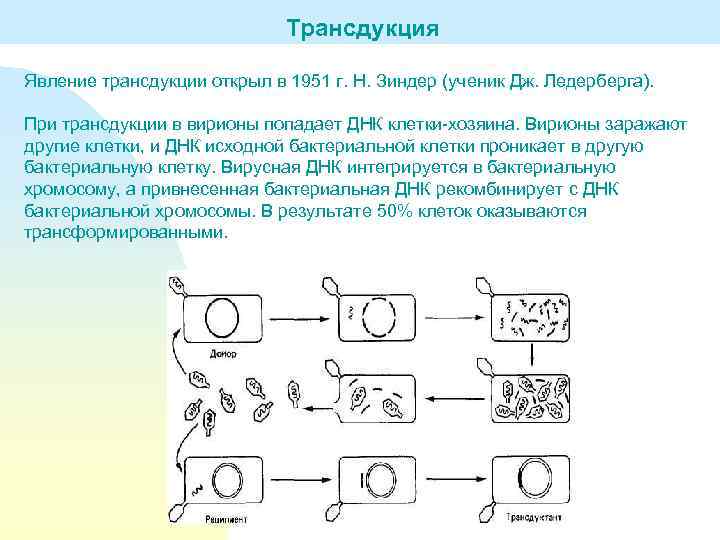 Трансдукция Явление трансдукции открыл в 1951 г. Н. Зиндер (ученик Дж. Ледерберга). При трансдукции в вирионы попадает ДНК клетки-хозяина. Вирионы заражают другие клетки, и ДНК исходной бактериальной клетки проникает в другую бактериальную клетку. Вирусная ДНК интегрируется в бактериальную хромосому, а привнесенная бактериальная ДНК рекомбинирует с ДНК бактериальной хромосомы. В результате 50% клеток оказываются трансформированными.
Трансдукция Явление трансдукции открыл в 1951 г. Н. Зиндер (ученик Дж. Ледерберга). При трансдукции в вирионы попадает ДНК клетки-хозяина. Вирионы заражают другие клетки, и ДНК исходной бактериальной клетки проникает в другую бактериальную клетку. Вирусная ДНК интегрируется в бактериальную хромосому, а привнесенная бактериальная ДНК рекомбинирует с ДНК бактериальной хромосомы. В результате 50% клеток оказываются трансформированными.
 Виды трансдукции n n n n Различают общую (неспецифическую), ограниченную (специфическую) и абортивную трансдукцию. Общая трансдукция При общей трансдукции фрагменты бактериальной ДНК донора случайно включаются в созревающую фаговую частицу вместе с фаговой ДНК или вместо фаговой ДНК. Фрагменты бактериальной ДНК образуются при ее разрезании ферментом, контролируемым фагом. В состав фаговой частицы может включаться до 100 бактериальных генов. Ограниченная трансдукция При ограниченной трансдукции происходит рекомбинация – бактериальная ДНК замещает часть фаговой ДНК. В состав рекомбинантной ДНК входит небольшое количество бактериальных генов, прилежащих к фаговой ДНК, интегрированной в бактериальную хромосому. При общей и ограниченной трансдукции донорская ДНК замещает гомологичные участки ДНК реципиента. Этот процесс сходен с трансформацией. Абортивная трансдукция может быть и неспецифической, и специфической. Ее сущность заключается в том, что трансдуцируемый фагом фрагмент ДНК не включается в хромосому реципиента, а существует как цитоплазматический репликон, который потом утрачивается.
Виды трансдукции n n n n Различают общую (неспецифическую), ограниченную (специфическую) и абортивную трансдукцию. Общая трансдукция При общей трансдукции фрагменты бактериальной ДНК донора случайно включаются в созревающую фаговую частицу вместе с фаговой ДНК или вместо фаговой ДНК. Фрагменты бактериальной ДНК образуются при ее разрезании ферментом, контролируемым фагом. В состав фаговой частицы может включаться до 100 бактериальных генов. Ограниченная трансдукция При ограниченной трансдукции происходит рекомбинация – бактериальная ДНК замещает часть фаговой ДНК. В состав рекомбинантной ДНК входит небольшое количество бактериальных генов, прилежащих к фаговой ДНК, интегрированной в бактериальную хромосому. При общей и ограниченной трансдукции донорская ДНК замещает гомологичные участки ДНК реципиента. Этот процесс сходен с трансформацией. Абортивная трансдукция может быть и неспецифической, и специфической. Ее сущность заключается в том, что трансдуцируемый фагом фрагмент ДНК не включается в хромосому реципиента, а существует как цитоплазматический репликон, который потом утрачивается.
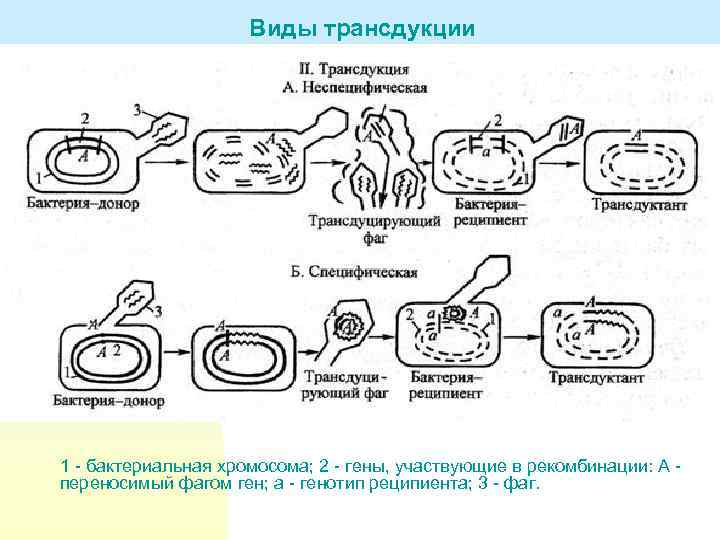 Виды трансдукции 1 - бактериальная хромосома; 2 - гены, участвующие в рекомбинации: А - переносимый фагом ген; а - генотип реципиента; 3 - фаг.
Виды трансдукции 1 - бактериальная хромосома; 2 - гены, участвующие в рекомбинации: А - переносимый фагом ген; а - генотип реципиента; 3 - фаг.
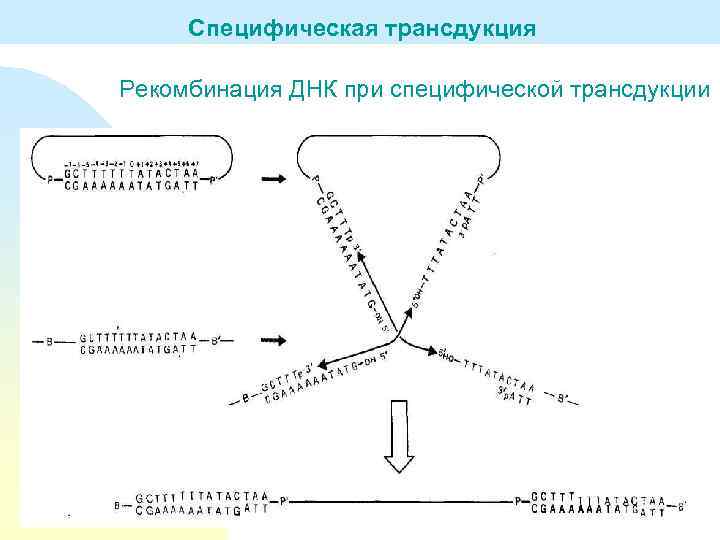 Специфическая трансдукция Рекомбинация ДНК при специфической трансдукции
Специфическая трансдукция Рекомбинация ДНК при специфической трансдукции
 Возможности трансдукции Феномен неспецифической трансдукции может быть использован для картирования бактериальной хромосомы. Явление трансдукции вирусами широко используется при переносе генов у эукариот. Если применяется вирус, неспособный формировать капсид (то есть существующий только в форме ДНК), то трансдукция принципиально не отличается от трансформации или от конъюгативного переноса генетического материала с помощью плазмид–векторов. Созданы системы векторов на основе модифицированных вирусов SV 40 (они образуют в клетке до 100 тысяч копий), герпеса, осповакцины, вирус мозаики цветной капусты.
Возможности трансдукции Феномен неспецифической трансдукции может быть использован для картирования бактериальной хромосомы. Явление трансдукции вирусами широко используется при переносе генов у эукариот. Если применяется вирус, неспособный формировать капсид (то есть существующий только в форме ДНК), то трансдукция принципиально не отличается от трансформации или от конъюгативного переноса генетического материала с помощью плазмид–векторов. Созданы системы векторов на основе модифицированных вирусов SV 40 (они образуют в клетке до 100 тысяч копий), герпеса, осповакцины, вирус мозаики цветной капусты.


