ХОС_лекция5.pptx
- Количество слайдов: 41
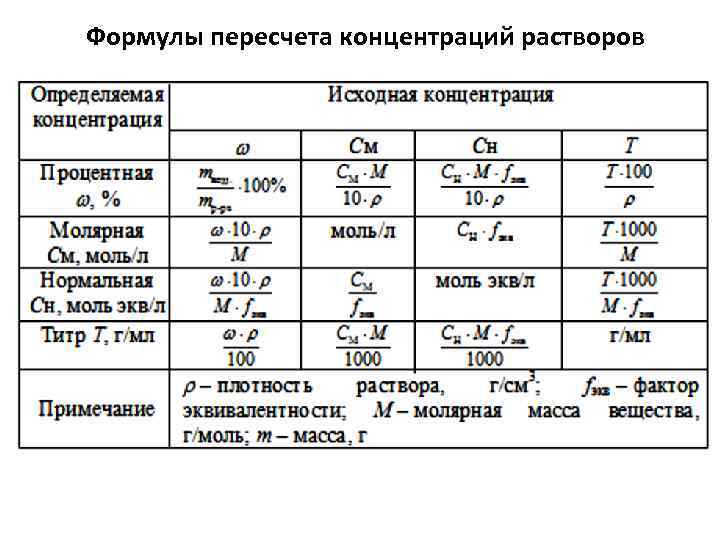 Формулы пересчета концентраций растворов
Формулы пересчета концентраций растворов
 Молярность и молярные растворы. Наиболее часто используемой концентрацией химических веществ в водных растворах является молярность — число молей растворенного вещества в литре раствора. Количество частей на миллион. Для описания очень разбавленных растворов обычно концентрацию выражают как количество частей на миллион. Рассмотрим питьевую воду, в которой концентрация растворенного свинца равна 1 ррт. ЭТО означает, что одна часть свинца содержится в 1 миллионе частей воды. Части можно выражать в любых единицах массы (в том числе, в унциях, тоннах, микрограммах), но при этом для растворенного вещества и растворителя необходимо использовать одни и те же единицы.
Молярность и молярные растворы. Наиболее часто используемой концентрацией химических веществ в водных растворах является молярность — число молей растворенного вещества в литре раствора. Количество частей на миллион. Для описания очень разбавленных растворов обычно концентрацию выражают как количество частей на миллион. Рассмотрим питьевую воду, в которой концентрация растворенного свинца равна 1 ррт. ЭТО означает, что одна часть свинца содержится в 1 миллионе частей воды. Части можно выражать в любых единицах массы (в том числе, в унциях, тоннах, микрограммах), но при этом для растворенного вещества и растворителя необходимо использовать одни и те же единицы.
 Количество частей на миллиард. Для определенных растворов, например образцов воды, содержащих ультрамалые примеси загрязняющих веществ, часто удобнее выражать концентрацию в величинах ppb, а не в единицах ррm. Таким образом, 1 ppb = 1 мкг/л. Агентство по защите окружающей среды США установило предельно допу стимую концентрацию свинца в окружающей среде, равную 15 ppb. Анализ образца воды из фонтана, проведенный в лаборатории, показал значение концентрации свинца, равное 18 мкг/100 мл. Превышает ли это значение предельно допустимую концентрацию или нет? На сколько превышает? Дана концентрация свинца в образце: Чтобы перевести эту концентрацию в мкг/л (ppb), умножим числитель и знаменатель на 10, чтобы в знаменателе оказалось 1000 мл (1 л): Это значение превышает предельно допустимую концентрацию, равную 15 ppb. На сколько превышает? 180 15 = 165 ppb. Концентрация свинца в образце воды, равная 180 ppb, превышает предельно допустимую концентрацию на 165 ppb.
Количество частей на миллиард. Для определенных растворов, например образцов воды, содержащих ультрамалые примеси загрязняющих веществ, часто удобнее выражать концентрацию в величинах ppb, а не в единицах ррm. Таким образом, 1 ppb = 1 мкг/л. Агентство по защите окружающей среды США установило предельно допу стимую концентрацию свинца в окружающей среде, равную 15 ppb. Анализ образца воды из фонтана, проведенный в лаборатории, показал значение концентрации свинца, равное 18 мкг/100 мл. Превышает ли это значение предельно допустимую концентрацию или нет? На сколько превышает? Дана концентрация свинца в образце: Чтобы перевести эту концентрацию в мкг/л (ppb), умножим числитель и знаменатель на 10, чтобы в знаменателе оказалось 1000 мл (1 л): Это значение превышает предельно допустимую концентрацию, равную 15 ppb. На сколько превышает? 180 15 = 165 ppb. Концентрация свинца в образце воды, равная 180 ppb, превышает предельно допустимую концентрацию на 165 ppb.
 Человек на 90% состоит из воды. На планете 1400 109 км 3 воды, и только 3% из этого количества – пресная вода. Пресная вода состоит из: - 75, 35% - льды - 22, 14% - грунтовые воды - 0, 0357% - атмосферная влага (мало, но вода – важнейший парниковый газ) - 0, 32% - озера - 0, 01 -0, 00357% - устойчивый сток рек.
Человек на 90% состоит из воды. На планете 1400 109 км 3 воды, и только 3% из этого количества – пресная вода. Пресная вода состоит из: - 75, 35% - льды - 22, 14% - грунтовые воды - 0, 0357% - атмосферная влага (мало, но вода – важнейший парниковый газ) - 0, 32% - озера - 0, 01 -0, 00357% - устойчивый сток рек.

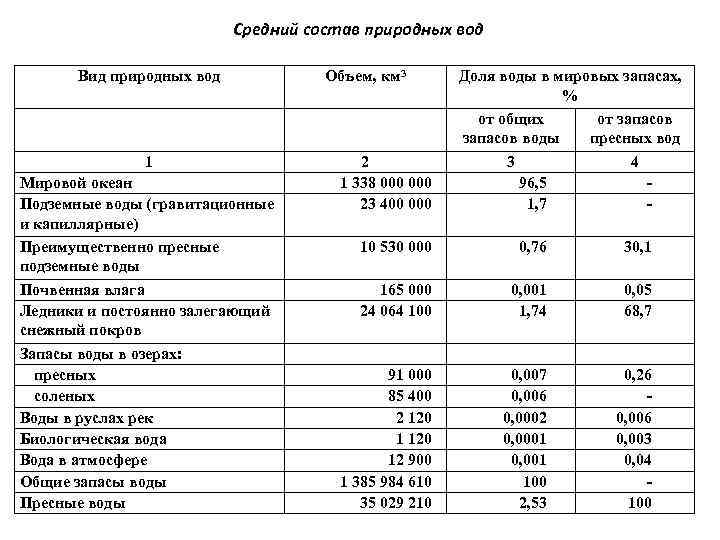 Средний состав природных вод Вид природных вод Объем, км 3 1 Мировой океан Подземные воды (гравитационные и капиллярные) Преимущественно пресные подземные воды Почвенная влага Ледники и постоянно залегающий снежный покров Запасы воды в озерах: пресных соленых Воды в руслах рек Биологическая вода Вода в атмосфере Общие запасы воды Пресные воды 2 1 338 000 23 400 000 Доля воды в мировых запасах, % от общих от запасов воды пресных вод 3 4 96, 5 1, 7 - 10 530 000 0, 76 30, 1 165 000 24 064 100 0, 001 1, 74 0, 05 68, 7 91 000 85 400 2 120 12 900 1 385 984 610 35 029 210 0, 007 0, 006 0, 0002 0, 0001 0, 001 100 2, 53 0, 26 0, 003 0, 04 100
Средний состав природных вод Вид природных вод Объем, км 3 1 Мировой океан Подземные воды (гравитационные и капиллярные) Преимущественно пресные подземные воды Почвенная влага Ледники и постоянно залегающий снежный покров Запасы воды в озерах: пресных соленых Воды в руслах рек Биологическая вода Вода в атмосфере Общие запасы воды Пресные воды 2 1 338 000 23 400 000 Доля воды в мировых запасах, % от общих от запасов воды пресных вод 3 4 96, 5 1, 7 - 10 530 000 0, 76 30, 1 165 000 24 064 100 0, 001 1, 74 0, 05 68, 7 91 000 85 400 2 120 12 900 1 385 984 610 35 029 210 0, 007 0, 006 0, 0002 0, 0001 0, 001 100 2, 53 0, 26 0, 003 0, 04 100
 Содержание основных ионов в пробе поверхностных вод (концентрация растворенного углекислого газа -1080 мг/л) Компоненты Содержание в растворе мг/л мг экв %экв HCO 3 - 1000 16, 39 89 SO 42 Cl. FИтого основные анионы 73 12 3, 2 1088 1, 52 0, 34 0, 17 18, 42 8 2 1 100 Na+ Ca 2+ Mg 2+ K+ Итого основные катионы 229 110 32 4 375 9, 96 5, 49 2, 63 0, 10 18, 18 55 30 14 1 100
Содержание основных ионов в пробе поверхностных вод (концентрация растворенного углекислого газа -1080 мг/л) Компоненты Содержание в растворе мг/л мг экв %экв HCO 3 - 1000 16, 39 89 SO 42 Cl. FИтого основные анионы 73 12 3, 2 1088 1, 52 0, 34 0, 17 18, 42 8 2 1 100 Na+ Ca 2+ Mg 2+ K+ Итого основные катионы 229 110 32 4 375 9, 96 5, 49 2, 63 0, 10 18, 18 55 30 14 1 100

 • • • Химические показатели ионный состав Na+, K+, Ca 2+, Mg 2+ и анионами SO 42– , HCO 3–, Cl– содержание железа и марганца щелочность жесткость р. Н среды; вода хозяйственно питьевого назначения имеет р. Н = 6, 5– 8, 5 содержание растворенных газов О 2, СО 2, Н 2 S и др.
• • • Химические показатели ионный состав Na+, K+, Ca 2+, Mg 2+ и анионами SO 42– , HCO 3–, Cl– содержание железа и марганца щелочность жесткость р. Н среды; вода хозяйственно питьевого назначения имеет р. Н = 6, 5– 8, 5 содержание растворенных газов О 2, СО 2, Н 2 S и др.
 Воды классифицируются по солесодержанию следующим образом: 0, 2 г ультрапресная 0, 2 -0, 5 пресная 0, 5 -1 с относительно повышенной минерализацией 1 -3 солоноватая 3 -10 соленая 10 -35 с повышенной соленостью 35 -50 переходная к рассолам 50 -400 рассолы 400 в природе не существует Для питья человеком используется вода с солесодержанием до 1 г/л, иногда до 3 г/л, выше – опасно. Некоторые животные переносят более соленую воду – до 10 г/л, например, овцы и верблюды. Ультрапресную воду пить тоже нельзя – происходит вымывание солей кальция из организма.
Воды классифицируются по солесодержанию следующим образом: 0, 2 г ультрапресная 0, 2 -0, 5 пресная 0, 5 -1 с относительно повышенной минерализацией 1 -3 солоноватая 3 -10 соленая 10 -35 с повышенной соленостью 35 -50 переходная к рассолам 50 -400 рассолы 400 в природе не существует Для питья человеком используется вода с солесодержанием до 1 г/л, иногда до 3 г/л, выше – опасно. Некоторые животные переносят более соленую воду – до 10 г/л, например, овцы и верблюды. Ультрапресную воду пить тоже нельзя – происходит вымывание солей кальция из организма.


 Неорганические соединения углерода, находящиеся в природных водах в виде производных угольной кислоты, тесно взаимосвязаны друг с другом и об-разуют карбонатную систему.
Неорганические соединения углерода, находящиеся в природных водах в виде производных угольной кислоты, тесно взаимосвязаны друг с другом и об-разуют карбонатную систему.
 CO 2 CO 2 p + H 2 O H 2 CO 3 HCO 3 - Н+ + CO 32 Значение отрицательных логарифмов констант равновесия карбонатной системы при различных температурах Т°, С РКСО 2 PK 1 РК 2 РКН 2 О 0 6, 12 6, 58 10, 62 14, 93 5 6, 19 6, 52 10, 56 - 10 6, 27 6, 47 10, 49 - 20 6, 41 6, 38 10, 38 14, 17 25 6, 47 6, 35 10, 33 14, 00 40 6, 64 6. 30 10, 22 13, 70
CO 2 CO 2 p + H 2 O H 2 CO 3 HCO 3 - Н+ + CO 32 Значение отрицательных логарифмов констант равновесия карбонатной системы при различных температурах Т°, С РКСО 2 PK 1 РК 2 РКН 2 О 0 6, 12 6, 58 10, 62 14, 93 5 6, 19 6, 52 10, 56 - 10 6, 27 6, 47 10, 49 - 20 6, 41 6, 38 10, 38 14, 17 25 6, 47 6, 35 10, 33 14, 00 40 6, 64 6. 30 10, 22 13, 70
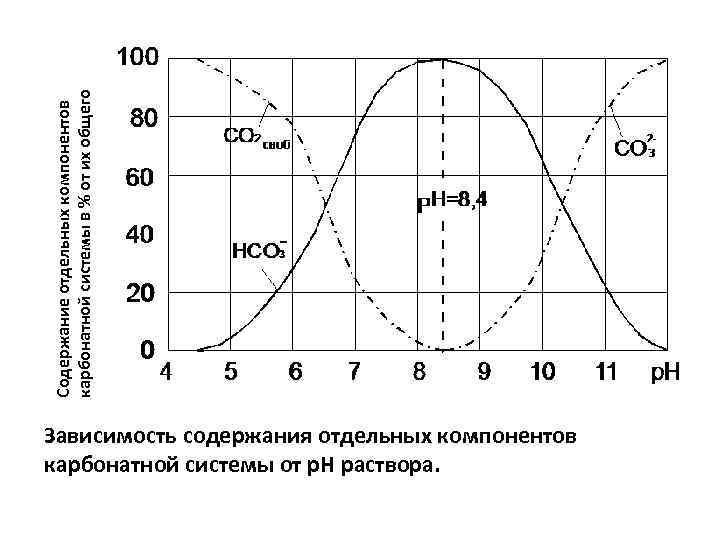 Содержание отдельных компонентов карбонатной системы в % от их общего Зависимость содержания отдельных компонентов карбонатной системы от р. Н раствора.
Содержание отдельных компонентов карбонатной системы в % от их общего Зависимость содержания отдельных компонентов карбонатной системы от р. Н раствора.

 Щелочность природных вод Таким образом, щелочность можно определить как сумму концентраций ионов гидрокарбоната, карбоната и гидроксила: где Що - общая щелочность воды, моль/л.
Щелочность природных вод Таким образом, щелочность можно определить как сумму концентраций ионов гидрокарбоната, карбоната и гидроксила: где Що - общая щелочность воды, моль/л.



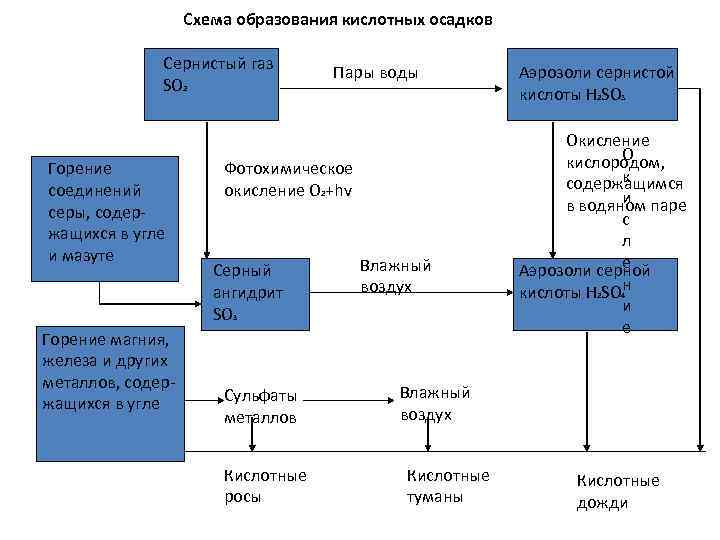 Схема образования кислотных осадков Сернистый газ SO 2 Горение соединений серы, содер жащихся в угле и мазуте Горение магния, железа и других металлов, содер жащихся в угле Пары воды Фотохимическое окисление О 2+hv Серный ангидрит SO 3 Сульфаты металлов Кислотные росы Влажный воздух Аэрозоли сернистой кислоты H 2 SO 3 Окисление О кислородом, к содержащимся и в водяном паре с л е Аэрозоли серной кислоты Н 2 SO 4 н и е Влажный воздух Кислотные туманы Кислотные дожди
Схема образования кислотных осадков Сернистый газ SO 2 Горение соединений серы, содер жащихся в угле и мазуте Горение магния, железа и других металлов, содер жащихся в угле Пары воды Фотохимическое окисление О 2+hv Серный ангидрит SO 3 Сульфаты металлов Кислотные росы Влажный воздух Аэрозоли сернистой кислоты H 2 SO 3 Окисление О кислородом, к содержащимся и в водяном паре с л е Аэрозоли серной кислоты Н 2 SO 4 н и е Влажный воздух Кислотные туманы Кислотные дожди

 Проблема тяжелых металлов в природных водах – накопление в трофических цепях. Самый яркий пример – болезнь Миномато (залив в Японском море, жители которого пострадали первыми). В залив впадает река, по берегам которой есть два завода – один производит ацетилен (использует ртуть как химический реагент), выбросов от него практически не было, второй завод занимался органическим синтезом, и тоже практически ничего не сбрасывал в реку (в микроколичествах присутствовали галоген-производные – CH 3 J). Когда металлическая ртуть и йод-метан попали в воду, то под воздействием микроорганизмов ртуть из нерастворимой формы и поэтому малоопасной формы перешла в Hg+ или Hg 2+, в результате образовалось растворимая форма – метил-ртуть (CH 3 Hg (I), CH 3 Hg+ (II)). Эти соединения поступили в залив, прошли по трофической цепи планктон – рыбы - рыбаки, и все 3 тысячи человек, которые жили в деревне на берегу, получили болезнь Миномато – заболевание нервной системы, сходное с болезнью Паркинсона – человек не может координировать свои движения. Это случилось в середине 60 -х гг, и, чтобы доказать, что вред, нанесенный здоровью жителей, был именно от сбросов этих двух заводов, потребовалось 20 лет. Именно столько шел судебный процесс.
Проблема тяжелых металлов в природных водах – накопление в трофических цепях. Самый яркий пример – болезнь Миномато (залив в Японском море, жители которого пострадали первыми). В залив впадает река, по берегам которой есть два завода – один производит ацетилен (использует ртуть как химический реагент), выбросов от него практически не было, второй завод занимался органическим синтезом, и тоже практически ничего не сбрасывал в реку (в микроколичествах присутствовали галоген-производные – CH 3 J). Когда металлическая ртуть и йод-метан попали в воду, то под воздействием микроорганизмов ртуть из нерастворимой формы и поэтому малоопасной формы перешла в Hg+ или Hg 2+, в результате образовалось растворимая форма – метил-ртуть (CH 3 Hg (I), CH 3 Hg+ (II)). Эти соединения поступили в залив, прошли по трофической цепи планктон – рыбы - рыбаки, и все 3 тысячи человек, которые жили в деревне на берегу, получили болезнь Миномато – заболевание нервной системы, сходное с болезнью Паркинсона – человек не может координировать свои движения. Это случилось в середине 60 -х гг, и, чтобы доказать, что вред, нанесенный здоровью жителей, был именно от сбросов этих двух заводов, потребовалось 20 лет. Именно столько шел судебный процесс.
 В стоматологии долгое время использовался пломбировочный материал – ртутная амальгама, состоящий из следующей смеси – 55% сплав (70% серебра, 26% олова, 2% меди и 2% цинка), и 45% ртути. Выражение "безумный шляпник" из "Алисы в стране чудес" (mad as a hatter) легко объяснить, если знать, что для получения шляпного фетра высшего качества до 40 -х гг использовался нитрат ртути, вызывающий сумасшествие. Тем не менее, нитрат ртути, как неорганическим соединением, наименее опасное соединение ртути.
В стоматологии долгое время использовался пломбировочный материал – ртутная амальгама, состоящий из следующей смеси – 55% сплав (70% серебра, 26% олова, 2% меди и 2% цинка), и 45% ртути. Выражение "безумный шляпник" из "Алисы в стране чудес" (mad as a hatter) легко объяснить, если знать, что для получения шляпного фетра высшего качества до 40 -х гг использовался нитрат ртути, вызывающий сумасшествие. Тем не менее, нитрат ртути, как неорганическим соединением, наименее опасное соединение ртути.
 На содержание вредных веществ сильно влияет способ приготовления продукта. Например, пестициды способны экстрагироваться в масло, поэтому рыба в масле содержат меньше остаточных пестицидов, чем рыба в собственном соку. Рыба в томатном соусе может содержать больше свинца, т. к. кислая среда консервов способствует его переходу в растворимое состояние (из консервной банки). Известно, что икра практически не накапливает ртуть, а максимальное содержание кадмия отмечалось в моллюсках (вероятно, что он каким-то образом включается в их метаболизм, и поэтому накапливается). Рыбу можно рассматривать как детоксикант морской среды – она аккумулирует вредные вещества, затем ее вылавливают, и т. о. море в некоторой степени очищается. Последние десятилетия объемы мирового вылова рыбы постоянно увеличиваются, однако потребление морских продуктов на душу населения не изменяется. Это можно объяснить значительной скоростью роста численности населения.
На содержание вредных веществ сильно влияет способ приготовления продукта. Например, пестициды способны экстрагироваться в масло, поэтому рыба в масле содержат меньше остаточных пестицидов, чем рыба в собственном соку. Рыба в томатном соусе может содержать больше свинца, т. к. кислая среда консервов способствует его переходу в растворимое состояние (из консервной банки). Известно, что икра практически не накапливает ртуть, а максимальное содержание кадмия отмечалось в моллюсках (вероятно, что он каким-то образом включается в их метаболизм, и поэтому накапливается). Рыбу можно рассматривать как детоксикант морской среды – она аккумулирует вредные вещества, затем ее вылавливают, и т. о. море в некоторой степени очищается. Последние десятилетия объемы мирового вылова рыбы постоянно увеличиваются, однако потребление морских продуктов на душу населения не изменяется. Это можно объяснить значительной скоростью роста численности населения.
 Источниками загрязнения являются: источник загрязнения тысяч тонн нефти в год природные источники (шельфовые месторождения) 270 танкерные аварии (воздействие на ограниченной 400 территории) танкерные операции (промывка) 710 другие виды транспорта (не танкеры) 380 атмосферный перенос 300 муниципальные отходы (различного рода 710 нефтезаправочные станции – неорганизованный источник) промышленные отходы (организованный источник) 295 утечка и прямой сброс 180
Источниками загрязнения являются: источник загрязнения тысяч тонн нефти в год природные источники (шельфовые месторождения) 270 танкерные аварии (воздействие на ограниченной 400 территории) танкерные операции (промывка) 710 другие виды транспорта (не танкеры) 380 атмосферный перенос 300 муниципальные отходы (различного рода 710 нефтезаправочные станции – неорганизованный источник) промышленные отходы (организованный источник) 295 утечка и прямой сброс 180
 Последствия попадания нефти в окружающую среду: 1) Изменяется коэффициент обмена между атмосферой и водой, затруднен газообмен – кислород не растворяется в воде, а продукты метаболизма морских организмов не могут выходить в атмосферу. 2) Углеводороды используются как экстрагенты для извлечения из руд редких металлов, например, урана. Извлекая металл из смеси, используют жидкости, которые не смешиваются с основной массой. При этом соли тяжелых металлов концентрируются в углеводородной части. При разливе нефти по водной поверхности все тяжелые металлы переходят в нефтяную пленку. В конце концов она окисляется (под действием микроорганизмов, солнечного излучения), переходит в битум, который, будучи тяжелее воды, опускается на дно. Битум уносит тяжелые металлы на дно, где они накапливаются в телах моллюсков (происходит трансформация загрязнения). 3) Нефтяное загрязнения способствует появлению фотохимического смога над океаном. Там есть все условия для его образования – солнце, углеводороды, практически не бывает дождя (над океаном нет ядер конденсации, как над сушей). Нужны еще оксиды азота. В дневное время растворенные в воде нитраты и нитриты достаточно эффективно переходят в газы (до 40%): NO 3 - NO 2 - NO В результате их разложения образуется атомарный кислород, затем озон. "Нимбус" обнаружил над океаном, в областях, где проходят нефтяные танкеры, тропосферный озон.
Последствия попадания нефти в окружающую среду: 1) Изменяется коэффициент обмена между атмосферой и водой, затруднен газообмен – кислород не растворяется в воде, а продукты метаболизма морских организмов не могут выходить в атмосферу. 2) Углеводороды используются как экстрагенты для извлечения из руд редких металлов, например, урана. Извлекая металл из смеси, используют жидкости, которые не смешиваются с основной массой. При этом соли тяжелых металлов концентрируются в углеводородной части. При разливе нефти по водной поверхности все тяжелые металлы переходят в нефтяную пленку. В конце концов она окисляется (под действием микроорганизмов, солнечного излучения), переходит в битум, который, будучи тяжелее воды, опускается на дно. Битум уносит тяжелые металлы на дно, где они накапливаются в телах моллюсков (происходит трансформация загрязнения). 3) Нефтяное загрязнения способствует появлению фотохимического смога над океаном. Там есть все условия для его образования – солнце, углеводороды, практически не бывает дождя (над океаном нет ядер конденсации, как над сушей). Нужны еще оксиды азота. В дневное время растворенные в воде нитраты и нитриты достаточно эффективно переходят в газы (до 40%): NO 3 - NO 2 - NO В результате их разложения образуется атомарный кислород, затем озон. "Нимбус" обнаружил над океаном, в областях, где проходят нефтяные танкеры, тропосферный озон.
 Нитраты, нитриты. Один из видов эфтрофикации. Источник – азотные удобрения и стоки от животноводческих ферм. а) NO 3 Нитраты достаточно легко переходят в нитриты, а они в свою очередь в нитрозоамины, которые являются сильными канцерогенами. Интенсивнее всего процесс образования нитрозоаминов происходит в желудках детей, находящихся на искусственном вскармливании. В африканские страны поставляли в качестве гуманитарной помощи искусственное питание, но не предупреждали, что его нельзя растворять в воде, содержащей нитраты. Результатом было резкое возрастание детской смертности. Этот процесс катализируется также приеме антибиотиков. б) NO 2 Нитриты являются причиной метгемоглобинемии. В норме гемоглобин переносит к тканям кислород и забирает от них углекислый газ. При присоединении кислорода к гемоглобину происходит следующая реакция: Fe 2+ Fe 3+
Нитраты, нитриты. Один из видов эфтрофикации. Источник – азотные удобрения и стоки от животноводческих ферм. а) NO 3 Нитраты достаточно легко переходят в нитриты, а они в свою очередь в нитрозоамины, которые являются сильными канцерогенами. Интенсивнее всего процесс образования нитрозоаминов происходит в желудках детей, находящихся на искусственном вскармливании. В африканские страны поставляли в качестве гуманитарной помощи искусственное питание, но не предупреждали, что его нельзя растворять в воде, содержащей нитраты. Результатом было резкое возрастание детской смертности. Этот процесс катализируется также приеме антибиотиков. б) NO 2 Нитриты являются причиной метгемоглобинемии. В норме гемоглобин переносит к тканям кислород и забирает от них углекислый газ. При присоединении кислорода к гемоглобину происходит следующая реакция: Fe 2+ Fe 3+
 Нитритное загрязнение впервые было выявлено в Канаде, где в больших количествах вносили азотные удобрения под пшеницу, в 1960 году. Болезнь голубых детей (blue baby diseases) – кровь новорожденных детей содержала много метгемоглобина, поэтому цвет их кожи был очень бледный, почти голубой. Причина – матери пили воду из колодца, куда фильтровались стоки с полей, содержащие много нитратов. По этим причинам содержание нитратов и нитритов в пищевых продуктах жестко контролируется. В Астрахани ПДК содержания остаточных нитритов в арбузах меньше, чем в Москве, т. к. это определяется рационом – в Москве меньше едят арбузов, поэтому они могут содержать больше нитритов, чем арбузы в Астрахани, где их едят много.
Нитритное загрязнение впервые было выявлено в Канаде, где в больших количествах вносили азотные удобрения под пшеницу, в 1960 году. Болезнь голубых детей (blue baby diseases) – кровь новорожденных детей содержала много метгемоглобина, поэтому цвет их кожи был очень бледный, почти голубой. Причина – матери пили воду из колодца, куда фильтровались стоки с полей, содержащие много нитратов. По этим причинам содержание нитратов и нитритов в пищевых продуктах жестко контролируется. В Астрахани ПДК содержания остаточных нитритов в арбузах меньше, чем в Москве, т. к. это определяется рационом – в Москве меньше едят арбузов, поэтому они могут содержать больше нитритов, чем арбузы в Астрахани, где их едят много.
 Загрязнение водных систем представляет большую опасность, чем загрязнение атмосферы Во – первых, процессы регенерации (самоочищения) протекают в водной среде медленнее, чем в воздухе. • мировой океан – 2500 лет, • подземные воды – 1400 лет, • воды озер – 17 лет, • воды рек – 16 дней, • в атмосфере - 8 -10 дней.
Загрязнение водных систем представляет большую опасность, чем загрязнение атмосферы Во – первых, процессы регенерации (самоочищения) протекают в водной среде медленнее, чем в воздухе. • мировой океан – 2500 лет, • подземные воды – 1400 лет, • воды озер – 17 лет, • воды рек – 16 дней, • в атмосфере - 8 -10 дней.
 Во – вторых, Источники загрязнения водоемов более разнообразны: Сточные воды промышленных предприятий; ·Сточные воды коммунального хозяйства городов и др. населенных пунктов; ·Стоки систем орошения, поверхностные стоки с полей и других с/х объектов; Атмосферные выпадения загрязнителей на поверхность водоемов и водосборных бассейнов.
Во – вторых, Источники загрязнения водоемов более разнообразны: Сточные воды промышленных предприятий; ·Сточные воды коммунального хозяйства городов и др. населенных пунктов; ·Стоки систем орошения, поверхностные стоки с полей и других с/х объектов; Атмосферные выпадения загрязнителей на поверхность водоемов и водосборных бассейнов.
 В – третьих, в воде как растворителе, увеличивается глубина протекания химических реакций. При этом - новые (вторичные) химические соединения еще более токсичнее, чем первичные.
В – третьих, в воде как растворителе, увеличивается глубина протекания химических реакций. При этом - новые (вторичные) химические соединения еще более токсичнее, чем первичные.
 Под загрязнением водоемов понимается снижение их биосферных функций в результате поступления повышенных концентраций вредных веществ. Выделяют три вида загрязнений: 1) биологическое, 2) химическое, 3) физическое
Под загрязнением водоемов понимается снижение их биосферных функций в результате поступления повышенных концентраций вредных веществ. Выделяют три вида загрязнений: 1) биологическое, 2) химическое, 3) физическое
 1) биологическое сброс в воды водоемов большого количества органических веществ, способных к брожению. Один комплекс для откорма 10 тысяч голов скота дает столько же сточных вод, сколько город с 100 тысячным населением.
1) биологическое сброс в воды водоемов большого количества органических веществ, способных к брожению. Один комплекс для откорма 10 тысяч голов скота дает столько же сточных вод, сколько город с 100 тысячным населением.
 Чрезмерное обогащение биогенами водоемов приводит к их эвтрификации, т. е. резкому повышению биопродуктивности. «Цветение» воды и отмирание сине-зеленых водорослей - источник вторичного загрязнения
Чрезмерное обогащение биогенами водоемов приводит к их эвтрификации, т. е. резкому повышению биопродуктивности. «Цветение» воды и отмирание сине-зеленых водорослей - источник вторичного загрязнения
 Биологическое загрязнение приводит к бактериологическому заражению С этим видом загрязнения связан ряд проблем в области общественной гигиены (гепатит, холера, кишечные инфекции)
Биологическое загрязнение приводит к бактериологическому заражению С этим видом загрязнения связан ряд проблем в области общественной гигиены (гепатит, холера, кишечные инфекции)
 2) химическое 1. Соли тяжелых металлов (Свинца, ртути, железа, меди) 2. Нефть и нефтепродукты 3. Нитраты, фосфаты (СПАВ-синтетические поверхностно-активные вещества) 4. Фенолы, пестициды и др. органические яды.
2) химическое 1. Соли тяжелых металлов (Свинца, ртути, железа, меди) 2. Нефть и нефтепродукты 3. Нитраты, фосфаты (СПАВ-синтетические поверхностно-активные вещества) 4. Фенолы, пестициды и др. органические яды.
 Химическое загрязнение природных вод Химическое загрязнение- изменение естественных химических свойств воды за счет увеличения содержания в ней вредных примесей как неорганической, так и органической природы. Основными неорганическими загрязнителями являются химические соединения, токсичные для обитателей водной среды. (мышьяк, фтор, медь…) Органическое загрязнение. Среди вносимых в океан с суши растворимых веществ, большое значение для обитателей водной среды являются и органические соединения.
Химическое загрязнение природных вод Химическое загрязнение- изменение естественных химических свойств воды за счет увеличения содержания в ней вредных примесей как неорганической, так и органической природы. Основными неорганическими загрязнителями являются химические соединения, токсичные для обитателей водной среды. (мышьяк, фтор, медь…) Органическое загрязнение. Среди вносимых в океан с суши растворимых веществ, большое значение для обитателей водной среды являются и органические соединения.
 Воздействие неорганических загрязнений. Вещество Планктон Ракообраз Моллюски ные Рыбы Медь +++ +++ Цинк + ++ ++ ++ Свинец - + + +++ Ртуть ++++ +++ Кадмий - + ++ ++++ Хлор - +++ ++ +++ Роданид - ++ + ++++ Цианид - +++ ++ ++++ Фтор - - + Сульфид - ++ + Степень токсичности: - отсутствует + очень слабая +++ сильная ++++ очень сильная
Воздействие неорганических загрязнений. Вещество Планктон Ракообраз Моллюски ные Рыбы Медь +++ +++ Цинк + ++ ++ ++ Свинец - + + +++ Ртуть ++++ +++ Кадмий - + ++ ++++ Хлор - +++ ++ +++ Роданид - ++ + ++++ Цианид - +++ ++ ++++ Фтор - - + Сульфид - ++ + Степень токсичности: - отсутствует + очень слабая +++ сильная ++++ очень сильная
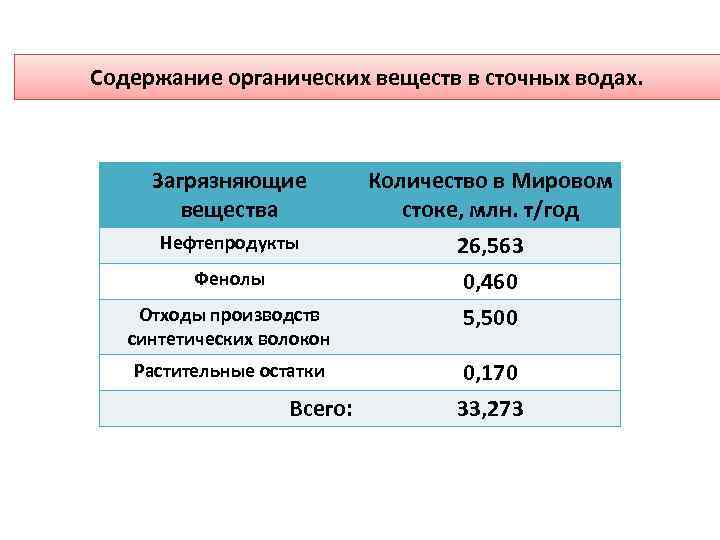 Содержание органических веществ в сточных водах. Загрязняющие вещества Количество в Мировом стоке, млн. т/год Нефтепродукты 26, 563 0, 460 5, 500 Фенолы Отходы производств синтетических волокон Растительные остатки Всего: 0, 170 33, 273
Содержание органических веществ в сточных водах. Загрязняющие вещества Количество в Мировом стоке, млн. т/год Нефтепродукты 26, 563 0, 460 5, 500 Фенолы Отходы производств синтетических волокон Растительные остатки Всего: 0, 170 33, 273
 Загрязнение подземных вод. Превышение допустимого загрязнения во много раз: 44% - 1 -10 ПДК 34% - 10 -100 ПДК 22% - больше 100 ПДК Недопустимо, чтобы степень загрязнения измерялась в единицах ПДК. Москва в своем роде – уникальный мегаполис – во всем мире вода для бытовых нужд берется из подземных скважин, тогда как в Москве это поверхностные воды. Загрязнение воды является очень острой проблемой, и во всем мире ее решению уделяется большое внимание, например, ЮНЕСКО финансирует только те природоохранные проекты, где предусматривается охрана и очистка вод. Параметры качества воды. 1) Соленость. 2) Цветность.
Загрязнение подземных вод. Превышение допустимого загрязнения во много раз: 44% - 1 -10 ПДК 34% - 10 -100 ПДК 22% - больше 100 ПДК Недопустимо, чтобы степень загрязнения измерялась в единицах ПДК. Москва в своем роде – уникальный мегаполис – во всем мире вода для бытовых нужд берется из подземных скважин, тогда как в Москве это поверхностные воды. Загрязнение воды является очень острой проблемой, и во всем мире ее решению уделяется большое внимание, например, ЮНЕСКО финансирует только те природоохранные проекты, где предусматривается охрана и очистка вод. Параметры качества воды. 1) Соленость. 2) Цветность.


